CO-128 Diseño, optimización y validación de un panel de
Anuncio

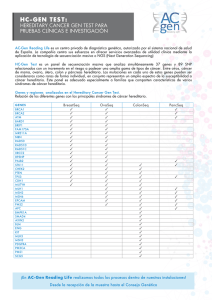
Comunicaciones Orales Introducción: las coagulopatías congénitas presentan un fenotipo clínico muy similar que puede dificultar su clasificación. Los estudios fenotípicos ofrecen una orientación sobre cuál puede ser la coagulopatía responsable, pero el diagnóstico molecular es definitivo para confirmar la enfermedad permitiendo la identificación de mutaciones en los genes implicados. En la actualidad, dado el elevado coste que supone la secuenciación tradicional, el estudio molecular se ha centrado en las coagulopatías más frecuentes (VWD HA y HB), pero existen otras enfermedades: déficit de factores II, V, VII, X, XI, XII y XIII, déficit combinado de factores V y VIII, trombastenia de Glanzmann, alteraciones en el fibrinógeno y la púrpura trombocitopénica congénita. La aparición de la secuenciación masiva paralela (NGS) ha revolucionado el mundo de la genética permitiendo secuenciar un elevado número de muestras y genes simultáneamente, reduciendo los costes, tiempo de preparación y análisis. Objetivo: Nuestro objetivo es utilizar la NGS y diseñar un panel de genes que permita realizar el estudio molecular de los genes asociados con la cascada de coagulación o con implicación descrita en las coagulopatías. Métodos: Se diseñó un panel de genes (GeneRead DNAseq Custom Panel V2 de QIAGEN) relacionados con las catorce coagulopatías descritas anteriormente. Concretamente, el panel permite amplificar 23 genes candidatos (VWF, F8, F9, F2, F5, F7, F10, F11, F12, F13A1, F13B, MCFD2, LMAN1, ITGB3, ITGA2B, FGG, FGA, FGB, ADAMTS13, MTHFR, GP1BB, GP1BA y GP9) por paciente en sólo 4 múltiplex PCRs. Tras la amplificación de las regiones de interés (regiones exónicas e intrónicas flanqueantes) se procede a la construcción de librerías indexadas mediante el sistema NEBNext Ultra DNA (New England Biolabs), que tras su purificación son secuenciadas en la plataforma MiSeq (Illumina). Resultados: Para la puesta a punto de esta técnica se seleccionaron 24 muestras previamente caracterizadas por secuenciación tradicional, con mutaciones en diferentes genes. La sensibilidad y especificidad de esta metodología fue del 100%. En el estudio de validación posterior, se analizaron 48 pacientes y familiares, sin estudio genético previo, y las mutaciones identificadas se confirmaron por secuenciación de Sanger con una concordancia del 100%. El panel diseñado cubre el 98,9% de las regiones genómicas de interés, lo que anticipa la robustez y utilidad del diseño. Por este motivo, el método se ha incorporado a la rutina del laboratorio de diagnóstico molecular y, hasta el momento, se ha aplicado a más de 200 muestras. Conclusiones: El estudio simultáneo de los genes responsables de las coagulopatías congénitas permite realizar el estudio genético de todas ellas aplicando la misma técnica y ofrece información molecular del resto de genes implicados en la coagulación. Por último, no es desdeñable la información de seis de los polimorfismos más frecuentemente asociados a riesgo trombótico, que puede ser esencial a la hora de evaluar la variabilidad fenotípica entre los pacientes. Todo ello ofrece un diagnóstico de mayor precisión que resulta especialmente relevante en los casos en los que la clínica y el fenotipo pueden ser confusos, además de profundizar en la investigación de los fundamentos biológicos de las coagulopatías y mejorar el conocimiento del riesgo hemorrágico. patológicos. En todos ellos se habían descartado causas secundarias. Se aplicó un panel de NGS que contenía 106 genes relacionados con trastornos plaquetarios previamente validado. Todas las mutaciones patogénicas encontradas fueron confirmadas mediante secuenciación convencional y además se estudiaron en los familiares. Resultados: El uso del panel de genes permitió el diagnóstico molecular del 77% de los enfermos con TPH (28/36). Trece de los 16 enfermos con TH presentaban mutación genética. Tres enfermos con Síndrome Plaqueta Gris [NBEAL2, c.6161C>T y c.6212G>C; GFI1B, c.859C>T], 2 May-Hegglin (MYH9, c.220A>G), 6 Síndrome Bernard-Soulier, entre los que destacaba un caso con heterocigosis compuesta en GP1BA, c.463C>G, c.1022C>G; una enferma con filaminopatía asociada a síndrome (FLNA, c.3695C>T) y un caso de trombopenia ligada al cromosoma X (WAS, c.802delC). En 3 macrotrombocitopenias autosómicas dominante no se encontró mutación en los genes analizados. En el 75% de las trombopatías, se ha establecido el diagnóstico molecular (15/20): dos enfermos con Trombastenia de Glanzmann (TG) tenían mutaciones en ITGA2B (c.2333a>C; c.2063C>T), dos casos con Síndrome Hermansky-Puddlack presentaban mutaciones en HPS3 (c.2464C>T) y HPS4 (c.2054delC), dos enfermos con trastornos de señalización del colágeno y ADP tenían mutaciones en GP6 (c.1206_1209dupTCTG) y P2YR12 (c.835G>A), una familia presentó una alteración en GATA1 (C.865C>T), otro caso en RUNX1 (c.167T>T), ambos estaban caracterizados como Síndromes “Aspirina-Like” (SAL). Además se detectaron 2 disfibrinogenemias [FGG (c.902G>A); FGA (c.1653delT)], una deficiencia de prekalicreína [KLKB1 (c.428G>A, c.1643G>A)]. Un caso con enfermedad de von Willebrand (EvW), una EvW tipo 2N (previamente diagnosticado de Hemofilia A) y otro enfermo una EvW tipo plaquetario, que tenían mutaciones en el gen VWF (c.2561G>A) y GP1BA (c.733G>A) respectivamente. Finalmente un niño diagnosticado de EvW tenía una mutación en F8 (p.Gln2208Arg). Sin embargo, no se detectó mutación patogénica en un paciente con EvW leve, TG (rs3809865) y 3 SAL. En total el estudio permitió definir la presencia de 24 mutaciones no descritas en la literatura. Conclusiones: La secuenciación masiva permite la detección, de manera rápida y automatizada, de mutaciones nuevas que puedan explicar la patogenia de las enfermedades hemorrágicas hereditarias. El diagnóstico correcto y precoz facilita el manejo adecuado de estos pacientes, evita tratamientos inapropiados y posibilita el consejo genético. CO-128 Diseño, optimización y validación de un panel de secuenciación de 23 genes como herramienta de diagnóstico e investigación de las coagulopatías congénitas Borràs Agustí N. (1), Corrales Insa I. (1), Ramírez Orihuela L. (1), Altisent Roca C. (2), Parra López R. (2), Vidal Pérez F. (1) (1) Banco de Sangre y Tejidos. Barcelona. (2) Hospital Universitario de la Vall d’Hebron. Barcelona 95