01 SEPARACIÓN DE LOS COMPONENTES DE ALGUNAS MEZCLAS
Anuncio

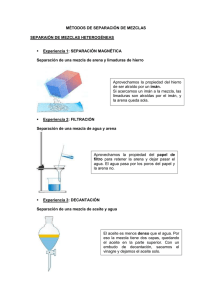
Cómo motivar a los estudiantes mediante actividades científicas atractivas SEPARACIÓN DE LOS COMPONENTES DE ALGUNAS MEZCLAS Begoña Monzonís Bernal Rosa Mª Montes Valero I.E.S. LES ALFÀBEGUES Bétera Introducción: En la naturaleza las sustancias puras (los compuestos y los elementos) se encuentran mezcladas o conteniendo pequeñas impurezas que a veces es necesario eliminar. En esta práctica aplicaremos algunas de las técnicas de separación y purificación y también compararemos algunas propiedades características de las sustancias puras y de las mezclas. Utilizaremos para la separación de mezclas heterogéneas los métodos de Filtración y Separación magnética y para las disoluciones Cristalización y Destilación. Objetivos: • • • • • Aprender a trabajar en el laboratorio y apreciar el orden, la limpieza y el rigor al trabajar en el mismo. Conocer la diferencia existente entre sustancia pura y mezcla. Conocer la diferencia existente entre mezcla homogénea y heterogénea. Diseñar procedimientos de separación de mezclas homogéneas. Diseñar procedimientos de separación de mezclas heterogéneas. Relación del tema propuesto con el curriculo del Curso: Está relacionado con los contenidos de la asignatura de Física y Química de 3º ESO que tratan sobre la diversidad de la materia. 1 Cómo motivar a los estudiantes mediante actividades científicas atractivas Material y recursos necesarios: • • • • • • • • • • • • • Reactivos: vino, etanol, agua destilada, limaduras de hierro, arena de playa y sulfato de cobre (II). Montaje de destilación (dos soportes, tres nueces, dos pinzas, aro y rejilla, matraz de fondo redondo acodado, tapón con termómetro incorporado, tubo refrigerante, gomas de caucho, trocitos de porcelana…) Imán Papel de filtro, embudo cónico. Mechero, Mechero Bunsen, soporte, trípode, rejilla. Vasos de precipitados de 250 ml. Matraces erlenmeyer de 250 ml. Cristalizadores. Varilla de vidrio. Termómetros. Reloj o cronómetro. Papel milimetrado. Espátulas o cucharas. Normas de seguridad: • • El etanol es inflamable. No debe haber ninguna llama en las proximidades. Las habituales para el trabajo en el laboratorio. Procedimiento: Se dividirá la clase en grupos de 3 o 4 alumnos, según la disponibilidad del material y el número de alumnos en el grupo. Los grupos realizarán alternativamente las prácticas 1 (sustancias puras y mezclas), 2 (mezcla homogénea) y 3 (mezcla heterogénea) Práctica 1; Propiedades características de las sustancias, puras y mezclas. 1.- Se añaden 75 ml de vino, 75 ml de alcohol y 75 ml de agua destilada a tres matraces erlenmeyer de 250 ml cada uno. 2.- Se coloca un termómetro en cada matraz y se calientan hasta la ebullición. 3.- Se toma nota de la temperatura de cada matraz a medida que transcurre el tiempo. Al principio cada 2 minutos, luego cada minuto y después cada 30 segundos. Se dejará de calentar cuando se tengan cinco o seis valores tomados en la ebullición. 4.- Se dibujan, en papel milimetrado, las gráficas de calentamiento para cada sustancia. Práctica 2; Separación de los componentes de una mezcla homogénea. 1.- Se monta el aparato de destilación y se coloca en el matraz de destilación la disolución homogénea, en este caso unos 120 ml (dependiendo del tamaño del matraz de fondo redondo) de vino y los trocitos de porcelana. 2.- Se lleva la mezcla a ebullición. 3.- Se recoge en un vaso de precipitados el destilado (alcohol y algo de agua). 2 Cómo motivar a los estudiantes mediante actividades científicas atractivas Práctica 3; Separación de los componentes de una mezcla heterogénea. 1.- Previamente, las profesoras, habremos realizado en un vaso de precipitados de 250 ml una mezcla del equivalente a dos cucharadas soperas de arena de playa, una cucharada de sulfato de cobre (II) y una cucharadita de café de limaduras de hierro. 2.- Se pasan los imanes envueltos en papel de filtro (para facilitar después la separación del hierro de ellos) por tota la mezcla. Se repite esta operación una vez más para conseguir separar la máxima cantidad de hierro posible. 3.- Se debe dar cuenta el alumnado que es necesario añadir agua destilada al resto de la mezcla (arena y sulfato) para poder proceder a la separación por filtración. 4.- Se realiza un filtro sencillo con el papel milimetrado del tamaño adecuado al embudo disponible. 5.- Se procede al filtrado de la mezcla dejando que resbale ésta sobre una varilla en el interior del embudo (con filtro). Hay que ayudarse con una espátula o cuchara para que la arena salga en su totalidad del vaso de precipitados. La disolución de sulfato filtrada se recoge en un vaso de precipitados. 6.- Una vez ha finalizado la filtración, se deja secar el filtro con la arena y la disolución filtrada se coloca en un cristalizador. 7.- El cristalizador con la disolución de sulfato se calienta lentamente para evaporar el agua y conseguir separar el sulfato de cobre (II) en forma de cristales. Tiempo necesario para desarrollar esta práctica: 1 hora y 30 minutos (o dos sesiones de 55 minutos) Cuestiones para los alumnos: • • • A simple vista que diferencias observas entre la mezcla 1 (arena, hierro y sulfato de cobre) y la mezcla 2 (vino). ¿Por qué hay que añadirle agua a la mezcla de sulfato de cobre (II) y arena? ¿Por qué crees que se mantiene constante la temperatura en la ebullición del etanol y el agua destilada y no la del vino? Análisis de las respuestas de los alumnos: Basándonos en sus respuestas podemos concluir que los alumnos entendieron bien la diferencia entre mezcla homogénea y heterogénea y entre sustancia pura y mezcla y también porque es importante el conocimiento de las técnicas de separación en nuestra sociedad. Sin embargo, detectamos cierta confusión entre compuesto y mezcla homogénea. 3 Cómo motivar a los estudiantes mediante actividades científicas atractivas Análisis de la práctica presentada por el profesor: Los alumnos quedaron muy sorprendidos al observar como se separaban las sustancias por destilación y que efectivamente la primera sustancia que se destilaba en el caso del vino era el alcohol que lo detectaron enseguida por el olor y color (Nota: si el vino es tinto la práctica resulta más llamativa por el contraste de colores). En el caso de la mezcla 1 les llamó mucho la atención el color del sulfato de cobre (azul intenso) y hubo que tener cuidado porque querían probarlo. También les surgieron preguntas tales como, si todas las sales eran solubles en agua. En conclusión fueron unas experiencias muy satisfactorias, ya que los alumnos estuvieron muy motivados y pudieron poner en práctica lo que habían aprendido teóricamente en clase. 4