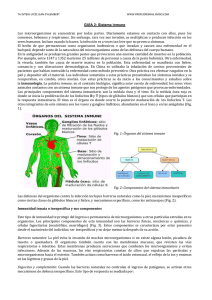
inmunidad en el perodo
Anuncio

INMUNIDAD EN EL PERÍODO NEONATAL DrC. Manuel Díaz Álvarez Especialista de 2do grado en Pediatría y Neonatología. Profesor Titular. Doctor en Ciencias Médicas. Email: [email protected] Servicio de Neonatología. Hospital Pediátrico Universitario “Juan M. Márquez”. Marianao, Ciudad Habana. CARACTERÍSTICAS DEL NEONATO QUE FAVORECEN LA INFECCIÓN. El período neonatal se caracteriza por ser un período de riesgo para la incidencia y gravedad de las infecciones, como está ampliamente demostrado en la literatura y en la práctica clínica, resultando mayor el riesgo cuando este recién nacido (RN) es un prematuro. En estos pacientes las infecciones tienden a ser comúnmente sistémicas, afectar con mayor frecuencia el sistema nervioso central y ser más letales. Por este motivo, a pesar del advenimiento de nuevos antibióticos y estrategias de prevención, las infecciones continúan siendo un problema de morbimortalidad en el período neonatal. Entre los factores que favorecen el incremento de las infecciones en los RNs tenemos que estas pueden originarse perinatalmente, además de las fuentes de infección para otros períodos de la vida, como son las infecciones originadas en la comunidad y las nosocomiales; quiere decir, tienen una fuente más de infección. Estas infecciones perinatales pueden expresarse clínicamente en la mujer embarazada, pero muchas veces cursan de manera oculta para todos y mientras tanto se afecta el feto sin tomarse medidas específicas, o cuando se produce el parto, el RN ya tiene un tiempo de latencia de la infección, por lo que el tratamiento llega muchas veces en un estadio avanzado, con menor probabilidad de curar y salvar al paciente. Otro aspecto que favorece el incremento de las infecciones en el RN es que este es un ser en desarrollo constante de todos sus aparatos y sistemas, y al nacimiento no ha logrado obtener aun la madurez en determinadas funciones tales como el sistema de defensa inmune. No obstante a eso, su capacidad de respuesta es lo suficientemente elemental y necesaria para poder sobrevivir, al pasar bruscamente de la vida fetal en un medio estéril, a la etapa extrauterina, en la cual hay un constante enfrentamiento a una extensa variedad de agentes biológicos, con los que tiene que interactuar y a la vez, evitar ser agredido por los mismos. La exposición prenatal y postnatal a productos microbianos ambientales que pueden activar la inmunidad innata, puede acelerar este proceso de maduración. BREVE RESEÑA DE LA INMUNIDAD La inmunidad se puede definir como conjunto de mecanismos que intervienen en la defensa del organismo ante diversos agentes extraños. Una parte de esta inmunidad se debe a la respuesta inmune, aunque intervienen otros mecanismos. Todos los mecanismos del sistema inmune recaen en detectar rasgos estructurales del agente extraño que lo marcan como distintos de las células del huésped. Esta discriminación de huésped-agente extraño es esencial para permitir al huésped eliminar el agente sin daño excesivo a sus propios tejidos. El reto del sistema inmune es por otra parte, su capacidad de seleccionar entre una respuesta inmune protectora contra microorganismos, tumores, trasplante, y de tolerancia inmunológica a los antígenos propios y alimentarios. Los agentes extraños son diversos y muchos son potencialmente patógenos para el organismo. La exposición o ingreso de estos al medio interno del organismo puede ser por: – Contacto – Ingestión – Inhalación – Introducción directa al medio interno Los mecanismos que intervienen en la defensa del organismo podemos enfocarlos así: • • Inmunidad natural (inespecífica) • Barreras físico-químicas • Respuesta inmune innata Inmunidad adquirida (específica) A- Inmunidad natural (inespecífica) Dada la exposición limitada a antígenos in utero y los defectos en la inmunidad adaptativa neonatal, los RNs deben recaer en su sistema inmune innato para su protección de manera significativa. A-1 Barreras físico-químicas Estas barreras constituyen la primera línea de defensa. Se debe a la presencia de determinadas condiciones o funciones inherentes a la fisiología del organismo humano que obstaculizan la entrada desde el exterior, adherencia o penetración al medio interno de microorganismos u otros agentes. Ejemplos de estas barreras físico-químicas son: • Mecánica: – • Química: – • Tráquea Otros: – • sudor, moco, flora, lágrimas Cilios: – • epitelios de piel y mucosas Temperatura, pH ácido, tos, estornudo Defensinas: – péptidos (15-20 aa) que actúan como antibióticos de amplio espectro A-2 Respuesta inmune innata Si se vence la primera línea de defensa, entonces entran en función los componentes del sistema inmune. En la respuesta inmune innata se produce una reacción a la invasión por un agente agresor y en la misma intervienen componentes celulares y humorales. Las tareas del sistema inmune innato son aclarar el cuerpo de la invasión microbiana, mediante la reducción del número y virulencia de los microorganismos, así como coordinar e instruir la respuesta inmune adaptativa. Las características principales de la respuesta del sistema inmune innato son: • Desencadenada por inmunoestimulantes asociados a patógenos • Las moléculas de reconocimiento están expresadas ampliamente en un gran número de células del organismo • No requiere contacto previo • Mecanismos de defensa que no incrementan tras exposiciones repetidas a la molécula o agente (no hay memoria inmune) • La misma célula o molécula del organismo actúa frente a las diferentes moléculas o agentes extraños • Respuesta rápida • Mediada principalmente por granulocitos, monocitos-macrófagos y células NK (“natural killer”) La respuesta inmune innata se ejecuta por diversos mecanismos inespecíficos. • Fagocitosis • Inflamación • Proteínas de fase aguda • Sistema del complemento • Células NK • Células dendríticas Fagocitosis La fagocitosis es un mecanismo por el cual el agente agresor es internalizado al medio interno de la célula inmune, en donde sufre un proceso de degradación enzimático que lleva a su destrucción en las que actúan aniones superóxido, radicales hidroxilo, oxido nítrico y otros. Las principales células que son capaces de realizar este proceso son los macrófagos, monocitos y neutrófilos. Los granulocitos neutrófilos y las células del sistema fagocítico mononuclear se originan de la médula ósea de las colonias de células granulocíticas y monocito-macrófago. Los factores estimulantes de la colonia (G-CSF/GM-CSF), inducen la proliferación, maduración y diferenciación en neutrófilos y monocitos. Los neutrófilos y monocitos son células fagocitarias circulantes, mientras que los macrófagos están distribuidos por toda la economía tisular. Los monocitos circulan en el torrente sanguíneo 2 a 3 días y posteriormente migran para localizarse algunos en los tejidos inflamatorios, mientras que otra subpoblación coloniza tejidos en condiciones basales y constituyen un “pool” de macrófagos residentes, los cuales pueden sobrevivir meses o años y adquieren especificidad de tejido (Ej. células de Kupffer en el hígado, células microgliales en el cerebro, macrófagos alveolares, y otros). Cuando el neutrófilo llega al foco de infección se adhiere, a través de los receptores FC de inmunoglobulinas, el complemento, la fibronectina, etc. y procede a la ingestión del microorganismo y a su incorporación al fagosoma de la célula, donde tiene lugar su muerte (Figura 1). En los granulocitos activados se produce la fusión de los gránulos con la membrana del fagosoma, con liberación del contenido de los gránulos primarios y secundarios en su interior; ello se acompaña de la puesta en marcha del metabolismo oxidativo. Con la activación de la NADPH oxidasa del fagosoma se reduce el oxígeno molecular, generando grandes cantidades de ion superóxido: éste tiene un efecto bactericida directo, contribuye a la formación de peróxido de hidrógeno (H2O2), de gran poder microbicida y se combina con aluros (ion Cl), en presencia de mieloperoxidasa, originando otros productos tóxicos. Además de los mecanismos de muerte que dependen de oxígeno, también hay mecanismos microbicidas independientes de oxígeno en los fagocitos, facilitados por la presencia de algunas sustancias en los gránulos citoplasmáticos que tienen capacidad microbicida por sí mismas (captesina G, lisozima y defensinas). Las proteínas catiónicas (catepsina) liberadas en los fagolisosomas pueden dañar a las membranas bacterianas; la lisozima rompe las paredes celulares de las bacterias; la lactoferrina quela al hierro, lo cual priva a la bacteria de este requerimiento nutricional; las enzimas hidrolíticas degradan proteínas bacterianas. Figura 1. Mecanismo de la fagocitosis. La fagocitosis se basa en que la célula engulle alguna partícula y luego la digiere en el interior de las vesículas digestivas que se forman. Las células fagocíticas usan una variedad de receptores Fc y receptores de complemento para incrementar la captación de partículas que han sido marcadas por el sistema innato y adaptativo para su destrucción (Figura 2). Las bacterias que tienen anticuerpos IgG unidos a su superficie tiene la región Fc expuesta y esta parte de la molécula de inmunoglobulina (Ig) es reconocida por el receptor Fc de los fagocitos. La unión al receptor para Fc requiere de la interacción previa del anticuerpo con el antígeno. La unión de las bacterias cubiertas con IgG a los receptores Fc resulta en una fagocitosis aumentada y en la activación de la actividad metabólica de los fagocitos (estallido respiratorio). Además las células fagocíticas tienen un receptor para el tercer componente del complemento, C3b. La unión de las bacterias cubiertas con el C3b a este receptor resulta también en una fagocitosis aumentada y en la estimulación del estallido respiratorio. Figura 2. Receptores en las células fagocíticas. En la superficie celular se encuentran receptores Fc para antígenos unidos a IgG, receptores para antígenos unidos a complemento y receptores scavenger. Los fagocitos tienen una variedad de receptores tipo “Toll-like” (RTL) o también llamados receptores de patrones de reconocimiento los cuales reconocen amplios patrones moleculares denominados PAMPS (pathogen associated molecular patterns), que presentan los agentes infecciosos (Figura 3). La unión de agentes infecciosos vía los RTL resulta en fagocitosis y liberación de interleuquinas (IL) inflamatorias por los fagocitos, tales como IL-1, IL-6 y factor de necrosis tumoral (TNF)-alpha. Los RTL, son receptores transmembrana con dominios extracelulares que contienen unidades repetitivas ricas en lectina y dominios citoplasmáticos con homología al dominio citoplasmático del receptor IL-1. El sistema RTL está altamente organizado en desarrollar señales sofisticadas, para instruir y regular tanto al sistema inmune innato como al adaptativo, con lo que se asegura así una respuesta inmune efectiva y coordinada, para que se establezcan las defensas a corto y largo plazo. Hasta el momento se han definido 10 RTL humanos. Los RTL son específicos, cada miembro de la familia media la respuesta a un grupo particular de ligandinas microbianas. La función primaria de los RTL es señalizar que los agentes extraños han roto las barreras de defensa del organismo. Los RTL parece que hacen esto mediante el reconocimiento de rasgos estructurales comunes de los microorganismos conocidos como patrones moleculares asociados a patógeno, los cuales están presentes en los microorganismos pero no en el huésped. Este patrón molecular incluye lipopolisacáridos de las bacterias Gram negativas, peptidoglicano, ácido lipoteicoico, y otros. Los RTL se encuentran particularmente en los macrófagos y células dendríticas, pero también se expresan en neutrófilos, eosinófilos, células epiteliales y keratinocitos. La mayoría de los RTL son proteínas de membranas, pero hay dos tipos de ellos que se expresan intracelularmente (RTL9 y RTL3). La activación de la mayoría de los RTL inducen respuestas celulares asociadas con inflamación aguda y crónica. Cuando las ligandinas microbianas interactúan con sus respectivos RTL, las proteínas adaptadoras intracelulares transducen la señal, resultando en activación de miembros de la familia del factor nuclear de transcripción proinflamatorio (NF-kB), que lleva a una expresión incrementada de genes codificando citoquinas y otros mediadores inflamatorios. Figura 3. Representación de señalización mediada por el receptor like-Toll (RLT)-4. La molécula receptor de membrana CD14 para lipopolisacáridos (LPS) se une al RLT-4 que tiene un dominio intracitoplasmático el cual, bajo estimulación de LPS, media el reclutamiento de moléculas adaptadoras incluyendo antígeno de diferenciación mieloide 88 (MyD88), quien sufre autofosforilación bajo asociación con el adaptador y activa el receptor para el factor de necrosis tumoral asociado a factor 6 (TRAF-6). Las señales por vía de TRAF-6 resultan en fosforilación y degradación del inhibidor de kB (I-kB), liberando el dimérico factor nuclear-kB (NF-kB) para translocación dentro del núcleo y poner en marcha los genes diana. Inflamación La inflamación es un proceso en que se movilizan varias líneas celulares, concentrándose en el sitio de invasión o lesión por agentes patógenos para aclarar los mismos del sitio de agresión. Las células que llevan el peso fundamental del proceso son los neutrófilos. La actividad de los neutrófilos se basa en su capacidad de responder a los estímulos ambientales a través de la interacción de los receptores situados en su membrana con los ligandos, conociéndose distintos grupos de receptores, que intervienen estimulando o inhibiendo específicamente el funcionamiento celular. Hay varios pasos secuenciales necesarios para que sea efectivo el proceso inflamatorio. • Estímulo • Activación del endotelio • Adhesión de leucocitos • Quimiotáxis • Diapédesis • Liberación de sustancias (citoquinas, óxido nítrico) – Vasodilatadores – Aumentan permeabilidad capilar • Migración de fagocitos al sitio de tejido dañado • Entrada al tejido dañado de enzimas del sistema de coagulación sanguínea • Reparación del tejido dañado y regeneración con tejido nuevo La misión esencial de los neutrófilos es ingerir y matar los microorganismos responsables de infección, para ello las células se dirigen al foco inflamatorio desde el lecho vascular (Figura 4). Para que las células dejen el torrente circulatorio y lleguen al foco inflamatorio tisular es necesario que se activen las células endoteliales y adquieran ciertos receptores de superficie que reaccionen con las correspondientes selectinas de las células sanguíneas. La activación es provocada por citoquinas liberadas en el foco. La adhesión con las selectinas es precoz pero débil y sólo consiguen frenar las células. Luego la unión es mediada por integrinas, que causan una fuerte fijación. La célula, una vez detenida, ya puede pasar por quimiotactismo al foco inflamatorio (Figura 5). La salida del torrente circulatorio, a través de un mecanismo de diapédesis, y su migración al foco de infección, es promovida por citoquinas y sustancias quimiotácticas de origen celular, o producidas por microorganismos (Figura 6). Una vez en el foco de infección las inmunoglobulinas y el complemento favorecen el contacto del microorganismo con la pared celular para que se efectúe su ingestión, o fagocitosis, pasando al fagosoma donde se vierten las sustancias de los gránulos y se activa el metabolismo oxidativo con la generación de productos tóxicos que ocasionan la muerte y digestión de los microorganismos (mecanismo de la fagocitosis). Figura 4. Mecanismo de la inflamación. Los neutrófilos son capaces de llegar hasta el foco infeccioso mediante distintos pasos, lo cual involucra otras sustancias, para eliminar el agente extraño y culminar el proceso con reparación del tejido dañado y regeneración con tejido nuevo. Figura 5. Elementos necesarios para que ocurra la fijación de los neutrófilos a la pared de los vasos sanguíneos. La activación de las células endoteliales produce la liberación de selectinas e integrinas, quienes facilitan la adhesión y fijación de los neutrófilos a la pared de los vasos sanguíneos. Figura 6. Mecanismo en la diapédesis de los polimorfonucleares neutrófilos que permite a estas células atravesar la pared vascular y llegar al espacio intersticial, al pasar entre las uniones de las células endoteliales mediante transformación de la citoarquitectura del neutrófilo. Proteínas de fase aguda En el organismo humano existen varias proteínas que se activan o sintetizan en la fase aguda de una infección, difiriendo en sus características moleculares, localización y mecanismo de acción, pero definitivamente van a interactuar con otros componentes del sistema inmune y también tener acción directa sobre el agente extraño al organismo. Algunas de estas proteínas que más se han estudiado son: • Proteína C reactiva (PCR) • Interferón (IFN) • Otras: α1-antitripsina, α2-macroglobulina, fibrinógeno El hígado secreta una gran cantidad de PCR en la circulación y lo hace más rápido y en mayor cantidad que otras proteínas de fase aguda que se miden rutinariamente en la clínica como pista de una infección. Se plantea que la IL-6 es el principal mediador que estimula la producción de PCR, pero otras citoquinas como la IL-1 y el TNF-α también están involucrados. Hay inequívoca evidencia de que la PCR juega un rol en las defensas del organismo contra los microorganismos, planteándose que su acción protectora se debe a que reduce la proliferación de bacterias en los estadios iniciales de la infección mediante la activación del complemento, opsonización y la inducción de fagocitosis. Sistema del complemento El sistema de complemento es un buen ejemplo de un proceso de activación secuencial en cascada, permitiendo una amplificación de la respuesta humoral (Figura 7). En este proceso, distintas proteínas plasmáticas en forma de proenzimas se van activando para producir sustancias capaces de cumplir funciones bactericidas o líticas, de opsonización y quimiotaxis. La activación puede iniciarse por la presencia de sustancias extrañas o de anticuerpos y hay 3 vías por la que puede producirse que se conocen como: • Vía clásica • Vía alterna • Vía dependiente de lecitina La vía clásica tiene un origen diferente a la alterna pero se llega a un paso que comparten la misma secuencia de activación, o sea, que convergen y de hay su nombre de vía común. La vía clásica se activa ante la presencia de anticuerpos circulantes que se unen a la proteína C1, mientras que la vía alterna no necesita la presencia de estos, sino la confrontación con ciertos componentes en la superficie del microorganismo. La vía dependiente de lecitina se desencadena por la unión de una proteína portando lecitina o ficolina, a las estructuras de carbohidratos bacteria/hongo. La cascada de activación del sistema de complemento se ilustra a continuación: Figura 7. Representación esquemática de la cascada de activación del sistema de complemento en que se aprecia las vías por las que puede iniciarse y secuencia en el proceso de activación. Células NK Otro de los mecanismos de inmunidad innata es el de las células NK, los cuales son un subtipo de linfocitos que destruyen las células extrañas sin mediar contacto previo. Las células NK se conocen también como linfocitos granulares grandes (LGL, por sus siglas en inglés) ya que se asemejan morfológicamente a los linfocitos, excepto que son ligeramente más grandes y tienen numerosos gránulos. Las células NK se identifican por la presencia de los marcadores de superficie CD56 y CD16 y la ausencia del marcador CD3. Cuando se incuban con IL-2 e IFN-gamma, las células NK se convierten en células activadas por linfocinas (LAK, por sus siglas en inglés), las cuales son capaces de matar células malignas (Figura 8). La exposición continua a IL-2 e IFN-gamma capacita a las células LAK para matar a células transformadas así como malignas. Las células NK y LAK no tienen receptores específicos a antígeno, más que eso, ellas tienen receptores inhibitorios y activadores que reconocen los antígenos del complejo de histocompatibilidad mayor (MHC) propios y otras ligandinas de la superficie celular; estos son un receptor activador de la citotoxicidad (KAR) y un receptor inhibidor de la citotoxicidad (KIR). Cuando el KAR encuentra su ligando, un ligando activador (KAL) en la célula diana, las células NK o LAK son capaces de matar a las células diana. Sin embargo, si el KIR se une también a su ligando entonces la citotoxicidad es inhibida aunque el KAR se encuentre unido al KAL. Los ligandos del KIR son las moléculas del MHC clase I. Por lo tanto, si una célula diana expresa moléculas MHC clase I no será destruida por las células NK o LAK aunque ésta tenga KAL que se una al KAR. Las células normales expresan constitutivamente moléculas MHC clase I en su superficie, sin embargo, las células malignas y las infectadas por virus regulan negativamente la expresión de las moléculas MHC clase I. Gracias a ello las células NK eliminan las células que no expresan las moléculas de MHC clase I debido a supresión por infección viral, o por pérdida de la expresión debido a transformación maligna, sin afectar a las células normales. Las células NK son verdaderas células centinelas, aunque su actuación frente a las infecciones es común, tienen una gran importancia en la defensa del organismo ante las células tumorales y en los trasplantes. Figura 7. Activación de las células NK que se convierten en células activadas por linfocinas (LAK) bajo el estímulo de IFN e IL-2, lo cual les da la capacidad de eliminar células del organismo malignas u otras no malignas transformadas por infección viral. Células dendríticas Las células dendríticas derivan de la médula ósea de origen hematopoyético, las cuales tienen un único rol y es la presentación primaria de antígenos a las células nativas de la rama efectora de la respuesta inmune. Sus diferentes subpoblaciones se encuentren en la sangre, órganos linfoides secundarios y en los sitios que son puerta de entrada de patógenos (piel y mucosas). En la sangre, tejidos y nódulos linfoides, dos subtipos de células dendríticas se han caracterizado, una mieloide y la otra plasmacitoide. Ambos subtipos difieren en su morfología, fenotipo de superficie y, posiblemente, en sus capacidades funcionales. A pesar de las diferencias observadas entre las células de origen linfoide y mieloide, ellas comparten varias propiedades, como su morfología dendrítica, y la expresión de un conjunto de moléculas necesarias para la estimulación de los linfocitos T vírgenes, tales como: MHC clase I y II, distintos marcadores de superficie, receptores de reconocimiento de patrones moleculares, receptores de quimiocinas, receptor para TNF, receptores para fragmentos del complemento, y receptores para Fc de inmunoglobulinas. Otro aspecto a destacar es que las células dendríticas, cuando salen a la periferia a colonizar los diferentes tejidos, se encuentran en un estado "inmaduro". Las células dendríticas inmaduras se especializan en su capacidad para tomar y procesar antígeno para presentación en receptores de MHC clase I y II, procesando los antígenos en endosomas y proteosomas intracelulares. La maduración de las células dendríticas puede ser inducida por estimulación con antígenos extraños, citoquinas o restos necróticos en el ambiente y por la provisión de señales “de ayuda” del ambiente celular circundante, tales como ligandinas CD40 en las células T CD4+. Cuando están maduras las células dendríticas presentan los antígenos procesados en el contexto de MHC clase I y II, o proteínas de superficie CD1 a las células T CD4+ y CD8+, además a las células NK. Las células dendríticas pueden estimular no solo la respuesta inmune adaptativa en la forma respuesta de anticuerpos de células B, por medio de células T CD4+, sino también las respuestas innatas más rápidas de células T CD8+ y células NK. Los macrófagos pueden diferenciarse como célula presentadora de antígeno (CPA) y asociar péptidos derivados de antígeno a sus moléculas de MHC clase II, para así contribuir a la inmunidad adaptativa al inducir activación de linfocito T específico. B- Inmunidad adquirida o adaptativa (específica) Este tipo de respuesta incluye la proliferación de linfocitos T y B antígeno-específico siguiendo a la presentación del antígeno a su receptor por las células del sistema inmune innato. La inmunidad adquirida o adaptativa tiene características que permiten diferenciarla de la innata y que consiste en: • Requiere contacto previo con el agente (sensibilización) • Es pequeño el número de células con especificidad para algún patógeno individual, por lo que las células que encuentran y reconocen un patógeno deben proliferar para alcanzar suficiente número para alcanzar una respuesta efectiva • Mecanismos de defensa que incrementan tras exposiciones repetidas a la MISMA molécula o agente (hay memoria inmune) • Cada molécula o agente extraño es reconocido por células diferentes • Respuesta lenta pero muy eficaz y selectiva • Mediada por el sistema inmune (principalmente linfocitos, pero también intervienen otras células) La inmunidad específica tiene dos componentes fundamentales que son: • • Humoral: mediada por anticuerpos – IgA(secretoria), IgA(humoral) – IgD – IgE – IgG1, IgG2, IgG3, IgG4 – IgM Celular: mediada por células – Linfocitos T citotóxicos – Linfocitos T de ayuda (“Helper”) B-1 Humoral La inmunidad humoral está representada por la síntesis de Ig por los linfocitos B, los cuales para producir las mismas se transforman y diferencian en células plasmáticas. Estas células se activan por la interacción con los linfocitos T y el antígeno. La primera respuesta ante un antígeno es la producción de IgM (respuesta primaria) y posteriormente la de IgG (respuesta secundaria). Una diferencia fundamental entre el reconocimiento de antígeno por las Ig y por los receptores de células T (TCR), es que las Ig pueden reconocer estructuras tridimensionales complejas, mientras que los TCR reconocen solo epítopes de péptidos lineares cortos. B-2 Celular Las células T se diferencian en el timo. Los linfocitos no diferenciados entran a la corteza del timo donde ellas proliferan y expresan moléculas transmembrana CD3, TCR, CD4 y CD8. La mayor parte de estas células muere en el timo, pero una pequeña parte pierde alguno de los marcadores CD4 o CD8. Las células CD4- CD8+ o CD4+ CD8- son seleccionadas por una interacción con MHC clase I (con las células CD4- CD8+) o MHC clase II (con las células CD4+ CD8-) del estroma tímico, para dejar este órgano y entrar a la circulación sistémica. Las células maduras que son CD4+ son células de cooperación; aquellas que son CD8+ son citotóxicas/supresoras. Los linfocitos T son células especializadas que después de ser estimuladas por las CPA y ser activadas, responden a los nuevos antígenos mediante la producción o expresión de citoquinas en sus membranas celulares que amplifican o regulan algunos procesos de la respuesta inmune. Además de las funciones efectoras, estas citoquinas toman parte en efectos claves para la proliferación de las células NK, monocitos, linfocitos B y la proliferación de los linfocitos T. La clase mayor de linfocitos T se define por su expresión de los TCR αβ; este receptor reconoce los antígenos peptídicos presentados en un complejo con las proteínas de los MHC clase I y II. La mayor función de los linfocitos T es identificar y destruir las células que han sido infectadas por patógenos que se multiplican intracelularmente. De los muchos mecanismos por los cuales los linfocitos T reconocen sus antígenos diana se enfoca en la respuesta de estos linfocitos sobre las células infectadas, o sobre las células que han tomado antígenos microbianos por medio de fagocitosis o picnocitosis y no en el antígeno libre en solución. Los linfocitos T reconocen un complejo molecular de un antígeno microbiano más una estructura propia. Las estructuras propias son las moléculas de MHC unidas a péptido antigénico (también denominadas antígenos HLA), dos clases de glicoproteínas de la superficie celular que unen fragmentos de proteínas que han sido sintetizadas dentro de la célula (moléculas MHC clase I), o han sido ingeridas por las células y proteolíticamente procesadas (moléculas MHC clase II). Hay tres tipos de moléculas MHC clase I: HLA-A, HLA-B y HLA-C; mientras que para las moléculas MHC clase II también existen tres tipos denominadas: HLA-DR, HLA-DQ y HLA-DP. Para una completa activación de los linfocitos T se requiere de la interacción entre el TCR y las moléculas péptido-MHC, pero además la interacción adicional entre la molécula CD28 coestimulatoria en el linfocito T y CD80 o CD86 en la CPA. Los linfocitos T producen, durante las respuestas inmunes natural y específicas, una familia de citoquinas o interleukinas, las cuales son proteínas solubles de bajo peso molecular y que son potentes a bajas concentraciones, las cuales se unen a receptores específicos de la membrana de las células donde van a ejercer su función, iniciando una cascada de transducción intracelular de señal que altera el patrón de expresión génica, de modo que modulan la actividad celular de proliferación, diferenciación y secreción. Tienen un rol fundamental en el desarrollo inmunológico. Algunas de estas son: ¾ IL-1 ¾ IL-6 ¾ IL-10 ¾ IL-12 ¾ TNF-α ¾ Interferón-γ Los linfocitos T αβ se diferencian en algunas subpoblaciones diferentes, incluyendo linfocitos T citotóxicos o CD8+ y linfocitos T de ayuda (“helper”) o CD4+. Además de su rol marcador para estas células de CD4+ y CD8+, estos sirven como coreceptores en la interacción de las células TCPA. Los linfocitos T citotóxicos o CD8+ son un grupo celular que desempeñan sus funciones inmunes con eficiencia y tienen una serie de características. • Presentan receptores de superficie que reconocen proteínas en la membrana de otras células • Tienen gran variedad de receptores • Destruyen células con proteínas extrañas presentadas por las CPA – Células infectadas por virus – Células tumorales – Células trasplantadas Otro grupo celular son las células T de ayuda o CD4+, las cuales también tienen características muy propias. • Ayudan a los linfocitos Tc y linfocitos B • Liberan citoquinas • Mecanismo de seguridad • Intervienen en la selección de los mecanismos efectores: respuesta Th1 o Th2. Cuando los linfocitos T nativos CD4+ y CD8+ se activan por las CPA, estas se diferencian en las subpoblaciones distintas funcionalmente dependiendo de las citoquinas y señales coestimulatorias que ellas reciben durante el proceso de activación. Cuando las células T CD4+ se activan por las CPA segregando IL-12 se diferencian a células efectoras productoras de altos niveles de Interferón-γ e IL-2 (nombradas células TH1), mientras que las células T CD4+ activadas por las CPA estimuladas por IL-4 que expresan CD86 se diferencian a células efectoras productoras de IL-4, IL-5, IL-9 e IL-13 (nombradas células TH2). Generalmente las células TH1 sostienen las respuestas inmunes mediada por células, mientras que las células TH2 sostienen las respuestas humoral y alérgica. La mayoría de las respuestas inmunes de las células TH muestran una combinación de rasgos TH1 y TH2; sin embargo, después de inmunización prolongada, la respuesta puede resultar dominante como TH1 o TH2. Los factores que determinan si las células CD4+ tienen respuestas TH1 o TH2 se desconocen, pero puede ser influenciado por el tipo de patógeno, el tamaño del inóculo bacteriano y el sitio de infección. Independientemente de la subdivisión y clasificación que hemos utilizado, estas son de cierta manera aparente, pues hay una imbricación y superposición de mecanismos, a veces muy difíciles de dilucidar, en la respuesta inmune del organismo ante una agresión y esto se debe a que existe una colaboración muy estrecha entre los mecanismos inmunológicos, con la respuesta innata representando la primera línea de defensa del huésped y la respuesta adaptativa resultando prominente después de algunos días cuando las células T y B han tenido una expansión clonal. Un esquema resumido (Figura 9) de los distintos tipos de los mecanismos efectores que se seleccionan y las implicaciones inmunes de las mismas se esquematizan a continuación: IL-12 Actividad de TH1 las células NK IL-12 Inmunidad IL-2 mediada por IFN-γ células IFN-γ INFLAMACIÓN CPA TH0 IL-10 TH2 IL-5 Activación de eosinófilos IL-6 Respuesta de fase aguda IL-10 Subregulación de la IL-13 inflamación IL-4 Activación de célula B (Ig) IL-4 SÍNTESIS DE ANTICUERPOS Figura 9. Aparecen esquematizadas las células T helper TH1 y TH2. La naturaleza y dosis del antígeno presentado por la célula presentadora de antígeno (CPA) puede también influenciar si el fenotipo TH1 o el TH2 se manifiesta. Las líneas continuas y discontinuas representan influencias positivas y negativas respectivamente. INMUNIDAD EN EL FETO Y RECIÉN NACIDO Después de repasar algunos aspectos de la inmunidad podemos adentrarnos en el desarrollo de los procesos inmunes que ocurren desde la formación del feto hasta el período neonatal y establecer de esta manera algunas comparaciones que permitan ilustrar con mayor exactitud por qué se dice que el RN es un ser que todavía no ha madurado inmunológicamente. I- Etapa fetal El feto se desarrolla en un medio estéril pero no exento de exposición ocasional a distintos microorganismos que pueden alcanzar el claustro materno o el medio interno del feto. De esta manera ya desde muy temprano del propio desarrollo de los distintos órganos y sistemas, los elementos relacionados con la inmunidad también tienen lugar. El sistema inmune proviene de las células derivadas de las células precursoras del sistema hematopoyético, cuya mayor fuente es el saco germinal hasta la tercera semana de vida fetal, seguido por el hígado fetal a las 8 semanas y finalmente por la médula ósea después del quinto mes de gestación. Durante la vida intrauterina estas células son sometidas al efecto de un microambiente especializado, tales como de la médula ósea y el timo, respondiendo a las señales de estimulación, proliferación y diferenciación, resultando en la proliferación y diferenciación, para así formar el sistema inmune innato y específico. Esto es un proceso complejo y detallado. Durante el desarrollo tímico, las células T que reconocen algún antígeno unido a los complejos MHC propios del individuo, son seleccionadas positivamente (restricción a los MHC propios), mientras que aquellas que no lo hacen sufren apoptosis. En un proceso de selección ulterior, aquellas que reconocen el complejo antígenos-propios/ MHC son eliminados (selección negativa), previniendo así la autoinmunidad. Menos de un 2% de los precursores de células T que entran al timo pasan por este riguroso proceso de selección y lo abandonan como células T nativas maduras. El origen de las distintas líneas celulares (Figura 10) que constituyen el sistema inmune se muestra a continuación: Figura 10. Representación esquemática del origen de las distintas líneas celulares que constituyen el sistema inmune. Una síntesis esquematizada del desarrollo inmune fetal se expone a continuación: Tipos de inmunidad Edad Inmunidad Inmunidad (semanas) Inmunidad innata Inmunidad celular humoral pasiva 5-6 9-10 12-14 16-17 20-30 Precursores de las células T en el hígado Macrófagos en el hígado y la sangre Inicio de la síntesis de complemento Células NK en hígado Macrófagos en nódulos linfoides y células presentadoras de antígeno con HLA mayor clase II Macrófagos maduros en el hígado y neutrófilos circulantes Precursores de células B en el hígado Precursores de las células T en el timo Células pre-B con IgD, IgG e IgA Células T CD4+ y células CD8+ en el timo, hígado y bazo Gran número de células B en el bazo, sangre y médula ósea Células T en la sangre y tejido linfoide/reordenamie nto de receptores Las células B secretan anticuerpos Incremento gradual de los linfocitos T secretores de linfoquinas Inicio de la transferencia de IgG materna Incremento gradual del transporte de IgG A medida que se avanza en el embarazo el feto alcanza mayor provecho, tanto en lo referente al traspaso pasivo de IgG materna, como en la propia maduración de sus defensas y sistema inmune. Con ello verificamos que el RN tiene capacidad de respuesta, pero todavía en este período no ha alcanzado la adecuada madurez inmunológica. Repasemos como se comportan los distintos mecanismos que intervienen en la defensa del RN en la misma secuencia que lo hicimos antes. II- Etapa neonatal Está claro en la literatura que el principal estímulo para la maduración postnatal de la función inmune son las señales del ambiente microbiano, particularmente en el tracto gastrointestinal, con la formación de la flora microbiana. Las infecciones, particularmente en el tracto gastrointestinal y respiratorio, también pueden contribuir a este proceso. A- Inmunidad natural (inespecífica) A-1 Barreras físico-químicas La piel tiene en el RN mayor permeabilidad, particularmente en el prematuro ya que su capa córnea está aun en formación en los inicios del tercer trimestre del embarazo, por lo que pueden penetrar a través de la misma microorganismos y sustancias extrañas. Hay susceptibilidad a formar ampollas que se rompen con facilidad y por lo tanto se pierde la integridad de la piel. Aun así, el RN cuenta con el vernix caseoso, que es una capa cerosa secretada por las glándulas sebáceas, la cual contiene péptidos y proteínas antimicrobianos, incluyendo lisozima, αdefensinas, ubiquitín y psoriasín, así también ácidos grasos libres que pueden actuar en sinergismo con los anteriores péptidos y proteínas para matar microorganismos (bacterias y hongos). Esta cubierta microbicida en la superficie de la piel por lo tanto protege al RN durante la transición a la vida extrauterina. Como consecuencia de la exposición al medio extrauterino, aun en el RN prematuro la piel acelera su maduración funcional. El tracto intestinal fetal está normalmente bañado de un líquido amniótico estéril que ha sido deglutido. El epitelio que recubre la mucosa del tubo digestivo es más permeable a la translocación de bacterias que comienzan a instalarse como flora intestinal. El pH gástrico es habitualmente menos ácido por la lactancia casi continua en el tiempo y por tanto, la acidez gástrica protectora se modifica. Los componentes secretorios y los inmunocitos productores de IgAs están deficientes en el epitelio mucoso intestinal, pero pronto hacen su presencia en respuesta a los factores estimulantes después del nacimiento. También se ha demostrado inmunidad innata mediada por RLT en los enterocitos del intestino delgado y paralelamente el desarrollo de las células de Paneth – las cuales son una fuente rica en péptidos y proteínas antimicrobianos- en el propio intestino delgado del RN, contribuye al aclaración de bacterias tales como E. coli. La alimentación con leche materna adiciona un mecanismo protector al tracto intestinal por la gran cantidad de factores inmunológicos que contiene. Las glándulas sudoríparas y lagrimales no forman sus secreciones en cantidad y con el pH ácido suficiente para realizar una función química y física eficaz. La filtración nasal y blanqueamiento mucociliar está alterado. Muchos RNs prematuros son sometidos a frecuente ejecución de procedimientos de diagnóstico y tratamiento que vulneran las barreras naturales. A-2 Respuesta inmune innata • Fagocitosis Los granulocitos neutrófilos están en mayor cantidad en el RN de manera absoluta, y el porcentaje en la fórmula leucocitaria muestra un predominio de los mismos durante el período neonatal y es más notable en la primera semana de vida. Aunque los RNs producen G-CSF/GMCSF y expresan estos receptores, el pool de reserva en la médula ósea es menor en comparación al adulto y se depleta rápidamente ante la respuesta a la sepsis. Estos neutrófilos tienen una serie de defectos funcionales en varios pasos de la actividad fagocítica como son: ¾ Adherencia (disminución de proteínas de superficie fibronectina y L-lecitina) ¾ Deformabilidad y diapédesis ¾ Quimiotaxis ¾ Fagocitosis ¾ Actividad microbicida ¾ Contenido de gránulos y degranulación Los monocitos y macrófagos están en cantidad adecuada pero se ha señalado que hay deficiencias en el procesamiento y presentación de antígenos y fallos en la regulación y expresión de los HLA mayor tipo II en la superficie celular; además, son funcionalmente deficientes en secretar citoquinas (TNF-α, IL-6, IL-8) y en otros pasos de la actividad fagocítica. • Inflamación Una cualidad importante del proceso inflamatorio es limitar o detener la expansión de una infección focal, por lo que las deficiencias señaladas antes en la actividad de los grupos celulares vinculados a este proceso, explican la tendencia a la diseminación de infecciones. Se ha encontrado una expresión notablemente disminuida de MyD88, la proteína del adaptador del RLT-4, sugiriendo un deterioro en las señales mediadas por RLT-4 en monocitos neonatales. La pobre respuesta de células mononucleares neonatales para LPS, el activador más potente derivado de un agente patógeno, y para IFN-γ, el más potente agente de activador de macrófago en vivo, incrementa la posibilidad de un defecto neonatal global de estímulo-respuesta en las células fagocitarias mononucleares. Tal defecto de señalización, resultando en supresión de inflamación y, como consecuencia, una respuesta antimicrobiana deteriorada de monocitos y macrófagos, podría ser el mayor componente de la inmunodeficiencia celular innata en RNs. • Proteínas de fase aguda No hay comprobación de que la inmadurez hepática, sitio de síntesis de la PCR, así como tampoco que la deficiencia en la secreción de citoquinas, inductores para la formación de la PCR, pueda influir en la formación de esta proteína en la respuesta inmune. • Sistema del complemento Las proteínas del complemento no son transferidas a través de la placenta por lo que el feto debe fabricarlas por sí mismo. En el RN a término los niveles de complemento no sobrepasan el 50% a 80% de los niveles del adulto, y son inferiores en proporción a la menor edad gestacional. Los bajos niveles del complemento causan deficiencias de activación de productos que son esenciales para la quimiotaxis y opsonización. • Células NK (“natural killer”) Las células NK representan una línea distinta de células linfoides que se desarrollan en la médula ósea bajo la influencia de IL-2 e IL-15. Los RNs tienen una cantidad similar o quizás mayor de células NK en sangre periférica en comparación al adulto, pero estas células tienen fenotipo y son funcionalmente diferentes. La expresión de marcadores de superficie como CD56 y CD57, así como CD16 está reducida lo cual obstaculiza la citotoxicidad dependiente de anticuerpos. Las células NK secretan Interferón-γ que activa los macrófagos y otras células NK y tiene acción antiviral directa. Como parte de la inmunotolerancia materno-fetal, en los RNs falta el Interferónγ y por esto, muestra disminución de la actividad de las células NK, llevando a incremento en la susceptibilidad a infecciones virales y a algunas infecciones bacterianas tales como Listeria monocytogenes. • Células dendríticas Las células dendríticas, aunque con deficiencias en su función evidentes bajo determinadas circunstancias, son competentes para funcionar a los niveles del adulto. Es posible que algunas de las discrepancias en la función observadas puedan ser debidas a las funciones regulatorias de otros tipos de células. B- Inmunidad adquirida o adaptativa (específica) B-1 Humoral De todas las Ig la única que atraviesa la barrera placentaria es la IgG, lo cual ocurre fundamentalmente en el último trimestre a partir de las 34 semanas de edad gestacional, pues de alrededor 400 mg/ml alrededor de las 32 semanas, se incrementa a 1,000 mg/ml al término, por lo que el RN prematuro se ve deprivado de esta transfusión pasiva de anticuerpos; sin embargo, no todas las subclases de IgG van a estar suficientemente representadas sino que es bien eficiente la transferencia de IgG1 e IgG3, pero es bajo el aporte de IgG2, la cual es una subclase que contribuye a la protección de bacterias conteniendo polisacáridos capsulares, como sería Streptococcus agalactiae. La IgM tiene una acción muy particular para los microorganismos Gram negativos y al no estar en suficiente cantidad en el RN hay predisposición también a la infección por estos microorganismos. De forma general, el RN tiene niveles disminuidos de todas las clases de Ig, excepto para la IgG, gracias al paso pasivo transplacentario, pero estos niveles a su vez disminuyen en pocos meses después del período neonatal, creando un bache inmunológico. Los niveles normales de Ig se alcanzan después del primer año. El feto y el RN infectado es capaz de producir anticuerpos IgM en respuesta a antígenos bacterianos, pero a un nivel más bajo que el adulto. La síntesis de IgG e IgA en estos casos es limitada y para colmo estos anticuerpos no responden a ciertos antígenos y tienen poca capacidad para desarrollar memoria. B-2 Celular Los linfocitos T del RN son diferentes a los del adulto y producen con limitaciones las citoquinas, se ha demostrado que en el feto y el RN estas células exhiben deficiencias tales como baja respuesta proliferativa, menor producción de IL-2, disminución de la actividad citolítica y producción anormal de citoquinas. Por esto, las respuestas a antígenos T-dependientes específicos, incluyendo citotoxicidad dependiente de CD8+ y la producción de anticuerpos dependientes de CD4+ están reducidas o retardadas en comparación con el adulto. Con el descubrimiento de las poblaciones de células TH1/TH2 resulta claro que las respuestas de las células T neonatal además de deficientes, también son desviadas a la línea de células TH2. Las propiedades cuantitativas y cualitativas de las células T CD4+ en RNs son probablemente factores en la plasticidad neonatal de las respuestas de células TH1/TH2, entre estas propiedades está la deficiente producción de citoquinas tipo TH1 por las células T CD4+ y los fagocitos mononucleares; además también contribuye en este desvío a la producción de citoquinas TH2 otras células accesorias inmaduras o disreguladas, particularmente las células dendríticas y los linfocitos B. Comparación de la inmunidad neonatal vs. adulto Valores en RN vs. adulto Aspectos clínicos Barreras naturales Deficiencias estructurales y funcionales por inmadurez Estructuras bien desarrolladas y funcionales Inmunidad por células B La IgG materna transplacentaria está dirigida a Porcentaje de linfocitos B normal patógenos específicos Los RNs de alto riesgo de infecciones Concentraciones séricas de: bacterianas severas carecen de anticuerpos específicos porque: Los anticuerpos son los que se transfieren de la IgG en RN a término normal circulación materna al feto transplacentariamente Si es un RN prematuro la transferencia de IgG en en RN prematuro ↓ anticuerpos no ha ocurrido IgM ↓ Estos anticuerpos no pasan la barrera placentaria IgA ↓ IgE ↓ La IgA secretoria puede ser suplementada por la IgA secretoria ausente leche materna Inmunidad por células T Porcentaje de linfocitos T ↓ Inmunidad mediada por células funcionalmente insuficiente y no responde a antígenos específicos Número absoluto de linfocitos T ↑ La insuficiente respuesta predispone a infecciones El incremento de células T supresoras puede Número de células T supresoras ↑ inhibir la producción de anticuerpos prenatalmente Inmunidad por neutrófilos y monocitos Número absoluto y porcentaje de Susceptibilidad a infecciones severas ↑ neutrófilos ↑ Quimiotaxis ↓ Defectos de fagocitosis Número absoluto de monocitos ↑ y Enzimas glicolíticas ↓ porcentaje normal Inmunidad por complemento La mayoría de los componentes están ↓ (30-50%) Generación defectuosa de factores quimiotácticos En el RN prematuro es acentuada que Anomalías en la opsonización en el RN a término La actividad de la vía alterna < clásica Bibliografía 1. Abreu MT, Arditi M. Innate immunity and Toll-like receptors: Clinical implications of basic science research. J Pediatr 2004; 144(4):421-9. 2. Adkins B, Leclerc C, Marshall-Clarke S. Neonatal adaptative immunity comes of age. Nature Rev Immunol 2004; 4:553-64. 3. Brown KL, Hancock REW. Cationic host defense (antimicrobial) peptides. Curr Op Immunol 2006; 18:24-30. 4. Buckley RH. Sistemas celulares T, B y citolíticos. En Behrman RE, Kliegman RM, Arvin AM. Nelson Tratado de Pediatría.15ª Edición. Ciudad de la Habana: McGraw-Hill. Interamericana. 1998, p: 703-11. 5. Burgaleta Alonso de Ozalla C, López Rubio M, García Suárez J, de Miguel Llorente D. Alteraciones funcionales de los granulocitos. Medicine 2001; 8(52):2743-8. 6. Cavaillon JM, Adib-Conquy M. Monocytes/macrophage and sepsis. Crit Care Med 2005; 33(12 Suppl):F506-9. 7. Chaplin DD. 1. Overview of the human immune response. J Allergy Clin Immunol 2006; 117:S430-5. 8. Enríquez-Rincón F. INMUNOLOGÍA-CAPÍTULO UNO. INMUNIDAD INNATA (NOESPECÍFICA). 2007 [accedido 31 de Mayo del 2007] URL disponible en: http://pathmicro.med.sc.edu/Spanish-immuno/imm-chapter1.htm. 9. Gaunt G, Ramin K. Immunological tolerance of the human fetus. Am J Perinatol 2001; 18(6):299-312.Medzhitov R. Toll-like receptors and innate immunity. Nature Rev Immunol 2001; 1135-45. 10. Gennery AR, Cant AJ. Applied physiology: Immune competence. Curr Paediatr 2006; 16:447-52. 11. Germain RN. T-cell development and the CD4-CD8 lineage decision. Nature Rev Immunol 2002; 2:309-22. 12. Goldman AS. Host responses to infection. Pediatr Rev 2000; 21(10):342-9. 13. Griffin G, Krishna S. Cytokines in infectious disease. J R Coll Physician Lond 1998; 32(3):195-8. 14. Holt PG, Jones CA. The development of the immune system during pregnancy and early life. Allergy 2000; 55:688-97. 15. Johnston RB Jr. Function and cell biology of neutrophils and mononuclear phagocytes in the newborn infant. Vaccine 1998; 16(14/15):1363-8. 16. Lecherman HM, Wilkenlstein JA. Immunology. In Oski. Principles and Practice of Pediatrics. 2nd edition.Philadelphia: JB Lippincott Company.1994, p:178-84. 17. Levy O. Innate immunity of the newborn: Basic mechanisms and clinical correlatos. Nature Rev|Immunology 2007; 7:379-90. 18. Maródi L. Innate cellular immune responses in newborns. Clin Immunol 2005; 118(23):137-44. 19. Marshall-Clarke S, Reen D, Tasker L, Hassan J. Neonatal immunity: how well has it grown up? Immunol Today 2000; 21(1):35-41. 20. Nesin M, Cunningham-Rundles S. Cytokines and neonates. Am J Perinatol 2000; 17(8):393-404. 21. Orange JS, Ballas ZK. Natural killer cells in human health and disease. Clin Immunol 2006; 118:1-10. 22. Panoskaltsis N, Reid CDL, Knight SC. Immune modulation with dendritic cells. Transfusion Med 2004; 14:81-96. 23. Póvoa P, Almeida E, Moreira P, Fernandes A, Mealha R, Aragão A, et al. C-reactive protein as an indicator of sepsis. Intensive Care Med 1998; 24:1052-6. 24. Rossi M, Young JW. Human dendritic cells: Potent antigen-presenting cells at the crossroads of innate and adaptative immunity. J Immunol 2005; 175:1373-81. 25. Szalai AJ, McCrory MA. Varied biologic functions of C-reactive protein. Immun Res 2002; 26(1-3):195-203. 26. Szalai AJ. The antimicrobial activity of C-reactive protein. Microb Infect 2002; 4:201-5. 27. Watson RS, Carcillo JA. Scope and epidemiology of pediatric sepsis. Pediatr Crit Care Med 2005; 6[Suppl.]:S3–S5. AGRADECIMIENTOS Al Dr. Héctor Iván Andreu, especialista de 1er grado en Inmunología, quien nos apoyó con su experiencia y solidaridad en la corrección de la versión final del manuscrito.