Laboratorio General de Química I
Anuncio

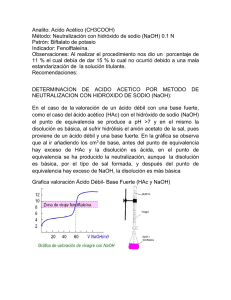
Laboratorio General de Química I Práctica tutelada. Valoración del pH de un yogur Nombre: Víctor Alcolea, Manuel Caballero, Toni Matias y Miguel Ángel Rodríguez Fecha: 24/10/2013 ESTANDARIZACIÓN DE UN PATRÓN SECUNDARIO. VALORACIÓN ACIDEZ DE YOGUR. 1.OBJETIVO Valoración del pH del yogur a partir de una disolución de NaOH previamente estandarizada. 2.INTRODUCCIÓN El pH es la medida de la acidez de un medio, es decir, la concentración de protones hidronio que presenta una disolución acuosa. Podemos calcularlo con la fórmula pH = -log[H3O+], siempre y cuando la actividad de los iones H3O+ sea igual a su concentración. Este método matemático se puede usar solo para sustancias con composición conocida. Para calcular el pH de una disolución cuya composición desconocemos existen dos métodos: pH-metro(medidas cuantitativas). El pH-metro es un potenciómetro que nos da un pH exacto de manera prácticamente instantánea, ya que mide la diferencia de potencial entre un electrodo de referencia y otro sensible al H+ Indicadores(medidas cualitativas). Los indicadores de pH son sustancias que cambian su estructura molecular según el pH del medio, lo que nos permite observar cambios a nivel macroscópico, como una variación del color. Generalmente, para un cálculo aproximado del pH se utiliza papel indicador, que nos da un intervalo de pH según el color que adquiere el papel en contacto con la substancia a valorar; aunque para cálculos más exactos se utilizan indicadores como la fenolftaleína, el naranja de metilo, el azul de metileno o el azul de bromotimol. Para calcular el pH mediante indicadores, es necesario utilizar un patrón primario (sustancia con concentración perfectamente conocida) o un patrón secundario anteriormente estandarizado, para conocer en todo momento el número de moles necesarios para neutralizar la disolución. El yogur es un producto alimenticio que proviene de la leche, la cual es fermentada para sustituir la lactosa por ácido láctico. Dicho proceso disminuye el pH del medio, ya que el ácido láctico (pKa=3,5) aumenta la concentración de iones hidronio, por lo tanto, el pH disminuye de 6(leche) a un intervalo de 4-5(yogur). 1 3. MATERIAL Y REACTIVOS: Material Reactivos 2 espátula papel indicador 1 pesasustancias 1 balanza de presición 2 vidrio de reloj 1 matraz aforado de 100 ml 1 erlenmeyer 250 ml 1 probeta 50 ml 1 bureta 50 ml 2 pipeta graduada 10 ml 1 pera de goma 2 pipeta Pasteur Ftalato ácido de potasio (HFK) Hidroxido de sodio (NaOH) Fenolftaleína (disolución) 4. Seguridad y riesgos 5. Procedimiento experimental Para realizar esta práctica es necesario dividirla en tres etapas: 1.- Preparación de las disoluciones 1.1. Preparación de NaOH 0.1M Con la espátula, se pone NaOH en un vidrio de reloj tarado para poder pesar 2g de NaOH en una balanza. Se introduce el NaOH en un vaso de precipitados de 150mL con agua hasta los 100mL y se disuelve completamente. Se mete la disolución en un matraz aforado de 500mL con 200mL de agua aproximadamente y se enrasa. Se tapa bien el matraz, se agita un poco y se mete en una botella de plástico de medio litro. (1)0,5 L NaOH · · = 2 g NaOH Con esta ecuación obtenemos los gramos de NaOH necesarios para preparar la disolución 1.2 Preparación de la disolución de HFK 2 Con la espátula ponemos HFK en un pesasustancias y se pesan exactamente 3g de HFK en una balanza de precisión. Se introduce en un vaso de precipitados de 50mL con alrededor de 30mL de agua y una vez disuelto completamente se enrasa hasta los 100mL. Una vez preparada la disolución se guarda en un frasco de cristal. (2) · = Con esta ecuación sacamos los moles de HFK que tenemos en la disolución. 2.- Estandarización del NaOH 1. Se añaden 10mL exactos de la disolución de HFK a un erlenmeyer de 250mL con aproximadamente 50 ml de agua y se agregan 3 gotas de fenolftaleína 2. Se llena la bureta con NaOH y se enjuaga con NaOH antes de usarla. 3. Se enrasa y se va añadiendo lentamente al erlenmeyer hasta que el indicador cambie de color. Se repite tres veces y midiendo los volúmenes exactos. La diferencia entre los volúmenes no debe ser mayor a 1mL. En caso de que la diferencia supere 1mL se debe repetir el ensayo. 4. Con los mL usados de NaOH para que la fenolftaleína cambie de color, se calculan la verdadera concentración de la disolución. 5. Para calcular la concentración real de NaOH, se necesita el volumen medio (v m) y la desviación estándar (σ) como indican las fórmulas 5 y 6 (3) · · · · = = NaOH yM Con esta ecuación se obtiene la concentración real de NaOH. 3.- Calculo del pH del yogur 1. Se cogen 10mL de yogur con una pipeta y se transfieren a un erlenmeyer de 250mL con aproximadamente 75mL de agua para disolver el yogur. Como es probable que se quede yogur en la pipeta, se introduce agua y se enjuaga hasta que ya no quede yogur, vaciando la pipeta dentro del erlenmeyer. 2. Se introduce NaOH dentro de la bureta y se enjuaga antes de su uso. 3. Se enrasa y se añade lentamente NaOH al erlenmeyer hasta que el indicador cambie de color. Se anota el volumen de NaOH usado. Se repite el proceso tres veces siempre y cuando la diferencia entre los volúmenes no sea mayor a 1mL. En caso de que la diferencia sea mayor a 1mL, se repite la valoración. 3 4. Usando la concentración real de NaOH, se calculan los moles de NaOH que hay. A partir de los moles, como es una base fuerte, podemos suponer que se disocia completamente y usamos los moles de NaOH como moles de OH -. 5. A partir de esos moles y el volumen usado, calculamos los moles de H3O+ que había en la disolución de yogur y, por consiguiente, los que había en los 10mL de yogur usados. Con esto, obtendremos la concentración de H3O+ y consecuentemente, el pH del yogur. 6. Para el cálculo de la concentración necesitaremos el volumen medio (v m) y la desviación estándar (σ) obtenida a partir de los volúmenes de NaOH. Para aplicarlas, necesitaremos las fórmulas 5 y 6 para el cálculo del volumen y la 7 para el cálculo de la concentración (4) · · · = Con esta fórmula obtenemos los moles de H3O+ del yogur (5) V= Vm NaOH ± σ (6) σ = √ ∑( ) (7) pH = -log[H3O+] = log Con estas fórmulas obtenemos el volumen a partir de la desviación estándar, la desviación estándar y el pH respectivamente. *Los valores de la concentración de NaOH se dan en la fórmula 3 en función de x, ya que no conocemos esos valores realmente, deben ser obtenidos en el laboratorio y para facilitar el trabajo durante la práctica, se deja ya la ecuación en función de x, que simplemente debe ser substituida por el valor del volumen de NaOH. La molaridad del NaOH está expresada como “y “(NaOH yM), siendo “y” el resultado de 1.77·10-3/x una vez conocido el valor de x. **Los valores de los mL de NaOH usados para la valoración del yogur se dejan expresados en la ecuación 4 como “z”, siendo así la concentración de H3O+ expresada en función de y y z. 6. Bibliografía: http://es.wikipedia.org/wiki/PH Prácticas anteriores: 4(preparación de disoluciones) y 6(Valoración ácido-base) Cuaderno de prácticas 4 es.wikipedia.org/wiki/Indicador_de_pH http://es.wikipedia.org/wiki/Yogur http://www.consumer.es/web/es/alimentacion/guia-alimentos/leche-yderivados/2001/04/10/35269.php http://es.wikipedia.org/wiki/Fermentación Operaciones de laboratorio en química, Fernández González, Manuel. Madrid, Anaya, 2004 http://www.unirioja.es/dptos/dq/docencia/material/obl/OBLFINAL.PDF http://es.wikipedia.org/wiki/Hidrogenoftalato_de_potasio 5