elementos traza y ultratraza - Asociación Española de Biopatología
Anuncio

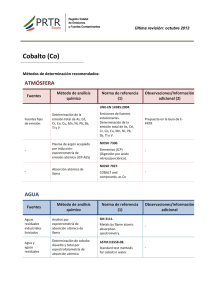
CURSO DE FORMACIÓN CONTINUADA A DISTANCIA TALLER DEL LABORATORIO CLÍNICO ELEMENTOS TRAZA Y ULTRATRAZA CURSO 2007 - 2008 Nº 6 I.S.S.N.- 1988-7469 Título: Taller del Laboratorio Clínico Editor: Asociación Española de Biopatología Médica Maquetación: AEBM Fecha de Distribución: Abril 2008 ELEMENTOS TRAZA Y ULTRATRAZA Laura López García. Residente de Análisis Clínicos. Luisa Mª Fernández Sánchez, Residente de Bioquímica Clínica. Dra. Montserrat González Estrecha. Servicio de Análisis Clínicos. Dra. Mª Ángeles Cuadrado Cenzual. Servicio de Análisis Clínicos. Hospital Clínico de San Carlos de Madrid. 1. INTRODUCCIÓN Todos los tejidos animales y vegetales contienen elementos minerales o inorgánicos en cantidades y proporciones muy variables. Estos elementos inorgánicos constituyen las cenizas resultantes de la incineración o calcinación de dichos tejidos, y tienen una importancia vital para una adecuada nutrición. En el organismo humano siete elementos (C, H, N, O, Cl, P y S) representan aproximadamente el 98.1% del peso, mientras que el 1.9% restante lo constituyen dos grupos de elementos: los minerales y los oligoelementos o elementos traza. La distinción entre minerales y elementos traza suele hacerse en función de las necesidades dietéticas diarias o, como propuso en su momento la IUPAC [1], según su concentración en suero o plasma. Así, los minerales son elementos que el organismo humano precisa en cantidades mayores de 100 mg/día o que se encuentran en concentraciones superiores de 100 µg mL-1 en suero o plasma, mientras que los elementos traza son aquellos que el ser humano precisa en concentraciones menores de 100 mg/día o que presentan concentraciones en plasma o suero inferiores a 100 µg mL-1. Se denominan elementos ultratraza aquellos cuyos - 91 - requerimientos están en el orden de µg/día o que se encuentran por debajo de 0.01µg g-1. Siguiendo esta clasificación, los minerales son Ca, K, Mg, y Na, y representan la práctica totalidad del 1.9% restante del peso del cuerpo. Por otra parte, los elementos traza suponen concentraciones inferiores al 0.01% del peso corporal; pertenecen a este grupo Fe, Cu, Zn e I. Los elementos ultratraza son aquellos cuyo contenido es inferior a 10 mg de peso corporal; a este grupo corresponden Al, Se, Cr, Mn, Li, Ni, Mo, Cd, Pb, Co, Si y V [2]. Los elementos traza son multifuncionales, y actúan en: 1. Actividad catalítica. 2. Configuración estructural y reguladora de múltiples estructuras (hormonas, enzimas, membranas biológicas); por ello su déficit o exceso provocan síntomas genéricos, no específicos a nivel sistémico. La principal fuente de los elementos traza es el ambiente (dieta, aire, agua), aunque su mayor o menor presencia en el organismo depende fundamentalmente de sus características físicoquímicas. Los elementos traza se clasifican en: 1. Esenciales: Presentan unas propiedades fisicoquímicas similares (corresponden en su mayoría a la primera serie de transición), lo que determina su función y distribución en el organismo. Los elementos traza esenciales son vanadio, - 92 - molibdeno, cromo, manganeso, hierro, cobalto, níquel, cobre, zinc, silicio, yodo, selenio y flúor. Una buena homeostasis de los elementos traza es muy importante para mantener las concentraciones fisiológicas dentro del intervalo óptimo para que desempeñen su función biológica, evitando aumentos o disminuciones que provocarían toxicidad o déficit. La ingesta baja de un elemento traza reconocido provoca una enfermedad por su deficiencia. Cuando se incrementa su ingesta con suplementos dietéticos se recuperan las funciones biológicas al alcanzar sus concentraciones óptimas en el organismo. Si se aumenta más la ingesta podría darse un efecto adverso tóxico. La ventana de concentraciones que separa la ingesta dietética beneficiosa de la ingesta tóxica depende del elemento en cuestión y de la naturaleza de las especies químicas presentes en la dieta [3]. Figura 1. Efecto de la dosis de un elemento esencial sobre la respuesta fisiológica Los elementos traza esenciales se pueden subdividir en tres grupos: - 93 - Elementos catiónicos: su absorción es variable y su control homeostático se realiza a través del hígado (vía de eliminación biliar) y del tracto gastrointestinal (vía de excreción fecal). Algunos de ellos son Zn, Mn y Cu. Elementos aniónicos: se absorben eficazmente en el intestino y la eliminación se realiza fundamentalmente a través de la vía renal, como por ejemplo el I y el Se. Elementos que forman parte de complejos orgánicos: como el hierro en el grupo hemo. 2. No esenciales: No tóxicos a las concentraciones que se encuentran habitualmente en el medio ambiente. Tóxicos: producen una alteración indeseable en el organismo, que puede ser reversible o irreversible e incluso puede llegar a ser letal. El ejemplo más conocido es el plomo, que es tóxico a cualquier concentración que se encuentre en el organismo y no tiene ninguna función biológica conocida. . A continuación se exponen ciertos elementos traza (Zn y Cu), y algunos elementos ultratraza (Se, As, Cd, Hg, Pb y Al). Nos referimos a estos elementos porque su estudio en el laboratorio de análisis clínicos se realiza mediante el uso de técnicas de absorción o emisión atómica. Se ha decidido no tratar el Fe debido a que sólo los trastornos que produce su carencia merecerían un capítulo aparte. En la actualidad la concentración de Fe en suero no es determinada por medio de espectrometría de absorción atómica. - 94 - 2. ELEMENTOS TRAZA ESENCIALES. 2.1. Zinc. Es el segundo elemento traza más abundante en el organismo después del hierro. Se encuentra presente en gran número de alimentos, fundamentalmente unido a proteínas, siendo las carnes rojas, pescado y las leguminosas buenas fuentes de este elemento. Las ostras son especialmente ricas en zinc. El zinc es un mineral extraordinariamente versátil que forma parte de 300 metaloenzimas, entre las que se incluyen en el ser humano: anhidrasa carbónica (EC 4.2.1.1), fosfatasa alcalina (EC 3.1.3.1), RNA y DNA polimerasas (EC 2.7.7.6 y EC 2.7.7.49), timidina quinasa (EC 2.7.1.21), carboxipeptidasa (EC 3.4.17.1) y alcohol deshidrogenasa (EC 1.1.1.1). Es fundamental para el funcionamiento del sistema inmune, para el crecimiento y el desarrollo. También resulta esencial para mantener el sentido del gusto, y por tanto el apetito, para facilitar la cicatrización de las heridas y para el normal desarrollo del feto. La ingesta diaria recomendada (IDR) para la población española es de 15 mg, y en la 2ª mitad de la gestación y la lactancia aumenta a 20 mg. Los signos y síntomas del déficit incluyen: retraso en el crecimiento, aumento de las infecciones, diarrea, alteraciones cognitivas, alteración en el metabolismo de los carbohidratos, teratógenesis, lesiones en la piel, alopecia, alteraciones en la visión y otros efectos clínicos adversos. - 95 - La deficiencia de zinc aparece en personas con dietas pobres en proteínas de origen animal y ricas en fibras y fitatos (vegetarianos), con procesos de malabsorción, con nutrición parenteral, alcohólicos, quemados o sometidos a cirugía. La acrodermatitis enteropática es una enfermedad autosómica recesiva que afecta a la absorción de zinc y se caracteriza por dermatitis alrededor de los orificios naturales, alopecia y diarrea. Los niveles de zinc en sangre son menores de 30 µg dL-1, y la sintomatología revierte al recibir los pacientes suplementación dietética de zinc. Los efectos clínicos de la ingestión excesiva de zinc son dolor abdominal, diarrea, nauseas y vómitos. Se ha establecido un nivel máximo tolerable de 40 mg al día en adultos [4,5,6]. 2.2. Cobre. Es el tercer elemento de transición más abundante en el cuerpo humano. Los alimentos ricos en cobre son las carnes rojas, vísceras, crustáceos, semillas, leguminosas, salvado, chocolate y huevos. El cobre está asociado a numerosas metaloproteínas que desempeñan funciones como la producción de energía en el citocromo C oxidasa (EC 1.9.3.1), formación del tejido conectivo (lisil-oxidasa, EC 1,14,11.4), metabolismo del hierro (ferroxidasas, EC 1.16.3.1)), síntesis de melanina (tirosinasa, EC 1.14.18.1)), formación de neurotransmisores (monoamina oxidasa, EC 1.4.3.4)), antioxidante o regulación en la expresión de genes. La cantidad diaria aconsejada en adultos es 1.5 - 3.0 mg. - 96 - La deficiencia de cobre puede dar lugar a niños malnutridos, bebés prematuros, enfermedad cardiovascular, síndromes de malabsorción, anemia microcítica, neutropenia, anomalías de la pigmentación, debilidad muscular, etc. Las enfermedades genéticas que afectan al metabolismo del cobre son de gran importancia: • Enfermedad de Menkes. Se debe a una alteración en la absorción del cobre por mutación en el gen de su transportador a nivel intestinal dando lugar a cupremias menores a 70 µg dL-1. Los pacientes van a presentar el pelo ensortijado, hipopigmentación, fragilidad vascular y alteraciones neurológicas. • Enfermedad de Wilson. Se debe a un trastorno en la eliminación del cobre, con acumulación de éste en hígado, cerebro, riñón, córnea y otros tejidos. En sangre las concentraciones de cobre y ceruloplasmina están disminuidas, y la cupruria está aumentada. Los pacientes presentan hipopigmentación, necrosis hepatocelular y depósitos de cobre en el iris (anillo de Kayser-Fleischer) [4,5,6]. 2.3. Selenio. El selenio se encuentra en las carnes, pescados y mariscos, leche, cereales, nueces, frutas y verduras. Es uno de los antioxidantes del organismo al formar parte de la enzima glutatión peroxidasa (EC 1.11.1.9), que previene la formación de radicales libres. Su función está relacionada con otros antioxidantes (vitaminas A, C, E). - 97 - Además, interviene en el metabolismo tiroideo al formar parte de las iodotironina desiodinasas (EC 3.8.1.4), en el mantenimiento del estado redox intracelular (tioredoxina reductasa) y en la formación de selenoproteínas. La ingesta diaria recomendada es entre 55 y 70 µg. Las deficiencias severas de selenio han sido bien estudiadas: • Enfermedad de Keshan. Caracterizada por una cardiomiopatía dilatada que se observó en un área de China cuyos suelos tenían escaso selenio. • Enfermedad de Kashin-Beck. Es una orteoartropatía asociada también a niveles bajos de selenio en el suelo. La deficiencia de selenio ocasiona alteraciones en la función tiroidea, función inmune, reproducción, aumento de riesgo de enfermedad cardiovascular, mayor incidencia de cáncer, etc. La intoxicación por selenio recibe el nombre de selenosis y se manifiesta con trastornos gastrointestinales, pérdida de pelo, uñas blanquecinas, alteraciones neurológicas, aliento con olor a ajo, y en casos extremos, la muerte. La dosis máxima tolerable es 400 µg/día [4,5,6]. 3. ELEMENTOS TRAZA TÓXICOS. 3.1. Aluminio. Las fuentes de aluminio son los alimentos debido al uso de espesantes, floculantes, aditivos y envases con aluminio, el agua de consumo y para diálisis, y los fármacos antiácidos que contienen este elemento. - 98 - El aluminio incorporado al organismo se acumula principalmente en el hígado, cerebro, tejido óseo y glándula paratiroides, originando osteodistrofia, inhibición de la PTH, interferencia con el metabolismo del hierro y degeneración neurofibrilar. La medición de concentraciones de aluminio en sangre es importante en pacientes sometidos a diálisis debido a que son tratados con sales de aluminio para controlar la absorción del fósforo y a que el agua de diálisis contiene aluminio. La FAO recomienda concentraciones de aluminio inferiores a 15 µg/L en agua para diálisis [5,7]. 3.2. Arsénico. Las fuentes de exposición al arsénico son laborales (plaguicidas), criminal (anhídrido arsenioso) y medicinales (trióxido de arsénico para tratar la leucemia aguda promielocítica y melarsoprol para tratar la fase meningoencefalítica de la tripanosomiasis). El arsénico se absorbe por diferentes vías, siendo las más importantes desde un punto de vista toxicológico la digestiva (criminal) y la respiratoria (accidental). Al ponerse en contacto por vía oral con el organismo humano desacopla la fosforilación oxidativa mitocondrial; de ahí su toxicidad. La intoxicación aguda produce dolor abdominal con vómitos, “diarrea de grano de arroz”, dificultad en la deglución, sed intensa, trastornos cardiovasculares y neurológicos, coma y muerte [5]. - 99 - 3.3. Cadmio. El cadmio se encuentra en plásticos (PVC), tabaco, pigmentos y en baterías electrónicas. El envenenamiento agudo por cadmio puede ocurrir por ingestión o por inhalación. La inhalación suele ser la vía de intoxicación más importante. La principal manifestación de su toxicidad es renal y nerviosa, aunque puede producir trastornos gastrointestinales, hipertensión y cáncer de pulmón. La enfermedad de Itai-Itai es una manifestación de la intoxicación crónica por cadmio caracterizada por osteomalacia dolorosa, con múltiples fracturas e insuficiencia renal [5]. 3.4. Mercurio. Las fuentes de exposición al mercurio son la laboral (minería del mercurio, industria clorocaústica, fábricas de termómetros y de pilas alcalinas), a través de empastes de amalgama y a través de la dieta por alimentos contaminados. En la mayor parte de los productos alimenticios el mercurio se encuentra en su forma inorgánica, excepto en el pescado y sus productos, que son la principal fuente de metilmercurio en la dieta, siendo en esta forma mucho más liposoluble y más tóxico. La vía de entrada es pulmonar (inhalación) y a través de la piel para compuestos inorgánicos, siendo la vía oral la más importante para los compuestos orgánicos. El mercurio absorbido se acumula principalmente en cerebro, hígado y riñón. La intoxicación aguda se manifiesta con gastritis con vómitos y diarrea, estomatitis y necrosis tubular con anuria. - 100 - La intoxicación crónica se denomina hidrargirismo y se caracteriza por estomatitis, gingivitis, encefalopatía mercurial y proteinuria. La enfermedad de Minamata es un síndrome neurológico grave debido a la ingestión crónica de pescado y marisco contaminado con mercurio [5,8]. 3.5. Plomo. Se encuentra en pinturas con plomo, en aguas que pasan por tuberías con plomo, recipientes y utensilios de cocina con esmaltes plomados, latas con soldaduras con plomo, tabaco y gasolinas, especialmente en las décadas pasadas. El plomo tiene también múltiples aplicaciones en la industria siendo una fuente de exposición laboral importante. Las vías de penetración de plomo son respiratoria (vapores, humos y partículas del polvo), oral y cutánea. El plomo afecta al menos a tres sistemas importantes del organismo: los sistemas nerviosos central y periférico, la vía de síntesis del grupo hemo y el sistema renal, pero puede tener efectos sobre la reproducción y el desarrollo, sobre el sistema cardiovascular, la tensión arterial y el metabolismo de la vitamina D. El plomo se incorpora a los hematíes e inhibe la síntesis del grupo hemo, bloqueando a la ALA deshidratasa y a la ferroquelatasa, inhibe la síntesis de globinas produciendo una anemía normocítica, normocrómica y hematíes con punteado basófilo, y un aumento del ácido delta-aminolevulínico y la coproporfirina urinarios y de la protoporfirina zinc eritrocitaria [5]. - 101 - El Real Decreto 374/2001 de 6 de abril sobre la protección de la salud y seguridad de los trabajadores contra los riesgos relacionados con los agentes químicos durante el trabajo establece como valor límite biológico 70 µg Pb/100 mL de sangre. Sin embargo, el CDC establece en Agosto de 2005 que existe evidencia de que concentraciones de plomo en sangre inferiores a 10 µg dL-1 presentan efectos adversos en niños y que no existe un umbral de plomo seguro, aunque mantienen los 10 µg dL-1 como nivel de actuación [10]. Por otra parte, en los últimos años numerosos estudios muestran también efectos adversos en adultos con concentraciones cada vez más bajas [5,8,9,11]. 4. ASPECTOS PREANALÍTICOS. OBTENCIÓN DE ESPECÍMENES. El principal problema en la medición de elementos traza es la contaminación. Los elementos analizados son metales, que en el organismo están presentes en concentraciones bajas; por ello se requiere un especial cuidado en la obtención y manipulación de la muestra [12]. Para la medición de los elementos traza es esencial: • Selección de una muestra adecuada: variable según el metal a estudiar, y que refleje los depósitos corporales de dicho elemento. De forma habitual se utiliza la sangre. • Recogida y proceso sin contaminación: - Es importante la hora de extracción puesto que hay elementos que presentan ritmo circadiano (Zn, Cu, Fe). Se recomienda la extracción de sangre entre las 8 y las 10 horas. - 102 - - No se deben utilizar desinfectantes con iodo; se recomienda el uso de jeringas de polipropileno y agujas de titanio, níquel o acero inoxidable. - Deben evitarse los activadores de la coagulación, los geles separadores y los anticoagulantes. Si se necesitan, como en el caso del plomo, los más adecuados son EDTA y heparina. - Los tubos utilizados son tubos de vacío específicos para elementos traza, y se deben extraer los últimos. - La hemólisis ha de evitarse en aquellos elementos en los que la concentración intraeritrocitaria es al menos diez veces superior a la sérica (por ejemplo: Fe, Zn, Mn). Una vez obtenidas las muestras de sangre es necesario proceder a su centrifugación en tubo cerrado con el fin de evitar contaminaciones procedentes del material de la centrífuga. Tras la centrifugación se debe decantar el sobrenadante para reducir el tiempo de contacto con el tubo de extracción y evitar que se libere el contenido de los hematíes. Una vez decantada la muestra, ésta puede conservarse durante cinco días a 4 ºC, o bien un mes a -20 ºC. Para evitar la contaminación de la muestra se utiliza material lavado con HNO3 al 10% durante una noche y aclarado posteriormente con agua destilada y desionizada. En el análisis de elementos traza se utilizan patrones y reactivos ultrapuros [5,13,14]. • Análisis exacto y preciso: puesto que las concentraciones de estos elementos en los medios biológicos son muy bajas es importante la elección de una técnica analítica adecuada para su estudio. - 103 - 5. ASPECTOS METODOLÓGICOS EN EL ANÁLISIS DE ELEMENTOS TRAZA. Los métodos analíticos usados en la medición de elementos traza y ultratraza en muestras biológicas deben presentar las siguientes características: sensibilidad, especificidad, precisión, exactitud y ser relativamente rápidos. Los límites de detección son muy importantes porque la concentración de los elementos traza y los ultratraza es del orden de µg g-1 ó ng g-1, respectivamente. En la actualidad las técnicas más empleadas son la espectrometría de absorción atómica con atomización de llama (FAAS), la espectrometría de absorción atómica con atomización electrotérmica o de horno de grafito (ETAAS), los de emisión atómica con fuentes de plasma de acoplamiento inducido (ICP-OES), y la espectrometría de masas con plasma de acoplamiento inducido (ICP-MS). 5.1 Espectrometría de absorción atómica. La espectrometría de absorción atómica se basa en la medida de la radiación absorbida por los átomos libres cuando se encuentran en su estado fundamental de menor energía. En ese estado cada átomo es capaz de captar un fotón de energía radiante de una determinada longitud de onda pasando un electrón de su orbital más externo a un nivel de mayor energía [15]. La emisión de la radiación se produce cuando las partículas excitadas vuelven a su estado fundamental, desprendiendo la - 104 - energía que previamente absorbieron. En la figura 2 se muestra el proceso de absorción y emisión atómica. Figura 2. Absorción y emisión atómica. De acuerdo con la ley de Lambert-Beer la magnitud de la radiación absorbida es proporcional a la concentración de este elemento en la muestra; A=ε.b.C (expresión de la ley de Lambert-Beer), donde ε es una constante característica, entre otros factores, de la naturaleza de la especie absorbente a una determinada longitud de onda, b es el paso óptico, y C es la concentración de la especie absorbente. Un espectrofotómetro de absorción atómica dispone de una fuente de emisión que incluya la longitud de onda de absorción, un atomizador donde se obtiene una nube de átomos, un monocromador que separa la línea de absorción y un detector. - 105 - En la figura 3 se muestra el esquema de un espectrómetro de absorción atómica [15]. Figura 3. Esquema componentes de un espectrofotómetro. Antes de alcanzar la llama, la radiación de la lámpara se convierte en una señal pulsada o alternante. Para esto puede utilizarse un chopper (un disco) que gira, o la propia fuente puede ser pulsada electrónicamente. Fuente de emisión. Las fuentes de emisión más utilizadas son las lámparas de cátodo hueco y las lámparas de descarga sin electrodos [13,15]. Lámpara de cátodo hueco: consiste en un ánodo de wolframio y un cátodo cilíndrico, cerrados herméticamente en un tubo de vidrio con una ventana delantera de cuarzo y lleno de un gas inerte (generalmente argón ó neón). Los átomos de argón son ionizados eléctricamente, y a continuación son atraídos hacia el cátodo, el cuál está construido con el metal cuyo espectro se desea obtener. Al chocar contra el cátodo arrancan los átomos del elemento a estudiar, y cuando éstos vuelven a su estado fundamental emiten radiación correspondiente a la longitud de onda a la que es - 106 - capaz de absorber ese elemento. El principal inconveniente es que se necesita una lámpara diferente para el análisis de cada elemento. Figura 4. Lámpara de cátodo hueco Lámpara de descarga sin electrodos: en este caso el gas argón de relleno de la lámpara es ionizado por medio de un campo de radiofrecuencias. A continuación el gas es acelerado y éste excita los átomos del metal a estudiar. La intensidad de la radiación obtenida es uno o dos órdenes de magnitud por encima de las lámparas de cátodo hueco. Estas lámparas se emplean principalmente en el estudio de elementos muy volátiles como Cd y Se. Para que los átomos puedan absorber han de estar en estado fundamental y libres de uniones con otros átomos. Esto se consigue suministrando a los átomos la energía suficiente, en el proceso denominado atomización. Sistemas de atomización. Según el tipo de atomización se distinguen cuatro tipos de técnicas de absorción atómica [13,15,16,17]. - 107 - Atomización con llama. El atomizador de llama consta de una llama fría cuya misión es llevar la muestra a su estado atómico, sin producir en la medida de lo posible átomos excitados. La muestra en solución es aspirada en el nebulizador, donde se forma un aerosol al que se le mezcla el oxidante y el combustible para ser transportados al quemador. La evaporación del disolvente de la muestra depende de la temperatura de la llama y del diámetro de las gotas. Puesto que la energía térmica de la llama es la responsable de la producción de las especies absorbentes, la temperatura de la llama es un parámetro importante. Las llamas más frías están sujetas a un mayor número de interferencias, puesto que en ocasiones la atomización es incompleta. Las dos mezclas más utilizadas de combustible-oxidante son acetileno-aire y acetileno-óxido nitroso. Mientras que la llama de acetileno-aire (que produce una llama con temperatura de 2200-2400 ºC) proporciona resultados satisfactorios para la mayor parte de los elementos (Fe, Cu, Zn), la llama de acetileno-óxido nitroso, más energética (2700 ºC), se utiliza en elementos que forman compuestos refractarios. En términos de reproducibilidad, la atomización con llama resulta ser superior a todos los demás métodos que se han desarrollado hasta ahora para la introducción de muestras. Sin embargo, en términos de eficacia en la introducción de las muestras (y por ello de sensibilidad), otros métodos de atomización son claramente mejores. Esto es debido a que una gran proporción de la muestra se pierde por el drenaje y a que el tiempo de residencia de los átomos individuales en el camino - 108 - óptico de la llama es breve. En la figura 5 se muestra el esquema de un atomizador de llama. Figura 5. Esquema de un atomizador de llama. Atomización Electrotérmica Los atomizadores electrotérmicos proporcionan en general una mayor sensibilidad (hasta menos de 1µg L-1) debido a que toda la muestra se atomiza en un periodo de tiempo muy breve y el tiempo promedio de residencia de los átomos en el camino óptico es de un segundo o más. Por otra parte, con esta técnica de atomización sólo se requieren unos µL de muestra. Sus principales inconvenientes son una menor precisión y la lentitud del análisis, que es monoelemental. La muestra es introducida en el horno, tubo o cámara de grafito. En la figura 6 se muestra la imagen de la cámara de grafito. Figura 6. Horno de grafito. - 109 - En el interior de la cámara de grafito se encuentra una plataforma sobre la cual se deposita la muestra. El calentamiento se produce por radiación. De esta manera el calentamiento es más rápido y homogéneo y se reducen las interferencias. Una vez introducida la muestra en el horno o cámara de grafito se somete a un programa gradual de calentamiento que comprende las siguientes etapas: Primero la muestra es secada, a continuación se carboniza la materia orgánica (mineralización o pirólisis), y por último se liberan los átomos del elemento para que estén en estado fundamental y puedan absorber la radiación proveniente de la fuente de emisión (atomización). Cada uno de estos pasos puede ser múltiple, con la excepción de la atomización, y pueden modificarse el tiempo que se tarda en alcanzar cada temperatura, el tiempo que se permanece a cada temperatura y la velocidad del gas argón en el interior del sistema que se emplea para arrastrar los gases que se producen durante los procesos de secado y mineralización. En el momento de la atomización el flujo del gas argón es interrumpido para concentrar la nube atómica. En la figura 7 se puede ver un ejemplo de programa de temperaturas. Figura 7. Ejemplo de programa de temperaturas para el Selenio. - 110 - La señal de absorbancia se mide en área de pico. Habitualmente las muestras se diluyen antes de su análisis con un modificador de matriz. Esta sustancia es empleada para homogeneizar la especie química en la que se encuentra el analito, aumentar la estabilidad térmica de éste y eliminar compuestos refractarios. Como modificadores de matriz se suelen utilizar el Ni, Pd, Mg, Ir y los fosfatos, así como mezclas de los mismos [13, 15]. Generación de hidruros Las técnicas de generación de hidruros proporcionan un método para la introducción de As, Sn, Se, Bi, y Pb como gases en un atomizador. Estos procedimientos aumentan la sensibilidad en un factor de 10 a 100. La generación de hidruros se produce por adición de una solución acuosa de la muestra en medio ácido a un pequeño volumen de una disolución acuosa de borohidruro sódico. El hidruro que se forma es arrastrado a la cámara de atomización mediante un gas inerte. La cámara es, generalmente, un tubo de sílice. Se calienta ligeramente para descomponer estos hidruros y se liberan los átomos en estado fundamental. Es una técnica muy sensible, pero más compleja. Además, ciertas matrices interfieren en la formación del hidruro. Técnica de vapor frío Se usa sólo para medir mercurio, ya que es el único elemento cuyos átomos se encuentran libres a temperatura ambiente, y no hay que calentar. - 111 - Interferencias del análisis por espectrometría de absorción atómica El análisis elemental por espectrometría de absorción atómica está sujeto a distintos tipos de interferencias: Interferencias espectrales: se originan por la presencia de líneas de absorbancia distintas a la del elemento a analizar. Pueden ser de dos tipos: - Aquellas que se producen cuando la absorción de una especie que interfiere se sobrepone o aparece muy cerca del analito. Se soluciona utilizando una línea de absorción del elemento de interés que esté lo suficientemente alejada de las que pueden interferir. - Presencia de un fondo de absorción debido a productos de combustión (de la matriz) que disminuyen la radiación transmitida y por tanto aumentan falsamente la concentración del analito. Este tipo de interferencias se pueden corregir mediante un corrector de fondo continuo, por ejemplo con lámpara de deuterio o bien mediante corrector por efecto Zeeman. Interferencias químicas: que pueden deberse a: - Formación de compuestos no volátiles (refractarios) que hacen que no todos los átomos del elemento se encuentren en estado fundamental, lo que disminuye la concentración del mismo. Estas interferencias pueden evitarse con el uso de modificadores de matriz. - Ionización de los elementos por un exceso de energía. Puede evitarse disminuyendo la temperatura de atomización. - 112 - La espectroscopia de absorción atómica con atomización electrotérmica (ETAAS) se ha convertido en la técnica más utilizada para la determinación de metales ultratraza en muestras biológicas [13, 15,16 ,17]. 5.2 ESPECTROMETRÍA DE EMISIÓN ATÓMICA CON PLASMA DE ACOPLAMIENTO INDUCIDO (ICP-OES) Un plasma es un gas fuertemente ionizado, eléctricamente neutro pero conductor de la corriente, formado por un conjunto de electrones, iones cargados positivamente y átomos o moléculas. El plasma se genera al someter un flujo de gas argón a la acción de un campo magnético oscilante inducido por una corriente de alta frecuencia. En el interior del plasma se pueden alcanzar temperaturas de 6000-10000 ºC; en estas condiciones, los átomos presentes en la muestra son ionizados. La muestra en forma líquida se transporta por medio de una bomba peristáltica hasta el sistema nebulizador, donde se transforma en aerosol gracias a la acción del gas argón. Dicho aerosol se transporta al plasma donde es desolvatado, vaporizado, atomizado y excitado/ionizado por él. En la figura 8 se muestran el transporte de la muestra a través del plasma, así como las distintas fases por las que pasa dicha muestra. - 113 - Iones Átomos Ionización Atomización Gas Sólido Vaporización Líquido Secado Figura 8. Esquema de las etapas que pasa la muestra durante su introducción en el ICP. El ICP-OES se basa en la medida de la luz emitida por los iones y átomos excitados de una muestra introducida en una fuente de ICP. La elevada temperatura del plasma, su estabilidad y su entorno químico inerte eliminan gran parte de las interferencias que se presentan en llamas de combustión. Está técnica analítica de emisión permite llevar a cabo un análisis multielemental y posee una sensibilidad intermedia entre la FAAS y ETAAS [13, 15]. 5.3 ESPECTROMETRÍA DE MASAS CON PLASMA DE ACOPLAMIENTO INDUCIDO (ICP-MS) La espectrometría de masas con plasma de acoplamiento inducido es una técnica de reciente incorporación al laboratorio clínico. Mediante esta técnica es posible determinar de forma cuantitativa la mayoría de los elementos de la tabla periódica a niveles de traza y ultratraza, partiendo de muestras en disolución acuosa. - 114 - El ICP-MS utiliza la misma fuente de radiación que el ICP-OES, es decir un plasma de acoplamiento inducido, cuyo funcionamiento ha sido descrito en el apartado anterior, y como detector utiliza un espectrómetro de masas. Los iones generados en el plasma pasan a través de un filtro cuadrupolar, que separa los iones generados en el plasma según su relación masa/carga (m/z). Cada una de las masas separadas llega al detector donde se cuantifica el elemento de la muestra [13, 15,18]. En la figura 9 se muestra el esquema del ICP-MS. Figura 9. Esquema de ICP-MS. Cuando la detección se lleva a cabo en ICP-MS se recurre al uso del patrón interno como forma de controlar la estabilidad de la señal obtenida y para corregir interferencias no espectrales. Con este fin se eligen elementos que no estén presentes en la muestra, como indio, rodio itrio y escandio, que se añaden tanto al blanco como a los estándares y a la muestra. Existen dos tipos de interferencias en un ICP-MS: - 115 - ♦ Interferencias espectroscópicas: que surgen cuando una especie iónica tiene una relación m/z igual a la del analito. Se pueden evitar con una adecuada selección del isótopo a analizar. ♦ Interferencias no espectroscópicas debidas a la matriz, que suele provocar una disminución de la señal al repelerse iones en el haz procedente del plasma. Pueden corregirse diluyendo la muestra, separando previamente los compuestos interferentes, introduciendo la muestra de forma diferente o bien empleando un patrón interno [16]. Debido al elevado grado de ionización de los metales en el plasma y a las pocas interferencias obtenidas, el ICP-MS presenta mejores límites de detección que las técnicas anteriormente citadas. Los espectros que proporciona son sencillos y fácilmente interpretables, permite el análisis multielemental, y es una técnica sensible y precisa. El ICP-MS es una técnica recomendable si hablamos en términos de sensibilidad y mínimo pretratamiento de la muestra. Se logran límites de detección menores de 1 µg L-1. 5.4. CONCLUSIONES Las distintas técnicas de análisis empleadas en el estudio de elementos traza presentan ventajas e inconvenientes. Los métodos de absorción atómica son los que se encuentran más difundidos, ya que poseen una sensibilidad suficiente para la mayoría de las aplicaciones clínicas y los equipos son menos caros y de fácil manejo. - 116 - FAAS es la técnica más reproducible y rápida, pero su sensibilidad es menor, pues sólo una pequeña fracción de la muestra alcanza la llama; se utiliza principalmente para la medición de Cu y Zn. ETAAS es una técnica muy sensible, con LOD de µg L-1 ( de 100 a 1000 veces más sensible), pero lenta y con numerosas interferencias. Se usa para la medición de Se, Pb, Cd y Al entre otros elementos. En cuanto a las técnicas de emisión atómica: ICP-AES es una técnica multielemental, más rápida que la anterior, pero su sensibilidad es intermedia entre FAAS y ETAAS. ICP-MS es una técnica multielemental, muy sensible (LOD del orden de ng L-1). El inconveniente principal es su elevado coste y que también presenta ciertas interferencias. - 117 - BIBLIOGRAFÍA 1. IUPAC. Nomenclature, symbols, units and their usage in spectrochemical analysisIII. Analytical flame spectroscopy and associated non-flame procedures. Rules approved 1975. Pure & Applied Chemistry, 1976; 45: 105-120. 2. Underwood E.J. Trace Elements in Human and Animal Nutrition. 5th Edition. Nueva York: Academia Press; 1987. 3. Baran, E.J. Química Bioinorgánica. Ed. McGraw-Hill. 1995. 3-11. 4. Burtis C. Tietz Textbook of clinical chemistry and molecular diagnostics. Editorial Saunders. 2005. 5. Cocho J.A., Escanero J.F., González Buitrago J.M. Elementos traza: aspectos bioquímicos, analíticos y clínicos. SEQC, 1998. 6. Requejo A.M., Ortega, R. M. Nutriguía: manual de nutrición clínica en atención primaria. Madrid. Editorial Complutense, 2000. 7. Fernández González M.D., César Márquez M.A. Procedimiento recomendado para la determinación del aluminio en muestras biológicas y otros especímenes de interés clínico. Química Clínica 2005; 24 (1) 46-54. 8. González Estecha M.M., Elementos traza en Biopatología y Neuropsicología. Madrid Editorial MAPFRE, 1996. 9. Real Decreto 374/2001, de 6 de abril (BOE nº 104 de 1 de mayo de 2001), sobre la protección de la salud y seguridad de los trabajadores contra los riesgos relacionados con los agentes químicos durante el trabajo. - 118 - 10. CDC 2005. Third National Report on Human Exposure to Environmental Chemical. NCEH Pub. Nº 05-05-07, Lead CAS Nº 7439-92-1 Atlanta. 11. Menke A., Muntner P., Batnman V., Siberfeld EK., Guallar E. Blood lead below 0.48 µmol/L (10 µg/dL) and mortality among US adults. Circulation 2006; 114: 13881394. 12. NCCLS. Control of pre-analytical variation in trace element determinations: proposed guideline. NCCLS document C38A. Vol. 17, Nº 13 NCCLS. Vilanova. Pennsylvania, 1997. 13. González-Estecha M.M, González-Revaldería J., López J.L., Análisis de Elementos Traza: espectrometría de absorción atómica. Madrid. Editorial MAPFRE; 2004. 14. Cocho J., González-Revaldería J., Recomendaciones para el aseguramiento de la calidad en la medición de elementos traza en muestras biológicas por espectrometría de absorción atómica electrotérmica. Química Clínica, 25(1), 30-35, 2006. 15. González-Revaldería J., Miravalles-González E. Elementos Traza y Ultratraza: Métodos Analíticos. Madrid: Editorial MAPFRE; 2004, 109-122. 16. Skoog DA., Leary JJ., Espectroscopia de emisión basada en la atomización con llama y electrotérmica. En Análisis Instrumental, 4ª edición. Ed. McGraw-Hill/ Interamericana de España, 1993. 227-271. 17. Schlemmer G., Radziuk B. Analytical graphite furnace atomic absorption spectrometry. A laboratory guide. Ed. Birkauser Verlag. 1999. 18. Skoog D.A., Leary J.J., Espectrometría de masas. En Análisis Instrumental, 4ª edición. Ed. McGraw-Hill/ Interamericana de España, 1993. 491-537. - 119 - CON LA COLABORACIÓN DE: