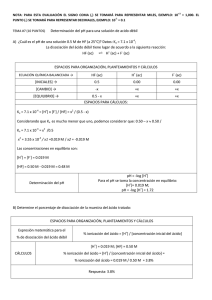
3.- A 25ºC el grado de ionización ce una disolución acuosa de ácido
Anuncio
Anuncio