ESPECTROFOTOMETRÍA.
Anuncio

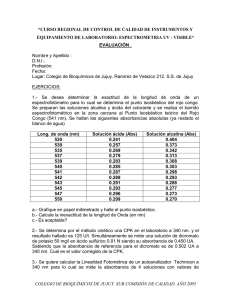
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en soluciones. II. OBJETIVOS PARTICULARES a. Conocer los fundamentos de la espectrofotometría y las variables involucradas en la ley de Lambert-Beer-Bourger. b. Seleccionar la longitud de onda apropiada para DETERMINACIÓN de absorbancia. c. Construir una curva patrón de la solución de YODO-YODURADO (serie tipo) a diferentes concentraciones . III. PROBLEMA A partir del espectro de absorción de una solución acuosa de yodo-yoduro de potasio seleccionar la longitud de onda apropiada para determinar el coeficiente de absortividad molar de soluciones acuosas de yodo por medio de una curva patrón. I2 + 0.002 I0.2 → I32X10-3 Introducción “Espectro” “Foto” “Metría” Espectro de radiación electromagnética Luz visible Medición ESPECTRO ELECTROMAGNÉTICO Tipos de Espectrofotometría La espectrofotometría de Absorción de infrarrojos ABSORCIÓN DE UV-VISIBLE Resonancia magnética nuclear (RMN) Fluorescencia Emisión atómica Absorción atómica de masas Fluorescencia de Rayos X Espectroscopia UV y Visible Estudia el fenómeno de adsorción de la radiación UV-Visible de moléculas orgánicas e inorgánicas. La región UV del espectro electromagnético se encuentra entre 0.6 y 380 nm. UV lejano 0.6 – 190 nm UV cercano 190 – 380 nm Visible 380 – 780 nm UV “cercano o de cuarzo”. Región en la que el aire y el cuarzo son transparentes) UV “lejano o de vacío” . intervalo 0.6 a 190 nm. El UV lejano requiere técnicas especiales, ya que el aire que se encuentra en el trayecto óptico absorbe intensamente en esta región, no es útil desde un punto de vista práctico. La región visible, a la que es sensible el ojo humano, se localiza entre los 380 y 780 nm. La absorción de la radiación UV o Visible por moléculas , generalmente se produce por la excitación de los electrones de enlace. La longitud de onda de los máximos de absorción se puede relacionar con los enlaces de las especies absorbentes. Espectrofotometría Es el método de análisis óptico más usado en el área de investigación. Es la medida de la cantidad de energía radiante absorbida por las moléculas de una muestra en función de las longitudes de onda específicas. Los métodos espectroscópicos se basan en la capacidad de las sustancias de ABSORBER o EMITIR radiación electromagnética, y tales métodos se pueden emplear para determinar la concentración de un reactivo o producto durante una reacción. Pantalla de lecturas Compartimento de celda Encendido y ajuste Del cero de T Selector de medida λ Ajuste de cero de Absorbancia El aparato detecta la cantidad de “luz” transmitida y/o absorbida a través de la solución en la celda y la compara con la que se transmite o absorbe a través de una solución de referencia o “blanco”. ¿Qué establece la ley de Lambert-Beer-Bourger? “A diferencia de la transmitancia, P la absorbancia de unaT =solución ≡ Transmitancia aumentaP a medida que aumenta P0 P la atenuación del haz de luz” 0 P Aλ = log P0 P Aλ = log = εbc P0 P0 A = − log T = log P P Aλ = log = εbc ⇒ A = εbc P0 ε.- Es la cte. de proporcionalidad llamada coeficiente de absorción molar, de absortividad o coeficiente de extinción. b.- Es el paso óptico, anchura de la celda que contiene la muestra (cm). c.- Es la concentración de la especie de la cual se esta midiendo la absorbancia (M). La ecuación mencionada es el fundamento de la espectrofotometría, y se cumple para una radiación monocromática que atraviesa una disolución diluida (≤ 0.01M), cuando la especie absorbente no participa en un equilibrio que dependa de su concentración. 1 ERA PARTE CALIBRACIÓN DEL ESPECTROFOTÓMETRO Y BARRIDO DEL ESPECTRO DE ABSORCIÓN 1.- Encender el espectrofotómetro. 2.- Esperar 15 minutos. 3.- Calibración: oprimir la tecla MODE, hasta que la luz roja se encuentre en A (absorbancia). 4.- Seleccionar la longitud de onda girando la perilla. 5.- Introducir la celda con el blanco (con un volumen por arriba de la mitad; nunca llena) en la porta-celda, oprime la tecla Λ (0A/100%T) y esperar a que se ponga en ceros la absorbancia. 6.- Tomar la lectura de absorbancia de la solución propuesta a una longitud de onda baja (λ nm). utilizar como blanco agua destilada. 7.- Repetir el procedimiento desde el punto 4 dando incrementos regulares a la longitud de onda. Registrar los datos en la tabla 1 A5. ORGANIZACIÓN DE DATOS, Temperatura: Registrar los datos experimentales del espectro de absorción de yodo (2*10-4M) en la tabla 1. Tabla 1. Absorbancia de la solución de I2 a diferentes longitudes de onda. EVENTO λ(nm) 1 ABSORBANCIA EVENTO λ (nm) 380 9 460 2 390 10 470 3 400 11 480 4 410 12 5 420 13 490 500 6 430 14 7 440 8 450 ABSORBANCIA Espectro Yodo 0.0002M 1.8 1.6 1.4 Abs 1.2 1 0.8 0.6 0.4 0.2 0 300 320 340 360 380 400 420 440 460 l (nm) Seleccionar una λ de esta zona 480 500 520 2 DA PARTE Curva Patrón 1.- Preparar soluciones de distinta concentración a partir de la solución de referencia I2 –KI (0.0002M - 0.2M) (Serie tipo). 2.- Seleccionar una longitud de onda adecuada para hacer las lecturas de Absorbancia para las soluciones de la serie tipo. 3.- Introducir la celda con el blanco (agua destilada), con un volumen por arriba de la mitad; nunca llena, en la porta-celda, oprimir la tecla Λ (0A/100%T) y esperar a que se ponga en ceros la absorbancia. 4.- Tomar la lectura de absorbancia propuestas para la serie tipo, a la seleccionada (λ nm). de las soluciones longitud de onda 5.- Registrar las lecturas de absorbancia y concentración de la serie tipo en la tabla 2 TABLA 2. Absorbancia a diferentes concentraciones molares de I2 Mezcla I2 H2O (ml) I2 mol/L CIV1=C2V2 (0.002 M) (ml) 1 6 4 2 5 5 3 4 6 4 3 7 5 2 8 Abs TABLA 2. Absorbancia a diferentes concentraciones molares de I2 Mezcl I2 (0.002 M) H2O (ml) I2 mol/L Abs a (ml) 1 10 0 0.002 1.61 2 8 2 0.0016 1.290 3 6 4 0.0012 0.950 4 4 6 0.0008 0.625 5 2 8 0.00045 0.311 Curva Patrón de soln de yodo ( Abs/ nm) 1.8 1.6 1.4 Abs 1.2 1 y = mx + b 0.8 0.6 0.4 0.2 0 0 0.0005 0.001 0.0015 I2 (mol/L) A = εbc 0.002 0.0025