TITULACION CONDUCTIMETRICA DE ACIDO BORICO Introducción El ácido bórico (H
Anuncio

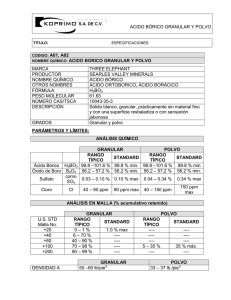
TITULACION CONDUCTIMETRICA DE ACIDO BORICO Introducción El ácido bórico (H3BO3) es un ácido extremadamente débil que en solución acuosa se comporta como un ácido monoprótico (pKa = 9,2). Es muy utilizado en la industria, fundamentalmente para la fabricación de fibra de vidrio. También es usado como ingrediente en abonos foliares, antisépticos e insecticidas. En este último caso, si bien su uso fue muy difundido en el pasado, actualmente ha sido desplazado por insecticidas orgánicos de origen sintético o natural. No obstante, en Argentina el ANMAT (Administración Nacional de Medicamentos, Alimentos y Tecnologías médicas) tiene en su listado de insecticidas habilitados varias formulaciones con concentraciones variables de ácido bórico. Habitualmente la determinación de ácido bórico se realiza por potenciometría ácido-base (en un medio polihidroxilado) o por absorción atómica (AA). En matrices muy sencillas, la determinación de ácido bórico podría realizarse a través de una titulación ácido-base conductimétrica. La conducción de la corriente eléctrica a través de la solución de un electrolito supone la migración de especies cargadas positivamente hacia el cátodo y cargadas negativamente hacia el ánodo. La conductancia, que es una medida de la corriente que resulta de la aplicación de una fuerza eléctrica dada, depende directamente del número de partículas cargadas existentes en la solución. Una forma de conocer la capacidad conductora de la disolución es poner dos electrodos en la solución y medir su resistencia, que depende de los siguientes factores: (i) el área de la superficie de los electrodos, (ii) la forma de los electrodos, (iii) la posición de los electrodos entre sí en la disolución, (iv) el tipo de especies en la disolución, (v) la concentración de las especies, y (vi) la temperatura. Todos los iones contribuyen al proceso de conducción, pero la fracción de corriente transportada por una especie dada está determinada por su concentración relativa y su movilidad intrínseca en el medio. La aplicación de mediciones de conductancia directas al análisis es limitada a causa de la naturaleza no selectiva de esta propiedad. Los principales usos de las mediciones directas se han reducido al análisis de mezclas binarias agua - electrolito y a la determinación de la concentración total del electrolito. Esta última medición es particularmente útil como un criterio de pureza para el agua destilada. En la actualidad tampoco es difundido el uso de la conductimetría para el análisis cuantitativo. Las titulaciones conductimétricas, en las que se usan mediciones de conductividad para detección del punto final, podría aplicarse a la determinación de numerosas sustancias. La principal ventaja del punto final conductimétrico es su aplicación a la titulación de soluciones muy diluidas y a sistemas en los que la reacción es relativamente incompleta. Así, por ejemplo, la titulación conductimétrica de soluciones acuosas de ácidos muy débiles (con constantes de equilibrio del orden 10-10) son factibles aunque el cambio de pH en el punto de equivalencia sea insuficiente para un punto final potenciométrico o un punto final establecido con un indicador visual. Aún así la determinación tiene sus limitaciones cuando la concentración total de electrolitos en la solución a titular es alta ya que pueden enmascarar los cambios de conductancia durante la titulación. Objetivos - Aplicar los fundamentos teóricos de las titulaciones conductimétricas. - Determinar la concentración de ácido bórico en un insecticida casero. Materiales - Conductímetro - Celda con electrodos de Pt - Agitador magnético - Barra magnética - Bureta de 25,00 mL - Pipeta aforada de 10,00 mL - Vasos de pp de 250 mL - Probetas - Embudo - NaOH 0.2500 M - Insecticida en polvo a base de ácido bórico (aprox. 50% P/P). Procedimiento Pesar aproximadamente 400,0 mg del insecticida, colocarlo en un vaso de precipitado y agregar agua para su disolución. Proceder a la titulación recordando que es necesario sumergir los electrodos cubriendo los discos negros (electrodos de negro de platino y sensor de temperatura) con agua destilada. Agitar la solución evitando proyecciones y comenzar a titular con el NaOH normalizado. Registrar los valores de conductividad ante cada agregado de titulante (se sugiere cada 1 mL). Graficar la conductividad en función de los mL de titulante y calcular la concentración de la muestra en % P/P (PMH3BO3 = 61,83).