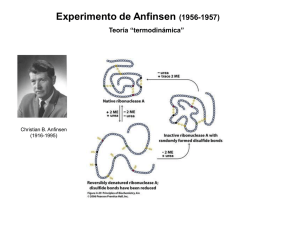
Estructura Terciaria y Cuaternaria
Anuncio

http://fc07.deviantart.net/fs71/f/2010/061/3/1/Spider_Web_by_Autar.png Estructura Terciaria y Cuaternaria Estructura Secundaria Arreglo espacial y local de los atomos de la cadena principal. Independiente a otros segmentos. Estructura Terciaria Arreglo tridimensional de todos los átomos . Incluye interacciones con otros segmentos a distancia. Estructura Cuaternaria Arreglo de subunidades (cadena polipéptida separada) en complejos 3D. Fibrosas Estructura Terciaria Arreglo tridimensional de todos los átomos . Incluye interacciones con otros segmentos a distancia. Globulares Proteinas Fibrosas Propiedades características le imparten fuerza y/o flexibilidad a las estructuras donde se encuentran. Unidad fundamental de estructura es un simple elemento repetitivo de estructura secundaria. Insolubles en agua: Altas concentraciones de residuos hidrofóbicos. α-Keratina Helices Derechas Supergiros Izquierdos Ricas en avlimf 18% Cys Filamentos Intermedios Otras proteinas de esta clasificación se encuentran en el cytoesqueléto de la célula. En α-keratina, estabilizados por S-S. Bioquímica en el “Beauty” Colágeno Helice Izquierda (3aa/vuelta) Supergiros Derechos de 3 α-cadenas 35%G, 11%A, 21%P y 4-Hyp G-X-Y, X=P, Y=4-Hyp Fibrillas de Colágeno Osteogenesis imperfecta y Síndrome Elhers-Danlos Variantes con substitución de un residuo a uno con R mas grande Cys o Ser por Gly (Gly-X-Y) Fibroína (Seda) Estrectura estabilizada por enlaces de H Las Estructuras de las Proteínas Globulares son Compactas Y Variadas HSA (64.5 KDa) 585 residuos Myoglobína Grupo Hemo H93 Myoglobína BOX 4-5 NMR Variedad y Variabilidad de Estructuras Terciarias Motif: Dos o más elementos de estructura secundaria y las conecciones entre ellos. También conocido como “Fold” y Estructura Supersecundaria Motif: Dos o más elementos de estructura secundaria y las conecciones entre ellos. También conocido como “Fold” y Estructura Supersecundaria Dominio: Parte de la cadena polipéptida que es independientemente estable o se puede mover sola como sola unidad independiente del resto de la proteína. Proto-oncogene tyrosine-protein kinase Src Dominio: Parte de la cadena polipéptida que es independientemente estable o se puede mover sola como sola unidad independiente del resto de la proteína. Estructura Cuaternaria Arreglo de subunidades (cadena polipéptida separada) en complejos 3D. Monómeros (protómeros) de un multímero Segmentos (o Proteinas) Intrinsicamente Desordenados Carecen de centro hidrofóbico Alta densida de aa con Carga (K, R, E & P) Tumor suppresor p53 http://origin-ars.els-cdn.com/content/image/1-s2.0-S0014579308001324-gr2.jpg Segmentos (o Proteinas) Intrinsicamente Desordenados Carecen de centro hidrofóbico Alta densida de aa con Carga (K, R, E & P) Tumor suppresor p53 http://cdn.sinobiological.com/Signaling-Pathway-Image/p53-Pathway.jpg Proteostasis http://www.nature.com/nrm/journal/v11/n11/images/nrm2993-f1.jpg Desnaturalización: Pérdida de Estructura Terciaria Cambio abrupto sugiere que es un proceso coperativo Desnaturalización: Pérdida de Estructura Terciaria Cambio abrupto sugiere que es un proceso coperativo Renaturalización Prueba que Estructura Terciaria es determinada por secuencia de aa Protein Folding La Paradoja de Levinthal 100 aa/10 conformaciones = 10100 ~10-13 segundos 1077 años!!! Termodinámica del “Protein Folding” The Free-Energy Funnel Menos Entropía=Mas Orden=Menos Energía Protein Folding Chaperones: GroEL/ES de E. coli Protein Folding Chaperones Protein Folding Chaperones: Heat-Shock Proteins (Hsp) en Eucariótas http://www.neurology.org/content/76/7/660/F1.large.jpg Protein Folding Chaperone: DnaK/J DnaJ – Hsp40 DnaK – Hsp70 Sitema de Degradación Proteosomal de Ubiquitina Reconocimiento y Conjugaciión Degradación y Recliclaje Proteostasis http://www.nature.com/nrm/journal/v14/n4/images/nrm3542-f1.jpg Enfermedades Asociadas a Problemas de Proteostasis http://www.nature.com/nrn/journal/v4/n1/images/nrn1007-f1.jpg Enfermedades Asociadas a Problemas de Proteostasis http://www.nyas.org/image.axd?id=9c42c767-8619-46b1-b665-bd0e698879c3&t=634931544523370000