Teórica Porifera
Anuncio
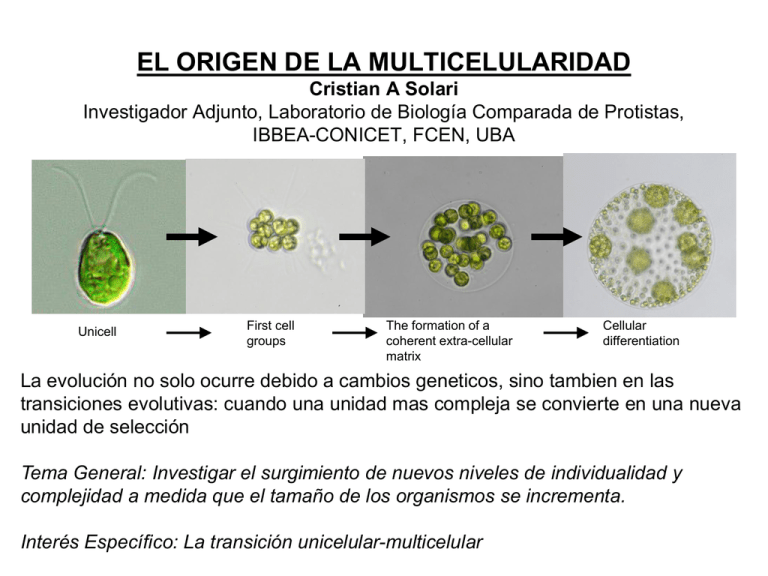
EL ORIGEN DE LA MULTICELULARIDAD Cristian A Solari Investigador Adjunto, Laboratorio de Biología Comparada de Protistas, IBBEA-CONICET, FCEN, UBA Unicell First cell groups The formation of a coherent extra-cellular matrix Cellular differentiation La evolución no solo ocurre debido a cambios geneticos, sino tambien en las transiciones evolutivas: cuando una unidad mas compleja se convierte en una nueva unidad de selección Tema General: Investigar el surgimiento de nuevos niveles de individualidad y complejidad a medida que el tamaño de los organismos se incrementa. Interés Específico: La transición unicelular-multicelular Es la transicion a la multicelularidad dificil? Grosberg & Strathmann (2007) - No, ocurrio en forma independiente muchas veces. - Pero, solo cinco linajes produjeron organismos complejos: Plantas, Animales, Hongos, Algas Marrones y Rojas The evolution of multicellularity Nescent meeting (2013) Hongos Algas marrones Animales Plantas Procariotas multicelulares actuales Streptomyces Methanospirillum Merismopedia Lyngbya Proterozoic stromatolite Cylindrospermum Neoproterozoic (850 Ma) multicellular ‘cyanobacteria’ Proterozoic stromatolite Early Archean (3500 Ma) multicellular ‘fossils’ Proterozoic Eukaryotes (2500-500 MYA) Desarrollo Clonal de una celula o zigota Este es el desarrollo de todos los linajes multicelulares Desarrollo por agregacion Dycstostelium (amebas) Mixobacteria Sistemas modelo para el estudio del origen de la multicelularidad • Procariotas filamentosas: Cianobacterias • Algas verdes: ej., Volvocales • Hongos: ej., Levaduras Beneficios de la multicelularidad Tamaño Chara sp. - Disminucion de la depredacion - Almacenamiento de nutrientes - Ventajas para conseguir recursos Acetabullaria sp. (hasta 10cm) - Generar un medio ambiente interno protegido: Homeostasis - Mas mobilidad para dispersion y conseguir recursos - Mayor eficiencia para diferentes procesos debido a la especializacion celular Las algas verdes Volvocales son un grupo de algas muy conveniente para el estudio de la transición hacia la multicelularidad First cell groups The formation of a coherent extra-cellular matrix germ-soma differentiation Germ line Soma A: Chlamydomonas reinhardtii B: Gonium pectorale (8 cells) C: Eudorina elegans (16-64 cells) D: Pleodorina californica (128 cells) E: Volvox carteri (1000 cells) F: Volvox aureus (2000 cells) La especialización en funciones reproductivas y vegetativas se da en los Volvocales de mayor tamaño Este grupo monofilético ha sufrido importantes transiciones evolutivas en repetidas ocasiones, lo que sugiere que han sido marcadas presiones selectivas las que han provocado varias de estas transiciones (Coleman 1999; Nozaki 2003, 2006; Herron et al 2008) Chlamydomonas reinhardtii Unicell Gonium Eudorina Eudorina Volvox Volvox Volvox First cell groups The formation of a coherent extracellular matrix Cellular differentiation En las Volvocales la transición hacia la multicelularidad involucra pocos cambios genéticos Working hypothesis of how cellular differentiation works in V. Carteri (Kirk 1998) RegA mutant Las presiones selectivas de los primeros grupos de celulas en Volvocales Swimming Sedimenting MOVILIDAD Unicell Solari et al. (2015). Chapter in Evolutionary Transitions to Multicellular Life First cell groups Eudorina elegans El Batido Flagelar y el Transporte Molecular de los Primeros Grupos • La movilidad puede estar asociada a la mejora del transporte molecular, ayudando a la absorción de nutrientes y a la dispersión de productos de desecho. • El mezclado del medio realizado por el batido colectivo de los flagelos puede incrementar la tasa del transporte molecular. • El número de Peclet, Pe, es una proporción de tiempos característicos para la difusión y la advección del transporte molecular. Si Pe>1, la advección adquiere importancia para la toma de nutrientes. tdiff tadv L2 D L V P tdiff tadv LV D Chlamydomonas L = 0.0005 cm V = 0.005 cm/sec P = 0.25 Difusion domina L = longitud característica (radio de la colonia) V = velocidad característica (velocidad de natación) D = coeficiente de difusión ~ 10-5 cm2/sec de O2 Volvox L = 0.02 cm V = 0.02 cm/sec P = 40 Adveccion domina Short et al. (2006) PNAS Solari et al. (2006) PNAS La transicion de los primeros grupos de celulas en Volvocales Transporte molecular P tdiff tadv LV D Gonium L = 0.001 cm V = 0.005 cm/sec P = 0.5 Diffussion dominates L = characteristic length (colony radius) V = characteristic velocity (swimming speed) D = diffusion coefficient ~ 10-5 cm2/sec for O2 Volvox L = 0.02 cm V = 0.02 cm/sec P = 40 Advection dominates Short et al. (2006) PNAS Solari et al. (2006) PNAS Las transicion de los primeros grupos de celulas en Volvocales DEPREDACION Solari et al. (2015). Chapter in Evolutionary Transitions to Multicellular Life Conclusiones del beneficio del tamaño en los primeros grupos de celulas en Volvocales 1. Nuestro analisis da soporte a la hipotesis que la depredacion fue una presion selectiva importante para el origen de la multicelularidad (Boraas et al. 1998; Lurling & Van Donk 2000; Solari et al. 2015, Ratcliff & Herron not published) 2. La matriz extracelular necesaria para formar grupos potencialmente puede ser coptada para el almacenamiento de nutrientes 3. No hemos encontrado evidencias que los primeros grupos de celulas en Volvocales hayan podido incrementar su movilidad o el transporte de nutrientes. Solari et al. (2015). Chapter in Evolutionary Transitions to Multicellular Life La Diferenciacion Celular en Volvocales W=LxV Fitness = tasa de reproduccion x probabilidad de superviviencia • El fitness de una unidad evolutiva puede entenderse en términos de sus dos componentes básicos: Fecundidad (tasa de reproducción) y viabilidad (tasa de supervivencia) Un organismo unicelular tiene que ocuparse en los dos componentes. Pero, en un organismo multicelular las células pueden potencialmente especializarse en uno de los dos componentes. Solari et al (2013) AmNat W=LxV Fitness = tasa de reproduccion x probabilidad de superviviencia Células somáticas estériles especializadas en funciones Viabilidad vegetativas: Fecundidad Células germinales especializadas en funciones reproductivas: Viabilidad Fecundidad El incremento en tamaño puede ser beneficioso para el fitness de la colonia, pero también costoso en términos de viabilidad y fecundidad. Beneficios del incremento en tamaño • viabilidad (Ej. disminución de la depredación) • fecundidad (Ej. incremento en la calidad de la descendencia) Costos del incremento en tamaño • viabilidad (Ej. mayor necesidad de flujo de nutrientes) • fecundidad (Ej. mayor tiempo de generación) Compensaciones Especificas (Trade-offs) Investigadas W=LxV Fitness = tasa de reproduccion x probabilidad de superviviencia Reproducción (Fecundidad) vs Movilidad (Viabilidad) a medida que el tamaño de la colonia se incrementa Células Somáticas con flagelos: Viabilidad Células Germinales sin flagelos: Fecundidad Fecundidad Viabilidad 1. A medida que el tamaño de la colonia se incrementa, es necesario la evolución de células somáticas especializadas en mobilidad 2. Como las colonias de mayor tamaño tienen mayores requisitos metabólicos, el batido colectivo de los flagelos ayuda también a la absorción de nutrientes. Solari et al (2006) AmNat Modelo Hidrodinámico Para Entender la Movilidad Por Flagelos en las Volvocales • Las Volvocales forman esferas pequeñas que se mueven a velocidades bajas. • Estos microorganismos viven en condiciones de flujos de bajo número de Reynolds (numero adimensional). Re = RV / <1 R = radio de la colonia V = velocidad = densidad del agua = viscosidad del agua e.g. Volvox Re = .25 R = .05 cm V = .05 cm/sec = 1 g/cm3 = .01 g/sec cm En este régimen donde no hay inercia y el flujo es laminar, la relación entre la fuerza y la velocidad es lineal Bajo Re Alto Re Solari et al (2006) AmNat El batido de los flagelos de las células somáticas en cámara lenta Velocidad de batido: 25-30 Hz • En el numero bajo de Reynolds, una esfera en proceso de sedimentación llega a una velocidad que esta dada por el equilibrio entre la fuerza de fricción (drag) y la fuerza de la gravedad (ley de Stokes). R V = radio de la colonia = velocidad sed = viscosidad del agua g = aceleración de la gravedad M = la diferencia en masa entre la colonia y el volumen de agua que esta desplaza 6 RV Mg • Usando este mismo esquema, la fuerza usada por una colonia para la natación vertical es la suma de las fuerzas para vencer la fricción y la fuerza de la gravedad. Nf Resolviendo para Vup 6 Vup RVup Nf 6 Mg Mg R N = numero de células f = fuerza/célula Vup = velocidad de natación Solari et al (2006) AmNat Las algas fueron sincronizadas bajo condiciones estándar y la velocidad de natación y de sedimentación de las colonias fueron medidas en diferentes etapas de su desarrollo 6 RVsed RVup Mg Nf 6 Mg Nf 6πηR(Vsed Vup ) •En la oscuridad las algas nadan hacia arriba (gravitaxis). Fueron filmadas en la oscuridad usando una luz con filtro infrarrojo. •Velocidades eran calculadas mediante un software diseñado para seguir el movimiento de las partículas y medir su velocidad Las velocidades de natación de las colonias a medida que estas se desarrollan • La colonias mas grandes tienen mayor velocidades que las mas chicas • A medida que la masa de las colonias se incrementa, la velocidad de natación disminuye • V. rousseletii es la que tiene mayor velocidad; nada en promedio 10 veces mas rápido que Chlamydomonas La Diferenciacion Celular en Volvocales Expected if f is constant: Vup N 1/2 Nf 6 Vup Nf M R Mg R f N -0.21 N 0.79 N 1.08 N 0.47 Solari et al (2006) AmNat La Movilidad por Flagelos es también importante para la absorción de nutrientes tdiff tadv L2 D L V P tdiff tadv LV D Chlamydomonas L = 0.0005 cm V = 0.005 cm/sec P = 0.25 Difusion domina Volvox L = 0.02 cm V = 0.02 cm/sec P = 40 Adveccion domina Para caracterizar el fluido se utilizó software de velocimetría de partículas (particle imaging velocimetry PIV). Solari et al (2006) PNAS Pseudo-darkfield (4x objective, Ph4 ring) Stirring by Volvox carteri micropipette Conclusiones 1. Nuestros estudios muestran que la transición unicelular-multicelular puede explicarse como consecuencia de las restricciones y las oportunidades dadas por el aumento de tamaño. 2. El incremento en los costos para reproducir un organismo de mayor tamaño es compensado en parte por el incremento en la especialización celular. Solari et al. (2013) AmNat Transición evolutiva UNICELULARES MULTICELULARES Físicamente conectadas Interdependencia entre células (comunicación) Diferenciación y epecialización de funciones Coordinación e integración Maynard Smith J. & Szathmáry E. 1995. The major transitions in evolution. Oxford, U.K: Freeman. +346 p. ¿Cómo surgió la multicelularidad? ¿Agente selectivo? Ej. Cultivos de eucariotas unicelulares Flagelado (Ochromonas vallescia) Alga (Chlorella vulgaris, normalmente unicelular). Boraas et. al 1998, Evol. Ecol. ¿Agente selectivo? ORIGEN DE LA PREDACIÓN (habilidad para fagocitar) llevó a que la multicelularidad sea seleccionada + células > Tamaño = > Ventaja (Escape a la predación) Evolución y complejidad morfológica ¿Complejidad? Mínima cantidad de información para describir un objeto (Hinegardner & Engleberg, 1983) • El aumento de tamaño va acompañado de un incremento de los elementos componentes + un aumento de sus iteraciones •Un objeto + complejo es aquel que ofrece más dificultad para describirlo • >dificultad = >nro de componentes + > nro de iteraciones (Ej., comparemos un diblástico con un triblástico) Cuantificación de la complejidad morfológica • Nro. de tipos morfológicos celulares Ej. Animales Origen de Metazoa Evidencias morfológicas y moleculares Probablemente, los metazoos descienden de ancestros protistas coloniales (semejantes a Phylum Choanoflagellata). Derivan de una colonia esférica de células flageladas Proterospongia sp. Coanoflagelado Phylum Porifera (8300 sps.) : Generalidades Acuáticas marinas; pocas de agua dulce (150 sps.). Asimétricas o simetría superficialmente radial. Adultos sésiles. Metazoos, con células especializadas NO organizadas en tejidos ni órganos. En gral. NO presentan membrana basal. Phylum Porifera: Estructura gral. del cuerpo Cuerpo cubierto por poros (ostíolos y ósculos), Salida del agua con un sistema exclusivo de canales y cámaras (S. acuífero) por donde circulan corrientes de agua. Entrada del agua Poros (= ostíolos) Canales Cámaras Atrio Ósculo Phylum Porifera: Estructura del cuerpo Capas celulares • Pinacodermo (pinacocitos, miocitos) • Mesohilo (matriz proteica, elementos esqueletales, arqueocitos o amebocitos y colenocitos,) • Coanodermo (coanocitos) Arqueocitos Pinacocitos Colenocitos Pinacodermo Mesohilo Coanodermo Coanocitos Espículas Phylum Porifera: Soporte y sostén Esqueleto unidades cristalinas (espículas): calcáreas o silíceas y/o fibras proteicas: colágeno fibrilar y/o espongina. Espículas silíceas Espongina Espículas calcáreas Phylum Porifera: Función de tipos celulares Fibras de colágeno Espícula Esclerocitos Esclerocitos: secretan espículas Lofocito Espongina Espongocito Lofocitos (móviles): secretan colágeno Colenocitos (fijos): secretan colágeno Espongocitos: secretan fibras de espongina Phylum Porifera: Función de tipos celulares Coanocito: alimentación (digestión parcial) Flujo del H2O Flagelo Dirección del Alimento Espongocele o atrio Partícula de alimento Vacuola digestiva Núcleo FILTRADORES Mesohilo Detalle de coana Flagelo Microvellosidades (verticales) Microfibrillas Intercambio de gases respiratorios Eliminación de deshechos Reproducción. DIGESTIÓN INTRACELULAR (Fagocitosis y pinocitosis) Alimentación: detritos, plancton, bacterias (50-0,1 µm) Detalle gral. del sistema acuífero Canal exhalante Flujo de H2O Pinacocito Dirección del alimento Apopilo Canal inhalante Arqueocito (Digestión final) Coanocito Colenocito Espícula Prosopilo Phylum Porifera: Función de tipos celulares Arqueocitos o amebocitos • Indiferenciadas y totipotentes. •Se trasladan a través del mesohilo •Recepción de alimento desde coanocitos o en pinacodermo (Digestión) • Transporte y excreción Arqueocito o amebocito Poro u ostíolo • Reproducción asexual Porocitos • Forman parte de los ostíolos Porocito • Son contráctiles Miocitos • Contráctiles • Regulan la apertura de poros y ósculos Miocitos Phylum Porifera: Función de tipos celulares Todos los tipos celulares Intercambio Excreción gaseoso Vacuolas contráctiles (arqueocitos y coanocitos) Difusión simple Phylum Porifera: Respuestas coordinadas Sin células nerviosas Cierre de ósculo y poros Coordinación a través de compuestos químicos en corriente de H2O? Defensa: tóxicos Diseños estructurales Ubicación de coanocitos Eficacia y complejidad del sistema de bombeo ASCONOIDE SICONOIDE LEUCONOIDE Phylum Porifera: Complejidad estructural Ósculo ASCONOIDE Pinacocito + simple Coanocito Pequeñas y tubulares Ostíolo Captura de alimento en espongocele Espícula Porocito Espongocele = Atrio Ruta del agua: Ostíolos, Espongocele (con coanodermo), Ósculo. Phylum Porifera: Complejidad estructural SICONOIDE Ruta del agua: Canal inhalante, Prosopilo, Canal radial, Apopilo, Atrio, Ósculo. Prosopilo Ósculo Canal inhalante • Pared del cuerpo plegada formando canales radiales. • Aumento de superficie •>ría del agua contenida en canales es accesible a coanocitos. • Tubulares. Captura de alimento en canales radiales. Apopilo Atrio Canal radial Coanocitos Sycon ciliatum Phylum Porifera: Complejidad estructural LEUCONOIDE + compleja Aumento del nro. de cámaras y disminución de su tamaño. Mejor regulación del flujo de agua. Aumento de tamaño corporal. Ej. Leuconia tiene 2 millones de cámaras flageladas. Bombea 22,5 L x día. En c. inhalantes flujo = 0,1 cm/s. En cámaras flageladas flujo = 0,001 cm/s. Velocidad en ósculo: 8,5 cm/s. >ría de las esponjas son leuconoides. Ruta del agua: Poros, Canal inhalante, Prosopilo, C. de coanocitos, Apopilo, canal exhalante, Ósculo. Phylum Porifera: Complejidad estructural Grado creciente de complejidad morfológica asconoide siconoide leuconoide Phylum Porifera: Reproducción asexual • Embriogénesis somática x fragmentación (reorganización estructural) • Gemación (poco común) Yemas externas • Gemulación Yemas internas o gémulas Drulia sp. Gémulas Gemulación Membrana externa Micropilo Membrana interna Arqueocitos Membrana interna Pinacodermo en desarrollo Espículas Arqueocitos Espongina Arqueocitos saliendo por el micropilo • Adaptación a cambios estacionales • Colonización de nuevos hábitat Phylum Porifera: Reproducción sexual Sin gónadas >ría monoicas Fecundación cruzada Oocito Folículo espermático Cél. nodriza Cél. nodriza Núcleo espermatozoides (a partir de coanocitos) oocitos (a partir de coanocitos o de arqueocitos) Ovíparas (pocas) (fecundación externa) Vivíparas (captura de espermatozoides por coanocitos) Larva nadadora (parenquímula, anfiblástula) Phylum Porifera: Reproducción sexual y desarrollo Vivíparas • captura de espermatozoide por coanocito • pérdida de flagelo (amebocito; coanocito de transferencia) Phylum Porifera: Reproducción sexual y desarrollo larva hueca con células flageladas internas Micrómero inversión Macrómero la anfiblástula se fija por el polo flagelado macrómeros crecen sobre los micrómeros que forman coanocitos, arqueocitos y colenocitos Cigota 16 células Blástula Inversión Anfiblástula Gástrula los macrómeros forman esclerocitos y pinacodermo Esponja Calcárea Phylum Porifera: Reproducción sexual y desarrollo larva sólida con flagelos (Parenquímula) Larva parenquímula Abertura exhalante Abertura inhalante Desarrollo de una demosponja Clasificación de las esponjas • Reino Animalia – – – – Clase Calcarea Clase Hexactinellida Clase Demospongiae Clase Homoscleromorpha Agelas conifera Neoesperiopsis rigida Haliclona Microciona Clase Calcarea • espículas CO3Ca • espículas de 1, 3 ó 4 radios • Sin espongina • todas marinas costeras • asconoides siconoides leuconoides • Sycon, Leucosolenia Clase Demospongiae (95%) • espículas de sílice (NO de 6 radios) y/o espongina o sin espículas • leuconoides • casi todas marinas agua dulce (gémulas) • esponjas de baño (Spongia e Hippospongia) Clase Homoscleromorpha • espículas de sílice (de 4 radios) o sin espículas • leuconoides • casi todas marinas • Con m. basal Oscarella lobularis Clase Hexactinellida Fagocitosis • Espículas de sílice de 6 radios • Simetría radial • Cuerpo formado por un sincicio continuo: red trabecular • Marinas de aguas profundas • Siconoides o leuconoides • Euplectella, Hexactinella Ruta del agua: poros, canal incurrente, coanas, canal excurrente, atrio, ósculo Hexactinella Euplectella Filogenia de Porifera Evidencia morfológica (coanocitos – coanoflagelados) Evidencia molecular (ARNr) (grupo hermano de coanoflagelados) Semejanzas con protistas • totipotencia celular • estrategias excretoras, respiratorias y de osmoregulación • digestión totalmente intracelular Semejanza con eumetazoos Síntesis de colágeno, principal proteína estructural del Reino Animal. Ancestro común que sintetiza colágeno para todos los animales. Diferencias con eumetazoos • totipotencia celular • ausencia de tejidos verdaderos (sin membrana basal) • ausencia de órganos. Sinapomorfía del Phylum: sistema acuífero (independiente del resto de los metazoos) Filogenia en Porifera Calcarea, Demospongia y Homoscleromorpha más estrechamente relacionadas entre sí que con las Hexactinélidas Subphylum Cellularia: células Clase Calcarea (espículas calcáreas) Clase Demospongia (espículas silíceas) Clase Homoscleromorpha Subphylum Symplasma: sinciciales Clase Hexactinellida (espículas silíceas) Tree of life Eukaryotes Animals (Metazoa)