1.0. DENOMINACIÓN DISTINTIVA. Polioral 2.0. DENOMINACIÓN
Anuncio

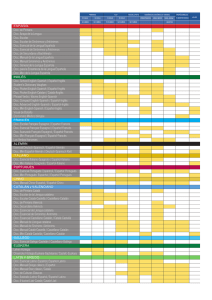
1.0. DENOMINACIÓN DISTINTIVA. Polioral 2.0. DENOMINACIÓN GENÉRICA Vacuna antipoliomielítica oral tipo Sabin, trivalente 3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Polivirus Tipo 1(Cepa LS-c, 2ab) Polivirus Tipo 2(Cepa P712,Ch, 2ab) Polivirus Tipo 3(Cepa Leon 12 a,b) 4.0. 1,000,000 DICC 50 100,000 DICC 50 600,000 DICC 50 FORMA FARMACÉUTICA. Suspensión (oral) Condición de uso: Inyectable 5.0. DATOS CLÍNICOS. 5.1. Indicaciones terapéuticas. Inmunización activa contra los virus de la poliomielitis tipo 1,2 y 3. 5.2. Posología y forma de administración. Una dosis=dos gotas (0.1ml) La vacunación contra la poliomielitis se inicia a los 60 días de vida (inmunización primaria). La segunda dosis se administra a las 6-8 semanas de la primera. La tercera dosis se debe administrar a los 10-11 meses de edad, al menos 4 meses después de la segunda dosis. Se recomienda una dosis adicional (cuarta) durante el tercer año de vida, al menos 12 meses después de la tercera dosis. La vacuna es administrada exclusivamente por la vía oral, en ayunas, eventualmente diluida con agua o leche o sobre un trozo de azúcar. Si la vacuna es regurgitada deberá repetirse la dosis. 5.3. Contraindicaciones. Si los pacientes no están en buena condición de salud o tienen enfermedades agudas febriles, es conveniente posponer la vacunación ya que la prolongación aún de meses, del intervalo fijado entre las dosis no influye sobre el grado de inmunidad. Así, se debe considerar como contraindicación los procesos febriles agudos, las enfermedades diarreicas graves, las infecciones respiratorias agudas graves, los trastornos cerebrales y enfermedades neurógenas progresivas o recurrentes y la inmunodepresión. 5.4. Advertencias y precauciones especiales de uso. Los pacientes inmunocomprometidos pueden no tener una respuesta adecuada a la vacunación, por lo que el médico deberá estar alerta ante esta posibilidad. 5.5. Interacciones con otros medicamentos y otras forma de interacción. Al igual que con las demás vacunas vivas, la respuesta inmunológica antipoliomielítica sobre todo la 1 primaria puede resultar disminuida en caso de tratamiento con ACTH, cortisona y derivados, antimetabólicos, agentes quelantes e irradiaciones. Para administrar la vacuna habrá que esperar no menos de tres meses a partir del final del tratamiento inmunodepresor. 5.6. Sobredosificación o ingesta accidental. No se ha reportado. 5.7. Embarazo y lactancia La vacuna antipoliomielítica, al igual que las demás vacunas vivas, no debe administrarse durante la gestación. 5.8. Efectos sobre la capacidad para conducir y utilizar máquinas. No aplica. 5.9. Reacciones adversas. En un 90% de los casos la vacuna oral no ocasiona reacciones y la infección artificial es asintomática. En el restante el 10% se pueden observar durante 1 ó 2 días formas leves de los síntomas característicos, en general de diarrea y en ocasiones de anorexia o vómito. La aparición de parálisis asociadas a la vacuna es un riesgo admitido pero remoto (según la OMS se calcula en 1 caso en 6 millones de dosis). 6.0. PROPIEDADES FARMACOLÓGICAS. 6.1. Propiedades farmacodinámicas. El poliovirus atenuado ingerido con la vacuna oral se multiplica en el íleon y el contiguo tejido linfático que forma la lámina propia y llega a los linfonódulos mesentéricos y a la sangre. Sobre todo el virus del tipo 2 ocasiona viremia que se observa en el 90% de los niños no inmunes entre el segundo y el quinto día después de la vacunación. Finalmente los vacunados eliminan virus durante 1-3 semanas con las heces: el tipo 3 por lo general es eliminado más lentamente. Una parte de los virus puede implantarse y multiplicarse en la mucosa orofaringea y en las amígdalas y así llegar a los linfonódulos cervicales profundos. La multiplicación de los virus origina la formación de anticuerpos neutralizantes de la clase IgA e IgG, que constituyen la base de la inmunidad. 6.2. Propiedades farmacocinéticas Nos e requieren para vacunas 6.3. Datos preclínicos sobre seguridad No aplica 7.0. DATOS FARMACÉUTICOS 7.1. Lista de aditivos 2 Sulfato de Kanamicina Sulfato de Neomicina trazas no más de 5µg / dosis trazas no más de 5µg / dosis Agua inyectable cbp 1.00 mL 7.2. Incompatibilidades No aplica 7.3. Plazo de caducidad. 24 meses 7.4. Condiciones de conservación. Consérvese en congelación a -20°C. Una vez descongelada consérvese en refrigeración entre 2°C y 8°C máximo 6 meses, sin rebasar la fecha de caducidad expedida. 7.5. Naturales y contenido del Sistema contenedor-cierre. Solución inyectable: 0.50 mL 7.6. Precauciones especiales de eliminación y otras manipulaciones de dispositivos anexos (jeringas, agujas, torundas, dispositivos de transferencia, etc.) No aplica 8.0. RAZÓN SOCIAL Y DOMICILIO DEL TITULAR DEL REGISTRO. NOVARTIS FARMACÉUTICA S.A. DE C.V. La Candelaria No. 186, Local A, Col. Atlántida, C.P. 04370, Deleg. Coyoacán, D.F., México. 3 9.0. RAZÓN SOCIAL Y DOMICILIO DEL FABRICANTE DEL MEDICAMENTO. Novartis Vaccines and Diagnostics S.R.L. Via Fiorentina No. 1, 53100, Siena, Italia. 10.0. RAZÓN SOCIAL Y DOMICILIO DEL ESTABLECIMIENTO QUE DA LICENCIA PARA FABRICAR EL MEDICAMENTO. No aplica 11.0. RAZÓN SOCIAL Y DOMICILIO DEL ESTABLECIMIENTO ACONDICIONADOR. Novartis Vaccines and Diagnostics S.R.L. Via Fiorentina No. 1, 53100, Siena, Italia. 12.0. RAZÓN SOCIAL Y DOMICILIO DEL ESTABLECIMIENTO DISTRIBUIDOR. NOVARTIS FARMACÉUTICA S.A. DE C.V. Km. 27.5 Carretera Lago de Guadalupe No. 2-D, Col. San Pedro Barrientos, C.P. 54010, Tlalnepantla, Estado de México. 13.0. NÚMERO DE REGISTRO SANITARIO. 462M99 SSA 14.0. FECHA DE VIGENCIA EN PROCESO DE PRORROGA 4 DECLARACIÓN DE ESPECIFICACIONES DE PRODUCTO TERMINADO. Denominación distintiva: Polioral Genérico: REGISTRO No. 462M99 SSA Forma farmacéutica: Suspensión Titular del registro: Novartis Farmacéutica S.A de C.V. PRUEBA Esterilidad Identidad Concentración y termoestabilidad viral Apariencia Contenido de MgCl2 Volumen extraible ESPECIFICACIÓN Esteril Positiva >= concentración viral prescribida/dosis Líquido Claro 0.80 -1.20 M >= 2.0 ml REFERENCIA Eur. Ph. Método Interno Método Interno Método Interno Método Interno U.S.P. 5