Abundancias relativas de los isótopos
Anuncio

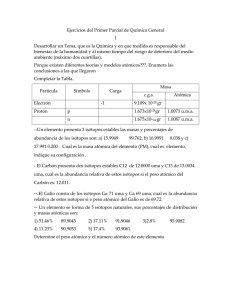
Abundancias relativas de los isótopos Química General I 2012 Donde están los isótopos de un elemento en la naturaleza? • Los isótopos de un elemento en la naturaleza se encuentran en cualquier muestra del elemento – Por ejemplo, el nitrógeno tiene 2 isótopos que existen naturalmente, el nitrógeno-14 y el nitrógeno 15. – El nitrógeno-14 tiene una abundancia relativa del 99.635% g y el nitrógeno-15 tiene una abundancia relativa de 0.365%. – Nótese que ambos porcentajes suman el 100%. Donde están los isótopos de un elemento en la naturaleza? – Esto quiere decir: • Si se tiene una muestra de nitrógeno de 100 g, 99.635 g son de átomos de nitrógeno-14 (con 7 protones y 7 neutrones en el núcleo) y 0.365 g son de átomos de nitrógeno-15 (con 7 protones y 8 neutrones en el núcleo) • Esto es independiente del origen de la muestra, si el nitrógeno es obtenido de la atmósfera, de un recipiente con nitrógeno líquido, etc. Esa composición no varía. Y que pasa cuando esa composición varía? • Resulta que a veces los porcentajes varían un poco en ciertas muestras. • Esto se debe a que hay en las mismas algún isótopo de origen artificial (creado por el hombre). • Por ejemplo, con el nitrógeno también hay nitrógeno-12, nitrógeno-13, nitrógeno-16 y nitrógeno-17 todos ellos sintéticos producidos por reacciones nucleares. Definición complementaria de elemento • Es el conjunto de átomos que poseen el mismo número atómico. Esta constituído por uno o varios isótopos. – Ejemplo: El azufre, tiene un peso atómico promedio de 32.06 que resulta de la mezcla de: • azufre-32, azufre-33, azufre-34 y azufre-36, cada uno con un porcentaje en la naturaleza. Peso o masa atómica • Es el promedio de las masas y los porcentajes de abundancia de los isótopos existentes para un elemento en particular. – Para medir la masa de los isótopos tomaron como referencia al carbono-12 (6 protones y 6 neutrones en su núcleo) y le asignaron un valor de 12 umas (unidades de masa atómica) Peso o masa atómica • Por lo tanto, 1 uma es 1/12 de la masa de UN átomo de carbono-12 • Es una unidad relativa de masa. Fórmula para obtener el peso atómico a partir de abundancias relativas. [(peso del isótopo en umas)(porcentaje de abundancia relativa)] Peso atómico 100 Problema no. 1 • Se determinó que el silicio (Si) posee 3 isótopos diferentes: silicio-28, silicio-29 y silicio-30, de masas atómicas: 27.9858 uma, 28.5859 uma y 29.9831 uma con abundancia relativa de 92.2700%, 4.6800% y 3.0500%. Calcule el peso atómico del silicio. R/ 28.0748 uma Problema no. 2 • El Boro (B) natural consta de 80.00% de boro-11 cuya masa es de 11.01 uma y 20.00% de otro isotopo. Para poder explicar el peso atómico de 10.81 cual debe ser la masa núclida del otro isótopo. R/ 10.01 uma Problema no. 3 • El antimonio (Sb) consta de 2 isótopos: el antimonio-121 y el antimonio-123. Calcúle la masa atómica del antimonio (con cuatro cifras significativas) con los siguientes datos: 120.9038 con 57.25% y 122.9041 con 42.75%. R/ 121.8 uma Problema no. 4 • El galio (Ga) consta de los siguientes isótopos: galio-69 con una masa de 68.926 uma y el galio-71 con una masa de 70.925 uma. El peso atómico calculado para este elemento es de 69.720 uma. Calcule el porcentaje de abundancia de cada uno de los isótopos. R/ galio-69: 60.28% galio-71: 39.72% Problema no. 5 • Hay dos isótopos naturales del nitrógeno, el nitrógeno-14 y el nitrógeno-15 cuyas masas son 14.0031 uma y 15,0001 uma respectivamente. Empleando el peso atómico del nitrógeno de 14.006 uma determine el porcentaje de abundancia de cada isótopo. R/nitrógeno-14: 99.7091% nítrógeno-15: 0.2909% Para recapitular… • Leer páginas 49 y 50 del libro de Chang. – Ojo con el ejemplo 2.1. – Realizar la revisión de conceptos (no se entrega)