Transducción de Señales
Anuncio

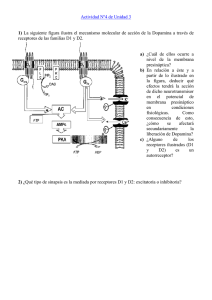
Señalización Celular • Formas de Señalización Celular • Mensajeros Químicos • Receptores • Transducción de Señales Control y coordinación del funcionamiento del organismo. Mensajeros Químicos → en respuesta a estímulos específicos que desencadenan una respuesta determinada. SISTEMA ENDÓCRINO SISTEMA NERVIOSO Hormonas Neurotransmisores Células blanco (Receptor) Membrana postsinaptica (Receptor) Formas de Señalización Intracelular Endócrina Neurotransmisor Hormona Sináptica Receptor Hormona Parácrina Sináptica Autócrina Señalización Celular • Formas de Señalización Celular • Mensajeros Químicos • Receptores • Transducción de Señales Mensajeros Químicos (Ligandos) Hormonas: Sustancias químicas que poseen un efecto regulador específico sobre la actividad de determinado órgano/s. Segregadas por estructuras glandulares. Neurotransmisores (NT): liberados por neuronas pre sinápticas , desencadenando un cambio en el potencial de acción de la neurona pos sináptica. Moléculas pequeñas y de acción rápida. Se sintetizan en el terminal sináptico. Hormonas: Según su naturaleza química: » Proteicas (insulina; Péptidos=ACTH) Esteroideas (estrógenos, testosterona, corticoides) Derivadas de aminoácidos (catecolaminas, tiroxina) Derivadas de ácidos grasos (eicosanoides) Solubles Se sintetizan como pro-hormonas en el RER. Luego de la maduración, que implica la eliminación del extremo N-terminal, se obtiene la hormona madura la que se almacena en vesículas intracelulares. Como respuesta a un estímulo se liberan al torrente sanguíneo por exocitosis. Insulina humana Hormona de Crecimiento (191 aa = 22 KDa) (51 aa, Hexámero) Hormonas: Según su naturaleza química: Receptor 7-TM Vasopresina (9 aa) ACTH (39 aa) » Proteicas (insulina; Péptidos=ACTH) Esteroideas (estrógenos, testosterona, corticoides) Derivadas de aminoácidos (catecolaminas, tiroxina) Derivadas de ácidos grasos (eicosanoides) Receptor Dimérico Insulina humana Hormona de Crecimiento (191 aa = 22 KDa) (51 aa, Hexámero) Hormonas: Según su naturaleza química: Estrógeno Receptor de estrógeno alfa Proteicas (insulina; Péptidos=ACTH) » Esteroideas (estrógenos, testosterona, corticoides) Derivadas de aminoácidos (adrenalina, tiroxina) Derivadas de ácidos grasos (Eicosanoides) Hidrofóbicas Derivan del Colesterol En sangre se asocian a proteínas de transporte. Atraviesan la membrana plasmática y se unen a receptores específicos dentro de la célula efectora. El complejo hormona-receptor ejerce, luego, su efecto sobre la transcripción de genes específicos en el núcleo. Hormonas: Según su naturaleza química: Proteicas (insulina; Péptidos=ACTH) Esteroideas (estrógenos, testosterona, corticoides) » Derivadas de aminoácidos (catecolaminas, tiroxina) Derivadas de ácidos grasos (eicosanoides) Hidrofóbicas Hidrofílicas Receptor soluble Receptor 7-TM Adrenalina Solubles, circulan libres o unidas a albúmina. Se unen a receptores específicos en el exterior de la membrana celular, disparando la síntesis de segundos mensajeros dentro de la célula. Tetrayodotironina Atraviesan las membranas por difusión y se unen a receptores específicos dentro de la célula efectora. Hormonas: Según su naturaleza química: Prostaglandina E2 Proteicas (insulina; Péptidos=ACTH) Esteroideas (estrógenos, testosterona, corticoides) Derivadas de aminoácidos (catecolaminas, tiroxina) » Derivadas de ácidos grasos (eicosanoides, 20C) Hidrofóbicas Derivan de ácido araquidónico Prostaglandinas, leucotrienos y tromboxanos Se sintetizan prácticamente en todos los tejidos. No son transportados por el torrente sanguíneo: Acción Autócrina o Parácrina Activan receptores hormonales en el núcleo, de la familia esteroidea/tiroidea Hormonas: Según su naturaleza química: Prostaglandina E2 Proteicas (insulina; Péptidos=ACTH) Esteroideas (estrógenos, testosterona, corticoides) Derivadas de aminoácidos (catecolaminas, tiroxina) » Derivadas de ácidos grasos (eicosanoides, 20C) Si son productos de la ruta de la ciclooxigenasa: prostaglandinas y tromboxanos Si son productos de la ruta de la lipoxigenasa: leucotrienos Neurotransmisores (NT) Clasificación: » Aminoácidos (Ácido γ- aminobutiríco, glutamato, glicina) Monoaminas (dopamina, noradrenalina, serotonina, histamina) Acetilcolina Neuropéptidos (vasopresina, endorfinas) Ácido γ- aminobutiríco (GABA) Principal NT inhibitorio del SNC en vertebrados. Ácido γ- aminobutiríco (GABA) GABA (inhibitorio) Glutamato (excitatorio) Glicina (inhibitorio) Hay dos tipos de receptores GABA (R-GABA). El R- GABAA es un receptor ionotropico y el R-GABAB es un receptor metabotrópico, acoplado a proteína G. La unión de GABA al R-GABA provoca la apertura del canal de cloro y la hiperpolarización de la membrana, disminuyendo la excitabilidad de la misma. Neurotransmisores (NT) Clasificación: » Aminoácidos (Ácido γ- aminobutiríco, glutamato, glicina) Monoaminas(dopamina, noradrenalina, serotonina, histamina) Acetilcolina Neuropéptidos (vasopresina, endorfinas) Sintetizada en las neuronas del SNC y las células de Kulchitsky en el tracto gastrointestinal de vertebrados. También se encuentra en varias setas y plantas. Serotonina (5-hidroxitriptamina) Receptores de 5-HT. Con la excepción del receptor de 5HT3 (canal iónico regulado por ligando), los demás son receptores de 7-TM. Funciones: saciedad, control de la temperatura corporal, la actividad motora y las funciones perceptivas y cognitivas. Actúa con dopamina y noradrenalina, en procesos relacionados con la angustia, ansiedad, miedo, agresividad, así como los problemas alimenticios. Es necesaria para elaborar la melatonina, una proteína encargada de la regulación del sueño, por lo que es importante en la regulación de los ciclos de sueño-vigilia. Neurotransmisores (NT) Clasificación: Aminoácidos (Ácido γ- aminobutiríco, glutamato, glicina) Monoaminas(dopamina, noradrenalina, serotonina, histamina) » Acetilcolina Neuropéptidos (vasopresina, endorfinas) Neutransmisor Excitatorio , histamina Acetilcolina 1867 - aislada por Bäyer 1914 – caract. farmacológica Henry Hallett Dale 1921 - como NT(el primero) Otto Loewi (1936= Premio Nobel en fisiol. y medicina). Se une a los receptores de acetilcolina (canal iónico) en el SNC y SNP. En las terminaciones neuromusculares = contracción muscular En el cerebro regula de diversas funciones como activación cortical, el paso de sueño a vigilia y procesos de memoria y asociación. Se sintetiza a partir de la colina y del acetil CoA, en una reacción catalizada por la colina acetiltranferasa. La difusión de Na+ y K+ a través del receptor provoca la despolarización de la membrana, la apertura de los canales de Na+ regulados por voltaje, permitiendo la aparición de un potencial de acción. Neurotransmisores (NT) Clasificación: » Aminoácidos (Ácido γ- aminobutiríco, glutamato, glicina) Monoaminas(dopamina, noradrenalina, serotonina, histamina) Acetilcolina Neuropéptidos (vasopresina, endorfinas) (Tyr-Gly-Gly-Phe-Met) Vasopresina (9 aa) Receptor 7-TM metionina-encefalina (5 aa) Se sintetizan en todo el citoplasma, no solo en el terminal sináptico. Los Mensajeros Químicos pueden unirse a Receptores de membrana o Intracelulares Señalización Celular • Formas de Señalización Celular • Mensajeros Químicos • Receptores • Transducción de Señales Receptores de membrana - Proteínas intrínsecas de membrana - Unen ligandos con alta afinidad (ka≥108M) Dominio Extracelular – Sitio de unión del ligando Dominio Transmembrana (α hélices) Dominio Intracelular Cambio conformacional Receptores transmembrana (ligandos polares) DIMERICOS Receptores con actividad enzimática intrínseca Factores de crecimiento (EGF) e insulina. Receptores que se asocian a enzimas Hormona de crecimiento, prolactina, citoquinas. Receptores de canal iónico GABA Acetilcolina Serotonina 7-TM Receptores asociados a proteínas G Vasopresina Serotonina, Histamina, Adrenalina, Calcitonina, Glucagón, Sentidos: Olfato,Visión y Sabor Receptores intracelulares (ligandos apolares) Hormona esteroidea Membrana plasmática Ausencia de Hormona Receptor de H. Tiroidea Transcripción reprimida Núcleo Hormona Receptor Estrogenos, testosterona, progesterona, cortisol, hormona tiroidea Transcripción activada Transcripción Proteínas solubles localizadas en el citoplasma o en el núcleo celular. La hormona que pasa a través de la membrana plasmática, alcanza el receptor e inicia la cascada de señales y activan la transcripción de ciertos genes Señalización Celular • Formas de Señalización Celular • Mensajeros Químicos • Receptores • Transducción de Señales Transducción de Señales Proceso en el cual participan circuitos moleculares que detectan, amplifican e integran las diversas señales externas, para generar respuestas. Señales Cascada de transducción de señales (Detección y Amplificación) Respuestas Señal Ligando o Primer mensajero Exterior celular Detectada Transmitida y Amplificada Receptores de membrana -7TM -Diméricos Segundos mensajeros - AMPc -GMPc - Ca+2 -IP3 - DAG Quinasas Respuesta Finalización del proceso Fosfatasas Ejemplos de Vías de Transducción de Señales: 7-TM Receptores asociados a proteínas G Adrenalina, Vasopresina DIMERICOS Receptores con actividad tirosina Quinasa intrínseca Factores de crecimiento (EGF) Receptores que se asocian a Quinasas Hormona de crecimiento, Receptores 7TM: Recepción de señales muy diversas 7 hélices que cruzan la bicapa lipídica Unión del ligando genera cambios conformacionales (estructura 3°) que son más marcados en los bucles citoplasmáticos y carboxilo terminal. Activan proteínas G Ejm: Receptor β adrenérgico Rodopsina Proteínas G: Heterotrímeros Subunidad α = Interactúa con nucleótidos de Guanina (bucle P) 2 α hélices que envuelven a la Sub β Anclada a la membrana (miristoilo o palmitoilo) Gα Actividad GTPasa intrínseca Gβγ Subunidad β = superbarril de 7 aspas Subunidad γ = anclada a la membrana (prenilación del C- terminal) Se une a Sub β con gran afinidad Palmitoilación Enlace tioester Ac.palmitico (C16) y Cys Miristoilación Enlace amida ácido miristico (C14) y Gly Prenilación Enlace tioeter Geranilo (C10), geranilgeranilo (C20) o farnesilo (C15) y Cys. Anclaje Glicosilfosfatidilinositol (GPI) Extremo Carbonilo Proteínas G: Heterotrímeros Subunidad α = Interactúa con nucleótidos de Guanina (bucle P) 2 α hélices que envuelven a la Sub β Anclada a la membrana (miristoilo o palmitoilo) Gα Actividad GTPasa intrínseca Gβγ Subunidad β = superbarril de 7 aspas Subunidad γ = anclada a la membrana (prenilación del C- terminal) Se une a Sub β con gran afinidad Complejo Ligando-Receptor interactúa con la forma inactiva Gα (unida a GDP) Facilita la salida de GDP y la unión de GTP Cambios conformacionales = Gα se disocia de Gβγ Activación de Gα (unida a GTP) Interactúa con otras proteínas Proteínas G: Heterotrímeros Subunidad α = Interactúa con nucleótidos de Guanina (bucle P) 2 α hélices que envuelven a la Sub β Anclada a la membrana (miristoilo o palmitoilo) Gα Actividad GTPasa intrínseca Gβγ Subunidad β = superbarril de 7 aspas Subunidad γ = anclada a la membrana (prenilación del C- terminal) Se une a Sub β con gran afinidad Un único complejo Ligando-Receptor puede activar a más de una Prot G Amplificación Quinasas, Cinasas o Kinasas Grupo de enzimas que catalizan el intercambio de grupos fosfato entre compuestos fosforilados ricos en energía y otros substratos. Estas enzimas son muy importantes en: a) el aumento del nivel energético de diferente compuestos, convirtiéndolos en moléculas metabólicamente activas. b) la modificación covalente de la actividad enzimática. Substrato + ATP ———-> Substrato-(P) + ADP Protein quinasa: El substrato es una proteína. Proteína + ATP ————-> Proteína-(P) + ADP Proteínas Quinasas (PK) Enzimas que transfieren grupos fosfato desde el ATP y fosforilan residuos de Serina, Treonina o Tirosina (OH). La fosforilación puede activar o inactivar al sustrato. -PKA Eucariotas Asociada a vías de AMPc Fosforila Ser y Thr -PKC Dependiente de Calcio Fosforila Ser y Thy Forma inactiva: interacción de secuencia pseudosustrato-sitio catalítico -JAK2 Tirosin Quinasa asociada a receptores diméricos Proteinfosfatasas Grupo de enzimas que hidrolizan grupos fosforilos unidos a las cadenas laterales de Ser, Thr y Thy. De esta forma invierten los efectos de la señal qu originalmente activó a la quinasa. Dominio fosfatasa conservado (∼240 aa) → secuencia característica de 11 aa (motivo CX5R). Contiene residuos catalíticos esenciales Cys y Arg. Grupo fosfato-Thy Cys-fosfato Tipos: -Proteinas transmembranas -Intracelulares (Thy) -De especificidad dual (Ser, Thr y Thy) Cys + ATP Ejm: Receptor β adrenérgico Adrenalina (1º M) R-β adrenergico Prot Gαs Adenilato Ciclasa Procesos Celulares afectados por el ↑ [AMPc]: - ↑ degradación de reservas energéticas - ↑ secreción gástrica - Induce la apertura de conductos de Cloro - Induce la dispersión de los gránulos de Melanina - ↓ la agregación plaquetaria AMPc (2º M) Quinasas (PKA) Finalización del proceso - Desactivación de la Prot Gαs: Actividad GTPasa= GTP GDP + Pi Regeneración del trímero inactivo (GDP). - Desactivación del receptor: Disociación de la hormona Fosforilación de residuos Ser y Thr (C-terminal) - 12 hélices transmembrana - 2 sitios catalíticos - hélices 6-7 - C-terminal - Interactúa con Gαs y su estructura se modifica = síntesis de AMPc (ATP) Cascada de los Fosfoinosítidos Fosfatidilinositol 4,5-bifosfato (PIP2) Fosfolipasa C Inositol 1,4,5 trifosfato (IP3) Diacilglicerol (DAG) Soluble Permanece en la membrana Fosfolipasa C (isoforma β) - 4 dominios - Anclada a la membrana - Sitio catalitico = barril αβ - Dominios mano EF Cascada de los Fosfoinosítidos = Fosfatidilinositol 4,5-bifosfato (PIP2) Ejm: Vasopresina (1º M) R-7TM Procesos Celulares afectados: - Contracción muscular lisa - Hidrólisis de glucógeno - Liberación de vesículas - Fosforilación de proteínas Finalización del proceso Prot Gαq Fosfolipasa C PIP2 (2º M) Inositol 1,4,5 trifosfato (IP3) RE Liberación de Ca+2 (2º M) Diacilglicerol (DAG) Quinasa (PKC) - Degradación de los segundos mensajeros (vida media corta) - Activación de Ca+2 ATPasa y bombas de Na+-Ca+2 que restauran el nivel basal. Síntesis de Eicosanoides - Contracción músculo liso - Agregación plaquetaria - Respuestas inflamatorias y febriles Ejemplos de Vías de Transducción de Señales: 7-TM Receptores asociados a proteínas G Adrenalina, Vasopresina DIMERICOS Receptores con actividad tirosina Quinasa intrínseca Factores de crecimiento (EGF) Receptores que se asocian a Quinasas Hormona de crecimiento, Actividad Enzimática (Asociada o Intrínseca) Estructura 3º y 4º = Dimerización Receptores Dimericos: Monómeros = Dominio extracelular (une el ligando) Dominio transmembrana (1 única α hélice) Dominio Intracelular c/actividad enzimática Actividad enzimática puede ser: - Ciclasa (R-guanilato ciclasa; Producción de GMPc) - Thy Fosfatasa (R-Tirosinfosfatasa, ataca grupos fosfato de Tyr) - Quinasa - (R-Treonina quinasa, fosforilan Thr) - (R-Treonina-Serina quinasa, fosforilan The y Ser) Asociada (Ejm: Receptor de la Hormona Humana Crecimiento) Intrínseca (Ejm: Receptor del factor de Crecimiento Epidérmico) Unión del ligando -Cambios conformacionales - Estructura 3º = Activación de la Enzima - Estructura 4º = Formación del Dímero (Cooperativo, permite la fosforilación cruzada de los monómeros.) Ejm: Receptor de la Hormona Humana de Crecimiento (HHC) Proteína con actividad Tyr quinasa (JAK2) asociada al dominio Intracelular del receptor Interacción con membrana Actividad Tyr quinasa Arg Se une a Tyr fosforiladas (Tyr*) JAK2* (activa) fosforila a - STAT5 (regulador de exp. génica). La Tyr* es reconocida por un dominio SH2 de otra STAT5 y se forma un dímero estable = afinidad por regiones de ADN. - R-HHC = permite la unión de la JAK2 por medio de su dominio SH2 Ejm: Receptor del Factor de Crecimiento Epidérmico (EGF) El dominio Tyr quinasa es una parte integral del dominio Intracelular del receptor Monómero enzimáticamente inactivo Unión del EGF = Cambio conformacional activa la PK Dimerización Fosforilación cruzada Activa a PK Ser y Thr Proteína adaptadora Dominios ricos en Pro Interactúa por medio de un dominio SH2 con la Tyr* Interactúa por medio de un dominio SH3 las regiones ricas en Pro de Grb-2 Fosforilan dianas que promueven el Crecimiento celular. Proteínas G pequeñas: Monoméricas Semejantes a Gα Forma inactiva (unida a GDP) Forma activa (unida a GTP) Actividad GTPasa intrínseca = finalización del proceso de transmisión de la señal GAPs= prot. auxiliares que ↑ eficiecia de la hidrólisis de GTP Sos = cumplen una función similar a GEF (factor de intercambio de nucleótidos) facilitando la liberación de GDP Calcio - Mensajero intracelular -Componente importante de varias vías Capaz de coordinarse con los oxígenos de la cadena principal y de las cadenas laterales de Gln, Asn y Glu, Asp. Cambios conformacionales Ejm: Calmodulina (CaM) - Dominio tipo mano EF (hélice – bucle – hélice) - El Ca+2 se coordina con 7 oxígenos - 6 de la proteína - 1 agua - Cambio conformacional = Regiones hidrofóbicas que permiten la interacción con otras proteínas (hélices (-)) -Activa a - CaM quinasas (metabolismo energético, permeabilidad iónica, síntesis y liberación de neutransmisores) - Ca+2 ATPasa (restauran los niveles basales de Ca+2) Señal Ligando o Primer mensajero Exterior celular Detectada Transmitida y Amplificada Receptores de membrana -7TM -Diméricos Segundos mensajeros - AMPc -GMPc - Ca+2 -IP3 - DAG Quinasas Respuesta Finalización del proceso Fosfatasas Según el siguiente esquema responda: 1- Que representa el esquema? Por que? 2- Identifique : Primer mensajero Segundo mensajero Receptor Adrenalina R-β adrenergico Prot Gαs Adenilato Ciclasa 3 - En que momento tiene lugar la mayor amplificación? Por que? AMPc 4 - Qué es y cuál es la función de la PKA? Que ocurre si sus residuos Ser y Thr son fosforilados? Que tipo de enzima podría hacerlo? Quinasas (PKA) En las vías de transducción de señales: -Es necesario que exista un mecanismo de finalización del proceso? Por que? -Que tienen en común los procesos de finalización de aquellas vías en que participa la proteína G? Los receptores con los que interactúan las Hormonas o Neurotransmisores (ligandos) son proteínas intrínsecas de membrana. Indique: -Que efecto produce la unión del ligando en el dominio extracelular del receptor? -Que estructura secundaria se espera que posea él dominio transmembrana ? -El dominio intracelular se ve afectado por la unión del ligando? -Es posible que cambios en la composición de la membrana induzcan cambios en la estructura del receptor inserto en ella?