NOCIONES DE BIO ELECTROQUÍMICA UN POCO DE HISTORIA
Anuncio

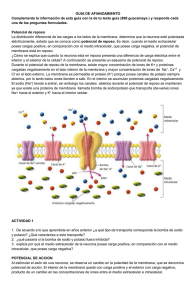
NOCIONES DE BIO ELECTROQUÍMICA UN POCO DE HISTORIA Desde los primeros trabajos realizados por Luigi Galvani el estudio de la llamada “electricidad animal” ha sido motivo de interés de muchos científicos. La idea de la presencia de un tipo especial de electricidad en algunos animales que producían una descarga eléctrica al ser perturbados, fue el primer motivo de estudio. Sin embargo, ahora podemos tener una visión mucho más amplia de este concepto. Es importante recordar que para la época de estos estudios aún no se tenía una descripción clara del modelo de átomo, ni de la identidad de los portadores de esa carga eléctrica. Para contradecir lo postulado por Galvani, A. Volta realizó una serie de experimentos que condujeron finalmente, a la invención de la “pila voltaica”. De esta manera se intentaba demostrar que la teoría de la corriente animal era equivocada. Al cabo de todos estos años, se puede afirmar que tanto Volta como Galvani, estaban en lo cierto puesto que actualmente se puede explicar no solo las evidencias experimentales obtenidas con ciertos animales, sino que tenemos una idea mas clara de la importancia de la presencia de electricidad para el funcionamiento del cuerpo humano. Sin duda la analogía más fácil de realizar es comparar lo que sucede cuando se transmite electricidad por un conductor metálico y el transporte de impulsos en el sistema nervioso. También se encontrarán analogías al analizar lo que sucede a nivel de membranas celulares. SISTEMA NERVIOSO Unidades básicas del sistema nervioso Una clase de células que constituyen el sistema nervioso son las denominadas “neuronas”, las que se unen unas con otras a través de las sinapsis. Los primeros estudios realizados con este tipo de células se llevaron a cabo observando el comportamiento del axón del calamar cuando se sometía a estimulación. Esta observación era relativamente fácil ya que tiene 1mm de diámetro. Transmisión de impulsos nerviosos La transmisión se da fundamentalmente a través de dos mecanismos: Señales eléctricas: se recorren rápidas distancias dentro de las neuronas Señales químicas: se da entre neuronas a través de neurotransmisores (acetilcolina, norepinefrina, dopamina, etc.). Este mecanismo actúa a nivel de las sinapsis. POTENCIAL DE MEMBRANA El potencial de membrana es el resultado de la separación de cargas positivas y negativas a través de una membrana celular. Esta separación, cargas positivas en el exterior de la membrana de una célula del sistema nervioso en reposo, es posible debido a que la bi-capa lipídica actúa como una barrera para la difusión de los iones y da lugar a la generación de una diferencia de potencial. Esta diferencia toma valores de 60 a 70 mV. POTENCIAL DE REPOSO Cuando una célula está en reposo, el potencial de membrana se conoce como potencial de reposo. Por convención se toma el potencial externo como cero, por lo que teniendo en cuenta que el interior tiene un exceso de carga negativa, el potencial de membrana en este caso toma valor negativo de -60 a -70 mV. La separación de carga a través de la membrana, y por lo tanto el potencial de reposo se modifica cada vez que ocurre un flujo neto de iones hacia o desde el interior de la célula. Cuando se produce una disminución de la separación de carga el proceso se denomina despolarización. El caso contrario se conoce como hiperpolarización. Al modificarse el potencial de membrana se genera un flujo de corriente. Esto es posible por la acción de canales iónicos. Existen dos tipos de canales iónicos en la membrana: Canales “gated” (algo equivalente a decir que tienen posibilidad de ser cerrados) y “nongated” (lo opuesto) Los canales “gated” se abren o cierran en respuesta a señales eléctricas, mecánicas o químicas específicas. Mientras que los segundos están siempre abiertos y no son influenciados significativamente por factores extrínsecos. Ellos son importantes para mantener el potencial de membrana en reposo. EQUILIBRIO DE SODIO Y POTASIO Dado que los canales iónicos reconocen y seleccionan iones específicos, la distribución de especies iónicas a través de la membrana dependerá de la distribución particular de canales iónicos que tenga la membrana celular. Las especies iónicas no se distribuyen de igual manera en ambos lados de la membrana: El sodio y el cloruro están más concentrados en el exterior de la célula El potasio y los aniones orgánicos (ácidos orgánicos y proteínas) están más concentrados en el interior. ¿Qué previene que estos gradientes sean vencidos simplemente por difusión a través de los canales “nongated”? La explicación está relacionada con la existencia de un equilibrio de fuerzas actuantes. Por una parte se tiene un gradiente de concentraciones que actúa impulsando los iones en el sentido de disminuir el mismo. Por otra parte, debido a la separación de cargas en la membrana se tiene un campo eléctrico que actuará también permitiendo o no el movimiento de los iones. Veamos con más detalle esta situación Analizando por ejemplo al ión cloruro, ya que se encuentra más concentrado en el exterior de la célula tendrá la tendencia a moverse hacia el interior a través de los canales “nongated”. Sin embargo si se tiene en cuenta que en el interior de la célula existe un exceso de carga negativa esto provocará la salida de los iones cloruros. De lo anterior se espera se alcance un estado de equilibrio, directamente relacionado con el potencial de membrana. Para el caso de los cationes, se debe hacer el análisis conjunto del movimiento de los iones sodio y potasio, ya que el movimiento de los iones sodio hacia el interior de la célula tiene que ser compensado por la salida de iones potasio. Este intercambio estacionario de iones previene una despolarización reversible, sin embargo no puede sostenerse indefinidamente a menos que se revierta el proceso. Esto se consigue mediante la acción de las “bombas de sodio y potasio”. Estos sistemas permiten la salida del sodio del interior de la célula e incorporan el potasio. Este proceso implica un consumo de energía puesto que los movimientos se realizan en contra de los gradientes electroquímicos. Esta energía se obtiene de la hidrólisis de ATP, que es la molécula “portadora de energía” por excelencia. Algunas células poseen también “bombas de cloro” que funcionan de la misma manera que la mencionada arriba. TRATAMIENTO TERMODINÁMICO Si se tuviera una membrana que solo fuera permeable al paso de los iones potasio, sería factible aplicar la ecuación de Nernst para calcular el potencial de membrana que se generaría a temperatura ambiente, al tener distintas concentraciones en ambos lado de la misma. [K ]int erior V ≅ −60mV log [K ]exterior Es decir que si se tuviera una concentración 0,1M en el interior y 0,01M en el exterior de la célula respectivamente, en el equilibrio se generaría una diferencia de potencial de unos 60 mV. Este potencial es el que contrarresta el gradiente de concentración y que permite que se alcance el equilibrio. En el análisis anterior se considero una membrana permeable solo a iones potasio. Obviamente que esto no corresponde con la realidad puesto que las membranas celulares muestran cierto grado de permeabilidad a otros iones diferentes al potasio, particularmente sodio y cloruro. Por este motivo, es necesario modificar la ecuación de Nernst para tener en cuenta esta influencia múltiple. Esta modificación es conocida como Ecuación de Goldman P [K ]int + PNa [Na ]int + PCl [Cl ]ext V ≅ −60mV log K PK [K ]ext + PNa [Na ]ext + PCl [Cl ]int Donde P, con unidad de cm.s-1, es la permeabilidad de cada ión y está relacionada con la actividad de los canales. POTENCIAL DE ACCIÓN Así como el potencial de reposo se corresponde con un estado donde la neurona está sin estimular, cuando es estimulada se produce una “explosión de actividad eléctrica” conocido como potencial de acción. Ante el estímulo, el potencial de reposo toma valores más positivos, pero solo cuando alcanza un valor umbral, de unos – 55 mV, se produce el disparo de un potencial de acción. Es importante mencionar que todos los potenciales de acción tienen la misma magnitud para cualquier neurona. En términos generales el proceso puede describirse teniendo en cuenta el funcionamiento de los canales iónicos. Ante el estímulo se abren primero los canales de sodio permitiendo el ingreso al interior de la célula lo que conduce a la despolarización. Cuando los canales de sodio comienzan a cerrarse se abren los de potasio, permitiendo la salida del mismo con lo que se revierte la despolarización anterior. Con esto se regresa al valor de potencial inicial (-70mV) es decir ocurre la re polarización. En resumen se comprueba la estrecha relación que existe entre la generación de diferencias de potencial a nivel de la membrana celular y el proceso de transmisión de impulsos nerviosos. Es decir que una vez más estamos en evidencia de la “electricidad animal” que tanto ha intrigado a los científicos históricamente. ALGUNOS TRASTORNOS RELACIONADOS CON EL FUNCIONAMIENTO DEL SISTEMA NERVIOSO Epilepsia: es una afección neurológica que implica una actividad eléctrica anormal del cerebro. Provoca convulsiones repetidas de algún tipo. Este trastorno no es contagioso ni está relacionado con ninguna enfermedad o retraso mental. La epilepsia es un trastorno con muchas causas posibles, cualquier cosa que impida o distorsione el patrón de actividad neuronal normal puede conducir a la aparición de una crisis epiléptica. Alzheimer: enfermedad irreversible que ataca el cerebro provocando una pérdida gradual de la memoria y dificultades con el lenguaje y las emociones. Se produce la interrupción del paso de mensajes entre las neuronas que controlan la memoria y el pensamiento. En estas células y en la corteza del cerebro se producen modificaciones distintivas. Mal de Parkinson: es el deterioro progresivo de las neuronas de la parte del cerebro que controla el movimiento muscular, área en la cual se produce normalmente la dopamina, uno de los neurotransmisores. Este deterioro reduce la cantidad de dopamina disponible para el organismo. Esto afecta el equilibrio con otros transmisores como la acetilcolina. Al no poderse transmitir adecuadamente los mensajes en las células nerviosas, se produce pérdida en la función muscular. TECNICAS E INSTRUMENTOS RELACIONADOS CON LA INTERACCIÓN ELECTRICIDAD-SERES VIVOS Electrocardiograma (ECG): instrumento que permite monitorear el funcionamiento del músculo cardíaco mediante la medición del potencial eléctrico generado. Fue inventado por el holandés Einthoven en 1907 (Premio Nóbel en 1924). El instrumento fue mejorado significativamente por el cardiólogo norteamericano Wilson en 1929 con la introducción de las derivaciones unipolares. Electroencefalograma (EEG): Fue inventado en 1929 por Hans Berger Mediante este instrumento se detecta y registra los patrones de la actividad eléctrica del cerebro. Electromiograma: mediante este análisis se estudia el sistema neuromuscular, consiste una prolongación del estudio clínico neurológico. Se fundamenta en el registro de los potenciales de las células excitables. La electro miografía se ocupa del registro de los potenciales evocados involuntariamente por el músculo, mientras que la electro neurografía estudia los potenciales generados luego de una estimulación eléctrica sobre los nervios que mantienen conexión anatómica o funcional con la zona de registro Terapia Electro convulsiva (Electroshock): aplicación de estímulo eléctrico en el cerebro que produce efectos similares a los causados por la epilepsia. Se emplea para el tratamiento de algunas enfermedades mentales Marcapasos: instrumento alimentado con baterías que envía señales eléctricas al músculo cardíaco. Ideado por Hyman en 1927, es empleado externamente al cuerpo en 1956. En 1958 Senning lo utiliza por primera vez incorporado en el cuerpo. Se emplean en aquellos pacientes cuyo corazón late muy lentamente (bradicardia) y eventualmente se puede utilizar en aquellos con una frecuencia cardiaca anormalmente alta (taquicardia). Defibrilador: instrumento que permite aplicar durante un corto tiempo un choque eléctrico de alta energía. Con este procedimiento se detiene la fibrilación (contracciones cardíacas rápidas y descoordinados). DROGAS QUE AFECTAN EL SISTEMA NERVIOSO • Alcohol • Barbitúricos • Cocaína • Heroína • LSD • Nicotina • Anfetaminas • Cafeína • Éxtasis • Inhalantes • Marihuana • Rofinol • Hongos alucinógenos DOBLE CAPA ELÉCTRICA En todos los procesos de electrodo, es decir en aquellos donde el proceso electroquímico se establece en la región que incluye la interfaz electrodo-solución se genera una distribución de cargas (aún cuando no se aplique un potencial al electrodo) conocida como doble capa eléctrica. Es de gran importancia el estudio de los procesos que ocurren a nivel de esta zona puesto que de esta manera se tendrá una mejor comprensión del comportamiento macroscópico del sistema. TEORIA DE LA DOBLE CAPA El estudio de la distribución de carga en la vecindad de la interfase ha sido motivo de interés de científicos desde mediados del siglo XIX, es así que se destacan los aportes realizados por: Helmholtz (1879) Gouy (1910) Chapman (1913) Stern (1924) Grahame (1947) Estos estudios han tenido como propósito elaborar un modelo de doble capa que permita interpretar como varía el potencial eléctrico desde la superficie metálica hasta el seno de la solución. MODELOS DE DOBLE CAPA ELÉCTRICA Teoría de Helmholtz De acuerdo a esta teoría la interfaz se considera similar a un condensador eléctrico, es decir dos placas paralelas cargadas y separadas una distancia d. De acuerdo a esta analogía se puede definir la capacidad por unidad de área de la doble capa eléctrica como: C= ε 4πd Donde ε es la constante dieléctrica del medio. De acuerdo con esa ecuación la capacidad de la doble capa debería ser independiente del potencial. Sin embargo experimentalmente puede verificarse que no solo existe esa dependencia sino que también varía de acuerdo a la concentración iónica de la solución y a la naturaleza de sus componentes. Todo lo anterior indica que el modelo presenta inconsistencias con la realidad por lo que debe ser tenido en cuenta estos factores. Teoría de Gouy-Chapman En la teoría anterior se consideraba que al igual que en la superficie metálica (electrodo) la carga se ubicaba en la superficie, del mismo modo se establecía que el exceso de carga en la solución se ubicaba en una “capa” de solución. Sin embargo esta última suposición no es correcta puesto que existe una distribución de carga hacia el interior de la solución que debe ser tenido en cuenta. En la teoría de Gouy-Chapman se define una capa difusa de iones hacia el interior de la misma En esta interfase la caída de potencial no es función lineal de la distancia. En el metal hay un plano de cargas del mismo signo, mientras que las de signo opuesto se distribuyen del lado de la solución a lo largo de una cierta distancia. En esta teoría se trabajan con dos ecuaciones fundamentales: Potencial eléctrico (Ley de Poisson) 4πp ∆φ = ε Concentración iónica (Ecuación de Maxwell-Boltzman) − zeφ kT Suponiendo que la doble capa se ajusta a una geometría de un paralelepípedo, es decir que tenga superficies equipotenciales paralelas, se llega a la expresión: − z i eφ ∂φ 2 − 4π ∆φ = 2 = z i eC io exp ε kT ∂x resolviendo la ecuación anterior y considerando valores de potencial pequeños tal que se cumpla que − z i eφ << 1 kT se llega a φ = φ o exp(−kx) 50 Esta relación es una buena aproximación para φ o ≤ mV a 25oC z CONSECUENCIAS De acuerdo a este análisis, ahora el potencial eléctrico establecido en la doble capa eléctrica resulta función de: Distancia Concentración del electrolito Valencia del electrolito Constante dieléctrica del medio Temperatura LIMITACIONES DE LA TEORÍA Como limitaciones de la teoría se puede afirmar que se requiere que la concentración iónica Cio sea muy baja para que no exista interacción entre los iones. Asimismo se requiere que la constante dieléctrica sea invariable en todo el medio. C i = C io exp Teoría de Stern En la teoría de Gouy-Chapman los iones se consideran como entidades puntuales, y por lo tanto con posibilidad de acercarse arbitrariamente tanto como se desee a la superficie del electrodo. Esta descripción no es correcta en la medida que los iones no pueden aproximarse a distancias menores que el propio radio iónico. Además de lo anterior si se tiene en cuenta la solvatación de los mismos, el radio ahora será mayor y por lo tanto la máxima aproximación será menor todavía. Stern propuso un modelo de doble capa eléctrica que consiste en la suma de las dos estructuras mencionadas antes, es decir que la diferencia total de potencial a través de la interfase resulta ser entonces la suma de la caída lineal de potencial en la doble capa de Helmholtz y la caída exponencial de potencial en la doble capa difusa. Admitiendo incluso que las dos contribuciones sean del mismo signo o de signo opuesto En este modelo mas completo se define una capa interna, más próxima al electrodo, donde los iones se encuentran específicamente adsorbidos. Esta capa se la conoce como: capa compacta, de Helmholtz o de Stern. El centro de estos iones define un plano, conocido como plano interno de Helmholtz que se encuentra a la distancia de menor acercamiento de los iones adsorbidos específicamente. COMENTARIOS FINALES La estructura de la doble capa puede afectar la velocidad de los procesos electroquímicos que se producen sobre el electrodo. Por ejemplo, una especie electro-activa que no se encuentre adsorbida específicamente sobre el electrodo, podrá acercarse a él solo hasta el plano externo de Helmholtz y por lo tanto “sentirá” un potencial diferente al establecido entre la superficie del electrodo y el seno de la solución. Esta diferencia puede ser importante o no, dependiendo del proceso bajo estudio. Es así que en algunos estudios cinéticos la presencia de la doble capa puede despreciarse, pero en otros casos cuando la concentración de la especie electro activa es muy pequeña, la capacidad de la doble capa eléctrica, y la corriente necesaria para cargarla, debe ser considerada porque incluso puede tener una magnitud superior a la corriente faradaica de interés. ESPESOR TEÓRICO DE LA DOBLE CAPA ELÉCTRICA Analizando la ecuación aproximada derivada en la teoría de Gouy-Chapman se observa que la inversa del parámetro k tiene dimensiones de longitud y caracteriza la disminución espacial del potencial. Por este motivo se toma el valor de 1/k como una medida del espesor de la capa difusa. Este espesor es función de varios parámetros: concentración iónica, temperatura, fuerza iónica, etc. Variación con la concentración iónica Teniendo en cuenta que el parámetro 1/k responde a la ecuación 1 εkT = k 8πe 2 z i C io Para un electrolito 1:1 a 25 oC en H2O, tomando una concentración C* como el cociente entre el número de moles y el número de Avogadro, se tiene la siguiente variación (tomada de Electrochemical Methods. Fundamental and Applications, A.J.Bard y L.P.Faulkner) C*(M) 1 10-1 10-2 10-3 10-4 1/κ(A) 3.0 9.6 30.4 96.2 304 Variación con la fuerza iónica A 20oC , tomando un valor de ε de 80 y teniendo en cuenta la relación k=2,3x109(ΣCiZi2)1/2 Se tienen los siguientes valores representativos Soluciones H2 O NaCl 1x10-4M MgSO4 1x10-4M Agua de mar Espesor 1/k (A) 9000 (aprox 1µm) 310 150 4 TÉCNICAS ELECTROQUÍMICAS PARA EL BIOANÁLISIS VOLTAMETRÍA “IN VIVO” A fines de los años 60 y comienzo de los 70 se realizaron los primeros experimentos con electrodos miniaturizados de pasta de carbono implantados en el cerebro. El propósito era obtener corrientes de oxidación correspondiente a una clase de neurotransmisores, las catecolaminas. Sin embargo, si bien se obtuvieron lecturas de corriente, el método no era selectivo y otras especies interferían en la determinación. Era necesario por lo tanto realizar modificaciones en el procedimiento experimental. Posteriormente esto se mejoró mediante el uso de coberturas de Nafion, un polímero aniónico que redujo la interferencia del ácido ascórbico y otros metabolitos acídicos. También se incorporó el pre-tratamiento electroquímico que permite desplazar los potenciales de oxidación de los interferentes. LIBERACIÓN E INCORPORACIÓN DE NEUROTRANSMISORES Ante la gran dificultad experimental para poder cuantificar la liberación basal de dopamina, se comenzó a emplear una modificación en el procedimiento. Se produce la estimulación eléctrica de los tejidos y se mide la liberación y posterior remoción del neurotransmisor en el espacio extracelular. Esta modificación permite la aplicación de distintas técnicas volta métricas para estudiar la dinámica real del neurotransmisor. La posibilidad de emplear técnicas con gran velocidad de adquisición de datos permite estudiar cuan veloz es el proceso de liberación e incorporación de neurotransmisores. Desde el punto de vista fisiológico es importante es considerar que el cerebro, a diferencia de una celda electroquímica convencional, es un ambiente eléctricamente y electro químicamente activo por lo que la implantación de un electrodo es traumático para las células. De aquí la importancia de utilizar electrodos con el menor diámetro posible, como los electrodos modernos de fibra de carbono de solo 10 µm de diámetro. VOLTAMETRIA EN TIEMPO REAL Para poder detectar la liberación de neurotransmisores en tiempos lo más próximo al real, es posible actualmente emplear voltametría de alta velocidad de barrido. Esto se consigue empleando los electrodos de fibra de carbono de área pequeña mencionados anteriormente. De esta manera, por ejemplo empleando un electrodo de diámetro de 8 Mm. es posible realizar un barrido de potencial en solo 20 ms, lo que implica una velocidad de barrido de aproximadamente 400 V/s. Dado el corto tiempo del barrido es posible realizar varios en un intervalo pequeño de tiempo. Estas modificaciones experimentales son importantes también en el sentido que no interfieren con la actividad neuronal normal. Incluso es posible combinar las determinaciones volta métricas con medidas electrofisiológicas al mismo tiempo, es decir que se monitorea simultáneamente la actividad eléctrica junto a la neuroquímica.