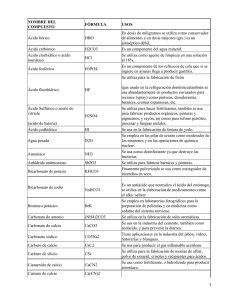
Nombre: - Teach.Chem
Anuncio

Nombre: ______________________ Hora: Fecha del __: _________ Química: Molarity y estequiometría Direcciones: Usando la definición del molarity, las ecuaciones equilibradas dadas, y la estequiometría, solucionan los problemas siguientes. Demostrar su trabajo e incluir las unidades para el crédito completo. 1. El hidróxido de calcio (“cal apagada ") y el ácido sulfúrico reaccionan al sulfato y al agua de calcio del producto según la ecuación equilibrada siguiente: Ca(OH)2 (aq) + CaS04 del H2SO4 (aq) + 2 H2O (l) a. ¿Cuántos litros de hidróxido de calcio de 0.5 M usted necesita para tener 5.5 topos de hidróxido de calcio? b. Encontrar el número de topos del ácido sulfúrico necesarios para reaccionar con 5.5 topos de hidróxido de calcio. c. ¿Si el ácido sulfúrico tiene una concentración de 0.82 M, cuántos litros de ella son necesarios reaccionar con 5.5 topos de hidróxido de calcio? 2. El carbonato de calcio (“piedra caliza ") reacciona con el ácido hidroclórico según la ecuación equilibrada siguiente: CO2 del ácido clorhídrico 2 del CaC03 (aq) + (aq) (g) + CaCl2 (aq) + H2O (l) a. ¿Qué masa del carbonato de calcio es necesaria hacer 1.2 litros de una solución del carbonato de calcio de 1.7 M? b. ¿Sobre qué volumen de ácido hidroclórico de 3.0 M es necesario reaccionar totalmente con la cantidad de carbonato de calcio en la parte 2a? c. ¿De acuerdo con las piezas 2a y 2b arriba, cuántos topos del agua serían producidos? 3. El cloruro de amonio y el hidróxido de calcio reaccionan según la ecuación equilibrada siguiente: 2 NH4Cl (aq) + CaCl2 del Ca(OH)2 (aq) (aq) + 2 NH3 (g) + 2 H2O (l) a. ¿Qué masa del cloruro de amonio es necesaria hacer 1.0 litros de una solución del cloruro de amonio de 2.0 M? b. ¿Qué masa del hidróxido de calcio es necesaria hacer 2.0 litros de una solución del hidróxido de calcio de 2.0 M? c. ¿Cuántos gramos de cloruro de calcio serán hechos cuando 1.0 litros de una solución del hidróxido de calcio de 1.0 M reaccionan con exceso de cloruro de amonio? 4. El cinc y el ácido hidroclórico reaccionan según la ecuación equilibrada siguiente: Zn + 2 ZnCl2 (aq) del ácido clorhídrico (aq) + H2 (g) a. ¿Qué volumen de ácido hidroclórico de 0.1 M reaccionará con 26 gramos de cinc? b. ¿Qué masa del cinc reaccionará con 2.0 litros de ácido hidroclórico de 0.25 M? c. ¿Cuántos litros del hidrógeno usted hará (en STP) si usted reacciona 2.74 L de ácido hidroclórico de 0.45 M con exceso de cinc? Respuestas: 1a. 11.0 L de Ca(OH)2 de 0.5 M (aq) 3a. 107 g NH4Cl 1b. 5.5 mol de H2SO4 3b. Ca(OH)2 de 296 g 1c. 6.71 L de 0.82 M H2SO4 (aq) 3c. CaCl2 de 111 g 2a. CaC03 4a de 204 g. 7.95 L de ácido clorhídrico de 0.1 M (aq) 2b. 1.36 L de ácido clorhídrico de 3.0 M (aq) 4b. Zn 16.4 de g 2c. 2.04 mol de H2O 4c. 13.8 L H2 (en STP)