efectos de la concentración proteica y presión sobre la estructura y
Anuncio

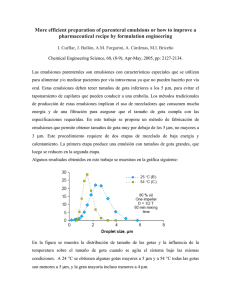
EFECTOS DE LA CONCENTRACIÓN PROTEICA Y PRESIÓN SOBRE LA ESTRUCTURA Y ESTABILIDAD DE EMULSIONES DE ACEITE EN AGUA, PRODUCIDAS CON CASEINATO SÓDICO Y TRATADAS POR ULTRA ALTA PRESIÓN DE HOMOGENIZACIÓN Hebishy E.*, Buffa M., Juan B., Guamis B., Trujillo A. J. Centre Especial de Recerca Planta de Tecnologia dels Aliments (CERPTA), XaRTA, TECNIO, MALTA Consolider, Departament de Ciència Animal i dels Aliments, Universitat Autònoma de Barcelona, 08193 Bellaterra, Barcelona, Spain. [email protected] Palabras clave: emulsión submicrón, molino coloidal, homogenización convencional, ultra alta presión homogenización, estabilidad física y microestructura. RESUMEN La ultra alta presión por homogenización (UHPH) es una nueva tecnología en estudio con aplicaciones en las industrias alimentaria, cosmética y farmacéutica en la obtención de dispersiones o emulsiones finas y estables. En este estudio se prepararon pre-emulsiones (20% aceite girasol + oliva) utilizando un molino coloidal (CM, 5000 rpm / 5 min) que después se sometieron a los tratamientos de homogenización convencional (CH, 15 MPa) o de UHPH (100-300 MPa). Las emulsiones se caracterizaron por estudio de la distribución del tamaño de partícula, su microestructura y propiedades físicas incluyendo la estabilidad al cremado mediante medida del tamaño de partícula (d4.3) en la parte superior e inferior de la emulsión después de un almacenamiento de la muestra de 9 días a temperatura ambiente. Todas las emulsiones CM y CH presentaron un tamaño de partícula elevado (6,03 y 0,6 µm, respectivamente) y separación de fases durante su almacenamiento. Sin embargo, las emulsiones CH producidas con un 1% de proteína presentaron un cremado menor en comparación a aquellas producidas con 5% de proteína, indicando que la utilización de bajas concentraciones de proteína en este tipo de emulsiones mejora su estabilidad física y microestructura, hechos que fueron confirmados por microscopía láser confocal (LCM). Las emulsiones UHPH producidas con un 1% de proteína presentaron (i) un tamaño de partícula elevado (0,212 µm en emulsiones tratadas a 100 MPa) en comparación con aquellas fabricadas con 5% de proteína, (ii) gotas de aceite sin cubierta proteica y (iii) fenómenos de coalescencia (especialmente las emulsiones tratadas a 300 MPa) como fue observado por LCM, parámetros que podrían explicar la baja estabilidad al cremado de estas emulsiones. El incremento de proteína al 5% en las emulsiones UHPH redujo el tamaño de partícula (0,116 y 0,123 µm en emulsiones tratadas a 200 y 300 MPa respectivamente, conteniendo 5% de proteína) y mejoró la estabilidad al cremado de las emulsiones. INTRODUCCIÓN Las emulsiones alimentarias son sistemas complejos ya que pueden contener, además de agua y aceite, proteínas, polisacáridos, tensioactivos de bajo peso molecular, sales, azúcares simples, alcohol, agentes antimicrobianos, colorantes o aromas (McClements, 2005). Las emulsiones alimentarias se producen generalmente en homogeneizadores de alta presión, en molinos coloidales o en reactores discontinuos con mezcladores de alta velocidad. Los homogeneizadores de alta presión son los más usados, ya que estas emulsiones necesitan el desarrollo de propiedades de textura precisas (p.e. en cremas y helados) y un alto grado de estabilidad. La tecnología de ultra alta presión por homogenización (UHPH) se basa en los mismos principios que la homogenización convencional con la gran diferencia de que se pueden alcanzar presiones superiores a 200 MPa gracias al diseño de las válvulas y a la utilización de nuevos materiales. La UHPH en el intervalo de presiones de 150-400 MPa es capaz de (1) producir emulsiones submicrónicas estables durante el almacenamiento, (2) inducir inactivación microbiana y enzimática y (3) conferir nuevas características funcionales debidas a las modificaciones producidas en las estructuras del alimento (Briñez et al., 2007; Datta et al., 2005; Peredaet al., 2006; Picart et al., 2006; Thiebaud et al., 2003; Vannini et al., 2004). Las emulsiones submicrónicas (< 1 µm) producidas por UHPH pueden ser utilizadas como vehículo de compuestos o moléculas bioactivas, lo cual abre grandes expectativas en la creación de aplicaciones en el sector alimentario, aunque también en los sectores farmacéutico y cosmético (Prakash and Thiagarajan, 2011). Es posible formar una emulsión mezclando sólo agua y aceite, sin embargo el sistema es termodinámicamente inestable y las dos fases tienden a separarse rápidamente para formar, debido a la diferencia de densidad entre las dos fases, una capa superior de aceite y una inferior de agua. Para que la emulsión sea estable en el tiempo, es necesario adicionar un agente emulsionante (McClements, 2005; Tcholakova et al., 2006), o compuesto amfifílico caracterizado para una estructura química particular con grupos hidrófilos e hidrófobos que le permite adsorberse en las interfases O/W. Durante la fabricación de la emulsión, la adsorción del agente emulsionante en la superficie de las gotitas formadas se debe hacer rápidamente de forma a disminuir la tensión interfacial entre las dos fases. Este film protector formado alrededor de las gotitas enlentecerá el fenómeno de re-coalescencia de las gotitas entre ellas, permitiendo la formación de emulsiones estables durante un periodo de tiempo razonable garantizando una duración de almacenamiento de producto óptimo (McClements, 2005; Mason et al., 2006). Las proteínas de la leche, especialmente los caseinatos, son buenos emulsificantes y por lo tanto se utilizan como ingredientes en una amplia gama de alimentos y en la formulación de emulsiones alimenticias. El objetivo del presente trabajo fue estudiar la estabilidad física y microestructura de emulsiones O/W preparadas con caseinato sódico (1 y 5%) usando la tecnología UHPH (100300 MPa) en comparación con aquellas producidas por homogenización convencional (CH, 15 MPa). MATERIAL Y MÉTODOS Las emulsiones se prepararon con un 20% de mezcla de aceite de girasol y aceite de oliva (15% +5%, respectivamente) y 80% de una solución de caseinato sódico (1 y 5%) utilizando un sistema de molino coloidal (muestra control) para luego ser tratadas por UHPH a presiones de 100-300 MPa a 25ºC (FPG 11300:400 Hygienic Homogenizer Unit, Stansted Fluid Power Ltd., Essex, UK) o bien por homogeneización convencional a 15 MPa y 55ºC (Niro Soavi, Italia). Cada emulsión se recogió cuidadosamente y se envasó y almacenó a temperatura ambiente durante 9 días y se analizaron los parámetros de estabilidad física inmediatamente después de la preparación de emulsiones. Todo el experimento se realizó por triplicado. La distribución del tamaño de partícula de las emulsiones se midió con un analizador de partículas basado en la dispersión de luz láser (Beckman Coulter Laser LS 230, USA). Las emulsiones se diluyeron con agua (dilución al 20%) para evitar la multiplicidad de efectos de dispersión. El tamaño medio de partícula se reporta como el diámetro de la superficievolumen (d3.2). Se realizaron observaciones de las emulsiones por microscopía laser confocal (LCM) esencialmente como Michalski et al. (2002) describen. La estabilidad de la emulsión se estudió mediante inspección visual y por medida del tamaño de partícula (d4.3) en la parte superior e inferior de un tubo después de un almacenamiento de la muestra de 9 días a temperatura ambiente. RESULTADOS Y DISCUSIÓN Todas las emulsiones CM y CH exhibieron un elevado tamaño de partícula (6,03 y 0,6 micras, respectivamente, Figuras 1a,b) y separación de fases, visualmente observable. Las emulsiones CH mostraron diferencias significativas en el tamaño de partícula (d4.3) en las dos partes de las emulsiones (superior e inferior) tras un periodo de almacenamiento de 9 días, tanto en las producidas a partir de 1% de proteína como las que contuvieron 5% de proteína (Figuras 3a,e), indicando la inestabilidad de estas emulsiones durante su almacenamiento. Sin embargo, las emulsiones CH producidas con 1% de proteína exhibieron un comportamiento de cremado más bajo en comparación a aquellas producidas con 5% de proteína, lo que indica que el 1% de proteína en estas emulsiones es suficiente para cubrir las gotitas de aceite y obtener una emulsión más estable, hecho que se confirmó visualmente y por LCM. Hemar et al. (2001) obtuvieron resultados similares en emulsiones producidas con 30% aceite de soja y con 1% de caseinato sódico, emulsiones que presentaron gotitas individuales sin ningún signo de floculación; sin embargo, al aumentar el contenido de proteína a 3% las emulsiones presentaron una floculación extensa de gotitas de aceite que se confirmó también por LCM. Visualmente las emulsiones UHPH mostraron una excelente estabilidad física, si las comparamos con el resto de emulsiones que presentaron fenómenos de cremado y coalescencia a temperatura ambiente. Las emulsiones UHPH tratadas a 100 MPa y producidas con 1% de proteína presentaron un tamaño de partícula superior (0,212 µm) en comparación con aquellas producidas con 5% de proteína como se muestra en la Fig. 1c. Sin embargo, al aumentar el contenido de proteína a 5%, si bien se redujo el tamaño de partícula y se encontró una mejora de su estabilidad, ésta fue inferior a la presentada por las emulsiones tratadas a 200 y 300 MPa, sugiriendo la realización de un estudio más profundo sobre la cantidad exacta requerida de proteína en este tipo de emulsión. El análisis de partícula (d4.3) durante el almacenamiento de estas emulsiones corroboró estos resultados ya que las emulsiones UHPH tratada a 100 MPa con 1% de proteína mostraron diferencias significativas en el tamaño de partícula en las dos partes de las emulsiones, diferencias que fueron menos acusadas en el caso de las emulsiones producidas con un 5% de proteína (Figuras 3 b,f). Las emulsiones UHPH tratadas por 200 y 300 MPa, producidas con 1% de proteína y en comparación a las elaboradas con 5% de proteína presentaron (i) una distribución de tamaño de partícula bimodal (Figuras 1d,e), (ii) fenómenos de coalescencia (sobre todo en las emulsiones tratadas a 300 MPa) durante el almacenamiento como indica el parámetro d4.3 y observable en las micrografías obtenidas por LCM (Fig. 2d,e, y Fig. 3c,d), y (iii) gotitas de aceite sin cubierta proteica como fue observado por LCM (Fig. 2d,e), hechos que podrían explicar la relativa baja estabilidad al cremado de estas emulsiones. Aumentando el contenido de proteína a 5% en las emulsiones, el tratamiento de UHPH redujo el tamaño de partícula (0,116 y 0,123 µm en emulsiones tratadas a 200 y 300 MPa, respectivamente) y cambió la distribución de partículas a monomodal (Fig. 1d,e) mejorando la estabilidad de las emulsiones evitando los fenómenos de cremado (Fig. 2 i,j, y Fig. 3g,h). CONCLUSIONES Este estudio muestra el potencial de la ultra alta presión por homogenización en la preparación de emulsiones compuestas por aceites vegetales y caseinato, reduciendo su tamaño de partícula e incrementando su estabilidad física utilizando un 5% de proteína en su formulación con la aplicación de presiones de 200 y 300 MPa. Por el contrario, con la utilización de la homogenización convencional sólo se obtuvieron emulsiones con una estabilidad inferior a las obtenidas por UHPH, mediante el uso de bajas concentraciones de proteína. a c b d e Figura 1. Distribución de tamaño de partícula en emulsiones producidas por CM (a), CH (b) UHPH a 100 (c), 200 (d) y 300 MPa (e) estabilizadas con caseinato de sodio (1 y 5%). 1% 5% a f b g c h d i e j Figura 2. Imágenes del microscopio laser confocal de emulsiones obtenidas por CM (a,f), CH (b,g) y emulsiones UHPH homogeneizadas a 100 (c,h), 200 (d,i) y 300 MPa (e,j) estabilizadas por caseinato de sodio (1 y 5%). a e b f c g d h Figura 3. Distribución de tamaño de partícula (d4.3) en diferentes partes (T: arriba y B: abajo) de las emulsiones estabilizadas con caseinato sódico (1 y 5%) y tratadas por CH (a,e) y UHPH tratadas a 100 (b,f), 200 (c,g) y 300 MPa (d,h), después de 9 días de almacenamiento a temperatura ambiente. AGRADECIMIENTOS Los autores agradecen a la Secretaría de Estado de Investigación, Desarrollo e Innovación (Ministerio de Economía y Competitividad) el soporte financiero otorgado a esta investigación (AGL2011-26766). E. Hebishy agradece a la Agencia Española de Cooperación Internacional para el Desarrollo (Ministerio de Asuntos Exteriores y de Cooperación) la beca otorgada para desarrollar este trabajo de investigación. BIBLIOGRAFÍA Briñez W. J., Roig-Sagués A. X., Hernández-Herrero M. M., Guamis-López B. (2007) Inactivation of Staphylococcus spp. strains in whole milk and orange juice using ultra highpressure homogenization at inlet temperatures of 6 and 20 °C, Food Control, 18, 1282– 1288. Datta N., Hayes M. G., Deeth H. C., Kelly A. L. (2005) Significance of frictional heating for effects of high pressure homogenization on milk, Journal of Dairy Research, 72, 393–399. Hemar Y., Tamehana M., Munro P.A., Singh H. (2001) Influence of xanthan gum on the formation and stability of sodium caseinate oil-in-water emulsions, Food Hydrocolloids 15, 513–519. Long Z., Zhao M.M., Zhao Q.Z., Yang B., Liu L.Y. (2011) Effect of homogenization and storage time on surface and rheology properties of whipping cream, Food Chemistry, vol. 131, pp. 748–753. Mason T.G., Wilking J.N., Meleson K., Chang C.B., Graves S.M. (2006) Nanoemulsions: formation, structure, and physical properties, Journal of Physics-Condensed Matter, 18, 635-666. McClements J.D. (2005) Food Emulsions, Principles, practices and techniques. Boca Raton: CRC Press. Michalski M.C., Cariou R., Michel F., Garnier C. (2002) Native vs. damaged milk fat globules: membrane properties affect the viscoelasticity of milk gels, Journal of Dairy Science 85, 2451-2461. Pereda J., Ferragut V., Guamis B., Trujillo A.J. (2006) Effect of high-pressure homogenisation on natural-occurring micro-organisms in bovine milk. Milchwissenschaft– Milk Science International, 61, 245–248. Picart, L., Thiebaud, M., René , M., Guiraud, J. P., Cheftel, J. C., & Dumay, E. (2006). Effects of high pressure homogenization of raw bovine milk on alkaline phosphatase and microbial inactivation. A comparison with continuous short-time thermal treatments. Journal of Dairy Research, 73, 454–463. Prakash, R. T and Thiagarajan, P. (2011). Nanoemulsions for drug delivery through different routes. Research in Biotechnology, 2 (3): 01-13. Tcholakova, S., Denkow, N.D., Ivanov, I.B., Campbell, B. (2006). Coalescence stability of emulsions containing globular milk proteins. Advances in Colloid and Interface Science 123, 259-293. Thiebaud, M., Dumay, E., Picart, L., Guiraud, J. P., & Cheftel, J. C. (2003). High-pressure homogenisation of raw bovine milk. Effects on fat globule size distribution and microbial inactivation. International Dairy Journal, 13, 427–439. Vannini, L., Lanciotti, R., Baldi, D., & Guerzoni, M. E. (2004). Interactions between high pressure homogenization and antimicrobial activity of lysozyme and lactoperoxidase. International Journal of Food Microbiology, 94, 123–135.