log( / ) 7.96 1780/( / ) P Torr TK
Anuncio

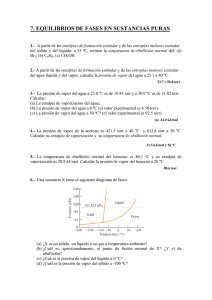
Equilibrio de fases en sistemas de una sustancia pura. Resolver el problema 4 con una hoja de cálculo usando regresión lineal. 1. La transición Sn(s,gris)Sn(s,blanco) está en equilibrio a 18°C y 1 bar. Si S=8.8 J/K mol para la transición a 18°C y si las densidades son 5.75 g/cm3 para el estaño gris y 3 7.28 g/cm para el blanco, calcúlese la temperatura de la transición con una presión de 100 bar. 2. La presión de vapor del diclorometano a 24.1°C es 400 Torr y su entalpía de vaporización es 28.7 kJ/mol. Estimar la temperatura de ebullición del diclorometano a 500 Torr. 3. Antes de descubrir que el freón 12 era dañino para la capa de ozono, éste era utilizado frecuentemente como un agente dispersante en los sprays para el cabello. Su entalpía de vaporización en su punto normal de ebullición (-29.2°C) es de 20.25 kJ/mol. Estimar la presión de una botella de spray para cabello (que usa freón 12) expuesta a la luz del sol a 40°C. Asumir que la entalpía de vaporización es constante en este intervalo de temperatura. 4. La presión de vapor de la cetona carbona (M=450.2 g/mol) que es un componente de la hierbabuena, depende de la temperatura de la manera siguiente: t/°C 57.4 100.4 133.0 157.3 203.5 227.5 P/Torr 1.00 10.0 40.0 100 400 760 Determinar a) la temperatura normal de ebullición b) la entalpía de vaporización de la carvona. 5. La presión de vapor del benceno entre 10°C y 30°C está dada por la ecuación log( P / Torr ) 7.96 1780 /(T / K ) . Calcular: a) la entalpía de vaporización b) la temperatura normal de ebullición del benceno. 6. El yodo hierve a 183°C, la presión de vapor del líquido a 116.5° es 100 Torr. Si H°fus=15.65kJ/mol y la presión de vapor del sólido es 1 Torr a 38.7°C, calcúlense: a) la temperatura y la presión del punto triple b) H°vap y S°vap c) G°de formación del I2(g) a 298.15K 7. Construir el diagrama de fases para el benceno cerca de su punto triple (36 Torr y 5.50°C) usando los siguientes datos: H°fus=10.6kJ/mol, H°vap=30.8 kJ/mol, (s)=0.891 g/cm3, (l)=0.879 g/cm3 8. La entalpía de fusión del mercurio es 2.292 kJ/mol, y su punto normal de fusión es de 234.3K con un cambio de volumen molar de +0.517 cm3/mol al fundir. ¿A qué temperatura se congelaría el fondo de una columna de 10 m de mercurio cuya densidad es de 13.6 g/cm3 9. Combinando la distribución barométrica con la ecuación de Clausius-Clapeyron, dedúzcase una ecuación que relaciones el punto de ebullición de un líquido con la temperatura de la atmósfera (Ta) y la altura (h). 10. Para el agua la temperatura de ebullición es 100°C a 1 atm de presión y H°vap=40.670 kJ/mol, ¿cuál será la temperatura de ebullición del agua en a) la ciudad de México que se encuentra a 2240 m sobre el nivel del mar en un día de primavera cuando la temperatura es de 24°C?; b) en la cima del Popocatépetl (5500 m sobre el nivel del mar) el mismo día de primavera siendo la temperatura ambiente de 0°C?; c) el punto más alto del Monte Everest (8840m sobre el nivel del mar) el mismo día de primavera siendo la temperatura ambiente de -25°C?