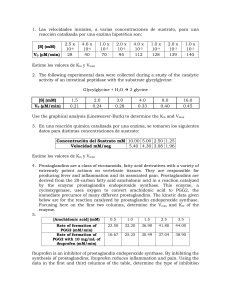
PROBLEMAS DE INHIBICIÓN 1. Se estudia la cinética de una
Anuncio

PROBLEMAS DE INHIBICIÓN 1. Se estudia la cinética de una enzima en ausencia y presencia de un inhibidor A, a una concentración 10 mM. La velocidad inicial viene dada en función de la concentración de sustrato. Los datos obtenidos son: [S] (mM) 1.25 1.67 2.50 5.00 10.00 V (mM min-1) Sin inhibidor Inhibidor A 1.72 0.98 2.04 1.17 2.63 1.47 3.33 1.96 4.17 2.38 a. Determina Vmax y KS en ausencia y presencia del inhibidor b. ¿Qué tipo de inhibición se produce? c. Calcula la constante de disociación (Ki) de la reacción de inhibición. Solución: Graficar 1/v versus 1[S] 1.2 1 y = 0.8582x + 0.3369 0.8 1/Vo 0.6 1/Vi 0.4 y = 0.4843x + 0.1951 0.2 0 0 0.2 0.4 Sin inhibición 1 1 Vmax = = = 5.13mM / min b 0.1951 K S = Vmax * (m ) = 5.13 * 0.4843 = 2.48mM Con inhibición 1 1 app V´max = = = 2.97 mM / min b 0.3369 app K Sapp = Vmax * (m ) = 2.97 * 0.8582 = 2.55mM Comaprando: 0.6 0.8 1 app Vmax > Vmax K S ≈ K Sapp Por lo tanto es una INHIBICIÓN NO-COMPETITIVA KI = [I ] Vmax −1 app Vmax = 10mM = 13.75mM 5.13mM / min −1 2.97mM / min 2. En un experimento se midió la tasa inicial de una reacción enzimática, v, a varias concentraciones de substrato [S]. La concentración de la enzima es 10 nM. Se graficó 1/v versus 1/[S] y se observó una línea recta en la cual el intercepto-y es 0.005 nM-1 seg y la pendiente es 200 seg. ¿Cuál es el valor de KM y el de Vmax para esta reacción enzimática? ¿Cuál es el valor de kcat para esta enzima? ¿Determine el coeficiente de especificidad? 30 µM de un inhibidor, E, es adicionado y se observó que el interceptoy es 0.0065 nM-1 seg y la pendiente es 260 seg. ¿Qué tipo de inhibición se observó? ¿Cuál es el valor de Ki para el inhibidor con esta enzima? Solución: Se observa que se utilizó la ecuación de Lineweaver-Burk 1 KM 1 1 = + v Vmax [S ] Vmax 1/v 1/Vmax Los datos del problema son: m = 200 s b = 0.005 s nM-1 KM/Vmax -1/KM 1 = 200 ⋅ nM ⋅ s −1 0.005 K M = 200 ∗ Vmax = 200 ∗ 200 = 40,000 ⋅ nM Sabemos que Vmax = kcat [E]t, por lo tanto V 200 ⋅ nM ⋅ s −1 k cat = max = = 20 ⋅ s −1 [E ]t 10 ⋅ nM El coeficiente de especificidad es: k 20 ⋅ s −1 α = cat = = 0.0005 ⋅ s −1 nM −1 K M 40,000 ⋅ nM En presencia del inhibidor tenemos m = 260 s b = 0.0065 s nM-1 Vmax = 1/[S] 1 = 153.846 ⋅ nM ⋅ s −1 0.0065 = 260 ∗ Vmax = 260 ∗ 153.846 = 40,000 ⋅ nM app Vmax = K Mapp K M = K Mapp , Se observa que: app Vmax > Vmax y Por lo tanto se trata de una Inhibición no competitiva, entonces app Vmax = Vmax [I ] 1 + K i Despejando Ki Ki = [I ] V max app V max −1 = 30,000 = 100,000 ⋅ nM 200 −1 153.846 3. Para una reacción enzimática en presencia de un inhibidor competitivo, la velocidad de reacción observada a una concentración de sustrato [S]i = 1.5 x 10-3 M es igual a la velocidad de reacción sin el inhibidor a una concentración de sustrato [S]0 = 7.69 x 10-5 M. Calcule la constante de inhibición, Ki, del inhibidor si su concentración [I] = 3.7 x 10-4 M. Solución: Para un inhibidor competitivo la relación [S]0 a [S]i para observar una misma velocidad es: [S ]i = [S ]0 1 + [I ] Ki Despejando Ki [I ] 3.7 x10 M −5 [S ]i − 1 = 1.5x10 −3 M = 2x10 M −1 [S ]0 7.69 x10 −5 M −4 Ki =