Efectos Adversos de los Me- dicamentos. Historia. Incidencia
Anuncio

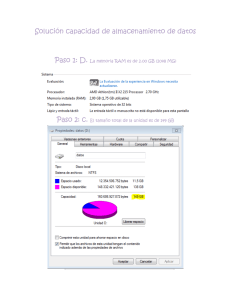
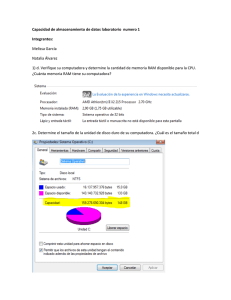
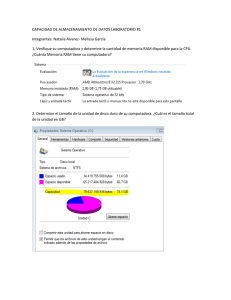
Efectos Adversos de los Medicamentos. Historia. Incidencia. Clasificación de los Efectos Adversos. i Dr. Jesús Frías Iniesta La prueba de oro en la investigación clínica actual. El ensayo clínico. Las fases administrativas de un ensayo clínico Sujetos Fase I Fase II Sanos Pacientes Fase III Pacientes Fase IV Pacientes Tamaño muestral Criterios de selección Objetivo Diseño PK/PD Tolerabilidad No controlados o controlados con placebo Restringidos Dosis-resp Eficacia preliminar Controlados (placebo o estándar) <3000 Amplios Eficacia Seguridad >3000 Condiciones de autorización Efectividad Seguridad Eficiencia <20 <300 - Controlados (placebo o estándar) Controlados con terapéutica estándar ESTADO ACTUAL DEL TEMA i El 6% de todos los ingresos hospitalarios son atribuibles a RAM con una estancia media debida a RAM de 9 días. Entre el 20-51% se pueden prevenir. i El 3% de los nuevos medicamentos aprobados tuvieron que ser retirados por razones primarias de seguridad (datos de España, EEUU y Reino Unido entre 1974-1993). Adverse drug reactions in hospital patients.A systematic review of the prospective and retrospective studies Bandolier Extra. June 2002 En el Reino Unido i i Entre 1972 y 1994, de 583 nuevas sustancias activas aprobadas, se retiraron 59 (10%). El 59% por razones comerciales, el 39% por razones de seguridad, el 2% por problemas de eficacia. (Jefferys et al. Br. J. Clin Pharmacol 1998; 45:151-156) En Estados Unidos de América. i i i i Entre 1996 y 1999 se produjeron 59 cartas alertando sobre problemas de seguridad en la página web de la FDA. El tiempo medio entre la comercialización y la noticia fue de 26 meses (rango 0-312 meses) En el 8% la acción fue añadir un rectángulo negro de PRECAUCIÓN a la información del producto. En un 16% (9) el fármaco fue retirado del mercado entre 0 a 39 meses después de la primera carta, media 9 meses. (Kwong KC et al Pharmacoepidemiology and Drug Safety 2000; 9:S28) En el mundo. i i En las últimas 4 décadas se han retirado por motivos de seguridad 121 productos farmacéuticos. 8 Sólo en Europa el 42% 8 Sólo en Norteamérica el 5% 8 Sólo en Asia pacífico el 3% 8 En más de un continente el 50% La mitad en los 5 primeros años de comercialización y 1/3 en los dos primeros años. (Fung M et al. Drug Information Journal 2001; 35:293-317) Evolución temporal de la retirada de medicamentos 40 Porcentaje de retiradas N= 121 40 35 31 30 25 20 15 10 17 12 5 0 1960-69 1970-79 1980-89 1990-99 Es 14 12 gé si an co ti s de pr va es iv so os di la ta do an re es s or ti ex m ul íg an en te os s de lS NC ba rb it an úr ti ic hi os st am ín ic os an al AI N Clases de fármacos más frecuentemente retirados 13 10 8 8 6 4 7 6 4 4 4 2 0 3 Razones más frecuentes para su retirada 30 25 20 15 10 5 0 s s is as as ar as as s ón ica so l le c c i c c e i i u i u a i cc tr át én óg sc og óg Ab en a á l l l g a p i r o R o e u ro te ov no at H at i u i iq n e c d s I m r P N em ar er H C Ca D Algunas retiradas de farmacos recientes FARMACO CAUSA RETIRADA Medios de contraste Alemania. Por iónico asociación de alter. Adversas graves del tipo hipotensión, arritmias, edema pulmonar y trast renales MIBEFRADILO Laboratorio por interacciones con un gran nº de fármacos SERTINDOL USA. 27 muertes, 13 súbitas PROXIBARBAL Francia. 38 casos de trombopenia inmunoalérgica TOLCAPONE Retirada paulatina en todo el mundo. Reacciones hepatobiliares A 6-Julio-1998 1998 1998 1998 1998 EJEMPLOS DE RAM i i i i i i i i i i i agranulocitosis H. colestásica pancreatitis rabdomiolisis ruptura del tendón de aquiles convulsiones S. Depresivo S. de Stevens Johnson hemorragia digestiva insuficiencia mitral hemorragia i i i i i i i i i i i ticlopidina antiH2 valproico Inh HMGCoA quinolonas imipenem isotretinoina TMP-SMX FANEs anorexígenos IRS EFECTOS DE UN MEDICAMENTO Efectos terapéuticos - < Morbilidad - < Mortalidad -Alta frecuencia > Placebo Efectos adversos / toxicos - > Morbilidad - > Mortalidad -baja frecuencia > Placebo OBJETIVOS DEL TRATAMIENTO: BALANCE BENEFICIO / RIESGO ACEPTABLE. Farmacovigilancia: El desastre de la Talidomida. HISTORIA DE LA FARMACOVIGILANCIA 1930 i 6-12-1961 i 1961-1965 i 1965-1966 i 1968 i 1970 i Síndrome oculomucocutáneo con practolol. 1975 1978 1980 1997 i Traslado del mismo a Ginebra. i Traslado del Proyecto a Uppsala (Suecia). MEDICAID Inman (Southampton) PEM. 200.000 notificaciones/año procedentes de 47 países. i i Bradford Hill difunde las teorías de Fisher sobre randomización, azar y sesgos. Carta al Editor en Lancet asociando una epidemia de focomelia al consumo de Talidomida. Australia, Italia, Holanda, N. Zelanda, Suecia, UK, USA y Alemania inician un SNE de sospechas de RAs. Finney (Escocia), Cluff (Baltimore), Jick y Slone (Boston) monitorización intensiva intrahospitalaria. Proyecto internacional de monitorización patrocinado por la OMS. Definiciones i i i i Acontecimiento adverso Reacción adversa Farmacovigilancia Farmacoepidemiología Definición de RAM i Una respuesta a un fármaco que es nociva e involuntaria, que se produce a dosis utilizadas normalmente en el hombre para la profilaxis, diagnóstico o tratamiento de una enfermedad, o para la modificación de funciones fisiológicas (OMS y Directiva 93/39 de la UE). i SINÓNIMOS Y TÉRMINOS RELACIONADOS: Efecto indeseable, Evento adverso, Enfermedad yatrogénica, Efecto colateral, Efecto secundario. Definiciones i ACONTECIMIENTO ADVERSO 8 Cualquier experiencia no deseada que ocurre en un paciente tratado con un un producto farmacéutico esté o no relacionada con el producto medicinal (CPMP 1995) Farmacovigilancia “Es la actividad de salud pública destinada a la identificación, cuantificación, evaluación y prevención de los riesgos del uso de los medicamentos” CLASIFICACIÓN DE LAS RAM i TIPO A (exageradas) i TIPO B (aberrantes) i TIPO C RAM TIPO A i Características 8 Relacionadas con el mecanismo farmacológico 8 Frecuentes 8 Relacionadas con la dosis 8 Reproducibles de forma experimental 8 Identificadas habitualmente precomercialización i Problemas 8 Cuando sólo afecta a una minoría de la población 8 Cuando la relación con la dosis no es fuerte 8 Cuando el evento es trivial 8 Cuando no se puede reproducir experimentalmente 8 Cuando el mecanismo es aún desconocido RAM TIPO B i Características 8 Mecanismo inmunológico o ‘idiosincrático’ 8 Frecuencia baja (< 1:1000) 8 Graves 8 Inesperadas e impredecibles 8 Difíciles de detectar i A favor 8 Cuando el evento tiene una frecuencia basal baja 8 Cuando la secuencia temporal es característica o el tiempo de latencia corto Tipos de Reacciones Adversas. Clasificación de Rawlins y Thompson. Reacciones tipo A Reacciones tipo B Mec. producción Conocido Desconocido Dosis-dependencia si no Incidencia Alta Baja Mortalidad Baja Alta Detección precoz si no Tratamiento Disminuir dosis Retirar RAM TIPO C i Características 8 Nueva morbilidad o cambios en la frecuencia natural de enfermedades 8 Relativamente frecuentes 8 Efecto sobre la salud pública 8 En un paciente individual discernir entre efecto causal o coincidente es imposible 8 No existe relación temporal característica ¿Como se evalúa la seguridad de un medicamento? EFICACIA Alta frecuencia > Placebo ++++ ++ SEGURIDAD Baja frecuencia > Placebo ENSAYO CLINICO ++ ESTUDIOS OBSERVACIONALES +++ NOTIFICACION ESPONTANEA ++++ Métodos utilizados para establecer la seguridad de los fármacos i PRECOMERCIALIZACION-Ensayos clínicos i POSTCOMERCIALIZACION 8 Estudios descriptivos observacionales 8 Series de casos 8 S. de Notificación Espontánea de RAM. 8 Estudios analíticos observacionales 8 Estudios de casos y controles 8 Estudios de cohorte 8 E. de eventos ligados a la prescripción 8 Ensayos en fase IV Los problemas en la evaluación de la seguridad de los medicamentos. i El primer problema: La detección 8 Los i El métodos de detección y el riesgo basal segundo problema: La causalidad 8 Asociación. i El tercer problema: Definiendo el riesgo 8 balance i El Los algoritmos beneficio/riesgo cuarto problema: Las consecuencias 8 Las medidas reguladoras Los números I -La ProbabilidadIncidencia de la RA 1/100 1/500 1/1.000 1/5.000 1/10.000 1/50.000 Nº de pacientes tratados 300 1.500 3.000 15.000 30.000 150.000 Tamaño de la muestra necesario para tener un 95% de probabilidad de observar una RA. Los problemas i El primer problema: La detección 8 Los i El métodos de detección y el riesgo basal segundo problema: La causalidad 8 Asociación. i El tercer problema: Definiendo el riesgo 8 balance i El Los algoritmos beneficio/riesgo cuarto problema: Las consecuencias 8 Las medidas reguladoras La relación causal i i la mayoría de los efectos adversos al uso de los medicamento son clínicamente y patológicamente indistinguibles de esos mismos eventos cuando ocurren en pacientes no tratados. La forma de establecer la relación causal en farmacoepidemiologia se basa en una aproximación probabilística. Los números II -La CasualidadFrecuencia por separado Prevalencia de la utilización del fármaco Incidencia de la enfermedad Incidencia de la aparición simultánea Población española Casos en España 1/100 individuos 40/1.000.000/año 1/100 × 40/1.000.000/año = 4/10.000.000/año 38.000.000 4/10.000.000/año × 38.000.000 = 15 casos/año Los números III -La Asociación- Incidencia espontánea en no tratados 1 por 10 1 por 100 1 por 1000 Incidencia adicional en tratados 1 por 100 1 por 1.000 1 por 10.000 20.000 3.200 1.300 2.000.000 220.000 32.000 200.000.000 22.000.000 2.300.000 Número de pacientes que deben recibir un nuevo fármaco, en un ensayo clínico, con dos grupos de tratamiento de igual tamaño, para tener un 95% de probabilidad detectar el incremento de riesgo. Imputabilidad ¿cómo se establece la asociación? i i CASO INDIVIDUAL 8 algoritmo. 8 bayesiana. Items en la evaluación del algoritmo: 8 8 8 8 8 secuencia temporal de inicio. evolución con la retirada. reexposición. causas alternativas conocimiento previo i GRUPO DE CASOS 8 8 8 8 8 8 fuerza de la asociación, dosis-respuesta, temporalidad, especificidad, plausibilidad, reversibilidad. Los problemas i El primer problema: La detección 8 El i El riesgo basal y los métodos de detección segundo problema: La causalidad 8 Asociación. i El tercer problema: Definiendo el riesgo 8 balance i El Los algoritmos beneficio/riesgo cuarto problema: Las consecuencias 8 Las medidas reguladoras Seguridad vs riesgo i Para que las Autoridades aprueben la comercialización de un medicamento éste debe haber demostrado que es seguro y eficaz. i Ningún i Un fármaco es completamente seguro. fármaco es seguro si su riesgo es aceptable. Seguridad i La evaluación de la seguridad requiere tres tipos de actividades 8 1.-Identificar el riesgo 8 2.-Estimarlo 8 3.-Valorar su aceptabilidad El riesgo y su percepción i i ¿Qué es y como se percibe un riesgo? Una vez definido el tipo, descripción y frecuencia de aparición de un determinado efecto adverso asociado al uso de un medicamento queda por establecer la relevancia clínica de este fenómeno, que tampoco es cuestión fácil. En realidad, la relevancia clínica de un efecto adverso puede ser más o menos subjetiva y depende sobre todo de la frecuencia y de la gravedad, aunque también de lo evitable que sea el acontecimiento y de la tolerabilidad o impresión que se tenga sobre ello. Aceptación del Riesgo I i En relación al evento adverso 8 1.- Gravedad 8 2.- Intensidad 8 3.- Frecuencia 8 4.- ‘Enfermedades malditas’ 8 5.- Periodo de latencia corto o largo 8 6.-Afecta a subgrupos sensibles 8 7.-Grado de conocimiento Aceptación del Riesgo II i En relación al factor de exposición 8 1.- Esencial u opcional 8 2.- Alternativa disponible 8 3.- Voluntaria 8 4.- Mala utilización Los problemas i El primer problema: La detección 8 El i El riesgo basal y los métodos de detección segundo problema: La causalidad 8 Asociación. i El tercer problema: Definiendo el riesgo 8 balance i El Los algoritmos beneficio/riesgo cuarto problema: Las consecuencias 8 Las medidas reguladoras La toma de decisiones i Medidas administrativas i Comunicación del riesgo 8 Instituciones 8 Profesionales 8 Usuarios i Estrategias de prevención