Algunas aplicaciones de las reacciones redox: Baterias
Anuncio

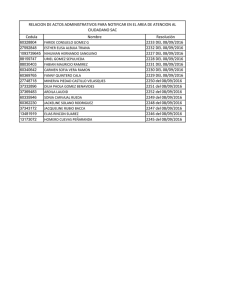
Algunas aplicaciones de las reacciones redox: Baterias Elaborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM Q U Í M I C A A N A L Í T I C A I C L AV E 1402 G rupo 13, s em es tre 2010-1 Baterias “secas”. Celda de Leclanche Zn Catodo 2 NH4+ + 2 MnO2 + 2 eZn + 2 NH4+ + 2 MnO2 E0anodo= -0.76V 2+ Zn + 2 e- Mn2O3 2+ Zn Anodo + 2 NH3 + OH2 + 2 NH3 + Mn2O3 + OH2 E0catodo= + 0.72V (basico) + 1.23V (acido) Como la pasta que contiene el NH4Cl tambien contiene almidon, se degrada con el tiempo de vida util de la bateria y no se puede inducir la reaccion en sentido contrario. De las primeras baterias comerciales de produccion masiva. No tiene un componente fluido. Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM Baterias “humedas” de uso general. Celdas alcalinas. 2 Zn + KOH MnO2 2 ZnO + Mn3O4 Reaccion similar a la celda de Leclanche, pero utiliza como electrolito un hidroxido alcalino en disolucion acuosa (KOH). Como la conduccion de los electrones se da a traves del electrolito, este cambia su composicion y se degrada, por lo que la induccion de la reaccion inversa no es posible al terminar la vida util de la celda. Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM Celdas de Mercurio + 2 OH- OH2 + 2 e- + OH2 + 2 e- Anodo Hg + 2 OHCatodo HgO ZnO Zn(Hg) HgO + Zn(Hg) + E0anodo= -0.76V ZnO + Hg E0catodo= + 0.587V Como no existen cambios en la composicion del electrolito, ya que en la reaccion global solo se involucran solidos y elementos, la bateria suminstra un voltaje mas constante que la celda de Leclanche, tiene una capacidad mayor y vida mas larga. Aplicaciones: Marcapasos, relojes electricos, fotometros, etc. Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM Acumuladores de plomo-acido Catodo PbO2 Pb + + + Pb SO4 2- PbSO4 PbSO4 4H + + SO4 2- + 2 e- PbO2 + 4H + + 2 SO4 2- E0anodo= -0.3363V Anodo + 2 e+ 2 OH2 2 PbSO4 + 2 OH2 E0catodo= +1.68 V Es un conjunto de 6 celdas identicas, con una disolucion de H2SO4 que actua como electrolito. A diferencia de las celdas de Leclanche, de mercurio y alcalinas, se puede inducir la reaccion inversa al aplicar un voltaje externo al anodo y al catodo (electrolisis), y por lo tanto se puede recargar. Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM Sobrerecarga de acumuladores de plomo-acido Induccion de formacion de Pb(II) y Pb(IV) con la aplicacion de voltaje externo. (“pasar corriente”) + 2 OH2 Pb + H2SO4 Pb 2 Pb + H2SO4 + 2 OH2 PbO2 Se induce esta reaccion por electrolisis al recargar la bateria. + + 4 e- + 4 H + PbSO4 + 2 e- + 2 H PbO2 2H2O <------> 2H2 + O2 + PbSO4 + 6 e- + 6 H + Mezcla explosiva Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM Celdas de litio (principios basicos) El Li tiene el potencial de reduccion mas negativo (por lo tanto es el reductor mas fuerte de todos los metales). Se usa un electrolito no acuoso, que permite el flujo de iones Li+ del anodo al catodo, a la vez que separa los electrodos (Li es demasiado reactivo como para ponerse en contacto directo). Electrolitos: Disolventes aproticos y lo suficientemente polares para disolver las sales de Li. Se evtia utilizar disoluciones acuosas, ya que el Li reacciona con el agua para formar H2. Ejemplos: Acetonitrilo, Dioxano, Butirolactona, DMSO, THF. Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM Celdas de litio (ejemplo) Reaccion principal de Li-ion Reaccion en la celda tipo Anodo LiC6 (s) + CoO2 (s) + Li (solv) + eLiC6 (s) + CoO2 (s) E0anodo= -3.03 V -3.86 V + Li (solv) + 6 C (s) + e- LiCoO2 (s) Catodo 6 C (s) + LiCoO2 (s) E0catodo= +0.57 V La reaccion es reversible al aplicarle corriente en direccion inversa y la vida util es muy larga, ya que los electrolitos organicos tardan mas en degradarse que los electrolitos acuosos. Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM Celdas de combustible. Anodo 2H2 (g) + 4OH- (ac) <-----> 4H2O (l) + 4 eCatodo O2 (g) + 2H2O (l) + 4 e- <-----> 4OH- (ac) O2 (g) + 2H2(g) <-----> 2H2O (ac) E0anodo= -0.83 V E0catodo= +0.40 V Se utilizan catalizadores de Ni en el anodo y de Ni y NiO en el catodo. En los modelos mas recientes tiene una etapa “reformadora” de gas natural, metanol, metano, etc. para producir hidrogeno. Amigables con el ambiente al no tener residuos. Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM Tecnologia post-holocausto (!!??) Elaborado por: Gustavo Gomez Sosa, Facultad de Quimica UNAM