SEMINARIO Nº 9 : Propiedades Coligativas
Anuncio

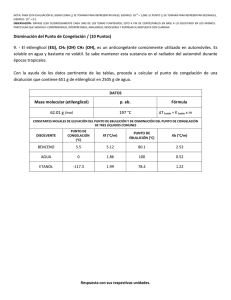
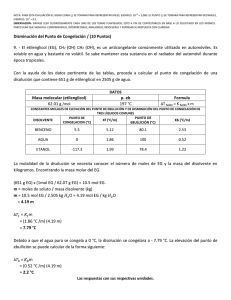
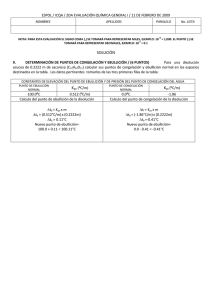
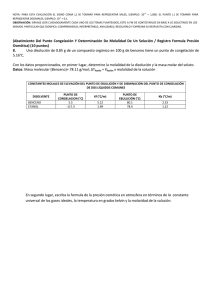
Cátedra de Introducción a la Química para Ciencias Naturales – UNLP - 2008 SEMINARIO Nº 9 : Propiedades Coligativas 1.- a) Indique qué entiende por propiedades coligativas y cuáles son, b) defina qué entiende por elevación del punto de ebullición y por disminución del punto de congelación, c) ¿cómo está relacionada, la disminución de la presión de vapor con el aumento del punto de ebullición en una dada disolución? 2.- Explique porqué se utiliza como unidad de concentración la molalidad para los cálculos de elevación del punto de ebullición y de descenso del punto de congelación y la molaridad para los cálculos de presión osmótica. 3.- Dadas las siguientes soluciones acuosas determine, cuál de ellas presentará el mayor punto de ebullición y cuál, el mayor punto de congelación: (kc = 1,86ºC/m, ke = 0,52ºC/m) a) KBr 1m (i = 1,77), b) KBr 0,1m (i = 1,88), c) sacarosa 0,1 m (no electrolito). 4.- Considerando valores ideales de i, estime: a) el punto de congelación, para cada una de las soluciones acuosas 0,02 m dadas a continuación: i) LiClO4, ii) Cr(NO3)3, iii) K2CrO4. b) el punto de ebullición para una solución acuosa 0,1 m de K2CO3. ke = 0,52ºC/m c) ¿cómo se compara el valor obtenido en el punto b, con el punto de ebullición verdadero de dicha solución? (i = 2,45). ¿Podría justificar a que se debe la diferencia? 5 - Se tienen dos disoluciones acuosas, una de MgCl2 0,0015 m y otra de urea 0,0035 m, indique, sin realizar cálculos, cuál de ellas considera que presentará: a) mayor presión de vapor; b) punto de congelación más alto, c) punto de ebullición más alt. Justifique su respuesta. 6.- Un anticongelante usado comúnmente en los radiadores de los autos es el etilenglicol C2H4(OH)2. a) ¿cuántos gramos de etilenglicol se deberán agregar a 1 Kg de agua, para producir una solución que congele a –10ºC (Peso molecular del etilenglicol = 62 g/mol); b) se prepara una disolución anticongelante 3 3 con 50 cm de etilenglicol (= 1,12 g/cm ) en 50 g de agua. Calcule el punto de congelación de esta mezcla. Dato: kc= 1,86ºC/m Rta= -33,7ºC 7.- a) ¿cuál será el punto de ebullición de una solución acuosa (i = 2) cuya temperatura de congelación es –0,74º C, a P = 1 atm ?, b) una solución acuosa de un no-electrolito, posee una temperatura de ebullición de 104,52°C. Calcule la temperatura de congelación de dicha solución. 8.- a) Una solución que se ha preparado disolviendo 0,243 g de un dado compuesto en 25 g de agua, tiene un punto de congelación de -0,201ºC. Calcule el peso molecular de ese compuesto. Considere i = 1. (Rta: 90 g/mol), b) una solución que se ha preparado disolviendo 2,5 g de un dado compuesto orgánico en 25 g de benceno, presenta una disminución de su punto de congelación de 1,2°C, respecto al del benceno puro. Calcule el peso molecular de ese compuesto. Kc(benceno) = 5,12°C/m. 9.- El principal mecanismo de ascenso de agua en las plantas es la presión osmótica, la que puede alcanzar valores de 10 a 15 atm. Mediante el proceso de transpiración, las plantas liberan agua al aire, aumentando así la concentración de soluto en los fluidos. Si el proceso de ósmosis fuese el única responsable del ascenso de la savia en un árbol, calcular la altura a la que esta llegaría, si fuese equivalente a una disolución 0,11 M de azúcar y el agua, fuera del árbol, no contuviese sólidos disueltos. (Recuerde que 1 atm equivale a 10,34 m de una columna de agua). Rta= ~ 27 m. 10.- 170 ml de una disolución acuosa que contiene 0,833 g de una dada proteína, tiene una presión osmótica de 5,20 mm de Hg a 25°C. Calcule el peso molecular de la proteína. Rta: 17.500 g/mol 1 Cátedra de Introducción a la Química para Ciencias Naturales – UNLP - 2008 11.- Explique por qué: a) las concentraciones de las disoluciones intravenosas deben controlarse cuidadosamente, b) el agua de mar tiene un punto de congelación menor que el del agua dulce, c) la conservación de dulces (elevada concentración de azúcar) está relacionada con el proceso de ósmosis (crenación de las células bacterianas),d) el agregado de una alta concentración salina (fertilizante) a un suelo, puede provocar la muerte de las plantas, e) se utiliza NaCl o CaCl2 para evitar la formación de hielo en las carreteras, f) un pepino colocado en agua salada concentrada, se arruga. 2