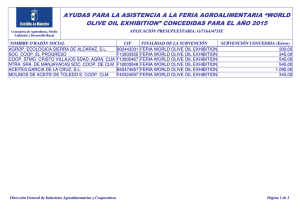
Descargar la Tesis de la Universidad de Castilla
Anuncio

UNIVERSIDAD DE CASTILLA - LA MANCHA Facultad de Ciencias Químicas Departamento de Química Analítica y Tecnología de los Alimentos INFLUENCIA DE FACTORES AGRONÓMICOS Y TECNOLÓGICOS EN EL PERFIL DE LOS COMPUESTOS FENÓLICOS Y VOLÁTILES DEL ACEITE DE OLIVA VIRGEN DE CALIDAD Aurora Gómez-Rico Rodríguez-Barbero TESIS DOCTORAL Ciudad Real, 2008 UNIVERSIDAD DE CASTILLA-LA MANCHA Facultad de Ciencias Químicas Departamento de Química Analítica y Tecnología de los Alimentos Influencia de factores agronómicos y tecnológicos en el perfil de los compuestos fenólicos y volátiles del aceite de oliva virgen de calidad Memoria de investigación presentada por Aurora Gómez-Rico RodríguezBarbero para aspirar al Grado de Doctor en Ciencia y Tecnología de Alimentos. Visado en Ciudad Real, 1 de Octubre de 2008 VºB Fdo. María Desamparados Salvador Moya Profesora Titular de Universidad del Departamento de Química Analítica y Tecnología de Alimentos de la Universidad de Castilla-La Mancha VºB Fdo. Giuseppe Fregapane Quadri Profesor Titular de Universidad del Departamento de Química Analítica y Tecnología de Alimentos de la Universidad de Castilla-La Mancha El Doctorando Fdo. Aurora Gómez-Rico Rodríguez-Barbero Dª. Antonia García Ruiz, Profesora Titular de Universidad y Secretaria del Departamento de Química Analítica y Tecnología de Alimentos de la Universidad de Castilla-La Mancha. CERTIFICA: Que el presente trabajo de investigación titulado Influencia de factores agronómicos y tecnológicos en el perfil de compuestos fenólicos y volátiles del aceite de oliva virgen de calidad, constituye la Memoria que presenta Dª Aurora Gómez-Rico Rodríguez-Barbero para aspirar al Grado de Doctor en Ciencia y Tecnología de Alimentos y ha sido realizado bajo la dirección de los profesores titulares Dr. D. Giuseppe Fregapane Quadri y Dra. Dª M. Desamparados Salvador Moya. Y para que así conste, expido y firmo el presente certificado en Ciudad Real a uno de octubre de dos mil ocho. VºBº Fdo.: José Antonio Murillo Pulgarín Fdo.: Antonia García Ruiz Director del Departamento Secretaria del Departamento ÍNDICE Índice Página CAPÍTULO 1. INTRODUCCIÓN GENERAL ............................................................................... 3 1.1. La calidad del aceite de oliva virgen ............................................................................ 6 Evaluación sensorial del aceite de oliva virgen ......................................................... 8 1.2. Compuestos volátiles del aceite de oliva virgen ......................................................... 10 Biosíntesis de los compuestos volátiles .................................................................. 11 Papel de los compuestos volátiles en la calidad del aceite de oliva virgen extra ... 14 1.3. Compuestos fenólicos del aceite de oliva virgen ....................................................... 18 Contribución de los compuestos fenólicos a la calidad del aceite de oliva virgen ... 23 1.4. Factores que influyen en la composición volátil y fenólica del aceite de oliva virgen de calidad ............................................................................................................................... 26 Influencia de aspectos agronómicos y pedoclimáticas ............................................ 26 Influencia de aspectos tecnológicos durante la extracción del producto ................. 28 CAPÍTULO 2. OBJETIVOS ....................................................................................................... 33 CAPÍTULO 3. MATERIAL Y MÉTODOS.................................................................................... 37 3.1. Planificación experimental de la aplicación de riego en el olivar de marco tradicional (Olea europaea L. Cornicabra cv.) .................................................................................... 37 Tratamientos de riego y organización de la parcela ................................................. 37 Toma de muestra del fruto ....................................................................................... 39 3.2. Planificación experimental del riego en olivares jóvenes de cubierta incompleta (Olea europaea L. Cornicabra cv. y Morisca cv.) ........................................................................ 40 Estrategias de riego y organización de las parcelas ................................................ 40 Toma de muestra del fruto ....................................................................................... 46 3.3. Planificación experimental del estudio de componentes minoritarios del fruto (Olea europaea L.) y aceite de oliva virgen en diversas variedades españolas ......................... 46 Toma de muestras en el ensayo .............................................................................. 47 3.4. Planificación experimental del estudio de los componentes minoritarios del aceite de oliva virgen (Cornicabra cv.) durante el batido .................................................................. 47 Características técnicas de la almazara experimental ............................................. 47 Obtención de las muestras del ensayo .................................................................... 49 I Índice 3.5. Elaboración de aceite de oliva virgen con el sistema Abencor ……........................... 50 3.6. Métodos analíticos realizados en el fruto ................................................................... 51 Índice de madurez .................................................................................................... 51 Rendimiento graso obtenido con el equipo Abencor ................................................ 51 Rendimiento graso de la pasta de aceituna ............................................................. 52 Determinación de compuestos fenólicos en fruto ................................................... 52 3.7. Métodos analíticos realizados en el aceite de oliva virgen ....................................... 54 Grado de acidez........................................................................................................ 54 Índice de peróxidos .................................................................................................. 55 Absorción de radiación ultravioleta (K232 y K270) ....................................................... 55 Pigmentos clorofílicos y carotenoides ...................................................................... 56 Composición en ácidos grasos ................................................................................ 56 Determinación de compuestos fenólicos en aceite de oliva virgen .......................... 57 Determinación de oleocantal por HPLC ................................................................... 60 Índice de amargor (K225) ........................................................................................... 61 Determinación de tocoferoles por HPLC .................................................................. 62 Determinación de la estabilidad oxidativa por el método Rancimat ......................... 63 Determinación de compuestos volátiles ................................................................... 64 Valoración organoléptica .......................................................................................... 66 3.8. Métodos estadísticos .................................................................................................. 66 CAPÍTULO 4. RESULTADOS EXPERIMENTALES Y DISCUSIÓN ......................................... 71 4.1. Resultados experimentales ……………………………………………………………….. 71 “Effect of cultivar and ripening on minor components in Spanish olive fruits and their corresponding virgin olive oils” ………..…….……………………………………….….. 83 “Influence of different irrigation strategies in a traditional Cornicabra cv. olive orchard on virgin olive oil composition and quality” .……………..…………………………….. 91 “Phenolic and volatile compounds of extra virgin olive oil (Olea europaea L. Cv. Cornicabra) with regard to fruit ripening and irrigation management” ……………. 103 II Índice “Virgin olive oil and olive fruit minor constituents as affected by irrigation management based on ETc, SWP and TDF in medium-density young olive orchards (Olea europaea L. Cv. Cornicabra and Morisca)” .……..………………………...…. 111 “Effect of malaxation conditions on phenolic and volatile profiles of olive paste and their corresponding virgin olive oils (Olea europaea L. cv. Cornicabra)” …………. 135 4.2. Discusión general ………………………………………………………………………… 155 CAPÍTULO 5. CONCLUSIONES ............................................................................................. 175 CAPÍTULO 6. BIBLIOGRAFÍA ................................................................................................ 181 III IV Abreviaturas ABREVIATURAS UTILIZADAS 3,4-DHPEA hidroxitirosol 3,4-DHPEA-AC acetato de hidroxitirosol 3,4-DHPEA-EA forma aldehídica del ácido elenólico unida a hidroxitirosol 3,4-DHPEA-EDA forma dialdehídica del ácido elenólico unida a hidroxitirosol AAT alcohol acil transferasa ADH alcohol deshidrogenasa AOV aceite de oliva virgen C16:0 ácido palmítico C18:0 ácido esteárico C18:1 ácido oléico C18:2 ácido linoléico C18:3 ácido linolénico DAD detector de diodos en línea DO Denominación de Origen DOC Denominación de Origen Controlada DOP Denominación de Origen Protegida ETc evapotranspiración del cultivo FAO Food and Agriculture Organization FCP perfil de libre elección FID detector de ionización en llama GC cromatografía de gases GC-MS cromatografía de gases-espectrometría de masas GC-O cromatografía de gases-olfatometría HPL hidroperóxido liasa HPLC cromatografía líquida de alta eficacia IM índice de madurez IP índice de peróxidos LC-MS cromatografía líquida-espectrometría de masas LOX lipoxigenasa MDS escalado multidimensional MOD máxima oscilación del diámetro de tronco MS espectrometría de masas MUFA ácidos grasos monoinsaturados p-HPEA tirosol p-HPEA-AC acetato de tirosol p-HPEA-EA forma aldehídica del ácido elenólico unida a tirosol p-HPEA-EDA forma dialdehídica del ácido elenólico unida a tirosol PAL L-fenilalanina amonio liasa PCA análisis de componentes principales V Abreviaturas PLS mínimos cuadrados parciales POD peroxidasa PPO polifenoloxidasa PUFA ácidos grasos poliinsaturados QDA análisis descriptivo cuantitativo RDI riego deficitario regulado (regulated deficit irrigation) RMN resonancia magnética nuclear ROS especie reactiva de oxígeno SΨ integral de estrés hídrico estacional SΨ229-277 integral de estrés hídrico durante el periodo DOY 229-277 SFA ácidos grasos saturados SPE extracción en fase sólida SPME microextracción en fase sólida SWP potencial hídrico del tronco (stem water potential) TCT tasa de crecimiento de tronco TDF fluctuaciones del diámetro del tronco (trunk diameter fluctuations) UFA ácidos grasos insaturados UV-Vis ultravioleta-visible VI Publicaciones Científicas PUBLICACIONES CIENTÍFICAS EN REVISTAS INTERNACIONALES • Fregapane, G, Mancebo-Campos, V., Gomez-Rico, A., Salvador, M.D. “Natural antioxidants content in virgin olive oil – Influence of agronomical and technological factors, and nutritional importance”, in Innovations in traditional foods. Vol. II. Ed. Elsevier/UPV. Pág. 963-966 (2005) ISBN 84-9705-881-X • Salvador, M.D., Gomez-Rico, A., Inarejos A.M., Fregapane, G. “Minor components with nutritional value, antioxidant activity and organoleptic properties status through the market period of commercial olive oil types”, in Special Issue of Italian Journal of Food Science- Shelflife International Meeting. Ed. Chiriotti/GSICA/DOFATA. Pág. 337-342 (2006) ISSN 1120-1770 • Aurora Gómez-Rico, M. Desamparados Salvador, Marta La Greca, Giuseppe Fregapane. “Phenolic and Volatile Compounds of Extra Virgin Olive Oil (Olea europaea L. Cv. Cornicabra) with Regard to Fruit Ripening and Irrigation Management”. Journal of Agricultural and Food Chemistry, 54, 7130-7136 (2006). • Alfonso Moriana, David Pérez, Aurora Gómez-Rico, M. Desamparados Salvador, Nicolás Olmedilla, Francisco Ribas, Giuseppe Fregapane. “Irrigation scheduling for traditional, lowdensity olive orchards: Water relations and influence on oil characteristics”. Agricultural Water Management, 87, 171-179 (2007). • Aurora Gómez-Rico, M. Desamparados Salvador, Alfonso Moriana, David Pérez, Nicolás Olmedilla, Francisco Ribas, Giuseppe Fregapane. “Influence of different irrigation strategies in a traditional Cornicabra cv. olive orchard on virgin olive oil composition and quality”. Food Chemistry, 100, 568-578 (2007). • Aurora Gómez-Rico, Giuseppe Fregapane, M. Desamparados Salvador. “Effect of cultivar and ripening on minor components in Spanish olive fruits and their corresponding virgin olive oils”. Food Research International, 41, 433-440 (2008). • Antonio M. Inarejos-García, Aurora Gómez-Rico, M. Desamparados Salvador, Giuseppe Fregapane. “Virgin olive oil processing technology: Influence of malaxation temperature and time and overall oil quality”. Food Research International, (aceptado). • Aurora Gómez-Rico, Antonio M. Inarejos-García, M. Desamparados Salvador, Giuseppe Fregapane. “Effect of malaxation conditions on phenolic and volatile profiles of olive paste and their corresponding virgin olive oils (Olea europaea L. cv. Cornicabra)”. Journal of Agricultural and Food Chemistry, (enviado). • Aurora Gómez-Rico, M. Desamparados Salvador, Giuseppe Fregapane. “Virgin olive oil and olive fruit minor constituents as affected by irrigation management based on ETc, SWP and TDF VII Publicaciones Científicas in medium-density young olive orchards (Olea europaea L. cv. Cornicabra and Morisca)”. Food Research International, (enviado). • Antonio M. Inarejos-García, Aurora Gómez-Rico, M. Desamparados Salvador, Giuseppe Fregapane. “Effect of pre-processing storage conditions on olive oil quality and composition”. Journal of Agricultural and Food Chemistry, (enviado). VIII 1. INTRODUCCIÓN GENERAL 1. Introducción General Según el Consejo Oleícola Internacional, “el aceite de oliva es el producto procedente únicamente del fruto del olivo (Olea europaea L.), con exclusión de los aceites obtenidos por disolventes o por procedimientos de reesterificación y de toda mezcla con aceites de otra naturaleza” (C.O.I., 2003). Además, dentro de los aceites de oliva que se pueden comercializar se considera que “el aceite de oliva virgen es el obtenido del fruto del olivo únicamente por procedimientos mecánicos o por otros medios físicos en condiciones especialmente térmicas, que no produzcan la alteración del aceite, que no haya tenido más tratamiento que el lavado, la decantación, la centrifugación y el filtrado” (C.O.I., 2003). El aceite de oliva virgen que se obtiene de esta forma se convierte, por tanto, en un producto único que es directamente apto para el consumo humano, lo que lo diferencia de los aceites vegetales comestibles, que en su gran mayoría, se deben someter obligatoriamente a procesos de refinado previamente a su consumo, lo cual provoca la desaparición de compuestos de gran interés estrechamente relacionados con las características sensoriales, la estabilidad oxidativa del producto y sus propiedades biológicas. El cultivo del olivo se encuentra localizado en los países de la cuenca mediterránea, que cuenta con el 98% del total de la superficie olivarera mundial, aunque durante los últimos años se ha extendido más allá de las zonas tradicionales de cultivo, como son los Estados Unidos, Sudáfrica, Sudamérica y Australia. De la misma forma, la mayor parte de la producción mundial de aceite de oliva se localiza en los países mediterráneos, siendo España, Italia, Grecia y los países del Magreb los principales productores, con un aporte medio de aproximadamente 2,5 toneladas anuales (C.O.I, 2005). En España se localiza alrededor del 39% de la producción mundial de aceite de oliva y una cuarta parte de la superficie olivarera (C.O.I, 2005), lo que nos da una clara idea de la gran relevancia social y económica de este producto en nuestro país. De hecho, el consumo de este aceite vegetal constituye la principal fuente de lípidos utilizada en la dieta mediterránea, aunque éste se ha visto incrementado durante los últimos años en países fuera de este área, debido por una parte a sus características sensoriales únicas y por otro lado, a que recientes investigaciones han demostrado que el consumo habitual de aceite de oliva virgen supone un aporte continuo de compuestos antioxidantes, descritos como sustancias protectoras contra enfermedades neuro-degenerativas, problemas cardiovasculares y algunos tipos de tumores (Visioli et al., 1995; Owen et al., 2000b; Rocca et al., 2002, etc.). Para mantener o incluso incrementar el consumo de este producto a nivel mundial es necesario ampliar los mercados, para lo cual se hace necesario proporcionar a los consumidores, no sólo aceites de oliva virgen de alta calidad, sino también información nutricional relevante sobre los beneficios del consumo de este aceite respecto del resto de aceites vegetales. Para ello, el énfasis ya realizado sobre los beneficios proporcionados por el aceite de oliva virgen debido a su alta composición en ácidos grasos monoinsaturados, necesita ser reforzado con información 3 1. Introducción General sobre la presencia de compuestos minoritarios en su composición responsables de su aroma y sabor únicos y sus propiedades antioxidantes (García-González et al., 2007). Actualmente, la reglamentación comunitaria vigente permite la clasificación del aceite de oliva en tres categorías comerciales en base a una serie de parámetros químico y sensoriales, “virgen extra”, “virgen” y “lampante”, esta última no apta para el consumo humano directo y destinada principalmente a procesos de refinado. Podría decirse que la reglamentación CEE 2568/91 y sus posteriores modificaciones (CE 796/2002, CE 1989/2003 y CE 640/2008) regulan un conjunto de parámetros analíticos y atributos sensoriales, así como sus valores límite. El objetivo que persigue esta reglamentación es obtener un producto alimenticio que presente unas características físico-químicas adecuadas para el consumo humano, además de evitar posibles fraudes, pero sin atender de forma explícita al grado de aceptación de este producto por parte de los consumidores, siendo esto último, el principal factor de interés para los productores de aceite de oliva virgen, que tienen ante sí un mercado cada vez más exigente y una mayor competencia, lo que les obliga a la elaboración de productos de mayor calidad. El principal factor que determina el grado de preferencia del aceite de oliva virgen por parte de los consumidores es la calidad sensorial del mismo, y que en este producto depende básicamente de las características organolépticas que son percibidas por el consumidor como un conjunto de sensaciones valoradas a través del olfato y el gusto (Morales et al., 2000). Existen multitud de compuestos orgánicos que determinan las características organolépticas del aceite de oliva virgen, siendo los compuestos fenólicos y volátiles los principales responsables de las mismas, y que son retenidos en él debido a que durante su proceso de elaboración solamente se utilizan procedimientos mecánicos, sin posteriores operaciones de refinado. Los compuestos volátiles son los principales responsables del aroma del aceite de oliva virgen y están relacionados con las notas aromáticas frescas y verdes propias de la materia prima de la que procede. Por otro lado, los compuestos fenólicos han sido relacionados con el sabor del aceite, en particular con los atributos sensoriales positivos de “amargo” y “picante” (Morales et al., 2000; Angerosa et al., 2000c), además de presentar un importante carácter antioxidante y ser considerados compuestos bio-activos, lo que los hace también responsables, entre otros, de la estabilidad oxidativa y del valor nutricional del producto (Shahidi et al., 1992; Servili et al., 1996). Por lo tanto, la presencia final de estos compuestos minoritarios en el aceite de oliva virgen representan en gran medida su aceptación sobre otras grasas vegetales comestibles presentes en el mercado. El contenido y el perfil de compuestos fenólicos y volátiles presentes en un aceite de oliva virgen depende de varios factores, principalmente agronómicos, como son el cultivar de procedencia, la madurez del fruto en el momento de la recolección, las condiciones pedo4 1. Introducción General climáticas y la disponibilidad de agua durante el desarrollo del fruto, así como de factores tecnológicos, como la metodología de extracción utilizada y las condiciones de almacenamiento del producto una vez elaborado (Angerosa et al., 2004; Servili et al., 2004). Por todo ello, en el presente trabajo de investigación se plantea el estudio de distintos factores agronómicos y tecnológicos que afectan al contenido y composición de estos componentes minoritarios del aceite de oliva virgen, como son el cultivar de origen, el grado de maduración del fruto, las técnicas de riego aplicadas en el olivar, así como la influencia de determinadas variables durante el proceso tecnológico de batido de la pasta de aceituna. 5 1. Introducción General 1.1. LA CALIDAD DEL ACEITE DE OLIVA VIRGEN. El principal objetivo del control analítico de los aceites vegetales comestibles establecido según la reglamentación internacional del Codex Alimentarius y la Comisión Europea es el de determinar la calidad, la pureza y la posible presencia de contaminantes, y está principalmente orientada hacia la clasificación de los aceites comestibles en diversas categorías comerciales. De esta forma, la evaluación de la calidad y la pureza de los aceites de oliva virgen se lleva a cabo mediante la medida de una serie de parámetros analíticos orientados principalmente hacia la detección de posibles fraudes, adulteraciones o degradación en el producto. Y por tanto, los límites establecidos por la reglamentación vigente están orientados básicamente hacia la clasificación del aceite de oliva dentro de la categoría comercial correspondiente, sin atender explícitamente los atributos de calidad positivos y específicos de este apreciado producto. De hecho, los criterios de calidad y pureza de los distintos tipos de aceite de oliva establecidos por la Reglamentación CEE 2568/91 y sus posteriores modificaciones (“virgen extra”, “virgen”, “lampante”,...) están basados principalmente en parámetros químicos como son el grado de acidez, el índice de peróxidos, las características de absorción en el UV, además de la valoración sensorial, entre otros parámetros de pureza. Aún así, la cuantificación de la mayoría de estos parámetros químicos en muestras de aceite de oliva, que han sido obtenidos a partir de frutos en buen estado y mediante procesos de extracción adecuados, no excede los límites máximos establecidos por la reglamentación vigente, siendo la evaluación sensorial del producto la herramienta más importante para determinar la calidad final del producto y que permite en muchos casos establecer el precio del aceite de oliva. Asimismo, se debe destacar que son las características organolépticas del producto las que determinan el grado de preferencia de los consumidores, ya que la elección de los alimentos que consumimos se basa primordialmente en los atributos que percibimos a través de nuestros sentidos. Los atributos sensoriales que consideramos principalmente en los alimentos son la apariencia, el color, la textura, la forma y el tamaño, la viscosidad, las sensaciones táctiles y kinestésicas, el olor y el sabor, además de sensaciones quimioestésicas, como una respuesta combinada de la sensación cutánea, térmica y de los estímulos dolorosos producidos por determinadas sustancias químicas irritantes (Angerosa, 2000a). En el caso del aceite de oliva virgen, como alimento líquido que es, el número de atributos que determinan su calidad sensorial y que son valorados por los consumidores quedan básicamente reducidos al color, olor y sabor, además de ciertas sensaciones quimioestésicas, como el picor y la astringencia típicas de este producto (Morales et al., 2000). 6 1. Introducción General El color del aceite de oliva depende de la presencia de determinados pigmentos liposolubles que se encuentran inicialmente en el fruto y que se transfieren al aceite durante el proceso de molienda y batido de la pasta de aceituna. Las distintas tonalidades verde-amarillentoanaranjado que pueden observarse en un aceite de oliva virgen dependen del contenido en clorofilas y carotenos. Los niveles de estos pigmentos se ven afectados principalmente por factores genéticos y por el grado de maduración del fruto, éste último supone un importante descenso en la concentración de los mismos, pudiendo llegar a desaparecer en los aceites de oliva virgen obtenidos a partir de frutos muy maduros (Mínguez-Mosquera et al., 1989; GandulRojas et al., 1996). A pesar de que el color es una de las características sensoriales más importantes y que es valorada en la mayoría de los productos alimentarios, la metodología aplicada por la reglamentación actual para clasificar el aceite de oliva (Reglamento CE nº 640/2008, última modificación del Reglamento CEE 2568/91) no juzga este atributo sensorial. Aún así cabe destacar el hecho de que el consumidor percibe el color del aceite de oliva como un indicador indirecto del olor y sabor del mismo, relacionando los aceites de color verdoso con notas sensoriales más verdes y siendo concebidos como más amargos y picantes, mientras que los aceites amarillentos, obtenidos de frutos maduros, se relacionan con notas sensoriales más frutadas y menos amargas. El conjunto de sensaciones olfativas y gustativas de un alimento, complementadas por las sensaciones táctiles y kinestésicas percibidas por los receptores táctiles y olorosos alojados en la boca, recibe el nombre de “flavor” (Reineccius, 1993). Existen multitud de compuestos orgánicos responsables del flavor del aceite de oliva virgen, los cuales pueden presentar características organolépticas positivas o negativas, de manera que la aceptación del producto por parte de los consumidores dependerá tanto de la presencia o ausencia de determinados compuestos, así como de los umbrales de detección de los mismos y de su concentración en el aceite. A lo largo de las dos últimas décadas, numerosas investigaciones han tratado de identificar cualitativa y cuantitativamente los compuestos orgánicos volátiles y no-volátiles responsables del flavor del aceite de oliva virgen y relacionarlos con los atributos sensoriales que percibe el ser humano, sobre todo aplicando procedimientos estadísticos multivariantes, con lo que se ha conseguido relacionar determinados compuestos con las notas sensoriales que generan (Morales et al., 1993; Morales et al., 1995; Aparicio et al., 1996; Andrewes et al., 2003). Algunos estudios han destacado la estrecha relación existente entre determinados compuestos fenólicos, principalmente los derivados secoiridoideos del hidroxitirosol y tirosol, con la intensidad del atributo amargo del aceite de oliva virgen, el cual se considera la percepción gustativa más importante del producto, además de ser responsables de las sensaciones 7 1. Introducción General quimioestésicas como la astringencia y el picor (García et al., 2001; Gutiérrez-Rosales et al., 2003; Andrewes et al., 2003), por lo que, probablemente, estos compuestos son las únicas sustancias responsables del las percepciones gustativas reales que nos ofrece el aceite de oliva virgen. Por otro lado, los compuestos volátiles se han relacionado principalmente con las notas sensoriales olfativas percibidas tanto por vía nasal directa como por vía retronasal, por lo que son los responsables del aroma global de este apreciado producto. Se han identificado cientos de compuestos volátiles en el aroma del aceite de oliva virgen mediante técnicas de cromatografía de gases y espectrometría de masas (Camera et al., 1990; Morales et al., 1994), siendo los aldehídos, alcoholes y ésteres de seis átomos de carbono los volátiles que se encuentran en mayor concentración y que contribuyen principalmente a su aroma (Morales et al., 1995; Olías et al., 1980). Pero aún en la actualidad, la determinación instrumental de los compuestos fenólicos y volátiles, basados en técnicas de separación, concentración y/o aislamiento desde su matriz oleosa y su posterior relación con las notas sensoriales del aceite de oliva virgen resulta ser un proceso complicado, básicamente porque las sensaciones olfato-gustativas percibidas por el ser humano resultan de la amplia combinación e interacción de un número elevado de sustancias orgánicas entre sí y con los receptores sensoriales localizados en la boca y en la cavidad nasal, lo que hace que el análisis sensorial aún sea la metodología más eficaz para evaluar sus características organolépticas, así como la aceptación final del producto por parte de los consumidores. EVALUACION SENSORIAL DEL ACEITE DE OLIVA VIRGEN. La evaluación sensorial del aceite de oliva virgen está ampliamente descrita en los Reglamentos CEE 2568/91 y CE 640/2008. Para llevar a cabo la valoración de los atributos sensoriales del aceite de oliva virgen se ha generado un vocabulario específico que permite describir el flavor de este producto, basado en la metodología propuesta por el COI en 1987. Por una parte, se distinguen los atributos positivos: “frutado”, “amargo” y “picante”, definidos como: - Frutado: conjunto de sensaciones olfativas características del aceite, dependientes de la variedad de las aceitunas, procedentes de frutos sanos y frescos, verdes o maduros, y percibidas por vía nasal y/o retronasal. El atributo frutado se considera verde cuando las sensaciones olfativas recuerdan las de los frutos verdes, características del aceite procedente de frutos verdes. El atributo frutado se considera maduro cuando las sensaciones olfativas recuerdan las de los frutos maduros, características del aceite procedente de frutos verdes y maduros. - Amargo: sabor elemental característico del aceite obtenido de aceitunas verdes o en envero. Se percibe en las papilas circunvaladas de la uve lingual. 8 1. Introducción General - Picante: sensación táctil de picor, característica de los aceites obtenidos al comienzo de la campaña, principalmente de aceitunas todavía verdes. Puede ser percibido en toda la cavidad bucal, especialmente en la garganta. Por otro lado, también se han descrito una serie de atributos negativos, con el fin de describir los posibles defectos que se pueden encontrar en los aceites de oliva de baja calidad, y que se deben a la presencia de ciertos compuestos volátiles indeseables que pueden aparecer si el aceite se ha obtenido a partir de frutos dañados y/o almacenados durante largo tiempo a temperatura ambiente y altas humedades relativas, o bien si se ha producido un procesado deficiente de la materia prima o a un almacenamiento inadecuado del producto final. Estos atributos sensoriales negativos se encuentran ampliamente descritos en el Reglamento CE 640/2008 y se denominan con los siguientes descriptores: atrojado/borras, moho-humedad, avinado-avinagrado/ácido-agrio, metálico, rancio, cocido o quemado, heno-madera, basto, lubricante, alpechín, salmuera, esparto, tierra, gusano, pepino y madera húmeda. La primera aplicación del análisis sensorial a este producto fue introducida por el COI en 1987 y posteriormente se incorporó en el Reglamento de la Comunidad Económica Europea (CEE) 2568/91, con la finalidad de detectar posibles defectos sensoriales y clasificar los aceites de oliva virgen en diversas categorías comerciales (“Virgen extra”, “Virgen”, “Virgen corriente” y “Virgen lampante”), en función de la intensidad de los defectos y atributos sensoriales positivos. El método empleaba una escala estructurada de 0 a 5, en la cual el 0 indicaba “ausencia total” y el punto 5 indicaba “percepción extrema”, además el catador debía proporcionar una puntuación total del aceite en una escala de 9 puntos. En este reglamento se indican, según las directrices establecidas por el COI, las características de la sala de cata y las cabinas que se deben utilizar. También se describe en detalle las pautas a seguir en el proceso de selección y entrenamiento de los catadores, además de las normas y condiciones necesarias para la realización del ensayo sensorial, el empleo de una copa normalizada para la degustación y una descripción detallada de las características generales en las que debe efectuarse la valoración sensorial. La experiencia aportada por esta metodología y los problemas surgidos en su aplicación plantearon que en 1996 el COI adoptara nuevos criterios en la valoración sensorial del aceite, de forma que se diseñó un nuevo formulario que clasificaba los aceites exclusivamente a través de sus perfiles en función de la intensidad de los defectos y considerando únicamente los atributos positivos “frutado”, “amargo” y “picante”, empleando escalas no estructuradas de 10 cm, en la cual el extremo izquierdo de la escala indica “ausencia total” y el extremo derecho indica “percepción extrema”. Esta reforma fue incluida en el Anexo XII de la reglamentación CE 796/2002 y muy recientemente en la reglamentación CE 640/2008, modificando determinados aspectos de la norma CEE 2568/91, de forma que actualmente el aceite de oliva se clasifica en tres categorías “Virgen extra”, “Virgen” y “Lampante” en función de la mediana de los posibles 9 1. Introducción General defectos que se pueden encontrar en el aceite y del atributo “frutado” obtenidas por el panel de cata integrado como mínimo por ocho catadores expertos. Remarcar que con la nueva norma, el formulario a emplear mantiene la misma estructura, a excepción de la incorporación de una casilla en la que el catador señala si el atributo “frutado” presenta un carácter de verde o maduro y el agrupamiento de los defectos “atrojado” y “borras” dentro de la misma percepción olfativa. En los casos en los que el análisis sensorial del aceite de oliva virgen tiene por finalidad una diferenciación en el producto, como es el caso de aceites acogidos a una Denominación de Origen Protegida (DOP) o Controlada (DOC), cuya clasificación está ligada a factores geográficos y varietales, el uso de la ficha de cata empleada actualmente en la norma CE 640/2008 no ofrece una información completa sobre el perfil que incluya posibles notas que pueden describirlo y caracterizarlo. Para llevar a cabo esta evaluación sensorial el COI ha adoptado en la norma COI/T.20/Doc nº 22 (Noviembre de 2005) un método específico para la valoración organoléptica de un aceite de oliva virgen extra que opta a una denominación de origen (DO). La norma propone, basado en un método de perfil, la selección de descriptores característicos de los productos a partir de una amplia lista en los que se incluyen sensaciones olfativas evaluadas por vía nasal directa o retronasal como almendra, manzana, hierba, tomate, alcachofa, verde, etc., sensaciones gustativas como amargo y “dulce”, la persistencia de la sensación percibida por vía retronasal y sensaciones táctiles como la fluidez y el picante. 1.2. COMPUESTOS VOLÁTILES DEL ACEITE DE OLIVA VIRGEN. La fracción volátil del aceite de oliva virgen está compuesta principalmente por numerosos aldehídos, alcoholes, ésteres, cetonas e hidrocarburos, la mayoría de los cuales han sido identificados mediante técnicas de CG-MS (Angerosa, 2000a). El perfil de compuestos volátiles detectado en un aceite de oliva varía en función de la calidad sensorial del mismo. De tal forma que en la fracción volátil de los aceites obtenidos a partir de frutos sanos y frescos mediante técnicas adecuadas de extracción, predominan principalmente los aldehídos, alcoholes y ésteres de seis átomos de carbono (C6), además de diversos compuestos carbonílicos de cinco átomos de carbono (C5), los cuales proceden de la oxidación enzimática de los ácidos grasos poliinsaturados a través de la denominada “ruta de la lipoxigenasa”, ruta LOX (Sánchez et al., 2000), y que son los principales responsables de las notas sensoriales verdes y frutadas propias del aceite de oliva virgen de alta calidad. Por otro lado, la fracción volátil de los aceites de oliva que presentan defectos sensoriales se caracteriza por la menor concentración o ausencia total de los productos de la ruta LOX, así como por la elevada presencia de aldehídos insaturados de siete a once átomos de carbono 10 1. Introducción General (C7-C11) (Solinas et al., 1987a y 1988), dienales de seis a diez átomos de carbono (C6-C10) (Aparicio et al., 2000), compuestos carbonílicos de ocho átomos de carbono (C8) (Angerosa et al., 1999b) o aldehídos y alcoholes ramificados de cinco átomos de carbono (Angerosa et al., 1996a), todos ellos caracterizados por poseer umbrales de detección bajos y por ser responsables de los atributos sensoriales negativos. BIOSINTESIS DE LOS COMPUESTOS VOLÁTILES. La presencia de compuestos volátiles es apenas imperceptible durante el crecimiento de la aceituna hasta que se inicia la fase climatérica, en la cual aumenta la producción de etileno, lo que implica numerosos cambios físicos, químicos y bioquímicos en el fruto, además del incremento de la síntesis proteica, acídica y un aumento en la actividad de las enzimas presentes, factores de los que posteriormente dependerá la presencia de compuestos volátiles en el aceite obtenido. Aunque existen una serie de volátiles presentes en el aceite de oliva virgen que se encuentran inicialmente de forma natural en el fruto intacto, los principales compuestos responsables del aroma de este producto son metabolitos secundarios, cuya formación comienza inmediatamente después de la ruptura del fruto y continúa durante el batido de la pasta de aceituna, debido a la actividad de diversas enzimas que actúan en presencia de oxígeno (Tressl et al., 1973; Olias et al., 1993) y que utilizan como principales sustratos los ácidos grasos y algunos aminoácidos, como la leucina, la isoleucina y la valina. Las principales rutas bioquímicas implicadas en la síntesis de los compuestos volátiles del aceite de oliva virgen de calidad son las que se resumen a continuación: (i) Metabolitos lipídicos: - Metabolismo de ácidos grasos. Durante la maduración del fruto se ha descrito la conversión de algunos ácidos grasos en cetonas, ésteres y alcoholes (Tressl et al., 1973), que posteriormente forman parte del perfil aromático del aceite de oliva virgen. - Ruta de la Lipoxigenasa (LOX). Como se ha comentado previamente, los compuestos volátiles C6, presentes no sólo en el aroma del aceite de oliva virgen sino también en numerosas frutas y vegetales, se generan a través de una serie de reacciones enzimáticas encadenadas que conforman la denominada ruta LOX y que utiliza como sustratos los ácidos grasos linoleico y linolénico (Olías et al., 1993). La Figura 1.1 representa de forma esquemática los principales productos obtenidos mediante esta ruta, así como las enzimas implicadas en la misma. La rotura de los tejidos de la aceituna durante la etapa de molienda permite la liberación de las enzimas implicadas en esta ruta bioquímica, que comienza tal y como puede 11 1. Introducción General observarse en la Figura 1.1 a través de la enzima lipoxigenasa (LOX), la cual cataliza la dioxigenación de los ácidos grasos poliinsaturados que presentan la estructura (Z-Z)1,4pentadieno en su cadena carbonada originando los correspondientes hidroperóxidos ∆13 y ∆-9. Estudios recientes han puesto en evidencia la regioespecificidad de la enzima LOX, presente en la pulpa de aceituna, por la posición ∆-13 de los ácidos linoleico y linolénico, obteniéndose entre un 75-90% de hidroperóxidos ∆-13, además de una actividad dos veces superior sobre el ácido linolénico respecto del linoleico (Salas et al., 1999c; Sánchez et al., 2000), lo que explica que los volátiles insaturados C6 sean los componentes mayoritarios presentes en el aroma del aceite de oliva virgen de calidad. Posteriormente, la enzima hidroperóxido liasa (HPL) cataliza la ruptura de los hidroperóxidos formados en la etapa anterior a través del enlace situado entre el átomo de carbono que contiene el grupo hidroperóxido y el adyacente que contiene el doble enlace con isomería E. Esta enzima muestra un especificidad estricta, por lo que las HPL específicas de los hidroperóxidos ∆-13 catalizan la formación de aldehídos C6 y oxoácidos C12, mientras que las HPL específicas de los hidroperóxidos ∆-9 generan aldehídos y oxoácidos C9. El aislamiento parcial de esta enzima en la pulpa de aceituna y su posterior estudio ha determinado una especificidad estricta por los hidroperóxidos ∆-13 derivados de los ácidos linoleico y linolénico, generándose hexanal y Z-3-hexenal, respectivamente, además de una actividad 2,5 veces superior sobre el hidroperóxido ∆13 del ácido linolénico que sobre el isómero análogo del ácido linoleico (Salas et al., 1999b), lo cual explica la ausencia de compuestos volátiles C9, además de la presencia mayoritaria de compuestos C6 insaturados en el aroma del aceite de oliva virgen de alta calidad. La alta inestabilidad del aldehído insaturado Z-3-hexenal generado en esta etapa, promueve su transformación casi inmediata en el isómero E-2-hexenal, gracias a la actividad de la enzima Z-3:E-2-enal isomerasa (Williams et al., 2000). La posterior reducción de los aldehídos C6 es llevada a cabo por la enzima alcohol deshidrogenasa (ADH) (Figura 1.4). En la pulpa de aceituna se han aislado e identificado tres isoenzimas distintas en función de su dependencia del nucleótido NADH o NADPH, estableciéndose que según sus características cinéticas, la única isoenzima envuelta en la biogénesis de los alcoholes C6 es la ADH NAPH-dependiente, que presenta una actividad 20 veces superior a la NADH-dependiente (Salas et al., 1998). La última etapa de la ruta LOX implica la formación de los correspondientes ésteres volátiles de los alcoholes saturados e insaturados C6, que se forman mediante la esterificación de los alcoholes con derivados acetil-CoA gracias a la acción de la enzima 12 1. Introducción General alcohol aciltransferasa (AAT). Esta enzima no actúa sobre alcoholes de cadena corta, como el metanol y el etanol, mostrando una actividad baja sobre el butanol y el 3metilbutanol (Sanchez et al., 2000), por lo que la falta de actividad de esta enzima sobre los alcoholes de cadena corta explica le escasez de los acetatos de hexilo y hexenilo que se observa en el aroma del aceite de oliva virgen (Morales et al., 1995), a pesar de la alta concentración relativa de los correspondientes sustratos (hexan-1-ol, Z-3-hexen1-ol y E-2-hexen-1ol) (Salas, 2004). Aún así los mayores valores de actividad enzimática se han obtenido al utilizar como sustratos el hexan-1-ol y el Z-3-hexen-1-ol (Salas, 2004). - Existe una rama adicional en la ruta LOX que tiene como sustrato específico el hidroperóxido ∆-13 del ácido linolénico, a través de la cual se generan dímeros de penteno y alcoholes C5, como el 1-penten-3-ol y el 2-penten-1-ol. La posterior actividad de la ADH podría ser la responsable de la formación de los correspondientes aldehídos C5 que también se han encontrado en el aroma del aceite de oliva virgen (Angerosa et al., 1998a). ADH LOX HIDROPERÓXIDO ∆-13 ACETATO DE HEXILO HEXAN-1-OL HEXANAL ÁCIDO LINOLEICO AAT HPL Isomerasa E-2-HEXENAL E-2-HEXEN-1-OL ADH ÁCIDO LINOLÉNICO RADICAL 13-ALCOXI Z-3-HEXENAL Z-3-HEXEN-1-OL RADICAL PENTENO DÍMERO PENTENO ADH AAT ACETATO DE Z-3-HEXENILO 2-PENTEN-1-OL 1-PENTEN-3-OL 2-PENTENAL 1-PENTEN-3-ONA Figura 1.1. Ruta de la Lipoxigenasa, responsable de la formación de los compuestos volátiles C6 y C5 presentes en el aroma de los aceites de oliva virgen de calidad. (Fuente utilizada: Angerosa et al., 2004). 13 1. Introducción General (ii) Metabolitos de aminoácidos: Ciertos volátiles presentes en el perfil aromático del aceite de oliva virgen proceden de la estructura ramificada de aminoácidos, como la valina, leucina e isoleucina, generando respectivamente los aldehídos ramificados, 2-metilpropanal, 3-metilbutanal y 2-metilbutanal, a través de una serie de transformaciones bioquímicas (Wyllie et al., 1995). La posterior actuación de la alcohol deshidrogenasa y la alcohol aciltransferasa supone la formación de los correspondientes alcoholes y ésteres ramificados (Van de Hijden et al., 1996; Wyllie et al., 1996). PAPEL DE LOS COMPUESTOS VOLÁTILES EN LA CALIDAD DEL ACEITE DE OLIVA. Todos los componentes de la fracción volátil del aceite de oliva virgen no presentan la misma influencia en la percepción sensorial del aroma del producto, ya que, aunque todos estos compuestos presentan unas características comunes, como son una masa molecular relativa baja (por debajo de los 300 Da), un carácter polar y ser suficientemente liposoluble, lo cual permite por un lado su difusión en el mucus que recubre las células epiteliales olfativas y su posterior disolución en la membrana lipídica que rodea los receptores proteicos, la capacidad olorosa depende además de otros factores, como son: - La capacidad de unión a los receptores proteicos presentes en el epitelio olfativo de las fosas nasales, lo cual viene determinado principalmente por su estructura química, como son la estructura conformacional de la molécula, además del tipo y posición de los grupos funcionales (Pelosi, 1994; Rossiter, 1996). - La presencia y posición de los dobles enlaces y su isomería cis-trans (Bedoukian, 1971), la cual se ha relacionado con la calidad del olor generado por el volátil. - La concentración en la que se encuentren los compuestos volátiles (Morales et al., 1997) y su umbral de detección (Ullrich et al., 1988), el cual se define como la mínima concentración de una sustancia volátil capaz de producir una respuesta olfativa. La relación existente entre la concentración de un compuesto volátil y su umbral de detección determina principalmente la contribución de cada compuesto volátil al aroma global del aceite de oliva virgen, de forma que cuanto más alto sea este valor, mayor será la intervención de dicha sustancia en la percepción aromática del producto (Grosch, 1993). Se han aplicado diversas técnicas de cromatografía de gases-olfatometría (GC-O) en el estudio de las notas sensoriales generadas individualmente por los compuestos volátiles presentes en el perfil aromático del aceite de oliva virgen (Aparicio et al., 2002; Morales et al., 1997; Morales et al., 2005; Reiners et al., 1998, entre otros). En la Tabla 1.1 se resumen las notas sensoriales características de los principales compuestos volátiles presentes en el aceite de oliva virgen 14 1. Introducción General extra, así como los umbrales de detección determinados por diversos autores y recogidos en bibliografía. En estos trabajos se puede observar que para un mismo compuesto volátil se han determinado diferentes umbrales de detección, lo cual puede deberse por una parte a que la matriz oleosa empleada en la determinación del mismo ha sido diferente, utilizándose aceite de girasol refinado (Aparicio et al., 1998; Reiners et al., 1998), aceite vegetal refinado (Aparicio et al., 2002), aceite de oliva refinado (Morales et al., 2005) o parafina. También se conoce el hecho de que las sustancias proteicas, carbohidratos u otros componentes minoritarios pueden alterar la intensidad aromática de las sustancias volátiles debido a la formación de complejos intramoleculares o a procesos de adsorción (Jung et al., 2000). Y por último, se debe tener también en cuenta que la determinación de este valor umbral depende en gran parte de la sensibilidad y entrenamiento de los catadores y que puede ser variable entre distintos sujetos. Otro hecho que destaca es que en ocasiones las notas aromáticas descritas por los catadores para un determinado compuesto volátil puedan ser ligera o bastante diferentes, como ocurre en el caso del hexan-1-ol (ver Tabla 1.1). Angerosa et al. (2002) argumenta que puede deberse a la dificultad de conciliar las sensaciones percibidas por los distintos paneles sensoriales, a pesar de utilizar un mismo vocabulario consensuado. No obstante, queda suficientemente aceptado que los aldehídos y alcoholes C6 son los principales responsables de las notas sensoriales verdes y herbáceas perceptibles en los aceites de oliva virgen obtenidos a partir de frutos verdes o en envero, mientras que los ésteres C6 están ligados a las sensaciones frutadas y florales del producto. Por otro lado, los compuestos C5 también contribuyen de forma positiva al flavor del aceite de oliva virgen, al estar relacionados con las notas sensoriales verdes, además de estar involucrados en la percepción del atributo “picante”, como es el caso del pentan-1-ol y 1-penten-3-ona, sustancias volátiles capaces de generar sensaciones punzantes, ásperas y astringentes. Como se ha dicho previamente (apartado 1.1), han sido numerosos los estudios que han tratado de relacionar los compuestos volátiles presentes en el aroma del aceite de oliva virgen con los atributos sensoriales que percibe el ser humano. A pesar del importante desarrollo de la instrumentación de hoy día, las técnicas analíticas todavía no son capaces de evaluar las interacciones y los sinergismos que derivan de la combinación e interacción de las diferentes sustancias volátiles entre sí y con los receptores sensoriales localizados en orificios nasales y boca. No obstante es posible relacionar determinados compuestos volátiles con las distintas notas sensoriales evaluadas por grupos de catadores entrenados, gracias al empleo de diferentes procedimientos estadísticos aplicados a los valores proporcionados por los equipos instrumentales y los paneles de cata. 15 1. Introducción General Tabla 1.1. Notas sensoriales de los principales compuestos volátiles C6 y C5 presentes en el aroma del aceite de oliva virgen extra determinados mediante técnicas de GC-O por diversos autores. Umbral detección Compuesto Nota aromática Hexanal Verde-dulce 75 Aparicio & Luna, 2002 Manzana verde, herbáceo 80 Morales et al., 2005 Hexan-1-ol Acetato hexilo (µg/Kg de aceite) Referencias 400 Fruta, banana, césped recién cortado Aparicio & Morales,1998 Indeseable 400 Aparicio & Luna, 2002 Verde, frutado, dulce 1040 Aparicio & Luna, 2002 Morales et al., 1997 E-2-hexenal Verde, manzana 424 Reiners & Grosch, 1998 Verde, almendra amarga 420 Morales et al., 2005 Verde astringente 1125 Aparicio & Luna, 2002 Z-3-hexenal Verde 3 Aparicio & Luna, 2002 E-2-hexen-1-ol Hoja Césped, hojas 1,7 5000 Reiners & Grosch, 1998 Morales et al., 2005 Verde, herbáceo, dulce 8000 Aparicio & Morales, 1998 Z-2-hexen-1-ol Fruta verde ------ Aparicio & Morales, 1998 Z-3-hexen-1-ol Verde 6000 Aparicio & Luna, 2002 Hoja 1100 Reiners & Grosch, 1998 E-3-hexen-1-ol Verde 1500 Morales et al., 1997 Acetato Z-3-hexenilo Verde, frutado 750 Aparicio & Luna, 2002 Banana, floral 200 Reiners & Grosch, 1998 Verde, manzana 300 Morales et al., 2005 Verde, almendra amarga 300 Aparicio & Luna, 2002 Z-2-pentenal Verde ------ Morales et al., 1997 Pentan-1-ol Picante ------ Morales et al., 1997 Z-2-penten-1-ol Banana ------ Morales et al., 1997 1-penten-3-ona Verde, punzante 50 Aparicio & Luna, 2002 Verde, picante 0,73 Reiners & Grosch, 1998 Tierra húmeda ------ Morales et al., 1997 E-2-pentenal 1-penten-3-ol * Fuentes utilizadas: Angerosa et al. (2004) y Kalua et al. (2007). 16 1. Introducción General De esta forma, Angerosa et al. (2000c) utilizaron el Análisis de Regresión Lineal para relacionar los compuestos C6 y C5 de la ruta LOX con los atributos sensoriales evaluados por un panel de jueces entrenados, obteniendo valores de R2 no demasiado elevados para las distintas notas aromáticas “verdes” evaluadas (entre 0,21 y 0,65). Aún así, se encontraron ciertas relaciones interesantes, como el hecho de que el hexanal presenta un papel esencial en la formación de la mayoría de los atributos sensoriales “verdes”, mientras que el E-2-hexenal participa en las notas olfativas descritas bajo los términos hierba, banana y almendra, el E-2hexen-1-ol se asocia con las notas florales, frutadas y tomate, y el acetato de Z-3-hexenilo es el mayor contribuyente en las notas banana y cáscara de nuez. El Análisis de los Componentes Principales (PCA) y Mínimos Cuadrados Parciales (PLS) fueron utilizados por Servili et al. (1995) para establecer posibles relaciones entre la concentración de los compuestos volátiles del aceite de olive virgen evaluados mediante GCMS y los atributos sensoriales evaluados mediante la metodología de perfil de libre elección (FCP) y el análisis descriptivo cuantitativo (QDA). De los resultados obtenidos cabe destacar que las muestras de aceite evaluadas se agruparon en conjuntos similares tanto en función de su composición volátil, como a través de las puntuaciones obtenidas en el conjunto de notas sensoriales evaluadas al aplicar la técnica PCA. Se han encontrado buenas predicciones mediante la regresión PLS procedente de los datos de composición volátil y el QDA. La predicción de la nota sensorial de “hierba recién cortada” se obtuvo a partir de cinco compuestos volátiles no identificados, los cuales presentaban un espectro de masas similar, por lo que posiblemente se trataba de compuestos isómeros, aunque mediante GC-O se determinó que sólo uno de ellos presentaba capacidad aromática y posiblemente sea el que podría relacionarse con el descriptor sensorial. De la misma forma Morales et al. (1995) utilizaron el Escalado Multidimensional (MDS) para establecer las posibles inter e intra-relaciones entre los compuestos volátiles del aceite de oliva virgen y los atributos sensoriales evaluados por seis paneles de catadores distintos, dos de ellos integrados por jueces expertos y el resto formado por consumidores habituales y potenciales entrenados para el ensayo. Al aplicar la técnica de MDS las diversas notas sensoriales se clasificaron en siete grupos de diferentes percepciones sensoriales -dulce, frutado, fruta madura, fruta sobre-madura, indeseable, amargo-picante y verde- dentro de las cuales se clasificaron los distintos compuestos volátiles presentes en el aceite de oliva virgen, de forma que los agrupamientos de sustancias aromáticas obtenidos deberían explicar cada una de las percepciones sensoriales definidas. De esta forma, el E-2-hexenal se incluye en la percepción amargo-picante, debido a sus notas sensoriales de almendra amarga, al igual que el E-3-hexen-1-ol. Compuestos como Z-3-hexenal, E-2-hexen-1-ol, Z-3-hexen-1-ol, Z-2-penten1-ol y los ésteres C6 forman parte de la sensación de verde, mientras que el hexanal y el 1penten-3-ona se localizan en la percepción de dulce-frutado. 17 1. Introducción General Cabe destacar la elaboración de la denominada Rueda Sensorial para el aceite de oliva virgen extra llevada a cabo por Aparicio et al. (1995), en donde se representa el flavor global de un aceite a través de siete zonas sensoriales –verde, amargo-picante, indeseable, aceituna madura, fruta madura, frutado y dulce- mediante la utilización de datos sensoriales obtenidos a partir del QDA y técnicas estadísticas multivariantes, como el PCA. La asignación de coordenadas dentro de la rueda sensorial para cada compuesto volátil permite obtener información de las características sensoriales de estos componentes orgánicos en base a las propiedades sensoriales del sector de la rueda del que forman parte. Así, compuestos como el Z-3-hexen-1-ol, acetato de hexilo y acetato de Z-3-hexenilo fueron localizados en el sector “verde”, enfatizando la contribución de estos volátiles a la percepción de las notas sensoriales verdes, mientras que el hexanal y 1-penten-3-ona se incluyeron en el “dulce” y volátiles como el E-2-hexen-1-ol, 1-penten-3-ol y hexan-1-ol formaron parte de la zona de “indeseable”. Recientemente se ha desarrollado un método instrumental rápido y no destructivo, la denominada nariz electrónica, permitiendo el estudio de las posibles relaciones sinérgicas de los compuestos volátiles presentes en el aroma de los alimentos. Este equipo constituido por un conjunto de sensores normalmente de materiales poliméricos conductores que alteran su conductividad al ser expuestos a sustancias volátiles, son capaces de establecer la denominada “huella digital” del aroma de un producto e incluso discriminarla dentro de un conjunto de sustancias olorosas. Su uso en el aceite de oliva se ha aplicado en el reconocimiento y cuantificación de defectos típicos (García-González et al., 2002), también ha permitido monitorizar el proceso de enranciamiento (Aparicio et al., 2000), así como discriminar pastas y muestras de aceite en función de su calidad (García-González et al., 2003 y 2007). 1.3. COMPUESTOS FENÓLICOS DEL ACEITE DE OLIVA VIRGEN. Los compuestos fenólicos constituyen un extenso grupo de sustancias presentes de forma natural en los tejidos vegetales. Están presentes principalmente en los frutos, aunque también en menor proporción, en hojas, tallos y otros órganos vegetales. Los fenoles son metabolitos aromáticos secundarios e incluyen un amplio número de compuestos que presentan en su estructura un anillo aromático sustituido por uno o varios grupos hidroxilo (Macheix et al., 1990). Aunque resulta más conveniente definir estos compuestos fenólicos, en función de su origen metabólico, como aquellas sustancias que proceden de la ruta del ácido siquímico y del metabolismo fenilpropanoide (Ryan et al., 1998). La mayor parte de los compuestos fenólicos presentes en el aceite de oliva virgen están presentes también en el fruto o bien son derivados de éstos, transfiriéndose al aceite durante las distintas etapas del proceso de extracción (Servili et al., 1999a). 18 1. Introducción General Los compuestos fenólicos presentes en el fruto del olivo son reconocidos, entre otros aspectos, por su actividad antimicrobiana (Fleming et al., 1973; Tranter et al., 1993; Aziz et al., 1998), por su papel preventivo en las infecciones por Dacus oleae (Lo Scalzo et al., 1994) y por su actividad inhibidora de enzimas celulolíticas, tanto endógenas como exógenas (Heredía et al., 1990), constituyendo, por tanto, una parte importante del sistema químico de defensa de la aceituna. El fruto del olivo presenta un elevado contenido de fenoles, los cuales llegan a constituir hasta el 3% del peso fresco de la pulpa (Raina, 1995), siendo los ácidos fenólicos, alcoholes fenólicos, flavonoides y secoiridoideos los principales grupos fenólicos presentes. Los compuestos secoiridoideos constituyen el grupo fenólico más abundante en el fruto del olivo, encontrándose de forma exclusiva en la familia Oleaceae. Estos compuestos se caracterizan por incluir en su estructura molecular el ácido elenólico o algún derivado de éste. Dentro de estos secoiridoideos, la oleuropeína es el componente predominante en la aceituna, cuyo contenido puede alcanzar hasta un 14% de la materia seca en aceitunas verdes. Panizzi et al. (1960) establecieron que se trataba de un éster heterosídico del ácido elenólico y el 3,4dihidroxifeniletanol. Posteriormente, Kubo y Matsumoto (1984) aislaron en la pulpa de la aceituna el secoiridoideo ligustrósido, cuya estructura es similar a la oleuropeína, con la excepción de secoiridoideos que el presentes p-hidroxifeniletanol en la aceituna, sustituye al 3,4-dihidroxifeniletanol. aunque en menor proporción, Otros son la demetiloleuropeína y el nüzhenido, éste último localizado únicamente en la semilla del fruto (Servili et al., 1999b). Los compuestos 3,4-dihidroxifeniletanol (3,4-DHPEA) y p-hidroxifeniletanol (p-HPEA), conocidos, como hidroxitirosol y tirosol, respectivamente, son los alcoholes fenólicos más abundantes del fruto. También se han identificado una gran número de ácidos fenólicos como el ácido cinámico y sus derivados: ferúlico, p-cumárico, o-cumárico, cafeico, sinapínico; derivados del ácido benzoico: p-hidroxibenzoico, gálico, protocatéquico; derivados del ácido fenilacético: p-hidroxifenilacético (Brenes et al., 1992; Romani et al., 1999; Servili et al., 1999a). Dentro del grupo de los flavonoides, se han identificado flavonoles como quercetín-3-rutinósido y quercetín-3-ramnósido; flavonas como luteolín-7-glucósido, luteolín-5-glucósido y apigenín-7glucósido y antocianinas, siendo cianidina-3-glucósido y cianidina-3-rutinósido las presentes en mayor proporción en los frutos maduros (Vázquez-Roncero et al., 1974; Esti et al., 1998; Romani et al., 1999; Ryan et al., 1999). El verbascósido es el derivado del ácido hidroxicinámico más abundante en la aceituna (Fleuriet et al., 1984) y es un éster heterosídico del ácido cafeico y el 3,4-dihidroxifeniletanol. Otro derivado del ácido hidroxicinámico identificado en este fruto es el 1-cafeil-glucosa (Vázquez-Roncero et al., 1974). 19 1. Introducción General En la biosíntesis de estos compuestos se ha identificado un intermediario común, la Lfenilalanina, aminoácido aromático precursor de la mayoría de los compuestos fenólicos (Haslam, 1993). Las principales rutas biosintéticas implicadas en la formación de estos compuestos se han esquematizado en las Figuras 1.2 y 1.3: Ruta del ácido siquímico: ruta responsable de la formación de los aminoácidos aromáticos Lfenilalanina y L-tirosina. La glicólisis no oxidativa de la glucosa origina el fosfoenol piruvato y la eritrosa-4-fosfato, compuestos que se unen mediante una serie de reacciones dando lugar al ácido siquímico, precursor biosintético de los aminoácidos aromáticos. El posterior conjunto de reacciones implicadas en la formación del ácido p-cumárico a partir de L-fenilalanina, es lo que se conoce como “metabolismo general fenilpropanoide”. Las enzimas que catalizan las reacciones parciales de esta ruta son: L-fenialanina amonio liasa (PAL), cinamato-4-hidroxilasa (C4H) y hidroxicinamato CoA ligasa. FOSFOENOL PIRUVATO ERITROSA-4-FOSFATO + L-TIROSINA Ac. SINÁPÍNICO SIQUIMATO CORISMATO Ac. FERÚLICO Ac. CAFEICO L-FENILALANINA PAL Ac. p-CUMÁRICO Ac. CINÁMICO C4H H.CoA ligasa Ac. o-CUMÁRICO SINAPINIL-CoA FERULIL-CoA CAFEIL-CoA p-CUMARIL-CoA FLAVONOIDES SINAPINIL ALCOHOL CONIFERIL ALCOHOL CAFEIL ALCOHOL p-CUMARIL ALCOHOL LIGNINAS LIGNANOS Figura 1.2. Ruta del ácido siquímico y metabolismo general fenilpropanoide. (Fuente utilizada: Ryan et al., 2002). La enzima L-fenilalanina amonio liasa es clave en la biosíntesis de compuestos fenólicos, ya que cataliza la desaminación no oxidativa y esteroespecífica de la L-fenilalanina para formar el ácido trans-cinámico (Haslam, 1993). La posterior hidroxilación del ácido trans-cinámico, llevada a cabo por la enzima cinamato-4-hidroxilasa, tiene como resultado la formación del ácido p-cumárico. En esta reacción se requiere oxígeno y NADPH. Si la hidroxilación es llevada a cabo en la posición orto se genera el ácido o-cumárico. Mientras que la enzima hidroxicinamato CoA ligasa cataliza la formación de CoA ésteres de los ácidos hidroxicinámicos, en presencia de CoA, ATP e iones Mg2+. Estas moléculas poseen un papel 20 1. Introducción General importante en la síntesis posterior de fenoles como flavonoides y hidroxicinamil alcoholes, éstos últimos precursores de ligninas y lignanos. Ruta del ácido mevalónico: ruta responsable de la síntesis de los compuestos secoiridoideos del fruto y forma parte del metabolismo secundario de los terpenos. Damtoft et al. (1993) propusieron la ruta biosintética esquematizada en la Figura 1.3 para la formación de los secoiridoideos ligustrósido y oleuropeína a partir del ácido mevalónico. H 3C OH OH OH OH OH Ác. mevalónico CHO O O O OH OH OH COOH COOH COOH HO O O O O OGlu OGlu OGlu Ác. deoxilogánico Ác. 7-epilogánico HOOC COOMe O COOH Ác. 7-cetologánico GluOOC COOMe COOMe O O O OGlu OGlu OGlu 7-cetologanina 7-β-1-D-glucopiranosil 11-metil oleósido Éster 11-metil oleósido HO HO O O CO OMe HO O O Ligustrósido OGlu O COOMe O Oleuropeína OGlu Figura 1.3. Ruta del ácido mevalónico. Propuesta por Damtoft et al. (1993) para la biosíntesis de los secoiridoideos oleuropeína y ligustrósido presentes en la aceituna. (Fuente utilizada: Ryan et al., 2002). La presencia de los componentes fenólicos en el aceite de oliva virgen fue determinada en 1969 mediante la utilización de métodos colorimétricos por Cantarelli y Montedoro. Sin embargo han sido los estudios exhaustivos llevados a cabo durante los últimos veinte años los que han permitido identificar y clasificar los compuestos fenólicos hidrofílicos presentes en este 21 1. Introducción General producto. Se han identificado prácticamente las mismas familias que en la aceituna, a excepción de la ausencia de antocianinas y flavonoles, y la presencia de lignanos. Los ácidos fenólicos, similares a los encontrados en la aceituna, fueron los primeros compuestos fenólicos identificados en el aceite de oliva virgen. Éstas sustancias junto a los alcoholes fenólicos (hidroxitirosol y tirosol) y las flavonas (luteolina y apigenina), procedentes de la hidrólisis de sus correspondientes glucósidos presentes en la pulpa y que se produce durante el proceso de extracción del aceite, se encuentran en concentraciones muy bajas en el aceite de oliva virgen (Vázquez-Roncero et al., 1976; Solinas et al., 1981; Brenes et al., 1999). Los acetatos de hidroxitirosol (3,4-DHPEA-AC) y tirosol (p-HPEA-AC), que también se encuentran en bajas cantidades, son dos de los últimos compuestos cuya presencia ha sido descrita en la bibliografía para el aceite de oliva virgen (Brenes et al., 1999; Mateos et al., 2001). Además, se ha determinado la presencia de dos compuestos pertenecientes a la familia de los lignanos, el pinorresinol y el 1-acetoxipinorresinol (Brenes et al., 2000, Owen et al., 2000a). El pinorresinol, sus derivados y glicósidos de éstos han sido aislados de la corteza de los olivos y otras oleáceas (Tsukamoto et al., 1984 y 1985), por lo que, éstos podrían encontrarse como tales en la aceituna o proceder de la degradación hidrolítica de sus glicósidos. Sin embargo, los compuestos fenólicos mayoritarios en el aceite de oliva virgen son derivados secoiridoideos del hidroxitirosol y tirosol, los cuales proceden de la hidrólisis enzimática de la oleuropeína, la demetiloleuropeína y el ligustrósido, proceso que se inicia con la molienda del fruto y continua durante el batido de la pasta de aceituna debido a la acción de la enzima βglucosidasa. Los principales secoiridoideos del aceite son las formas dialdehídica y aldehídica del ácido elenólico unido al hidroxitirosol, denominadas generalmente como 3,4-DHPEA-EDA y 3,4-DHPEA-EA, respectivamente, y sus formas análogas del ácido elenólico unido al tirosol: pHPEA-EDA y p-HPEA-EA, respectivamente. La identificación de la estructura de los derivados 3,4-DHPEA-EDA, 3,4-DHPEA-EA y p-HPEA-EDA fue llevada a cabo en 1993 por Montedoro et al. mediante RMN y posteriormente confirmada por otros autores (Angerosa et al., 1995; Angerosa et al., 1996b; Owen et al., 2000a). En 1995, Angerosa et al. determinó la estructura del p-HPEA-EA mediante GC-MS, la cual fue confirmada posteriormente con RMN por Mateos et al. (2001). Aunque, aún en la actualidad, se desconocen los mecanismos bioquímicos que generan la presencia de estos compuestos secoiridoideos en el aceite de oliva virgen, se ha propuesto la ruta de biosíntesis esquematizada en la Figura 1.4. 22 1. Introducción General R R R O HO O COOMe I O - Glu O HO O COOMe O O HO COOMe II β-glucosidasa O OGlu O OH O R R O HO O COOMe O HO O COOMe III OH O O O Metilesterasa R - CH3 R O HO O HO O O COOH IV O O O O Figura 1.4. Mecanismo propuesto para la biosíntesis de los derivados secoiridoideos presentes en el aceite de oliva virgen. I: R=H, ligustrósido; R=OH, oleuropeína. II: R=H, p-HPEA-EA; R=OH, 3,4DHPEA-EA. III y IV: R=H, p-HPEA-EDA carboximetilada y decarboximetilada; R=OH, 3,4-DHPEA-EDA carboximetilada y decarboximetilada, respectivamente. (Fuente utilizada: Servili et al., 2004). CONTRIBUCIÓN DE LOS COMPUESTOS FENÓLICOS A LA CALIDAD DEL ACEITE DE OLIVA VIRGEN. Los compuestos fenólicos están relacionados con las notas sensoriales amargas del aceite de oliva virgen, así como con las sensaciones quimioestésicas de astringencia y picor característicos de este producto. Varios estudios han puesto de manifiesto la relación existente entre los atributos sensoriales positivos “amargo” y “picante” y el contenido fenólico total del aceite. En 1992, GutiérrezRosales et al. observaron una elevada correlación entre la intensidad de amargor del aceite de oliva virgen y la absorbancia a 225 nm de sus extractos fenólicos correspondientes, parámetro denominado por los autores como K225. 23 1. Introducción General Aunque, aún en la actualidad, no se han definido claramente las relaciones existentes entre los compuestos fenólicos individuales y las características sensoriales del aceite de oliva virgen, algunos estudios han puesto en evidencia tanto la falta de correlación existente entre los ácidos fenólicos y el amargor del aceite de oliva virgen, así como el importante impacto sensorial de los derivados secoiridoideos presentes en este producto (Uccella et al., 2001). De esta forma, se han descrito la elevada correlación estadística entre las formas 3,4-DHPEAEDA, 3,4-DHPEA-EA y p-HPEA-EDA y la intensidad de amargor del aceite de oliva virgen (García et al., 2001; Kiritsakis et al., 1998b; Gutiérrez-Rosales et al., 2003; Tovar et al., 2001). Por otro lado, en un intento de determinar las propiedades sensoriales de los compuestos fenólicos de forma individual, Gutiérrez et al. (2000) fraccionaron los fenoles de un aceite de oliva virgen utilizando HPLC preparativa encontrando cuatro picos mayoritarios. Tras su separación y aislamiento, los extractos fueron presentados a un panel de cata y fueron descritos dos de ellos como ligeramente amargos, otro de ellos como fuertemente amargo, y uno como picante. Los picos aislados no fueron identificados, aunque tras el análisis HPLC de la fracción más amarga se encontró que a su vez estaba constituida por al menos tres picos distintos. Un estudio más exhaustivo realizado por Andrewes et al. (2003) puso de manifiesto, tras el aislamiento e identificación parcial de diversas fracciones fenólicas a través de sus características de absorción en el UV y por MS, y posterior presentación ante un panel de cata, que aunque todas las fracciones fenólicas estudiadas fueron descritas como amargas y picantes, el p-HPEA-EDA, identificado mediante MS y RMN, es el principal contribuyente a las notas sensoriales picantes de los aceites de oliva virgen, al producir una sensación ardiente en la parte posterior de la garganta, mientras que la forma 3,4-DHPEA-EDA sólo causó una pequeña sensación picante en los catadores. Por otro lado también es conocida desde hace tiempo la capacidad antioxidante de los compuestos fenólicos presentes en el aceite de oliva virgen, ya que son numerosos los autores que han relacionado el contenido de compuestos fenólicos con su estabilidad oxidativa, evaluada mediante el test de capacidad de absorción del radical oxígeno (ORAC), como con la vida útil del producto, evaluada mediante ensayos acelerados de estabilidad oxidativa, como son el método Rancimat o el método del oxígeno activo (AOM) (Gutiérrez et al., 1977; Gutfinger, 1981; Montedoro et al., 1992a; Baldioli et al., 1996; Litridou et al., 1997; Salvador et al., 1999; Ninfali et al., 2002). Estos compuestos actúan como antioxidantes primarios evitando la propagación de las reacciones oxidativas mediante la donación de un radical hidrógeno a los radicales peroxilo que se forman durante la fase de iniciación de la oxidación lipídica, con la consecuente formación de radicales fenoxilo, los cuales son estables por resonancia y relativamente no reactivos frente a los ácidos grasos y el oxígeno, por lo que no son capaces de iniciar o propagar reacciones de oxidación. La eficacia de los compuestos fenólicos como sustancias antioxidantes depende de 24 1. Introducción General la estabilidad por resonancia de los radicales fenoxilo a los que dan lugar, que se encuentra condicionada por la presencia de sustituyentes donadores de electrones en el anillo aromático y por el tamaño de los mismos (Scott, 1965). Existen varios estudios sobre la capacidad antioxidante individual que presentan determinados compuestos fenólicos del aceite de oliva virgen, como es el caso del hidroxitirosol, tirosol y ácidos fenólicos, como el cafeico, p-cumárico, ferúlico o vanílico, cuya actividad antioxidante ha sido estudiada tras su adición a aceite de oliva refinado o de girasol, observándose el gran poder antioxidante del hidroxitirosol (Chimi et al., 1991; Papadopoulos et al., 1991). Está claramente confirmado que el hidroxitirosol y sus derivados secoiridoideos (3,4-DHPEAEDA y 3,4-DHPEA-EA) son los antioxidantes naturales del aceite de oliva virgen que muestran una mayor capacidad antioxidante, frente al tirosol y sus derivados secoiridoideos, los cuales demostraron una escasa o nula actividad antioxidante (Baldioli et al., 1996; Mateos, 2002; Carrasco-Pancorbo et al., 2005). La razón de las diferencias encontradas entre ambas especies fenólicas se debe a la presencia del grupo o-difenol en la estructura del hidroxitirosol y sus derivados, la cual origina radicales fenoxilo muy estables por la presencia de grupos donadores de electrones. La elevada capacidad antioxidante demostrada por el hidroxitirosol y sus derivados permitiría su uso como aditivos antioxidantes en la industria alimentaria, además de incrementar el valor nutricional de los productos (Shahidi et al., 1992), sin embargo su empleo no se ha generalizado debido al carácter poco liposoluble del hidroxitirosol y a que sus derivados secoiridoideos son amargos. Asimismo, la capacidad antioxidante de los compuestos fenólicos del aceite de oliva virgen, y en especial del hidroxitirosol, ha sido relacionada durante los últimos años con una efectiva actividad protectora frente a enfermedades cardiovasculares, neuro-degenerativas y algunos tumores, debido a que estas sustancias son capaces de inhibir ciertas especies reactivas de oxígeno (ROS) responsables del estrés oxidativo que se produce en todas estas enfermedades. Así por ejemplo, estudios in vivo han demostrado que la ingesta habitual de aceite de oliva virgen reduce el riesgo relativo estimado de cáncer de pecho (Martín-Moreno et al., 1994), páncreas (Soler et al., 1998), colón y recto (Stoneham et al., 2000), entre otros. Mientras que, otras investigaciones in vitro han establecido la capacidad protectora del hidroxitirosol frente a los cambios producidos por los peroxinitrilos en las bases del DNA (Dejana et al., 1999), su actividad inhibidora de los procesos de agregación plaquetaria (Petroni et al., 1995), así como su capacidad protectora de los eritrocitos, las lipoproteínas de baja densidad y los fosfolípidos de los liposomas frente a procesos oxidativos (Aeschbach et al., 1994; Visioli et al., 1995; Manna et al., 1999). 25 1. Introducción General Dentro de los derivados secoiridoideos presentes en el aceite de oliva virgen, resulta de gran interés destacar el reciente re-descubrimiento del p-DHPEA-EDA como un potente agente antiinflamatorio no-esteroideo, similar al ibuprofeno, y denominado por los autores con el nombre de oleocantal (Beauchamp et al., 2005). En lo que respecta a otros compuestos fenólicos presentes en este producto en concentraciones apreciables, como son los lignanos, varios estudios han mostrado el interés farmacológico de estas sustancias debido a su actividad antiviral, antimitótica y anti-tumoral (Nikaido et al., 1981; MacRae et al., 1984; Oomad et al., 1998). Por otro lado, aunque la capacidad antioxidante de estas sustancias fue expuesta por Owen et al. (2000b), otros autores no han encontrado ninguna correlación entre la concentración de lignanos y la estabilidad oxidativa del aceite de oliva virgen (Tovar et al., 2001). 1.4. FACTORES QUE INFLUYEN EN LA COMPOSICIÓN VOLÁTIL Y FENÓLICA DEL ACEITE DE OLIVA VIRGEN DE CALIDAD. El perfil fenólico y volátil del aceite de oliva virgen, así como el resto de componentes minoritarios y mayoritarios del mismo, depende de una serie de interacciones entre factores genéticos, ambientales y tecnológicos que influyen tanto en el desarrollo y maduración del fruto, como en el posterior procesado del mismo (Montedoro et al., 1991). INFLUENCIA DE ASPECTOS AGRONÓMICOS Y PEDOCLIMÁTICOS. El principal factor que determina el perfil de compuestos volátiles y fenólicos de un aceite de oliva virgen es la variedad de aceituna de la que procede, lo cual se debe al hecho de que el contenido enzimático de un fruto, responsable tanto de la formación de sustancias volátiles durante su molturación como de la acumulación previa y posterior transformación de los metabolitos fenólicos de la aceituna, está determinado genéticamente. Así, diversos estudios han llevado a cabo la clasificación de aceites de oliva virgen monovarietales en función tanto de sus componentes volátiles (Angerosa et al., 1999a; Aparicio et al., 2002; Luna et al., 2006), como fenólicos (Briante et al., 2002; Gómez-Alonso et al., 2002). La composición volátil y fenólica cuantitativa del producto depende de la actividad de las enzimas presentes en su fruto, la cual se ve afectada por una serie de parámetros externos, como son el grado de maduración del fruto, el área geográfica de crecimiento, la disponibilidad de agua durante el desarrollo del fruto, así como las condiciones tecnológicas utilizadas en la extracción del aceite de oliva virgen. Así, se ha determinado como la actividad enzimática de la mayoría de las enzimas responsables de la formación de los volátiles C6 y C5 a través de la ruta LOX disminuye a 26 1. Introducción General medida que madura el fruto, como es el caso de la ADH (Salas et al., 1998) y la LOX (Salas et al., 1999c), lo cual apoya la disminución en la formación de estos compuestos volátiles que han observado numerosos autores, a medida que aumenta el grado de maduración de las aceitunas (Morales et al., 1996; Aparicio et al., 1998). Aún así, la evolución de los distintos compuestos C6 es variable; por ejemplo, se ha descrito como el E-2-hexenal aumenta hasta una concentración máxima, lo cual sucede cuando el color del fruto pasa de verde-amarillento a púrpura, momento a partir del cual su contenido en el aceite de oliva virgen comienza a disminuir (Solinas et al., 1987b), y mientras que el contenido de la mayoría de los alcoholes C6 disminuye con la maduración del fruto, la concentración de hexan-1-ol aumenta en algunas variedades (Benincasa et al., 2003). De igual forma se ha observado un importante descenso en el contenido de compuestos fenólicos presentes en el aceite de oliva virgen a medida que aumenta el índice de madurez del fruto, sobre todo en los derivados secoiridoideos del hidroxitirosol y tirosol (Pannelli et al., 1989; Brenes et al., 1999; Uceda et al., 1999), lo cual podría estar relacionado con la disminución del contenido de precursores fenólicos presentes en la aceituna, como es el caso de la oleuropeína y el ligustrósido, hecho observado por varios autores a medida que el fruto madura (Amiot et al., 1986; Ryan et al., 1999; Morelló et al., 2004). El contenido de volátiles C6 y C5 también puede verse modificado por factores geográficos. Por ejemplo, el contenido mayoritario de E-2-hexenal en el aroma de los aceites europeos señalado por numerosos autores (p.e. Cavalli et al., 2004) no ha sido observado en muchos aceites australianos (Tura et al., 2004), mientras que los aceites obtenidos en la zona del Magreb se caracterizan por un gran contenido en ésteres C6 (Reiners et al., 1998). Asimismo, el estudio de la composición volátil de diversos aceites de oliva virgen monovarietales procedentes de dos áreas italianas distintas, permitió clasificar correctamente todas las muestras en función de su origen geográfico basándose principalmente en la composición de aldehídos y alcoholes C6, lo que sugiere que las condiciones medioambientales pueden influir en la actividad de enzimas como la ADH (Vichi et al., 2003a). Por otro lado, la disponibilidad de agua por parte del fruto durante su desarrollo, ha sido descrito como uno de los factores agronómicos más importantes en la posterior composición fenólica del aceite de oliva virgen obtenido. Varios autores han determinado un menor contenido fenólico en los aceites obtenidos a partir de frutos desarrollados bajo diversas técnicas de riego, y que por tanto, no han sufrido condiciones de estrés hídrico apreciable, encontrando una relación inversamente proporcional entre las dosis de agua aplicadas en el olivar y la presencia de sustancias fenólicas en los aceites (D´Andria et al., 1996; Motilva et al., 1999; Motilva et al., 2000; Tovar et al., 2001; Romero et al., 2002; Servili et al., 2007). Este hecho podría estar relacionado con la menor concentración fenólica observada en los frutos cuando se aplica riego al olivar (Patumi et al., 1999; Tovar et al., 2002b), y también ha sido 27 1. Introducción General asociado a cambios en la actividad de las enzimas implicadas en la síntesis fenólica, como la L-fenilalanina amonio liasa (PAL), cuya actividad es mayor ante situaciones de estrés hídrico elevado, favoreciéndose la acumulación de fenoles en la drupa y por lo tanto un mayor contenido fenólico en el aceite de oliva virgen obtenido. Aún así, no todas los compuestos fenólicos presentes en el aceite de oliva virgen se ven afectados de igual forma por la disponibilidad de agua durante el desarrollo del fruto, así es el contenido de los derivados secoiridoideos 3,4-DHPEA-EDA, 3,4-DHPEA-EA y p-HPEA-EDA el que más disminuye al descender el estrés hídrico de los frutos (Tovar et al., 2001; Romero et al., 2002; Servili et al. 2007). En lo que respecta a la influencia de la aplicación de riego en el olivar sobre la composición volátil del aceite posteriormente obtenido, recientemente se ha descrito un aumento significativo de los compuestos C6, como el E-2-hexenal, hexanal, Z-3-hexen-1-ol y hexan-1-ol, en aquellos obtenidos a partir de frutos que no han sufrido condiciones de estrés hídrico apreciables (Gómez-Rico et al., 2006; Servili et al., 2007), por lo que se puede decir que la actividad de las enzimas de la ruta LOX, especialmente la ADH y la HPL, puede verse afectada por el estado hídrico de las aceitunas. INFLUENCIA DE ASPECTOS TECNOLÓGICOS DURANTE LA EXTRACCIÓN DEL PRODUCTO. Varios autores han apuntado la importancia de las distintas fases de extracción del aceite de oliva virgen sobre la composición minoritaria del mismo y los cambios observados en estos compuestos. Así, el uso de molinos metálicos permite una mayor ruptura de los tejidos vegetales dando lugar a una mejor extracción de las sustancias fenólicas en comparación con los molinos de piedra (Caponio el al., 2003), obteniéndose de este modo aceites más amargos y con una mayor estabilidad oxidativa (Di Giovacchino et al., 2002). De igual forma, Servili et al. (2002b) describieron también cambios en la composición volátil de este producto en función del tipo de molino utilizado, de forma que la cantidad total de volátiles era significativamente superior en aceites obtenidos a partir de molinos de piedra, sobretodo en lo que respecta al contenido de Z-3-hexen-1-ol, hexanal y E-2-hexenal. Este último compuesto llegó casi a triplicarse frente al aceite obtenido utilizando un molino metálico de discos. La razón de ello, es que la temperatura que puede alcanzar la pasta de aceituna después de su molturación en un molino metálico es 10 ºC superior a la de un molino de piedra, con el consecuente descenso en la actividad de las enzimas de la ruta LOX (Salas et al., 1998 y 1999b). En el caso de los molinos metálicos, también se ha descrito que el tamaño de la luz de malla del tamiz es un importante factor a valorar, ya que cuanto menor es el diámetro del tamiz, 28 1. Introducción General mejor es la extracción de las sustancias polares presentes en los tejidos vegetales, como son los compuestos fenólicos (Di Giovacchino et al., 2002). En lo que respecta al posterior proceso de batido, esta etapa permite no sólo la ruptura de las emulsiones entre la fase acuosa y oleosa presentes en la pasta de aceituna y la consiguiente agregación física de las partículas de aceite, sino que además tengan lugar numerosos procesos bioquímicos que afectan a la calidad final del producto obtenido. De hecho, las condiciones utilizadas durante esta etapa afectan tanto al rendimiento graso obtenido en el proceso de extracción, como a la composición minoritaria del aceite de oliva virgen. El tiempo y la temperatura de batido son las principales variables a controlar durante esta etapa, de forma que es posible cambiar potencialmente la composición volátil y fenólica del aceite de oliva virgen obtenido y, por consiguiente, sus características sensoriales. Así, un incremento de la temperatura de batido generalmente implica un mayor contenido fenólico en los aceites (Di Giovacchino et al., 1991; Ranalli et al., 2001), debido al aumento que se produce en los coeficientes de partición de estos compuestos entre la fase acuosa y oleosa de la pasta de aceituna, y que supone el incremento de la solubilidad relativa en la fase oleosa (Rodis et al., 2002). Por el contrario, en la composición volátil del aceite obtenido disminuye el contenido de Z-3-hexen-1-ol y ésteres C6, mientras que aumenta el hexan-1-ol y E-2-hexen-1-ol, además de favorecerse la acumulación de 2-metilbutanal y 3-metilbutanal, a causa de la activación de la ruta de conversión de los aminoácidos (Morales et al., 1999; Angerosa et al., 2001). Aún así, en varios estudios llevados a cabo en procesos de extracción a escala de laboratorio, en donde se han procesado lotes de frutos inferiores a 10-20 Kg, se ha descrito un descenso en la concentración fenólica del aceite al incrementarse la temperatura de batido, lo cual, independientemente del aumento de la solubilidad de estas sustancias en la fase oleosa, es atribuido a la acción de enzimas oxidativas como la polifenoloxidasa y peroxidada. Estos resultados aparentemente contradictorios pueden explicarse en función de la concentración de O2 atmosférico en contacto con la pasta de aceituna durante el batido que favorece la degradación oxidativa de los compuestos fenólicos, y que es más evidente al procesar poca cantidad de aceituna (Servili et al., 1994; Angerosa et al., 2001). Este hecho pone en evidencia la precaución de trasladar las pruebas realizadas a escala de laboratorio para predecir los resultados a obtener en plantas de extracción industriales. Por otro lado, los tiempos de batido largos favorecen la degradación oxidativa, ya sea química o enzimática, de los compuestos fenólicos, obteniéndose aceites de oliva virgen con un menor contenido en las formas 3,4-DHPEA-EDA, 3,4-DHPEA-EA y p-HPEA-EDA (Lercker et al., 1999; Angerosa et al., 2001; Di Giovacchino et al., 2002), aunque se ha puesto de manifiesto que una reducción en la disponibilidad de oxígeno, disminuye la actividad de la polifenoloxidasa y peroxidasa, aumentando el contenido fenólico del aceite (Servili et al., 1999). Sin embargo, el 29 1. Introducción General contenido volátil de los aceites se ve incrementado, debido principalmente a un aumento de los aldehídos y alcoholes C6, compuestos con umbrales de detección bajos y que por tanto contribuyen en gran medida al aroma del producto (Angerosa et al., 2001; Ranalli et al., 2003). El proceso de separación sólido-líquido que permite extraer el aceite de oliva virgen de la pasta de aceituna puede realizarse de diferentes formas. En la elección de uno u otro sistema se debe considerar que la composición fenólica y volátil del aceite puede verse afectada. La utilización de los sistemas de centrifugación de tres fases implica la adición de agua en el proceso, aproximadamente en torno a 40-60 L por 100 Kg de pasta, para conseguir la correcta separación de las mismas, ejerciendo un efecto de lavado sobre el aceite, que puede modificar el equilibrio de partición y arrastrar parte de las sustancias polares, como los compuestos fenólicos y sustancias volátiles. Algunos estudios han descrito que los aceites obtenidos empleando sistemas de extracción por presión o equipos de percolación para la separación sólido-líquido son más ricos en fenoles y en volátiles C6, como Z-3-hexen-1-ol, hexan-1-ol y E2-hexen-1-ol, que los obtenidos por sistemas de centrifugación en tres fases (Nergiz et al., 1991; Di Giovacchino et al., 1994; Di Giovacchino et al., 1995). Como mejora tecnológica para la elaboración del aceite de oliva virgen, en la década de los noventa se introdujo un nuevo sistema de centrifugación en dos fases que no necesitaba de la adición de agua a la pasta de aceituna para efectuar la separación sólido-líquido. Como cabía esperar, varios estudios han descrito que los aceites obtenidos mediante este sistema muestran un mayor contenido medio en fenoles y volátiles C6, como E-2-hexenal y alcoholes C6, respecto a los obtenidos por centrifugación de tres fases, aunque no se encontraron diferencias estadísticamente significativas (Angerosa et al., 1996b y 2000b; Ranalli et al., 1996; Salvador et al., 1998; Di Giovacchino et al., 1994 y 2001). Finalmente, durante la separación líquido-líquido, que se efectúa para limpiar el aceite completamente de los restos de aguas de vegetación y que actualmente suele llevarse a cabo empleando centrífugas verticales, se produce de nuevo la reducción en el contenido en fenoles (Ranalli et al., 1998). Esta disminución se debe a la adición de agua, que suele estar en torno a una relación 1:1 a 1.5:1 v/v (agua/aceite) y que se realiza en esta etapa del proceso de extracción para el adecuado funcionamiento de la centrífuga. 30 2. OBJETIVOS 2. Objetivos El objetivo general de la Tesis Doctoral ha sido el estudio de la influencia que distintos factores agronómicos y tecnológicos ejercen sobre los componentes minoritarios del aceite de oliva virgen, y muy especialmente sobre la composición fenólica y volátil, estrechamente relacionada con la calidad de este producto y que por tanto representan en gran medida el grado de preferencia de este aceite frente a otras grasas vegetales comestibles presentes en el mercado. A continuación se resumen los objetivos específicos planteados en este trabajo: Influencia de diferentes estrategias de riego en el olivar sobre la calidad y los componentes mayoritarios y minoritarios del aceite de oliva virgen. • Evaluar la influencia que diferentes tratamientos de riego ejercen en el desarrollo y productividad de un olivar adulto de baja densidad con un marco tradicional de plantación (Olea europaea L. Cornicabra cv.), así como sus efectos sobre la composición y calidad del aceite de oliva virgen obtenido. Resulta de especial interés el estudio de los compuestos fenólicos y volátiles, debido a la gran relevancia de estos componentes minoritarios sobre la características organolépticas de este aceite de oliva monovarietal, caracterizado por una destacada presencia del atributo sensorial amargo. • Evaluar la viabilidad de diversas programaciones de riego basadas en medidas del estado hídrico de la planta en dos olivares jóvenes de cubierta incompleta (Olea europaea L. Cornicabra cv. y Morisca cv.), como son el potencial hídrico del tronco (stem water potential, SWP) y las fluctuaciones del diámetro del tronco (trunk diameter fluctuations, TDF), respecto de la metodología de riego propuesta por FAO (Food and Agriculture Organization), y analizar su repercusión sobre la composición de los aceites de oliva virgen obtenidos. • Optimizar la aplicación de riego en los olivares Cornicabra de marco tradicional de la región de Castilla-La Mancha, teniendo en cuenta la escasez de recursos hídricos que presenta esta zona de la geografía española y que obliga a establecer un adecuado compromiso entre la producción del cultivo y el consumo de agua, con el fin de mejorar la productividad y obtener un producto de excelentes características químicas y sensoriales, a la vez que se racionaliza el gasto de los recursos hídricos disponibles. • Analizar el efecto de la aplicación de programaciones de riego en dos olivares de cubierta incompleta (Olea europaea L. Cornicabra cv. y Morisca cv.) cultivados en zonas geográficas españolas diferentes, Castilla-La Mancha y Extremadura, sobre los componentes mayoritarios y minoritarios de los aceites de oliva virgen obtenidos. 33 2. Objetivos Efecto de los factores agronómicos “variedad” e “índice de madurez” sobre los componentes minoritarios del fruto (Olea europaea L.) de diversas variedades españolas y en sus aceites de oliva virgen correspondientes. • Conocer el perfil cualitativo y cuantitativo de la fracción fenólica presente en los frutos, a distintos estadíos de maduración, de diversas variedades españolas (Olea europaea L. Arbequina cv., Cornicabra cv., Morisca cv., Picolimón cv., Picual cv. y Picudo cv.), cultivadas en un mismo olivar experimental, y por tanto, en las mismas condiciones agronómicas y pedoclimáticas. • Ampliar el conocimiento sobre los principales compuestos minoritarios presentes en aceites de oliva virgen monovarietales, con el fin de determinar su relación con los componentes precursores presentes en el fruto, así como la presencia de posibles marcadores varietales. • Estudiar la evolución de los componentes mayoritarios y minoritarios en los aceites de oliva virgen Cornicabra obtenidos durante del proceso de maduración del fruto y establecer el período óptimo de recogida de los frutos de esta variedad, en base a las características químicas y sensoriales de los aceites obtenidos. Influencia de la etapa tecnológica de batido de la pasta sobre los principales componentes minoritarios del aceite de oliva virgen (Cornicabra cv.). • Estudiar la influencia de las variables tiempo y temperatura durante la etapa tecnológica de batido sobre la composición fenólica y volátil de la pasta de aceituna, así como en los aceites de oliva virgen obtenidos. • Definir las condiciones de batido óptimas en la variedad Cornicabra, cultivada en Castilla-La Mancha, de manera que puedan ser aplicadas por las almazaras industriales de la región para optimizar las características sensoriales del aceite de oliva virgen. 34 3. MATERIAL Y MÉTODOS 3. Material y Métodos 3.1. PLANIFICACIÓN EXPERIMENTAL DE LA APLICACIÓN DE RIEGO EN EL OLIVAR DE MARCO TRADICIONAL (Olea europaea L. Cornicabra cv.). Este ensayo fue llevado a cabo durante las campañas olivareras 2003/04 y 2004/05 en una parcela propiedad de la Conserjería de Agricultura y Medio Ambiente, ubicada a 3 Km de la Escuela en Capacitación de Almodóvar del Campo (Ciudad Real). En ella está ubicado un olivar adulto de marco tradicional (50 años, marco 12 x 12 m2) de la variedad Cornicabra (Olea europaea L.), con una densidad de 70 olivos por hectárea y una superficie total de 46080 m2. El clima de la zona es continental-mediterráneo con una precipitación media anual de 404 mm, mayoritariamente distribuida fuera de la estación veraniega. Durante 2003 y 2004 la precipitación registrada fue de 426 y 484 mm, respectivamente, siendo de 41 y 138 mm desde mayo a septiembre, época que coincide con el periodo de riego en la parcela. TRATAMIENTOS DE RIEGO Y ORGANIZACIÓN DE LA PARCELA. La aplicación de los tratamientos de riego que constituyen este ensayo comenzó en 2001, encontrándose la parcela originariamente en condiciones de secano. Las estrategias estudiadas fueron las siguientes: (1) Secano, sin aporte de riego. Actuó como control, con el fin de comparar los datos obtenidos con los restantes tratamientos. (2) Riego Deficitario Regulado o, en inglés, Regulated Deficit Irrigation (RDI). El límite legal de riego permitido en numerosas zonas olivareras españolas es de 100 mm, por ello para este tratamiento se estableció como objetivo dar un riego durante ambas campañas inferior a 75 mm, en función de la climatología y el estado fenológico de los olivos, aunque en cada campaña se evaluaron dos estrategias de riego distintas. Durante el 2003, el agua fue aplicada durante toda la estación de riego con una distribución de 28 mm en mayo y junio, 21 mm en julio y agosto y 7 mm en septiembre (RDI-1); mientras que en 2004, el agua fue aplicada solamente a partir de agosto, cuando comienza la acumulación de aceite en el fruto (RDI-2). (3) FAO. Este tratamiento tuvo como objetivo aplicar dosis de riego equivalentes al 100% de la demanda evapotranspirativa del olivo, es decir, reponer el 100% de las pérdidas hídricas del cultivo en función de la evapotranspiración del cultivo (ETc), la cual fue estimada según la metodología propuesta por la FAO (Food and Agriculture Organization). De esta forma las necesidades hídricas de los olivos se determinaron restando la precipitación efectiva (41 mm en 2003 y 138 mm en 2004) del valor de evapotranspiración del cultivo (ETc), calculado este último término según la siguiente ecuación (Doorenbos y Pruitt, 1977); ETc = Kc x ETo x Kr 37 3. Material y Métodos donde ETo es la evapotranspiración de referencia del cultivo, la cual se estimó usando la ecuación de Penman-Monteith según datos climáticos obtenidos de una estación meteorológica cercana y empleando los coeficientes de cultivo (Kc) estimados por Orgaz y Fereres en 1997 (0,55 en mayo, junio y septiembre y 0,50 en julio y agosto). Por último, el coeficiente reductor (Kr) que depende de la densidad y tamaño de los olivos, se calculó mediante la ecuación; Kr = 2 x π x D2 x N / 4,1 x 105, siendo D el diámetro medio de la copa de los olivos (m) y N la densidad de la plantación de olivos (olivos/Ha). (4) 125 FAO. La dosis de riego aplicada en este tratamiento fue incrementada un 25% respecto al tratamiento FAO, ya que en condiciones de baja cobertura del terreno, como es el caso de este olivar de baja densidad (70 olivos/Ha), las necesidades hídricas reales del olivar pueden ser ligeramente superiores a las calculadas mediante la metodología FAO. En la experimentación realizada se utilizó un diseño estadístico de bloques al azar con cuatro repeticiones de cada tratamiento de riego, lo que supuso un total de dieciséis bloques distintos. Cada bloque elemental estuvo compuesto por tres filas de cuatro olivos cada una (1728 m2), de los que se tomaron para los muestreos los dos olivos centrales de la fila intermedia. El ensayo se encontraba rodeado por dos filas de olivos en regadío que actuaban de bordes. La Figura 3.1 representa de forma esquemática el diseño estadístico utilizado en el olivar experimental. Figura 3.1. Diseño estadístico utilizado en el olivar experimental Cornicabra de marco tradicional. Secano; RDI; FAO; 125 FAO; , olivo borde. El suministro de las diferentes dosis de riego se realizó mediante portagoteros a lo largo de la línea de olivos, realizándose un bucle alrededor de cada árbol, donde se insertaron ocho goteros autocompensantes de 4 l/h. Al comienzo de cada parcela elemental se instaló un 38 3. Material y Métodos contador con el fin de conocer la cantidad de agua suministrada, y un contador totalizador de cada tratamiento de riego. Destacar que, a excepción de las dosis de agua aplicadas a los olivos, el resto de las prácticas agronómicas y fitosanitarias fueron similares en toda la parcela. Las dosis de agua aplicadas en la campaña 2003 en cada tratamiento de riego fueron: 56 mm en RDI-1, 148 mm en FAO y 206 mm en 125 FAO. Para 2004: 60 mm en RDI-2, 124 mm en FAO y 154 mm en 125 FAO. Con la finalidad de describir el estado hídrico de los olivos sometidos a los distintos tratamientos de riego, se presentan en la Tabla 3.1 los valores de las integrales de estrés hídrico (SΨ) (MPa x día, según Myers, 1998), calculadas a partir de los datos de potencial hídrico del tronco obtenidos a mediodía, y el valor potencial hídrico mínimo registrado durante cada campaña. Tabla 3.1. Dosis de agua aplicada en cada tratamiento y distintos parámetros representativos del estrés hídrico de los olivos Cornicabra durante 2003 y 2004. Dosis agua aplicada (mm) SΨ (MPa x día) Potencial hídrico de tronco mínimo (MPa) SECANO 0,0 332 -4,1 (mediados de septiembre) RDI-1 56,0 316 -4,1 (mediados de septiembre) FAO 148,0 218 -2,3 (mediados de septiembre) 125 FAO 206,0 172 -1,8 (mediados de septiembre) SECANO 0,0 269 -4,1 (mediados de octubre) RDI-2 60,0 223 -2,9 (inicios de agosto) FAO 124,0 176 -2,2 (finales de septiembre) 125 FAO 154,0 159 -1,7 (mediados de octubre) 2003 2004 * Datos proporcionados por el Dr. Alfonso Moriana (C.M.A. El Chaparrillo, Ciudad Real). TOMA DE MUESTRA DEL FRUTO. Durante la campaña olivarera 2003/04 se realizaron cinco muestreos en distintos grados de maduración del fruto en cada uno de los dieciséis bloques en los que se dividía la parcela, de forma que fue posible estudiar no sólo el efecto de los distintos tratamientos de riego sobre el fruto y el aceite de oliva extraído, sino también la evolución de los distintos parámetros analíticos y de calidad a lo largo de la maduración del fruto. Los muestreos se efectuaron basándose en el grado de maduración del fruto, definido por la pigmentación de la piel de las aceitunas, correspondiéndose a los colores verde, pintona (al inicio y al final del envero), morada y negra. Por el contrario, durante la campaña 2004/05 se realizaron únicamente tres muestreos, correspondiéndose con la pigmentación pintona (inicio y final del envero) y morada del fruto. 39 3. Material y Métodos La recolección de las aceitunas en las dos campañas olivareras fue llevada a cabo mediante el sistema manual de ordeño desde noviembre hasta finales de diciembre. A excepción del quinto y último muestreo realizado en la primera campaña, que se llevó a cabo a mediados de enero utilizando un vibrador; sistema mecánico que agita los pies del olivo produciendo el desprendimiento de las aceitunas. Una vez recogidos los frutos, se procedió a su molturación inmediata en la Planta Piloto de Tecnología de Alimentos (UCLM), empleándose el sistema de extracción a escala de laboratorio Abencor (Abengoa S.A., Sevilla, España) (ver epígrafe 3.5). El aceite se almacenó en oscuridad en botellas de vidrio color topacio a 4º C y sin espacio de cabeza hasta su análisis. 3.2. PLANIFICACIÓN EXPERIMENTAL DEL RIEGO EN OLIVARES JÓVENES DE CUBIERTA INCOMPLETA (Olea europaea L. Cornicabra cv. y Morisca cv.). Este ensayo experimental fue llevado a cabo durante las campañas olivareras 2005/06, 2006/07 y 2007/08. Se utilizaron dos parcelas experimentales de las variedades Cornicabra y Morisca. El olivar Cornicabra estaba situado en la Finca “La Entresierra” (Ciudad Real) y es propiedad de la Consejería de Agricultura de la Junta de Comunidades de Castilla-La Mancha. Fue plantado en 1999, con una superficie total de 3,2 hectáreas y un marco de plantación de 4,75 x 7,00 m2. El olivar de la variedad Morisca, situado en la Finca “La Orden” (Badajoz) y propiedad de la Consejería de Agricultura y Medio Ambiente de la Junta de Extremadura, fue plantado en 1998, con una superficie total de 1,0 hectárea y un marco de plantación de 6,00 x 4,00 m2. Ambas zonas presentan un clima continental-mediterráneo, aunque Badajoz muestra influencias atlánticas, debido a su proximidad a la costa portuguesa. La media anual de precipitaciones es de 404 mm (Ciudad Real) y 475 mm (Badajoz), distribuidas mayoritariamente fuera de la estación veraniega. Las precipitaciones registradas en Ciudad Real fueron 172 y 412 mm durante 2005 y 2006, respectivamente, y 324 y 199 mm a lo largo de 2006 y 2007 en Badajoz. Las lluvias durante el período de riego (desde mayo a septiembre) fueron alrededor de 27 y 95 mm en Ciudad Real (año 2005 y 2006, respectivamente), y 40 y 102 mm en Badajoz (año 2006 y 2007, respectivamente). A pesar de que las lluvias en este período en 2006 (Ciudad Real) y 2007 (Badajoz) fueron anormalmente altas, ambos olivares sufrieron los periodos de sequía propios de la estación veraniega. ESTRATEGIAS DE RIEGO Y ORGANIZACIÓN DE LAS PARCELAS. Las estrategias de riego bajo estudio empleadas en ambas parcelas fueron las siguientes: (1) Tratamiento de riego basado en la metodología FAO. Fue utilizado como control, con el fin de evaluar la eficacia del resto de las estrategias evaluadas. Este método suministró dosis de 40 3. Material y Métodos riego equivalentes al 100% de la evapotranspiración del cultivo (100% ETc), con el fin de reponer completamente el agua extraída del terreno por parte de los olivos. La evapotranspiración del cultivo se calculó, tal y como se ha explicado previamente en el apartado 3.1., mediante la ecuación ETc = ETo x Kc x Kr (Doorenbos y Pruitt, 1974). (2) Estrategia de riego basada en las Fluctuaciones del Diámetro del Tronco o, en inglés, Trunk Diameter Fluctuations (TDF). Las dosis de agua aplicadas dependieron de las medidas de la fluctuación diaria del diámetro de tronco, realizadas con dendrómetros (modelo DF 2.5; Solartron Metrology, West Sussex, UK), que tomaron datos con una frecuencia de 30 segundos y calcularon los valores medios cada 15 minutos. Los ciclos de TDF permitieron obtener dos índices: la Tasa de Crecimiento de Tronco (TCT), calculado como la pendiente obtenida a partir de los máximos diarios monitorizados y la Máxima Oscilación del Diámetro de Tronco (MOD), calculado como la diferencia entre el valor máximo y mínimo monitorizado cada día (Goldhamer and Fereres, 2001). En función de los trabajos de Moriana y Fereres (2003) se establecieron tres fases para la programación de la estrategia de riego y en cada una se adoptaron referencias diferentes: (a) Desde brotación hasta valor máximo de TCT igual a 0,15 mm/día. Se utilizó una ecuación que relaciona la TCT con la temperatura mínima (Tmin); TCT=-0,011 + 0,011 x Tmin (1) (b) Desde que se obtuvieron valores de TCT iguales a 0,15 mm/día hasta principios de Septiembre. Se aplicó el algoritmo de la Figura 3.2. (c) Desde Septiembre hasta las primeras lluvias de Otoño. Se usó la siguiente ecuación, que relaciona la TCT con la temperatura máxima (Tmax); TCT=-0,06 + 0,045 x Tmax (2) Las ecuaciones 1 y 2 fueron obtenidas a partir de los datos de TCT de Moriana y Fereres (2003) en relación con la temperatura. El crecimiento del tronco, representado por la TCT, es un factor más sensible al estrés hídrico del olivo que la MOD, por esa razón este último parámetro no se empleó en las fases a y c. La primera aplicación de riego se realizó cuando el valor de la medida TCT indicó estrés hídrico, es decir una TCT por debajo del valor marcado para la primera fase (0,15 mm/día) y la cantidad de agua aplicada en este primer riego fue estimada por el cálculo de la ETc entre las dos últimas fechas de medida. En los riegos sucesivos se incrementó o disminuyó un 10% la cantidad de agua aplicada en la fecha anterior según la TCT se encontraba por debajo o por encima del umbral establecido. 41 3. Material y Métodos NO TCTi < TCTu Disminuir 10% dosis de agua SI Aumentar 10% dosis de agua SI MODi < MODu NO a=a+1 a=0 SI a=1 NO a=0 TCTu = TCTi SI TCTi > TCTi-1 NO NO SI NO TCTi = TCTi-1 SI Mantener la dosis de agua a=4 Figura 3.2. Algoritmo de decisión para la fase b del tratamiento TDF. Los subíndices “u” indican valores umbrales y los “i” valores actuales. Desarrollado por el Dr. Alfonso Moriana (C.M.A. El Chaparrillo, Ciudad Real). La fase b de la programación de riego es la más larga. Investigaciones previas en olivares jóvenes indican que la sensibilidad de la MOD al estrés hídrico del árbol es pequeña, y que hay una influencia de la presencia del fruto y la edad del árbol en la TCT (Moriana y Fereres, 2002 y 2003). Para intentar integrar estos factores, se diseñó un algoritmo de decisión que se recoge en la Figura 3.2. El valor de TCT umbral (TCTu) en la fase b fue 0,15 mm/día. El valor de MOD se determinó por la recta de regresión entre este parámetro y el déficit de presión de vapor. La variable “a” es un contador que nos indica el número de veces que ocurre un evento. 42 3. Material y Métodos Como se ha dicho anteriormente, el crecimiento del olivo, representado por el parámetro TCT, se considera un factor más sensible al estrés hídrico que el MOD, por lo que si la TCT medida era superior a la TCTu se consideraba que el tratamiento estaba bien regado y se disminuía un 10% la aportación de agua. En el caso contrario, se comparaba el valor de MOD, de forma que si éste era superior al esperado se incrementaba un 10% el riego, ya que se suponía que éste era insuficiente. Si la MOD medida no era superior al esperado cabía la posibilidad de que este parámetro no fuera sensible al estrés hídrico o que los valores de TCT empleados como umbral fueran excesivamente altos. Si era la primera vez que ocurría esto (a=1) se incrementaba el riego un 10% para comprobar si había respuesta de los indicadores. Si no era así y este suceso había ocurrido en otras ocasiones (a>1), se comparaba la TCT obtenida en el periodo anterior con el actual; (i) si la TCT actual era mayor, implicaba que había habido una respuesta al incremento del riego y se incrementaba de nuevo otro 10%, (ii) si el valor de TCT actual era inferior que en el periodo anterior se suponía que existía un déficit hídrico en el olivo y se incrementaba la dosis de riego un 10%, (iii) si el valor de TCT actual era igual al medido en el período anterior, podría deberse a que el umbral empleado fuera mayor al umbral que le correspondería realmente al olivo, ya sea por edad o por carga de fruto, de forma que en este caso no habría variación en el aporte de agua y cuando los valores de TCT se estabilizasen en torno a ese valor (a=4) se usaría como nuevo valor umbral (ver Figura 3.2). (3) Programaciones de riego basados en el Potencial Hídrico del Tronco o, en inglés, Stem Water Potential (SWP). Las programaciones de riego se realizaron según los valores del potencial hídrico del tronco medidos con una cámara de presión (Soil Moisture Equip., Santa Barbara, CA, USA), utilizando hojas cercanas al tronco y cubiertas con papel de aluminio al menos una hora antes de efectuarse la medida (13:00 horas). Las dosis de agua aplicadas a los olivos durante el periodo de riego permitieron mantener las medidas del estado hídrico de los olivos en dos umbrales diferentes fijados al inicio del ensayo; -1,2 MPa (SWP -1,2), el cual no supuso ninguna condición de estrés hídrico en el árbol, y -2,0 MPa (SWP -2,0) que implicó condiciones hídricas ligeramente deficitarias. Las medidas de SWP se efectuaron dos veces por semana sobre doce olivos de referencia, de forma que el valor medio de las doce medidas se utilizaba para comparar con los umbrales establecidos previamente, iniciándose la aplicación de riego cuando la medida de potencial fuera inferior a dichos umbrales y tomando como dosis de agua inicial los valores de ETc obtenidos entre las dos ultimas fechas de medida. La sistemática de riego seguida en las fechas sucesivas supuso un incremento o un descenso de la dosis de riego de un 10%, en función de si el SWP medido estaba por encima o por debajo de los umbrales establecidos (en valores superiores a ±10%). Ambas parcelas utilizaron un diseño estadístico de bloques al azar con tres repeticiones de cada tratamiento de riego, lo que supuso un total de doce bloques distintos. Cada bloque elemental estuvo compuesto por cuatro filas de cuatro olivos cada una, de los que se tomaron 43 3. Material y Métodos para los muestreos los cuatro olivos centrales de las filas intermedias. El ensayo se encontraba rodeado por filas de olivos en regadío que actuaban de bordes. Las Figuras 3.3 y 3.4 representan de forma esquemática el diseño experimental utilizado en los olivares Cornicabra y Morisca de cubierta incompleta utilizados para la realización del ensayo. Figura 3.3. Diseño estadístico utilizado en el olivar Cornicabra de cubierta incompleta. Localizado en la finca “La Entresierra” (Ciudad Real). SWP -2,0; SWP -1,2; FAO; TDF; , olivo borde. Figura 3.4. Diseño estadístico utilizado en el olivar Morisca de cubierta incompleta. Localizado en la finca “La Orden” (Badajoz). SWP -2,0; SWP -1,2; FAO; TDF; , olivo borde. El riego de las parcelas se realizó mediante portagoteros a lo largo de la línea de árboles, realizándose un bucle alrededor de cada olivo donde se insertaron cuatro goteros autocompensantes de 4 l/h, situados a un metro del tronco. El sistema de riego se surtía de un 44 3. Material y Métodos pozo presente en cada una de las parcelas y disponía de un programador de riego y una bomba inyectora de fertilizantes. A excepción de las estrategias de riego descritas utilizadas, el resto de las prácticas agronómicas y fitosanitarias empleadas en los olivares fueron similares. Las dosis de agua aplicadas en cada una de las estrategias de riego a lo largo del ensayo están recogidas a modo de resumen en la Tabla 3.2. Con la finalidad de describir de manera más completa el estado hídrico de los olivos de las variedades Cornicabra y Morisca utilizados en cada tratamiento, esta tabla también muestra las integrales de estrés hídrico estacional (SΨ) y las integrales de estrés hídrico correspondiente al periodo DOY 229-277 (SΨ229-277) (MPa x día, según Myers, 1998), obtenidos a partir de los datos de potencial hídrico del tronco medidos a mediodía, además del potencial hídrico mínimo registrado en cada campaña. Tabla 3.2. Dosis de agua aplicada en cada tratamiento y distintos parámetros representativos del estrés hídrico de los olivos durante 2005, 2006 y 2007. (MPa x día) SΨ229-277 (MPa x día) Potencial hídrico de tronco mínimo (MPa) 125,0 70,1 179,5 28,9 94,6 98,7 75,0 161,6 26,0 28,8 19,2 43,1 -1,69 (mediados de agosto) -1,71 (mediados de agosto) -1,47 (inicios de sept.) -2,10 (mediados de sept.) FAO 92,7 138,3 53,6 TDF 51,5 172,1 81,5 SWP -1.2 101,2 141,4 54,2 SWP -2.0 25,1 199,8 84,9 -1,75 (mediados de agosto) -2,10 (mediados de agosto y septiembre) -1,82 (mediados de agosto) -2,17 (mediados de agosto y septiembre) FAO 408,9 197,6 82,3 TDF SWP -1.2 704,1 388,6 129,3 185,8 38,9 63,7 SWP -2.0 184,2 328,9 119,6 297,3 350,2 304,8 193,1 185,4 163,8 165,1 267,2 44,9 48,5 46,3 90,7 Dosis agua aplicada (mm) SΨ CORNICABRA ´05 FAO TDF SWP -1.2 SWP -2.0 CORNICABRA ´06 MORISCA ´06 -1,91 (inicios de agosto y mediados de septiembre) -1,28 (inicios de agosto) -1,71 (inicios de agosto) -2,71 (inicios de agosto y septiembre) MORISCA ´07 FAO TDF SWP -1.2 SWP -2.0 -1,73 (mediados de sept.) -2,43 (inicios de sept.) -1,64 (mediados de sept.) -2,97 (inicios de sept.) * Datos proporcionados por el Dr. Alfonso Moriana (C.M.A. El Chaparrillo, Ciudad Real) y la Dra. Henar Prieto (Centro de Investigación Finca La Orden, Badajoz). 45 3. Material y Métodos TOMA DE MUESTRA DEL FRUTO. Durante las campañas olivareras 2005/06, 2006/07 y 2007/08 se realizaron dos muestreos a distintos grados de maduración del fruto en cada uno de los doce bloques en los que se dividían ambas parcelas (3 bloques x 4 estrategias de riego). Los muestreos se efectuaron basándose en el grado de maduración del fruto, definido por la pigmentación de la piel de las aceitunas, correspondiéndose con los colores pintona (al final del envero), morada y negra. La recolección de las aceitunas en las tres campañas olivareras fue llevada a cabo mediante el sistema manual de ordeño desde mediados de octubre hasta mediados de noviembre. Una vez recogidos los frutos se procedió a su molturación inmediata mediante el sistema de extracción a escala de laboratorio Abencor (Abengoa S.A., Sevilla, España) (ver epígrafe 3.5). El aceite obtenido se almacenó en oscuridad en botellas de vidrio color topacio a 4º C y sin espacio de cabeza hasta su análisis. Por último, destacar la imposibilidad de obtener muestras de frutos de la variedad Cornicabra durante la campaña olivarera 2007/08 en Ciudad Real y de la variedad Morisca en la campaña 2005/06 en Badajoz, debido a factores ajenos al ensayo. Durante el 2007, el olivar Cornicabra sufrió importantes heladas a inicios de Octubre, produciéndose la pérdida total del fruto, y en el 2005, el olivar Morisca no presentó apenas producción debido a un espectacular “año de descarga”. 3.3. PLANIFICACIÓN EXPERIMENTAL DEL ESTUDIO DE COMPONENTES MINORITARIOS DEL FRUTO (Olea europaea L.) Y ACEITE DE OLIVA VIRGEN EN DIVERSAS VARIEDADES ESPAÑOLAS. Este estudio fue llevado a cabo durante la campaña olivarera 2005/06, las muestras necesarias para el mismo se obtuvieron de un olivar experimental situado en Almodóvar del Campo (Ciudad Real) y propiedad del C.M.A El Chaparrillo, Servicio de Investigación y Tecnología Agraria. El clima de la zona es continental-mediterráneo; con una precipitación media anual de 404 mm, mayoritariamente distribuida fuera de la estación veraniega. El olivar estaba formado por olivos de seis años de edad (marco 4,5 x 6,0 m2) de seis variedades españolas distintas: Arbequina, Cornicabra, Morisca, Picolimón, Picudo y Picual. Todo el olivar se encontraba en condiciones de no laboreo y sin ninguna aplicación de riego; la maleza era controlada mediante herbicidas post-surgimiento. Destacar que el hecho de obtener todas las muestras del ensayo a partir de un mismo olivar experimental, permitió estudiar el efecto de las variables “variedad” e “índice de madurez” sobre los componentes minoritarios de frutos desarrollados en el mismo área geográfica, bajo la mismas condiciones agronómicas y pedoclimáticas. 46 3. Material y Métodos TOMA DE MUESTRAS EN EL ENSAYO. Se realizaron tres muestreos distintos a lo largo de la maduración del fruto en todas las variedades del olivar. El grado de maduración se determinó en función de la pigmentación de la piel, correspondiéndose con los colores verde, pintona y negra. La recogida del fruto se realizó mediante la técnica manual de “ordeño”, tomándose dos muestras representativas de cada variedad para cada etapa de maduración, las cuales eran inmediatamente congeladas mediante nitrógeno líquido y posteriormente almacenadas a -70 ºC hasta la realización de los análisis correspondientes. Se realizaron dos muestreos adicionales con el fin de obtener muestras de aceite de oliva virgen de cada variedad a partir de frutos inmaduros (pigmentación de la piel verde-amarillenta y pintona) y maduros (pigmentación de la piel morada y negra). Las muestras de aceite se obtuvieron mediante el sistema de molturación Abencor (Abengoa S.A., Sevilla, Spain), que como se ha comentado previamente permite la extracción de aceite de oliva virgen a escala de laboratorio (epígrafe 3.5). El aceite obtenido se almacenó en oscuridad en botellas de vidrio color topacio a 4º C y sin espacio de cabeza hasta su análisis. 3.4. PLANIFICACIÓN EXPERIMENTAL DEL ESTUDIO DE LOS COMPONENTES MINORITARIOS DEL ACEITE DE OLIVA VIRGEN (Cornicabra cv.) DURANTE EL BATIDO. El estudio del efecto que determinadas variables tecnológicas durante el batido de la pasta de aceituna tienen sobre la composición minoritaria del aceite de oliva virgen, se llevó a cabo durante la campaña olivarera 2005/06, utilizando dos lotes de frutos distintos (Olea europaea L. Cornicabra cv.) de aproximadamente 1600 Kg cada uno de ellos, con un índice de madurez de 4,5 y 4,7 (ver apartado 3.6), respectivamente. La realización de este ensayo tecnológico se llevó a cabo en las instalaciones de la Almazara Experimental (modelo Fattoria, Pieralisi España S.L.), ubicada el la Finca Galiana (Ciudad Real) y propiedad de la Universidad de Castilla-La Mancha, con una capacidad máxima de trabajo de 200 Kg/h de pasta de aceituna, lo que supone una producción de aceite de oliva virgen de unos 50 Kg/h. En la experimentación realizada también se empleó el sistema de molturación Abencor (Abengoa S.A., Sevilla, España) (epígrafe 3.5). CARACTERÍSTICAS TÉCNICAS DE LA ALMAZARA EXPERIMENTAL. La Almazara Experimental utilizada reproduce a escala piloto las instalaciones de una almazara industrial de grandes proporciones, de hecho se encuentra dividida físicamente en tres zonas diferenciadas; (a) zona de recepción y lavado de las aceitunas, (b) zona de molturación, batido 47 3. Material y Métodos y centrifugación de las pastas de aceituna y (c) zona de almacenamiento del aceite de oliva virgen obtenido. (a) La zona de recepción de la materia prima está formada por una tolva de recepción con una capacidad de 400 Kg y que está conectada mediante una cinta transportadora ascendente a una deshojadora, que permite la eliminación de los restos vegetales de menor peso que las aceitunas, tales como hojas y pequeñas ramitas. A continuación, se encuentra la lavadora (modelo I10) conectada a la red pública de aguas y que permite una limpieza profunda de los frutos, eliminando polvo, barro o restos de mayor peso que las aceitunas que pueden acompañar a la materia prima, como son pequeñas piedras procedentes de las redes donde caen las aceitunas tras su recogida bien por vareo, o por la acción de los vibradores mecánicos. (b) En la zona de molturación se encuentra un molino de martillos de tipo vertical, que presenta una potencia de 11 KW. La etapa de batido se lleva a cabo en una batidora de dos cuerpos (modelo 7+7, potencia; 1,5 KW), con una capacidad total de 500 Kg de pasta de aceituna, está provista de aspas o brazos de acero inoxidable que permiten el movimiento de la pasta y de sondas de temperatura que permiten el control de temperatura de la misma durante el batido. La separación sólido-líquido se realiza mediante un decanter o centrífuga horizontal (modelo Baby I, potencia; 7,5 KW), con una capacidad de trabajo de 200 Kg/h de pasta de aceituna, que es trasegada a este equipo desde la batidora por la acción de una bomba de trasiego (modelo p40-p40, potencia; 0,55 KW). La fase líquida obtenida es recogida en un depósito de acero inoxidable, equipado en su parte superior con un vibrofiltro que elimina los posibles restos sólidos del producto. Posteriormente se procede a la separación de la fase oleosa de las aguas de vegetación del fruto, para ello se utiliza una centrífuga vertical constituida por 60 platos (modelo Cucciolo, potencia; 1,85 KW), equipada con una bomba autoaspirante (modelo Hydra, potencia; 0,25 KW), que lleva el aceite desde el depósito hasta la centrífuga. 48 3. Material y Métodos (c) Posteriormente el aceite de oliva virgen obtenido es trasegado hacia la zona de almacenamiento. Esta se encuentra equipada con depósitos de acero inoxidable de fondo cónico (100 L de capacidad) y llave de purga, que permiten la decantación natural del producto durante unas 24 horas y la posterior eliminación de posibles restos de aguas de vegetación. Una vez realizada la purga del depósito, el producto final es trasvasado a depósitos de acero inoxidable con fondo plano (300, 100 y 50 L de capacidad) para su almacenamiento, evitando que exista espacio de cabeza en el depósito y se favorezca los procesos oxidativos del aceite. OBTENCIÓN DE LAS MUESTRAS DEL ENSAYO. Las variables tecnológicas bajo estudio en este trabajo experimental han sido la temperatura y el tiempo de batido de la pasta de aceituna y, como se ha explicado previamente, el estudio de su efecto sobre la composición minoritaria del aceite de oliva virgen. Se realizaron diversos ensayos en la almazara experimental utilizando diferentes condiciones de temperatura (20 ºC, 28 ºC y 40 ºC) y tiempo (30 min, 60 min y 90 min) de batido, procesándose en cada caso lotes de 200 Kg de aceitunas. Las muestras de aceite de oliva virgen obtenidas fueron recogidas a la salida de la centrífuga horizontal, filtradas a través de papel jarabe y almacenadas en oscuridad en botellas de vidrio topacio a 10ºC hasta la realización de los correspondientes análisis. Para el estudio de la evolución de los compuestos fenólicos y volátiles durante el proceso de batido también se recogieron muestras de fruto (100 g) y de pasta de aceituna (100 g) a lo largo de esta etapa a los tiempos correspondientes a los percentiles 25, 50 y 75 de cada ensayo. También se recogieron diversas muestras de orujo para analizar la composición fenólica retenida en la fase sólida tras la centrifugación de la pasta de aceituna. Todas estas muestras fueron congeladas y almacenadas a -70 ºC hasta su correspondiente análisis. Como ya se indicó previamente, además de los ensayos realizados en la Almazara Experimental, se llevaron a cabo pruebas adicionales a diferentes condiciones de temperatura y tiempo de batido con el sistema de extracción a escala de laboratorio Abencor, utilizando los mismos lotes de aceituna y que tuvieron como finalidad (i) comparar los datos obtenidos en la almazara y (ii) ampliar las condiciones de temperatura - tiempo de batido estudiadas en este trabajo experimental. La Tabla 3.3 muestra de forma esquemática las diferentes combinaciones de temperaturatiempo de batido utilizadas en este ensayo, tanto en la Almazara Experimental, como con el sistema Abencor. 49 3. Material y Métodos Tabla 3.3. Combinaciones de temperatura - tiempo de batido utilizadas en el ensayo tecnológico. 20 ºC 15 min 30 min 45 min 60 min 75 min 90 min □ ■ □ ■ 24 ºC □ 28 ºC □ ■,□ □ ■,□ □ ■,□ 35 ºC □ 40 ºC □ ■ □ ■ ■, Pruebas realizadas en la almazara experimental; □, Pruebas realizadas con sistema Abencor. 3.5. ELABORACIÓN DE ACEITE DE OLIVA VIRGEN CON EL SISTEMA ABENCOR. Este método reproduce a escala de laboratorio el procedimiento industrial habitual siguiendo las fases de molienda, batido, centrifugación y decantación (Martínez et al., 1975). El equipo consta de tres elementos básicos; un molino de martillos, una termobatidora y una centrífuga de pastas. El molino de martillos está construido de acero inoxidable y gira a una velocidad de 3000 r.p.m. La termobatidora consta de un baño de agua en su parte inferior, cuya temperatura está regulada mediante un termostato, y en la parte superior un sistema de paletas de acero inoxidable que gira a 50 r.p.m. y que permite el batido simultáneo de hasta ocho muestras de pasta de aceituna. La centrífuga de pastas es de tipo “cesta”, está construida de acero inoxidable y gira a 3500 r.p.m. El procedimiento experimental que se utiliza para la obtención del aceite de oliva virgen mediante este sistema consiste en molturar las aceitunas sanas, una vez limpias, lavadas y secas, en el molino de martillos. Posteriormente se homogeneiza la pasta obtenida y se procede al batido de la misma en cazos de acero inoxidable, en cada uno de los cuales se pesan 700 g de pasta, durante 20 minutos a 30 ºC. A continuación se añaden 100 ml de agua caliente y se continúa batiendo 10 minutos más. En el caso de pastas difíciles se añade microtalco natural en una cantidad adecuada (1,5-2,0 %) para romper la emulsión que pudiera formarse. Terminado el batido, se somete la pasta a centrifugación y se recoge el mosto oleoso en una probeta graduada. Con el fin de recuperar la máxima cantidad de aceite del retenido en la pasta, se añade una pequeña cantidad de agua y se centrifuga de nuevo, recogiendo el líquido separado en una probeta. 50 3. Material y Métodos Una vez separadas las aguas de vegetación, el aceite de oliva virgen se recoge y se filtra a través de papel “jarabe”. El aceite filtrado se recoge en una botella de vidrio de color topacio y se almacena sin espacio de cabeza en nevera a 4 ºC hasta el momento de su utilización. 3.6. MÉTODOS ANALÍTICOS EMPLEADOS EN EL ANÁLISIS DEL FRUTO. Índice de madurez. Para la determinación del grado de maduración de las aceitunas se utiliza la escala propuesta por la Estación experimental Venta del Llano en Menjíbar (Uceda y Frías, 1975), que consiste en tomar del conjunto de frutos unas 100 aceitunas de forma aleatoria y clasificarlas en siete grupos diferentes en función del color de piel y pulpa de las mismas, según las características que se exponen a continuación: Grupo 0.- Piel verde intensa. Grupo 1.- Piel verde amarillenta. Grupo 2.- Piel verde con manchas rojizas (inicio del envero). Grupo 3.- Piel rojiza o morada (terminación del envero). Grupo 4.- Piel negra con pulpa blanca. Grupo 5.- Piel negra con menos de la mitad de la pulpa morada. Grupo 6.- Piel negra con la mitad o más de la pulpa morada. Grupo 7.- Piel negra con toda su pulpa morada. El índice de madurez se obtiene multiplicando el número de aceitunas incluidas en cada grupo por el número del grupo correspondiente, se suman los valores obtenidos y se divide por el número de frutos total. Rendimiento graso obtenido con el equipo Abencor. Una vez extraído el aceite a través del equipo Abencor se decanta en una probeta graduada y se mide el volumen de aceite obtenido. El rendimiento graso de las aceitunas se obtiene aplicando la fórmula siguiente: Rendimiento (%) = 91 , 5 ⋅ V P siendo V, el volumen de aceite obtenido (ml) y P, la cantidad de pasta de aceituna utilizada (g). 51 3. Material y Métodos Rendimiento graso de la pasta de aceituna. Se ha utilizado el método Soxhlet para determinar la riqueza grasa total en pasta de aceituna. Este procedimiento se basa en la extracción de la grasa presente en una muestra totalmente desecada al ponerse en contacto con un disolvente orgánico, generalmente éter de petróleo o hexano. La fracción recogida es sometida a calefacción para eliminar el disolvente residual, quedando en el matraz solamente la grasa extraída de la pasta de aceituna (Norma UNE 55032). La riqueza grasa referida a materia seca se calcula mediante la fórmula: RGMS (%) = 100 ⋅ P ( mt + g ) ⋅ P ( mt ) P ( ms ) siendo P(mt+g) el peso del matraz con la grasa extraída (g), P(mt) el peso del matraz seco y vacío y P(ms) el peso de muestra seca empleado en la extracción (g). Determinación de compuestos fenólicos en fruto. El procedimiento consiste en obtener en primer lugar la fracción fenólica del fruto mediante extracción sólido-líquido, para posteriormente analizarla mediante cromatografía liquida de alta eficacia (HPLC) a través de una columna C18 y empleando como sistema de detección la absorción en el ultravioleta-visible (UV-Vis). La obtención del extracto fenólico se realiza homogenizando la muestra de pulpa (4,0 g) con una mezcla de metanol:agua (80:20 v/v, 40 ml) con el homogeneizador Ultraturrax (14000 rpm, 2 min). La suspensión obtenida se agita durante 20 minutos a una velocidad de 250 rpm sobre un baño de hielo, para ser posteriormente centrifugada durante 10 minutos a una velocidad de 5000 rpm y una temperatura de 4 ºC. La fase hidrometanólica se recupera y se hace pasar a través de un filtro de jeringa de nylon (0,45 µm) para su posterior análisis cromatográfico. Para realizar la separación de los compuestos fenólicos se utiliza un equipo HPLC Agilent serie 1100 con detector ultravioleta-visible de diodos (DAD). La columna utilizada es una Zorbax SBC18 con tamaño de partícula de 5 µm y dimensiones 250 x 4,6 mm (Agilent Technologies, USA). La temperatura de análisis es de 30 ºC, y el volumen de inyección es de 20 µl. La separación de los fenoles se logra mediante una elución en gradiente con una mezcla de aguaácido acético 95:5 (v/v), metanol y acetonitrilo, cuyo esquema se recoge en la Tabla 3.4. Los cromatogramas se adquieren a diferentes longitudes de onda; 280, 340 y 520 nm. El hidroxitirosol, oleuropeína, demetiloleuropeína se cuantifican a 280 nm, los antocianos a 520 nm y el verbascósido, los flavonoles y flavonas a 340 nm. La cuantificación se realiza por interpolación del área de cada pico en rectas de calibrado de cinco puntos obtenidas en base a la disolución de las sustancias estándar correspondientes (Sigma Chemical Co. y 52 3. Material y Métodos Extrasynthèse) en metanol:agua (80:20, v/v), exceptuando el hidroxitirosol, que se cuantifica como tirosol, y la demetiloleuropeína y los antocianos como oleuropeína. Tabla 3.4. Gradiente de disolventes empleado durante la separación cromatográfica de los fenoles de la pulpa de aceituna. Tiempo (min) H2O-ácido acético (%) Metanol (%) Acetonitrilo (%) Flujo (ml/min) 0 50 52 65 68 72 95,0 34,0 0,0 0,0 95,0 95,0 2,5 33,0 100,0 100,0 2,5 2,5 2,5 33,0 0,0 0,0 2,5 2,5 1,0 1,0 1,0 1,0 0,6 1,0 La identificación de los compuestos fenólicos se realiza por comparación de los tiempos de retención, características de absorción en el UV-Vis y espectros obtenidos mediante LC-MS de sustancias estándar. La demetiloleuropeína y los antocianos se identificaron mediante sus características UV-Vis y sus espectros de masas. El detector de masas utilizado ha sido un LCQ Deca XP Plus (Thermo Electron Corporation, Waltham, USA) equipado con un sistema de ionización electrospray. El nitrógeno utilizado como gas nebulizador se introduce con un flujo de 14 unidades. La temperatura y el voltaje del capilar han sido 250 ºC y 4,50 KV, respectivamente. Los datos fueron adquiridos en el modo de ionización negativo. Los experimentos de fragmentación se realizaron utilizando helio como gas de colisión, con una energía del 30-40%. La Tabla 3.5 recoge los valores de absorción en el UV-Vis, así como la relación masa/carga (m/z) del ión molecular y los fragmentos característicos obtenidos para cada uno de los compuestos fenólicos identificados en la pulpa de aceituna. Tabla 3.5. Características UV-Vis y relación m/z de los compuestos fenólicos identificados en la pulpa de aceituna. Pico TR (min) UV-visible λmax (nm) Ión Molecular [M-H] (m/z) Fragmentos (ESI -) (m/z) PM 1 2 3 4 5 6 7 8 9 10 6,1 19,0 27,2 20,5 20,8 21,1 24,1 24,7 12,2 13,0 230, 280 230, 282 230, 282 257, 358 340 255, 350 256, 350 268, 335 520 520 153 525 539 609 623 447 447 431 447 593 ---481, 345, 319 377, 345, 307, 275 301, 271, 179 461, 315 285 301, 271, 179 269 285 285 154 526 540 610 624 448 448 432 448 594 Compuesto identificado hidroxitirosol demetiloleuropeína oleuropeína quercetín-3-rutinósido verbascósido luteolín-7-glucósido quercetín-3-ramnósido apigenín-7-glucósido cianidín-3-glucósido cianidín-3-rutinósido 53 3. Material y Métodos En la Figura 3.5 se muestra, a modo de ejemplo, un cromatograma de los compuestos fenólicos presentes en la pulpa del fruto de la variedad Cornicabra. 3 mAU 250 280 nm 200 150 1 100 50 2 0 5 mAU 80 10 15 20 25 30 35 min 4 5 340 nm 60 6 40 8 7 20 0 -20 5 mAU 30 10 520 nm 15 20 25 30 35 min 15 20 25 30 35 min 10 20 9 10 0 5 10 Figura 3.5. Cromatograma de los compuestos fenólicos de la pulpa del fruto variedad Cornicabra. 1, 3,4-DHPEA (hidroxitirosol); 2, demetiloleuropeína; 3, oleuropeína; 4, quercetín-3-rutinósido; 5, verbascósido; 6, luteolín-7-glucósido; 7, quercetín-3-ramnósido; 8, apigenín-7-glucósido; 9, cianidín-3glucósido; 10, cianidín-3-rutinósido. 3.7. MÉTODOS ANALÍTICOS EMPLEADOS EN EL ACEITE DE OLIVA VIRGEN. Grado de acidez. El grado de acidez de un aceite es el contenido en ácidos grasos libres presentes, expresados en tanto por ciento en peso de ácido oleico, el mayoritario del aceite de oliva. La determinación se realiza mediante valoración de la muestra, previamente disuelta en éter etílico-etanol 96º (1:1 v/v), con una disolución etanólica de potasa de concentración exactamente conocida (0,1 ó 0,5 N) utilizando fenolftaleína como indicador (CEE 2568/91). El grado de acidez o acidez libre del aceite de oliva se calcula a partir de la siguiente expresión: Grado de acidez = 54 282⋅V ⋅ N 10 ⋅ P 3. Material y Métodos en donde V es el volumen de disolución de KOH gastado en la valoración (ml), N es la normalidad exacta de la disolución de KOH y P es el peso de la muestra de aceite (g). Índice de peróxidos. El índice de peróxidos es el método químico más común para determinar el grado de deterioro oxidativo de las grasas y aceites. Los resultados se expresan como miliequivalentes de oxígeno activo por kilogramo de aceite que producen la oxidación del yoduro a yodo en unas condiciones determinadas (CEE 2568/91). En la reacción, que tiene lugar en medio ácido, se libera un mol de yodo por cada mol de oxígeno peroxídico presente en la muestra de aceite. El yodo liberado se valora con una disolución de tiosulfato sódico de concentración exactamente conocida (0,002 ó 0,01 N) utilizando almidón como indicador. Paralelamente se debe realizar una prueba en blanco, sin aceite, para conocer el estado de los reactivos y la limpieza del material empleado en la determinación analítica. El índice de peróxidos (IP) del aceite se calcula a partir de la expresión: Índice de peróxidos = (V − Vo) ⋅ N ⋅1000 P en donde V es el volumen de disolución de tiosulfato empleado en la valoración (ml), V0 es el volumen de la misma disolución utilizado en el ensayo en blanco (ml), N es la normalidad exacta de la disolución de tiosulfato sódico empleada y P es el peso de la muestra (g). Absorción de radiación ultravioleta (K232 y K270). La medida de absorción en el UV de una disolución de aceite en ciclohexano permite valorar su estado de deterioro oxidativo. Durante la autooxidación de los ácidos grasos poliinsaturados se forman hidroperóxidos que en su estructura contienen dobles enlaces conjugados los cuales absorben radiación en torno a una longitud de onda de 232 nm. Estos compuestos evolucionan con el tiempo dando lugar a otros como las diacetonas o, en el caso de los hidroperóxidos de ácidos grasos poliinsaturados, a sistemas con tres dobles enlaces conjugados. Estos productos secundarios, procedentes de la degradación de los hidroperóxidos, tienen la característica de absorber radiación UV entorno a los 270 nm. Los coeficientes de extinción de la muestra disuelta en ciclohexano se han determinado según el Reglamento de la Unión Europea (CEE 2568/91), utilizando un espectrofotómetro Agilent 8453. El coeficiente de extinción a una longitud de onda λ (Kλ) se calcula a partir de la expresión: Kλ = Eλ C ⋅e 55 3. Material y Métodos en donde Eλ es la extinción medida en el espectrofotómetro a dicha longitud de onda, C es la concentración de la disolución de aceite (g/100 ml) y e es el paso óptico de la cubeta (cm). Pigmentos clorofílicos y carotenoideos. Los pigmentos clorofílicos y los carotenoides se han determinado según el método propuesto por Mínguez-Mosquera et al. (1991) empleando un espectrofotómetro Agilent 8453. El método analítico se basa en la capacidad de absorción de los pigmentos clorofílicos y carotenoides a 670 y 472 nm, respectivamente, de la muestra de aceite previamente disuelta en ciclohexano. El contenido de pigmentos se expresa en mg/kg a partir de las siguientes expresiones: Clorofilas = A670 ⋅ V f E1% ⋅ P Carotenoides = ⋅ 10000 A472 ⋅ V f E1% ⋅ P ⋅ 10000 siendo A670 y A472 la absorbancia medida a 670 y 472 nm respectivamente, Vf el volumen final de ciclohexano, E1% el coeficiente de extinción de clorofilas y carotenoides, igual a 613 y 2000, respectivamente, y P el peso de la muestra (g). Composición en ácidos grasos. La composición en ácidos grasos del aceite de oliva se expresa como porcentaje de área de sus ésteres metílicos. El procedimiento consiste en realizar la hidrólisis de los triglicéridos y la transesterificación de los ácidos grasos obtenidos para dar lugar a los ésteres metílicos correspondientes. Posteriormente se procede a la separación de los ésteres metílicos formados por cromatografía de gases (GC) en columna capilar. El protocolo seguido para la formación de los ésteres metílicos en frío es una modificación del método A.O.C.S. Ch 1-91 correspondiente al Reglamento Europeo EU 796/2002. El procedimiento consiste en disolver en hexano (3 ml) una muestra de aceite (0,5 g). A continuación se añaden 0,5 ml de KOH metanólica 2 N, se agita enérgicamente durante 1 minuto y se deja reposar hasta la perfecta separación de las fases. La disolución sobrenadante que contiene los ésteres metílicos de los ácidos grasos es posteriormente inyectada en el cromatógrafo de gases. Para la separación de los ésteres metílicos de los ácidos grasos se ha seguido el método recogido en el Anexo X”A” del Reglamento CEE 2568/91. En la determinación se utilizó un cromatógrafo de gases Agilent serie 6890 equipado con un detector de ionización de llama (FID). La columna capilar empleada en la separación ha sido una SGL-1000 (Sugelabor, 56 3. Material y Métodos España), con fase estacionaria de polietilenglicol acidificado (100%) y de dimensiones 50 m x 0,25 mm x 0,25 µm. Como gas portador se emplea helio con un flujo de 1 ml/min, el volumen de inyección de muestra es de 1 µl y la relación de split es 50:1. Durante el análisis la temperatura del inyector y el detector es de 250 ºC y el horno se mantiene a 210 ºC. El contenido de cada uno de los ésteres metílicos de los ácidos grasos (AGi) se expresa como porcentaje del total, calculándose de acuerdo a la siguiente expresión: AGi = Ai ⋅ 100 AT en la que Ai es el área de pico correspondiente al éster metílico del ácido graso “i” y AT es el área total correspondiente a la suma de todos los ésteres metílicos. En la Figura 3.6 se muestra, a modo de ejemplo, un cromatograma de los ésteres metílicos de los ácidos grasos de un aceite de oliva virgen de la variedad Cornicabra. pA 1 160 6 7 140 120 100 5 80 60 2 40 8 20 9 34 10 11 0 2 4 6 8 10 12 14 16 min Figura 3.6 Cromatograma de los ésteres metílicos de los ácidos grasos de un aceite de oliva virgen Cornicabra. 1, ácido palmítico (C16:0); 2, ácido palmitoleico (C16:1); 3, ácido margárico (C17:0); 4, ácido margaroleico (C17:1); 5, ácido esteárico (C18:0); 6, ácido oleico (C18:1); 7, ácido linoleico (C18:2); 8, ácido linolénico (C18:3); 9, ácido araquídico (C20:0); 10, ácido gadoleico (C20:1); 11, ácido behénico (C22:2). Determinación de compuestos fenólicos en aceite de oliva virgen. Se ha realizado de acuerdo con el protocolo propuesto por Mateos et al. (2001). En primer lugar se extrae la fracción fenólica del aceite mediante extracción en fase sólida (SPE) y posteriormente se procede a su análisis cromatográfico a través de una columna C18, similar a la utilizada en la separación de los compuestos fenólicos del fruto. Como sistema de 57 3. Material y Métodos cuantificación se ha elegido el método del patrón interno, utilizándose en este caso el ácido siríngico (Sigma Chemical Co.). Para la obtención del extracto fenólico se toman 2,5 g de muestra, se añaden 250 µl de una disolución (15 ppm) de patrón interno en metanol y se lleva a un evaporador rotativo a vacío (Büchi R-114) con el fin de eliminar el disolvente. Posteriormente, el aceite se disuelve en 6 ml de hexano y se hace pasar por una columna de extracción en fase sólida, con un volumen de 3 ml y un relleno de 0,5 g de fase diol (Supelco Inc., USA), que previamente ha sido acondicionada con 6 ml de metanol y 6 ml de hexano. A continuación, la columna SPE se lava con 6 ml de hexano y 4 ml de hexano-acetato de etilo 85:15 (v/v) para eliminar los posibles restos de grasa y otros compuestos ligeramente polares que pudieran contaminar el extracto. La elución del extracto fenólico se realiza por paso a través de la columna de tres volúmenes de 5 ml de metanol que se recogen en un solo matraz. A continuación, el extracto fenólico se lleva a sequedad en el evaporador rotativo a vacío a una temperatura no superior a 35 ºC. Una vez concentrado hasta sequedad, el residuo se disuelve en 250 µl de metanol-agua 50:50 (v/v), para su posterior análisis cromatográfico. La separación y detección de los fenoles del aceite de oliva se realiza en el mismo equipo HPLC y en condiciones similares a las utilizadas con la pulpa de aceituna. Los cromatogramas se adquieren a las longitudes de onda de 240, 280 y 335 nm, para la cuantificación se utilizan solamente los datos obtenidos a 280 nm, mientras que el resto se usan con fines cualitativos. Para la cuantificación se recurre al empleo del patrón interno, en este caso ácido siríngico, y por tanto la concentración de los compuestos (Ci) se expresa en miligramos de ácido siríngico por kilogramo de aceite, calculándose de acuerdo con la siguiente expresión: Ci = C PI ⋅ Ai API donde CPI es la concentración del patrón interno en el aceite (mg/kg) y Ai y API son las áreas del compuesto fenólico de interés y el patrón interno respectivamente. Posteriormente se emplean los factores de respuesta corregidos a partir de los datos publicados por Mateos et al. (2001) y que se muestran en la Tabla 3.6 de acuerdo a la siguiente expresión: C F = C i ⋅ FR donde CF es la concentración de compuesto fenólico en cuestión (mg/kg), Ci es la concentración de dicho compuesto fenólico expresada como miligramos de ácido siríngico por kilogramo de aceite y FR es el factor de respuesta. 58 3. Material y Métodos Tabla 3.6. Factores de respuesta* respecto al ácido siríngico de los principales fenoles presentes en el aceite de oliva virgen. Compuesto TR (min) Factor de respuesta (FR) Hidroxitirosol Tirosol Ácido vanílico Vainillina Ácido p-cumárico 3,4-DHPEA-AC Ácido ferúlico 3,4-DHPEA-EDA p-HPEA-AC p-HPEA-EDA Pinorresinol 1-acetoxipinorresinol Ácido t-cinámico 3,4-DHPEA-EA p-HPEA-EA 6,1 9,8 12,1 16,1 17,8 18,8 20,3 24,0-26,0 29,2 29,8 30,4 31,0 31,0 34,4 38,7 3,947 5,065 1,259 0,770 0,648 4,814 3,311 7,961 6,678 11,260 1,240 3,568 0,348 9,696 12,959 * Calculados a partir de los factores de respuesta respecto al ácido p-hidroxifenilacético publicados por Mateos et al. (2001) En la Figura 3.7 se muestra un cromatograma típico de los compuestos fenólicos que se pueden encontrar en un aceite de oliva virgen a una longitud de onda de 280 nm. mAU 13 600 8 500 400 10 1 300 14 200 2 100 12 11 P.I. 3 4 0 5 10 15 5 6 7 20 9 25 30 35 40 45 min Figura 3.7. Cromatograma de los compuestos fenólicos de un aceite de oliva virgen Cornicabra. 1, 3,4-DHPEA (hidroxitirosol); 2, p-HPEA (tirosol); 3, ácido vanílico; P.I., ácido siríngico; 4, vainillina; 5, ácido p-cumárico; 6, 3,4-DHPEA-AC; 7, ácido ferúlico; 8, 3,4-DHPEA-EDA decarboximetilada+carboximetilada; 9, p-HPEA-AC; 10, p-HPEA-EDA; 11, pinorresinol; 12, 1acetoxipinorresinol+ácido t-cinámico; 13, 3,4-DHPEA-EA; 14, p-HPEA-EA. 59 3. Material y Métodos Determinación de oleocantal por HPLC. El contenido en oleocantal se ha determinado mediante el método desarrollado por Impellizeri et al. (2006), realizando primero una extracción líquido-líquido del compuesto de interés y su posterior determinación cromatográfica en una columna C18. Como sistema de cuantificación se ha elegido el método del patrón interno, en este caso de 3,5-dimetoxifenol (Sigma Chemical Co.). Para la obtención del extracto se toma 1,0 g de muestra, se añaden 250 µl de una disolución (200 ppm) de patrón interno en metanol y se lleva a un evaporador rotativo a vacío para eliminar el disolvente. Posteriormente, el aceite se disuelve en 2 ml de hexano y se pasa a un tubo de centrífuga (15 ml), al que se adicionan 5 ml de acetonitrilo y se agita con ayuda de un vórtex durante 15 s para favorecer la extracción del oleocantal, a continuación se centrifuga (4000 rpm, 5 min) para separar el solvente de la fase oleosa. Este procedimiento se repite tres veces, y el solvente del extracto obtenido se elimina mediante flujo de N2. Una vez concentrado hasta sequedad, el residuo se disuelve en 1 ml de metanol-agua 50:50 (v/v), y se adiciona 1 ml de hexano con el fin de eliminar las posibles restos de aceite, este proceso se repite tres veces. El tubo se centrifuga y se recupera la fase metanólica para su posterior análisis cromatográfico. Para realizar la separación del oleocantal se utiliza un equipo HPLC Agilent serie 1100 equipado con un detector ultravioleta-visible de diodos (DAD). La columna empleada en la separación es una Zorbax SB-C18 con tamaño de partícula de 5 µm y dimensiones 250 x 4,6 mm (Agilent Technologies, USA). La temperatura de análisis es de 25 ºC, y el volumen de inyección es de 20 µl. La separación de los fenoles se logra mediante una elución en gradiente con una mezcla de acetonitrilo y agua, cuyo esquema se recoge en la Tabla 3.7. Los cromatogramas se adquieren a la longitud de onda de 280 nm y a modo de ejemplo se presenta uno de ellos en la Figura 3.8. Tabla 3.7. Gradiente de disolventes empleado durante la separación cromatográfica de los fenoles de la pulpa de aceituna. Tiempo (min) H2O (%) Acetonitrilo (%) Flujo (ml/min) 0 35 35,01 45 45,01 55 75 75 20 20 75 75 25 25 80 80 25 25 1,0 1,0 1,0 1,0 1,0 1,0 Para la cuantificación se recurre al empleo del patrón interno, en este caso 3,5-dimetoxifenol, y por tanto la concentración de oleocantal (Co) se expresa en miligramos de 3,5-dimetoxifenol por kilogramo de aceite, calculándose de acuerdo con la siguiente expresión: 60 3. Material y Métodos CO = C PI ⋅ AO API donde CPI es la concentración del patrón interno en el aceite (mg/kg) y AO y API son las áreas del oleocantal y el patrón interno respectivamente. mAU 40 30 20 Oleocantal Forma cis Forma trans 10 0 0 5 10 15 20 25 30 min Figura 3.8. Cromatograma obtenido en la determinación del contenido en oleocantal de un oliva virgen de la variedad Cornicabra. Índice de amargor (K225). El índice de amargor se ha determinado según el método propuesto por Gutiérrez et al. (1994) empleando un espectrofotómetro Agilent modelo 8453. El procedimiento analítico consiste en la extracción de los compuestos amargos de la muestra de aceite disuelta en hexano mediante extracción en fase sólida (SPE), utilizando un columna de tipo C18 (Supelco Inc., USA) y su posterior elución utilizando una mezcla de metanol-agua 1:1 (v/v), cuya absorbancia se mide a 225 nm. Por definición, el parámetro K225 es la absorbancia de un extracto obtenido a partir de 1 g de aceite en 100 ml de disolvente de elución en las condiciones descritas. Por tanto: K225 = A225 ⋅ V 100 ⋅ P siendo P el peso de la muestra (g), A225 la absorbancia del extracto medido a 225 nm y V el volumen de extracto (ml). 61 3. Material y Métodos Determinación de tocoferoles por HPLC. Los tocoferoles se han determinado por cromatografía líquida de alta eficacia, según el método de la A.O.C.S. (Ce 8-89). El procedimiento analítico consiste en pesar 200 mg de aceite en un matraz aforado de 10 ml, disolverlos en hexano para HPLC e inyectar en el cromatógrafo. El αtocoferol, mayoritario en el aceite de oliva virgen, se ha cuantificado por interpolación del área del pico correspondiente en una recta de calibrado obtenida en las mismas condiciones experimentales, a partir de disoluciones patrón de α-tocoferol en hexano preparadas inmediatamente antes de su uso, de concentraciones exactamente conocidas que cubren el rango entre 1 y 8 mg/l. El equipo empleado para la separación y cuantificación del α-tocoferol ha sido un HPLC Agilent serie 1100 acoplado a un detector de fluorescencia Thermo Finnigan modelo FL3000 y una columna (250 x 4,6 mm) de relleno Lichrosorb Si-60 de 5 µm (Sugerlabor, España). La fase móvil utilizada es una mezcla de n-hexano-isopropanol 98,5:1,5 (v/v) a un flujo de 1 ml/min, y un volumen de inyección de 20 µl. Para la detección del α- tocoferol mediante fluorescencia se emplea una longitud de onda de excitación de 290 nm y una longitud de onda de emisión de 330 nm (Figura 3.9). mAU 225 α- tocoferol 200 175 150 125 100 75 γ- tocoferol δ- tocoferol 50 1 2 3 5 4 6 7 8 min Figura 3.9. Cromatograma obtenido en la determinación de tocoferoles de un aceite de oliva virgen de la variedad Cornicabra. La concentración de α- tocoferol en el aceite de oliva Cα-T (mg/kg) se calcula a partir de la siguiente expresión: C α −T = CD ⋅V P en donde CD es la concentración de α- tocoferol en la disolución de aceite calculada a partir de la recta de calibrado (mg/l), V es el volumen del matraz donde se prepara la disolución de aceite (ml) y P es el peso de aceite empleado (g). 62 3. Material y Métodos Determinación de la estabilidad oxidativa por el método Rancimat. Para la realización del ensayo de estabilidad oxidativa se ha empleado un equipo Rancimat 679 (Metrohm) en el cual el proceso de oxidación tiene lugar con saturación de oxígeno y a temperatura elevada. La determinación de la estabilidad oxidativa, que se mide en horas y se calcula como el periodo que tardan en producirse compuestos volátiles polares como consecuencia del inicio de la oxidación secundaria de las grasas y es denominado “periodo de inducción”. La medida proporcionada por este equipo se basa en la detección conductimétrica de los productos de descomposición de los hidroperóxidos, principalmente ácidos orgánicos de cadena corta. El aparato consta de un bloque calefactor, que puede alcanzar temperaturas de hasta 220 ºC. Para acelerar el proceso de oxidación se introduce un flujo de aire a través del aceite. Este aire, a la vez que proporciona el oxígeno necesario para la oxidación, arrastra los compuestos volátiles formados durante el proceso y los conduce a un frasco borboteador que contiene agua y una célula que mide constantemente la conductividad del agua. Cuando se inicia la descomposición de los hidroperóxidos, se desprenden una serie de compuestos volátiles, que son retenidos en el agua desionizada dando lugar a un aumento de la conductividad. El punto de inflexión de la curva de conductividad, denominada curva de oxidación, define el periodo de inducción del proceso de oxidación de la muestra, y se muestra a modo de ejemplo en la Figura 3.10. Figura 3.10. Registro obtenido en la determinación de la estabilidad oxidativa “Rancimat” de tres muestras de aceite de oliva virgen. Las condiciones de trabajo empleadas para el aceite de oliva virgen de este trabajo de investigación son una temperatura de 120 ºC y un caudal de aire de 20 l/h, según el método propuesto por Laübli et al. (1986). 63 3. Material y Métodos Determinación de compuestos volátiles. La determinación de los compuestos volátiles del aceite de oliva virgen se ha realizado según el protocolo desarrollado por Vichi et al. (2003b). En primer lugar se procede a la extracción de estos compuestos mediante microextracción en fase sólida (SPME) y posteriormente al análisis cromatográfico mediante una columna capilar polar (100% polietilenglicol). Como sistema de cuantificación se ha elegido el método del patrón interno, en este caso el 4-metil-2-pentanol (Sigma Chemical Co.). El procedimiento analítico consiste en pesar una muestra de aceite de oliva virgen (1,5 g) a la que posteriormente se añade el patrón interno disuelto en aceite de oliva refinado hasta una concentración de 1,5 µg/g en un vial de 10 ml, sellado mediante un septum de silicona. El proceso SPME se realiza mediante la exposición de una fibra de 2 cm de longitud de DVB/Carboxeno/PDMS (50/30 µm, Supelco Inc., USA) durante 30 min en el espacio de cabeza de la muestra situada en un bloque calefactor a 40 ºC. Posteriormente la fibra se retrae dentro de la aguja e inmediatamente se transfiere y desorbe durante un minuto en el puerto de inyección de un cromatógrafo de gases Agilent serie 6890 equipado con un detector de ionización de llama (FID). La separación de los compuestos volátiles se realiza mediante una columna capilar Supelcowax-10 (30 m x 0,25 mm, Supelco Inc., USA) recubierta interiormente de una película de 0,25 µm de espesor de 100% polietilenglicol. Como gas portador se utiliza helio, con una presión en cabeza de columna de 10 psi. Durante el análisis la temperatura del puerto de inyección y del detector se mantienen a 260 ºC y 280 ºC, respectivamente y el gradiente de temperatura utilizado en el horno es el siguiente: temperatura inicial 35 ºC durante 10 minutos, rampa de 3 ºC por minuto hasta 160 ºC y posteriormente 15 ºC por minuto hasta 200 ºC, temperatura final que se mantiene durante 5 minutos. Para la cuantificación se recurre al empleo del patrón interno, en este caso 4-metil-2-pentanol, y por tanto la concentración de los compuestos (Ci) se expresa en miligramos de 4-metil-2pentanol por kilogramo de aceite, calculándose de acuerdo con la siguiente expresión: Ci = C PI ⋅ Ai API en donde CPI es la concentración del patrón interno en el aceite (mg/kg) y Ai y API son las áreas del compuesto volátil de interés y el patrón interno, respectivamente. Los compuestos volátiles se identificaron por comparación de los tiempos de retención y los espectros de masas de las correspondientes sustancias estándar (Sigma Chemical Co.) adicionadas a aceites de oliva refinado. El equipo utilizado fue MS Agilent serie 5975C equipado con un detector de ionización por impacto electrónico (IE+) y acoplado a un GC Agilent serie 6850, con columna capilar DB-Wax (30 m x 0,25 mm, J&W Scientific, USA) recubierta interiormente de una película de 0,25 µm de espesor de 100% polietilenglicol. Como 64 3. Material y Métodos gas portador se utiliza helio, con una presión en cabeza de columna de 5 psi. La temperatura de la línea de transferencia se mantiene a 280 ºC, y la de la fuente de ionización y el cuadrupolo, a 230 ºC y 150 ºC, respectivamente, con un voltaje en el electromultiplicador igual a 941 eV. La Tabla 3.8 recoge los valores de la relación masa/carga (m/z) de los iones característicos obtenidos en los principales compuestos volátiles presentes en el aceite de oliva virgen. Tabla 3.8. Valores m/z de los iones característicos obtenidos para los principales compuestos volátiles presentes en el aceite de oliva virgen. Pico TR (min) Iones MS (m/z) CAS Number PM Compuesto identificado 1 13,1 27, 57 1629-58-9 84 1-penten-3-ona 2 17,0 56, 72, 82 66-25-1 100 hexanal 3 22,3 29, 57 616-25-1 86 1-penten-3-ol 4 25,8 55, 69, 83, 98 6728-26-3 98 E-2-hexenal 5 28,6 56, 61, 69, 84 142-92-7 144 acetato de hexilo 6 31,1 57, 68 1576-95-0 86 Z-2-penten-1-ol 7 31,3 43, 55, 67, 82 3681-71-8 142 acetato de Z-3-hexenilo 8 32,9 56, 69, 84 111-27-3 102 hexan-1-ol 9 34,5 55, 67, 82 928-96-1 100 Z-3-hexen-1-ol 10 35,6 57,67, 82 928-95-0 100 E-2-hexen-1-ol En la Figura 3.11 se presenta un cromatograma típico de los volátiles presentes en un aceite de oliva virgen. pA 4 80 70 60 50 P.I. 40 2 30 9 1 6 8 20 3 10 7 5 0 5 10 15 20 25 30 10 35 min Figura 3.11. Cromatograma de los compuestos volátiles de un aceite de oliva virgen Cornicabra. 1, 1-penten-3-ona; 2, hexanal; 3, 1-penten-3-ol; P.I., 4-metil-2-pentanol; 4, E-2-hexenal; 5, acetato de hexilo; 6, Z-2-penten-1-ol; 7, acetato de Z-3-hexenilo; 8, hexan-1-ol; 9, Z-3-hexen-1-ol; 10, E-2-hexen-1ol. 65 3. Material y Métodos Valoración organoléptica. El análisis sensorial de las muestras de aceite de oliva virgen de este trabajo de investigación se ha realizado siguiendo el protocolo descrito en el Anexo XII del Reglamento CE nº 796/2002. Participaron entre 10 y 12 catadores adecuadamente seleccionados y entrenados pertenecientes al Panel Analítico de la Denominación de Origen de los Montes de Toledo y reconocido por el Consejo Oleícola Internacional (COI). El método descrito en el Reglamento CE 792/2002 clasifica los aceites de oliva en su categoría comercial en función de la posible presencia de defectos sensoriales en la muestra y por la intensidad de su atributo “frutado”, para lo cual se utiliza una hoja de perfil en donde cada catador anota la intensidad con que percibe cada uno de los atributos positivos y negativos en una escala no estructurada de 10 cm, en la cual el extremo izquierdo de la escala indica “ausencia total” y el extremo derecho indica “percepción extrema”. Estos datos se introducen en un programa informático que proporciona la categoría comercial del aceite evaluado junto a los índices estadísticos que indican la calidad del análisis efectuado. El aceite se clasifica, según los límites establecidos por el Reglamento CE nº 796/2002, en la denominación “Virgen extra” cuando la mediana de los defectos sea igual a cero y la mediana del frutado sea superior a cero. “Virgen” cuando la mediana de los defectos sea superior a cero e inferior a 2,5 y la mediana del frutado sea superior a cero. “Lampante” cuando la mediana de los defectos sea superior a 2,5, o bien, la mediana de los defectos es inferior o igual a 2,5 y la del atributo frutado sea igual a cero. 3.8. MÉTODOS ESTADÍSTICOS. Todos los análisis y tratamientos estadísticos de resultados que aparecen a lo largo de esta memoria han sido realizados aplicando el programa informático SPSS (SPSS Inc., Chicago, USA). Estadística descriptiva. Este tratamiento se ha empleado para presentar los datos experimentales resumidos en las tablas de la memoria, a través de los parámetros estadísticos media y desviación típica, que representan la dispersión de los valores observados. Análisis de la varianza. El análisis de la varianza estudia los efectos de uno o más factores sobre la variación de los valores medios dentro de uno o más grupos de datos, determinando si existen o no diferencias estadísticamente significativas entre los mismos. El nivel de la significación estadística se establece a partir del valor de F que proporciona este análisis. Para determinar entre qué grupos existen diferencias significativas se ha empleado el test de Duncan. 66 3. Material y Métodos Análisis discriminante. El análisis discriminante es una técnica multivariante de clasificación supervisada, cuyo objetivo es encontrar funciones o reglas de clasificación que permitan la diferenciación entre poblaciones. Cuando en este análisis las variables independientes se van seleccionando de forma escalonada, de manera que en cada paso interviene la variable que más contribuye a la separación entre los grupos, la técnica se denomina análisis discriminante por pasos sucesivos. 67 4. RESULTADOS EXPERIMENTALES Y DISCUSIÓN 4.1. Resultados Experimentales Del trabajo de investigación realizado durante la ejecución de esta Tesis Doctoral han derivado las siguientes publicaciones científicas: • ART. I: Aurora Gómez-Rico, Giuseppe Fregapane, M. Desamparados Salvador. 2008. “Effect of cultivar and ripening on minor components in Spanish olive fruits and their corresponding virgin olive oils”, Food Research International, 41, 433-440. • ART. II: Aurora Gómez-Rico, M. Desamparados Salvador, Alfonso Moriana, David Pérez, Nicolás Olmedilla, Francisco Ribas, Giuseppe Fregapane. 2007. “Influence of different irrigation strategies in a traditional Cornicabra cv. olive orchard on virgin olive oil composition and quality”, Food Chemistry, 100, 568-578. • ART. III: Aurora Gómez-Rico, M. Desamparados Salvador, Marta La Greca, Giuseppe Fregapane. 2006. “Phenolic and volatile compounds of extra virgin olive oil (Olea europaea L. Cv. Cornicabra) with regard to fruit ripening and irrigation management”, Journal of Agricultural and Food Chemistry, 54, 7130-7136. • ART. IV: Aurora Gómez-Rico, M. Desamparados Salvador, Giuseppe Fregapane. 2008. “Virgin olive oil and olive fruit minor constituents as affected by irrigation management based on ETc, SWP and TDF in medium-density young olive orchards (Olea europaea L. cv. Cornicabra and Morisca)”, Food Research International. (Enviado). • ART. V: Aurora Gómez-Rico, Antonio M. Inarejos-García, M. Desamparados Salvador, Giuseppe Fregapane. 2008. “Effect of malaxation conditions on phenolic and volatile profiles of olive paste and their corresponding virgin olive oils (Olea europaea L. cv. Cornicabra)”, Journal of Agricultural and Food Chemistry. (Enviado). Previamente a la presentación de estas publicaciones científicas y con el fin de proporcionar una visión global de la estructura del trabajo experimental realizado, se procede a describir brevemente los resultados más relevantes que se han obtenido en esta Tesis Doctoral. Tal y como se ha descrito en el capítulo de Objetivos, la labor investigadora realizada ha estado principalmente orientada al estudio de la influencia que diversos factores agronómicos, como i) la variedad de aceituna, ii) el grado de maduración del fruto y iii) las prácticas de riego en el olivar, ejercen sobre la composición minoritaria tanto del fruto inicial utilizado, como de los aceites de oliva virgen obtenidos. Asimismo se ha determinado el efecto de las variables temperatura y tiempo utilizados durante la etapa tecnológica de batido, sobre la composición fenólica y volátil de la pasta de aceituna y de los correspondientes aceites de oliva virgen (AOV). 71 4.1. Resultados Experimentales «El estudio de los perfiles fenólicos y volátiles obtenidos a partir de diversas variedades de aceituna españolas ha demostrado que poseen una composición cualitativa semejante, aunque muy diferente desde un punto de vista cuantitativo» El estudio de la influencia de la variable agronómica “variedad” sobre la composición minoritaria de la aceituna y sus correspondientes aceites de oliva virgen se ha llevado a cabo sobre seis variedades españolas - Arbequina, Cornicabra, Morisca, Picolimón, Picudo y Picual – cultivadas en un mismo olivar experimental y, por tanto, bajo idénticas condiciones agronómicas y pedoclimáticas. Se realizaron tres muestreos a lo largo de la maduración del fruto en todas las variedades del olivar, en base a la pigmentación de la piel; verde (índice de madurez, I.M = 1,0), pintona (I.M = 2,5) y negra (I.M = 4,0). Asimismo, se llevaron a cabo dos muestreos adicionales con el fin de obtener muestras de aceite de oliva virgen de cada variedad a partir de frutos inmaduros (pigmentación de la piel verde-amarillenta y pintona) y maduros (pigmentación de la piel morada y negra). Tras el análisis del efecto de esta variable agronómica sobre la composición fenólica de la drupa, se ha determinado que el oleósido oleuropeína es el compuesto fenólico más abundante presente en los frutos de las diversas variedades estudiadas, siendo su contenido ampliamente variable entre las mismas, al estar comprendido entre 2200 y 11600 mg/Kg, valores cuantificados en los frutos verdes de las variedades Arbequina y Cornicabra, respectivamente (ver ART. I; Tabla 1). Por otro lado, el oleósido demetiloleuropeína se ha detectado únicamente en los frutos Arbequina, doblando su concentración en la drupa a lo largo de la maduración de la misma y alcanzando valores de 2000 mg/Kg en el fruto maduro (I.M 4,0). La presencia de verbascósido en el fruto se ha relacionado inversamente con el contenido de oleuropeína del mismo, de forma que las variedades con una mayor concentración de oleuropeína mostraron, a su vez, un menor contenido de este compuesto fenólico. De esta forma los frutos de Arbequina presentaron un notable contenido en verbascósido (entre 15% y 22% del contenido fenólico total en frutos con I.M de 1,0 y 4,0, respectivamente) y la menor concentración de oleuropeína (entre 50% y 1% del total), mientras que variedades ricas en este oleósido (entre 90% y 50% del total), como Cornicabra y Picual, se distinguieron también por el menor contenido en verbascósido (del 0,5% al 4% del total) (ART. I; Tabla 1). La aplicación del Análisis Discriminante sobre el contenido fenólico de las drupas ha proporcionado la clasificación correcta del 100% de las muestras utilizadas en este ensayo en función de la variedad de origen, basándose en el contenido de oleuropeína, apigenin-7-Oglucósido, hidroxitirosol y cianidin-3-O-rutinósido (ART. I; Figura 1). Asimismo, el perfil fenólico de las distintas muestras de aceituna ha permitido su distribución en tres grupos distintos, el primero de ellos constituido por las variedades Cornicabra y Picual, caracterizadas por una composición similar en oleuropeína, flavonoides y antocianinas, un segundo grupo constituido 72 4.1. Resultados Experimentales por los frutos de Picudo, que presentaron una alta concentración de hidroxitirosol y un tercer grupo formado por Arbequina, Morisca y Picolimón, que mostraron los mayores niveles de verbascósido y un contenido similar en flavonoides (ART. I; Tabla 1). Del mismo modo, en el análisis de los compuestos fenólicos y volátiles de los correspondientes aceites de oliva virgen elaborados a partir de las variedades estudiadas, se obtuvieron perfiles de composición cualitativa semejante, aunque muy diferentes desde un punto de vista cuantitativo. Así, mientras que los derivados secoiridoideos del hidroxitirosol y tirosol son los principales fenoles presentes en todos los aceites, su distribución varía entre las distintas variedades, siendo los derivados del hidroxitirosol los fenoles complejos más abundantes en las variedades Arbequina, Cornicabra, Picolimón y Picual (principalmente la forma 3,4-DHPEAEDA), con valores comprendidos entre 105,0 mg/Kg (en Morisca con I.M 3,0) y 1113,2 mg/Kg (en Cornicabra con I.M 2,5), mientras que los secoiridoideos del tirosol se detectaron en mayor concentración que sus análogos del hidroxitirosol en los aceites Morisca y Picudo (principalmente la forma p-HPEA-EDA), con concentraciones entre 54,8 mg/Kg (Picolimón, I.M 3,0) y 769,6 mg/Kg (Picudo, I.M 0,8) (ART. I; Tabla 2). En lo que respecta al contenido volátil, la fracción aldehídica C6, constituida por E-hexenal y hexanal, ha predominado en todos los aceites obtenidos en esta experimentación, siendo además los compuestos volátiles que han permitido la mejor discriminación entre los aceites en función de la variedad de procedencia, especialmente el contenido de E-2-hexenal, el cual ha variado desde 20,55 mg/Kg, como valor medio, en los aceites Arbequina hasta 3,15 mg/Kg en la variedad Cornicabra. Otro aspecto a destacar es la presencia de ésteres C6 en el aroma de los aceites, la cual está claramente establecida en la variedad Morisca, y especialmente en Arbequina y Picual (ART. I; Tabla 3). Por otro lado, puesto que los compuestos fenólicos presentes en un AOV son derivados de los oleósidos y lignanos de la aceituna, se ha relacionado el contenido oleosídico de las drupas con la composición secoiridoidea cuantitativa descrita en los correspondientes aceites del ensayo, observándose un ratio considerablemente heterogéneo entre las variedades estudiadas (aproximadamente 2,3 para Picudo, 4,5-5,5 para Cornicabra y Morisca, 7,0-8,5 para Arbequina y Picual y 28 para Picolimón) (ART. I; Figura 2). Lo cual permite establecer que la variedad Picolimón, con un contenido de oleuropeína relativamente alto en su fruto (4760 mg/Kg de media entre I.M 2,5 y 4,0) proporcionó el menor contenido secoiridoideo en su aceite (160 mg/Kg, I.M 3,0; ratio 29,8), mientras que Picudo, con un nivel bajo de oleuropeína (2305 mg/Kg, I.M 2,5), presentó un contenido relativamente alto de fenoles complejos en su aceite (1040 mg/Kg, I.M 2,5; ratio 2,3). 73 4.1. Resultados Experimentales «La maduración de la drupa se caracteriza por una gran génesis de antocianos y un considerable descenso de oleuropeína, relacionándose con la disminución de derivados secoiridoideos en su aceite, donde también se ha observado una importante pérdida de la fracción aldehídica C6» Otra de las variables agronómicas bajo estudio ha sido el “grado de maduración” del fruto y su influencia tanto en la composición fenólica de la drupa, como en los perfiles fenólicos y volátiles del aceite de oliva virgen de calidad. Para ello, se han utilizados las drupas y aceites de oliva virgen obtenidos a partir de las variedades Arbequina, Cornicabra, Morisca, Picolimón, Picudo y Picual a distintos estadíos de maduración, como se ha comentado previamente. Además, con el objetivo de realizar un estudio más exhaustivo de esta variable agronómica y para evaluar su efecto sobre la variedad Cornicabra, mayoritaria en la región de Castilla-La Mancha, se prepararon un mayor número de muestras de aceite de esta variedad a partir de frutos con un I.M entre 1,5-2,0 hasta 5,0-5,5, sometidos a distintas condiciones de irrigación (secano, riego deficitario regulado (RDI), FAO y 125 FAO; sobre este aspecto se discutirá en profundidad en el siguiente apartado). Destaca en primer lugar el importante descenso observado en el contenido de oleuropeína a medida que madura la aceituna, independientemente de la variedad de procedencia. Así por ejemplo, los niveles de oleuropeína en los frutos de Arbequina descendieron desde 2230 mg/Kg (I.M 1,0) hasta 60 mg/Kg (I.M 4,0) y en Cornicabra desde 11600 mg/Kg (I.M 1,0) hasta 6340 mg/Kg (I.M 4,0), con la única excepción de los frutos de la variedad Morisca, en donde aumentó de forma no significativa desde 1954 mg/Kg (I.M 1,0) hasta 2639 mg/Kg (I.M 4,0). En segundo lugar, subrayar la génesis predominante de antocianinas responsables de la coloración negra de los frutos maduros (I.M 4,0), siendo el cianidin-3-O-rutinósido la antocianina más abundante en todas las variedades bajo estudio, variando su concentración entre 1058 mg/Kg en los frutos de Morisca y 3236 mg/Kg en la variedad Cornicabra. Por el contrario, la concentración de otros compuestos fenólicos como el verbascósido y los flavonoides, principalmente rutina y luteolin-7-O-glucósido, se vio incrementada durante la maduración del fruto, siendo ésta estadísticamente significativa solamente en las variedades Morisca (con incrementos del 160% en el contenido de rutina y 200% en el luteolín-7-Oglucósido) y Picolimón (con aumentos del 270% y 170% para rutina y luteolín-7-O-glucósido, respectivamente) (ART. I; Tabla 1). El descenso en el contenido de oleuropeína de las drupas a lo largo de su maduración, implica por supuesto, una disminución en la concentración de derivados secoiridoideos en sus correspondientes aceites de oliva virgen (ART. I; Tabla 2), con la única excepción de la forma 3,4-DHPEA-EDA en los aceites Morisca cuya concentración aumenta desde 67,6 mg/Kg (I.M 1,5) hasta 112,6 mg/Kg (I.M 3,0). En el caso de la variedad Cornicabra, con muestras de aceite obtenidos a partir de frutos con I.M 1,5-2,0 hasta I.M 5,0-5,5, se ha observado claramente la 74 4.1. Resultados Experimentales tendencia descendente de los derivados secoiridoideos del hidroxitirosol y tirosol presentes en los mismos (ART. III; Figura 1), ya que la concentración de estas formas fenólicas complejas descendió alrededor de un 40% y 55% de su contenido inicial, respectivamente, en los aceites obtenidos a partir de frutos muy maduros, independientemente del tratamiento de riego empleado en el olivar (campaña 2003/04; I.M 5,0-5,5). Sobre la evolución de los compuestos volátiles C6 presentes en los aceites de las variedades Morisca, Picolimón y Picudo obtenidos en estadíos de maduración temprana (I.M1 0,8-1,5 y I.M2 2,3-3,0), se ha observado un incremento del contenido de E-2-hexenal, hexan-1-ol y Z-3-hexen1-ol, especialmente considerable en el caso del AOV Picudo (I.M1 0,8 y I.M2 2,3) en donde estos volátiles aumentaron un 47%, 162% y 55%, respectivamente. Por otro lado, en los aceites Arbequina, Cornicabra y Picual obtenidos a partir de frutos en estadíos de maduración algo superiores (I.M1 2,0-2,5 y I.M2 3,5-4,0), el incremento de estos volátiles fue menos perceptible e incluso se pudo observar un ligero descenso de los aldehídos C6 (ART. I; Tabla 3). De la misma forma que en los compuestos fenólicos, la evolución de los compuestos volátiles de la ruta LOX a lo largo de la maduración del fruto, se ha estudiado de forma más exhaustiva en la variedad Cornicabra, obteniéndose un descenso de los aldehídos C6 y los volátiles C5, como 1-penten-3-ona y 1-penten-3-ol, desde los estadíos inmaduros a sobremaduros, especialmente notable en el caso del E-2-hexenal, cuya concentración disminuyó entre un 40% (en aceites elaborados con frutos de secano) y un 60% (en aceites obtenidos con el tratamiento de riego FAO) durante la maduración del fruto (campaña 2003/04; ART. III; Figura 2 y Tabla 2). En lo referente a los alcoholes C6, se observó un considerable descenso del E-2-hexen-1-ol, mientras que la presencia de hexan-1-ol y Z-3-hexen-1-ol aumentó de forma significativa durante la maduración del fruto. Por ejemplo el contenido de hexan-1-ol se incrementó desde 0,04 mg/Kg hasta 0,14 mg/Kg y el de Z-3-hexen-1-ol desde 0,17 mg/Kg hasta 0,35 mg/Kg (AOV FAO) (campaña 2003/04; ART. III; Tabla 2). La aplicación del Análisis Discriminante sobre el contenido fenólico y volátil de los aceites de oliva virgen Cornicabra obtenidos a lo largo de la maduración de la aceituna, permitió clasificar correctamente el 85% de los mismos en función del índice de madurez de los frutos de los que procedían mediante el empleo de las variables hexan-1-ol, E-2-hexen-1-ol, 3,4-DHPEA-EDA y p-HPEA-EDA (ART. III; Figura 3), lo que pone de manifiesto la gran influencia de esta variable agronómica en la composición minoritaria del producto obtenido. 75 4.1. Resultados Experimentales «El nivel de estrés hídrico de los olivos está relacionado directamente con el perfil fenólico secoiridoideo del aceite de oliva virgen e inversamente con su contenido en volátiles C6» En lo relativo al análisis del efecto que diversas estrategias de riego aplicadas en el olivar ejercen sobre la calidad y composición del aceite de oliva virgen obtenido, es importante destacar que para llevar a cabo este estudio se han realizado dos ensayos diferentes; (i) El primero de ellos se ha llevado a cabo en un olivar adulto Cornicabra de marco tradicional (50 años) originariamente en condiciones de secano, en donde se aplicaron distintas metodologías de irrigación basadas en el coeficiente de evapotranspiración del cultivo (ETc) y que suponían la aplicación de dosis de riego equivalentes o superiores a este coeficiente, como es el 100% ETc (o método FAO) o el 125% ETc (125 FAO), además de dos estrategias distintas de riego deficitario regulado (regulated deficit irrigation, RDI) en las cuales las dosis de agua se administraron bien a lo largo de toda la estación de riego (RDI-1), o bien a partir del mes de agosto, cuando comienza la acumulación de aceite en el fruto (RDI-2). (ii) El segundo ensayo se ha realizado en dos olivares jóvenes de cubierta incompleta de las variedades Morisca y Cornicabra, plantados en 1998 y 1999 respectivamente, en los cuales se evaluaron dos programaciones de riego basadas en medidas del estado hídrico del olivo in situ, como son el potencial hídrico del tronco (stem water potencial, SWP, con umbrales definidos a 2,0 MPa (SWP -2,0) y -1,2 MPa (SWP -1,2), y las fluctuaciones del diámetro del tronco (trunk diameter fluctuations, TDF), como posibles alternativas a la estrategia de riego en el olivar basada en el cálculo del ETc, como es el 100% ETc (o método FAO). Los detalles del procedimiento experimental utilizado están ampliamente recogidos en la sección de Material y Métodos. Estos ensayos agronómicos se han realizado con olivos de edades distintas y con estrategias de riego diferentes dirigidas a la consecución de objetivos específicos distintos en cada caso, por ello no es posible la comparación directa de los resultados obtenidos en los dos ensayos. Aún así, en ambos estudios se han observado tendencias similares, especialmente en la composición minoritaria de los aceites de oliva virgen obtenidos, que se describirán brevemente a continuación. En primer lugar, resaltar el aumento significativo de la productividad del olivar que supone la aplicación de riego en comparación con el cultivo de secano, cifrándose aproximadamente en un 35%. Se observó como la producción media obtenida en el olivar adulto Cornicabra a lo largo de las campañas olivareras consecutivas entre 2001 y 2004 aumentaba desde 39,2 Kg de aceituna por olivo en condiciones de secano hasta valores medios de 51,8-52,7 Kg de aceituna por olivo en las áreas de regadío (ART. II; Tabla 1). 76 4.1. Resultados Experimentales En lo referente a la influencia del riego sobre la composición fenólica de los AOV, en ambos ensayos se ha descartado cualquier tipo de influencia de este factor agronómico sobre el contenido de fenoles simples en el aceite, como es el caso del hidroxitirosol, tirosol y los ácidos fenólicos, ya que no se observaron diferencias estadísticas relacionadas con los diversas estrategias de riego ensayadas. Así por ejemplo, el contenido de hidroxitirosol en los AOV Cornicabra obtenidos en el olivar tradicional adulto durante la campaña 2003/04, varío entre 1,46 mg/Kg (RDI-1; I.M 1,8) y 3,31 mg/Kg (125 FAO; I.M 4,9), y el de tirosol entre 1,62 mg/Kg (secano; I.M 2,7) y 4,89 mg/Kg (FAO; I.M 5,5), mientras que la cantidad de ácidos fenólicos detectada fue muy pequeña -vainillina (<0,22 mg/Kg), ácido vanílico (<0,26 mg/Kg), ácido pcumárico (<0,25 mg/Kg) y ácido ferúlico (<0,21 mg/Kg)- independientemente de la estrategia de riego utilizada. Por el contrario, los niveles de los derivados secoiridoideos presentes en los aceites de oliva virgen, tanto de la variedad Cornicabra como Morisca, dependieron ampliamente de las técnicas de riego utilizadas en los olivares. Se ha observado que el estado hídrico del olivo afecta en mayor medida al contenido de derivados secoiridoideos del hidroxitirosol presentes en el AOV que a los derivados del tirosol, ya que condiciones de estrés hídrico elevadas suponen un mayor incremento en la concentración de los primeros (ART. III; Figura 1 y ART. IV; Figura 2). De hecho, son las formas complejas 3,4-DHPEA-EDA, 3,4-DHPEA-EA y p-HPEAEDA los compuestos fenólicos más afectados por el estado hídrico de los olivos, de manera que la concentración de los mismos es significativamente superior en aquellos aceites procedentes de frutos en condiciones de mayor déficit hídrico, como es el caso de las condiciones de secano en el olivar adulto o el riego SWP -2,0 en el olivar joven. Así, por ejemplo, en los aceites Cornicabra obtenidos en el olivar adulto, el contenido de 3,4-DHPEAEDA disminuyó alrededor de un 40% al comparar la estrategia FAO con las condiciones de secano (campaña 2003/04; I.M 4,0), mientras que los niveles de 3,4-DHPEA-EA y p-HPEAEDA descendieron alrededor del 35% y 25%, respectivamente, al comparar los mismos AOV (ART. III; Tabla 1). Igualmente, en los aceites Cornicabra obtenidos en el olivar joven, la concentración de 3,4-DHPEA-EDA, 3,4-DHPEA-EA y p-HPEA-EDA disminuyeron alrededor del 40%, 50% y 25%, respectivamente, al comparar los AOV obtenidos mediante las estrategias FAO y SWP -2,0 (campaña 2005/06; I.M 4,0) (ART. IV; Tabla 3). Es bien conocido el hecho de que la intensidad de los atributos sensoriales “amargo” y “picante” están relacionados con el contenido fenólico del AOV, por lo que la intensidad de estos atributos, y especialmente el amargor de los aceites, ha sido significativamente superior en los aceites obtenidos bajo condiciones de mayor déficit hídrico, disminuyendo gradualmente al incrementar las dosis de riego aplicadas al olivar. De forma que la puntuación sensorial del atributo “amargo” en los aceites Cornicabra (I.M ≈ 4,0) descendió desde 8,5 (AOV secano) hasta 6,9 (AOV 125 FAO) en la campaña 2003/04 y desde 7,4 (AOV secano) hasta 6,6 (AOV 77 4.1. Resultados Experimentales 125 FAO) en la campaña 2004/05 (ART. II; Tabla 4), según los datos proporcionados por el panel de cata oficial de la Denominación de Origen Protegida “Montes de Toledo”. También se ha procedido a determinar el amargor de los aceites obtenidos en ambos ensayos mediante la medida instrumental del amargor (índice K225), obteniéndose valores acordes con el contenido fenólico de los mismos y siendo los aceites procedentes de las condiciones hídricas más deficitarias - secano y SWP -2,0 - los que presentaron los mayores valores de K225. Por ejemplo, en los aceites Cornicabra (I.M ≈ 4,0) obtenidos en el olivar tradicional adulto los valores de K225 variaron desde 0,77 (AOV secano) a 0,49 (AOV 125 FAO) en la campaña 2003/04 y desde 0,59 (AOV secano) a 0,36 (AOV 125 FAO) en la campaña 2004/05 (ART. II; Tabla 4), e igualmente sucedió en los aceites procedentes del ensayo en olivares jóvenes (campaña 2006/07; I.M ≈ 3,0-3,5), para los cuales se registraron valores de K225 entre 0,78 (SWP -2,0) y 0,64 (SWP -1,2; AOV Cornicabra) y entre 0,27 (SWP -2,0) y 0,09 (SWP -1,2; AOV Morisca) (ART. IV; Tabla 4). Asimismo, las diferencias encontradas en el contenido fenólico de los aceites Cornicabra y Morisca en función de las diferentes estrategias de riego ensayadas, implican cambios en la estabilidad oxidativa, siendo inferiores en aquellos AOV obtenidos en condiciones de menor déficit hídrico. De esta forma, la estabilidad oxidativa Rancimat registrada en los aceites del ensayo en el olivar adulto (campaña 2003/04; I.M ≈ 4,0) varió entre 38,5 (Secano) y 24,5 horas (125 FAO) y del mismo modo en aquellos procedentes del ensayo en olivares jóvenes (campaña 2006/07; I.M ≈ 3,0-3,5), para los cuales se registraron valores entre 36,5 (SWP -2,0) y 31,7 horas (SWP -1,2; AOV Cornicabra) y entre 5,5 (SWP -2,0) y 2,9 horas (SWP -1,2; AOV Morisca) (ART. II; Tabla 6 y ART. IV; Tabla 4). Por otro lado, se ha determinado en ambos ensayos, que los compuestos volátiles del AOV más afectados por las técnicas de irrigación son el E-2-hexenal, hexanal, Z-3-hexen-1-ol y hexan-1-ol, mostrando una relación inversa respecto al nivel de estrés hídrico del olivo, de manera que el contenido en volátiles C6 de los aceites procedentes de los olivos con mayor déficit hídrico (secano o SWP -2,0) ha sido claramente inferior a aquellos obtenidos mediante el resto de técnicas de irrigación, donde los olivos presentaron un menor estrés hídrico. Así por ejemplo, el contenido en volátiles C6 de los aceites Cornicabra del ensayo en el olivar tradicional adulto se incrementó un 85% (campaña 2003/04; I.M ≈ 4,0) y un 56% (campaña 2004/05; I.M ≈ 4,0) al comparar los AOV obtenidos en condiciones de secano y mediante la metodología de riego FAO (ART. III; Tabla 2). Del mismo modo los aceites del ensayo efectuado en el olivar joven obtenidos con el método FAO presentaron un contenido en volátiles C6 alrededor de un 35% (AOV Cornicabra) y un 18% (AOV Morisca) superior respecto de los obtenidos con la estrategia de riego SWP -2,0 (campaña 2006/07; I.M ≈ 3,0-3,5) (ART. IV; Tabla 5). 78 4.1. Resultados Experimentales También se procedió a la aplicación del Análisis Discriminante sobre el contenido de componentes minoritarios de los AOV Cornicabra obtenidos en el ensayo con el olivar tradicional adulto, clasificándose correctamente el 77% de las muestras en función del tratamiento de irrigación del que procedían, utilizándose las variables 3,4-DHPEA-EDA, E-2hexenal, Z-3-hexen-1-ol y 3,4-DHPEA-EA (ART. III; Figura 4) y poniéndose en evidencia la similitud en el perfil volátil y fenólico de los AOV procedentes del tratamiento RDI-2 respecto de estrategias con mayor grado de irrigación como los métodos FAO o 125 FAO. «El incremento de la temperatura de batido implica un considerable aumento en la concentración secoiridoidea del aceite de oliva virgen, además de un descenso significativo de su fracción aldehídica C6; por el contrario la prolongación del tiempo de batido permite intensificar notablemente la presencia de E-2-hexenal y hexanal en el aroma final del producto» Las variables del proceso de elaboración del aceite de oliva bajo estudio en este trabajo experimental han sido la temperatura y el tiempo utilizados durante la etapa tecnológica de batido de la pasta de aceituna. Se realizaron diversos ensayos en Almazara Experimental utilizándose diferentes temperaturas (20 ºC, 28 ºC y 40 ºC) y tiempos (30 min, 60 min y 90 min) de batido y procesándose dos lotes de aceitunas Cornicabra diferentes (lote I y lote II). Además se llevaron a cabo pruebas adicionales con el sistema de extracción a escala de laboratorio Abencor, empleándose los mismos lotes de aceituna, pero ampliando el rango de temperaturatiempo estudiados a 20, 24, 28, 35 y 40 ºC y 15, 30, 45, 60, 75 y 90 minutos. Los detalles específicos de las pruebas experimentales realizadas están ampliamente recogidos en la sección de Material y Métodos. Tras el estudio de la influencia de estas variables tecnológicas sobre la composición minoritaria de la pasta de aceituna, es importante destacar ciertos resultados. En primer lugar, la inmediata degradación de la oleuropeína del fruto tras la etapa de molienda, cuyo contenido queda inmediatamente reducido hasta un 8,5-5,0% de su contenido inicial (ART. V; Tabla 1), y el cual continúa degradándose a lo largo de toda la etapa de batido desde valores medios de 790 a 270 mg/Kg (ART. V; Figura 1). El principal compuesto fenólico presente en la pasta de aceituna es el 3,4-DHPEA-EDA, que representa entre el 64-76% del contenido fenólico total y cuya concentración también disminuye notoriamente durante el proceso de batido desde valores medios de 7100 hasta 2990 mg/Kg, mientras que el resto de derivados secoiridoideos están presentes en cantidades mucho menores –la forma 3,4-DHPEA-EA representa el 5,4-9,5% del total, el p-HPEA-EDA el 5,9-13,8% y el p-HPEA-EA el 0,4-0,7%- y apenas varían durante esta etapa (ART. V; Figura 1). Por otro lado, al analizar el efecto de la temperatura y el tiempo de batido sobre los niveles de oleuropeína y secoiridoideos del hidroxitirosol presentes en la pasta 79 4.1. Resultados Experimentales de aceituna, se ha observado su notable disminución al aumentar la temperatura de batido desde 20 ºC a 40 ºC y al prolongar el tiempo de trabajo de 30 minutos a 90 minutos, mientras que la forma p-HPEA-EDA mostró una tendencia opuesta (ART. V; Tabla 2 y 3). Además, el carácter hidrófilo de estos compuestos supuso su mayor retención en el orujo húmedo en lugar de producirse su migración a la fase oleosa. Acerca de la evolución de los compuestos volátiles C6 presentes en la pasta de aceituna a lo largo del proceso de batido, se ha detectado un ligero descenso inicial del contenido de E-2hexenal y hexanal para dar lugar a sus respectivos alcoholes C6 al comparar la composición volátil de las pastas inmediatamente después de la molienda del fruto y al inicio del proceso de batido, sin observarse cambios significativos posteriormente (ART. V; Tabla 5). Asimismo, el mayor contenido en volátiles en las pastas de aceituna se detectó al emplearse temperaturas próximas a 20 ºC y prolongar el tiempo de batido hasta 90 minutos, incrementándose especialmente el contenido de E-2-hexenal y hexanal, aunque este último en menor medida (ART. V; Tabla 4 y 5). En lo que respecta a los efectos de la temperatura y tiempo de batido sobre la composición fenólica y volátil de los aceites obtenidos en la Almazara Experimental, se deben remarcar los siguientes aspectos. Por un lado, el incremento de la temperatura de batido desde 20 ºC a 40 ºC supone un aumento considerable de los derivados secoiridoideos del hidroxitirosol y tirosol presentes en el aceite, alrededor de un 130% y 65%, respectivamente, como media de los valores registrados en los lotes I y II (ART. V; Figura 2a); mientras que por el contrario, la fracción aldehídica C6 del aceite disminuye visiblemente, especialmente el E-2-hexenal, cuyo contenido mermó alrededor de un 30% (ART. V; Figura 5a). Por otro lado, el aumento del tiempo de batido de la pasta entre 30 y 90 minutos implicó el aumento significativo de la fracción volátil del aceite obtenido, especialmente los niveles de E-2-hexenal (con incrementos de un 70% como media de los dos lotes estudiados). Por el contrario la concentración de compuestos secoiridoideos apenas se ve afectada, detectándose únicamente un incremento de los derivados secoiridoideos del tirosol de un 17%, como media de los lotes I y II (ART. V; Figuras 2b y 5b). La evolución del perfil fenólico y volátil registrado en los aceites obtenidos con el sistema de molturación Abencor ha sido similar a los cambios observados en los aceites de la Almazara Experimental. El aumento de la temperatura de batido de 20 ºC a 40 ºC implica un incremento de los derivados secoiridoideos del hidroxitirosol y del tirosol del 120% y 65%, respectivamente, mientras que la prolongación del tiempo de batido hasta 90 minutos supuso un descenso del 45% en los secoiridoideos del hidroxitirosol y un aumento del 50% en el nivel de los secoiridideos del tirosol, como valor medio entre los lotes I y II (ART. V; Figuras 3a y 3b). De la misma forma, el contenido en volátiles C6 de los aceites disminuyó al aumentar la temperatura de batido de 20 ºC a 40 ºC, debido principalmente a un considerable descenso en el contenido 80 4.1. Resultados Experimentales de la fracción aldehídica C6 (alrededor de un 45% como media de los dos lotes estudiados), mientras que tiempos más largos de batido suponen en esta misma fracción volátil incrementos del 37% (ART. V; Figuras 6a y 6b). A continuación se presentan los artículos científicos derivados de esta Tesis Doctoral. En ellos se describe y explica de forma detallada los resultados que se han generado tras la labor investigadora realizada. 81 4.1. Resultados Experimentales 82 Food Research International 41 (2008) 433–440 Contents lists available at ScienceDirect Food Research International journal homepage: www.elsevier.com/locate/foodres Effect of cultivar and ripening on minor components in Spanish olive fruits and their corresponding virgin olive oils Aurora Gómez-Rico a, Giuseppe Fregapane b, María Desamparados Salvador a,* a Departamento de Química Analítica y Tecnología de los Alimentos, Universidad de Castilla-La Mancha, Facultad de Químicas, Avda. Camilo José Cela, 10, 13071 Ciudad Real, España, Spain b Instituto Regional de Investigación Científica Aplicada (IRICA), Universidad de Castilla-La Mancha, Avda. Camilo José Cela, 10, 13071 Ciudad Real, España, Spain a r t i c l e i n f o Article history: Received 7 October 2007 Accepted 24 February 2008 Keywords: Olive cultivar Ripening Virgin olive oil Phenols Volatiles a b s t r a c t Phenolics and volatiles are the compounds mainly responsible for the desirable flavour of extra virgin olive oils and therefore to a large extent determine the degree of consumer preference for this highly regarded product. The effect of both (i) the nature of the cultivar and (ii) the degree of ripening of the olive fruit on the biophenolic and volatile profiles of six different Spanish varieties (Arbequina, Cornicabra, Morisca, Picolimón, Picudo and Picual) and their corresponding virgin olive oils was determined in this study. A clear and statistically significant difference was observed for the oleuropein content, the main phenolic component found in the olive varieties studied. Demethyloleuropein was only found in the Arbequina variety and its content doubled during the ripening process. Verbascoside steadily increased throughout fruit maturation and cyanidin 3-O-rutinoside was the most abundant anthocyanin in all the varieties studied. Within the same cultivar a relationship between the oleosides content in the fruit and the presence of secoiridoids in the virgin olive oils was observed; however, the ratio between biophenols content in the olive fruit and in the virgin olive oil varied significantly for each of the cultivars studied (ranging from 2.3 for Picudo and 28 for Picolimon). The major volatile component was the C6 aldehyde fraction whose content varied greatly between the different varieties studied: E-2-hexenal content ranged from 20.5 mg of internal standard (4-methyl-2-pentanol) per kg of oil in the Arbequina variety to 3.1 mg/kg for Cornicabra; the amount of hexanal ranged from 1.75 mg/kg in Morisca to 0.70 mg/kg for Picual samples. Ó 2008 Elsevier Ltd. All rights reserved. 1. Introduction Extra virgin olive oil is obtained from healthy olive fruits by mechanical processes only and is therefore a vegetable oil ready for direct human consumption. The fine sensory characteristics of this fruit juice, which possesses a unique aroma and taste, are mainly due to the presence of minor components, chiefly volatile and phenolic compounds (Angerosa, 2002; Aparicio & Luna, 2002). Volatiles are mainly responsible for the aroma of virgin olive oil, especially for the green sensory notes of high-quality extra virgin olive oils, whereas compounds with a phenolic structure affect both the taste, in particular the positive bitterness organoleptic attribute, and the oxidative stability of virgin olive oil (Angerosa, Mostallino, Basti, & Vito, 2000). Phenolics and volatiles are the compounds mainly responsible for the desirable flavour of extra virgin olive oils and therefore to a large extent determine the degree of consumer preference for this highly regarded product. * Corresponding author. E-mail address: [email protected] (M.D. Salvador). 0963-9969/$ - see front matter Ó 2008 Elsevier Ltd. All rights reserved. doi:10.1016/j.foodres.2008.02.003 The phenolic and volatile contents and profiles of virgin olive oils depend on both (I) the initial composition characteristics of the olive fruits employed for processing and (II) the technological factors used during the oil mill process, in particular milling and malaxation conditions. The chemical and biochemical (especially enzyme activity) composition of olives rely on some agronomical factors, e.g. olive cultivar (Esti, Cinquanta, & La Notte, 1998; Romani, Mulinacci, Pinelli, Vincieri, & Cimato, 1999), the ripening stage of the fruit (Amiot, Fleuriet, & Macheix, 1989), pedoclimatic conditions (Vinha et al., 2005) and irrigation management (Patumi et al., 2002; Tovar, Romero, Girona, & Motilva, 2002). The characteristics and quality of the olive fruits entering the oil mill is therefore a key factor, and probably the most important variable, involved in the quality assurance of the final product. Several studies have already been carried out with the aim of describing the differences found between the phenolic profiles of different olive cultivars (Esti et al., 1998; Romani et al., 1999; Vinha et al., 2005), as well as their evolution throughout the ripening process (Amiot, Fleuriet, & Macheix, 1986; Morelló, Vuorela, Romero, Motilva, & Heinonen, 2005; Servili, Baldioli, Selvaggini, Macchioni, & Montedoro, 1999). Moreover, phenolic and volatile 434 A. Gómez-Rico et al. / Food Research International 41 (2008) 433–440 compounds have likewise been used to discriminate between maturation stages, geographical origin and variety (Angerosa, Basti, & Vito, 1999; Aparicio & Morales, 1998; Vichi, Pizzale, Conte, Buxaderas, & Lopez-Tamames, 2003). However, there have been few (Kalua, Allen, Bedgood, Bishop, & Prenzler, 2005) research projects focusing on phenols and volatiles in both olives and virgin olive oils. In fact, one of the main novelties of this research is to combine these two issues studying the olive fruit minor components as directly related to the corresponding virgin olive oil in order to get a deeper and clearer idea of the effect of cultivar and ripening on the quality of the final product. Moreover, in this study all the olive varieties have been grown in the same olive orchard, with therefore identical agronomical and pedoclimatic conditions. The aim of this work was, therefore, to determine the effect of both (i) the nature of the cultivar and (ii) the ripening stage of the olive fruit on the biophenolic profile of six different Spanish varieties: Arbequina, Cornicabra, Morisca, Picolimón, Picudo and Picual, and their corresponding virgin olive oils. The volatile composition of the virgin olive oils obtained at different maturation stages was likewise studied, the ultimate goal being to enhance knowledge with regard to the most relevant minor components of olive fruits and their virgin olive oils which could be used as cultivar markers and to improve the quality of virgin olive oil. 2. Material and methods 2.1. Experimental olive orchard The study was carried out during the 2005/06 olive season in an olive orchard maintained by C.M.A. El Chaparrillo, Servicio de Investigación y Tecnología Agraria, located in Almodovar del Campo, Ciudad Real, Spain (398N, 38W, altitude 640 m). The climate of the area is Mediterranean; the average annual rainfall was 404 mm, mostly distributed outside of a 4-month summer drought period. The olive orchard was composed of six-year-old olive trees of six different Spanish varieties: Arbequina, Cornicabra, Morisca, Picolimón, Picudo and Picual. The soil at the experimental orchard was a clay loam (depth 1.6 m). The orchard was managed under no irrigation and no tillage conditions; weeds were controlled with post-emergence herbicides. 2.4. Analytical determinations in olive fruit 2.4.1. Phenolic compounds A sample of olive pulp (4.0 g) was homogenised with a mixture of methanol:water (80:20 v/v) (40 ml) during 2 min with an Ultraturrax homogenizer (14,000 rpm). The suspension obtained was shaken (20 min, 150 rpm, <4 °C in darkness), and then centrifuged (10 min, 5000 rpm and 4 °C). The hydromethanolic phase was recovered and filtered with a 0.45 lm nylon syringe filter. The phenolic fraction extracted was analyzed by high-performance liquid chromatography (HPLC) using an Agilent Technologies 1100 series system equipped with an automatic injector, a column oven and a diode array UV detector. A Spherisorb S3 ODS2 column (250 4.6 id mm, 5 lm particle size) (Waters Co., Milford, Massachusetts, USA), maintained at 30 °C, was used with an injection volume of 20 ll and a flow rate of 1.0 ml/min. The mobile phase consisted of a mixture of water/ acetic acid (95:5 v/v) (solvent A), methanol (B) and acetonitrile (C): from 95% (A)–2.5% (B)–2.5% (C) to 34% (A)–33% (B)–33% (C) in 50 min. Chromatograms were recorded at 280 nm, 340 nm and 520 nm. Hydroxytyrosol, oleuropein and demethyloleuropein were quantified at 280 nm, anthocyanins at 520 nm and verbascoside and flavonoids at 340 nm. Phenolic compound quantification was achieved using a five-point calibration curve on the basis of the corresponding standard substances with the exception of hydroxytyrosol which was quantified as tyrosol, and demethyloleuropein, cyanidin 3-glucoside and cyanidin 3-rutinoside as oleuropein. Identification of colourless phenolic compounds was carried out by comparison of their retention times, UV–Visible characteristics and MS spectra with their standard substances. In the case of the anthocyanins and demethyloleuropein (a colourless phenol), these were tentatively identified by their UV–Visible characteristics and MS spectra. The mass detector used was a LCQ Deca XP Plus (Thermo Electron Corporation, Waltham, MA, USA) equipped with an electrospray ionisation system. Nitrogen was used as nebulizing gas at a flow rate of 14 (arbitrary units). The temperature and voltage of the capillary were 250 °C and 4.50 kV, respectively. Data were acquired in the negative ionisation mode. Fragmentation experiments were performed using helium as the collision gas with collision energy between 30% and 40%. 2.2. Fruit harvest and olive oil extraction 2.5. Analytical determination in virgin olive oils Olive fruit samples from the different varieties were handpicked throughout ripening at green, spotted and black stages. Two representative subsamples from each variety were picked at each stage and frozen using liquid N2 and stored at 70 °C until analysis. The olive ripeness index was determined according to the method proposed by the International Olive Oil Council (IOOC, 1984), based on evaluation of the olive skin and pulp colours. Two samplings were also gathered in order to obtain virgin olive oil samples of each variety from unripe (R.I. 1.5–2.0) to ripe (R.I. 3.0–3.5) fruit. Virgin olive oil samples were obtained using the Abencor analyzer (Abengoa S.A., Sevilla, Spain); this system reproduces the industrial process (at laboratory scale) through three basic elements: hammer mill, thermomixer, and centrifuge. The oil obtained was separated by decanting and stored in amber glass bottles at 4 °C in darkness without headspace until analysis. 2.3. Reagents All reagents used were of analytical or HPLC grade, and were supplied by Merck (Darmstadt, Germany). The standards used were from Sigma (St. Louis, MO, USA) or Extrasynthèse (Genay, France). 2.5.1. Phenolic compounds A solution of the internal standard (250 ll of 15 mg/kg of syringic acid in methanol) was added to a sample of virgin olive oil (2.5 g) and the solvent was evaporated with a rotary evaporator at 35 °C under vacuum. The oil was then dissolved in 6 ml of hexane and a diol-bonded phase cartridge (Supelco Co., Bellefonte, USA) was used to extract the phenolic fraction. The cartridge had been previously conditioned first with methanol (6 ml) and then with hexane (6 ml). The oil solution was then applied, and the solid-phase extraction (SPE) column was washed with hexane (2 3 ml) and with hexane/ethyl acetate (85:15, v/v; 4 ml). Finally, the phenols were eluted with methanol (15 ml) and the solvent was removed with a rotary evaporator at 35 °C under vacuum until dryness. The phenolic residue was dissolved in methanol/water (1:1 v/v; 250 ll) and analyzed by HPLC. Chromatographic conditions were the same as those used with the olive pulp phenolic fraction. Phenolic compounds were quantified at 280 nm using syringic acid as internal standard and the response factors determined by Mateos et al. (2001). 435 A. Gómez-Rico et al. / Food Research International 41 (2008) 433–440 2.5.2. Volatile compounds (adapted from Vichi et al., 2003) Solid-phase microextraction (SPME) followed by GC were used to analyze the volatile compounds in the virgin olive oil samples studied. Olive oil (1.5 g) spiked with 4-methyl-2-pentanol (as internal standard) to a concentration of 1.5 lg/g was placed in a 10 ml vial fitted with silicone septum. The SPME sampling was performed by exposing the DVB/Carboxen/PDMS fiber (50/ 30 lm, 2 cm long from Supelco) for 30 min in the headspace of the sample maintained at 40 °C and then retracted into the needle and immediately transferred and desorbed for 1 min in the injection port of a gas chromatoghaph equipped with an FID. Compounds were resolved on a Supelcowax-10 column (30 m 0.25 mm 0.25 lm, Supelco Inc., Bellefonte, PA) under the following conditions: injection port temperature 260 °C; helium flow 0.8 ml/min; oven temperature ramp: 35 °C for 10 min, 3 °C/min up to 160 °C and then 15 °C/min up to 200 °C (maintained for 5 min). Volatile compounds were tentatively identified by comparison with standard substances added to the refined oils. 3. Results and discussion 3.1. Olive fruit biophenols Concentrations, expressed as mg/kg of fresh weight, of the major biophenolic compounds found in the different olive fruit varieties studied at three different ripening stages are reported in Table 1. The main phenolic components found in the olive fruits studied was oleuropein, as previously reported (Amiot et al., 1986,1989; Servili et al., 1999). The content of this oleoside decreased significantly during the course of fruit ripening especially between the spotted and black drupes in almost all the varieties studied. For example in the Arbequina cultivar the levels of oleuropein decreased from 2230 mg/kg to 60 mg/kg (3% of its initial content) during fruit ripening and from 11600 mg/kg to 6340 mg/kg for the Cornicabra variety (55% of initial content). However, it is important to note that oleuropein content increased until reaching its maximum level in the spotted fruits in the Picual and Picolimón cultivars and then decreased significantly in black olives, as also reported by Amiot et al. (1986), Ryan, Robards, and Lavee (1999) and Morelló, Romero, and Motilva (2004). This behaviour could be due to the turnover of the phenolic moieties into new conjugates; on the other hand, the steady decrease in oleuropein contents may be due to its extensive degradation (Ryan, Antolovich, Prenzler, Robards, & Lavee, 2002). In the case of the Morisca variety, the levels of oleuropein increased along the fruit maturation continuum, although this rise was not statistically significant. This trend was All experiments and analytical determinations were carried out at least in duplicate. 2.5.3. Statistical analysis Analysis of ANOVA and discriminant analysis were performed using SPSS 14.0 statistical software (SPSS Inc., Chicago, IL). Duncan’s test (p 6 0.05) was used to discriminate among the mean values. Table 1 Content of major olive fruit biophenolic (mg/kg of fresh weight) with regards to olive cultivar and fruit ripening stage Arbequina Oleuropein Demethyloleuropein Hydroxytyrosol Verbascoside Rutin Luteolin 7-Oglucoside Quercetin 3-Orutinoside Apigenin 7-Oglucoside Cyanidin 3-Orutinoside Cyanidin 3-Oglucoside Cornicabra Green (RI = 1) Spotted (RI = 2.5) Black (RI = 4) 2231 ± 52a 984 ± 47b 219 ± 3a 665 ± 161b 265 ± 83b,c 113 ± 5a 370 ± 222a 1368 ± 68b 333 ± 13a,b 729 ± 276b 265 ± 84a 118 ± 0a 63 ± 13a 1985 ± 637b 349 ± 10b 1231 ± 122d 500 ± 197a 266 ± 89a 0.0 ± 0.0a 2.3 ± 1.4a 0.0 ± 0.0a 9.1 ± 2.9a a a 0.0 ± 0.0 0.0 ± 0.0a 0.0 ± 0.0 0.0 ± 0.0a Spotted (RI = 2.5) Black (RI = 4) NS NS NS NS 11602 ± 1274d 0.0 ± 0.0a 271 ± 56a 0.0 ± 0.0a 344 ± 2d 344 ± 1b,c 8932 ± 413d 0.0 ± 0.0a 206 ± 58a 0.0 ± 0.0a 346 ± 42a 327 ± 59a,b 6340 ± 113d 0.0 ± 0.0a 236 ± 38a 35 ± 24a 359 ± 28a 314 ± 52a NS NS NS NS 1.9 ± 0.7a NS 19.6 ± 2.4c 19.6 ± 1.7b 18.9 ± 2.0b NS 22 ± 13a NS 85 ± 2d 80 ± 21b 68 ± 12b NS b a 3159 ± 169 0.0 ± 0.0 233 ± 40a 0.0 ± 0.0a Picolimon Oleuropein Demethyloleuropein Hydroxytyrosol Verbascoside Rutin Luteolin 7-Oglucoside Quercetin 3-Orutinoside Apigenin 7-Oglucoside Cyanidin 3-Orutinoside Cyanidin 3-Oglucoside Morisca Green (RI = 1) Spotted (RI = 2.5) Black (RI = 4) 5434 ± 514b 0.0 ± 0.0a 255 ± 46a 176 ± 28a 66 ± 1a 62 ± 6a 6978 ± 645c 0.0 ± 0.0a 353 ± 62b 321 ± 102a 151 ± 2a 101 ± 8a 2546 ± 219b 0.0 ± 0.0a 427 ± 12c 624 ± 7c 244 ± 26a 146 ± 10a NS NS NS Black (RI = 4) 1954 ± 205a 0.0 ± 0.0a 346 ± 79a 127 ± 77a 143 ± 57a,b 95 ± 20a 2480 ± 252b 0.0 ± 0.0a 322 ± 6a,b 130 ± 57a 161 ± 34a 137 ± 28a 2639 ± 168b 0.0 ± 0.0a 229 ± 37a 356 ± 130b 359 ± 35a 296 ± 36a NS NS NS NS 4.6 ± 2.3b 2.6 ± 1.8a 6.1 ± 1.9a NS 12 ± 1a,b 11 ± 1a 15 ± 3a NS 3236 ± 238 0.0 ± 0.0 0.0 ± 0.0a 874 ± 98b 0.0 ± 0.0a Picudo Green (RI = 1) Spotted (RI = 2.5) a 0.0 ± 0.0 b Green (RI = 1) a a 1058 ± 110 0.0 ± 0.0a 964 ± 12b 0.0 ± 0.0 a Picual Green (RI = 1) 3441 ± 396a 0.0 ± 0.0a 580 ± 66b 0.0 ± 0.0a 311 ± 149c,d 238 ± 95b Spotted (RI = 2.5) Black (RI = 4) 2305 ± 543b 0.0 ± 0.0a 1102 ± 70c 0.0 ± 0.0a 448 ± 70a 252 ± 35a – – – – – – Green (RI = 1) Spotted (RI = 2.5) Black (RI = 4) NS NS NS NS 8070 ± 74c 0.0 ± 0.0a 327 ± 21a 64 ± 91a 288 ± 142c 463 ± 130c 8311 ± 502d 0.0 ± 0.0a 321 ± 63a,b 92 ± 53a 290 ± 161a 402 ± 198b 5999 ± 233c 0.0 ± 0.0a 377 ± 1b,c 173 ± 45b 449 ± 71a 529 ± 113b NS NS NS NS NS 0.1 ± 0.0a 0.3 ± 0.4a 15 ± 8a NS 0.1 ± 0.0a,b 1.7 ± 0.4a – NS 0.1 ± 0.0a 0.1 ± 0.0a 0.1 ± 0.0a NS 0.1 ± 0.0a 2 ± 1a 11 ± 8a NS 23 ± 12b 27 ± 5a – NS 58 ± 2c 50 ± 34a,b 67 ± 17b NS 0.0 ± 0.0a 0.0 ± 0.0a 2290 ± 144b 0.0 ± 0.0a 0.0 ± 0.0a – NS 0.0 ± 0.0a 68 ± 96a a a a a NS a 0.0 ± 0.0 0.0 ± 0.0 c 1870 ± 35 0.0 ± 0.0 0.0 ± 0.0 – 0.0 ± 0.0 Different letters within a compound (a–d) indicate significant differences (p < 0.05) with respect to olive cultivar at each ripening stage. Last column of each variety indicates significant differences (p < 0.05, ) with respect to maturation for each cultivar; NS, not significant. 5±7 a 3117 ± 721b b 1210 ± 249 A. Gómez-Rico et al. / Food Research International 41 (2008) 433–440 confirmed by the increase in the complex phenol content found in the virgin olive oils of this variety. A clear, statistically significant difference between the six different varieties studied as concerns their oleuropein content was observed (Table 1). This difference was much higher for the Cornicabra and Picual cultivars and accounted for about 95% of the total phenol content at the unripe stage and about 50–60% at overripe stages. The phenol demethyloleuropein was only found in the Arbequina variety and its content doubled during the course of fruit ripening to the point that at the black stage it was the major phenolic compound in these fruits, while no trace was found in the other varieties studied. This phenolic compound, which is most likely a degradation product of the oleuropein as some researches claim (Amiot et al., 1989; Servili et al., 1999), could also be treated as a cultivar marker. This finding is in agreement with Amiot et al. (1989) who found demethyloleuropein in only two of eleven French varieties (Cailletier cv. and L11 cv.) and with Esti et al. (1998) who found this compound in only two out of eight Italian varieties (Coratina cv. and Leccino cv.). The concentration of the simple phenol hydroxytyrosol increased as the fruit ripened although no significant statistical differences were found in these increases for nearly any of the varieties studied. The level of this phenolic acid probably increased as the result of the degradation of the oleuropein during fruit ripening due to the increased activity of some hydrolytic enzymes during maturation (Amiot et al., 1989; Esti et al., 1998), in particular glycosidases, like b-glucosidase which hydrolyze the oleuropein to oleuropein aglycon and 3,4-DHPEA-EDA (Limiroli et al., 1995; Montedoro et al., 1993). Verbascoside, the main hydroxycinnamic derivative in olives, steadily increased along the fruit maturation continuum in all the varieties studied, ranging from 90% in the case of the Arbequina variety and up to 250% for the Picolimón variety (Table 1). Moreover, an inverse relationship between oleuropein and verbascoside content was found, the Arbequina variety exhibiting the highest verbascoside content (between 15% and 22% of the total phenols depending on fruit ripening) and the lowest level of oleuropein (between 50% and 1%), whereas the varieties richest in oleuropein (between 90% and 50% of the total) such as Cornicabra, Picual and Picolimón had the lowest verbascoside content (between 0.5% and 4%). These trends were also observed by Amiot et al. (1989), Servili et al. (1999) and Vinha et al. (2005), the first authors having suggested a metabolic relationship between oleuropein and verbascoside based on the partial degradation of the oleuropein molecule that could be responsible for the formation of verbascoside since the latter is not detected in young fruits. In this study, four colourless flavonoids were also identified and quantified. In all of the varieties studied, rutin and luteolin 7-Oglucoside were the major flavonoids. A clear increase in the concentrations of these compounds during fruit ripening was observed and was statistically significant for the Morisca (an increase of 160% for rutin and 200% for luteolin 7-O-glucoside) and Picolimón varieties (270% and 170%, respectively) (Table 1). A similar trend was observed by Esti et al. (1998) for some Italian cultivars like Coratina and Leccino among others. In contrast, clear differences were not found in the rutin content of the six varieties used in this assay with the exception of the unripe Cornicabra and Picudo fruits whose content was higher than the rest of cultivars. However, luteolin 7-O-glucoside did permit discrimination between the Picual and the other cultivars drupes since its content was significantly higher at the three different ripening stages employed. Quercetin 3-O-rutinoside and apigenin 7-O-glucoside content in the olive fruits was very low except for the Cornicabra cultivar. However, apigenin 7-O-glucoside content for the six cultivars was very dis- 8 6 Function 2 436 5 4 2 2 3 0 6 1 4 -2 -5.0 -2.5 0.0 2.5 5.0 7.5 Function 1 Fig. 1. Discriminant functions plot of olive fruits from the different cultivar studied, classified according to their phenolic profile. Variables: Oleuropein, Hydroxytyrosol, apigenin 7-O-glucoside, cyanidin 3-O-rutinoside. s (open circle), Arbequina; j (solid square), Picual; 4 (open up-triangle), Morisca; $ (open down-triangle), Picolimón; (solid diamond), Picudo; h (open square), Cornicabra. similar, allowing for the statistical discrimination of the Cornicabra and Picual cultivars from the other varieties (Fig. 1). Anthocyanins are principally responsible for the black colour of over-ripe fruits, this ripening stage also being characterized by a significant decrease in chlorophyll content. Table 1 shows the values of the two cyanidin glycosides identified. For all the varieties studied, cyanidin 3-O-rutinoside was the most abundant anthocyanin ranging from 1050 mg/kg for the Morisca fruits and 3240 mg/ kg for the Cornicabra variety at the black ripening stage. Similar results were reported by Romani et al. (1999) and Vinha et al. (2005) who found higher values for cyanidin 3-O-rutinoside than for cyanidin 3-O-glucoside in some Italian and Portuguese cultivars. The results of the Anova and Principal Component Analyses were applied to the Discriminant Analysis to more accurately describe the differences observed in the phenol profile of the fruits of the six Spanish varieties studied. The most useful variables for the classification of the olive fruit samples according to variety were oleuropein, apigenin 7-O-glucoside, hydroxytyrosol and cyanidin 3-O-rutinoside (Fig. 1). The first two discriminant functions accounted for 93.9% of the variance (82.1% and 11.8% respectively), yielding an excellent classification (100%) of olive fruit samples from the different cultivars. As depicted in Fig. 1, the olive fruit samples studied can be broken down into three different groups in relation to their phenolic profile. The first group is constituted by the Cornicabra (number 6 in the figure) and Picual (number 2) cultivars, whose oleuropein, flavonoids and anthocyanin composition was very similar. The second group contains the Picudo (5) variety, characterized by a higher content of hydroxytyrosol, and the third group was formed by the Arbequina (1), Morisca (3) and Picolimón (4) olive fruits, which have similar flavonoid content and the highest verbascoside levels. 3.2. Virgin olive oil minor components 3.2.1. Phenolic compounds Virgin olive oil biophenols are mainly derivatives of the oleosides and lignans contained in olive fruit. Table 2 reports the 437 A. Gómez-Rico et al. / Food Research International 41 (2008) 433–440 Table 2 Content of major virgin olive oil phenols (mg/kg) with regards to olive cultivar and fruit ripening stage Arbequina Hydroxytyrosol 3,4-DHPEA-EDA 3,4-DHPEA-EA Secoiridoids Htyr Tyrosol p-HPEA-EDA p-HPEA-EA Secoiridoids Tyr Total phenols Cornicabra Unripe (RI = 2) Ripe (RI = 3.5) 2.9 ± 0.1d 205.3 ± 5.4c 30.0 ± 0.1a 238.3 ± 4.5c 2.4 ± 0.0b 138.8 ± 1.7b 0.0 ± 0.0a 141.2 ± 1.7b 379.5 ± 6.3b 2.1 ± 0.1b 127.5 ± 10.7b 18.5 ± 1.4a 148.2 ± 11.9b 2.1 ± 0.2b 93.6 ± 6.6b 0.0 ± 0.0a 95.7 ± 6.9b 243.8 ± 18.8b NS NS Picolimon Hydroxytyrosol 3,4-DHPEA-EDA 3,4-DHPEA-EA Secoiridoids Htyr Tyrosol p-HPEA-EDA p-HPEA-EA Secoiridoids Tyr Total phenols Morisca Unripe (RI = 2.5) Ripe (RI = 4.0) 2.8 ± 0.1d 773.6 ± 14.1f 336.8 ± 0.5e 1113.2 ± 14.7f 1.5 ± 0.1a 480.2 ± 6.9e 147.9 ± 3.2d 629.6 ± 10.1e 1742.9 ± 24.7e 2.1 ± 0.1b 717.6 ± 8.5e 286.5 ± 2.2e 1006.2 ± 10.7d 1.2 ± 0.0a 344.1 ± 9.0e 102.1 ± 1.4c 447.4 ± 10.3e 1453.7 ± 21.1e NS NS NS NS Picual Unripe (RI = 1.5) Ripe (RI = 3.0) 0.8 ± 0.0b 99.8 ± 0.7b 41.3 ± 0.4b 142.0 ± 1.1b 4.2 ± 0.0d 88.3 ± 2.1a 3.1 ± 0.0a 95.6 ± 2.1a 237.7 ± 3.2a 0.6 ± 0.0a 72.1 ± 0.3a 32.4 ± 0.4b 105.0 ± 0.1a 3.9 ± 0.0d 49.6 ± 0.1a 1.2 ± 0.0a 54.8 ± 0.1a 159.9 ± 1.0a Unripe (RI = 1.5) Ripe (RI = 3.0) 0.4 ± 0.0a 67.6 ± 0.0a 43.3 ± 0.2b 111.4 ± 0.1a 5.5 ± 0.0e 287.1 ± 1.3d 12.7 ± 1.5b 305.2 ± 0.1c 416.6 ± 1.0b 0.6 ± 0.0a 112.6 ± 1.7b 44.6 ± .2c 157.8 ± 1.9b 6.4 ± 0.1e 261.5 ± 0.7d 9.7 ± 0.5b 277.6 ± 0.4c 435.4 ± 2.3c Picual Very unripe (RI = 0.8) Unripe (RI = 2.3) 4.9 ± 0.1 582.3 ± 10.1 90.1 ± 1.1 677.3 ± 11.4 25.1 ± 0.5 720.0 ± 13.4 24.5 ± 0.8 769.6 ± 14.7 1447.1 ± 26.1 5.0 ± 0.3e 419.9 ± 20.7e 67.5 ± 1.8c 492.4 ± 19.3d 29.8 ± 0.3f 509.0 ± 20.4f 8.7 ± 0.5b 547.5 ± 20.2d 1040.1 ± 39.5d NS Unripe (RI = 2) Ripe (RI = 3.5) 1.8 ± 0.1c 350.3 ± 3.6d 249.5 ± 1.1d 601.6 ± 2.6e 3.3 ± 0.1c 230.0 ± 3.3c 94.2 ± 1.9c 327.6 ± 5.2c 919.3 ± 2.6c 2.2 ± 0.7b 328.4 ± 6.2c 255.4 ± 0.0d 585.9 ± 7.0c 3.3 ± 0.3c 205.4 ± 5.3c 98.1 ± 5.9c 306.8 ± 11.0d 892 ± 18.6d Different letters within a compound (a–f) indicate significant differences (p < 0.05) with respect to olive cultivar at each ripening stage. Last column of each variety indicates significant differences (p < 0.05, ) with respect to maturation for each cultivar; NS, not significant. 7000 7000 ARBEQUINA RI = 3.0 - 3.5 6000 Phenolic Content (mg/Kg) Phenolic Content (mg/Kg) 5000 1000 CORNICABRA RI = 4.0 Oleuropein 6000 2000 Oleuropein + Demethyloleuropein Verbascoside Hydroxytyrosol secoiridoids Htyr Total phenols Htyr 0 Olive fruit 5000 2000 Total phenols Hydroxytyrosol secoiridoids 1000 Tyrosol secoiriodoids Verbascoside Tyrosol secoiriodoids Tyr Htyr Htyr 0 7000 PICUDO RI = 2.5 PICOLIMON RI = 3.0 - 3.5 6000 Phenolic Content (mg/Kg) 6000 Phenolic Content (mg/Kg) Tyr Virgin olive oil Olive fruit Virgin olive oil 7000 5000 Oleuropein 2000 1000 Verbascoside Htyr 0 Olive fruit NS NS NS Hydroxytyrosol Tyrosol Total phenols secoiridoids secoiriodoids Htyr Tyr 5000 Oleuropein 2000 Htyr Total phenols 1000 Hydroxytyrosol Tyrosol secoiridoids secoiriodoids Verbascoside 0 Htyr Virgin olive oil Olive fruit Virgin olive oil Tyr Hydroxytyrosol Oleosides; Verbascoside; Total phenols; Secoiridoids of hydroxytyrosol; Tyrosol; Secoiridoids of tyrosol Fig. 2. Comparison between the biophenol profile in olive fruit and their corresponding virgin olive oils. NS NS NS NS NS NS NS 438 A. Gómez-Rico et al. / Food Research International 41 (2008) 433–440 concentrations of the main phenolic compounds expressed as mg per kg of VOO samples obtained at two different ripening stages from the six varieties studied. The secoiridoid derivatives of hydroxytyrosol and tyrosol were the major phenolic fraction in all the varieties studied, but their distribution varied in the different cultivars. In fact, the secoiridoid derivatives of hydroxytyrosol were the most important complex phenols for Arbequina, Cornicabra, Picolimón and Picual VOO, especially 3,4-DHPEA-EDA whose content ranged from 105.0 mg/ kg to 1113.2 mg/kg, whereas the tyrosol secoiridoids were the major ones found in Morisca and Picudo VOO (mainly p-HPEA-EDA) with values ranging from 54.8 mg/kg to 769.6 mg/kg. This fact is relevant, since hydroxytyrosol and its complex derivative forms are known to possess much greater antioxidant activity and sensory influence than the tyrosol group (Baldioli, Servili, Peretti, & Montedoro, 1996; Gennaro, Piciola Bocca, Modesti, Masella, & Coni, 1998). On the other hand, a significant decrease in these complex phenols in the different cultivars studied was observed as the fruit ripened except for the Morisca variety which showed an increase in the secoiridoid forms of hydroxytyrosol during ripening – from 111.4 mg/kg to 157.8 mg/kg, this behaviour probably having to do with the increase of oleuropein values observed as the Morisca olive fruits ripened. As regards simple phenol content, VOO hydroxytyrosol (ranging from 0.4 mg/kg up to 5.0 mg/kg in the different varieties) and tyrosol values (1.2–29.8 mg/kg) were apparently not affected by the nature of the cultivar (Table 2), with the exception of the higher values in the Picudo variety. This behaviour was similar to that observed for the rest of the minor simple phenols identified, which were present in small amounts – p-coumaric acid (ranging from 0.3 mg/kg up to 1.1 mg/kg in the different cultivars), vanilic acid (0.2–0.5 mg/kg), pinoresinol (4.5–13.0 mg/kg), ferulic acid (0.5– 5.0 mg/kg) – with the exception of the higher ferulic acid content in the Arbequina cultivar (ranging from 25.0 mg/kg up to 33.7 mg/kg). Fig. 2 depicts the oleoside, verbascoside and hydroxytyrosol content of Arbequina, Cornicabra, Picolimon and Picudo fruits and values of total phenols, hydroxytyrosol, tyrosol and their secoiridoid derivatives in the corresponding virgin olive oils obtained. Within the same cultivar a relationship between oleoside (oleuropein plus demethyloleuropein, the latter only found in Arbequina) content in the fruit and the presence of secoiridoids in virgin olive oils was observed and therefore an increase in the oleuropein content in the drupe always led to a proportional increase in the corresponding total phenol concentration in virgin olive oil. In contrast, the ratio between oleoside content in the olive fruit and secoiridoid derivatives in the virgin olive oil was quite different for each of the cultivars studied (approximately 2.3 for Picudo, 4.5–5.5 for Cornicabra and Morisca, 7.0–8.5 for Arbequina and Picual and 28 for Picolimon, calculated as an average value for unripe and ripe olives). This means that the Picolimon variety with a relatively high oleuropein content (4760 mg/ kg on average between RI 2.5 and 4.0) in the olive fruit exhibited the lowest secoiridoid content in the virgin olive oil (160 mg/kg, RI 3.0; ratio 29.8). However Picudo, with a low oleuropein content in the drupe (2305 mg/kg, RI 2.5), showed a relatively high content of complex phenols in virgin olive oil (1040 mg/kg, RI 2.5; ratio 2.3). This is probably due to the varying enzyme levels of each olive cultivar. 3.2.2. Volatile profile The concentrations of C6 and C5 volatile compounds from the lipoxygenase (LOX) pathway, expressed as mg of the internal standard (IS) used (4-methyl-2-pentanol) per kg of oil in VOO samples for the six cultivars studied are reported in Table 3. These compounds, responsible for the positive green sensory notes in VOO, are produced through the LOX pathway which takes place during crushing of the olive fruit and olive paste malaxation and are incorporated into the oily phase (Sanchez & Harwood, 2002). The different activities of the enzymes influence the biogenesis of the volatiles (Scheier, 1984) and explain the typical profiles of the Table 3 Content of virgin olive oil volatiles (mg/kg of IS) with regards to olive cultivar and fruit ripening stage Arbequina 1-penten-3-one 1-penten-3-ol C5 volatiles Hexanal E-2-hexenal Hexan-1-ol Z-3-hexen-1-ol E-2-hexen-1-ol Hexyl acetate Z-3-hexenyl acetate C6 volatiles Cornicabra Unripe (RI = 2) Ripe (RI = 3.5) 0.38 ± 0.01a 0.17 ± 0.01a 0.55 ± 0.01a 1.19 ± 0.01b 20.66 ± 0.05e 0.04 ± 0.00b 0.15 ± 0.00a 0.17 ± 0.01b 0.01 ± 0.00b 0.01 ± 0.01c 22.25 ± 0.08e 0.37 ± 0.02a 0.13 ± 0.01a 0.49 ± 0.01a 1.17 ± 0.02b 20.47 ± 0.36e 0.15 ± 0.00c 0.13 ± 0.00b 0.18 ± 0.02b 0.03 ± 0.00b 0.02 ± 0.00c 22.17 ± 0.40e NS NS NS NS NS NS NS NS NS Picolimon 1-penten-3-one 1-penten-3-ol C5 volatiles Hexanal E-2-hexenal Hexan-1-ol Z-3-hexen-1-ol E-2-hexen-1-ol Hexyl acetate Z-3-hexenyl acetate C6 volatiles Morisca Unripe (RI = 2.0) Ripe (RI = 4.0) 1.10 ± 0.18b 0.34 ± 0.02c 1.54 ± 0.21c 1.18 ± 0.12b 3.20 ± 0.47a 0.02 ± 0.00a 0.12 ± 0.04a 0.11 ± 0.03a <0.01a <0.01a 4.63 ± 0.67a 0.70 ± 0.1c 0.22 ± 0.01d 0.93 ± 0.12c 0.73 ± 0.05a 3.10 ± 0.37a 0.03 ± 0.00a 0.08 ± 0.01a 0.04 ± 0.01a <0.01a <0.01a 3.98 ± 0.44a NS NS NS NS NS NS NS NS NS NS NS Picudo Unripe (RI = 1.5) Ripe (RI = 3.0) 0.52 ± 0.02a 0.18 ± 0.01a 0.71 ± 0.03a,b 1.71 ± 0.03c 9.07 ± 0.19d 0.06 ± 0.00b 0.33 ± 0.01c 0.25 ± 0.01d <0.01a <0.01a 11.44 ± 0.24d 0.67 ± 0.03c 0.17 ± 0.00c 0.84 ± 0.04b,c 1.90 ± 0.11d 10.32 ± 0.34d 0.16 ± 0.01c 0.38 ± 0.01c 0.24 ± 0.00c <0.01a <0.01a 13.02 ± 0.49d NS NS NS NS NS NS NS NS NS NS Unripe (RI = 1.5) Ripe (RI = 3.0) 0.52 ± 0.00a 0.16 ± 0.00a 0.68 ± 0.00a,b 1.75 ± 0.00c 4.11 ± 0.00b 0.15 ± 0.00c 0.26 ± 0.00b 0.19 ± 0.00b <0.01a 0.01 ± 0.00b 6.47 ± 0.00b 0.60 ± 0.01b,c 0.14 ± 0.00b 0.75 ± 0.02b 1.73 ± 0.03c 4.41 ± 0.09b 0.28 ± 0.01d 0.32 ± 0.00c 0.16 ± 0.01b <0.01a 0.01 ± 0.00b 6.91 ± 0.15b NS NS NS NS NS NS NS NS NS NS Picual Very unripe (RI = 0.8) Unripe (RI = 2.3) 0.51 ± 0.00 0.29 ± 0.00 0.80 ± 0.01 1.49 ± 0.02 3.90 ± 0.09 0.06 ± 0.00 0.33 ± 0.00 0.22 ± 0.02 <0.01 <0.01 6.00 ± 0.15 0.54 ± 0.03a 0.24 ± 0.01b 0.79 ± 0.04a,b 1.69 ± 0.48c 5.73 ± 0.15c 0.15 ± 0.00c 0.51 ± 0.00d 0.21 ± 0.02b,c <0.01a <0.01a 8.30 ± 0.23c NS NS NS NS NS NS Unripe (RI = 2) Ripe (RI = 3.5) 0.43 ± 0.00a 0.18 ± 0.00a 0.61 ± 0.00a,b 0.77 ± 0.00a 3.66 ± 0.00a,b 0.04 ± 0.00b 0.27 ± 0.00b 0.23 ± 0.00c,d 0.02 ± 0.00c 0.07 ± 0.00d 5.08 ± 0.00a 0.48 ± 0.00a,b 0.18 ± 0.01c 0.66 ± 0.01a,b 0.69 ± 0.01a 3.48 ± 0.09a 0.07 ± 0.00b 0.33 ± 0.01c 0.21 ± 0.03b,c 0.03 ± 0.00b 0.14 ± 0.00d 4.95 ± 0.15a Different letters within a compound (a–f) indicate significant differences (p < 0.05) with respect to olive cultivar at each ripening stage. Last column of each variety indicates significant differences (p < 0.05, ) with respect to maturation for each cultivar; NS, not significant. NS NS NS NS NS NS NS A. Gómez-Rico et al. / Food Research International 41 (2008) 433–440 monovarietal virgin olive oils, although external variables modulate the final volatile profile. In all the VOO samples analyzed, the major volatile component was the C6 aldehyde fraction, whose content was highly variable between the varieties studied. Especially the E-2-hexenal content, responsible for almond and green sensory notes (Aparicio, Morales, & Alonso, 1996), whose levels ranged from 20.5 mg/kg in the Arbequina VOO to approximately 3.1 mg/kg for Cornicabra VOO. These results agree with the findings of Aparicio and Luna (2002) that suggested that monovarietal VOO could be distinguished by E-2-hexenal. On the other hand, the amount of hexanal related with the apple and green fruity attributes (Aparicio et al., 1996) was lower and varied between 1.75 mg/kg in Morisca VOO and 0.70 mg/kg for Picual VOO samples. Statistically significant differences were likewise found in C6 alcohol content (also related to fruity, green, grassy and sweet sensory notes) between the different cultivars studied. Hexan-1-ol was the minor C6 alcohol found in all six cultivars and its low content accounted for between 0.2% and 0.7% of the total volatiles in the Arbequina and Cornicabra VOO and 2.2% and 3.7% in the Morisca samples. Z-3-hexen-1-ol and E-2-hexen-1-ol values were lower in the Cornicabra and Arbequina cultivars and each C6 alcohol ranged from 0.08 to 0.15 mg/kg and 0.04 to 0.18 mg/kg respectively. On the other hand, the Picudo VOO samples had a higher Z-3-hexen-1-ol concentration (0.33–0.51 mg/Kg), whereas the greatest E-2-hexen-1-ol values were found in the Picolimón, Picual and Picudo varieties (0.21–0.24 mg/kg). C6 esters such as hexylacetate (also related with sweet and fruity notes) and Z-3-hexylacetate (fruity and green leaves), were also present in very small amounts in all the VOO except for the Picual and Arbequina varieties, indicating scant alcohol acyl transferase (AAT) activity in the majority of the cultivars (Sanchez & Harwood, 2002). As regards the evolution of C6 volatile compounds of VOO throughout fruit maturation, some researchers (Angerosa, Mostallino, Basti, & Vito, 2001; Solinas, Maesilio, & Angerosa, 1987) have shown that the amount of volatile compounds increases up to a maximum concentration, especially E-2-hexenal content occurring when fruit skin colour turns from yellow-green to purple; beyond that point volatile content decreases. In this study the virgin olive oils from Morisca, Picolimón and Picudo cultivars were obtained at very early ripening stages (RI1 = 1.0–1.5 and RI2 = 2.3–3.0), so a clear increase in the majority of the C6 volatiles was observed, especially E-2-hexenal, although these increases were only statistically significant for this aldehyde in the Picudo VOO and for the hexan-1-ol content in the three varieties. On the other hand, the Arbequina, Picual and Cornicabra VOO were obtained at two different later ripening stages (RI1 = 2.0–2.5 and RI2 = 3.5–4.0) and therefore the increase of C6 volatiles was less perceivable and a slight decrease of the C6 aldehydes was even observed. An additional branch of the LOX pathway is active on the linolenic acid substrate, leading to the production of C5 volatile compounds, which are also present in the VOO aroma (Angerosa et al., 2000,2001). As expected, reasonable amounts of 1-penten-3-one and 1-penten-3-ol were found in all VOO cultivars, their content ranging from 0.38 mg/kg and 1.10 mg/kg for 1-penten-3-one, and from 0.13 mg/kg and 0.34 mg/kg for 1-penten-3-ol in the different oil varieties, being the major quantities in the Cornicabra variety. Acknowledgments This research project was supported by the Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (Project INIA-MEC RTA04-046-C3-3). We express our gratitude to Dr. Alfonso Moriana (C.M.A. El Chaparrillo, Servicio de Investigación y Tecnología Agraria, Ciudad Real, Spain) for the supply of the different olive fruit varieties employed in this study. 439 References Amiot, M. J., Fleuriet, A., & Macheix, J. J. (1986). Importance and evolution of phenolic compounds in olive during growth and maturation. Journal of Agriculture and Food Chemistry, 34, 823–826. Amiot, M. J., Fleuriet, A., & Macheix, J. J. (1989). Accumulation of oleuropein derivatives during olive maturation. Phytochemistry, 28, 67–69. Angerosa, F. (2002). Influence of volatile compounds on virgin olive oil quality evaluated by analytical approaches and sensor panels. Journal of Lipid Science and Technology, 104(9–10), 639–660. Angerosa, F., Basti, C., & Vito, R. (1999). Virgin olive oil volatile compounds from lipoxigenase pathway and characterization of some Italian cultivars. Journal of Agriculture and Food Chemistry, 47, 836–839. Angerosa, F., Mostallino, R., Basti, C., & Vito, R. (2000). Virgin olive oil odour notes: Their relationship with volatile compounds from the lipoxygenase pathway and secoiridoid compounds. Food Chemistry, 68, 283–287. Angerosa, F., Mostallino, R., Basti, C., & Vito, R. (2001). Influence of malaxation temperature and time on the quality of virgin olive oils. Food Chemistry, 72, 19–28. Aparicio, R., & Morales, M. T. (1998). Characterization of olive ripeness by green aroma compounds of virgin olive oil. Journal of Agriculture and Food Chemistry, 46, 1116–1122. Aparicio, R., Morales, M. T., & Alonso, M. V. (1996). Relationship between volatile compounds and sensory attributes of olive oil by the sensory wheel. Journal of American Oil Chemistry Society, 73, 1253–1264. Aparicio, R., & Luna, G. (2002). Characterisation of monovarietal virgin olive oil. European Journal Lipid Science and Technology, 104, 614–627. Baldioli, M., Servili, M., Peretti, G., & Montedoro, G. F. (1996). Antioxidant activity of tocopherols and phenolic compounds of virgin olive oil. Journal of American Oil Chemistry Society, 73, 1589–1593. Esti, M., Cinquanta, L., & La Notte, E. (1998). Phenolic compounds in different olive varieties. Journal of Agriculture and Food Chemistry, 46, 32–35. Gennaro, L., Piciola Bocca, A., Modesti, D., Masella, R., & Coni, E. (1998). Effect of biophenols on olive oil stability evaluated by thermogravimetric analysis. Journal of Agriculture and Food Chemistry, 46, 4465–4469. IOOC (1984). Document no 6. International Olive Oil Council, Madrid. Kalua, C. M., Allen, M. S., Bedgood, D. R., Bishop, A. G., & Prenzler, P. D. (2005). Discrimination of olive oils and fruit into cultivars and maturity stages based on phenolic and volatile compounds. Journal of Agriculture and Food Chemistry, 53, 8054–8062. Limiroli, R., Consonni, R., Ottolina, G., Marsilio, V., Bianchi, G., & Zetta, L. (1995). 1H and 13C NMR characterization of new oleuropein aglycones. Journal of American Oil Chemistry Society, 1, 1519–1523. Mateos, R., Espartero, J. L., Trujillo, M., Ríos, J. J., León-Camacho, M., Alcudia, F., & Cert, A. (2001). Determination of phenols, flavones and lignans in virgin olive oil by solid-phase extraction and high-performance liquid chromatography with diode array ultraviolet detection. Journal of Agriculture and Food Chemistry, 49, 2185–2192. Montedoro, G. F., Servili, M., Baldioli, M., Selvaggiani, R., Miniati, E., & Macchioni, A. (1993). Simple and hydrolyzable compounds in virgin olive oil. 3. Spectroscopic characterizations of the secoiridoids derivatives. Journal of Agriculture and Food Chemistry, 41, 2228–2234. Morelló, J. R., Romero, M. P., & Motilva, M. J. (2004). Effect of maturation process of the olive fruit on the phenolic fraction of drupes and oils from Arbequina, Farga and Morrut cultivars. Journal of Agriculture and Food Chemistry, 52, 6002–6009. Morelló, J. R., Vuorela, S., Romero, M. P., Motilva, M. J., & Heinonen, M. (2005). Antioxidant activity of olive pulp and olive oil phenolic compounds of the Arbequina Cultivar. Journal of Agriculture and Food Chemistry, 53, 2002–2008. Patumi, M., d́Andria, R., Marsilio, V., Fontanazza, G., Morelli, G., & Lanza, B. (2002). Olive and olive oil quality after intensive monocone olive growing (Olea europaea L., cv. Kalamata) in different irrigation regimes. Food Chemistry, 77, 27–34. Romani, A., Mulinacci, N., Pinelli, P., Vincieri, F., & Cimato, A. (1999). Polyphenolic content in five tuscany cultivars of Olea europaea L. Journal of Agriculture and Food Chemistry, 47, 964–967. Ryan, D., Antolovich, M., Prenzler, P., Robards, K., & Lavee, S. (2002). Biotransformations of phenolic compounds in Olea europaea L. Scientia Horticulturae, 92, 147–176. Ryan, D., Robards, K., & Lavee, S. (1999). Determination of phenolic compounds in olives by reversed-phase chromatography and mass spectrometry. Journal of Chromatography A, 832, 87–96. Sanchez, J., & Harwood, J. L. (2002). Byosinthesis of triacylglycerols and volatiles in olives. European Journal of Lipid Science and Technology, 104, 564–573. Scheier, P. (1984). Chromatographic studies of biogenesis of plant volatiles. In W. Bertsch, W. G. Jenning, & R. E. Kaiser (Eds.), Series of chromatographic methods (pp. 52–147). Heidelberg, Germany: Hüthig. Servili, M., Baldioli, M., Selvaggini, R., Macchioni, A., & Montedoro, G. F. (1999). Phenolic compounds of olive fruit: One- and two-dimensional nuclear Magnetic Resonance Characterization of Nüzhenide and its distribution in the constitutive parts of fruit. Journal of Agriculture and Food Chemistry, 47, 12–18. Solinas, M., Maesilio, V., & Angerosa, F. (1987). Evoluzione di alcuni componenti delĺaroma degli oli vergini di oliva in relazione del grado de maturazione delle olive. Rivista Italiana della Sostanze Grase, 64, 475. 440 A. Gómez-Rico et al. / Food Research International 41 (2008) 433–440 Tovar, M. J., Romero, M. P., Girona, J., & Motilva, M. J. (2002). L-Phenylalanine ammonia-lyase activity and concentration of phenolics in developing fruit of olive tree (Olea europaea L. cv. Arbequina) grown under different irrigation regimes. Journal of Science and Food Agriculture, 82, 892–898. Vichi, S., Castellote, A. I., Pizzale, L., Conte, L. S., Buxaderas, S., & Lopez-Tamames, E. (2003). Analysis of virgin olive oil volatile compounds by headspace solidphase microextraction coupled to gas chromatography with mass spectrometric and flame ionisation detection. Journal of Chromatography A, 983, 19–33. Vichi, S., Pizzale, L., Conte, L. S., Buxaderas, S., & Lopez-Tamames, E. (2003). Solid-phase microextraction in the analysis of virgin olive oil volatile fraction: characterization of virgin olive oils from two distinct geographical areas of northern Italy. Journal of Agriculture and Food Chemistry, 51, 6572–6577. Vinha, A. F., Ferreres, F., Silva, B. M., Valentao, P., Goncßalves, A., Pereira, J. A., Oliveira, B., Seabra, R. M., & Andrade, P. B. (2005). Phenolic profiles of Portuguese olive fruits (Olea europaea L.): Influences of cultivar and geographical origin. Food Chemistry, 89, 561–568. Food Chemistry Food Chemistry 100 (2007) 568–578 www.elsevier.com/locate/foodchem Influence of different irrigation strategies in a traditional Cornicabra cv. olive orchard on virgin olive oil composition and quality Aurora Gómez-Rico a, M. Desamparados Salvador b, Alfonso Moriana c, David Pérez c, Nicolás Olmedilla c, Francisco Ribas c, Giuseppe Fregapane a,* a c Departamento de Quı́mica Analı́tica y Tecnologı́a de los Alimentos, Faculdad de Quimicas, Universidad de Castilla-La Mancha, Avda. Camilo Jose Cela 10, 13071 Ciudad Real, Spain b Instituto Regional de Investigación Cientı́fica Aplicada (IRICA), Universidad de Castilla-La Mancha, Spain C.M.A. El Chaparrillo, Servicio de Investigación y Tecnologı́a Agraria, Delegación Provincial de Agricultura, Ciudad Real, Spain Received 1 August 2005; received in revised form 30 September 2005; accepted 30 September 2005 Abstract The olive tree is generally grown under rain-fed conditions. However, since the yield response to irrigation, even with low amounts of water, is great there is increasing interest in irrigated agriculture. The main goal of this study was therefore to optimize sustainable irrigation conditions in the Cornicabra olive cultivar grown in Castilla-La Mancha, a region where the aquifers are over-exploited, and to study the effect of different irrigation strategies on the composition and quality of Cornicabra virgin olive oil. Different irrigation treatments, based on regulated deficit irrigation (RDI), 100% ETc, 125% ETc, and rain-fed as control, were applied to a traditional olive orchard (cv Cornicabra) in a randomized complete-block design with four replications. The average olive production of the trees grown under rain-fed conditions was much lower, about 35%, than that obtained by applying the different irrigation treatments studied, between which practically no difference were observed. The total phenol content, which affected the sensory bitterness in the oils, decreased significantly as the amount of supplied water increased. This is very relevant, as high levels of phenols, typical of Cornicabra virgin olive oils, may decrease consumer preference. Notably, one of the RDI strategies produced olive oil similar in composition and quality to that obtained by 100% ETc but with reduced water usage. 2005 Elsevier Ltd. All rights reserved. Keywords: Irrigation; Olive oil; Production; Composition; Quality; Phenols; Sensory 1. Introduction The olive tree is the most extensive arboreous crop in Spain, the number one olive oil producing country in the world. More than 280,000 ha are grown in the region of Castilla-La Mancha, accounting for 15% of the Spanish olive crop. The most important olive cultivar grown in this region is the Cornicabra, which produces virgin olive oil characterised by high oxidative stability and unique sen- * Corresponding author. Tel.: +34 902204100x3439; fax: +34 926 295318. E-mail address: [email protected] (G. Fregapane). 0308-8146/$ - see front matter 2005 Elsevier Ltd. All rights reserved. doi:10.1016/j.foodchem.2005.09.075 sory characteristics (intense bitterness), which are both due to high levels of phenolic compounds. The olive tree is generally grown under rain-fed conditions, especially in Castilla-La Mancha, a region with limited water resources. Nevertheless, since irrigation increases the yield of the olive orchard, even with a low amount of water, there is increasing interest in irrigated agriculture. This has led to a situation in which some of the traditional olive groves, and the majority of the new ones, are being adapted to irrigation techniques. Proper agriculture practices must contribute to healthy olive fruit production, which is the best guarantee of high quality olive oil production. Irrigation, even in areas where water is limited, is therefore an advisable technique from the A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 point of view of both the production and quality of olive fruit, since high-quality olive oil cannot be obtained from olive fruit suffering from a high degree of water stress. Nevertheless, a satisfactory compromise between the amount of water applied and the improvement in the production and quality of the olive crop must be fully investigated. There is scarce information available on the influence of irrigation on olive tree growth and production and on the composition and quality of the virgin olive oil obtained, especially in the case of the Cornicabra variety. Some recent research has shown differences in the chemical makeup and sensory characteristics of virgin olive oil from irrigated and rain-fed olive trees (Aparicio & Luna, 2002). The chemical components most influenced by irrigation are the phenolic compounds, which affect both the oxidative stability and the sensory characteristics, especially the bitterness attribute, showing in both cases an inverse relationship with the amount of water applied to the olive trees (DÕAndria, Morelli, Martuccio, Fontanazza, & Patumi, 1996; Motilva, Romero, Alegre, & Girona, 1999; Motilva, Tovar, Romero, Alegre, & Girona, 2000; Tovar, Romero, & Motilva, 2001). This aspect is important in olive cultivars that produce virgin olive oils with high bitterness and pungency, such as, the Cornicabra variety in Castilla-La Mancha, and therefore just the right level of irrigation could enhance its sensory characteristics. The main goal of this study was therefore to optimize sustainable irrigation conditions in the Cornicabra olive cultivar grown in Castilla-La Mancha, a region where aquifers are over-exploited, and to study the effect of different irrigation strategies on the composition and quality of Cornicabra virgin olive oil. Different irrigation treatments (based on 100% crop evapotranspiration, ETc, also known as the FAO method, 125% ETc, two different regulated deficit irrigation strategies and rain-fed) were applied to a traditional olive orchard (cv Cornicabra) planted at 70 trees per hectare in a randomized complete-block design with four replications. 2. Materials and methods 2.1. Experimental olive orchard The study was carried out during the 2003/2004 and 2004/2005 olive crop seasons in an experimental olive orchard of Cornicabra cv. maintained by Conserjerı́a de Agricultura y Medio Ambiente (Department of Agriculture and the Environment), located in Almodóvar del Campo (Ciudad Real, Spain). About three hundred and twenty 50-year-old trees, spaced 12 · 12 m2, were used in a randomised complete block design with four different treatments and four replications. Each experimental unit consisted of 4 · 3 trees, where only the central ones were used for sampling. The experimental olive orchard was enclosed by two outer rows of irrigated olives. All of the agronomical treatments applied to the experimental olive 569 orchard were identical, with the exception of the amount of water applied. 2.2. Irrigation treatments Four treatments were applied two years before the commencement of this assay: rain-fed (RF), regulated deficit irrigation (RDI), FAO and 125 FAO. Rain-fed treatment was used as the control to compare the results obtained with the three irrigation treatments studied. In the FAO treatment, the water requirements were obtained using methodology proposed by the Food and Agriculture Organization of the United Nations, by subtracting the effective precipitation (41 mm in 2003 and 138 mm in 2004) from the crop evapotranspiration (ETc), this latter term being calculated using the effective crop coefficient (Kc), the reference crop evapotranspiration (ETo; 822 mm in 2003 and 801 mm in 2004) obtained from an agronomic weather station and a reductor coefficient (Kr) that depended on the size of the tree (ETc = Kc · ETo · Kr; Doorenbos & Pruitt, 1977). In 125 FAO treatment, an irrigation dosage 25% higher than the FAO treatment was applied. As for the regulated deficit irrigation (RDI), a maximum amount of 75 mm of water was established since, in many Spanish irrigated olive areas, there is a legal limitation of 100 mm, and two different strategies were evaluated. In 2003, water was applied throughout the entire season with different rates of application (10% FAO in May and June, 4% FAO in July and August and 18% FAO in September); however, in 2004, based on the results obtained during the previous crop season, water was applied only from the beginning of August, when the oil formation starts in the fruit, with the purpose of investigating which RDI treatment is more effective in reaching similar olive production and olive oil quality to that obtained by the FAO method but considerably reducing the total amount of water applied. In all irrigation treatments, olive trees were irrigated daily with eight compensating drippers (4 l/h) placed around the trees. The total water applied in 2003 for the different irrigation treatments was: 56 mm for RDI, 148 mm for FAO and 206 mm for 125 FAO; and in 2004: 60 mm for RDI, 124 mm for FAO and 154 mm for 125 FAO. In order to fully describe the different irrigation strategies used, the water stress integrals (MPa · day; as defined by Myers, 1998), calculated from the midday steam water potential data, and the minimum potential values are reported. These values during 2003 were: 332 MPa d and 4.1 MPa (observed in the middle of September) for RF; 316 MPa d, 4.1 MPa (middle of September) for RDI; 218 MPa d, 2.3 MPa (middle of September) for FAO; 172 MPa d, 1.8 MPa (middle of September) for 125 FAO. The following experimental data were observed in 2004: 269 MPa d and 4.1 MPa (middle of October) for RF; 223 MPa d, 2.9 MPa (beginning of August) for RDI; 176 MPa d, 2.2 MPa (end of September) for FAO; 159 MPa d, 1.7 MPa (middle of October) for 125 FAO. 570 A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 2.3. Olive and olive oil samples Olive fruit samples from rain-fed and irrigation treatments trees were harvested throughout ripening, from immature stage to normal harvest period for the Cornicabra variety. Five and three samplings were gathered in 2003/2004 and 2004/2005, respectively; the samples were collected by hand from the beginning of November to the end of December, whereas the fifth sampling collected from the 2003/2004 crop was collected by a mechanical shaker at the beginning of January. The olive fruit sampling of the different irrigation treatments was not always carried out on the same date, with a view to obtaining a more homogeneous pool of samples between the irrigation treatments studied. Four representative subsamples from each treatment (four subsamples · four treatments) were picked at each sampling and brought to the laboratory for oil extraction. Virgin olive oil samples of Cornicabra variety were then obtained using the Abencor method and analysed for this study. 2.4. Analytical determinations in olive fruits Ripeness index. The olive ripeness index was determined according to the method proposed by the International Olive Oil Council (IOOC, 1984), based on the evaluation of the olive skin and pulp colours. Ripeness index values range from 0 (100% intense green skin) to 7 (100% purple flesh and black skin). Industrial oil yield. An Abencor system was used to extract the virgin olive oil. The oil obtained was separated by decanting and the amount measured. The industrial oil yield was expressed as a percentage of fresh olive paste weight (Martı́nez, Muñoz, Alba, & Lanzón, 1975). Samples were filtered and stored at 4 C in darkness using amber glass bottles without headspace until analysis. Water and oil content. The water content of olive paste was determined by desiccation according to the UNE Spanish standard method. The fat content was determined by Soxhlet extraction and was expressed as a percentage of dry olive paste weight (UNE Spanish Standard 55032:1973). 2.5. Analytical determinations in virgin olive oil All reagents used were of analytical, HPLC or spectroscopic grade, and were supplied by Merck (Darmstadt, Germany). Free acidity, given as % of oleic acid, peroxide value (PV) expressed as milliequivalents of active oxygen per kilogramme of oil (meq O2/kg), and K232 and K270 extinction coefficients calculated from absorption at 232 and 270 nm, were measured following the analytical methods described in European Regulation EEC 2568/91 and subsequent amendments. For phenolic compounds a solution of the internal standard (250 ll of 15 mg/L of syringic acid in methanol) was added to a sample of virgin olive oil (2.5 g) and the solvent was evaporated with a rotary evaporator at 35 C under vacuum. The oil was then dissolved in 6 ml of hexane and a diol-bonded phase cartridge (Supelco Co., Bellefonte, USA) was used to extract the phenolic fraction. The cartridge was conditioned with methanol (6 ml) and hexane (6 ml), the oil solution was then applied, and the SPE column was washed with hexane (2 · 3 ml) and with hexane/ethyl acetate (85:15, v/v; 4 ml). Finally, the phenols were eluted with methanol (15 ml) and the solvent was removed with a rotary evaporator at 35 C under vacuum to dryness. The phenolic residue was dissolved in methanol/water (1:1 v/v; 250 ll). HPLC analysis was performed using an Agilent Technologies 1100 series system equipped with an automatic injector, a column oven and a diode array UV detector. A Spherisorb S3 ODS2 column (250 · 4.6 id mm, 5 lm particle size) (Waters Co., Milford, Massachusetts, USA) was used, maintained at 30 C, with an injection volume of 20 ll and a flow rate of 1.0 ml/min. Mobile phase was a mixture of water/acetic acid (95:5 v/v) (solvent A), methanol (B) and acetonitrile (C): from 95% (A) 2.5% (B) 2.5% (C) to 34% (A) 33% (B) 33% (C) in 50 min. Phenolic compounds were quantified at 280 nm using syringic acid as internal standard and the response factors determined as by Mateos et al. (2001). Tocopherols were evaluated following the AOCS Method Ce 8-89. A solution of oil in hexane was analysed on an Agilent Technologies HPLC (1100 series) on a silica gel Lichrosorb Si-60 column (particle size 5 lm, 250 mm · 4.6 mm i.d.; Sugerlabor, Madrid, Spain) which was eluted with hexane/2propanol (98.5:1.5) at a flow rate of 1 ml/min. A fluorescence detector (Thermo-Finnigan FL3000) was used with excitation and emission wavelength set at 290 and 330 nm. Oxidative stability was evaluated by the Rancimat method (Laübli & Bruttel, 1986). Stability was expressed as the induction time (hours) measured with the Rancimat 679 apparatus (Metrohm, Switzerland). Fatty acid composition was determined following the European Regulations EEC 2568/91 and subsequent amendments, corresponding to the AOCS method Ch 291. To determine fatty acid composition, the methyl-esters were prepared by vigorous shaking of a solution of oil in hexane (0.2 g in 3 ml) with 0.4 ml of 2 N methanolic potassium hydroxide and analysed by GC with a FID detector. A fused silica column (50 m length · 0.25 mm i.d.) coated with SGL-1000 phase (0.25 lm thickness; Sugerlabor, Spain) was used. The carrier gas was helium, at a flow through the column of 1 ml/min. The injector and detector temperatures were set at 250 C and the oven temperature at 210 C. The injection volume was 1 ll. Sensory evaluation was done by an International Olive Oil Council recognized Panel of assessors from the Protected Designation of Origin ‘‘Montes de Toledo’’ (Toledo, Spain) and the University of Castilla-La Mancha according to Annex XII of Regulation EC 796/2002 (amending ECC 2568/91). A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 Bitterness index (K225) was determined by the method described by Gutiérrez-Rosales, Perdiguero, Gutiérrez, and Olı́as (1992), which consists of the extraction of the bitter components from a sample of 1.0 ± 0.01 g of oil dissolved in 4 ml of hexane passed through a C18 column (Bakerbond spe, J.T. Baker, Phillipsburg, NJ, USA) previously activated with methanol and washed with hexane. After elution, 10 ml of hexane was passed to eliminate the oil residues and then the retained compounds were eluted with methanol/water (1:1) to 25 ml. The absorbance of the extract was measured at 225 nm against methanol/ water (1:1) in a 1-cm cuvette. Chlorophyll and carotenoid compounds (mg/kg) were determined at 472 and 670 nm in cyclohexane using specific extinction values, by the method described by Mı́nguezMosquera, Rejano, Gandul, Sánchez, and Garrido (1991). All experiments and analytical determinations were carried out at least in duplicate. 2.6. Statistical Analysis Statistical analyses were performed using SPSS 11 statistical software (SPSS Inc. Chicago, IL). 3. Results and discussion 3.1. Production of the olive grove The olive production data of the experimental olive orchard studied, expressed as weight of fruits per olive tree throughout the 2001/2002 to 2004/2005 crop seasons for the different irrigation treatments studied, rain-fed (RF), regulated deficit irrigation (RDI), FAO (Food and Agriculture Organization methodology, based on the crop evapotranspiration, ETc), and 125% FAO, are listed in Table 1. The average olive production of the trees grown under rain-fed conditions (39.2 kg/tree) was much lower, about 35%, compared with that obtained applying the different irrigation treatments studied (from 51.8 to 52.7 kg/tree), between which practically no differences were observed. This observation agrees with the results obtained by Patumi et al. (1999) and Pastor et al. (1999), who reported a rise in olive production using irrigation, but no statistically significant difference between the irrigation doses used. The reported data also show the typical high and Table 1 Olive production in the different irrigation treatments studied Crop Season Olive Production (kg/tree) Rain-fed Deficit irrigation FAO 125 FAO 2001/2002 2002/2003 2003/2004 2004/2005 47.4 27.0 62.3 20.1 54.3 58.3 61.1 35.5 62.0 52.5 67.2 28.9 50.2 52.4 80.1 24.4 Mean 39.2 52.3 52.7 51.8 571 low fruit load behaviour of the olive trees in successive crop seasons, especially in the case of the RF conditions. 3.2. Characteristics and composition of the olive fruit Table 2 lists the olive fruit characteristics and composition, as affected by the different irrigation treatments studied and the ripeness index of the fruits for the two crop seasons studied (2003/2004 and 2004/2005). The olive fruit sampling of the different irrigation conditions was not always carried out on the same date, with a view to obtaining a more homogeneous pool of samples between the irrigation treatments studied. For this reason a discussion of the statistically significant difference in the ripeness index of the olive fruit, among the different irrigation treatments studied, cannot be performed. Nevertheless, taking into account the harvesting date of the different olive sampling (data not shown), it should be noted that, with the exception of the last sampling, the olive fruits of the FAO irrigation treatment generally had a higher ripeness index than those of rain-fed conditions. For the 125 FAO treatment, corresponding to the higher amount of water applied, this tendency was not observed, due to the greater olive production obtained with this treatment in the crop season 2003/2004 (Table 1), given that, as olive production rises, fruit ripening slows down. In crop season 2003/2004 the fresh fruit weight and the pulp/pit ratio of the olive fruit were consistently higher in the irrigation treatments than in rain-fed conditions which contributed to the higher production yield observed in the irrigated olive orchard (Table 2). Similar results were observed by Lavee, Nashef, Wodner, and Harshemesh (1990), Pastor et al. (1999), Patumi et al. (1999), Patumi et al. (2002), Moriana, Orgaz, Fereres, and Pastor (2003) among other researchers. The weight of the fruit in the 125 FAO irrigation treatment was slightly lower than in FAO and RDI, probably due, as previously mentioned, to the fact that, in the crop season 2003/2004, the production of 125 FAO was greater (about 80 kg per tree) than in the FAO and RDI treatments (65 and 60 kg per tree, respectively) and, as the olive tree production increases, the size of the fruit diminishes (Lavee & Wodner, 2004). In the 2004/2005 season, this behaviour, in terms of the weight of the fruit was not observed, probably due to the relatively high fruit damage produced by an olive fly attack which was not detected in the previous crop season (Table 2). The fruit damage observed in the 2004/2005 crop (and that affected mainly the irrigated olive trees), as well as varying weather conditions, meant that a number of statistically significant differences observed in the previous crop season could not be fully confirmed at the following harvesting. As is well known, this is one of the most relevant limitations in experimental agronomical studies in which it is generally necessary to monitor the evolution of one crop for several years running to reach a general conclusion on the effect of the factors studied. 572 A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 Table 2 Olive fruit characteristics and composition, as affected by the different irrigation treatments studied and the ripeness index of the fruits Ripeness index Fresh wt. (g/olive) Pulp/pit ratio Fruit damage (%) Water content (%) Oil content Soxhlet (%) 2003/2004 Rain-fed Deficit irrigation FAO 125 FAO 1.5 ± 0.5a,w 1.8 ± 0.6ab,w 2.5 ± 0.4b,w 2.0 ± 0.3ab,v 2.14 ± 0.23a,w 2.65 ± 0.96a,w 2.93 ± 0.45a,w 2.56 ± 0.45a,w 3.49 4.50 4.30 3.82 nd nd nd nd 50.4 ± 1.6a,w 53.9 ± 2.3b,x 52.2 ± 1.9ab,y 52.0 ± 2.3ab,x 39.5 ± 6.8a,w 39.8 ± 5.8a,w 42.2 ± 4.5a,w 39.1 ± 3.9a,w Rain-fed Deficit irrigation FAO 125 FAO 2.7 ± 0.3a,x 2.8 ± 0.4a,x 3.1 ± 0.3a,x 2.8 ± 0.2a,w 2.13 ± 0.19a,w 2.67 ± 1.02a,w 2.80 ± 0.49a,w 2.42 ± 0.51a,w 3.60 4.05 4.20 3.62 nd nd nd nd 47.9 ± 2.9a,w 49.8 ± 3.4a,wx 49.5 ± 1.8a,xy 50.2 ± 4.5a,wx 42.9 ± 6.0a,wx 42.3 ± 2.2a,w 43.5 ± 4.1a,w 42.9 ± 3.6a,w Rain-fed Deficit irrigation FAO 125 FAO 3.2 ± 0.3a,xy 3.5 ± 0.4a,xy 3.6 ± 0.4a,xy 3.4 ± 0.3a,x 2.14 ± 0.22a,w 2.55 ± 0.88a,w 2.81 ± 0.54a,w 2.42 ± 0.41a,w 3.69 4.19 4.38 3.76 nd nd nd nd 47.3 ± 3.0a,w 51.1 ± 1.9a,wx 49.5 ± 2.0a,xy 48.2 ± 3.5a,wx 43.8 ± 4.9a,wx 44.3 ± 2.6a,w 46.7 ± 1.3a,w 43.5 ± 5.1a,w Rain-fed Deficit irrigation FAO 125 FAO 3.7 ± 0.2a,y 3.8 ± 0.3a,y 4.0 ± 0.4a,y 3.9 ± 0.1a,y 2.11 ± 0.25a,w 2.27 ± 0.64a,w 2.72 ± 0.38a,w 2.39 ± 0.35a,w 3.75 3.80 4.25 3.74 nd nd nd nd 46.5 ± 4.0a,w 48.2 ± 3.9a,x 47.8 ± 2.5a,wx 45.8 ± 2.8a,w 46.2 ± 5.1a,wx 46.0 ± 4.6a,w 47.4 ± 3.4a,w 43.1 ± 4.8a,w Rain-fed Deficit irrigation FAO 125 FAO 5.7 ± 0.4b,z 5.4 ± 0.5ab,z 5.5 ± 0.3ab,z 4.9 ± 0.1a,z 2.52 ± 0.19a,x 2.84 ± 0.87a,w 2.95 ± 0.43a,w 2.62 ± 0.44a,w 4.12 4.60 4.57 4.12 nd nd nd nd 47.3 ± 3.0a,w 49.4 ± 3.5a,wx 46.1 ± 1.6a,w 48.2 ± 1.2a,wx 49.2 ± 4.5a,x 42.8 ± 8.5a,w 46.1 ± 2.6a,w 43.2 ± 4.0a,w 2004/2005 Rain-fed Deficit irrigation FAO 125 FAO 2.8 ± 0.2b,w 2.3 ± 0.1a,w 2.5 ± 0.2ab,w 2.4 ± 0.1a,w 2.44 ± 0.10a,w 2.72 ± 0.21b,w 2.56 ± 0.00a,w 2.47 ± 0.11a,w – – – – 5.5 ± 0.0a,w 25.8 ± 0.1b,w 17.8 ± 0.0b,w 30.8 ± 0.1b,wx 50.3 ± 1.1b,x 50.8 ± 0.2b,x 46.7 ± 0.6a,x 49.8 ± 0.9b,x 42.9 ± 0.5a,w 40.1 ± 1.8a,w 40.2 ± 0.1a,w 40.1 ± 2.7a,w Rain-fed Deficit irrigation FAO 125 FAO 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.5 ± 0.1a,x 2.57 ± 0.28b,w 2.55 ± 0.17b,w 2.37 ± 0.08a,w 2.66 ± 0.37b,w – – – – 4.0 ± 0.0a,w 35.0 ± 0.1c,x 17.0 ± 0.0b,w 36.0 ± 0.0c,x 48.7 ± 1.2a,x 50.1 ± 1.4a,x 49.6 ± 0.6a,y 47.7 ± 0.7a,x 46.7 ± 0.4a,w 42.9 ± 4.2a,w 48.7 ± 0.0a,x 42.2 ± 2.6a,w Rain-fed Deficit irrigation FAO 125 FAO 4.1 ± 0.1a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 2.40 ± 0.05a,w 2.39 ± 0.14a,w 2.39 ± 0.07a,w 2.15 ± 0.14a,w – – – – 4.5 ± 0.0a,w 23.5 ± 0.0b,w 22.5 ± 0.0b,w 25.5 ± 0.0b,w 43.2 ± 1.3a,w 43.5 ± 0.7a,w 44.0 ± 0.3a,w 42.1 ± 1.0a,w 43.8 ± 3.4a,w 43.6 ± 3.1a,w 47.3 ± 1.5a,x 40.6 ± 1.4a,w Different letters within a column (a–c) indicate significant differences (p < 0.05) with respect to irrigation treatment in each sampling. Different letters within a column (w–y) indicate significant differences (p < 0.05) with respect to ripeness index for each treatment. nd, not detected. Moreover, in the discussion of the experimental results observed in the two crop seasons studied, it is important to note that a different RDI strategy was employed each year (see details in Section 2), with the purpose of investigating which RDI treatment was more effective in attaining similar olive production and olive oil quality to that obtained by the FAO method but considerably reducing the total amount of water applied to the olive grove. Although the mean value of the water content of the olive fruit (Table 2) was generally slightly lower under RF conditions than under irrigation, especially in the crop season 2003/2004, practically no statistically significant differences were observed. Apparently, the evolution of the fruit water content was not affected by the ripeness index. Similar results were also reported by Motilva et al. (2000). The industrial oil content, determined by the Abencor method, and the Soxhlet fat yield of the olive fruit generally increased during ripening (Table 2). However, at the higher end of the ripeness index (greater than 3.5–4.0) these increases were modest (similar to rain-fed conditions) or even slightly less in terms of the values observed (as in the irrigation treatments), similar to results previously reported by Salvador, Aranda, and Fregapane (2001) for the same olive variety. The irrigation treatment apparently did not affect the oil accumulation in the Cornicabra fruit since no statistically significant differences in the oil yield were observed in the present study. In contrast, Lavee and Wodner (1991), Motilva et al. (2000) did observe a slight delay in oil accumulation in fruits from non-irrigated olive trees as a consequence of hydric stress at the end of the summer season. 3.3. Virgin olive oil quality and composition 3.3.1. Quality indices The observed free acidity ranging from 0.09% to 0.20%, and peroxide value, from 1.7 to 3.4 meqO2 kg 1, of the dif- A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 ferent types of virgin olive oils studied in this assay in the crop season 2003/2004 (Table 3) were considerably lower than the upper limit of 0.8% as oleic acid and 20 meqO2 kg 1, respectively, established by EU legislation for extra virgin olive oil. Moreover, these two quality indices were not influenced by irrigation, since no statistically significant differences in oil from rain-fed and irrigation treatments in the crop season 2003/2004 were obtained. This was also observed by Tovar et al. (2001) in virgin olive oils from Arbequina cultivar, by Dettori and Russo (1993) in Leccino, Nociara and Ogliarola Salentina cultivars and Patumi et al. (1999) in Nocellara del Belice and Ascolana Tenera cultivars. On the contrary, in crop 2004/2005, a statistical difference for free acidity and peroxide value was indeed obtained between RF and the irrigation treatments, due to the higher degree of fruit damage as a consequence of the olive fly attack (Table 3). Nevertheless, the values of free acidity and the peroxide value of the olive oil obtained from partially damaged fruit were not high from an olive oil quality point of view: a maximum acidity of 0.4% and a 5.4 peroxide value were observed. In both crop seasons, a slight increase in free acidity was generally observed during the ripening of the olive fruit. Spectrophotometric absorption characteristics in the UV region at 270 and 232 nm decreased at later ripeness 573 index in all treatments. Statistically significant differences were obtained in K232 and K270 between oils from rainfed conditions and the different irrigation treatments studied. These indices were always higher in RF and decreased by increasing the amount of the water employed in the irrigation. This effect is probably caused by the interference of the phenolic compounds content, which absorbs in the UV region in these analytical determinations. In fact, the observed effect of irrigation on UV characteristics could not be confirmed in the 2004/2005 crop in which the phenolic compounds were less affected by the amount of water applied. All the virgin olive oils obtained using the different irrigation treatments of the trees studied were classified as Ôextra virginÕ oil by mean of the organoleptic evaluation carried out by an IOOC (International Olive Oil Council) recognized olive oil taster panel, as shown in Table 4. Sensory attributes affected by irrigation were ‘‘bitterness’’, ‘‘pungency’’ and ‘‘fruitiness’’, according to what has previously been described for other olive cultivars (Salas, Pastor, Castro, & Vega, 1997; Tovar et al., 2001; Tovar, Romero, Alegre, Girona, & Motilva, 2002). As is known, the intensity of sensory pungency, and especially bitterness, are related to the phenol content in the olive oil, which, as expected, was higher in oils obtained under rain-fed conditions. In all cases, a slight decrease in the Table 3 Virgin olive oil quality indices, as affected by the different irrigation treatments studied and the ripeness index of the fruits Ripeness index Free acidity (%) Peroxide value (meqO2/kg) K232 K270 2003/2004 Rain-fed Deficit irrigation FAO 125 FAO 2.7 ± 0.3a,x 2.8 ± 0.4a,x 3.1 ± 0.3a,x 2.8 ± 0.2a,w 0.10 ± 0.01a,w 0.10 ± 0.03a,w 0.10 ± 0.03a,w 0.10 ± 0.02a,w 2.9 ± 0.3ab,w 2.4 ± 0.6a,w 2.5 ± 0.2a,wx 3.4 ± 0.8b,w 1.90 ± 0.05b,xy 1.74 ± 0.08a,xy 1.67 ± 0.06a,y 1.64 ± 0.11a,xy 0.18 ± 0.00b,y 0.16 ± 0.02ab,x 0.14 ± 0.01a,x 0.14 ± 0.02a,xy Rain-fed Deficit irrigation FAO 125 FAO 3.7 ± 0.2a,y 3.8 ± 0.3a,y 4.0 ± 0.4a,y 3.9 ± 0.1a,y 0.10 ± 0.01a,w 0.09 ± 0.01a,w 0.10 ± 0.02a,w 0.12 ± 0.01a,w 2.4 ± 0.2ab,w 2.4 ± 0.5ab,w 2.0 ± 0.3a,w 2.8 ± 0.4b,w 1.84 ± 0.02b,x 1.65 ± 0.10a,wx 1.54 ± 0.05a,wx 1.54 ± 0.09a,wx 0.16 ± 0.01b,x 0.13 ± 0.02a,w 0.11 ± 0.01a,w 0.12 ± 0.01a,wx Rain-fed Deficit irrigation FAO 125 FAO 5.7 ± 0.4b,z 5.4 ± 0.5ab,z 5.5 ± 0.3ab,z 4.9 ± 0.1a,z 0.14 ± 0.02ab,x 0.11 ± 0.02a,w 0.18 ± 0.07ab,x 0.20 ± 0.06b,x 2.6 ± 1.2a,w 1.7 ± 0.5a,w 2.3 ± 0.4a,wx 2.6 ± 0.5a,w 1.68 ± 0.04c,w 1.56 ± 0.04b,w 1.47 ± 0.03a,w 1.45 ± 0.08a,w 0.15 ± 0.01b,w 0.12 ± 0.01a,w 0.11 ± 0.00a,w 0.11 ± 0.01a,w 2004/2005 Rain-fed Deficit irrigation FAO 125 FAO 2.8 ± 0.2b,w 2.3 ± 0.1a,w 2.5 ± 0.2ab,w 2.4 ± 0.1a,w 0.14 ± 0.01a,w 0.23 ± 0.02b,w 0.25 ± 0.01b,w 0.25 ± 0.02b,w 2.7 ± 0.3a,w 3.4 ± 0.5a,w 3.1 ± 0.1a,w 5.4 ± 0.1b,w 1.67 ± 0.14a,w 1.73 ± 0.03a,x 1.74 ± 0.00a,y 1.73 ± 0.02a,y 0.15 ± 0.01a,w 0.15 ± 0.00ab,w 0.16 ± 0.00ab,x 0.17 ± 0.00b,y Rain-fed Deficit irrigation FAO 125 FAO 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.5 ± 0.1a,x 0.15 ± 0.01a,w 0.31 ± 0.09b,w 0.28 ± 0.05b,w 0.32 ± 0.07b,w 2.7 ± 0.2a,w 3.6 ± 0.6ab,w 3.7 ± 0.1b,x 3.4 ± 0.0ab,w 1.59 ± 0.11a,w 1.63 ± 0.01a,w 1.63 ± 0.01a,x 1.53 ± 0.01a,x 0.13 ± 0.01a,w 0.14 ± 0.02a,w 0.14 ± 0.00a,wx 0.13 ± 0.00a,x Rain-fed Deficit irrigation FAO 125 FAO 4.1 ± 0.1a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 0.17 ± 0.03a,w 0.32 ± 0.03b,w 0.31 ± 0.00b,w 0.38 ± 0.01b,w 2.2 ± 0.0a,w 4.1 ± 0.8ab,w 3.9 ± 0.0ab,y 4.4 ± 1.1b,w 1.62 ± 0.17a,w 1.64 ± 0.03a,w 1.58 ± 0.02a,w 1.43 ± 0.00a,w 0.13 ± 0.02a,w 0.13 ± 0.00a,w 0.13 ± 0.01a,w 0.11 ± 0.01a,w Different letters within a column (a–c) indicate significant differences (p < 0.05) with respect to irrigation treatment in each sampling. Different letters within a column (w–y) indicate significant differences (p < 0.05) with respect to ripeness index for each treatment. 574 A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 Table 4 Virgin olive oil organoleptic evaluation, as affected by the different irrigation treatments studied and the ripeness index of the fruits Ripeness index Grade Sensory attributes K225 Fruity Bitterness Pungency virgin virgin virgin virgin 6.1 ± 0.2b,x 6.2 ± 0.5b,w 5.5 ± 0.1b,w 4.9 ± 0.3a,w 8.2 ± 0.4b,w 8.0 ± 0.3b,wx 7.7 ± 0.5ab,w 7.2 ± 0.3a,wx 7.8 ± 0.3a,w 8.0 ± 0.3a,wx 7.7 ± 0.3a,w 7.6 ± 0.3a,w 0.78 ± 0.01c,x 0.67 ± 0.07b,x 0.66 ± 0.04b,yz 0.56 ± 0.07a,xy Extra Extra Extra Extra virgin virgin virgin virgin 5.4 ± 0.2ab,w 6.2 ± 0.3b,w 5.5 ± 0.2ab,w 5.3 ± 0.2a,w 8.5 ± 0.2c,w 8.3 ± 0.2c,x 7.7 ± 0.3b,w 6.9 ± 0.4a,w 8.4 ± 0.2ab,w 8.5 ± 0.1b,w 8.0 ± 0.2ab,w 8.0 ± 0.2a,w 0.77 ± 0.01c,x 0.64 ± 0.07b,wx 0.56 ± 0.04ab,x 0.49 ± 0.08a,wx 5.7 ± 0.4b,z 5.4 ± 0.5ab,z 5.5 ± 0.3ab,z 4.9 ± 0.1a,z Extra Extra Extra Extra virgin virgin virgin virgin 5.4 ± 0.3ab,wx 6.2 ± 0.1b,w 5.0 ± 0.3a,w 6.0 ± 0.1b,x 8.3 ± 0.2a,w 7.5 ± 0.5a,w 7.7 ± 0.3a,w 8.0 ± 0.3a,x 8.1 ± 0.2ab,w 7.7 ± 0.1a,x 7.9 ± 0.2a,w 8.0 ± 0.2b,w 0.66 ± 0.05c,w 0.57 ± 0.03b,w 0.46 ± 0.03a,w 0.41 ± 0.09a,w 2004/2005 Rain-fed Deficit irrigation FAO 125 FAO 2.8 ± 0.2b,w 2.3 ± 0.1a,w 2.5 ± 0.2ab,w 2.4 ± 0.1a,w Extra Extra Extra Extra virgin virgin virgin virgin 6.4 ± 0.3a,w 6.0 ± 0.2a,x 5.6 ± 0.4a,w 5.2 ± 0.6a,w 7.6 ± 0.2a,w 7.4 ± 0.5a,w 6.7 ± 0.3a,w 7.3 ± 0.2a,w 8.0 ± 0.3a,w 7.9 ± 0.6a,wx 7.5 ± 0.2a,w 7.7 ± 0.3a,w 0.66 ± 0.09a,w 0.70 ± 0.00a,x 0.67 ± 0.00a,x 0.60 ± 0.00a,y Rain-fed Deficit irrigation FAO 125 FAO 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.5 ± 0.1a,x Extra Extra Extra Extra virgin virgin virgin virgin 5.5 ± 0.2ab,w 4.9 ± 0.4a,w 5.5 ± 0.2ab,w 5.5 ± 0.5b,w 7.0 ± 0.5a,w 7.0 ± 0.3a,w 6.9 ± 0.4a,w 6.6 ± 0.3a,w 7.4 ± 0.5a,w 7.1 ± 0.3a,w 7.6 ± 0.2a,w 7.4 ± 0.2a,w 0.60 ± 0.08a,w 0.60 ± 0.03a,x 0.59 ± 0.03a,x 0.50 ± 0.02a,x Rain-fed Deficit irrigation FAO 125 FAO 4.1 ± 0.1a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y Extra Extra Extra Extra virgin virgin virgin virgin 6.0 ± 0.4a,w 5.4 ± 0.3a,wx 5.4 ± 0.3a,w 5.9 ± 0.2a,w 7.4 ± 0.3ab,w 7.6 ± 0.2b,w 7.4 ± 0.3b,w 6.6 ± 0.4a,w 7.6 ± 0.4a,w 8.2 ± 0.2a,x 7.5 ± 0.3a,w 7.4 ± 0.3a,w 0.59 ± 0.12b,w 0.57 ± 0.01b,w 0.54 ± 0.01ab,w 0.36 ± 0.04a,w 2003/2004 Rain-fed Deficit irrigation FAO 125 FAO 2.7 ± 0.3a,x 2.8 ± 0.4a,x 3.1 ± 0.3a,x 2.8 ± 0.2a,w Extra Extra Extra Extra Rain-fed Deficit irrigation FAO 125 FAO 3.7 ± 0.2a,y 3.8 ± 0.3a,y 4.0 ± 0.4a,y 3.9 ± 0.1a,y Rain-fed Deficit irrigation FAO 125 FAO Different letters within a column (a–c) indicate significant differences (p < 0.05) with respect to irrigation treatment in each sampling. Different letters within a column (w–y) indicate significant differences (p < 0.05) with respect to ripeness index for each treatment. intensity of these positive attributes was observed, more marked in the case of bitterness, by increasing the amount of water delivered through irrigation. This observation is very relevant from the olive quality and marketing point of view since, although bitterness is a positive sensory attribute in virgin olive oil, a high level of bitterness could cause consumers to reject the oil. A high level of bitterness is a unique characteristic of the Cornicabra variety virgin olive oilsÕ sensory profile, and therefore the use of irrigation could produce a desirable descent in the intensity of this attribute and hence increase consumer preference. However, in the 2004/2005 crop season no statistically significant differences were obtained in the positive sensory attributes, including bitterness, between the olive oils obtained under rain-fed and irrigation conditions. Olive oil bitterness can also be measured by the instrumental K225 parameter called bitterness index (GutiérrezRosales et al., 1992). In the 2003/2004 crop, a dramatic decrease in the bitterness index was observed as the water dose applied to olive trees increased (Table 4), varying from 0.77 to 0.49, respectively, for RF and 125 FAO for the sampling close to a ripeness index of 4.0. However, in the 2004/2005 crop, no statistically significant differences were obtained. 3.3.2. Fatty acid composition The effect of irrigation and ripening on the main fatty acid composition of the different types of virgin olive oils is shown in Table 5. In both crop seasons studied, and in all irrigation treatments studied, the palmitic acid content slightly decreased as fruit ripened, i.e., from 10.4% down to 9.1% and from 11.4% to 9.7%, respectively, for RF and FAO irrigation treatments, whereas oleic and linoleic acids showed an opposite trend, i.e., the oleic acid content varied from 78.4% to 79.5% and the linoleic acid from 3.7% to 4.6% under the FAO conditions. The increase in oleic acid content is due to the triacylglycerols active biosynthesis which takes place throughout fruit ripening, involving a fall in the relative percentage of the oilÕs palmitic acid content. On the other hand, the increase in linoleic acid content is due to the transformation of oleic acid into linoleic acid by the oleate desaturase activity which is active during triacylglycerol biosynthesis (Sanchez & Harwood, 2002). The content of the other fatty acids remained practically unchanged during fruit ripening. In the 2003/2004 crop, rain-fed olive oils always showed a statistically significant higher content of oleic acid, whereas olive oils from irrigated trees had higher contents A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 575 Table 5 Virgin olive oil main fatty acid composition, as affected by the different irrigation treatments studied and the ripeness index of the fruits Ripeness index C16:0 (%) C18:1 (%) C18:2 (%) 2003/2004 Rain-fed Deficit irrigation FAO 125 FAO 2.7 ± 0.3a,x 2.8 ± 0.4a,x 3.1 ± 0.3a,x 2.8 ± 0.2a,w 10.4 ± 0.4a,x 11.1 ± 1.0ab,xy 11.4 ± 0.3ab,y 11.8 ± 0.3b,y 80.2 ± 0.4b,x 78.2 ± 1.9a,w 78.4 ± 0.2a,wx 77.9 ± 0.3a,wx 3.5 ± 0.3a,w 4.2 ± 0.5b,w 3.9 ± 0.1ab,wx 3.8 ± 0.1ab,wx Rain-fed Deficit irrigation FAO 125 FAO 3.7 ± 0.2a,y 3.8 ± 0.3a,y 4.0 ± 0.4a,y 3.9 ± 0.1a,y 9.7 ± 0.6a,wx 10.0 ± 0.8ab,wx 10.6 ± 0.2bc,x 11.0 ± 0.4c,x 80.8 ± 0.5c,y 79.6 ± 1.2b,w 78.7 ± 0.3ab,x 78.2 ± 0.5a,x 3.7 ± 0.2a,w 4.4 ± 0.3b,w 4.3 ± 0.4b,yz 4.2 ± 0.5b,y Rain-fed Deficit irrigation FAO 125 FAO 5.7 ± 0.4b,z 5.4 ± 0.5ab,z 5.5 ± 0.3ab,z 4.9 ± 0.1a,z 9.1 ± 0.8a,w 9.4 ± 0.8ab,w 9.7 ± 0.4ab,w 10.2 ± 0.2b,w 81.1 ± 0.4c,y 79.7 ± 1.2b,w 79.5 ± 0.6b,y 78.4 ± 0.3a,x 4.1 ± 0.5a,w 4.7 ± 0.3b,w 4.6 ± 0.3ab,z 4.8 ± 0.2b,z 2004/2005 Rain-fed Deficit irrigation FAO 125 FAO 2.8 ± 0.2b,w 2.3 ± 0.1a,w 2.5 ± 0.2ab,w 2.4 ± 0.1a,w 11.0 ± 0.2a,x 11.7 ± 0.0b,x 11.5 ± 0.0b,y 11.6 ± 0.1b,y 78.2 ± 0.2a,w 78.8 ± 0.1a,w 78.3 ± 0.2a,w 78.7 ± 0.3a,w 4.3 ± 0.1c,w 3.3 ± 0.1a,w 3.7 ± 0.1b,w 3.5 ± 0.1ab,w Rain-fed Deficit irrigation FAO 125 FAO 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.5 ± 0.1a,x 10.3 ± 0.4a,wx 10.9 ± 0.0b,w 10.7 ± 0.0ab,x 10.8 ± 0.1ab,x 78.9 ± 0.5a,w 79.1 ± 0.1a,w 78.8 ± 0.2a,w 78.9 ± 0.1a,w 4.4 ± 0.0c,wx 3.7 ± 0.0a,x 4.0 ± 0.1b,w 3.9 ± 0.1ab,x Rain-fed Deficit irrigation FAO 125 FAO 4.1 ± 0.1a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 9.9 ± 0.2a,w 10.7 ± 0.2b,w 10.3 ± 0.0ab,w 10.5 ± 0.0b,w 78.8 ± 0.2a,w 79.0 ± 0.2a,w 78.7 ± 0.2a,w 78.7 ± 0.1a,w 4.9 ± 0.2b,x 4.2 ± 0.1a,y 4.6 ± 0.1b,x 4.6 ± 0.0b,y Different letters within a column (a–c) indicate significant differences (p < 0.05) with respect to irrigation treatment in each sampling. Different letters within a column (w–y) indicate significant differences (p < 0.05) with respect to ripeness index for each treatment. palmitic and linoleic acids. As a consequence, the unsaturated/saturated and MUFA/PUFA ratios were significantly higher in oils obtained in rain-fed conditions, in line with the results obtained by Salas et al. (1997). However, these changes are very slight and do not have any nutritional relevance. 3.3.3. Natural antioxidants content The values of the a-tocopherol and total phenol content and the oxidative stability of the oils from the different treatments studied are shown in Table 6. The a-tocopherol content decreased slightly during ripening, whereas insignificant differences in its concentration were observed between the irrigation treatments studied. Fig. 1 illustrates the evolution of the total phenol content of oils in the four irrigation treatments studied throughout fruit maturation in the 2003/2004 crop season. The total phenol content of the oils was significantly affected by the irrigation such that, as the water dose applied to olive trees increased, the amount of the phenolic compounds in the virgin olive oil obtained decreased significantly (Fig. 1 and Table 6). For example, in crop 2003/ 2004, in the case of rain-fed virgin olive oil samples, the total phenol content decreased from 1700 to 900 mg/kg through fruit ripening, whereas for olive oil samples under FAO treatment, the phenol content decreased from 1080 to 650 mg/kg. Panelli, Famiani, Servili, and Montedoro (1989), Salas et al. (1997), Patumi et al. (1999, 2002) observed similar behaviour for other olive cultivars, such as Picual, Nocellara del Belice, Kalamata and Ascolana Tenera. In the 2004/2005 crop, although the total phenol content in the olive oil samples was lower, a trend similar to that of the previous crop season with the water applied was observed (Table 6). Moreover, the regression lines of RDI and FAO treatments were closer (data not shown), showing that the RDI strategy employed in the second crop season, produced an olive oil whose composition, specifically regarding the phenolic compounds, was more similar to that of FAO than in the previous year, and therefore these RDI conditions are apparently more efficient. As far as the ripening of the olive fruit is concerned, the mean concentration of phenolic compounds in the olive oils greatly decreased in both crop seasons studied, as previously described in the same olive variety (Salvador et al., 2001; Salvador, Aranda, Gómez-Alonso, & Fregapane, 2003). The observed differences in phenol concentration in the oils could be a consequence of the different water stress level of olives from rain-fed to irrigation conditions that involve changes in the activity of enzymes responsible for phenolic compound synthesis, such as L-phenylalanine ammonia-lyase whose activity is greater under higher water 576 A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 Table 6 Virgin olive oil antioxidants content and oxidative stability, as affected by the different irrigation treatments studied and the ripeness index of the fruits Ripeness index a-Tocopherol (mg/kg) Total phenols (mg/kg) Oxidative stability (h) 2003/2004 Rain-fed Deficit irrigation FAO 125 FAO 1.5 ± 0.5a,w 1.8 ± 0.6ab,w 2.5 ± 0.4b,w 2.0 ± 0.3ab,v 283 ± 64a,x 284 ± 59a,w 222 ± 25a,w 273 ± 33a,x 1719 ± 130c,y 1354 ± 42b,y 1076 ± 122a,z 968 ± 254a,y – – – – Rain-fed Deficit irrigation FAO 125 FAO 2.7 ± 0.3a,x 2.8 ± 0.4a,x 3.1 ± 0.3a,x 2.8 ± 0.2a,w 235 ± 43a,wx 259 ± 35a,w 212 ± 25a,w 254 ± 26a,wx 1380 ± 62c,x 1084 ± 146b,x 998 ± 85b,yz 805 ± 125a,xy 38.3 ± 0.5d,x 34.0 ± 0.4c,w 31.1 ± 1.3b,x 27.1 ± 0.1a,w Rain-fed Deficit irrigation FAO 125 FAO 3.2 ± 0.3a,xy 3.5 ± 0.4a,xy 3.6 ± 0.4a,xy 3.4 ± 0.3a,x 226 ± 41ab,wx 252 ± 29b,w 201 ± 25a,w 237 ± 8ab,wx 1294 ± 64c,x 946 ± 40b,x 868 ± 78b,xy 699 ± 139a,wx – – – – Rain-fed Deficit irrigation FAO 125 FAO 3.7 ± 0.2a,y 3.8 ± 0.3a,y 4.0 ± 0.4a,y 3.9 ± 0.1a,y 225 ± 47a,wx 242 ± 44a,w 204 ± 21a,w 227 ± 25a,w 1364 ± 107c,x 1004 ± 160b,x 824 ± 56ab,x 651 ± 124a,wx 38.4 ± 0.5d,x 31.9 ± 1.3c,w 30.1 ± 1.3b,x 24.6 ± 0.4a,w Rain-fed Deficit irrigation FAO 125 FAO 5.7 ± 0.4b,z 5.4 ± 0.5ab,z 5.5 ± 0.3ab,z 4.9 ± 0.1a,z 193 ± 32a,w 226 ± 31a,w 202 ± 11a,w 233 ± 19a,w 905 ± 189b,w 757 ± 12ab,w 654 ± 108a,w 536 ± 124a,w 34.4 ± 0.3b,w 28.5 ± 3.2ab,w 24.3 ± 0.5a,x 22.2 ± 3.4a,w 2004/2005 Rain-fed Deficit irrigation FAO 125 FAO 2.8 ± 0.2b,w 2.3 ± 0.1a,w 2.5 ± 0.2ab,w 2.4 ± 0.1a,w 298 ± 17b,w 250 ± 7a,w 272 ± 10ab,x 271 ± 19ab,w 1019 ± 216a,w 905 ± 10a,x 877 ± 11a,x 724 ± 38a,x 29.8 ± 2.2a,w 32.5 ± 2.0a,w 30.3 ± 0.9a,x 28.7 ± 1.0a,x Rain-fed Deficit irrigation FAO 125 FAO 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.5 ± 0.1a,x 280 ± 14b,w 238 ± 11a,w 263 ± 2b,wx 238 ± 3a,w 921 ± 183b,w 691 ± 11ab,w 724 ± 57ab,w 551 ± 14a,wx 29.7 ± 2.5a,w 28.2 ± 1.6a,w 28.5 ± 1.6a,wx 25.5 ± 0.1a,x Rain-fed Deficit irrigation FAO 125 FAO 4.1 ± 0.1a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 269 ± 12b,w 226 ± 3a,w 241 ± 8ab,x 241 ± 17ab,w 818 ± 224b,w 739 ± 51b,w 679 ± 19b,w 423 ± 102a,w 27.2 ± 3.4b,w 27.4 ± 1.1b,w 23.9 ± 1.8ab,w 18.3 ± 3.6a,w Different letters within a column (a–d) indicate significant differences (p < 0.05) with respect to irrigation treatment in each sampling. Different letters within a column (w–z) indicate significant differences (p < 0.05) with respect to ripeness index for each treatment. stress conditions (Patumi et al., 1999; Tovar, Romero, & Girona, 2002). As was previously mentioned, the concentration of phenolic compounds affects the sensory bitterness attribute with the beneficial and important consequences earlier discussed in the case of the Cornicabra olive oil variety, as well as oxidative stability. In terms of the latter, the observed decrease in the oxidative stability does not affect the Cornicabra virgin olive oil shelf-life or quality since this is a very stable and phenol-rich olive oil variety, but could significantly reduce the shelf-life of other varieties, such as Arbequina, due to its naturally poor phenol content. 3.3.4. Chlorophyll and carotenoid pigments These contents of the oils was not influenced by irrigation (data not shown). However, as expected, an important decrease in pigment content during fruit ripening was observed, since at later stages of fruit ripening pigments were diminished to only a few ppm, as previously reported for the same variety (Salvador et al., 2001). 3.4. Discriminant analysis Results obtained from Anova and principal component analyses were applied to stepwise discriminant analysis showing that total phenol content, oleic acid, linoleic acid and K232 were the most useful variables for classification of the virgin olive oils from the different treatments studied. The first two discriminant functions of the statistical analysis explained 96% of the variance (84% and 12%, respectively) for both crop seasons studied. The plotting of the discriminant functions is shown in Fig. 2, which shows that virgin olive oils obtained using rain-fed conditions were clearly separated from those obtained using the different irrigation treatments studied. Virgin olive oils from the FAO treatment were midway between those of A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 Fig. 1. Evolution of total phenol content throughout fruit maturation in the four treatments studied in crop season 2003/2004. , rain-fed; N, regulated deficit irrigation, RDI; , FAO; r, 125 FAO. 577 RDI and 125 FAO treatments in 2003/2004. Moreover, it is very important to note that the RDI strategy planned in the second crop season, where water was applied only from the beginning of August, produced olive oil more similar to that obtained by FAO conditions as far as its composition and quality is concerned, but with an important reduction in the amount of water used in the olive grove. The selection of an optimal irrigation treatment for traditional olive orchards in Castilla-La Mancha, where water resources are scarce, calls for the establishment of a suitable compromise between olive production, quality of virgin olive oil and water consumption. Therefore, in terms of the results obtained in this two-year assay, the best irrigation treatment for this region is a regulated deficit irrigation (RDI), and apparently better results are obtained applying water only from the beginning of August, when the accumulation of oil begins in the fruit, since it is sufficient for the olive tree to recover from water stress and, moreover, similar results to FAO conditions are obtained. Acknowledgement This research project was supported by the Conserjerı́a de Ciencia y Tecnologı́a de la Junta de Comunidades de Castilla-La Mancha (Project PBI-03-015). References Fig. 2. Plotting of the discriminant functions of the virgin olive oils obtained from the four irrigation treatments studied in the two crop seasons. Variables: total phenol content, oleic acid, linoleic acid and K232 s, rain-fed; N, regulated deficit irrigation, RDI; , FAO; r, 125 FAO. Aparicio, R., & Luna, G. (2002). Characterisation of monovarietal virgin olive oil. European Journal Lipid Science and Technology, 104, 614–627. DÕAndria, R., Morelli, G., Martuccio, G., Fontanazza, G., & Patumi, M. (1996). Valutazione della produzione e della qualitaÕdellÕolio di Giovanni piante di olivo allevate con diversi regimi idrici. Italus Hortus, 3, 23–31. Dettori, S., & Russo, G. (1993). Influencia del cultivar y del régimen hı́drico sobre el volumen y la calidad del aceite de oliva. Olivae, 49, 36–43. Doorenbos, J., & Pruitt, W. O. (1977). Crop water requirements. FAO Irrigation and drainage paper No. 24. Food and Agriculture Organization of the United Nations, Roma. European Union Commission (1991). Regulation EEC 2568/91 on the characteristics of olive oils and their analytical methods. Official Journal of European Communities. European Union Commission (2002). Regulation EC 796/2002. Official Journal of European Communities. Gutiérrez-Rosales, F., Perdiguero, S., Gutiérrez, R., & Olı́as, J. M. (1992). Evaluation of bitter taste in virgin olive oil. Journal of American Oil Chemistry Society, 69, 394–395. IOOC (1984). Document no. 6. International Olive Oil Council, Madrid. Laübli, M. W., & Bruttel, P. A. (1986). Determination of the oxidative stability of fats and oils by the Rancimat method. Journal of American Oil Chemistry Society, 63, 792–795. Lavee, S., Nashef, M., Wodner, M., & Harshemesh, H. (1990). The effect of complementary irrigation added to old olive trees (Olea europaea L., cv. Souri) on fruit characteristic, yield and oil production. Advances in Horticultural Science, 4, 135–138. Lavee, S., & Wodner, M. (1991). Factors affecting the nature of oil accumulation in fruit of olive (Olea europaea L.) cultivars. Journal of Horticultural Science, 66, 583–591. 578 A. Gómez-Rico et al. / Food Chemistry 100 (2007) 568–578 Lavee, S., & Wodner, M. (2004). The effect of yield, harvest time and fruit size on the oil content in fruits of irrigated olive trees (Olea europaea), cvs. Barnea and Manzanillo. Scientia Horticulturae, 99(3-4), 267–277. Martı́nez, J. M., Muñoz, E., Alba, J., & Lanzón, A. (1975). Informe sobre utilización del analizador de rendimiento Abencor. Grasas y Aceites, 26, 379–385. Mateos, R., Espartero, J. L., Trujillo, M., Rı́os, J. J., León-Camacho, M., Alcudia, F., & Cert, A. (2001). Determination of phenols, flavones and lignans in virgin olive oil by solid-phase extraction and high-performance liquid chromatography with diode array ultraviolet detection. Journal of Agriculture and Food Chemistry, 49, 2185–2192. Mı́nguez-Mosquera, M. I., Rejano, L., Gandul, B., Sánchez, A. H., & Garrido, J. (1991). Color-pigment correlation in virgin olive oil. Journal of American Oil Chemistry Society, 68(5), 332–336. Moriana, A., Orgaz, F., Fereres, E., & Pastor, M. (2003). Yield responses of mature olive orchard to water deficits. Journal of American Society Horticultural Science, 128, 425–431. Motilva, M. J., Romero, M. P., Alegre, S., & Girona, J. (1999). Effect of regulated déficit irrigation in olive oil production and quality. Acta Horticulturae, 474, 377–380. Motilva, M. J., Tovar, M. J., Romero, M. P., Alegre, A., & Girona, J. (2000). Influence of regulated deficit irrigation strategies applied to olive trees (Arbequina cultivar) on oil yield and oil composition during the fruit ripening. Journal of Science and Food Agriculture, 80, 2037–2043. Myers, B. J. (1998). Water stress integral a link between short-term stress and long term growth. Tree Physiology, 4, 315–323. Panelli, G., Famiani, F., Servili, M., & Montedoro, G. F. (1989). Agroclimatic factors and characteristics of the compostion of virgin olive oils. Acta Horticulturae, 286, 477–480. Pastor, M. J., Castro, M. J., Mariscal, V., Vega, F., Orgaz, F., Fereres, E., & Hidalgo, J. (1999). Respuesta del olivar tradicional a diferentes estrategias y dosis de agua de riego. Investigación Agraria, 14, 393–404. Patumi, M., dÕAndria, R., Fontanazza, G., Morelli, G., Giori, P., & Sorrentino, G. (1999). Yield and oil quality of intensively trained trees of three cultivars of olive under different irrigation regimes. Journal of Horticultural Science and Biotechnology, 74, 729–737. Patumi, M., dÕAndria, R., Marsilio, G., Fontanazza, G., Morelli, G., & Lanza, B. (2002). Olive and olive oil quality after intensive monocone olive growing (Olea europaea L., cv. Kalamata) in different irrigation regimes. Food Chemistry, 77, 27–34. Salas, J., Pastor, M., Castro, J., & Vega, V. (1997). Influencia del riego sobre la composición y caracterı́sticas del aceite de oliva. Grasas y Aceites, 48, 74–82. Salvador, M. D., Aranda, F., & Fregapane, G. (2001). Influence of fruit ripening on Cornicabra virgin olive oil. A study of four crop seasons. Food Chemistry, 73, 45–53. Salvador, M. D., Aranda, F., Gómez-Alonso, S., & Fregapane, G. (2003). Influence of extraction system, production year and area on Cornicabra virgin olive oil: a study of five years. Food Chemistry, 80, 359–366. Sanchez, J., & Harwood, J. L. (2002). Biosynthesis of triacylglycerols and volatiles in olives. European Journal of Lipid Science and Technology, 104, 564–573. Tovar, M. J., Romero, M. P., Alegre, S., Girona, J., & Motilva, M. J. (2002). Composition and organoleptic characteristics of oil from Arbequina olive (Olea europaea L.) trees under déficit irrigation. Journal of Science and Food Agriculture, 82, 1755–1763. Tovar, M. J., Romero, M. P. J., & Girona, M. J. (2002). Motilva. LPhenylalanine ammonia-lyase activity and concentration of phenolics in developing fruit of olive tree (Olea europaea L. cv. Arbequina) grown under different irrigation regimes. Journal of Science and Food Agriculture, 82, 892–898. Tovar, M. J., Romero, M. P. J., & Motilva, M. J. (2001). Changes in the phenolic composition of olive oil from young trees (Olea europaea L. cv. Arbequina) grown under linear irrigation strategies. Journal of Agriculture and Food Chemistry, 49, 5502–5508. UNE Spanish Standard (Asociación Española de Normalización y Certificación) (1973). UNE 55032: Fats. Determination of oil grease in total fat matter (Materias grasas. Determinación del contenido en materia grasa total del orujo de aceituna). AENOR, Madrid. 7130 J. Agric. Food Chem. 2006, 54, 7130−7136 Phenolic and Volatile Compounds of Extra Virgin Olive Oil (Olea europaea L. Cv. Cornicabra) with Regard to Fruit Ripening and Irrigation Management AURORA GOÄ MEZ-RICO,† M. DESAMPARADOS SALVADOR,† MARTA LA GRECA,† AND GIUSEPPE FREGAPANE*,‡ Departamento de Quı́mica Analı́tica y Tecnologı́a de los Alimentos and Instituto Regional de Investigación Cientı́fica Aplicada (IRICA), Universidad de Castilla-La Mancha, Ciudad Real, Spain This study investigated the effect of both the degree of ripening of the olive fruit and irrigation managementsrain-fed, two different regulated deficit irrigations (RDI), the method proposed by the Food and Agriculture Organization of the United Nations (known as FAO), and 125 FAO (125% FAO)son the phenolic and volatile composition of Cornicabra virgin olive oils obtained during two crop seasons. Secoiridoid phenolic derivatives greatly decreased upon increase of both irrigation and ripening, for example, the 3,4-DHPEA-EDA content decreased from 770 to 450 mg/kg through fruit ripening under rain-fed conditions and from 676 to 388 mg/kg from rain-fed conditions to FAO irrigation treatment (at a ripeness index of approximately 4). Moreover, secoiridoid derivatives of hydroxytyrosol decreased more than those of tyrosol. The levels of major volatile components decreased in the course of ripening but were higher in irrigated olive oils: for example, the E-2hexenal content ranged between 4.2 and 2.6 mg/kg (expressed as 4-methyl-2-pentanol) over fruit maturation under rain-fed conditions and between 8.0 and 3.5 mg/kg under FAO scheduling. It is important to note that where water was applied only from the beginning of August (RDI-2), when oil begins to accumulate in the fruit, the resulting virgin olive oil presented a phenol and volatile profile similar to those of the FAO and 125 FAO methods, but with a considerable reduction in the amount of water supplied to the olive orchard. KEYWORDS: Virgin olive oil; phenols; volatiles; ripening; irrigation; Olea europaea L. cv. Cornicabra INTRODUCTION Extra virgin olive oil (EVOO) is obtained from healthy olive fruits by mechanical processes only and is the most important vegetable oil ready for direct human consumption. The fine sensory characteristics of this fruit oil, which possesses unique aroma and taste, are mainly due to the presence of minor components, chiefly volatile and phenolic compounds (1, 2). Volatiles are mainly responsible for the aroma of virgin olive oil, especially for the green sensory notes of high-quality virgin olive oils, whereas compounds with a phenolic structure affect both the taste, in particular the positive bitterness organoleptic attribute, and the oxidative stability of the virgin olive oil (3, 4). Phenolics and volatiles are therefore the compounds chiefly responsible for the flavor of EVOOs and to a large extent determine the degree of consumer preference for this highly appreciated product. It is known that the amount of these minor components in virgin olive oil depends on agronomical and technological * Corresponding author (e-mail [email protected]; fax +34 926 295318). † Departamento de Quı́mica Analı́tica y Tecnologı́a de los Alimentos. ‡ Instituto Regional de Investigación Cientı́fica Aplicada. factors, for example, the olive cultivar, the degree of ripening of the olive fruit, the irrigation management, and the extraction process, in particular the milling and malaxation conditions and the type of centrifugation system employed. For example, the level of phenolic compounds and volatiles in the olive oil decreases in the course of maturation of the olive fruits (5-8). In addition, some researchers have reported that of the chemical components of virgin olive oil, phenolic compounds were the most influenced by irrigation, and their concentration is in inverse proportion to the amount of water applied to the olive trees (9-12). Nevertheless, to date there is no detailed information available on the influence of irrigation and fruit ripening on the volatile composition of virgin olive oil, especially in the case of the Cornicabra variety, which is the second most important variety in Spain (13). The aim of this work was to determine the effect of both (i) the degree of ripening of the olive fruit and (ii) five different types of irrigation management on virgin olive oil volatile and phenolic composition. EVOOs (Olea europaea L. cv. Cornicabra) obtained during the 2003/2004 and 2004/2005 crop seasons were used. The ultimate goals are to enhance knowledge with regard to the composition and quality of virgin olive oil 10.1021/jf060798r CCC: $33.50 © 2006 American Chemical Society Published on Web 08/25/2006 VOO Phenolic and Volatile Compounds and to define, if possible, (i) the optimum harvesting period and (ii) sustainable irrigation conditions in the Cornicabra olive cultivar grown in Castilla-La Mancha, a region where aquifers are overexploited. MATERIALS AND METHODS Experimental Olive Orchard. The study was conducted during two consecutive crop seasons (2003/2004 and 2004/2005) in an experimental olive (O. europaea L.) orchard of cv. Cornicabra maintained by the Consejerı́a de Agricultura (Department of Agriculture) of Castilla-La Mancha, located in Almodóvar del Campo (Ciudad Real, Spain). About 320 50-year-old trees, spaced 12 × 12 m2, were used in a randomized complete block design with four different treatments and four replications. Each experimental unit consisted of 4 × 3 trees, of which only the central ones were used for sampling. The experimental olive orchard was surrounded by two outer rows of irrigated olives. All of the agronomical treatments applied to the experimental olive orchard were identical, with the exception of irrigation practice. Irrigation Treatments. Four treatments were applied 2 years before the commencement of this assay: rain-fed conditions (RF), regulated deficit irrigation (RDI), FAO, and 125 FAO. Rain-fed conditions were used as a control to compare the results obtained with the irrigation treatments studied. In the FAO treatment the water requirements were calculated using a methodology based on the crop evapotranspiration (ETc) proposed by the United Nations Food and Agriculture Organization (14). In 125 FAO treatments, a total irrigation dosage 25% higher than the FAO treatment was applied. For regulated deficit irrigation (RDI), a maximum of 75 mm of water was established because in many Spanish irrigated olive areas there is a legal limitation of 100 mm. Two different strategies were evaluated. In 2003 (RDI-1), water was applied throughout the entire season with different rates of application (10% FAO in May and June, 4% FAO in July and August, and 18% FAO in September), whereas in 2004 (RDI2), on the basis of the results obtained during the previous crop season, water was applied only from the beginning of August, when the oil starts to form in the fruit, for the purpose of investigating which RDI treatment is more effective in achieving olive production and olive oil quality similar to that obtained by the FAO method while considerably reducing the total amount of water applied. In all irrigation treatments, olive trees were irrigated daily (4 L/h) using eight compensating drippers placed around the trees. The total water applied in 2003/2004 for the different irrigation treatments was 56 mm for RDI-1, 148 mm for FAO, and 206 mm for 125 FAO; in 2004/2005 these levels were 60 mm for RDI-2, 124 mm for FAO, and 154 mm for 125 FAO. More detailed data on the irrigation management have been previously reported (12). Olive Oil Samples. Olive fruit samples from rain-fed and irrigated trees were harvested throughout ripening at various ripeness indices (RI), from the immature stage (1.5 < RI < 2.0) to the normal harvest period for the Cornicabra variety (RI ≈ 5.5). The olive ripeness index was determined according to the method proposed by the International Olive Oil Council (IOOC) (15), based on the evaluation of the olive skin and pulp colors. RI values range from 0 (100% intense green skin) to 7 (100% purple flesh and black skin). Five and three samplings were gathered in 2003/2004 and 2004/2005, respectively; the samples were collected by hand from the beginning of November to the end of December, whereas the fifth sampling from the 2003/2004 crop was collected by a mechanical shaker at the beginning of January. Four representative subsamples from each treatment (4 subsamples × 4 treatments) were picked at each sampling and brought to the laboratory for oil extraction. Virgin olive oil samples of Cornicabra variety were then obtained using the Abencor analyzer (Abengoa S.A., Sevilla, Spain); this system reproduces at laboratory scale the industrial process through three basic elements: hammer mill, thermomixer, and centrifuge (16). The oil obtained was separated by decanting and stored in amber glass bottles at 4 °C in darkness without headspace until analysis. Methods. HPLC Analysis of Phenolic Compounds. A solution of the internal standard (250 µL of 15 mg/kg of syringic acid in methanol) was added to a sample of virgin olive oil (2.5 g), and the solvent was evaporated with a rotary evaporator at 35 °C under vacuum. The oil J. Agric. Food Chem., Vol. 54, No. 19, 2006 7131 was then dissolved in 6 mL of hexane, and a diol-bonded phase cartridge (Supelco Co., Bellefonte, PA) was used to extract the phenolic fraction. The cartridge was conditioned first with methanol (6 mL) and then with hexane (6 mL). The oil solution was then applied, and the solidphase extraction (SPE) column was washed with hexane (2 × 3 mL) and with hexane/ethyl acetate (85:15 v/v; 4 mL). Finally, the phenols were eluted with methanol (15 mL) and the solvent was removed with a rotary evaporator at 35 °C under vacuum until dry. The phenolic residue was dissolved in methanol/water (1:1 v/v; 250 µL). HPLC analysis was performed using an Agilent Technologies 1100 series system equipped with an automatic injector, a column oven, and a diode array UV detector. A Spherisorb S3 ODS2 column (250 × 4.6 i.d. mm, 5 µm particle size) (Waters Corp., Milford, MA) was used, maintained at 30 °C, with an injection volume of 20 µL and a flow rate of 1.0 mL/min. The mobile phase was a mixture of water/acetic acid (95:5 v/v) (solvent A), methanol (B), and acetonitrile (C): from 95% A-2.5% B-2.5% C to 34% A-33% B-33% C in 50 min. Phenolic compounds were quantified at 280 nm using syringic acid as internal standard and the response factors determined by Mateos et al. (17). GC Analysis of Volatile Compounds [Adapted from Vichi et al. (18)]. Solid-phase microextraction (SPME) followed by GC was used to analyze the volatile compounds in the virgin olive oil samples studied. Olive oil (1.5 g) spiked with 4-methyl-2-pentanol (as internal standard) to a concentration of 1.5 µg/g was placed in a 10 mL vial fitted with a silicone septum. The SPME sampling was performed by exposing the DVB/Carboxen/PDMS fiber (50/30 µm, 2 cm long from Supelco Inc.) for 30 min in the headspace of the sample maintained at 40 °C; it was then retracted into the needle and immediately transferred and desorbed for 1 min in the injection port of an Agilent 6890 series gas chromatoghaph equipped with a flame ionization detector (FID). Compounds were separated on a Supelcowax-10 column (30 m × 0.25 mm × 0.25 µm, Supelco Inc.) under the following conditions: injection port temperature, 260 °C; helium flow, 0.8 mL/min; oven temperature ramp, 35 °C for 10 min, 3 °C/min to 160 °C and then 15 °C/min to 200 °C (maintained for 5 min). Volatile compounds were tentatively identified by comparison with standard substances (Sigma Aldrich) added to the refined oils. The analytical determinations were carried out at least in duplicate. Statistical Analysis. Analysis of ANOVA and discriminant analysis were performed using SPSS 13 statistical software (SPSS Inc., Chicago, IL). Duncan’s test (p e 0.05) was used to discriminate among the mean values. RESULTS AND DISCUSSION The influence of fruit ripening and irrigation management on (i) the production of the olive grove, which was significantly lower under rain-fed conditions than under irrigation (≈35%), (ii) the characteristics and composition of the olive fruit, and (iii) the quality indices and major components of virgin olive oil has been analyzed and discussed elsewhere (12). Phenolic Compounds. The concentrations of the major phenolic compounds found in virgin olive oil (VOO) obtained throughout ripening from olives subjected to the different irrigation treatments are reported in Table 1. As previously reported by our research group, the main phenolic compounds in Cornicabra monovarietal VOO are the dialdehydic form of elenolic acid linked to hydroxytyrosol and tyrosol (3,4-DHPEA-EDA and p-HPEA-EDA), oleuropein aglycon (3,4-DHPEA-EA), and ligstroside aglycon (p-HPEA-EA). The main simple phenols are tyrosol (p-HPEA) and hydroxytyrosol (3,4-DHPEA) (19). The VOO hydroxytyrosol contents (ranging from 1.34 to 3.30 mg/kg, expressed as the 10th and 90th percentiles of the data distribution, respectively) and tyrosol (1.12-4.92 mg/kg) were apparently not affected by the water doses applied or by the degree of ripening of the fruit, because practically no statistically significant differences were observed (Table 1). This behavior was similar to that observed for the rest of the minor simple 7132 J. Agric. Food Chem., Vol. 54, No. 19, 2006 Gómez-Rico et al. Table 1. Levels of Major Virgin Olive Oil Phenolic Compounds (Milligrams per Kilogram) with Regard to Fruit Ripening Stage and Irrigation Managementa ripeness index 3,4-DHPEA 3,4-DHPEA-EDA 3,4-DHPEA-EA p-HPEA p-HPEA-EDA p-HPEA-EA total phenol 1.86 ± 0.59a,w 1.89 ± 1.00a,w 2.76 ± 1.22a,w 2.26 ± 0.72a,w 498 ± 47c,z 440 ± 65bc,y 451 ± 31ab,z 336 ± 81a,y 138 ± 20b,y 88 ± 18a,y 79 ± 23a,x 61 ± 20a,y 1719 ± 130c,y 1354 ± 42b,y 1076 ± 122a,z 968 ± 254a,y rain-fed RDI-1 FAO 125 FAO 1.5 ± 0.5a,w 1.8 ± 0.6ab,w 2.5 ± 0.4b,w 2.0 ± 0.3ab,v 2.80 ± 0.56b,w 1.46 ± 0.25a,w 1.55 ± 0.79a,w 1.46 ± 0.41a,w 770 ± 49c,y 637 ± 83b,x 451 ± 31a,y 433 ± 120a,x 2003/2004 301 ± 41b,x 180 ± 21a,y 150 ± 26a,w 129 ± 33a,w rain-fed RDI-1 FAO 125 FAO 2.7 ± 0.3a,x 2.8 ± 0.4a,x 3.1 ± 0.3a,x 2.8 ± 0.2a,w 2.28 ± 0.42a,w 2.75 ± 1.99a,w 1.91 ± 0.62a,wx 1.79 ± 0.22a,w 651 ± 42c,x 542 ± 145bc,wx 442 ± 13ab,xy 372 ± 85a,wx 245 ± 23c,x 163 ± 26b,x 144 ± 22ab,w 113 ± 24a,w 1.62 ± 0.66a,w 2.56 ± 2.52a,w 3.10 ± 1.10a,w 2.41 ± 1.17a,w 378 ± 29c,y 307 ± 11ab,x 335 ± 42bc,yz 264 ± 25a,x 94 ± 12b,x 61 ± 10a,x 66 ± 17a,wx 47 ± 7a,xy 1380 ± 62c,x 1084 ± 146b,x 998 ± 85b,yz 805 ± 125a,xy rain-fed RDI-1 FAO 125 FAO 3.2 ± 0.3a,xy 3.5 ± 0.4a,xy 3.6 ± 0.4a,xy 3.4 ± 0.3a,x 2.44 ± 0.74a,w 1.82 ± 0.51a,w 2.13 ± 0.29a,wx 1.97 ± 0.12a,w 642 ± 48c,x 482 ± 69b,wx 399 ± 24ab,xy 338 ± 91a,wx 240 ± 31c,x 143 ± 16b,x 129 ± 13ab,w 99 ± 27a,w 1.63 ± 0.73a,w 2.40 ± 1.69ab,w 3.79 ± 1.35b,w 2.51 ± 0.72ab,w 323 ± 15c,x 260 ± 14b,x 276 ± 46b,xy 215 ± 23a,wx 77 ± 10b,x 49 ± 9a,wx 51 ± 10a,w 36 ± 8a,wx 1294 ± 64c,x 946 ± 40b,x 868 ± 78b,xy 699 ± 139a,wx rain-fed RDI-1 FAO 125 FAO 3.7 ± 0.2a,y 3.8 ± 0.3a,y 4.0 ± 0.4a,y 3.9 ± 0.1a,y 2.14 ± 0.51a,w 2.38 ± 0.71a,w 2.22 ± 0.62a,wx 2.87 ± 0.37a,x 675 ± 51c,xy 522 ± 133b,wx 388 ± 39a,x 310 ± 86a,wx 258 ± 36c,x 161 ± 25b,x 123 ± 17ab,w 102 ± 22a,w 1.68 ± 0.85a,w 2.17 ± 1.37ab,w 4.05 ± 1.23b,w 3.54 ± 1.47ab,w 335 ± 29c,xy 259 ± 20b,x 255 ± 28b,x 192 ± 15a,w 85 ± 15c,x 53 ± 9b,wx 47 ± 8ab,w 35 ± 4a,wx 1364 ± 107c,x 1004 ± 160b,x 824 ± 56ab,x 651 ± 124a,wx rain-fed RDI-1 FAO 125 FAO 5.7 ± 0.4b,z 5.4 ± 0.5ab,z 5.5 ± 0.3ab,z 4.9 ± 0.1a,z 2.44 ± 1.19a,w 2.53 ± 1.13a,w 3.22 ± 1.47a,x 3.31 ± 1.05a,x 446 ± 126b,w 384 ± 41ab,w 302 ± 55a,w 255 ± 77a,w 168 ± 53b,w 123 ± 5ab,w 128 ± 41ab,w 90 ± 17a,w 2.25 ± 1.88a,w 2.34 ± 1.02a,w 4.89 ± 2.51a,w 3.87 ± 1.88a,w 228 ± 21c,w 200 ± 27bc,w 168 ± 38ab,w 151 ± 30a,w 52 ± 10b,w 40 ± 8ab,w 42 ± 13ab,w 28 ± 4a,w 905 ± 189b,w 757 ± 12ab,w 654 ± 108a,w 536 ± 124a,w rain-fed RDI-2 FAO 125 FAO 2.8 ± 0.2b,w 2.3 ± 0.1a,w 2.5 ± 0.2ab,w 2.4 ± 0.1a,w 0.99 ± 0.04a,w 2.09 ± 0.26ab,w 2.71 ± 0.94b,w 2.43 ± 0.17b,w 519 ± 95b,w 429 ± 11ab,x 401 ± 13ab,x 327 ± 14a,x 2004/2005 148 ± 46a,w 142 ± 3a,x 152 ± 9a,w 122 ± 4a,w 1.01 ± 0.01a,w 1.88 ± 0.12b,w 2.12 ± 0.09bc,w 2.43 ± 0.16c,w 289 ± 58a,w 266 ± 5a,x 253 ± 33a,x 215 ± 14a,x 53 ± 16a,w 54 ± 3a,x 57 ± 1a,y 44 ± 4a,w 1019 ± 216a,w 904 ± 9a,x 877 ± 10a,x 724 ± 38a,x rain-fed RDI-2 FAO 125 FAO 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.5 ± 0.1a,x 1.09 ± 0.34a,w 8.23 ± 0.99c,x 2.97 ± 1.27ab,w 3.78 ± 0.38b,w 478 ± 54c,w 319 ± 2ab,w 354 ± 42b,wx 240 ± 8a,wx 136 ± 50a,w 117 ± 2a,w 125 ± 12a,w 94 ± 15a,w 1.24 ± 0.48a,w 4.92 ± 1.02c,x 2.43 ± 0.84ab,w 4.26 ± 0.22bc,w 252 ± 54b,w 187 ± 8ab,w 192 ± 3ab,wx 166 ± 14a,wx 45 ± 21a,w 45 ± 0a,wx 39 ± 1a,w 34 ± 4a,w 921 ± 183b,w 691 ± 11ab,w 724 ± 57ab,w 551 ± 14a,wx rain-fed RDI-2 FAO 125 FAO 4.1 ± 0.1a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 1.39 ± 0.15a,w 2.89 ± 1.76a,w 3.84 ± 1.38a,w 6.97 ± 3.26a,w 396 ± 81b,w 365 ± 23b,w 307 ± 3b,w 160 ± 54a,w 145 ± 67a,w 130 ± 7a,wx 136 ± 14a,w 88 ± 15a,w 1.79 ± 0.19a,w 2.97 ± 0.11a,w 3.79 ± 0.69a,w 7.34 ± 3.99a,w 229 ± 48b,w 186 ± 17ab,w 172 ± 5ab,w 119 ± 36a,w 39 ± 25a,w 42 ± 4a,w 46 ± 3a,x 32 ± 5a,w 818 ± 224b,w 738 ± 51b,w 679 ± 18b,w 422 ± 102a,w a Different letters (a−c) within a column indicate significant differences (p < 0.05) with respect to irrigation treatment in each sampling. Different letters (w−y) within a column indicate significant differences (p < 0.05) with respect to ripeness index for each irrigation treatment. phenols identified (data not shown), which were present in very small amountssvanillin (<0.22 mg/kg), vanillic acid (<0.26 mg/kg), p-coumaric acid (<0.25 mg/kg), and ferulic acid (<0.21 mg/kg)sexcept for pinoresinol (<4.40 mg/kg), the content of which was higher. In contrast, there was a considerable difference in the concentrations of secoiridoid derivatives of hydroxytyrosol and tyrosol observed in the VOO in the course of fruit ripening and under the various irrigation treatments studied. In fact, the compounds most affected by irrigation scheduling of the olive grove and by ripening of the fruit were the complex phenol chemical forms, the levels of which decreased significantly in the VOO during ripening and as the water supplied increased. For example, in the 2003/2004 crop the 3,4-DHPEA-EDA content decreased from 770 to 450 mg/kg and the 3,4-DHPEAEA diminished from 300 to 170 mg/kg in the course of fruit ripening in the rain-fed (RF) VOO samples, whereas from RF conditions to FAO irrigation, at a RI of ≈4.0, the 3,4-DHPEAEDA content decreased from 676 to 388 mg/kg and the 3,4DHPEA-EA from 258 to 123 mg/kg (Table 1). Tovar et al. (11) observed similar behavior for the Arbequina cultivar, for which the levels of secoiridoids diminished as the irrigation dose of olive trees increased. As far as the 2004/2005 crop season is concerned, although the levels of complex phenols in the VOO samples were lower, the trend was similar to that of the previous crop season (Table 1). It is important to note that the differences in phenol contents between the oils from FAO and the second regulated deficit irrigation (RDI-2) strategy were not statistically significant; this indicates that the RDI scheduling employed in the second crop season (RDI-2), when water was applied from the beginning of August only, produced a VOO with a phenolic composition more similar to that of oil from FAO-treated olives than to that from olives grown under RDI-1 water scheduling of the previous year. In this view one of the main goals of the study was attained. Indeed, the phenolic and volatile composition related to the quality of VOO comparable to FAO management was achieved with less demand in water supply. A high level of bitterness, which as well-known is related to the phenol content (6), is a peculiar characteristic of the sensory profile of VOOs of the Cornicabra variety (8). Nevertheless, an excessive level of this positive organoleptic attribute could cause consumers to reject the product (8). Thus, to meet product quality and marketing needs, the use of irrigation could produce a desirable reduction in the intensity of bitterness and, consequently, improvement in consumer preference may be achieved. A slight but statistically significant decrease in the intensity of bitterness was indeed observed in the organoleptic evaluation of the VOO obtained in this study (12), which was carried out by an olive oil taster panel certified by the IOOC. The observed differences in VOO phenol composition could be a consequence of the different water stress levels of the olive VOO Phenolic and Volatile Compounds J. Agric. Food Chem., Vol. 54, No. 19, 2006 7133 Figure 1. Evolution of hydroxytyrosol and its complex secoiridoid forms and of tyrosol and its derivatives in the course of fruit ripening as affected by irrigation management in crop season 2003/2004: (O) rain-fed; (2) regulated deficit irrigation, RDI-1; (0) FAO; ([) 125 FAO. trees under rain-fed conditions and under the experimental irrigation conditions, which prompts changes in the activity of the enzymes responsible for biosynthesis of the phenolic compounds, such as L-phenylalanine ammonia-lyase, which is more active under higher water stress conditions (20, 21). The complex phenols were not affected in the same way by irrigation, because the secoiridoid derivatives of hydroxytyrosol decreased more than those of tyrosol, as clearly shown in Figure 1. This is very important because hydroxytyrosol and its complex derivative forms are known to possess much greater antioxidant activity and organoleptic influence than the tyrosol group (22, 23). These results were similar to those reported by Tovar et al. (11, 24) for the Arbequina variety. Volatile Compounds. Table 2 reports the concentrations of C6 volatile compounds from the lipoxygenase (LOX) pathway, expressed as milligrams of internal standard (4-methyl-2pentanol) per kilogram of oil, in VOO samples taken throughout the course of fruit ripening according to the different irrigation treatments, for the two crop seasons studied. In all of the Cornicabra VOO samples analyzed, the major volatile component was the C6 aldehyde fraction, the content of which decreased as ripening progressed. For example, the E-2-hexenal content ranged between 4.2 and 2.6 mg/kg of IS over fruit maturation for VOOs under RF conditions and between 8.0 and 3.5 mg/kg for those under FAO scheduling; the amount of hexanal was lower and varied between 1.10 and 0.45 mg/kg over fruit ripening under RF conditions and between 0.90 and 0.50 mg/kg under FAO treatment. These compounds, which are responsible for the positive green sensory notes in VOO, are produced through the LOX pathway that takes place during crushing of the olive fruit and olive paste malaxation and are incorporated into the oily phase (25). Figure 2 depicts the evolution of the main volatile compounds found in Cornicabra VOO in the course of fruit ripening as affected by RF and FAO irrigation conditions in crop season 2003/2004. As already mentioned, the decrease of C6 aldehydes was steady from the unripe to over-ripe stages, especially that of E-2-hexenal, which is the major volatile compound in various VOO cultivars. Its concentration diminished by about 40% in oils from RF conditions and 60% in oils from FAO treatment throughout fruit maturation (RI between 2.0 and 5.0) (Figure 2 and Table 2). Aparicio et al. (26) reported similar behavior, but other researches (5, 27) have shown that during olive ripening the amount of volatile compounds, especially E-2hexenal, increased to a maximum concentration, which occurred when fruit skin color turned from yellow-green to purple; beyond that point the volatile content decreased. With respect to the evolution of C6 alcohols, there was a significant decrease in E-2-hexen-1-ol content, whereas hexan1-ol and Z-3-hexen-1-ol increased slightly during fruit ripening. It is worth noting that this observed increase was statistically significant in VOO from olives under FAO and 125 FAO treatments, which received the highest irrigation doses. A similar trend was observed in the crop season 2004/2005 (Table 2). The moderate increase in the hexan-1-ol and Z-3-hexen-1-ol content has not been observed by other researchers in other VOO varieties, such as cvs. Picual and Coratina (5, 26), probably due to the different activities of alcohol dehydrogenase (ADH), which is genetically determined in each cultivar (28). With regard to C6 esters such as hexyl acetate and Z-3-hexyl acetate, these were present in very small amounts in Cornicabra VOO, indicating that there was also little activity of the alcohol acyl transferase (AAT). In both crop seasons, the volatile compounds most affected by the irrigation were E-2-hexenal, Z-3-hexen-1-ol, and hexan1-ol, in the sense that the increase in the water applied to the olive trees produced an increase in these volatiles, mainly in oils from fruits whose ripeness index was >2.5-3.0. An additional branch of the LOX pathway is active on the linolenic acid substrate, leading to the production of C5 volatile compounds, which are also present in the VOO aroma (4, 5). Reasonable amounts of 1-penten-3-one and 1-penten-3-ol were found in Cornicabra VOO, and their contents ranged between 1.40 and 0.80 mg/kg of IS for 1-penten-3-one and between 0.30 and 0.16 mg/kg for 1-penten-3-ol over the course of fruit maturation (Table 2). On the other hand, these volatiles were apparently not affected by the irrigation strategies studied. RDI-1 resulted in a VOO with a volatile composition similar to those from FAO treatment. On the other hand, the total volatile levels in VOOs produced under RDI-2 conditions were higher than in VOOs produced under FAO conditions and similar to the levels found in VOOs produced under 125 FAO conditions. It is therefore very important to note that the VOOs produced by the second RDI strategy were richer in volatile compounds than those produced under FAO conditions, but with a considerable reduction in the total amount of water used in the olive grove. Discriminant Analysis. The results of ANOVA and principal component analyses (PCA) were applied to the discriminant analysis to better describe the differences observed in the phenol 7134 J. Agric. Food Chem., Vol. 54, No. 19, 2006 Gómez-Rico et al. Table 2. Levels of Major Virgin Olive Oil Volatile Compounds (Milligrams per Kilogram of IS) with Regard to Fruit Ripening Stage and Irrigation Managementa Z-3-hexen1-ol E-2-hexen2-ol Z-3hexenyl acetate 2003/2004 4.18 ± 1.72a,y 6.46 ± 1.19ab,x 7.74 ± 2.21ab,x 9.74 ± 2.14b,y 0.11 ± 0.03a,w 0.15 ± 0.03a,w 0.17 ± 0.04a,w 0.12 ± 0.04a,w 0.11 ± 0.02a,x 0.14 ± 0.00b,y 0.12 ± 0.02ab,y 0.12 ± 0.00ab,y <0.01 <0.01 <0.01 <0.01 1.14 ± 0.17a,z 1.51 ± 0.27b,y 1.06 ± 0.16a,y 1.07 ± 0.07a,x 0.34 ± 0.02a,y 0.34 ± 0.08a,y 0.26 ± 0.02a,y 0.25 ± 0.05a,w <0.01 <0.01 <0.01 <0.01 3.76 ± 0.10a,xy 5.69 ± 1.25ab,x 5.82 ± 1.84ab,wx 7.21 ± 2.27b,xy 0.11 ± 0.05a,w 0.18 ± 0.05a,w 0.23 ± 0.06ab,w 0.39 ± 0.12b,y 0.06 ± 0.00a,w 0.08 ± 0.00b,x 0.08 ± 0.00b,x 0.09 ± 0.01b,x <0.01 <0.01 <0.01 <0.01 0.95 ± 0.07a,y 1.18 ± 0.18a,x 0.98 ± 0.07a,xy 0.98 ± 0.11a,wx 0.29 ± 0.02a,x 0.27 ± 0.02a,xy 0.24 ± 0.01a,xy 0.26 ± 0.03a,w 0.05 ± 0.01a,x 0.08 ± 0.04ab,wx 0.08 ± 0.03ab,wx 0.12 ± 0.01b,xy <0.01 <0.01 <0.01 <0.01 3.25 ± 0.35a,wx 4.71 ± 0.99ab,wx 4.02 ± 1.19ab,w 5.48 ± 0.83b,wx 0.08 ± 0.01a,w 0.15 ± 0.03b,w 0.19 ± 0.05bc,w 0.23 ± 0.03c,wx 0.05 ± 0.00a,w 0.06 ± 0.01a,wx 0.05 ± 0.01a,wx 0.06 ± 0.01a,w <0.01 <0.01 <0.01 <0.01 0.81 ± 0.07a,xy 0.97 ± 0.07a,x 0.90 ± 0.11a,xy 0.92 ± 0.10a,w 0.26 ± 0.03a,x 0.23 ± 0.04a,wx 0.22 ± 0.01a,x 0.23 ± 0.03a,w 0.52 ± 0.05a,wx 0.67 ± 0.09b,wx 0.58 ± 0.07ab,w 0.73 ± 0.08b,w 0.04 ± 0.02a,wx 0.12 ± 0.07a,x 0.11 ± 0.03a,xy 0.21 ± 0.06b,z <0.01 <0.01 <0.01 <0.01 1.90 ± 0.40a,w 3.40 ± 1.10ab,w 3.70 ± 1.35ab,w 5.14 ± 0.74b,wx 0.11 ± 0.09a,w 0.27 ± 0.19ab,w 0.36 ± 0.19ab,w 0.42 ± 0.08b,y 0.05 ± 0.01a,w 0.06 ± 0.00a,w 0.06 ± 0.01a,wx 0.06 ± 0.01a,w <0.01 <0.01 <0.01 <0.01 0.72 ± 0.08a,x 0.91 ± 0.10b,x 0.82 ± 0.07ab,x 0.87 ± 0.07ab,w 0.24 ± 0.02a,x 0.26 ± 0.03a,xy 0.22 ± 0.02a,x 0.24 ± 0.03a,w 5.7 ± 0.4b,z 5.4 ± 0.5ab,z 5.5 ± 0.3ab,z 4.9 ± 0.1a,z 0.44 ± 0.06a,w 0.50 ± 0.09a,w 0.52 ± 0.15a,w 0.71 ± 0.08b,w 0.08 ± 0.03a,x 0.12 ± 0.01ab,x 0.14 ± 0.03ab,y 0.17 ± 0.03b,yz <0.01 <0.01 <0.01 <0.01 2.46 ± 0.68a,wx 3.10 ± 0.77a,w 3.09 ± 1.79a,w 3.91 ± 0.76b,w 0.23 ± 0.04a,x 0.32 ± 0.05ab,w 0.35 ± 0.07b,w 0.35 ± 0.04b,xy 0.05 ± 0.02a,w 0.06 ± 0.00a,w 0.05 ± 0.01a,w 0.06 ± 0.01a,w <0.01 <0.01 <0.01 <0.01 0.48 ± 0.05a,w 0.57 ± 0.12a,w 0.56 ± 0.08a,w 0.82 ± 0.04b,w 0.15 ± 0.02a,w 0.16 ± 0.02a,w 0.16 ± 0.01a,w 0.20 ± 0.03b,w rain-fed RDI-2 FAO 125 FAO 2.8 ± 0.2b,w 2.3 ± 0.1a,w 2.5 ± 0.2ab,w 2.4 ± 0.1a,w 0.83 ± 0.07a,x 0.74 ± 0.06a,x 0.73 ± 0.12a,x 0.83 ± 0.06a,x 0.05 ± 0.01a,w 0.06 ± 0.00a,w 0.05 ± 0.00a,w 0.06 ± 0.01a,w <0.01 <0.01 <0.01 <0.01 2004/2005 3.50 ± 0.38a,x 5.45 ± 0.67ab,x 4.73 ± 1.47ab,x 6.38 ± 0.12b,x 0.08 ± 0.02a,w 0.14 ± 0.00b,w 0.12 ± 0.00b,w 0.14 ± 0.04ab,w 0.09 ± 0.00a,x 0.08 ± 0.01a,w 0.08 ± 0.00a,x 0.09 ± 0.00a,x <0.01 <0.01 <0.01 <0.01 1.10 ± 0.11a,x 1.17 ± 0.05a,y 1.07 ± 0.02a,y 1.21 ± 0.00a,x 0.28 ± 0.01b,w 0.24 ± 0.01a,w 0.26 ± 0.01ab,w 0.27 ± 0.00ab,wx rain-fed RDI-2 FAO 125 FAO 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.4 ± 0.0a,x 3.5 ± 0.1a,x 0.56 ± 0.11a,wx 0.73 ± 0.08a,x 0.58 ± 0.02a,wx 0.72 ± 0.08a,wx 0.03 ± 0.01a,w 0.13 ± 0.02b,wx 0.07 ± 0.00b,wx 0.19 ± 0.10b,x <0.01 <0.01 <0.01 <0.01 1.92 ± 0.88a,w 4.80 ± 0.54b,x 3.17 ± 0.30ab,x 4.43 ± 0.50b,w 0.18 ± 0.07a,wx 0.38 ± 0.13a,w 0.32 ± 0.02a,x 0.32 ± 0.04a,w 0.07 ± 0.01a,wx 0.08 ± 0.03a,w 0.06 ± 0.00a,wx 0.06 ± 0.00a,w <0.01 <0.01 <0.01 <0.01 0.89 ± 0.11a,wx 0.99 ± 0.03a,x 0.86 ± 0.01a,x 0.87 ± 0.12a,w 0.26 ± 0.02a,w 0.23 ± 0.00a,w 0.26 ± 0.00a,w 0.21 ± 0.03a,w rain-fed RDI-2 FAO 125 FAO 4.1 ± 0.1a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 4.2 ± 0.0a,y 0.36 ± 0.15a,w 0.45 ± 0.02a,w 0.43 ± 0.00a,w 0.57 ± 0.06a,w 0.10 ± 0.00a,x 0.24 ± 0.07b,x 0.20 ± 0.07b,x 0.23 ± 0.06b,x <0.01 <0.01 <0.01 <0.01 1.40 ± 0.74a,w 2.64 ± 0.00ab,w 2.09 ± 0.20ab,w 3.14 ± 0.53b,w 0.28 ± 0.02a,x 0.83 ± 0.17a,x 0.64 ± 0.28a,x 0.55 ± 0.09a,x 0.04 ± 0.01a,w 0.06 ± 0.01b,w 0.04 ± 0.00ab,w 0.07 ± 0.00c,w <0.01 <0.01 <0.01 <0.01 0.58 ± 0.20a,w 0.63 ± 0.02a,w 0.69 ± 0.01a,w 0.86 ± 0.03a,w 0.21 ± 0.03a,w 0.21 ± 0.01a,w 0.27 ± 0.01b,w 0.28 ± 0.01b,x ripeness index hexanal rain-fed RDI-1 FAO 125 FAO 1.5 ± 0.5a,w 1.8 ± 0.6ab,w 2.5 ± 0.4b,w 2.0 ± 0.3ab,v 1.10 ± 0.16ab,z 1.38 ± 0.28b,y 0.90 ± 0.14a,x 0.91 ± 0.09a,x 0.02 ± 0.00a,w 0.03 ± 0.02a,w 0.04 ± 0.00a,w 0.03 ± 0.01a,w <0.01 <0.01 <0.01 <0.01 rain-fed RDI-1 FAO 125 FAO 2.7 ± 0.3a,x 2.8 ± 0.4a,x 3.1 ± 0.3a,x 2.8 ± 0.2a,w 0.68 ± 0.03a,y 0.90 ± 0.16b,x 0.68 ± 0.06a,w 0.68 ± 0.04a,w 0.03 ± 0.01a,wx 0.06 ± 0.01ab,wx 0.05 ± 0.01ab,w 0.08 ± 0.02b,wx rain-fed RDI-1 FAO 125 FAO 3.2 ± 0.3a,xy 3.5 ± 0.4a,xy 3.6 ± 0.4a,xy 3.4 ± 0.3a,x 0.62 ± 0.06a,xy 0.75 ± 0.11a,wx 0.66 ± 0.09a,w 0.73 ± 0.03a,w rain-fed RDI-1 FAO 125 FAO 3.7 ± 0.2a,y 3.8 ± 0.3a,y 4.0 ± 0.4a,y 3.9 ± 0.1a,y rain-fed RDI-1 FAO 125 FAO hexan-1-ol hexyl acetate E-2-hexenal 1-penten3-one 1-penten3-ol a Different letters (a−c) within a column indicate significant differences (p < 0.05) with respect to irrigation treatment in each sampling. Different letters (w−y) within a column indicate significant differences (p < 0.05) with respect to ripeness index for each irrigation treatment. Figure 2. Evolution of main volatile compounds in virgin olive oils under rain-fed conditions and FAO irrigation scheduling in the course of fruit ripening in crop season 2003/2004: (O) E-2-hexenal; (9) hexanal; (]), Z-3-hexen-1-ol; (2) hexan-1-ol; ([) E-2-hexen-1-ol. and volatile compound profile according to the ripening stage and the different experimental irrigation treatments. The most useful variables for classification of the VOO samples according to the stage of ripening of the fruit in both crop seasons 2003/2004 and 2004/2005 were hexanol, E-2hexen-1-ol, 3,4-DHPEA-EDA, and p-HPEA-EDA (Figure 3). The first two discriminant functions explained 99.9% of the variance (97.9 and 2.0%, respectively), yielding a good classification (85%) of VOO oil samples obtained from unripe to over-ripe fruits. On the basis of this result and, in particular, the pattern of evolution of phenolic and volatile compositions throughout fruit VOO Phenolic and Volatile Compounds Figure 3. Discriminant functions plot of virgin olive oil composition classified according to the stage of ripening of the fruit in the crop seasons studied: (O) RI 1.1−2.3; (1) RI 2.5−3.0; (0) RI 3.5−4.3; (2) RI 5.0− 5.9. Variables: hexanol, E-2-hexen-1-ol, 3,4-DHPEA-EDA, p-HPEA-EDA. maturation in this two-year experimental field work and their relationship to VOO quality, the best stage of maturity of Cornicabra olive fruits grown in Castilla-La Mancha for VOO processing would appear to be a RI ranging from 3.0 to 4.0. In fact, at higher RI the concentrations of major volatiles from the LOX pathway in oils from over-ripe fruits (RI > 4.5-5) would be too low, and hence the attractive green odor notes would be less perceptible, which would reduce the level of consumer preference for the product. Moreover, at this RI the decrease in complex phenols would no longer be beneficial in the sense discussed earlier with respect to the Cornicabra olive oil variety, but would produce a significant reduction in the oxidative stability, bitter taste, and nutritional value, especially in irrigated VOO. With regard to irrigation, 3,4-DHPEA-EDA, E-2-hexenal, Z-3-hexen-1-ol, and oleuropein aglycon were the most useful variables for classification of the samples obtained under the different types of irrigation scheduling (Figure 4). The first two discriminant functions explained 97.3% of the variance (87.5 and 9.7%, respectively), yielding 77% of correctly classified cases. It is important to note that, as depicted in Figure 4, VOO samples obtained using the RDI-1 (no. 2 in the figure) and the RDI-2 (no. 3) strategies were plotted quite far apart, although the total amounts of water applied were similar in both cases (56 and 60 mm, respectively). Moreover, as previously observed, because of their different phenol and volatile profiles, VOO samples from RDI-1 management (2) were situated between samples from RF (1) and FAO (4) treatments, whereas samples from RDI-2 (3) were situated between the VOO samples from FAO (4) and 125 FAO (5) treatments. This clearly shows that the minor compounds in VOO are influenced not only by the total amount of water employed in the olive grove throughout the crop season but in particular by the water irrigation scheduling used. Finally, the different water stress levels in olive trees affected not only the total amount of phenolic and volatile compounds in the VOO but also their profile. For example, phenolic compounds such as 3,4-DHPEA-EDA and 3,4-DHPEA-EA decreased sharply when the water dosage applied to the olive grove was increased, whereas E-2-hexenal, hexan-1-ol, and Z-3hexen-1-ol concentrations were higher in irrigated olive oils. It J. Agric. Food Chem., Vol. 54, No. 19, 2006 7135 Figure 4. Discriminant functions plot of virgin olive oil composition classified according to the five different types of irrigation management studied in the 2003/2004 and 2004/2005 crop seasons: (O) rain-fed; (9) regulated deficit irrigation (2003/2004), RDI-1; (0) regulated deficit irrigation (2004/ 2005), RDI-2; (2) FAO; (3) 125 FAO. Variables: 3,4-DHPEA-EDA, E-2hexenal, Z-3-hexen-1-ol, 3,4-DHPEA-EA. was further observed that applying water only from the beginning of August (RDI-2), when oil begins to accumulate in the fruit, produced a VOO with similar phenol and volatile profiles to VOOs produced under the FAO and 125 FAO methods, but with a considerable reduction in the amount of water supplied to the olive orchard. This aspect is very important for olive groves in Castilla-La Mancha because it is a region with limited water resources. ACKNOWLEDGMENT We express our gratitude to Dr. Alfonso Moriana, Dr. Francisco Ribas, David Pérez, and Nicolás Olmedilla (C.M.A. El Chaparrillo, Servicio de Investigación y Tecnologı́a Agraria, Ciudad Real, Spain) for managing the irrigation scheduling in the experimental olive orchard. LITERATURE CITED (1) Angerosa, F. Influence of volatile compounds on virgin olive oil quality evaluated by analytical approaches and sensor panels. J. Lipid Sci. Technol. 2002, 104 (9-10), 639-660. (2) Aparicio, R.; Luna, G. Characterisation of monovarietal virgin olive oils. J. Lipid Sci. Technol. 2002, 104 (9-10), 614-627. (3) Morales, M. T.; Tsimidoou, M. The role of volatile compounds and polyphenols in olive oil sensory quality. In Handbook of OliVe Oil: Analysis and Properties; Harwood, J., Aparicio, R., Eds.; Aspen Publishing: Gaithersburg, MD, 2000; pp 393-458. (4) Angerosa, F.; Mostallino, R.; Basti, C.; Vito, R. Virgin olive oil odour notes: their relationship with volatile compounds from the lipoxygenase pathway and secoiridoid compounds. Food Chem. 2000, 68, 283-287. (5) Angerosa, F.; Mostallino, R.; Basti, C.; Vito, R. Influence of malaxation temperature and time on the quality of virgin olive oils. Food Chem. 2001, 72, 19-28. (6) Gutiérrez-Rosales, F.; Perdiguero, S.; Gutiérrez, R.; Olı́as, J. M. Evaluation of bitter taste in virgin olive oil. J. Am. Oil Chem. Soc. 1992, 69, 394-395. (7) Morales, M. T.; Aparicio, R.; Calvente, J. J. Influence of olive ripeness on the concentration of green aroma compounds in virgin olive oil. FlaVour Fragrance J. 1996, 11, 171-178. 7136 J. Agric. Food Chem., Vol. 54, No. 19, 2006 (8) Salvador, M. D.; Aranda, F.; Fregapane, G. Influence of fruit ripening on Cornicabra virgin olive oil. A study of four crop seasons. Food Chem. 2001, 73, 45-53. (9) Motilva, M. J.; Romero, M. P.; Alegre, S.; Girona, J. Effect of regulated deficit irrigation in olive oil production and quality. Acta Hortic. 1999, 474, 377-380. (10) Motilva, M. J.; Tovar, M. J.; Romero, M. P.; Alegre, A.; Girona, J. Influence of regulated deficit irrigation strategies applied to olive trees (Arbequina cultivar) on oil yield and oil composition during the fruit ripening. J. Sci. Food Agric. 2000, 80, 20372043. (11) Tovar, M. J.; Romero, M. P.; Motilva, M. J. Changes in the phenolic composition of olive oil from young trees (Olea europaea L. cv. Arbequina) grown under linear irrigation strategies. J. Agric. Food Chem. 2001, 49, 5502-5508. (12) Gómez-Rico, A.; Salvador, M. D.; Soriana, A.; Pérez, D.; Olmedilla, N.; Ribas, F.; Fregapane, G. Influence of different irrigation strategies in a traditional Cornicabra cv. olive orchard on virgin olive oil composition and quality. Food Chem. 2006, doi: 10.1016/j.foodchem. 2005.09.075. (13) M.A.P.A. Anuario de Estadı́stica Agroalimentariaqq; Ministerio de Agricultura, Pesca y Alimentación: Spain, 2004. (14) Doorenbos, J.; Pruitt, W. O. Crop Water Requirements; FAO Irrigation and Drainage Paper 24; Food and Agriculture Organization of the United Nations: Rome, Italy, 1977. (15) IOOC. Document 6; Internacional Olive Oil Council: Madrid, Spain, 1984. (16) Martı́nez, J. M.; Muñoz, E.; Alba, J.; Lanzón, A. Informe sobre utilización del analizador de rendimiento Abencor. Grasas Aceites 1975, 26, 379-385. (17) Mateos, R.; Espartero, J. L.; Trujillo, M.; Rı́os, J. J.; LeónCamacho, M.; Alcudia, F.; Cert, A. Determination of phenols, flavones and lignans in virgin olive oil by solid-phase extraction and high-performance liquid chromatography with diode array ultraviolet detection. J. Agric. Food Chem. 2001, 49, 21852192. (18) Vichi, S.; Castellote, A. I.; Pizzale, L.; Conte, L. S.; Buxaderas, S.; Lopez-Tamames, E. Analysis of virgin olive oil volatile compounds by headspace solid-phase microextraction coupled to gas chromatography with mass spectrometric and flame ionisation detection. J. Chromatogr. A 2003, 983, 19-33. (19) Gómez-Alonso, S.; Salvador, M. D.; Fregapane, G. Phenolic compounds profile of Cornicabra virgin olive oil. J. Agric. Food Chem. 2002, 50, 6812-6817. Gómez-Rico et al. (20) Patumi, M.; d’Andria, R.; Fontanazza, G.; Morelli, G.; Giori, P.; Sorrentino, G. Yield and oil quality of intensively trained trees of three cultivars of olive under different irrigation regimes. J. Hortic. Sci. Biotechnol. 1999, 74, 729-737. (21) Tovar, M. J.; Romero, M. P.; Girona, J.; Motilva, M. J. L-Phenylalanine ammonia-lyase activity and concentration of phenolics in developing fruit of olive tree (Olea europaea L. cv. Arbequina) grown under different irrigation regimes. J. Sci. Food Agric. 2002, 82, 892-898. (22) Baldioli, M.; Servili, M.; Peretti, G.; Montedoro, G. F. Antioxidant activity of tocopherols and phenolic compounds of virgin olive oil. J. Am. Oil Chem. Soc. 1996, 73, 1589-1593. (23) Gennaro, L.; Piciola Bocca, A.; Modesti, D.; Masella, R.; Coni, E. Effect of biophenols on olive oil stability evaluated by thermogravimetric analysis. J. Agric. Food Chem. 1998, 46, 44654469. (24) Tovar, M. J.; Romero, M. P.; Alegre, S.; Girona, J.; Motilva, M. J. Composition and organoleptic characteristics of oil from Arbequina olive (Olea europaea L) trees under deficit irrigation. J. Sci. Food Agric. 2002, 82, 1755-1763. (25) Sanchez, J.; Harwood, J. L. Byosinthesis of triacylglycerols and volatiles in olives. Eur. J. Lipid Sci. Technol. 2002, 104, 564573. (26) Aparicio, R.; Morales, M. T. Characterization of olive ripeness by green aroma compounds of virgin olive oil. J. Agric. Food Chem. 1998, 46, 1116-1122. (27) Solinas, M.; Maesilio, V.; Angerosa, F. Evoluzione di alcuni componenti dell’aroma degli oli vergini di oliva in relazione del grado de maturazione delle olive. RiV. Ital. Sostanze Grasse 1987, 64, 475. (28) Angerosa, F.; Basti, C.; Vito, R. Virgin olive oil volatile compounds from lipoxigenase pathway and characterization of some Italian cultivars. J. Agric. Food Chem. 1999, 47, 836839. Received for review March 22, 2006. Revised manuscript received July 5, 2006. Accepted July 20, 2006. This research project was supported by the Conserjerı́a de Ciencia y Tecnologı́a de la Junta de Comunidades de Castilla-La Mancha (Project PBI-03-015). JF060798R Artículo IV Virgin olive oil and olive fruit minor constituents as affected by irrigation management based on ETc, SWP and TDF in medium-density young olive orchards (Olea europaea L. cv. Cornicabra and Morisca) (Submitted to Food Research International) Aurora Gómez-Rico†, M. Desamparados Salvador† & Giuseppe Fregapane*‡ † Departamento de Química Analítica y Tecnología de los Alimentos, Universidad de Castilla-La Mancha, España ‡ Instituto Regional de Investigación Científica Aplicada (IRICA), Universidad de Castilla-La Mancha, España -------------------------------------------------------------------------------------------------------------------------------ABSTRACT This study investigated the effect of different irrigation scheduling, based on the measurements of the water status of olive tree, like the stem water potential (SWP) and the trunk diameter fluctuations (TDF), as compared to the FAO methodology, with respect to the virgin olive oil and olive drupe minor constituents composition in two different experimental olive orchards (Olea europaea L. Cornicabra cv. and Morisca cv.). No clear relationships between the water stress integral, both seasonal and obtained from DOY 229-277 (period from day 229 to day 277 of the year), and the oleuropein content in the drupes were found. Nevertheless, a good agreement between the content of this biophenol and the minimum SWP of the olive trees, measured from the beginning of August to the end of the irrigation season, were found (r2 = 0.88-0.95 and r2 = 0.90-0.95 in Cornicabra and Morisca cultivars, respectively). A lower minimum water potential corresponds therefore with a higher biophenols content in the drupe and consequently with a superior phenolic content in VOO. In both cultivars, the volatile compounds most affected by the water status of olive trees were hexanal, E-2-hexenal and hexan-1-ol, showing an inverse relationship with the water stress integral observed in the trees. Furthermore, it was observed that the irrigation schedule based on the SWP measurement, with a threshold about -1.2 MPa (SWP 1.2), provided VOO in both cultivars with a similar phenolic and volatile composition with respect to those obtained with the FAO treatment. KEYWORDS: Virgin olive oil; olive fruit; phenols; volatiles; irrigation; water status measurement. -------------------------------------------------------------------------------------------------------------------------------- 111 Artículo IV INTRODUCTION The olive tree is an arboreous crop mainly located in the Mediterranean countries, which cultivation has been recently extended outside this traditional area in countries like United States (California), South America, South Africa and Australia, since it is a crop with a great economic and social relevance. Almost all these new orchards employ different irrigation techniques in order to accelerate the rate of growth of the olive trees, diminish the characteristic alternate-bearing pattern of this crop, and increase fruit yields per hectare and consequently the oil production (Beede & Goldhammer, 1994; Moriana, Orgaz, Fereres & Pastor, 2003). The methodology generally used to determine the water requirements of the olive trees has been proposed by the Food and Agriculture Organization (FAO) and it is based on the crop evapotranspiration (ETc) (Doorenbos & Pruitt, 1974). Nevertheless, the great water demand of the FAO procedure recently have promoted the study of diverse regulated deficit irrigation (RDI) scheduling in the olive orchards in order to diminish and achieve a proper use of the water applied, without diminish the yields obtained under fully irrigation conditions, either setting inferior water doses or using different rates of the ETc along all the growing season or according to the phenological stage of the crop (Moriana et al., 2003; Moriana, Pérez-López, Gómez-Rico, Salvador, Olmedilla, Ribas & Fregapane, 2007; Tognetti, d´Andria & Morelli, 2005). However, the ETc parameter estimation is subjected to great uncertainties related to meteorology and olive crop characteristics (load level, crop age, vegetative stage of olive tree, etc.) (Fereres, Goldhamer & Parsons, 2003; Naor, 2003), so that the use of irrigation scheduling based on the direct measurements of olive tree water status seem to be a proper alternative to determine the irrigation doses to be applied in the orchard. Two interesting measurements effectively related to the water status of the plant, and already used in some fruit tree species and more recently in olive orchards, are the Stem Water Potential (SWP) and the Trunk Diameter Fluctuations (TDF) (Moriana & Fereres, 2002; Gucci, Lodolini & Rapaport, 2007). However, it is very relevant to remark that any type of irrigation management employed in the olive orchard must take into account the ultimate effect on the quality and composition of the virgin olive oil obtained, especially with respect to its content in minor compounds, like phenols and volatiles, which are chiefly responsible of the unique aroma and taste of this vegetable oil (Angerosa, 2002; Aparicio & Luna, 2002). Several research works have already been carried out in order to study the effect of irrigation techniques on the minor composition of virgin olive oils and reporting a direct relationship between the water stress of olive trees and the phenolic compounds of the final product obtained, especially with the secoiridoid derivatives of hydroxytyrosol (Tovar, Romero & Motilva, 2001; 112 Artículo IV Romero, Tovar, Girona & Motilva, 2002; Gómez-Rico, Salvador, La Greca & Fregapane, 2006; Servili, Esposto, Lodolini, Selvaggini, Taticchi, Urbani, Montedoro, Serravalle & Gucci, 2007), furthermore, some changes in the volatile profile of the oils have been related to different irrigation schedules applied to Cornicabra cv. and Leccino cv. orchards (Gómez-Rico et al., 2006; Servili et al. 2007, respectively), so the fine sensory characteristics of virgin olive oil are clearly affected by the water status of the olive trees (Berenguer, Vossen, Grattan, Connell & Polito, 2006; GómezRico, Salvador, Moriana, Pérez, Olmedilla, Ribas & Fregapane, 2007; Servili et al., 2007). Nevertheless, up to date there is only a few detailed information about the effect of different irrigation strategies based on the measurements of the water status in the olive tree itself, like the SWP and TDF, on the major and minor composition of virgin olive oils (Servili et al., 2007). The ultimate goal and the main innovation of this study is therefore (i) to test different irrigation scheduling applied using the measurements of the water status of olive tree, like the stem water potential (SWP) and the trunk diameter fluctuations (TDF), as compared to the FAO methodology, with respect to their influence on virgin olive oil and olive drupe composition and (ii) to compare the possible advantages attached to irrigation on these two unlike varieties. In this assay two experimental olive orchards of Spanish olive varieties (Olea europaea L. Cornicabra cv. and Morisca cv.) were used. MATERIALS AND METHODS Experimental olive orchards. The study was carried out during three consecutives olive crop seasons (2005/06, 2006/07 and 2007/08) in two experimental olive (Olea europaea L.) orchards of Cornicabra and Morisca cultivars. The Cornicabra cv. orchard, maintained by the Consejería de Agricultura of Castilla-La Mancha, was located in Ciudad Real (Spain), while Morisca cv. orchard, maintained by the Conserjería de Agricultura y Medio Ambiente of Junta de Extremadura, was sited in Badajoz (Spain). Both areas show a Mediterranean continental climate, although Badajoz experiences a mild Atlantic influence, due to the proximity of the Portuguese coast; the average annual rainfall is just 404 mm (Ciudad Real) and 475 mm (Badajoz), mostly distributed outside of a 4-month (June-September) summer drought period. The total rainfall in Ciudad Real was 172 and 412 mm during 2005 and 2006, respectively, and 324 and 199 mm along 2006 and 2007 in Badajoz. The rainfall from May to September (the irrigation season) was 27 and 95 mm in Ciudad Real, for each season, and 40 and 102 mm in Badajoz. Although the rainfall during the irrigation season in 2006 (Ciudad Real) and 2007 (Badajoz) was uncommonly high, both orchards experienced summer drought. Cornicabra cv. orchard (3.2 ha) was planted in 1999 with olive trees spaced 4.75m x 7.0m, whereas Morisca cv. orchard (1 ha) was planted in 1998 with trees 113 Artículo IV spaced 6.0m x 4.0m. All of the agronomical treatments applied to the experimental olive orchards were identical, with the exception of the irrigation management. A randomised complete block design was used with three blocks that each received the irrigation treatments denominated FAO, TDF and SWP. FAO - Irrigation scheduling establish according to the FAO methodology. This method applied the estimated evapotranspiration (100%ETc) based on the fully replenishing soil water extraction. ETc was calculated using the method proposed by the Food and Agriculture Organization (ETc = ETo x Kc x Kr; Doorenbos & Pruitt, 1974), and employing the crop coefficient (Kc) suggested for olive trees growing under the conditions reigning in Cordoba (Spain) (Orgaz & Fereres, 1997), with correction for the canopy size (Kr) (Fereres & Goldhamer, 1990). The reference evapotranspiration (ETo) was estimated using the Penman–Monteith equation using daily data from a nearby automatic weather station. TDF - Irrigation treatment in relation to the trunk diameter fluctuations (TDF), which were measured with linear variable differential transformers (LVDT) (model DF 2.5; Solartron Metrology, West Sussex, UK). Measurements were taken on each experimental tree every 30 s and the datalogger (model CR21X, Campbell Sci., Logan, USA) was programmed to calculate 15 min means. The daily TDF cycles provides two indices; maximum daily shrinkage (MDS), calculated as the difference between the maximum daily diameter (MXTD) and the minimum daily diameter (MNTD) (Goldhamer & Fereres, 2001) and trunk growth rate (TGR), calculated as the slope of MXTD daily records. These two indices were used to estimate the irrigation doses according to the results obtained by Moriana et al. (2002). SWP - Two different irrigation managements based on the measurements of the stem water potential (SWP). SWP was determined with a pressure chamber (Soil Moisture Equip., Santa Barbara, CA, USA) using fully expanded leaves on branches near the trunk which were covered with aluminium foil at least 1 hour before removal at midday (13:00 h civil time). The water doses applied to the olive trees during the irrigation seasons allowed to preserve this water status measurement in two different thresholds; -1.2 MPa (SWP -1.2), which supposed any water deficit conditions in olive trees, and -2.0 MPa (SWP -2.0) which involved medium water stress. The total water applied for the different irrigation treatments during the three crop seasons in both varieties is reported in Table 1. In order to fully describe the different irrigation strategies used and water status of Cornicabra and Morisca olive trees, the seasonal water stress integrals (SΨ) and the water stress integrals from DOY 229-277 (SΨ229-277) (MPa x day; as defined by Myers, 1998), calculated from the midday stem water potential data, and the minimum potential values observed are also reported. 114 Artículo IV Table 1. Irrigation doses employed and water status in Cornicabra and Morisca olive trees. Water doses (mm) Water stress seasonal integral (MPa x day) Water stress DOY 229-277 integral (MPa x day) Minimum potential value (MPa) CORNICABRA 2005 FAO 125.0 94.6 26.0 -1.69 (middle August) TDF 70.1 98.7 28.8 SWP -1.2 179.5 75.0 19.2 SWP -2.0 28.9 161.6 43.1 -1.71 (middle August) -1.47 (beginning September) -2.10 (middle September) CORNICABRA 2006 FAO 92.7 138.3 53.6 TDF 51.5 172.1 81.5 SWP -1.2 101.2 141.4 54.2 SWP -2.0 25.1 199.8 84.9 FAO 408.9 197.6 82.3 TDF 704.1 129.3 38.9 SWP -1.2 388.6 185.8 63.7 SWP -2.0 184.2 328.9 119.6 FAO 297.3 185.4 44.9 TDF 350.2 163.8 48.5 SWP -1.2 304.8 165.1 46.3 SWP -2.0 193.1 267.2 90.7 -1.75 (middle August) -2.10 (middle August and middle September) -1.82 (middle August) -2.17 (middle August and middle September) MORISCA 2006 -1.91 (beginning August and middle September) -1.28 (beginning August) -1.71 (beginning August) -2.71 (beginning August and beginning September) MORISCA 2007 -1.73 (middle September) -2.43 (beginning September) -1.64 (middle September) -2.97 (beginning September) Olive fruit and olive oil samples. Olive fruit samples from the different irrigation treatments were harvested at two ripening indexes (RI1≈3.5 and RI2≈4.5) for both varieties studied (Cornicabra cv. and Morisca cv.). The olive ripeness index was determined according to the method proposed by the International Olive Oil Council (IOOC, 1984), based on the evaluation of the olive skin and pulp colours. Three representative subsamples from each treatment (3 subsamples x 4 treatments) were picked at each sampling and brought to the laboratory for oil extraction, moreover 100 g of olive fruit from each subsample were frozen using liquid N2 and stored at – 70ºC for the analysis of biophenols in olive fruits. Virgin olive oil samples of Cornicabra and Morisca variety were obtained using the Abencor analyzer (Abengoa S.A., Sevilla, Spain), this system reproduces at laboratory scale the industrial process through three basic elements; hammer mill, thermo-mixer and centrifuge. The oil obtained was separated by decanting and stored in amber glass bottles at 4ºC in darkness without headspace until analysis. 115 Artículo IV Analytical determinations in olive fruits. All reagents used were of analytical, HPLC or spectroscopic grade, and were supplied by Merck (Darmstadt, Germany). Biophenols. A sample of olive pulp (4.0 g) was homogenized with a mixture of methanol:water (80:20 v/v) (40 mL) during 2 min with an Ultraturrax homogenizer (14000 rpm). The suspension obtained was shaken (20 min, 150 rpm, <4ºC in darkness), and then centrifuged (10 min, 5000 rpm and 4ºC). The hydromethanolic phase was recovered and filtered with a 0.45 µm nylon syringe filter. The phenolic fraction extracted was analysed by high-performance liquid chromatography (HPLC) using an Agilent Technologies 1100 series system equipped with an automatic injector, a column oven and a diode array UV detector. A Zorbax SB-C18 column (250 x 4.6 id mm, 5 µm particle size) (Agilent Technologies, USA), maintained at 30 ºC, was used with an injection volume of 20 µl and a flow rate of 1.0 ml/min. The mobile phase consisted of a mixture of water/acetic acid (95:5 v/v) (solvent A), methanol (B) and acetonitrile (C): from 95% (A)-2.5% (B)- 2.5% (C) to 34% (A)-33% (B)-33% (C) in 50 min. Chromatograms were recorded at 280 nm, 340 nm and 520 nm. Hydroxytyrosol, oleuropein and demethyloleuropein were quantified at 280 nm, anthocyanins at 520 nm and verbascoside and flavonoids at 340 nm. Phenolic compound quantification was achieved using a five-point calibration curve on the basis of the corresponding standard substances with the exception of hydroxytyrosol which was quantified as tyrosol, and demethyloleuropein and anthocyanins as oleuropein. Identification of colourless phenolic compounds was carried out by comparison of their retention times, UV-Visible characteristics and MS spectra with their standard substances. In the case of the anthocyanins and demethyloleuropein, these were tentatively identified by their UV-Visible characteristics and MS spectra. The mass detector used was a LCQ Deca XP Plus (Thermo Electron Corporation, Waltham, MA, USA) equipped with an electrospray ionisation system. Nitrogen was used as nebulizing gas at a flow rate of 14 (arbitrary units). The temperature and voltage of the capillary were 250 ºC and 4.50 kV, respectively. Data were acquired in the negative ionisation mode. Fragmentation experiments were performed using helium as the collision gas with collision energy between 30-40%. Analytical determinations in virgin olive oil. Free acidity, given as % of oleic acid, peroxide value (PV) expressed as milliequivalents of active oxygen per kilogram of oil (meq O2/kg), and K232 and K270 extinction coefficients calculated from absorption at 232 and 270 nm, were measured following the analytical methods described in European Regulation EEC 2568/91 and subsequent amendments. Fatty acid composition (European Regulations EEC 2568/91 and subsequent amendments, corresponding to the AOCS method Ch 2-91). To determine fatty acid composition, the methyl- 116 Artículo IV esters were prepared by vigorous shaking of a solution of oil in hexane (0.2 g in 3 ml) with 0.4 ml of 2N methanolic potassium hydroxide and analysed by GC with a FID detector. A fused silica column (50 m length x 0.25 mm i.d.) coated with SGL-1000 phase (0.25 µm thickness; Sugerlabor, Spain) was used. The carrier gas was helium, at a flow through the column of 1 ml/min. The injector and detector temperature was set at 250ºC and the oven temperature at 210ºC. The injection volume was 1 µl. Oxidative stability. This was evaluated by the Rancimat method (Laübli & Bruttel, 1986). Stability was expressed as the induction time (hours) measured with the Rancimat 679 apparatus (Metrohm, Switzerland). Bitterness index (K225) was determined by the method described by Gutiérrez-Rosales, Perdiguero, Gutiérrez & Olías (1992), which consists of the extraction of the bitter components from a sample of 1.0 ±0.01 g of oil dissolved in 4 ml of hexane passed through a C18 column (Bakerbond spe, J.T. Baker, Phillipsburg, NJ, USA) previously activated with methanol and washed with hexane. After elution, 10 ml of hexane was passed to eliminate the oil residues and then the retained compounds were eluted with methanol/water (1:1) to 25 ml. The absorbance of the extract was measured at 225 nm against methanol/water (1:1) in a 1 cm cuvette. Phenolic compounds. A solution of the internal standard (250 µl of 15 mg/Kg of syringic acid in methanol) was added to a sample of virgin olive oil (2.5 g) and the solvent was evaporated with a rotary evaporator at 35 ºC under vacuum. The oil was then dissolved in 6 ml of hexane and a diolbonded phase cartridge (Supelco Co., Bellefonte, PA) was used to extract the phenolic fraction. The cartridge was conditioned first with methanol (6 ml) and then with hexane (6 ml). The oil solution was then applied, and the solid phase extraction (SPE) column was washed with hexane (2 x 3 ml) and with hexane/ethyl acetate (85:15, v/v; 4 ml). Finally, the phenols were eluted with methanol (15 ml) and the solvent was removed with a rotary evaporator at 35 ºC under vacuum until dry. The phenolic residue was dissolved in methanol/water (1:1 v/v; 250 µl). Chromatographic conditions were the same as those used with the olive pulp phenolic fraction. Phenolic compounds were quantified at 280 nm using syringic acid as internal standard and the response factors determined by Mateos, Espartero, Trujillo, Ríos, León-Camacho, Alcudia & Cert (2001). Tocopherols were evaluated following the AOCS Method Ce 8-89. A solution of oil in hexane was analysed on an Agilent Technologies HPLC (1100 series) on a silica gel Lichrosorb Si-60 column (particle size 5 µm, 250 mm x 4.6 mm i.d.; Sugerlabor, Madrid, Spain) which was eluted with hexane/2-propanol (98.5:1.5) at a flow rate of 1 ml/min. A fluorescence detector (Thermo-Finnigan FL3000) was used with excitation and emission wavelength set at 290 and 330 nm. 117 Artículo IV Volatile compounds ﴾adapted from Vichi, Castellote, Pizzale, Conte, Buxaderas & LopezTamames, 2003). Solid phase microextraction (SPME) followed by GC were used to analyze the volatile compounds in the virgin olive oil samples studied. 1.5 g of olive oil spiked with 4-methyl-2pentanol (as internal standard) to a concentration of 1.5 µg/g was placed in a 10 mL vial fitted with a silicone septum. The SPME sampling was performed by exposing the DVB/Carboxen/PDMS fiber (50/30 µm, 2 cm long from Supelco Inc., Bellefonte, PA) for 30 min in the headspace of the sample maintained at 40ºC; it was then retracted into the needle and immediately transferred and desorbed for 1 min in the injection port of an Agilent 6890 Series gas chromatograph equipped with a flame ionization detector (FID). Compounds were separated on a Supelcowax-10 column (30 m x 0.25 mm x 0.25 µm, Supelco Inc., Bellefonte, PA) under the following conditions: injection port temperature 260ºC; helium flow 0.8 mL/min; oven temperature ramp: 35ºC for 10 min, 3ºC/min up to 160ºC and then 15ºC/min up to 200ºC (maintained for 5 min). Volatile compounds were identified by comparison of retention times and mass chromatograms of standard substances (Sigma Aldrich) added to refined olive oil. The equipment used was an Agilent 5975C Series mass spectrometer (Agilent Technologies, USA) equipped with an electron ionisation (EI+) detector and coupled to an Agilent 6850 Series gas chromatograph, the capillary column used was a DB-Wax (30 m x 0.25 mm x 0.25 µm, J&W Scientific, USA). Helium was employed as carrier gas at a flow rate of 0.8 mL/min. The transfer line temperature was 280 ºC and the temperature of the ionisation source and the quadrupole were 230 ºC and 150 ºC, respectively, with an electromultiplier voltage of +941 eV. The analytical determinations were carried out at least in duplicate. Statistical Analysis. Analysis of ANOVA analysis was performed using SPSS 15 statistical software (SPSS Inc., Chicago, IL). Duncan´s test (p ≤0.05) was used to discriminate among the mean values. RESULTS AND DISCUSSION The influence of the different irrigation management proposed in this study, based on the Trunk Diameter Fluctuations (TDF) and the Stem Water Potential (SWP) measurements, as compared with the FAO methodology on agronomical aspects like the growth rate and the production of the olive groves of Cornicabra and Morisca cultivars are currently being deeply analyzed and will be discussed elsewhere. 118 Artículo IV Virgin olive oil quality indices. The values of free acidity, peroxide value and spectrophotometric absorption characteristics in the UV region at 270 and 232 nm for all the types of virgin olive oil (VOO) samples studied were considerably lower than the maximum limit establish by the EU legislation for extra virgin olive oil Thereby, in the 2006/07 crop season, the free acidity and peroxide value varied from 0.15 to 0.18% and from 6.4 to 11.7 meqO2Kg-1, respectively, in Cornicabra oil samples, while ranged from 0.14 to 0.35% and from 14.9 to 16.5 meqO2Kg-1, respectively, in Morisca cultivar. Moreover, these quality indexes were not clearly influenced by the different irrigation strategies studied, since no statistically significant differences were obtained in all the seasons studied (data not shown). Similar results have been observed recently in oils from young olive orchards under different irrigation practices by Berenguer et al. (2006) in Arbequina cultivar and Servili et al. (2007) in Leccino cultivar. Similarly, statistically significant differences in K232 and K270 values according to the type of irrigation applied in both olive orchards were not found (data not shown). Virgin olive oil major components: fatty acid composition. The effect of irrigation on the main fatty acid composition and MUFA/PUFA and UFA/SFA fatty acids ratios in the VOO obtained in the different crop seasons are reported in Table 2. First of all, it is worth to remark the great differences found between Cornicabra and Morisca varieties respect to their fatty acid composition, especially in the oleic acid content, ranging from 77.5-80.3% and 55.8-59.0% in Cornicabra and Morisca VOO, respectively, and linoleic acid, which content varied from 3.0-3.3% and 18.5-22.5% in Cornicabra and Morisca VOO, respectively. As a consequence, the MUFA/PUFA ratios obtained in Cornicabra VOO were about 7.4 times higher than in Morisca VOO (Table 2). The potential oxidative susceptibility is therefore higher in the Morisca VOO (lower oxidative stability) than other VOO, like Cornicabra or Picual varieties, a part from the natural antioxidant content of each variety. With respect to the effect produced in the fatty acid composition by the irrigation practices applied in both olive orchards, these were very weak and moreover did not show similar trends in the different successive crop seasons studied (complete data not shown). Moreover, these not statistically significant changes in the fatty acid composition do not possess any relevance on the nutritional value. In a similar way, the MUFA/PUFA and SFA/UFA ratios were practically unaffected by the different irrigation scheduling studied. Berenguer et al. (2006) observed similar trends in Arbequina VOO obtained from a young super-high-density orchard, where different regulated deficit irrigation (based on several %ETc) were applied, moreover Inglese, Barobe & Gullo (1996) and Patumi, d´Andria, Fontanazza, Morelli, Giori & Sorrentino (1999) found that the fatty acid composition of different Italian varieties was affected mainly by cultivar factors and not by irrigation practices. Other researches found that irrigation implied an increase in palmitic and 119 Artículo IV linoleic acids and a decrease in oleic and linolenic acid content in VOO but significant differences were observed only between rainfed and the rest of the irrigation treatments studied (Salas, Pastor, Castro & Vega, 1997; Gómez-Rico et al., 2007). Table 2. Virgin olive oil main fatty acid composition as affected by the irrigation scheduling studied. CORNICABRA cv. 2005/06 RATIOS R.I. C16:0 (%) b C18:0 (%) 11.6 ±0.2 a a 12.8 ±0.9 a 2.8 ±0.0 a 11.4 ±0.7 a 2.9 ±0.2 a 12.6 ±0.8 a 2.9 ±0.5 FAO TDF 3.7 ±0.2 SWP -1.2 3.6 ±0.3 SWP -2.0 3.6 ±0.3 3.6 ±0.2 a C18:1 (%) C18:2 (%) 79.4 ±0.6 a 78.1 ±0.6 a 3.3 ±0.1 a 79.5 ±0.9 a 3.3 ±0.0 a 78.2 ±1.1 a 3.3 ±0.0 b 59.0 ±0.3 b 18.7 ±0.3 a 1.1 ±0.0 b 55.9 ±2.0 a 20.8 ±1.5 b 1.2 ±0.0 56.2 ±0.6 a 20.9 ±0.3 b 58.3 ±0.3 b 19.7 ±0.7 b 3.1 ±0.3 a C18:3 (%) a 3.1 ±0.1 a a a a MUFA/PUFA UFA/SFA 21.3 ±0.8 a b 19.9 ±0.7 a 5.2 ±0.3 a,b 20.2 ±0.1 a 5.6 ±0.4 b 20.3 ±0.9 a 5.0 ±0.4 a 3.1 ±0.1 b 2.6 ±0.3 0.6 ±0.0 0.7 ±0.0 0.7 ±0.0 0.7 ±0.0 a 5.4 ±0.2 a a a MORISCA cv. 2006/07 FAO 3.5 ±0.1 b 14.9 ±0.1 a 3.6 ±0.0 TDF 3.1 ±0.1 a 15.6 ±0.2 b 3.5 ±0.2 15.5 ±0.2 b 14.9 ±0.2 a SWP -1.2 SWP -2.0 b 3.5 ±0.2 b 3.5 ±0.2 a 3.4 ±0.2 a 3.3 ±0.1 b 1.2 ±0.0 a 1.1 ±0.0 b a a 2.6 ±0.1 a,b 2.8 ±0.2 b,c 4.2 ±0.0 a 4.0 ±0.1 a,b 4.1 ±0.1 Different letters within a column (a-c) indicate significant differences (p<0.05) with respect to irrigation treatment in each sampling. R.I: ripeness index. Biophenols in the olive drupe and in virgin olive oil. Biophenols are the chief antioxidant components naturally occurring in the olive drupe and in virgin olive oils. Oleuropein was the main oleoside found in the olive fruits, accounting for about 85-95% of the total biophenol content in the Cornicabra olives and about 50-75% in the Morisca variety (data not shown). Great differences were found in the oleuropein content of the two cultivars, which was significantly higher in Cornicabra fruits, ranging from 6500 to 12000 mg/Kg, than in Morisca olives, ranging from 400 to 3000 mg/Kg, as depicted in Figure 1. The influence of seasonal changes on this biophenol content can also be observed in this figure; as known the different pedoclimatic conditions in the successive crop seasons affect the content of oleosides in olive fruits from the same variety at similar ripeness index. No clear relationships between the water stress integral, both seasonal and obtained from DOY 229-277, and the oleuropein content in the drupes were found. Nevertheless, a good agreement between the content of this biophenol and the minimum stem water potential of the olive trees, measured from the beginning of August to the end of the irrigation season, were obtained (r2 = 0.88-0.95 and r2 = 0.90-0.95 in Cornicabra and Morisca cultivars, respectively; Table 1 and Figure 1): therefore, a lower minimum water potential correspond with a higher biophenols content. In fact, in 2006 crop season, in which the minimum potential values reported in 120 c 4.3 ±0.1 Artículo IV Cornicabra olive trees under the different irrigation schedules were similar (varied between -1.75 MPa and -2.17 MPa; Table 1), no significant differences in oleuropein content in drupes were found. Furthermore, in 2007 crop season, the minimum potential values in Morisca olive trees were -1.64 MPa (SWP -1.2 strategy), -1.73 MPa (FAO treatment), -2.43 MPa (TDF strategy) and 2.97 MPa (SWP -2.0 strategy), and the oleuropein content in olive drupes were similar in FAOSWP -1.2 strategies and TDF-SWP-2.0 irrigation schedules. 14000 Oleuropein content (mg/Kg) 12000 10000 8000 6000 3000 2000 1000 0 2005 2006 Cornicabra drupe 2007 2006 Morisca drupe Figure 1. Oleuropein content in Cornicabra and Morisca drupes as affected by the irrigation management. , FAO; , TDF; , SWP -1.2; , SWP -2.0 Each box includes the content within the 10th and 90th percentiles of the data distribution (RI ≈ 3.0-3.5). Several research works (Patumi et al., 1999; Tovar, Romero, Girona & Motilva, 2002) have reported that different water status of olive trees under different irrigation strategies, implied changes in the activity of enzymes responsible for phenolic compounds synthesis in drupes, such as L-Phenylalanine ammonia-lyase (PAL), whose activity is greater under higher water stress conditions, leading superior phenolic contents in olive flesh and therefore in the virgin olive oils obtained. However, according to the results of this study, the activity of PAL would be probably affected by critical drop water status that could happen during the phenological stage III of the olive fruit, and not only by the total seasonal water status of the olive tree. The total phenol content and the secoiridoid forms of hydroxytyrosol and tyrosol in Cornicabra and Morisca VOO from the different irrigation strategies and crop seasons studied are depicted in Figure 2. 121 Artículo IV 1250 1250 Phenolic content (mg/Kg) CORNICABRA 2005 CORNICABRA 2006 1000 1000 750 750 500 500 250 250 0 Total phenols Secoiridoids of hydroxytyrosol Secoiridoids of tyrosol Total phenols Secoiridoids of hydroxytyrosol Secoiridoids of tyrosol 450 450 MORISCA 2006 Phenolic content (mg/Kg) 0 MORISCA 2007 300 300 150 150 0 Total phenols Secoiridoids of hydroxytyrosol Secoiridoids of tyrosol Total phenols Secoiridoids of hydroxytyrosol Secoiridoids of tyrosol 0 Figure 2. Total phenols and complex secoiridoid forms of hydroxytyrosol and tyrosol contents in Cornicabra and Morisca VOO as affected by the irrigation management. , FAO; , TDF; , SWP -1.2; , SWP -2.0 Each box includes the content within the 10th and 90th percentiles of the data distribution (RI ≈ 3.0-3.5). The major phenolic fraction in both varieties were the secoiridoids derivatives of hydroxytyrosol and tyrosol. As expected, within the same variety a relationship between oleuropein concentration in the fruit and the presence of these compounds in virgin olive oils (Gómez-Rico, Fregapane & Salvador, 2008) was observed and therefore an increase in the oleuropein content in the drupe led to a proportional increase in the total phenol concentration in virgin olive oil. As a consequence, the content in these complex phenols was significantly higher in Cornicabra VOO than in Morisca VOO. On top of this, the different water status of olive trees affected more the content of secoiridoid derivatives of hydroxytyrosol in VOO than those of tyrosol, since higher water stress conditions lead to superior increases in the first ones (fig. 2), as previously reported (Gómez-Rico et al., 2006). 122 Artículo IV Table 3 reports the concentrations of the main phenolic compounds (mg/Kg) found in VOO obtained from Cornicabra and Morisca olives subjected to the different irrigation schedules. Table 3. Virgin olive oil main individual phenolic compounds (mg/Kg) as affected by the irrigation strategies studied. CORNICABRA cv. 2005/06 FAO TDF SWP -1.2 R.I. 3,4-DHPEA a 3.1 ±0.4 a 3.0 ±0.2 a 3.0 ±0.3 a 1.04 ±0.14 a 0.94 ±0.06 a a 1.08 ±0.05 b SWP -2.0 3.0 ±0.3 FAO 3.7 ±0.2 a 0.98 ±0.77 a a 0.94 ±0.42 a a 0.43 ±0.02 a TDF 3.6 ±0.2 SWP -1.2 3.6 ±0.3 SWP -2.0 2.20 ±1.85 a 0.79 ±0.27 a a 3.6 ±0.3 a 1.06 ±0.41 3,4-DHPEAEDA 3,4-DHPEAEA 350.4 ±59.6 a 138.2 ±17.4 a 365.4 ±27.1 a 147.3 ±14.3 a 310.1 ±12.4 a a 477.6 ±65.9 b 150.1 ±70.6 a,b 175.2 ±64.4 a,b p-HPEA-EDA 3.77 ±1.33 a 2.83 ±0.80 a 2.37 ±0.34 a 82.5 ±28.7 a,b 3.12 ±1.21 a 86.9 ±22.8 a,b 2.81 ±0.43 a a 182.0 ±0.5 199.1 ±27.1 a 123.3 ±32.3 2.28 ±0.38 a a 163.6 ±23.7 a 4.06 ±1.59 392.1 ±12.1 a 183.6 ±5.8 a,b 369.6 ±13.2 a 433.9 ±43.0 a a 400.9 ±32.7 1.28 ±0.16 b 0.94 ±0.03 a 342.5 ±22.3 a,b 2.50 ±0.06 1.96 ±0.06 259.3 ±83.1 a,b b 124.4 ±4.4 59.9 ±1.7 b 343.4 ±36.4 a b 96.8 ±1.4 a p-HPEA 328.4 ±7.3 a p-HPEA-EA 55.6 ±10.8 60.3 ±14.6 51.7 ±3.3 a b 79.8 ±11.4 218.4 ±34.7 a,b 40.5 ±8.8 248.1 ±49.3 a,b 51.4 ±11.3 395.7 ±32.8 a 35.9 ±1.9 a a,b b a a,b a 295.1 ±52.2 b 65.3 ±12.3 b a 370.5 ±29.3 a 77.7 ±0.3 4.03 ±0.11 a 366.8 ±34.4 a 79.2 ±13.7 3.72 ±0.01 a 395.0 ±22.0 a 81.3±15.2 4.82 ±0.58 a 409.6 ±39.2 a 109.8 ±20.9 2006/07 FAO 3.0 ±0.2 TDF 3.0 ±0.1 SWP -1.2 SWP -2.0 a 3.1 ±0.1 a 3.1 ±0.2 1.73 ±0.09 b 155.3 ±22.0 a 215.4 ±16.5 b a a a a MORISCA cv. 2006/07 FAO TDF R.I. 3,4-DHPEA 3,4-DHPEAEDA b 0.59 ±0.36 a 9.8 ±8.0 a 3.5 ±0.1 a 0.62 ±0.08 a 5.31 ±2.3 b 0.46 ±0.09 a a 7.5 ±1.4 b 120.1 ±14.8 3.1 ±0.1 SWP -1.2 3.5 ±0.2 SWP -2.0 3.5 ±0.2 0.82 ±0.32 a a 0.38 ±0.17 a 4.4 ±3.5 a 1.4 ±0.3 FAO 4.2 ±0.1 TDF 4.3 ±0.1 a b 3,4-DHPEAEA p-HPEA p-HPEA-EDA p-HPEA-EA 18.9 ±7.0 a 2.54 ±0.05 b 20.6 ±5.8 a 3.6 ±0.7 13.8 ±1.5 a 2.56 ±0.46 b 16.8 ±2.1 a 3.5 ±0.1 15.9 ±0.7 a 1.77 ±0.14 a 22.0 ±1.1 a 4.1 ±0.3 124.1 ±25.8 35.2 ±2.1 b 1.81 ±0.33 a a 15.3 ±4.7 a 2.47 ±0.15 a a 10.6 ±1.6 a 2.22 ±0.37 a 10.3 ±0.1 a 3.25 ±1.08 a 26.7 ±9.8 b 2.83 ±0.69 a 114.5 ±60.7 a a a b b 7.8 ±1.0 17.6 ±3.4 a 3.3 ±0.8 a 13.0 ±1.6 a 3.2 ±.3 15.8 ±0.9 a 3.1 ±0.2 0.21 ±0.07 a a 0.23 ±0.09 a 1.5 ±0.1 b 1.73 ±0.86 b 87.5 ±56.8 a 1.03 ±0.13 a 50.6 ±22.3 a,b 24.9 ±2.6 a,b 2.82 ±0.56 a 61.2 ±19.3 a 3.2 ±0.7 a 0.99 ±0.15 a 87.3 ±17.2 a,b 33.8 ±6.7 a,b 3.66 ±2.09 a 92.5 ±11.7 a 3.2 ±0.3 a 23.8 ±6.6 a 2.67±0.12 a 66.2 ±27.5 a 2.8 ±0.3 37.9 ±9.0 b 2.13 ±0.08 a 95.7 ±2.6 a 59.1 ±11.8 a 2.8 ±0.0 94.7 ±11.2 b 3.4 ±0.1 65.1 ±20.8 a,b 3.1 ±0.1 86.1 ±16.2 a,b 3.1 ±0.7 SWP -1.2 4.1 ±0.2 SWP -2.0 4.7 ±0.1 a b a a b b 6.9 ±2.0 2007/08 FAO 2.9 ±0.1 TDF 3.4 ±0.6 SWP -1.2 3.1±0.1 0.74 ±0.11 a 42.2 ±13.3 a 0.78 ±0.20 a 96.7 ±9.8 b a 43.4 ±11.8 a 25.8 ±0.8 a 2.72 ±0.30 a 80.5 ±18.5 b 31.6 ±4.7 a 4.04 ±2.02 a a,b 22.9 ±6.5 a 3.55 ±0.30 a 26.2 ±4.5 a 1.82 ±0.41 a SWP -2.0 3.0 ±0.1 FAO 4.1 ±0.1 0.72 ±0.21 a a 1.41 ±0.89 a a 0.79 ±0.40 a 0.87 ±0.26 a TDF 4.0 ±0.1 SWP -1.2 4.2 ±0.1 SWP -2.0 a 4.1 ±0.3 51.3 ±28.6 83.3 ±21.0 a b a a a a 3.5 ±0.4 a a a a Different letters within a column (a-c) indicate significant differences (p<0.05) with respect to irrigation treatment in each sampling. R.I: ripeness index. 123 Artículo IV The phenolic compounds most affected by the irrigation scheduling employed in the olive orchards were the 3,4-DHPEA-EDA, 3,4-DHPEA-EA and p-HPEA-EDA, which concentrations were significantly higher in the VOO from the more stressed treatment (SWP -2.0), while no clear statistical significant differences were observed between FAO, SWP -1.2 and TDF schedules along the successive crop seasons in Cornicabra and Morisca cultivars. As previously reported in the case of the oleuropein in the drupes, the total water doses employed in the olive trees under the different irrigation strategies, and consequently the different water status of the plant (Table 1), apparently were not clearly related neither to the oleoside content of the drupes nor to the phenolic composition of virgin olive oils (Figure 1 and Figure 2). On the contrary, the main falls in the water status of the trees, expressed as the minimum potential values (Table 1), were the main factor responsible of the final phenolic content reported in drupes and virgin olive oils. For example, in 2006/07 season (RI ≈ 3.0), the content of 3,4-DHPEA-EDA and p-HPEA-EDA were about 400.9 mg/Kg and 370.5 mg/Kg, respectively, in Cornicabra VOO under FAO treatment (water dose: 92.7 mm; SΨ: 138.3 MPa x day), whereas in VOO from TDF strategy (water dose: 51.5 mm; SΨ: 172.1 MPa x day) were similar, 392.1 mg/Kg and 366.8 mg/Kg, though the irrigation dose was almost halved and the water stress integrals were significantly different (see Table 1). On the other hand, in 2007 season (RI ≈ 3.5), the content of the same phenolic compounds in Morisca VOO from FAO schedule (water dose: 297 mm; SΨ: 185.4 MPa x day) were 50.6 mg/Kg and 61.2 mg/Kg, respectively, while in TDF virgin olive oils (water dose: 350 mm; SΨ: 163.8 MPa x day) were significantly higher - 87.3 mg/Kg and 92.5 mg/Kg - despite the irrigation doses and the water stress integrals were almost the same (Table 1). Recently, Tovar et al. (2001), Gómez-Rico et al. (2006) and Servili et al. (2007) reported in Arbequina, Cornicabra and Leccino cultivars, respectively, a higher decrease in the levels of 3,4DHPEA-EDA, 3,4-DHPEA-EA and p-HPEA-EDA as the water stress of olive trees fell off, finding clearly significant differences between the VOO from the most stressed treatments and those from medium-highly irrigated treatments, depending on the irrigation schedule used. However, in this study, the effect reported on phenolic composition were lower, this fact can be probably due to the different strategies employed in the olive orchards, which involved not very dissimilar water status in olive trees, with the exception of the SWP -2.0 strategy and the differences observed in the minimum water potential value reported in FDT, FAO and SWP -1.2 in Cornicabra and Morisca orchards (Table 1). As concerned the simple phenols found in virgin olive oils, the hydroxytyrosol contents (ranging from 0.42 mg/Kg up to 3.72 mg/Kg in Cornicabra VOO and from 0.13 mg/Kg up to 2.45 mg/Kg in 124 Artículo IV Morisca VOO, expressed as the 10th and 90th percentiles of the data distribution respectively) and tyrosol (1.94 - 5.31 mg/Kg in Cornicabra and 1.49 - 5.80 mg/Kg in Morisca oils) were apparently not affected by the irrigation strategies studied, since no statistically significant differences were observed (Table 3). This behavior was similar to that observed for the rest of the minor simple phenols identified (data not shown), which were present in very small amounts – vanillin (<0.14 mg/Kg and <0.94 mg/Kg in Cornicabra and Morisca VOO, respectively), vanillic acid (<0.32 mg/Kg and <0.28 mg/Kg), p-coumaric acid (<0.29 mg/Kg and <0.91 mg/Kg) – except for ferulic acid (ranging from 12.2 up to 31.4 mg/Kg in Morisca and <1.28 mg/Kg in Cornicabra, respectively) and pinoresinol (4.5 - 6.8 mg/Kg in Morisca and 5.6 - 11.5 mg/Kg in Cornicabra), which contents were higher. As previously reported, the complex phenols have been not only related with the oxidative stability (Baldioli, Servili, Peretti & Montedoro, 1996; Gennaro, Piciola Bocca, Modesti, Masella & Coni, 1998), but also with the sensory properties of the virgin olive oil, especially with the positive sensory attribute “bitterness” and “pungency” (Morales & Tsimidou, 2000). The oxidative stability, expressed in hours, and the bitterness of the virgin olive oils of the study, measured by the instrumental K225 parameter (Gutierrez-Rosales et al., 1992), are reported in Table 4. Table 4. Virgin olive oil oxidative stability (OS), K225 and α-tocopherol content as affected by the irrigation strategies studied. CORNICABRA cv. 2005/06 2006/07 OS (h) K225 α-tocopherol (mg/Kg) OS (h) K225 α-tocopherol (mg/Kg) FAO 30.4 ±2.0a 0.65 ±0.02a 317.1 ±5.7a 32.9 ±1.2a 0.67 ±0.06a 259.6 ±25.5a TDF 30.9 ±1.2a 0.68 ±0.03a 295.2 ±23.4a 32.7 ±0.5a 0.69 ±0.02a 278.9 ±18.9a,b SWP -1.2 29.2 ±0.3a 0.65 ±0.02a 309.6 ±6.4a 31.7 ±1.3a 0.64 ±0.03a 344.4 ±17.5c SWP -2.0 35.9 ±2.2b 0.74 ±0.05b 315.9 ±34.1a 36.3 ±1.4b 0.78 ±0.01b 321.4 ±15.8b,c MORISCA cv. 2006/07 2007/08 OS (h) K225 α-tocopherol (mg/Kg) OS (h) K225 α-tocopherol (mg/Kg) FAO 3.8 ±0.3a 0.12 ±0.02b 436.1 ±18.6a 5.0 ±0.4a 0.17 ±0.03a 592.9 ±10.9a TDF 2.8 ±0.1a 0.09 ±0.02a 467.8 ±7.4b 5.6 ±0.5a,b 0.19 ±0.03a 639.7 ±32.1a SWP -1.2 2.9 ±0.1a 0.09 ±0.01a 459.1 ±8.3a,b 4.3 ±0.7a 0.15 ±0.03a 616.3 ±30.8a SWP -2.0 5.5 ±1.0b 0.27 ±0.02c 476.4 ±13.7b 5.8 ±0.3b 0.21 ±0.00a 647.1 ±11.9a Different letters within a column (a-b) indicate significant differences (p<0.05) with respect to irrigation treatment in first sampling (RI ≈ 3.0-3.5). R.I: ripeness index. 125 Artículo IV As expected, according to the large differences found between the phenolic composition of Cornicabra and Morisca VOO, a greater oxidative stability in Cornicabra VOO (ranging from 29.2 up to 36.3 hours in the different irrigation strategies) than in Morisca ones (from 2.9 up to 5.8 hours) was observed. The same trend was observed for the bitterness index (directly related to the K225), which was about 3 times higher in Cornicabra than in Morisca oils from SWP -2.0 treatment, and about 4.4, 4.5 and 5.4 times higher in Cornicabra oils from TDF, FAO and SWP 1.2 strategies, respectively, respecting the Morisca ones. As observed in the phenolic composition, clearly significant differences were only reported between the VOO from the most stressed treatment (SWP -2.0) and the rest ones (Table 4). The bitterness decrease due to the irrigation technique used, though very slightly in the oils used in this study, is very relevant from a marketing point of view, so high levels of bitterness are rejected by the consumers and therefore the descent of this positive attribute could be desirable in rich-phenol virgin olive oil, like the Cornicabra variety. On the contrary, probably this factor could affect negatively Morisca VOO´s sensory profile, so due to their natural low phenolic content, a descent of these compounds would imply to obtain virgin olive oils too mild and flat, and moreover the implied decrease in the oxidative stability could reduced significantly the shelf-life of the product, since due to its high content in polyunsaturated fatty acids the oxidation processes could be accelerated. Tocopherols. Changes observed in α-tocopherol content, practically the only tocopherol present in VOO, in from both varieties (Cornicabra and Morisca cv.), as affected by the irrigation strategies and along the successive crop seasons studied are reported in Table 4. The small differences found in the α-tocopherol content in both olive orchards were not statistically significant. Gómez-Rico et al. (2007) reported similar observations in virgin olive oils obtained from different irrigation treatments applied in a Cornicabra cv. low-density orchard. On the other hand, according to Tovar et al. (2001) and Tovar, Romero, Alegre, Girona & Motilva (2002) contradictorily results were found, although the irrigation strategies applied in these cases were not similar, and anyway the observed changes were not noteworthy to vary the VOO oxidative stability. As well known seasonal and cultivar are the main factors affecting the α-tocopherol content in VOO. In this case, the content of this antioxidant was 50-70% higher in Morisca than Cornicabra and depended on the crop season as well. 126 Artículo IV Volatile compounds. Figure 3 shows the distribution of C6 aldehydes, alcohols, esters and C5 volatiles in the VOO of the study, whereas Table 5 reports the concentrations these individual volatile compounds from the lipoxygenase (LOX) pathway, expressed as mg of internal standard (4-methyl-2-pentanol) per kg of oil, in Cornicabra and Morisca VOO samples according to the different irrigation techniques and the successive crop seasons studied, These compounds are related with the “green”, “fruity” and “floral” sensory notes found in highquality virgin olive oils and are produced through the LOX enzymatic pathway mainly during the crushing of the fruit and incorporated to the oily phase during the kneading stage of the olive paste (Sanchez & Harwood, 2002). C5 volatiles C6 esters C6 alcohols C6 aldehydes CORNICABRA 2005 0,0 0,5 1,0 CORNICABRA 2006 1,5 3,0 4,5 6,0 7,5 9,0 0,0 0,5 1,0 Volatile content (ppm IS) 1,5 3,0 4,5 6,0 7,5 9,0 Volatile content (ppm IS) C5 volatiles C6 esters C6 alcohols C6 aldehydes MORISCA 2007 MORISCA 2006 0,0 1,0 2,0 3,0 6,0 9,0 12,0 Volatile content (ppm IS) 15,0 0,0 1,0 2,0 3,0 6,0 9,0 12,0 15,0 Volatile content (ppm IS) Figure 3. C6 and C5 (LOX pathway) volatiles content in Cornicabra and Morisca VOO as affected by the irrigation management. , FAO; , TDF; , SWP -1.2; , SWP -2.0 Each box includes the content within the 10th and 90th percentiles of the data distribution (RI ≈ 3.0-3.5). 127 Artículo IV The volatile composition observed in virgin olive oils from the two studied cultivars was quite different (Figure 3), since, as known, the aromatic profile depend mainly on the enzymatic activities which are genetically determined in each cultivar (Angerosa, Basti & Vito, 1999). Table 5. Virgin olive oil volatiles (ppm of IS) from the LOX pathway (C5 and C6) as affected by the irrigation strategies studied. CORNICABRA cv. 2005/06 Hexanal Hexan-1-ol Hexyl acet. E-2-hexenal Z-3-hexen1-ol E-2-hexen1-ol Z-3hexenyl acetate 1-penten3-ol 1-penten3-one FAO 0.36±0.13 a 0.14±0.05 a <0.01 5.85 ±1.49 b 0.84±0.47 a 0.07±0.00 a <0.01 0.15±0.04 a 0.26±0.10 a TDF 0.47±0.05 a 0.15±0.05 a <0.01 6.57 ±1.41 b 0.77±0.41 a 0.08±0.01 a <0.01 0.21±0.03 b 0.39±0.10 a SWP -1.2 0.37±0.12 a 0.17±0.04 a <0.01 6.00 ±1.91 b 0.68±0.46 a 0.07±0.00 a <0.01 0.15±0.05 a 0.27±0.12 a SWP -2.0 0.33±0.07 a 0.09±0.03 a <0.01 4.14 ±0.95 a 0.58±0.39 a 0.07±0.02 a <0.01 0.26±0.05 b 0.44±0.05 a FAO 0.36±0.03 a 0.23±0.10 b <0.01 5.04 ±0.67 b 0.33±0.16 a 0.05±0.02 a <0.01 0.11±0.05 a 0.19±0.07 a TDF 0.31±0.14 a 0.31±0.04 b <0.01 4.72 ±0.76 b 0.47±0.29 a 0.06±0.01 a <0.01 0.14±0.05 a 0.23±0.10 a SWP -1.2 0.28±0.05 a 0.34±0.12 b <0.01 3.94 ±0.19 b 0.32±0.17 a 0.05±0.00 a <0.01 0.11±0.03 a 0.20±0.08 a SWP -2.0 0.23±0.06 a 0.15±0.03 a <0.01 3.56 ±0.18 a 0.23±0.15 a 0.07±0.03 a <0.01 0.15±0.02 a 0.25±0.03 a FAO 0.29±0.06 b 0.02±0.00 b <0.01 2.57 ±0.58 a,b 0.05±0.00 a 0.05±0.03 a <0.01 0.15±0.08 a 0.10±0.07 a TDF 0.14±0.05 a 0.02±0.00 b <0.01 2.07 ±0.32 a 0.07±0.03 a 0.08±0.02 b <0.01 0.35±0.05 b 0.37±0.09 b SWP -1.2 0.24±0.01 b 0.03±0.00 b <0.01 3.48 ±0.57 b 0.06±0.00 a 0.06±0.01 a <0.01 0.19±0.04 a 0.15±0.05 a SWP -2.0 0.14±0.02 a 0.01±0.00 a <0.01 1.91 ±0.46 a 0.07±0.02 a 0.10±0.00 b <0.01 0.33±0.01 b 0.41±0.11 b 2006/07 MORISCA cv. 2006/07 Hexanal Hexan-1-ol Hexyl acet. E-2hexenal Z-3-hexen1-ol FAO 1.59±0.16 a 0.33±0.08 b 0.01±0.00 b 8.14±0.95 b 0.13±0.01 TDF 1.93±0.31 a 0.25±0.05 a 0.02±0.00 b 8.75±0.57 b SWP -1.2 1.79±0.16 a 0.37±0.08 b 0.04±0.00 SWP -2.0 1.52±0.15 a 0.23±0.01 a 1.92±0.15 a 1.15±0.24 a 2.66±0.65 b 1.70±0.32 b SWP -1.2 3.19±0.20 b 1.04±0.22 a SWP -2.0 1.55±0.09 a 0.86±0.09 FAO 2.14±0.27 b TDF 1.61±0.32 b SWP -1.2 1.92±0.26 b SWP -2.0 1.3 ±0.18 a FAO TDF E-2-hexen1-ol Z-3hexenyl acetate 0.12±0.00 a 0.03±0.01 a 0.22±0.01 a 0.29±0.05 0.06±0.01 b 0.49±0.05 c 0.45±0.38 a 0.47±0.02 c 0.47±0.33 a 0.10±0.01 6.51±0.48 a 0.38±0.05 b 0.20±0.01 a 6.75±0.42 b 0.75±0.17 a 0.14±0.07 a 5.23±0.46 a 11.7±2.37 0.02±0.00 a 0.17±0.05 b 0.22±0.05 b 0.27±0.05 b a 0.06±0.04 0.61±0.01 a 0.65±0.11 a 1.07±0.21 b 1-penten3-one a c c 1-penten3-ol c 0.22±0.02 a 0.23±0.07 a c 0.20±0.01 a 0.17±0.03 a 0.07±0.01 b 0.30±0.01 b 0.32±0.02 0.31±0.03 b 0.18±0.01 a 0.26±0.03 a 0.14±0.05 a 0.20±0.09 a 0.16±0.02 a 0.17±0.04 a 0.20±0.06 a 0.26±0.08 a 1.74±0.78 b 0.28±0.20 a 7.47±0.56 c 0.65±0.06 a 0.36±0.18 a 0.40±0.04 a 8.34±0.35 c 0.93±0.54 a 0.25±0.12 a 0.20±0.3 0.06±0.01 a 9.76±1.39 c 0.35±0.01 a 0.04±0.06 a 0.11±0.01 a 0.20±0.01 a 0.58±0.07 b 0.05±0.03 a a,b 0.05±0.01 a 0.63±0.09 c c b a 2007/08 5.97±1.15 8.04±0.96 0.38±0.06 a 0.16±0.01 b 0.07±0.03 a 0.20±0.01 a 0.47±0.13 a b,c 0.58±0.21 b 0.07±0.02 a 0.12±0.03 a 0.20±0.01 a 0.72±0.07 b 0.45±0.17 a 0.09±0.02 a 4.37±2.19 a 0.31±0.02 a 0.06±0.05 a 0.24±0.03 b 0.22±0.05 a 0.49±0.03 a 1.17±0.47 a 0.13±0.01 b 5.56±1.42 a 0.90±0.43 a 0.15±0.03 a 0.34±0.11 a 0.18±0.01 a 0.64±0.06 a FAO 2.13±0.36 a TDF 1.85±0.17 a 0.90±0.47 a 0.12±0.04 b 4.43±0.72 a 0.67±0.50 a 0.12±0.02 a 0.26±0.06 a 0.18±0.02 a 0.64±0.06 a SWP -1.2 2.18±0.37 a 0.98±0.30 a 0.11±0.02 b 4.96±1.12 a 0.58±0.18 a 0.12±0.01 a 0.19±0.04 a 0.20±0.01 a 0.72±0.15 a SWP -2.0 1.85±0.05 a 0.84±0.05 a 0.07±0.00 a 3.53±1.25 a 1.01±0.25 a 0.12±0.02 a 0.22±0.00 a 0.17±0.01 a 0.68±0.07 a Different letters within a column (a-c) indicate significant differences (p<0.05) with respect to irrigation treatment in each sampling. R.I (ripeness index) are similar to those from the first column of Table 3. 128 Artículo IV The C6 aldehydes fraction were the major volatile components in both varieties, being significantly superior in the Morisca VOO (Figure 3), especially the hexanal content (related to apple, green, cut grass sensory notes), which average content depending on irrigation treatment and crop season ranged from 0.14 to 0.47 mg/Kg in Cornicabra VOO and from 1.33 to 3.19 mg/Kg in Morisca samples (Table 5). In a similar way, the C6 alcohols concentration was higher in Morisca oils, specially the hexan-1-ol (fruity, grassy and soft sensory notes), which content varied between 0.02-0.34 mg/Kg in Cornicabra VOO, and between 0.23-1.70 mg/Kg in Morisca oils (Tab. 5). As regards C6 esters such as hexyl-acetate and Z-3-hexenyl-acetate (also related with sweet, fruity and green leaves notes), these were present in very small amounts in Cornicabra VOO, indicating a little activity of the alcohol acyl transferase (AAT) in this cultivar, contrariwise the virgin olive oils from Morisca variety contained much higher quantities of these volatiles. Hence, according to the different volatile profiles reported, virgin olive oils from Morisca cultivar are characterized by significantly higher levels of green and fruity notes than Cornicabra ones. Although the volatile composition in each variety was also affected by the seasonal factor, there were similar and clear changes in volatiles that can be attributed to the different irrigation practices studied. Hence, in both cultivars, the volatile compounds most affected by the water status of olive trees were mainly hexanal, E-2-hexenal and hexan-1-ol, showing an inverse relationship with the water stress integral observed in the plants (Table 1), thus the volatile composition of VOO from the SWP -2.0 treatment was clearly inferior to VOO obtained under the other irrigation strategies which showed similar water status in many occasions, with the exception of 2006/07 season, when water status of Cornicabra olive trees from SWP -2.0 and TDF schedules were similar (SΨ (SΨ229-277): 199.8 (84.9) and 172.1 (81.5) MPa x day, respectively for both irrigation treatments) and therefore the volatile profiles of these virgin olive oils were also alike. Similar trends in C6 aldehydes and alcohols were reported by Gómez-Rico et al. (2006) and Servili et al. (2007) in Cornicabra cv. and Leccino cv. under different irrigation strategies. Hence, independently of other aspects, such as olive cultivar and growing season, VOO obtained from olive trees under low water stress conditions are characterized by higher “green” sensory notes than those from rainfed or stressful situations; being a helpful factor in olive cultivars usually typified by a low content in volatiles from the LOX pathway, like the Cornicabra VOO. The main C5 volatile compounds found in both varieties and generated by an additional branch of the LOX pathway from the linolenic acid (Angerosa, Mostallino, Basti & Vito, 2000), were the 1penten-3-ol and 1-penten-3-one, which are also related with sweet, green and wet earth odour notes in virgin olive oils. Similar values for 1-penten-3-ol and 1-penten-3-one were reported in both cultivars, ranging between 0.11-0.35 mg/Kg and 0.10-0.44 mg/Kg, respectively, in Cornicabra VOO along the successive growing seasons and between 0.14-0.30 mg/Kg and 0.17- 129 Artículo IV 0.72 mg/Kg, respectively, in Morisca VOO (Table 5). Their content was affected mainly by the seasonal and ripening factors, whereas no clear significantly differences were attributed to the irrigation practices. Conclusions According to the results obtained in this study, where similar irrigation strategies were used in two different Spanish olive cultivars (Cornicabra cv. and Morisca cv.) during two crop seasons, it can be concluded that the composition and quality of the olive drupe and of the virgin olive oils, especially related to phenolic and volatile profiles, depend greatly not only on the water status of the young olive trees and, moreover, of critical decreases in the water potential of the plant which probably can be occurred during the phenological stage III, when begins the oil accumulation in the fruit. It was further observed that the irrigation schedule based on the stem water potential measure, with a threshold around -1.2 MPa (SWP -1.2), provided VOO in both cultivars with a similar phenolic and volatile composition with respect to those obtained with the FAO treatment, since the water status measured in olive trees were alike. The use of this type of measurement can be proposed, as an alternative of the ETc parameter, for the scheduling of irrigation treatments. On the contrary, the treatment based on the daily trunk diameter fluctuations (TDF) provided VOO with a minor composition similar to FAO or SWP -2.0 strategies, depending on the water status generated in the olive trees in the successive growing seasons and conflicting results were reported between Cornicabra and Morisca cultivars; thereby, volatile and phenolic profiles of TDF Cornicabra VOO were similar to FAO in 2005 and alike to SWP -2.0 in 2006, since the water stress generated in Cornicabra trees was quite different in both seasons (SΨ229-277: 28.8 and 81.5 MPa x day, respectively). In the same way, Morisca VOO from TDF treatment had a minor composition comparable to FAO or SWP -1.2 in 2006 and more similar to SWP -2.0 in 2007, despite the water status reached in both periods was alike (SΨ229-277: 38.9 and 48.5 MPa x day, respectively), but during 2007, great punctual decreases in the water potential of the trees, similar to SWP -2.0, were produced. References Angerosa, F., Basti, C. & Vito, R. (1999). Virgin olive oil volatile compounds from lipoxigenase pathway and characterization of some Italian cultivars. Journal of Agricultural and Food Chemistry, 47, 836-839. Angerosa, F., Mostallino, R., Basti, C. & Vito, R. (2000). Virgin olive oil odour notes: their relationship with volatile compounds from the lipoxygenase pathway and secoiridoid compounds. Food Chemistry, 68, 283-287. Angerosa, F. (2002). Influence of volatile compounds on virgin olive oil quality evaluated by analytical approaches and sensor panels. Journal of Lipid Science and Technology, 104, nº 9-10, 639-660. 130 Artículo IV Aparicio, R. & Luna, G. (2002). Characterisation of monovarietal virgin olive oil. European Journal Lipid Science and Technology, 104, 614-627. Baldioli, M., Servili, M., Peretti, G. & Montedoro, G.F. (1996). Antioxidant activity of tocopherols and phenolic compounds of virgin olive oil. Journal of the American Oil Chemist Society, 73, 1589-1593. Beede, R.H. & Goldhamer, D.A. (1994). Olive Irrigation Management. In: Olive Production Manual. (Eds: Ferguson,L, Sibetti,GS; Martin,GC), University of California, Oakland, 61-68. Berenguer, M.J., Vossen, P.M., Grattan, S.R., Connell, J.H. & Polito, V.S. (2006). Tree irrigation levels for optimum chemical and sensory properties of olive oil. Horticultural Science, 41, 427-432. Doorenbos, J. & Pruitt, WO. (1977). Crop water requirements. FAO Irrigation and drainage paper No. 24. Food and Agriculture Organization of the United Nations, Roma. European Union Commission. (1991). Regulation EEC 2568/91 on the Characteristics of Olive Oils and their Analytical Methods. Official Journal of European Communities. European Union Commission. (2002). Regulation EC 796/2002. Official Journal of European Communities. Fereres, E. & Goldhamer, D. (1990). Deciduous fruit and nut trees. In: Stewart, B.A., Nielsen, B.A., D.R., (Eds.), Irrigation of Agricultural Crops. Agronomy Monograph No. 30. American Society of Agronomy, U.S.A, pp. 987-1017. Fereres, E., Goldhamer, D.A. & Parsons, L.R. (2003). Irrigation water management of horticultural crops. Horticultural Science, 38, 1036-1042. Gennaro, L., Piciola Bocca, A., Modesti, D., Masella, R. & Coni, E. (1998). Effect of biophenols on olive oil stability evaluated by thermogravimetric analysis. Journal of Agricultural and Food Chemistry, 46, 44654469. Goldhamer, D.A. & Fereres, E. (2001). Irrigation scheduling protocols using continuously recorded trunk diameter measurements. Irrigation Science, 20, 115-125. Gómez-Rico, A., Salvador, M.D., La Greca, M. & Fregapane, G. (2006). Phenolic and volatile compounds of extra virgin olive oil (Olea europaea L. Cv. Cornicabra) with regard to fruit ripening and irrigation management. Journal of Agricultural and Food Chemistry, 54, 7130-7136. Gómez-Rico, A., Salvador, M.D., Moriana, A., Pérez, D., Olmedilla, N., Ribas, F. & Fregapane, G. (2007). Influence of different irrigation strategies in a traditional Cornicabra cv. olive orchard on virgin olive oil composition and quality. Food Chemistry, 100, 568-578. Gómez-Rico, A., Fregapane, G. & Salvador M.D. (2008). Effect of cultivar and ripening on minor components in Spanish olive fruits and their corresponding virgin olive oils. Food Research International, 41, 433-440. Gucci, R., Lodolini, E. & Rapaport, H.F. (2007). Productivity of olive tress with different water status and crop load. Journal of Horticultural Science and Biotechnology, 82, 648-656. Gutiérrez-Rosales, F., Perdiguero, S., Gutiérrez, R. & Olías, J.M. (1992). Evaluation of bitter taste in virgin olive oil. Journal of the American Oil Chemist Society, 69, 394-395. Inglese, P., Barobe, E. & Gullo, G. (1996). The effect of complementary irrigation on fruit growth, ripening pattern and oil characteristics of olive (Olea europaea L.) cv. Carolea. Journal of Horticultural Science, 71, 257-263. IOOC. (1984). Document no 6. International Olive Oil Council, Madrid. Laübli, M.W. & Bruttel, P.A. (1986). Determination of the oxidative stability of fats and oils by the Rancimat method. Journal of the American Oil Chemist Society, 63, 792-795. 131 Artículo IV Mateos, R., Espartero, J.L., Trujillo, M., Ríos, J.J., León-Camacho, M., Alcudia, F. & Cert, A. (2001). Determination of phenols, flavones and lignans in virgin olive oil by solid-phase extraction and highperformance liquid chromatography with diode array ultraviolet detection. Journal of Agricultural and Food Chemistry, 49, 2185-2192. Myers, B.J. (1998). Water stress integral a link between short-term stress and long term growth. Tree Physiology, 4, 315-323. Morales, M.T. & Tsimidou, M. (2000). The role of volatile compounds and polyphenols in olive oil sensory quality. Handbook of Olive Oil: Analysis and properties. Eds. J. Harwood and R. Aparicio, Aspen Publ. Inc. Gaitersburg, Maryland, 393-458. Moriana, A. & Fereres, E. (2002). Plant indicator for scheduling irrigation of young olive trees. Irrigation Science, 21, 83-90. Moriana, A., Orgaz, F., Fereres, E. & Pastor, M. (2003). Yield responses of mature olive orchard to water deficits. Journal of American Society Horticultural Science, 128, 425-431. Moriana, A., Pérez-López, D., Gómez-Rico, A., Salvador, M.D., Olmedilla, N., Ribas, F. & Fregapane, G. (2007). Irrigation scheduling for traditional, low-density olive orchards: Water relations and influence on oil characteristics. Agricultural Water Management, 87, 171-179. Motilva, M.J., Romero M.P., Alegre, S. & Girona, J. (1999). Effect of regulated deficit irrigation in olive oil production and quality. Acta Horticulturae, 474, 377-380. Motilva, M.J., Tovar, M.J., Romero, M.P., Alegre, A. & Girona, J. (2000). Influence of regulated deficit irrigation strategies applied to olive trees (Arbequina cultivar) on oil yield and oil composition during the fruit ripening. Journal of Science and Food Agriculture, 80, 2037-2043. Naor, A. (2003). Practical implications in scheduling irrigation of deciduous trees. 4th International Symposium on Irrigation of Horticultural Crops. Books of Abstracts p 85. Orgaz, F., Fereres, E. (1997). Riego. In: Barranco, D., Fernández Escobar, R., Rallo, L. (Eds.), El cultivo del olivo. Mundiprensa, Madrid, pp. 251–271. Patumi, M., d´Andria, R., Fontanazza, G., Morelli, G., Giori, P. & Sorrentino, G. (1999). Yield and oil quality of intensively trained trees of three cultivars of olive under different irrigation regimes. Journal of Horticultural Science and Biotechnology, 74, 729-737. Patumi, M., d´Andria, R., Marsilio, G., Fontanazza, G., Morelli, G. & Lanza, B. (2002). Olive and olive oil quality after intensive monocone olive growing (Olea europaea L., cv. Kalamata) in different irrigation regimes. Food Chemistry, 77, 27-34. Romero, M.P., Tovar, M.J., Girona, J. & Motilva, M.J. (2002). Changes in the HPLC phenolic profile of virgin olive oil from young trees (Olea europaea L. cv. Arbequina) grown under different deficit irrigation strategies. Journal of Agricultural and Food Chemistry, 50, 5349-5354. Salas, J., Pastor, M., Castro, J. & Vega, V. (1997). Influencia del riego sobre la composición y características organolépticas del aceite de oliva. Grasas y Aceites, 48, 74-82. Sanchez, J. & Harwood, J.L. (2002). Byosinthesis of triacylglycerols and volatiles in olives. European Journal of Lipid Science and Technology, 104, 564-573. Servili, M., Esposto, S., Lodolini, E., Selvaggini, R., Taticchi, A., Urbani, S., Montedoro, G.F., Serravalle, M. & Gucci, R. (2007). Irrigation effects on quality, phenolic composition and selected volatiles of virgin olive oil cv. Leccino. Journal of Agricultural and Food Chemistry, 55, 6609-6618. Tognetti, R., d´Andria, R. & Morelli, G. (2005). The effect of deficit irrigation on seasonal variations of plant water use in Olea europaea L. Plant and Soil, 273, 139-155. 132 Artículo IV Tovar, M.J., Romero, M.P., J. & Motilva M.J. (2001). Changes in the phenolic composition of olive oil from young trees (Olea europaea L. cv. Arbequina) grown under linear irrigation strategies. Journal of Agricultural and Food Chemistry, 49, 5502-5508. Tovar, M.J., Romero, M.P., Alegre, S., Girona, J. & Motilva M.J. (2002). Composition and organoleptic characteristics of oil from Arbequina olive (Olea europaea L.) trees under deficit irrigation. Journal of Science and Food Agriculture, 82, 1755-1763. Tovar, M.J., Romero, M.P., Girona, J. & Motilva. M.J. (2002). L-Phenylalanine ammonia-lyase activity and concentration of phenolics in developing fruit of olive tree (Olea europaea L. cv. Arbequina) grown under different irrigation regimes. Journal of Science and Food Agriculture, 82, 892-898. UNE Spanish Standard (Asociación Española de Normalización y Certificación). (1973) UNE 55032: Fats. Determination of oil grease in total fat matter (Materias grasas. Determinación del contenido en materia grasa total del orujo de aceituna). AENOR, Madrid. Vichi, S., Castellote, A. I., Pizzale, L., Conte, L. S., Buxaderas, S. & Lopez-Tamames, E. (2003). Analysis of virgin olive oil volatile compounds by headspace solid-phase microextraction coupled to gas chromatography with mass spectrometric and flame ionisation detection. Journal of Chromatography A, 983, 19-33. 133 Artículo V Effect of malaxation conditions on phenolic and volatile profiles of olive paste and their corresponding virgin olive oils (Olea europaea L. cv. Cornicabra) (Submitted to Journal of Agricultural and Food Chemistry) Aurora Gómez-Rico†, Antonio M. Inarejos-García†, M. Desamparados Salvador† & Giuseppe Fregapane*‡ † Departamento de Química Analítica y Tecnología de los Alimentos, Universidad de Castilla-La Mancha, España ‡ Instituto Regional de Investigación Científica Aplicada (IRICA), Universidad de Castilla-La Mancha, España --------------------------------------------------------------------------------------------------------------------------------ABSTRACT Malaxation of the olive paste must be considered much more than a simple physical separation, since a complex bioprocess takes place, which is very relevant to the final product quality and composition. A combined study of the effect of the kneading temperature and time on the minor composition of the olive paste and its corresponding virgin olive oil, processed in an experimental oil mill (Pieralisi, Fattoria) with a working capacity of 200 kg/h, is reported. A great fall in the oleuropein content in the olive paste with respect to the initial content in the olive fruit (between 91.5% and 96.7%) was observed, which supposed its almost total degradation during the crushing operation. The major phenolic compound found in the olive paste during kneading was the 3,4-DHPEA-EDA (between 64% and 76% of the initial total phenols content) which greatly decreased during malaxation (from 7100 to 2990 mg/Kg). Moreover, while the oleuropein and the secoiridoid derivatives of hydroxytyrosol values in olive paste decreased increasing the temperature and the kneading time (e.g. close to 40 ºC and 90 minutes), an opposite trend was observed in their corresponding VOO, with a significant increase in the secoiridoids of hydroxytyrosol and tyrosol as the malaxation temperature raised. The content of C6 volatiles in olive paste was great at temperatures close to 20 ºC, especially in the case of the aldehyde E-2hexenal (1.36 ppm of IS), while a fall in the C6 aldehydes in VOO as the malaxation temperature increased was observed, especially in the E-2-hexenal content (about a 30%). In contrast, a significant increase in C6 aldehydes of the oils from the oil mill plant as the malaxation time increased from 30 to 90 minutes, chiefly the E-2-hexenal content (about a 70%) was observed. KEYWORDS: Virgin olive oil; olive paste; phenols; volatiles; malaxation temperature; malaxation time. --------------------------------------------------------------------------------------------------------------------------------135 Artículo V INTRODUCTION As well known the unique sensory profile of extra virgin olive oil is due to the presence of some minor components, chiefly phenolic and volatile compounds (1, 2), which remain in this oil thanks to the use of mechanical processes only for its extraction from the fruit of the olive tree (Olea europaea L.). The fresh and green aroma sensory notes of high quality virgin olive oils are mainly due to the presence of volatiles formed by the lipoxygenase (LOX) pathway from free polyunsaturated fatty acids (3), whereas phenolic compounds affect both the taste, in particular the positive bitterness and pungency organoleptic attributes, and the oxidative stability of the virgin olive oil (4). Phenolics and volatiles are therefore the compounds largely responsible for the flavor of extra virgin olive oils and to a large extent determine the degree of consumer preference for this highly appreciated product. The phenolic and volatile contents and profiles of virgin olive oils depend on both (I) the initial composition characteristics of the olive fruits employed during processing and (II) the technological factors used during the oil mill process, in particular milling and malaxation conditions. Several researches have pointed out the importance of the different virgin olive oil processing stages in the minor composition and changes observed in the final product. Thus the use of mechanical crushers led to a higher phenol extraction from the vegetable tissues than the traditional stone mills (5) and therefore oils with higher antioxidant capacity are obtained (6). Servili et al. (7) also reported changes in the volatile composition and pigment content of the oil in terms of the type of mill employed. Moreover, it is important to remark the great importance of the malaxation process of the olive paste; indeed kneading must be considered much more than a simple physical separation, since a complex bioprocess takes place, which is very relevant to the final product quality and composition. Indeed malaxation conditions have proved to affect not only the oil yield but in particular the composition and quality of the final virgin olive oil. For example higher kneading temperature generally improves phenols content (8) and as a consequence, oxidative stability and bitter taste improve (9), whereas volatile content usually decreases as the kneading temperature increases (8). On the contrary kneading time apparently affects negatively the phenols content, while volatile profile improves its presence in the oil (6, 10-13). However, there have been only a few (14) research projects studying at the same time phenols and volatiles affected by both malaxation temperature and time conditions. In fact, one of the main novelty of this work is to combine these two issues in the study of the minor composition of 136 Artículo V the olive paste as directly related to the minor compounds of the virgin olive oil obtained in an experimental oil mill. The aim of this study was therefore to improve the scientific and technological knowledge on the variables involved in the kneading operation that affects the minor components of the Cornicabra virgin olive. The ultimate goal is to define the optimum kneading conditions in the Cornicabra variety grown in Castilla-La Mancha to be applied by the industrial oil mills of our region. Indeed, proper combined effect of temperature and time conditions during malaxation should be applied to enhance in particular the sensory characteristics and therefore the consumers´ preference of this product. To this end, a continuous experimental virgin olive oil mill plant (Pieralisi, Fattoria) was employed in this study. The olive paste was kneaded at different temperatures (20-40 ºC) and times (30-90 min) both in the pilot plant and in a laboratory scale equipment (Abencor), obtaining a wide matrix of results that cover the range of the real malaxation conditions used by the industry. MATERIAL AND METHODS Experimental oil mill plant. The technological assays were performed using an oil mill plant (Pieralisi, Fattoria) with a working capacity of 200 kg/h olive paste and equipped with an olive washing machine, a hammer crusher, a single-stage kneader, a two-phase horizontal decanter and a vertical centrifuge. Olive paste and virgin olive oil samples. Two different batches of Cornicabra cv. fruit were used, each weighing approximately 1600 kg. The malaxation assays were performed in different temperature (20, 28 and 40 ºC) and time (30 min, 60 min and 90 min) conditions; batches of 200 Kg of fruit were processed in each assay. Also, different assays were performed on the same olive batches using the laboratory scale Abencor system, in order to amplify with the range of temperature-time conditions studied (20, 24, 28, 35 and 40 ºC and 15, 30, 45, 60 and 75 min). All samples were filtered with anhydrous Na2SO4 and stored at 10 ºC in darkness using amber glass bottles without head space prior to analysis. To study the evolution of phenolic and volatile compounds throughout the kneading process, samples of olive paste were collected along this stage at percentile time 25, 50 and 75 for each assay, moreover olive pomace samples were taken to analyse the phenolic composition that remains in the solid phase after centrifugation of the olive paste, all of these were frozen and stored at -70 ºC until analysis. Analytical determinations in olive fruits, olive paste and olive pomace. 137 Artículo V Water and oil content. The water content of olive fruit was determined by desiccation according to the UNE Spanish standard method. The fat content was determined by Soxhlet extraction and was expressed as a percentage of dry olive paste weight (15). Phenolic compounds. A sample of olive pulp, olive paste or olive pomace (4.0 g) was homogenised with a mixture of methanol:water (80:20 v/v) (40 ml) during 2 min with an Ultraturrax homogenizer (14000 rpm). The suspension obtained was shaken (20 min, 150 rpm, <4 ºC in darkness), and then centrifuged (10 min, 5000 rpm and 4 ºC). The hydromethanolic phase was recovered and filtered with a 0.45 µm nylon syringe filter. The phenolic fraction extracted was analysed by high-performance liquid chromatography (HPLC) using an Agilent Technologies 1100 series system equipped with an automatic injector, a column oven and a diode array UV detector. A ZORBAX SB-C18 column (250 x 4.6 id mm, 5 µm particle size) (Agilent Technologies, USA), maintained at 30 ºC, was used with an injection volume of 20 µl and a flow rate of 1.0 ml/min. Mobile phase was a mixture of water/acetic acid (95:5 v/v) (solvent A), methanol (B) and acetonitrile (C): from 95% (A)-2.5% (B)- 2.5% (C) to 34% (A)-33% (B)-33% (C) in 50 min. Chromatograms were recorded at 280 nm, 340 nm and 520 nm. The hydroxytyrosol, oleuropein, demethyloleuropein from olive fruit and secoiridoids of hydroxytyrosol and tyrosol from the olive paste and pomace were quantified at 280 nm, the anthocyanins at 520 nm and the verbascoside and flavonoids at 340 nm. Phenolic compounds quantification was achieved by a minimum of five point calibration curve on the basis of the corresponding standard substances, with the exception of hydroxytyrosol which was quantified as tyrosol, and demethyloleuropein, anthocyanins from olive fruit and secoiridoids of hydroxytyrosol and tyrosol from the olive paste and pomace as oleuropein. The identification of non-coloured phenolic compounds was carried out by comparison of their retention times, UV-Visible characteristics and MS spectra with their standard substances. In the case of the anthocyanins and demethyloleuropein, these were tentatively identified by their UVVisible characteristics and MS spectra. The mass detector used was a LCQ Deca XP Plus (Thermo Electron Corporation, Waltham, MA, USA) equipped with an electrospray ionisation system. Nitrogen was used as nebulizing gas at a flow rate of 14 units. The temperature and voltage of the capillary were 250 ºC and 4.50 kV, respectively. Data were acquired in the negative ionisation mode. Fragmentation experiments were performed using helium as the collision gas with collision energy between 30-40%. Volatile compounds ﴾adapted from Vichi et al. (16)﴿. Solid phase microextraction (SPME) followed by GC-FID were used to analyze the volatiles compounds in the olive paste samples studied. 1.5 g of olive paste was placed in a 10 ml vial fitted with silicone septum. The SPME sampling was performed by exposing the DVB/Carboxen/PDMS fiber (50/30 µm, 2 cm long from Supelco Inc., Bellefonte, USA) for 30 min in the headspace of the sample maintained at 40 ºC 138 Artículo V and then retracted into the needle and immediately transferred and desorbed for 5 min in the injection port of a gas chromatograph equipped with an FID. Compounds were resolved on a Supelcowax-10 column (30 m x 0.25 mm x 0.25 µm, Supelco Inc., Bellefonte, USA) under the following conditions: injection port temperature 260 ºC; helium flow 0.8 ml/min; oven temperature ramp: 35 ºC for 10 min, 3 ºC/min up to 160 ºC and then 15 ºC/min up to 200 ºC (maintained for 5 min). Volatile compounds were identified by comparison of retention times and mass spectra of standard substances (Sigma Aldrich) added to refined olive oil. The equipment used was an Agilent 5975C Series mass spectrometer (Agilent Technologies, USA) equipped with an electron ionisation (EI+) detector and coupled to an Agilent 6850 Series gas chromatograph, the capillary column used was a DB-Wax (30 m x 0.25 mm x 0.25 µm, J&W Scientific, USA). Helium was employed as carrier gas at a flow rate of 0.8 ml/min. The transfer line temperature was 280 ºC and the temperature of the ionisation source and the quadrupole were 230 ºC and 150 ºC, respectively, with an electromultiplier voltage of +941 eV. Their quantification was achieved by a minimum of five point calibration curve on the basis of the corresponding standard substances. Analytical determinations in virgin olive oil. All reagents used were of analytical, HPLC or spectroscopic grade, and were supplied by Merck (Darmstadt, Germany). Phenolic compounds. A solution of the internal standard (250 µl of 15 mg/kg of syringic acid in methanol) was added to a sample of virgin olive oil (2.5 g) and the solvent was evaporated with a rotary evaporator at 35 ºC under vacuum. The oil was then dissolved in 6 ml of hexane and a diol-bonded phase cartridge (Supelco Co., Bellefonte, USA) was used to extract the phenolic fraction. The cartridge was conditioned with methanol (6 ml) and hexane (6 ml), the oil solution was then applied, and the SPE column was washed with hexane (2 x 3 ml) and with hexane/ethyl acetate (85:15, v/v; 4 ml). Finally, the phenols were eluted with methanol (15 ml) and the solvent was removed with a rotary evaporator at 35 ºC under vacuum until dryness. The phenolic residue was dissolved in methanol/water (1:1 v/v; 250 µl) and analysed by HPLC. Chromatographic conditions were the same as those used with the olive pulp and olive pomace phenolic fractions. Phenolic compounds were quantified at 280 nm using syringic acid as internal standard and the response factors determined by Mateos et al. (17). Oleocanthal. Oleocanthal was extracted by liquid-liquid extraction following the method developed by Impellizzeri et al. (18). A solution of the internal standard (250 µl of 200 mg/kg of 3,5-dimethoxyphenol in methanol) was added to a sample of virgin olive oil (1.0 g) and the solvent was evaporated with a rotary evaporator at 35 ºC under vacuum. The oil was then dissolved in 2 ml of hexane and transferred to a centrifuge tube (15 ml). The tube was shaken for 15 s twice, then 5 ml of acetonitrile was added, followed by shaken the tube twice for 15 s. The 139 Artículo V tube was centrifuged at 4000 rpm for 5 min to separate the solvent from the oil phase, and the solvent extract was collected in another centrifuge tube. Each sample was extracted three times in this way, and the solvent of the combined extract was removed with a N2 stream. The residue of the extract was dissolved with 1 ml of methanol:water (1/1, v/v). Hexane (1 ml) was added to the solution to wash away any remaining oil, this procedure was carried out three times. The tube was centrifuged and the methanolic phase was recovered. The fraction extracted was analysed by HPLC using an Agilent Technologies 1100 series system equipped with an automatic injector, a column oven and a diode array UV detector. A ZORBAX SB-C18 column (250 x 4.6 id mm, 5 µm particle size) (Agilent Technologies, USA), maintained at 25 ºC, was used with an injection volume of 20 µl and a flow rate of 1.0 ml/min. Mobile phase was a mixture of acetonitrile (A) and water (B): from 25% (A)- 75% (B) for 35 min to 80% (A)20% (B) in 0.01 min during 10 min and returned to the initial conditions in 0.01 min. Oleocanthal was quantified at 280 nm using 3,5-dimethoxyphenol as internal standard. Volatile compounds. Solid phase microextraction (SPME) followed by GC-FID were used to analyze the volatile compounds in the virgin olive oil samples studied. 1,5 g of olive oil was placed in a 10 ml vial fitted with silicone septum. The SPME sampling and CG-FID conditions, as well as identification and quantification of volatiles, were the same as those used with the olive paste volatile fraction. All experiments and analytical determinations were carried out at least in duplicate. Statistical Analysis. Statistical analyses were performed using SPSS 15 statistical software (SPSS Inc., Chicago, IL). RESULTS AND DISCUSSION Evolution in olive paste biophenols during malaxation The initial characteristics of the two batches of Cornicabra olive fruit employed in this assay are reported in Table 1, it shows a similar composition with respect to oil yield, humidity, dry matter and phenolic compounds of batch I and II, with the exception of the oleuropein content, which was about 20% superior in the batch I. It is well known that this oleoside is by far the most abundant biophenol in the olive fruit (19-21) and the mainly precursor of the phenolic compounds present in virgin olive oil (22). Furthermore, Table 1 also reports the phenolic composition of the olive paste obtained just after the crushing stage; showing the greater fall detected in the oleuropein content in the olive paste 140 Artículo V with respect to the original content in the olive fruit (between 91.5% and 96.7%), which supposed almost its total degradation during the crushing stage (t=0 in Tab. 1). This was probably due by the activity of the β-glucosidase enzyme, so it is accepted its activation during the crushing step and moreover this activity is confirmed by the presence in the olive paste of the different secoiridoid derivatives. Table 1. Olive fruit and olive paste initial composition of the two Cornicabra cv. batches employed. BATCH I BATCH II Ripeness Index 4.5 ±0.3 4.7 ±0.2 Oil yield (%, FW) 24.6 ±0.4 28.4 ±0.3 Humidity (%) 39.8 ±0.8 37.5 ±0.7 Phenolic compounds (mg/Kg) FRUIT PASTE t=0 FRUIT PASTE t=0 Oleuropein 14043 ±209 1187±25 11924 ±639 392 ±17 Demethyloleuropein nd nd nd nd Hydroxytyrosol 203 ±45 165 ±1 204 ±22 211 ±2 3,4-DHPEA-EDA nd 8201±26 nd 6010±38 3,4-DHPEA-EA nd 488 ±5 nd 442 ±3 Tyrosol nd nd nd nd p-HPEA-EDA nd 476 ±5 nd 498 ±6 p-HPEA-EA nd 66 ±1 nd 40 ±1 Verbascoside 131 ±5 115 ±3 63 ±7 55 ±2 Rutin 343 ±7 150 ±2 331 ±12 111 ±2 Luteolin-7-O-glucoside 319 ±86 115 ±2 352 ±48 94 ±3 Apigenin-7-O-glucoside 69 ±11 50 ±3 63 ±9 59 ±1 nd, not detected. t=0, olive paste obtained just after crushing. The values of the individual phenols of the olive paste from the different kneading conditions studied in the oil mill plant are shown in Table 2 and 3. As expected phenolic compounds found in the olive paste were a mixture of the phenols found in the olive fruit of origin and in final virgin olive oil. Relating to secoiridoid compounds, it is important to note the fairly decrease of the oleuropein during the malaxation process (from 790 mg/Kg to 270 mg/Kg, as average between batch I and II; Tab. 2 and 3), surely due by the action of the β-glucosidase, which degradation activity continued along the kneading of olive paste, a similar trend was reported by Artajo et al. (23). The major phenolic compound found in the olive paste during kneading phase was the dialdehydic form of elenolic acid linked to hydroxytyrosol (3,4-DHPEA-EDA), which content was between 64% and 76% of the initial total phenols and 141 Artículo V greatly decreased during malaxation (from 7100 mg/Kg to 2990 mg/Kg, as average between batch I and II; Tab. 2 and 3), probably due to the activity of oxidative enzymes, like the polyphenoloxidase (PPO), peroxidase (POD) or lipoxygenase (LOX) (24). In contrast, the other secoiridoid derivatives determined in the olive paste showed values much lower (among 5.49.5% of the initial total phenols for the 3,4-DHPEA-EA, 5.9-13.8% for the p-HPEA-EDA and 0.40.7% for the p-HPEA-EA) and did not clearly change along kneading stage, excepting the slightly decrease of the 3,4-DHPEA-EA. Table 2. Phenolic content in olive paste in relation to malaxation temperature (kneading time 60 minutes). OLIVE PASTE 20 ºC P25 P50 28 ºC P75 P25 40ºC P50 P75 P25 P50 P75 Phenolic alcohol 3,4-DHPEA p-HPEA I II I II 212 ±1 c,w 225 ±2 c,w 233 ±2 c,x 241 ±2 c,x I II I II 584 ±9 c,y 421 ±8 c,y I II I II I II I II I II 5575±8 b,y 5393±8 b,y 4792±8 b,w 526 ±3 c,y 432 ±6 I II I II I 141 ±2 248 ±3 242 ±2 c,y c,x 181 ±1 b,w 146 ±1 a,w 189 ±3 b,x 186 ±3 a,x 201 ±3 b,y 237 ±3 b,y 159 ±2 a,w 196 ±3 b,x 172 ±8 a,x 197 ±1 b,x 182 ±3 172 ±2 nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd a,y a,w Secoiridoids Oleuropein Ligstroside 408 ±9 c,x 393 ±6 c,x 372 ±9 b,w 375 ±7 b,w 418 ±4 312 ±8 a,x a,w 383 ±7 b,w 293 ±8 a,w 371 ±6 b,w 288 ±9 a,w 468 ±9 b,x 386 ±4 b,x 316 ±5 a,w 323 ±2 a,w 315 ±7 b,w 307 ±3 b,w nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd Secoiridoid Der. 3,4-DHPEA-EDA 3,4-DHPEA-EA p-HPEA-EDA p-HPEA-EA Verbascoside 513 ±4 470 ±5 433 ±3 a,w 456 ±6 28 ±1 b,w 44 ±1 b,x 123 ±3 55 ±2 a,x b,w a,w 5180±7 b,x 3951±6 c,x 516 ±3 450 ±2 a,x 42 ±1 b,x 39 ±1 b,x 57 ±3 b,w b,x a,x 126 ±2 4580±6 c,x b,w a,w 6193±14 c,w 3568±5 512 ±5 c,w 468 ±2 423 ±5 c,w 519 ±9 445 ±5 38 ±1 30 ±1 a,x a,w a,x a,w 125 ±3 58 ±2 a,w a,w c,y 5310±10 a,y 3458±7 a,x 345 ±5 a,w 582 ±4 b,w 474 ±8 a,w 43 ±2 26 ±2 c,x a,w 112 ±3 56 ±2 a,w a,w c,x 4430±9 a,y b,w 3598±6 a,x 3966±6 a,w 574 ±2 c,y 465 ±5 b,y 413 ±5 b,y 395 ±4 4710±5 a,x 3339±7 461 ±2 a,x 445 ±4 382 ±1 a,x 400 ±3 582 ±9 b,w 526 ±7 b,x 40 ±3 b,w 29 ±2 a,w 118 ±7 58 ±4 a,w a,w 593 ±7 b,w 528 ±9 40 ±1 b,x a,w 33 ±2 a,x 123 ±5 56 ±3 c,w a,x a,w 574 ±3 b,w 703 ±7 b,w 16 ±2 a,w 50 ±2 c,x 115 ±3 55 ±4 a,w a,w 4256±7 a,w 4321±8 b,y 3053±9 a,w 493 ±3 b,x 367 ±3 674 ±4 c,x 721 ±5 732 ±9 c,x 24 ±2 a,x 45 ±2 c,x 121 ±2 a,x 31 ±1 b,x a,w 710 ±9 45 ±1 a,x a,w c,y c,w b,y a,w 127 ±3 a,x 57 ±1 a,w 58 ±2 a,w a,w 99 ±1 a,w 97 ±1 a,w a,x 100 ±1 a,w 94 ±2 a,w 107 ±2 b,w 111 ±2 a,w c,w 114 ±3 b,w Flavonoids Rutin Luteolin-7-O-G Apigenin-7-O-G II c,w 139 ±2 b,x 138 ±2 135 ±1 97 ±3 a,w 89 ±1 a,w 56 ±1 a,w 55 ±2 a,w 101 ±1 c,w 139 ±2 c,w 112 ±2 b,w 111 ±3 b,w 109 ±2 b,w 102 ±2 c,x 126 ±2 c,w 105 ±3 a,w 108 ±2 b,w 106 ±3 b,w 108 ±2 108 ±2 b,w 111 ±3 b,w 100 ±2 b,w a,w 95 ±2 a,x 58 ±2 a,w 57 ±1 a,w 108 ±2 a,x 96 ±1 a,x 54 ±2 a,w 60 ±1 a,w 102 ±2 55 ±4 b,x a,w 60 ±2 a,x 56 ±3 a,w 58 ±2 a,x 116 ±3 b,x 98 ±1 a,w 57 ±3 a,w 50 ±3 a,w 107 ±3 b,w 116 ±9 c,w 57 ±2 a,w 59 ±2 a,w 111 ±2 53 ±1 a,w 50 ±4 a,w 57 ±1 a,w 58 ±2 a,w Different letters within a column (a-c) indicate significant differences (p<0.05) with respect to malaxation temperature in olive paste. Different letters within a column (w-y) indicate significant differences (p<0.05) with respect to olive paste at different stages of malaxation process (P25, P50 and P75). nd, not detected. 142 Artículo V Table 3. Phenolic content in olive paste in relation to malaxation temperature (kneading temperature 28 ºC). OLIVE PASTE 30 min P25 P50 60 min P75 P25 P50 90 min P75 P25 P50 P75 Phenolic alcohol 3,4-DHPEA p-HPEA I II I II 165 ±1 b,w 211 ±2 b,w I II I II 1187±5 I II I II I II I II I II 8201±6 c,y 7816±9 c,x 6379±8 c,w 6193±14 6010±8 c,y 4749±8 c,x 4187±9 c,w 3568±5 I II I II I II 150 ±2 b,y 111 ±2 b,x 163 ±2 a,w 210 ±2 c,w 176 ±2 a,x 234 ±2 a,x 181 ±1 146 ±1 c,w a,w 189 ±3 b,x 186 ±3 b,x 201 ±3 237 ±3 c,y a,y 156 ±2 a,w 224 ±2 c,x b,x 181 ±2 b,x a,w 258 ±3 b,y 186 ±3 175 ±3 nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd Secoiridoids Oleuropein Ligstroside 392 ±7 b,y b,y 714 ±8 c,x 335 ±7 c,x 471 ±9 260 ±7 c,w b,w 418 ±4 312 ±8 a,x a,w 383 ±7 a,w 293 ±8 b,w 371 ±6 b,w 288 ±9 b,w 406 ±9 a,x 299 ±2 a,y 407 ±3 b,x 318 ±2 a,w 245 ±3 a,x 227 ±3 a,w nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd nd Secoiridoid Der. 3,4-DHPEA-EDA 3,4-DHPEA-EA p-HPEA-EDA p-HPEA-EA Verbascoside 488 ±5 c,w 487 ±3 b,x 472 ±7 442 ±3 476 ±5 a,w 498 ±6 b,w 66 ±1 40 ±1 b,y b,w 115 ±3 55 ±2 a,w a,w c,w c,x 503 ±4 c,y 424 ±2 468 ±2 c,w 501± 9 a,x 560 ±5 a,y 515 ±7 a,x 524 ±2 a,y 50 ±2 39 ±1 c,x c,w 119 ±2 56 ±1 a,w a,w 46 ±1 c,w 40 ±1 c,w 121 ±2 59 ±2 a,w a,w b,y b,y 5310±10 3458±7 b,x 345 ±5 a,w 582 ±4 b,w 582 ±9 474 ±8 a,w 526 ±7 43 ±2 26 ±2 a,x a,w 112 ±3 56 ±2 a,w a,w a,x b,x 4710±5 b,w 5596±8 a,y 5486±9 b,x 3905±8 a,w 3339±7 b,w 3379±5 a,y 2684±9 a,x 2083±5 a,w 461 ±2 b,x 445 ±4 382 ±1 b,x 400 ±3 442 ±4 b,y 448 ±2 457 ±2 c,y 310 ±2 b,w 678 ±7 c,x 660 ±9 a,x 523 ±9 b,w 581 ±4 593 ±7 a,x 528 ±9 40 ±3 29 ±2 b,w 58 ±4 a,x b,w a,w 118 ±7 b,w a,w a,w 40 ±1 b,w 33 ±2 b,x 123 ±5 56 ±3 a,x a,w 40 ±1 a,w 24 ±1 a,w 113 ±2 56 ±1 a,w a,w a,w 363 ±5 c,x 637 ±9 b,x 589 ±9 37 ±2 a,w 29 ±2 115 ±3 55 ±2 355 ±4 a,w b,x 44 ±1 21 ±2 a,x a,w a,w b,x a,w a,x 119 ±2 58 ±1 a,x c,w a,w a,w Flavonoids Rutin Luteolin-7-O-G Apigenin-7-O-G 115 ±2 b,w 94 ±3 a,w 50 ±3 a,w 59 ±1 a,x 141 ±2 b,x 120 ±2 c,y 118 ±2 b,x 111 ±1 b,y 52 ±2 a,w 57 ±3 a,x 127 ±2 106 ±2 c,w a,w 118 ±1 a,x 105 ±2 b,x 57 ±1 51 ±2 a,x a,w 112 ±2 a,w 105 ±3 a,w 108 ±2 a,w 102 ±2 55 ±4 b,x a,w 60 ±2 a,x 111 ±3 a,w 108 ±2 b,w 111 ±3 a,w 100 ±2 a,w 56 ±3 a,w 58 ±2 a,x 109 ±2 b,w 106 ±3 a,w 116 ±3 a,x 98 ±1 a,w 57 ±3 a,w 50 ±3 a,w 108 ±2 a,x 108 ±2 a,x 112 ±2 b,w 101 ±1 b,w 53 ±2 a,w 55 ±3 a,w a,x 101 ±2 a,w 108 ±2 a,x b,x 116 ±2 a,x a,w 108 ±2 b,x 109 ±2 103 ±2 115 ±2 100 ±1 55 ±2 a,w 56 ±1 54 ±2 a,w 55±2 Different letters within a column (a-c) indicate significant differences (p<0.05) with respect to malaxation time in olive paste. Different letters within a column (w-y) indicate significant differences (p<0.05) with respect to olive paste at different stages of malaxation process. nd, not detected. Figure 1 clearly depicts these trends along the malaxation process, being the secoiridoids of hydroxytyrosol, especially the 3,4-DHPEA-EDA, the phenolic compounds in olive paste most affected by time during the kneading stage. On the contrary, statistical significant increases were reported for the phenolic alcohol 3,4-DHPEA (tab. 2) along the malaxation process, due to the hydrolysis of the secoiridoids derivatives, whereas the presence of p-HPEA was not detected in the olive paste. It is important to remark the well-known hydrophilic character of these simple phenols and their secoiridoids derivatives, which was clearly observed by the higher values found in the wet pomace, specially for the 3,4-DHPEA-EDA (data not shown). Concerning the concentration of verbascoside and flavonoids, like rutin, luteolin-7-O-glucoside and apigenin-7-O143 a,w a,w a,w Artículo V glucoside, did not vary with time along the malaxation process and remained in the wet pomace (data not shown), thus indicate the retention of this complex compounds in the solid phases, alike Phenol Content (mg/Kg of oleuropein) results were described by Artajo et al. (23). 8000 6000 4000 2000 1000 750 500 250 0 20 40 60 80 100 Olive Paste Kneading Time (min) Figure 1. Evolution of oleuropein and secoiridoids forms of hydroxytyrosol and tyrosol in the olive paste during the malaxation process. , oleuropein; {, secoiridoids of hydroxytyrosol; U, secoiridoids of tyrosol As for as the combined effect of kneading temperature and time on the phenolic composition of olive paste, it could be seen that oleuropein and the secoiridoid derivatives of hydroxytyrosol (3,4-DHPEA-EDA and 3,4-DHPEA-EA) values decreased at temperature close to 40 ºC and time nearby 90 minutes, whereas p-HPEA-EDA content showed an opposite trend (Table 2 and 3); these details confirm the considerable oxidative degradation, as chemical as enzymatic, of compounds with o-diphenolic structure. Since, it is known that LOX acts catalysing the formation of hydroperoxides and could be implied in the indirect oxidation of the o-diphenols (11), which are characterised by a higher antioxidant capacity. On the other hand, PPO from the olive fruit possesses a higher affinity by the o-diphenols than monophenols, which are practically not affected by this enzyme (25), insomuch, it was active on the secoiridoids derivatives of hydroxytyrosol, yielding the decrease of these compounds as the malaxation time and temperature of the olive paste increased. In contrast, the verbascoside and flavonoids content were not visibly affected by the processing temperature and time. Effect on virgin olive oil phenols Figures 2a and 2b depict the effect of kneading temperature and time on the secoiridoid forms of hydroxytyrosol and tyrosol in the virgin olive oils obtained in the experimental oil mill plant. 144 Artículo V 2,5 2,5 2b 2a 2,0 Normalized values Normalized values 2,0 1,5 1,0 1,5 1,0 0,5 0,5 0,0 0,0 20 30 Kneading Temperature (ºC) 40 30 60 90 Kneading Time (min) Figure 2. Oil mill plant VOO phenolic profile as affected by the malaxation temperature (2a) and time (2b). , hydroxytyrosol; , secoiridoids of hydroxytyrosol; S, tyrosol; U, secoiridoids of tyrosol; {, total phenols As concerned the effect of malaxation temperature, a significant increase in the secoiridoids of hydroxytyrosol and tyrosol as the malaxation temperature raised was observed; in particular, the 3,4-DHPEA-EDA content rose between 220% and 630% in the two batches studied in the oil mill between 20 and 40 ºC (individual data not shown). This trend was opposite to that observed in the olive paste, probably due to the fact that higher kneading temperature implied a rise in the partition coefficient of phenolic compounds between the oil and water phases of the olive paste, which supposed an increase in the phenolic content in the virgin olive oil obtained (26), despite the phenolic content in olive paste was inferior as the malaxation temperature increased. Other investigations performed in industrial olive oil mills found similar trends to ours (8, 27). Similar behaviours in the phenol content were observed in virgin olive oil samples obtained at different malaxation temperatures with the laboratory scale Abencor system (see Figure 3a), concerning to the significant increase of the secoiridoids derivatives with the temperature, mainly 3,4-DHPEA-EDA (300% as average between batch I and II) and p-HPEA-EDA (110%, as average), however other works carried out in small laboratory set ups (10, 28) reported a decrease in the phenol content of the oil as the kneading temperature of the olive paste increased. On the other hand, as the malaxation time increased, it was observed a tiny diminish of the derivatives secoiridoids of hydroxytyrosol content of about a 5%, whereas the content of secoiridoids of tyrosol increased between 15 and 20% in the oil mill plant (Figure 2b), these trends were similar to those observed in the olive paste. Similar results were found by Di 145 Artículo V Giovacchino et al. (6), Angerosa et al. (10) and Lercker et al. (12). Moreover, these tendencies were also observed in the oils from the Abencor system, although the decrease in the derivatives of hydroxytyrosol and the increase in those from the tyrosol were somehow superior, 45% and 50%, respectively, as average between batch I and II (Figure 3b). 2,5 2,5 3b 3a 2,0 Normalized values Normalized values 2,0 1,5 1,0 0,5 1,5 1,0 0,5 0,0 0,0 20 25 30 35 Kneading Temperature (ºC) 40 15 30 45 60 75 Kneading Time (min) Figure 3. Abencor VOO phenolic profile as affected by the malaxation temperature (3a) and time (3b). , hydroxytyrosol; , secoiridoids of hydroxytyrosol; S, tyrosol; U, secoiridoids of tyrosol; {, total phenols As well known, the phenolic compounds affect the sensory properties of the VOO, hence the intensity of sensory pungency is mainly related to p-HPEA-EDA content (29), moreover, recently have been discover the ibuprofen-like activity of the deacetoxy-ligstroside aglycone, re-called oleocanthal (30); thus, it was of special interest to analyse the evolution of this bioactive compound in VOO as affected by kneading conditions. Values about 3.0 times higher in VOO from the oil mill plant by rising malaxation temperature from 20 ºC to 40 ºC and time from 30 min to 90 min (Figure 4a and 4b) were observed, similar trends were noted in the oils obtained with the Abencor system. On the other hand, other secoiridoids, especially 3,4-DHPEA-EDA and 3,4-DHPEA-EA, are associated to the sensory intensity of the bitterness attribute in the virgin olive oil (31), and consequently high levels of these compounds may produce an excessive bitterness that can imply a lower preference of the product. Therefore, the changes reported in the phenolic composition in virgin olive oils depending on the kneading conditions employed, could be very important from the nutritional and sensory point of view in biophenol-rich olive oil varieties, like Cornicabra cultivar, since the control of these technological variables could provide an adequate 146 Artículo V level of phenolic substances in order to improve the nutritional value of the product and, at the same time, the intensity of these positive attributes. 20ºC / 60 min 160 20ºC / 45 min 160 28ºC / 75 min 120 28ºC / 90 min 80 28ºC / 60 min 0 40 28ºC / 45 min 0 28ºC / 45 min 28ºC / 60 min 24ºC / 45 min 80 28ºC / 60 min 40 120 35ºC / 45 min 40ºC / 60 min 28ºC / 30 min 40ºC / 45 min 28ºC / 30 min 28ºC / 15 min 4a 4b Figure 4. Changes in oleocanthal (mg/Kg of IS) in virgin olive oils from the oil mill plant (4a) and Abencor system (4b), as affected by the malaxation temperature and time. , cis-oleocanthal; U, trans-oleocanthal; z, total oleocanthal (cis+trans) Evolution in olive paste volatile compounds during malaxation The content of six-carbon (C6) family of volatile compounds, expressed as mg of volatile compound per Kg of oil, of the olive paste at different stages of the malaxation process from the different kneading temperature-time conditions studied in the oil mill plant are reported in Table 4 and 5. These compounds, which are responsible for the positive green sensory notes in virgin olive oil aroma, are produced through the lipoxygenase (LOX) pathway from the linoleic and linolenic acids and takes place mainly during crushing of the olive fruit, which are then incorporated into the oily phase during the olive paste malaxation (3). As expected, in the olive paste a slight decrease of the C6 aldehydes, mainly hexanal (related to apple and green fruity attributes) and E-2-hexenal (responsible of almond and green sensory notes), after crushing of the olive fruits and the first kneading stage was observed (see time 0 and P25), which is due to their transformation in their respective C6 alcohols, hexan-1-ol, Z-3hexen-1-ol and E-2-hexen-1-ol (related to fruity, green, grassy and sweet notes). On the other hand, the content of these volatiles in the olive paste were not varied significantly along the kneading process (time: see P25, P50 and P75), which could indicate a higher activity levels of the LOX pathway enzymes only during the beginning of this stage. As regards C6 esters, such as hexyl-acetate and Z-3-hexyl-acetate (with sweet, fruity and green leaves sensory notes), were present in very small amounts in olive paste and consecutively in Cornicabra virgin olive oil, indicating that there was also little activity of the enzyme alcohol acyl transferase (AAT), as previously reported for this variety (32). 147 148 0.16±0.02 0.22 ±0.01 b,x 0.57±0.01 <0.01 <0.01 0.63±0.01 0.72±0.02 0.49 ±0.01 <0.01 <0.01 0.65 ±0.01 0.71 ±0.01 2.87±0.02 2.26 ±0.01 1.58 ±0.01 II c,w c,x a,w b,w b,w b,w 1.36±0.02 0.03±0.01 0.03 ±0.01 I 0.03±0.01 0.02 ±0.01 <0.01 0.67±0.01 0.46 ±0.01 <0.01 0.58±0.02 0.38 ±0.01 c,w <0.01 0.66±0.01 1.09 ±0.01 c,w <0.01 2.06±0.01 1.96 ±0.01 c,x c,x b,w 0.44±0.02 0.35 ±0.01 b,w 0.19±0.01 0.32 ±0.02 b,w I II I II I II I II I II I II I II I II P25 c,w c,w c,x 1.40±0.03 c,w c,w a,w a,w b,w b,w 2.66±0.03 <0.01 <0.01 0.03±0.01 0.03±0.01 0.68±0.02 0.60±0.01 0.69±0.01 2.05±0.02 0.70±0.01 c,w b,w b,w b,w b,w 0.58±0.01 <0.01 <0.01 0.58±0.01 0.43±0.01 0.13±0.01 0.16±0.02 P50 20 ºC 1.40±0.01 c,w c,w a,w b,w b,w b,w 2.67±0.01 <0.01 <0.01 0.03±0.01 0.03±0.01 0.69±0.01 0.62±0.01 0.68±0.02 c,w c,w b,w c,y a,w b,w 2.03±0.01 0.66±0.01 c,x b,w 0.71±0.02 <0.01 <0.01 0.57±0.02 0.46±0.01 0.10±0.02 0.26±0.03 P75 1.22±0.01 2.15±0.01 <0.01 <0.01 0.03±0.01 0.02±0.01 0.63±0.01 0.60±0.01 0.56±0.01 1.53±0.01 0.67±0.01 b,w b,w a,w a,w a,w b,w b,w b,w b,w b,y a,w b,w b,w a,w 0.59±0.01 <0.01 <0.01 0.53±0.02 0.46±0.01 0.14±0.01 0.06±0.01 P25 1.22±0.01 2.19±0.03 <0.01 <0.01 0.03±0.01 0.02±0.01 0.63±0.01 b,w b,w a,w a,w a,w c,w b,w b,w b,w b,w a,w 0.62±0.02 0.57±0.02 1.55±0.02 0.66±0.01 0.50±0.03 <0.01 <0.01 0.54±0.01 c,w b,w a,w 0.47±0.02 0.12±0.01 0.04±0.02 P50 28 ºC 1.22±0.02 2.15±0.01 <0.01 <0.01 0.03±0.01 0.02±0.01 0.63±0.01 0.62±0.01 0.56±0.01 1.51±0.01 0.67±0.02 b,w b,w a,w a,w a,w b,w b,w b,w b,w b,x a,w 0.56±0.01 <0.01 <0.01 0.54±0.01 0.46±0.01 c,w b,x b,w 0.14±0.01 0.10±0.01 P75 a,x a,w b,w 1.16±0.01 1.91±0.01 <0.01 <0.01 0.04±0.01 0.02±0.01 a,w c,w a,w a,w a,w a,w a,w 0.73±0.03 0.44±0.01 0.39±0.03 1.45±0.01 0.63±0.01 0.45±0.01 <0.01 <0.01 c,w a,w a,w a,w 0.61±0.01 0.40±0.02 0.02±0.01 0.05±0.01 P25 1.11±0.03 1.92±0.01 <0.01 <0.01 0.04±0.01 0.02±0.01 0.71±0.02 0.44±0.01 0.36±0.01 1.46±0.01 0.59±0.03 0.44±0.02 <0.01 <0.01 0.59±0.02 0.40±0.01 0.01±0.01 0.05±0.02 P50 40ºC a,w a,w a,w a,w b,w a,w a,w a,w a,w a,w b,w a,w a,w a,w a,x a,w a,w 1.16±0.01 1.90±0.02 <0.01 <0.01 0.04±0.01 0.02±0.01 a,w c,x a,w a,w a,w a,w a,w b,w a,w a,w a,x 0.75±0.01 0.43±0.03 0.38±0.01 1.43±0.03 0.63±0.01 0.46±0.01 <0.01 <0.01 0.61±0.03 0.39±0.01 0.02±0.01 0.07±0.01 P75 Different letters within a column (a-c) indicate significant differences (p<0.05) with respect to malaxation temperature in olive paste. Different letters within a column (w-y) indicate significant differences (p<0.05) with respect to olive paste at different stages of malaxation process (P25, P50 and P75). C6 from C18:3 Z-3-hexenyl acetate E-2-hexen-1-ol Z-3-hexen-1-ol E-2-hexenal C6 from C18:2 Hexyl acetate Hexan-1-ol Hexanal t=0 OLIVE PASTE Table 4. Volatile LOX content in olive paste in relation to malaxation temperature (kneading time 60 min). Artículo V 0.67±0.01 1.46±0.01 0.51±0.01 0.71 ±0.01 1.96 ±0.01 1.09 ±0.01 <0.01 2.13±0.01 1.19±0.01 2.26 ±0.01 1.58 ±0.01 I II 0.03 ±0.01 <0.01 0.03±0.01 0.02 ±0.01 <0.01 0.03±0.01 0.46 ±0.01 <0.01 0.64±0.02 0.66±0.01 0.38 ±0.01 a,x a,w a,w a,w b,w b,w a,x a,w a,w 0.54±0.01 a,w b,w b,w a,w 0.65 ±0.01 <0.01 0.55±0.01 0.49 ±0.01 <0.01 0.49±0.02 0.35 ±0.01 <0.01 0.11±0.01 0.22 ±0.01 <0.01 0.05±0.01 0.32 ±0.02 a,w I II I II I II I II I II I II I II I II P25 a,x a,w b,w a,w b,w 1.19±0.02 2.10±0.03 <0.01 <0.01 0.03±0.01 0.03±0.01 0.66±0.01 0.63±0.01 a,w a,x a,w 0.51±0.01 1.48±0.02 b,x a,w b,w 0.70±0.01 0.53±0.01 <0.01 <0.01 0.57±0.02 0.48±0.01 b,w b,x a,w 0.13±0.01 0.05±0.01 P50 30 min 1.14±0.01 2.15±0.02 <0.01 <0.01 0.03±0.01 0.03±0.01 0.66±0.01 0.65±0.01 0.46±0.01 1.47±0.02 b,x a,w a,w a,w a,w b,w b,w a,w a,w 0.69±0.01 a,x b,w 0.59±0.02 <0.01 <0.01 0.55±0.01 0.48±0.01 a,x a,x b,w 0.14±0.01 0.11±0.01 P75 1.22±0.01 2.15±0.01 <0.01 <0.01 0.03±0.01 0.02±0.01 0.63±0.01 0.60±0.01 0.56±0.01 1.53±0.01 0.67±0.01 a,w a,w a,w a,w a,w a,w b,w a,w a,w b,y a,w b,w b,w a,w 0.59±0.01 <0.01 <0.01 0.53±0.02 0.46±0.01 0.14±0.01 0.06±0.01 P25 1.22±0.01 2.19±0.03 <0.01 <0.01 0.03±0.01 0.02±0.01 0.63±0.01 0.62±0.02 0.57±0.02 1.55±0.02 0.66±0.01 0.50±0.03 <0.01 <0.01 0.54±0.01 0.47±0.02 0.12±0.01 0.04±0.02 P50 a,w b,w a,w a,w a,w a,w b,w b,w a,w a,w a,w b,w a,w a,w 60 min 1.22±0.02 2.15±0.01 <0.01 <0.01 0.03±0.01 0.02±0.01 0.63±0.01 0.62±0.01 0.56±0.01 1.51±0.01 0.67±0.02 a,x a,w a,w a,w a,w a,w a,w b,w a,w a,w a,x a,w a,w b,w 0.56±0.01 <0.01 <0.01 0.54±0.01 0.46±0.01 0.14±0.01 0.10±0.01 P75 1.43±0.01 b,w b,x b,w b,w b,w 2.27±0.01 <0.01 <0.01 0.04±0.01 0.04±0.01 0.65±0.01 0.63±0.01 b,w c,x b,x 0.75±0.01 1.60±0.01 a,x a,w b,w a,w a,w b,w 0.67±0.01 0.53±0.01 <0.01 <0.01 0.55±0.01 0.44±0.02 0.12±0.01 0.09±0.01 P25 1.44±0.01 b,w c,x b,w b,w b,w 2.26±0.01 <0.01 <0.01 0.04±0.01 0.04±0.01 0.67±0.01 0.63±0.01 c,x a,w 0.73±0.02 b,x a,w a,w a,w a,w a,w b,w 1.59±0.01 0.64±0.01 0.52±0.01 <0.01 <0.01 0.55±0.01 0.44±0.01 0.11±0.01 0.08±0.01 P50 90 min Different letters within a column (a-c) indicate significant differences (p<0.05) with respect to malaxation time in olive paste. Different letters within a column (w-y) indicate significant differences (p<0.05) with respect to olive paste at different stages of malaxation process. C6 from C18:3 Z-3-hexenyl acetate E-2-hexen-1-ol Z-3-hexen-1-ol E-2-hexenal C6 from C18:2 Hexyl acetate Hexan-1-ol Hexanal t=0 OLIVE PASTE Table 5. Volatile LOX content in olive paste in relation to malaxation time (kneading temperature 28 ºC). c,w b,x b,w b,w b,w 1.46±0.01 2.20±0.01 <0.01 <0.01 0.04±0.01 0.04±0.01 c,x a,w 0.70±0.01 0.63±0.01 b,x a,x c,x b,w 0.72±0.01 1.53±0.01 0.70±0.01 0.58±0.02 <0.01 <0.01 0.58±0.01 0.45±0.01 a,w a,x b,w 0.15±0.01 0.13±0.01 P75 Artículo V 149 Artículo V As for the effect of malaxation temperature on the C6 volatile compounds of olive paste, their concentration was great at temperatures close to 20 ºC, especially in the case of the aldehydes E-2-hexenal (1.36 ppm of IS, as average between batch I and II) and hexanal (0.18 ppm of IS, as average between batch I and II), so low temperatures permitted a higher activity of enzymes from LOX pathway, especially for the hydroperoxide lyase (HPL) which have the major activity at 15 ºC and decrease largely at temperatures up 35 ºC (33), while almost any difference was observed in C6 alcohols (Table 4). On the other hand there were not found practically significant differences in the C6 volatiles content in olive paste with respect to malaxation time (between 30 to 90 minutes, at 28 ºC, Table 5), except for the slightly increase in E-2-hexenal content. Effect on virgin olive oil volatiles After crushing of olive fruits, the volatile content in virgin olive oil depends mainly on the partition phenomena of these compounds between the oil and water phases of the olive paste that is promoted by the malaxation process (34). The effect of kneading temperature on volatile compounds from LOX pathway in the virgin olive oils obtained in this study is depicted in Figure 5a, it can be seen a similar trend to that observed in the olive paste. In all cases a fall in the C6 aldehydes as the malaxation temperature increased was observed, especially in the E-2-hexenal content (about a 30% as average between batch I and II), similar results were observed by Ranalli et al. (8). On the contrary, a very slightly increase of C6 alcohols, mainly hexan-1-ol and Z-3-hexen-1-ol, was observed at higher temperatures in the oils from the oil mill plant. 1,75 5a 1,50 Normalized values Normalized values 1,50 1,75 1,25 1,00 0,75 5b 1,25 1,00 0,75 0,50 0,50 0,25 0,25 20 30 Kneading Temperature (ºC) 40 30 60 90 Kneading Time (min) Figure 5. Oil mill plant VOO volatile profile as affected by the malaxation temperature (5a) and time (5b). , C6 aldehydes; , C6 alcohols; {, LOX volatiles (C6 volatiles + C5 volatiles) 150 Artículo V In contrast, it was monitored a significant increase in C6 aldehydes of the oils as the malaxation time increased, chiefly the E-2-hexenal content which rose about a 70% between 30 and 90 minutes in the oil mill plant, as average between batch I and II, these findings agree with Angerosa et al. (10) and Ranalli et al. (11), while no clear trend in the content of C6 alcohols was observed (Figure 5b). Similar trend in the volatile content in virgin olive oil samples obtained at different malaxation temperatures and times with the laboratory scale Abencor system were reported (Figure 6a and 6b), specially concerning the E-2-hexenal and hexanal variations, which decreased about 48% and 32% respectively, as average between batch I and II, as the kneading temperature rose from 20 ºC up to 40 ºC. 1,75 6a 1,50 1,25 Normalized values Normalized values 1,50 1,75 1,00 0,75 0,50 6b 1,25 1,00 0,75 0,50 0,25 0,25 20 25 30 35 40 Kneading Temperature (ºC) 15 30 45 60 75 Kneading Time (min) Figure 6. Abencor VOO volatile profile as affected by the malaxation temperature (6a) and time (6b). , C6 aldehydes; , C6 alcohols; {, LOX volatiles (C6 volatiles + C5 volatiles) The selection of optimal kneading conditions for the Cornicabra cultivar forces to establish a suitable compromise between the industrial yield obtained and the sensory quality of the virgin olive oil, that depends mainly on the phenolic and volatile profiles. Hence, in terms of the results attained in this assay, the best malaxation conditions may be a temperature below 28 ºC and a time upper than 60 minutes, since the phenolic content of the virgin olive oil obtained would improve the sensory properties of this variety through a desirable decrease of bitterness, and nonetheless the logical diminution in the oxidative stability does not affect the Cornicabra virgin olive oil shelf-life, as this is a very stable and phenol rich olive oil variety. Moreover, the volatile profile from the LOX pathway is favoured by these kneading conditions and the green odour notes of the appreciated product would increase. 151 Artículo V References (1) Angerosa, F. Influence of volatile compounds on virgin olive oil quality evaluated by analytical approaches and sensor panels. J. Lipid Sci. Technol., 2002, 104, 639-660. (2) Aparicio, R.; Luna, G. Characterisation of monovarietal virgin olive oil. Eur. J. Lipid Sci. Technol., 2002, 104, 614-627. (3) Sanchez, J.; Harwood, J.L. Byosinthesis of triacylglycerols and volatiles in olives. Eur. J. Lipid Sci. Technol., 2002, 104, 564-573. (4) Angerosa, F.; Mostallino, R.; Basti, C.; Vito, R. Virgin olive oil odour notes: their relationship with volatile compounds from the lipoxygenase pathway and secoiridoid compounds. Food Chem., 2000, 68, 283-287. (5) Caponio, F.; Gomes, T.; Summo, C.; Pasqualone, A. Influence of the type of olive-crusher used on the quality of extra virgin olive oils. Eur. J. Lipid Sci. Technol., 2003, 105, 201-206. (6) Di Giovachino L.; Sestili S.; Di Vincenzo D. Influence of olive processing on virgin olive oil quality. Eur. J. Lipid Sci. Technol., 2002, 104, 587-601. (7) Servili, M.; Piacquadio, P.; De Stefano, G.; Taticchi, A.; Sciancalepore, V. Influence of a new crushing technique on the composition of the volatile compounds and related sensory quality of virgin olive oil. Eur. J. Lipid Sci. Technol., 2002, 104, 483-489. (8) Ranalli, A.; Contento, S.; Schiavone, C.; Simone, N. Malaxing temperature affects volatile and phenol composition as well as other analytical features of virgin olive oil. Eur. J. Lipid Sci. Technol., 2001, 103, 228-238. (9) Jiménez Márquez, A.; Hermoso Fernández, M.; Uceda Ojeda, M. Elaboración del aceite de oliva virgen mediante sistema continuo en dos fases. Influencia de diferentes variables del proceso en algunos parámetros relacionados con la calidad del aceite. Grasas Aceites, 1995, 46, 299-303. (10) Angerosa, F.; Mostallino, R.; Basti, C.; Vito, R. Influence of malaxation temperature and time on the quality of virgin olive oils. Food Chem., 2001, 72, 19-28. (11) Ranalli, A.; Pollastri, L.; Contento, S.; Lannucci, E.; Lucera, L. Effect of paste kneading process time on the overall quality of virgin olive oil. Eur. J. Lipid Sci. Technol., 2003, 105, 57-67. (12) Lercker, G.; Frega, N.; Bocci, F; Mozzori, M. Volatile constituents and oxidative stability of virgin olive oils: influence of the kneading of the olive paste. Grasas Aceites, 1999, 50, 26-29. (13) Servilli, M.; Selvaggini, R.; Taticchi, A.; Esposto, S.; Montedoro, G. Air exposure time of olive pastes during the extraction process and phenolic and volatile composition of virgin olive oil. J. Am. Oil Chem. Soc., 2003, 80, 685-695. (14) Kalua, C.M.; Bedgood, D.R.; Bishop, A.G.; Prenzler, P.D. Changes in volatile and phenolic compounds with malaxation time and temperature during Virgin Olive Oil production. J. Agric. Food Chem., 2006, 54, 7641-7651. (15) UNE Spanish Standard (Asociación Española de Normalización y Certificación). UNE 55032: Fats. Determination of oil grease in total fat matter (Materias grasas. Determinación del contenido en materia grasa total del orujo de aceituna). AENOR, 1973 Madrid. (16) Vichi, S.; Castellote, A. I.; Pizzale, L.; Conte, L. S.; Buxaderas, S.; Lopez-Tamames, E. Analysis of virgin olive oil volatile compounds by headspace solid-phase microextraction coupled to gas chromatography with mass spectrometric and flame ionisation detection. J. Chromatography A, 2003, 983, 19-33. 152 Artículo V (17) Mateos, R.; Espartero, J.L.; Trujillo, M.; Ríos, J.J.; León-Camacho, M.; Alcudia, F.; Cert, A. Determination of phenols, flavones and lignans in virgin olive oil by solid-phase extraction and highperformance liquid chromatography with diode array ultraviolet detection. J. Agric. Food Chem., 2001, 49, 2185-2192. (18) Impellizzeri, J.; Jianming, L. A simple high-performance liquid chromatography method for the determination of throat-burning oleocanthal with probated antiinflammatory activity in Extra Virgin Olive Oils. J. Agric. Food Chem., 2006, 54, 3204-3208. (19) Amiot, M.J.; Fleuriet, A.; Macheix, J.J. Importance and evolution of phenolic compounds in olive during growth and maturation. J. Agric. Food Chem., 1986, 34, 823-826. (20) Amiot, M.J.; Fleuriet, A.; Macheix, J.J. Accumulation of oleuropein derivatives during olive maturation. Phytochem., 1989, 28, 67-69. (21) Servili, M.; Baldioli, M.; Selvaggini, R.; Macchioni, A.; Montedoro, G.F. Phenolic compounds of olive fruit: One- and two-dimensional nuclear Magnetic Resonance Characterization of Nüzhenide and its distribution in the constituve parts of fruit. J. Agric. Food Chem., 1999, 47, 12-18. (22) Ryan, D.; Antolovich, M.; Prenzler, P.; Robards, K.; Lavee, S. Biotransformations of phenolic compounds in Olea europaea L. Scientia Horticulturae, 2002, 92, 147-176. (23) Artajo, L.S.; Romero, M.P.; Suarez, M.; Motilva, M.J. Partition of phenolic compounds during the virgin olive oil industrial extraction process. Eur. Food Research Technol., 2006, 225, 617-625. (24) Servili, M.; Baldioli, M.; Begliomini, A.; Selvaggini, R.; Montedoro, G.F. The phenolic and volatile compounds of virgin olive oil: relationship with the endogenous oxidoreductases during the mechanical oil extraction process. In Flavour and Fragrance Chemistry; Proceedings of the Phytochemical Society of Europe, Campobasso, Italy, January 13-16 2000; Kluwer Academic: Dordrecht, The Netherlands, 2000; pp 163-173. (25) Toscano, G.; Colarieti, M.L.; Greco, G. Oxidative polymerisation of phenols by a phenol oxidase from green olives. Enzyme Microbial Technol., 2003, 33, 47-54. (26) Rodis P.S.; Karathanos, V.T.; Mantzavinou, A. Partitioning of olive oil antioxidants between oil and water phases. J. Agric. Food Chem., 2002, 50, 596-601. (27) Di Giovacchino, L. L´estrazione dell´olio con la centrifugazione diretta delle paste di oliva. Nota I: influenza della gramolazione. Riv. Ital. Sostanze Grasse, 1991, 68, 314-420. (28) Servili, M.; Baldioli, G.; Montedoro, G. Phenolic composition of virgin olive oil in relationship to some chemical and physical aspects of malaxation. Acta Horticulturae, 1994, 356, 331-336. (29) Andrewes, P.; Busch, J.; De Joode, T.; Groenewegen, A.; Alexandre, H. Sensory properties of virgin olive oil polyphenols: Identification of deacetoxy-ligstroside aglycone as a key contributor to pungency. J. Agric. Food Chem., 2003, 51, 1415-1420. (30) Beauchamp, G. K.; Keast, R. S. J.; Morel, D.; Lin, J.; Pika, J.; Han, Q.; Lee, C.-H.; Smith, A. B.; Breslin, P. A. S. Ibuprofen-like activity in extra virgin olive oil: Enzymes in an inflammation pathway are inhibited by oleocanthal, a component of olive oil. Nature, 2005, 437, 45-46. (31) Gutiérrez-Rosales, F.; Rios, J.J.; Gomez-Rey, M.L. Main polyphenols in the bitter taste of virgin olive oil. Structural confirmation by on-line high-performance liquid chromatography electrospray ionization mass spectrometry. J. Agric. Food Chem., 2003, 51, 6021-6025. (32) Gómez-Rico, A.; Salvador, M.D.; La Greca, M.; Fregapane, G. Phenolic and volatile compounds of extra virgin olive oil (Olea europaea L. Cv. Cornicabra) with regard to fruit ripening and irrigation management. J. Agric. Food Chem., 2006, 54, 7130-7136. 153 Artículo V (33) Salas, J.J.; Sanchez, J. The decrease of virgin olive oil flavour produced by high malaxation temperature is due to inactivation of hydroperoxide lyase. J. Agric. Food Chem., 1999, 47, 809-812. (34) Angerosa, F.; d´Alessandro, N.; Basti, C.; Vito, R. Biogeneration of volatile compounds in virgin olive oil: Their evolution in relation to malaxation time. J. Agric. Food Chem., 1998, 46, 2940-2944. 154 4.2. Discusión General «La composición fenólica de las aceitunas, así como el perfil fenólico y volátil de sus correspondientes aceites de oliva virgen presentan un marcado carácter varietal, puesto que el contenido enzimático responsable de los procesos biosintéticos se encuentra esencialmente determinado por factores genéticos» Se sabe que la composición química y bioquímica – especialmente el contenido enzimático - de las aceitunas está determinada genéticamente, lo cual explica las diferencias encontradas en la composición mayoritaria y minoritaria de los aceites de oliva virgen monovarietales, destacando en especial la gran diversidad en perfiles fenólicos y volátiles que han sido descritos en bibliografía y que han permitido la clasificación de los aceites según la variedad de procedencia en base únicamente a su composición minoritaria (Briante et al., 2002; Gómez-Alonso et al., 2002; Luna et al., 2006, entre otros). Este hecho se ha puesto en evidencia en la experimentación llevada a cabo con seis variedades españolas, cultivadas todas ellas en el mismo olivar experimental y por tanto, bajo idénticas condiciones agronómicas y pedoclimáticas. Una de las mayores novedades de este estudio ha sido poder estudiar simultáneamente tanto la composición minoritaria de los frutos, así como la de sus correspondientes aceites de oliva virgen, con el fin de determinar la presencia de posibles marcadores químicos varietales. Por una parte, el análisis del perfil fenólico de las aceitunas ha permitido la excelente clasificación de las mismas según la variedad de procedencia (100% de los casos agrupados correctamente tras la aplicación del Análisis Discriminante). Alguno de los aspectos de especial interés ha sido la composición oleosídica de los frutos, que además de ser la más abundante en las drupas, ha resultado ser también la que ha presentado mayor variabilidad entre las distintas variedades en estudio, destacando el hecho de que la demetiloleuropeína solo fue detectada en los frutos de la variedad Arbequina y aumentando su concentración significativamente a lo largo del proceso de maduración. Este aspecto permite por un lado la confirmación de que este compuesto fenólico es un producto de degradación de la oleuropeína (Amiot et al., 1989; Servili et al., 1999) y por otro lado, su carácter de marcador varietal, ya que investigadores como Amiot et al. (1989) y Esti et al. (1998) sólo detectaron demetiloleuropeína en dos de once variedades francesas (Cailletier cv. y L11 cv.) y en dos de ocho variedades italianas (Coratina cv. y Leccino cv.). Sobre el contenido de verbascósido de los frutos y su relación inversa con la concentración de oleuropeína, tendencia ya observada por varios autores (Amiot et al., 1989; Servili et al., 1999 y Vinha et al., 2005), podría corroborar la existencia de una ruta metabólica entre estos dos compuestos fenólicos, ya sugerida por Amiot et al. (1989) y basada en la degradación parcial de la molécula de oleuropeína para originar el verbascósido, ya que éste último no es detectado en frutos muy verdes. 155 4.2. Discusión General Por otra parte, la presencia mayoritaria de los derivados secoiridoideos del hidroxitirosol y tirosol en todas las muestras de AOV estudiadas, pone de manifiesto la importancia de la ruta de degradación de los oleósidos del fruto en la génesis de los compuestos fenólicos del aceite, la cual se inicia por la actividad de la enzima β-glucosidasa tras la rotura de los tejidos de la drupa. Otro hecho a destacar es la relación tan heterogénea observada entre el contenido de oleósidos de la drupa (oleuropeína más demetiloleuropeína, este último encontrado sólo en Arbequina) y los compuestos secoiridoideos del AOV en cada una de las variedades españolas estudiadas, con ratios desde 2,3 para el caso de Picudo, de 4,5 a 5,5 para Cornicabra y Morisca y de 7,0 a 8,5 para Arbequina y Picual y como valor máximo observado 28 para la variedad Picolimón, todos ellos calculados como valores medios entre los frutos maduros e inmaduros. Todos estos datos avalan que probablemente el contenido de derivados secoiridoideos de un AOV depende principalmente de su contenido enzimático responsable de la degradación de los oleósidos, el cual presenta un marcado carácter varietal. De la misma forma, el nivel de actividad de las enzimas de la ruta de la lipoxigenasa (LOX), que se encuentra estrechamente asociado a factores genéticos (Angerosa et al., 1999), ha determinado considerablemente la biogénesis de los compuestos volátiles C6 y C5 presentes en los AOV monovarietales del ensayo realizado. De esta forma se obtienen perfiles aromáticos totalmente distintos desde un punto de vista cuantitativo, lo que indica que los distintos aceites se caracterizan por intensidades de notas “verdes” y “frutadas” muy distintas entre si; destacando el hecho de que el contenido de E-2-hexenal -asociado a notas aromáticas verde, manzana y almendra amarga- ha permitido la diferenciación de los distintos AOV en función de la variedad de procedencia, lo que corrobora los resultados ya descritos por Aparicio & Luna (2002) que sugirieron la diferenciación de aceites monovarietales en función de la concentración de este volátil. Es importante resaltar también el nivel de actividad tan heterogéneo observado en la enzima alcohol acil transferasa (AAT) en las distintas variedades estudiadas, ya que la presencia de ésteres C6 -acetato de Z-3-hexenilo y acetato de hexilo, responsables de las sensaciones olfativas verde, frutado, floral y dulce- sólo ha sido detectada apreciablemente en las variedades Morisca, y especialmente, en Arbequina y Picual. «El perfil de compuestos minoritarios de un aceite de oliva virgen puede variar en base a la actividad de las enzimas responsables de las rutas biosintéticas, la cual puede modularse a través de factores externos, tanto agronómicos como tecnológicos» Se debe resaltar que a pesar de que la composición volátil y fenólica de un aceite de oliva virgen está esencialmente determinada por factores genéticos propios de la variedad de procedencia, el perfil de estos compuestos minoritarios también puede modularse en función de la actividad de las enzimas presentes en el fruto a través de una serie de parámetros externos, 156 4.2. Discusión General como son el grado de maduración y la disponibilidad de agua durante el desarrollo del fruto, y las condiciones utilizadas en el proceso de extracción de su aceite de oliva virgen, entre otros. Tal y como se ha podido apreciar en las publicaciones científicas presentadas, el resto de los ensayos realizados en el trabajo experimental de esta Tesis Doctoral han estado principalmente orientados hacia el estudio de la influencia de estas variables sobre la composición minoritaria de este producto. Asimismo es bien conocido el hecho de que las características organolépticas tan apreciadas en el aceite de oliva virgen se deben fundamentalmente al contenido fenólico y volátil del mismo, por lo que la finalidad última de esta investigación ha sido también poder definir y seleccionar las variables que más influyen sobre ellos con el propósito de obtener perfiles fenólicos y volátiles deseables, con el consiguiente incremento de la calidad sensorial del producto y el aumento, por tanto, de la preferencia de este aceite por parte de los consumidores respecto del resto de los aceites vegetales presentes en el mercado. Antes de continuar con la discusión de los resultados, destacar que la razón que ha llevado a que estos ensayos se hayan realizado fundamentalmente con frutos Cornicabra, se debe a que el cultivo de esta variedad, localizado mayoritariamente en las provincias de Toledo y Ciudad Real, supone el 15% de la superficie nacional dedicada al olivo, y representa una aportación a la producción nacional de aceite de oliva del 7% (MAPA, 2001), lo que ofrece una idea de la gran importancia social y económica de este cultivo en la región de Castilla-La Mancha. También es importante destacar que el aceite de oliva virgen Cornicabra se caracteriza por una elevada estabilidad oxidativa y un intenso amargor, ambos como consecuencia de su gran contenido fenólico natural. Este hecho implica que aunque el atributo “amargo” está valorado positivamente en este producto, intensidades excesivas del mismo llegan a producir el rechazo de los consumidores. Por todo ello resulta ser de gran importancia en este aceite monovarietal la investigación de las variables que favorezcan la obtención de aceites de oliva virgen Cornicabra de gran calidad, pero que permitan además modular su perfil fenólico según las preferencias de los consumidores, lo que supondrá el aumento de su competitividad en el mercado actual. 157 4.2. Discusión General «La elección del grado de madurez óptimo de la aceituna para su procesamiento debe realizarse en base a la evolución del perfil de compuestos fenólicos y volátiles del aceite de oliva virgen, permitiendo obtener productos de gran calidad sensorial y valor nutricional» Como se ha comentado anteriormente, uno de los factores agronómicos a optimizar para la obtención de aceites de oliva virgen de alta calidad sensorial es el estado de maduración del fruto para su procesamiento, ya que se ha comprobado la importancia de este aspecto en la calidad global y composición de este producto (García et al., 1996; Aparicio et al., 1998; Uceda et al., 1999; Salvador et al., 2001; Rotondi et al., 2004). Por ello se ha creído conveniente efectuar el estudio de esta variable sobre la composición minoritaria de variedades españolas poco estudiadas como Picudo, Morisca y Picolimón y de forma más exhaustiva en aceites Cornicabra. Con los ensayos efectuados se ha confirmado como la maduración del fruto implica un considerable descenso del contenido en derivados secoiridoideos del hidroxitirosol y tirosol presentes en el AOV obtenido, debido seguramente a la disminución observada en la cantidad de precursores fenólicos presentes en la aceituna, como es el caso de la oleuropeína, que ha sido observada en la mayoría de los variedades bajo estudio (ART. I; Tabla 1), aspecto que también ha sido descrito por varios autores (Amiot et al., 1986; Ryan et al., 1999; Brenes et al., 1999; Uceda et al., 1999; Morelló et al., 2004). Es importante destacar que en variedades como Picual y Picolimón se ha observado un incremento del contenido en oleuropeína en los frutos en estado de envero para posteriormente disminuir significativamente en los frutos sobremaduros, comportamiento que puede ser debido a la transformación de sustancias fenólicas en nuevos productos conjugados, mientras que el posterior descenso se debería al considerable proceso de degradación que sufren estos compuestos (Ryan et al., 2002). En cuanto a la influencia de esta variable agronómica sobre los compuestos volátiles C6 y C5 de los AOV, responsables de las notas aromáticas verdes y frutadas de este producto, varios estudios han determinado que la actividad de enzimas responsables de su biosíntesis, como la lipoxigenasa (LOX) o alcohol deshidrogenasa (ADH), disminuye a lo largo de la maduración del fruto (Salas et al., 1998 y 1999c), lo cual también supone la disminución en la formación de estos compuestos volátiles a medida que aumenta el índice de madurez de las aceitunas (Morales et al., 1996; Aparicio et al., 1998). Por otro lado, algunos autores han descrito que la concentración máxima de estos volátiles en el aceite, especialmente en lo que respecta al E-2 hexenal, se produce cuando el color de la piel del fruto pasa de verde-amarillento a púrpura, momento a partir del cual comienza a disminuir considerablemente su contenido (Solinas et al., 1987b). Este aumento del contenido en volátiles C6 se ha observado en este estudio en los AOV de las variedades Morisca, Picolimón y Picudo obtenidos a partir de frutos verdeamarillentos (I.M1 = 1,0-1,5) y en envero (I.M2 = 2,3-3,0), especialmente en lo que respecta a la 158 4.2. Discusión General concentración del E-2-hexenal, Z-3-hexen-1-ol y hexan-1-ol; mientras que en el resto de aceites, que fueron obtenidos a partir de frutos en estadíos de maduración superiores (I.M1 = 2,0-2,5 y I.M2 = 3,5-4,0), el incremento de estos volátiles no fue apenas perceptible e incluso se pudo observar una ligero disminución de la fracción aldehídica C6 (ART. I; Tabla 3), debido probablemente a un leve descenso de la actividad enzimática en la ruta LOX. Por otro lado, la evolución de los volátiles C6 y C5 presentes en las muestras de AOV Cornicabra obtenidas con diferente grado de madurez de los frutos: desde I.M = 1,5-2,0 hasta I.M = 5,0-5,5, ha puesto de manifiesto un descenso constante y significativo en el contenido de aldehídos C6 y volátiles C5, como 1-penten-3-ol y 1-penten-3-ona. Por el contrario el contenido de alcoholes C6, como Z-3-hexen-1-ol y hexan-1-ol, ha aumentado a lo largo del proceso de maduración del fruto (ART. III; Figura 2 y Tabla 2), y aunque algunos autores no han observado estos incrementos en otras variedades de aceituna, como Picual, Arbequina o Koroneiki (Morales et al., 1996; Aparicio et al., 1998), Benincasa et al. (2003) sí detectaron aumentos similares en la variedad Coratina, lo cual vuelve a poner de manifiesto la importante dependencia de carácter varietal de la actividad de las enzimas de la ruta LOX. Por último indicar que uno de los objetivos previstos de este estudio era establecer el estado de maduración recomendable para el procesamiento de los frutos Cornicabra con el fin de obtener un aceite de oliva virgen de máxima calidad. Se ha determinado una influencia mínima del grado de madurez de los frutos sobre los índices de calidad normalizados que se han estudiado (grado de acidez, índice de peróxidos y absorción en el ultravioleta), con la excepción de un ligero descenso en la intensidad de los atributos sensoriales “frutado” y “amargo” tras realizar el análisis sensorial de las muestras, clasificándose todas ellas dentro de la categoría comercial “virgen extra”. A la vista de estos resultados se ha considerado conveniente establecer el índice de madurez óptimo en esta variedad en base al patrón de evolución de su perfil de compuestos fenólicos y volátiles, sugiriéndose por lo tanto un estado de maduración óptimo para valores de I.M entre 3,0 y 4,0. De hecho, a índices de madurez más elevados – superiores a 4,5-5,0 – el contenido de los volátiles mayoritarios de la ruta LOX (la fracción aldehídica C6) presentes en el aceite es demasiado bajo y por tanto las notas aromáticas verdes tan apreciadas en este producto pueden ser poco perceptibles, lo cual reduce su grado de preferencia por parte del consumidor. Además, la obtención de aceites de oliva virgen a partir de frutos sobre-maduros supone una disminución, posiblemente excesiva, de los fenoles complejos que no resultaría beneficioso para este producto, ya que aunque en principio un descenso en la intensidad del sabor amargo resultaría deseable en este aceite monovarietal, también implicaría un importante descenso de su estabilidad oxidativa y su valor nutricional. 159 4.2. Discusión General «La aplicación de riego en el olivar supone un incremento de la producción global de aceite por hectárea de plantación. Por tanto las técnicas de irrigación resultan ser aconsejables desde un punto de vista social y económico y su utilización debe resultar del compromiso existente entre la cantidad de agua utilizada, el incremento en la producción del olivar y la calidad y composición del aceite de oliva virgen obtenido» Dentro del estudio de la composición minoritaria del aceite de oliva virgen llevado a cabo en esta Tesis se ha evaluado la influencia que la actual tendencia de aplicación de riego en el olivar posee sobre el perfil minoritario de los aceites obtenidos en estas condiciones. Por ello se han estudiado distintas estrategias de riego con el objetivo general de determinar el efecto que la disponibilidad de agua en la plantación tiene sobre su productividad y, muy especialmente, sobre la composición y calidad del aceite resultante. El olivo tradicionalmente se ha considerado un cultivo de secano, sobre todo en regiones con recursos hídricos limitados como es el caso de Castilla-La Mancha. Aún así, se ha demostrado que la aplicación de riego en el olivar acelera el crecimiento de los olivos jóvenes, además de reducir el patrón característico de “carga-descarga” propio de este cultivo e incrementar la producción de los olivos (Beede and Goldhammer, 1994, Moriana et al., 2003). Como consecuencia de ello el uso de prácticas de irrigación se ha implantado de forma generalizada en la mayoría de los olivares jóvenes e incluso en olivares adultos tradicionales. Así, el ensayo realizado en un olivar tradicional adulto Cornicabra efectuado en las campañas 2003/04 y 2004/05 ha puesto de manifiesto un aumento significativo de la productividad de los olivos bajo condiciones de riego respecto a los de secano (alrededor de un 35%), y aunque el contenido graso de las aceitunas no se ha visto afectado por las técnicas de irrigación, el obtener una mayor producción frutícola implica claramente un incremento de la producción global de aceite por hectárea de olivar, con resultados similares a los descritos por Pastor et al. (1999) en un olivar tradicional Picual y por Patumi et al. (1999) en varios olivares intensivos de diversas variedades italianas. Por tanto la aplicación de riego, incluso en zonas donde las fuentes de agua son limitadas, se convierte en una técnica agronómica aconsejable desde un punto de vista social y económico. No obstante, la utilización de cualquier técnica o programación de riego debe tener siempre en cuenta su efecto sobre la calidad y composición del aceite de oliva virgen obtenido, especialmente en lo que respecta a su composición volátil y fenólica, estrechamente relacionada con la calidad sensorial del producto. Lo que implica que toda técnica de irrigación debe resultar del compromiso existente entre la cantidad de agua utilizada, el incremento en la producción del olivar y la calidad y composición del aceite de oliva virgen obtenido. 160 4.2. Discusión General «Los perfiles volátiles y fenólicos del aceite de oliva virgen dependen tanto del estado hídrico registrado en el olivo, como de la programación de riego utilizada; así una estrategia de riego deficitario regulado, centrada durante la etapa fenológica III del desarrollo del fruto, permite la obtención de aceites con una composición fenólica y volátil comparable a los obtenidos con la metodología de riego FAO» La metodología más utilizada para determinar los requerimientos hídricos de los olivos ha sido propuesta por la Organización de Alimentación y Agricultura (FAO) y está basada en el coeficiente de evapotranspiración del cultivo (ETc), desarrollada por Doorenbos y Pruitt en 1974. Este método implica la aplicación del 100% de las pérdidas hídricas del olivo (100% ETc) y ha sido ampliamente recomendada para el riego de los olivares, aunque hay que destacar las grandes dosis de agua que en ocasiones se requieren. Es importante destacar que en muchas zonas olivareras de España existe un límite máximo legal de riego de 100 mm, por lo que la aplicación de esta metodología no siempre resulta factible. Por todo ello se han desarrollado las denominadas estrategias de riego deficitario regulado (regulated deficit irrigation, RDI), que tienen como finalidad hacer un uso más adecuado del agua mediante la utilización de dosis de riego inferiores, bien durante toda la estación de irrigación o de acuerdo al estado fenológico del cultivo (Moriana et al., 2003 y 2007; Tognetti et al., 2005). Por esta razón se evaluaron dos estrategias de RDI diferentes en un olivar tradicional adulto Cornicabra, que inicialmente se encontraba en condiciones de secano. La primera estrategia denominada RDI-1 consistía en la aplicación de las dosis de agua durante toda la estación de riego y la segunda, denominada RDI-2, sólo desde principios de agosto, momento en el que comienza la acumulación de aceite en el fruto (estado fenológico III), con el fin de determinar cual de ellas permitía obtener aceites de oliva virgen de una calidad y composición comparables a la metodología FAO o a la estrategia de irrigación excesiva 125 FAO, con dosis de riego equivalentes a 125% del valor del parámetro ETc. El análisis de los índices de calidad normalizados (grado de acidez, índice de peróxidos y absorción en el ultravioleta) de los distintos aceites del ensayo no generó ninguna diferencia atribuible a la aplicación de riego en el olivar, a excepción de una menor intensidad de los atributos sensoriales “amargo” y “frutado” detectado en los aceites procedentes de las diversas estrategias de irrigación estudiadas. Por el contrario, el análisis instrumental del amargor o índice K225, reveló diferencias significativas entre los AOV bajo condiciones de secano y los obtenidos con estrategias de riego, mostrando que niveles de estrés hídrico elevado en los olivos implican la obtención de aceites más amargos. La disminución de la intensidad del atributo “amargo” producida tras la aplicación de riego en el olivar resulta ser de gran interés en los aceites Cornicabra, ya que incrementaría la aceptación de este producto por parte de los consumidores no acostumbrados a la acusada presencia de este atributo. 161 4.2. Discusión General Con respecto a la composición en ácidos grasos, los resultados obtenidos han mostrado que los aceites obtenidos a partir de olivos en condiciones de secano presentan un contenido ligeramente superior en el ácido graso C18:1, mientras que por el contrario los aceites de las técnicas de irrigación se caracterizan por niveles mayores de C16:0 y C18:2, aunque hay que destacar que estos cambios son muy leves respecto a la composición acídica global del aceite, por lo que no presentan ninguna relevancia nutricional. Salas et al. (1997) también detectaron ligeros cambios en la composición en ácidos grasos de aceites Picual atribuibles a la aplicación de riego en el olivar. En lo referente al contenido en antioxidantes naturales presentes en el aceite de oliva virgen, destacar en primer lugar que las escasas diferencias significativas encontradas en el contenido de α-tocoferol de las muestras del ensayo no presentaron ningún tipo de relación con las estrategias de riego estudiadas. Esto indica que las dosis de agua aplicadas a los olivos y, por consiguiente, el estado hídrico registrado en las plantas a lo largo de las distintas campañas olivareras no han influido en la ruta metabólica de formación de este antioxidante. Por el contrario, son varios los estudios que han destacado la relación inversa existente entre el estrés hídrico de los olivos y el contenido en fenoles complejos del aceite obtenido (D´Andria et al., 1996; Motilva et al., 1999 y 2000; Tovar et al., 2001; Servili et al., 2007, entre otros), observación también confirmada en este ensayo de irrigación, donde la concentración de las formas secoiridoideas 3,4-DHPEA-EDA, 3,4-DHPEA-EA y p-HPEA-EDA han disminuido significativamente en los aceites Cornicabra al incrementar las dosis de riego utilizadas en las distintas estrategias evaluadas, seguramente debido tal y como han descrito varios autores (Patumi et al., 1999; Tovar et al., 2002), a que el estado hídrico de los olivos implica cambios en la actividad de las enzimas responsables de la síntesis fenólica en las drupas, como es el caso de la L-fenilalanina amonio liasa (PAL), cuya actividad es superior bajo condiciones de estrés hídrico elevadas, dando lugar por lo tanto a un mayor contenido fenólico en el fruto y en consecuencia en el aceite de oliva virgen obtenido. Hay que destacar de forma explícita que han sido los derivados secoiridoideos del hidroxitirosol presentes en el AOV los fenoles complejos más afectados por el estado hídrico del olivo, disminuyendo de forma más acusada que los secoiridoideos del tirosol. Este aspecto resulta de gran interés, ya que es bien conocida la elevada capacidad antioxidante e influencia sobre la percepción del atributo sensorial “amargo” del AOV que poseen el hidroxitirosol y sus secoiridoideos, frente al tirosol y sus derivados, que han demostrado una escasa actividad antioxidante y una mayor influencia sobre el atributo sensorial “picante” (Baldioli et al., 1996; Mateos, 2002; Andrewes et al., 2003; Carrasco-Pancorbo et al., 2005). Este hecho justifica las diferencias registradas tanto en las características organolépticas como en la estabilidad oxidativa Rancimat de los aceites de oliva virgen del ensayo, ambas significativamente superiores en las muestras procedentes del cultivo en condiciones de secano. 162 4.2. Discusión General Por otro lado, es importante destacar que hasta el momento de la realización de este ensayo no existían datos en la bibliografía del efecto del riego sobre la composición volátil del aceite de oliva virgen, siendo éste punto de especial interés por su influencia en las características organolépticas del producto y una de las principales novedades de este estudio. De manera que el análisis de estos componentes minoritarios ha permitido establecer la existencia de una relación directa entre el estado hídrico del olivo y la cantidad de aldehídos C6 (especialmente E-2-hexenal) y alcoholes C6 (como Z-3-hexen-1-ol y hexan-1-ol) presentes en el AOV; siendo su contenido significativamente superior en los aceites Cornicabra obtenidos a partir de frutos que no han sufrido condiciones de estrés hídrico apreciables, lo que indica probablemente que la actividad de las enzimas de la ruta LOX, especialmente las enzimas hidroperóxido liasa (HPL) y alcohol deshidrogenasa (ADH), también resulta afectada por disponibilidad de agua durante el desarrollo de las aceitunas. Por tanto, se ha puesto de manifiesto que las técnicas de irrigación permiten acentuar las notas sensoriales “verdes” y “frutadas” del aceite de oliva virgen, disminuyendo simultáneamente la intensidad de atributo sensorial “amargo”, siendo por tanto, una práctica agronómica aconsejable en AOV caracterizados bien por un bajo contenido en volátiles C6 o por una elevada concentración fenólica, como es el caso de la variedad Cornicabra. Asimismo, este estudio sobre la influencia del riego en el olivar sobre la calidad y composición del aceite de oliva virgen ha demostrado como los perfiles volátiles y fenólicos de este producto se encuentran afectados no sólo por el estado hídrico estacional registrado en el olivo, sino en particular por la programación de riego utilizada; así la utilización de la estrategia RDI-2, donde las dosis de irrigación comenzaron a principios de agosto (etapa fenológica III del desarrollo del fruto), ha dado lugar a una composición fenólica y volátil en los aceites comparable a los obtenidos con las estrategias de riego FAO y 125 FAO, pero con una considerable reducción de la cantidad de agua suministrada en el olivar, siendo éste uno de los objetivos marcados inicialmente en el estudio. Este aspecto resulta de gran interés en los olivares de Castilla-La Mancha, región que como se ha comentado previamente presenta unos recursos hídricos escasos. A la vista de los resultados descritos en este ensayo, la técnica de irrigación más apropiada para los olivos tradicionales de esta región es un riego deficitario regulado, estrategia que permite un uso más racional y adecuado del agua disponible, además aparentemente basta con centrar la aplicación de riego durante la etapa fenológica III del desarrollo del fruto para permitir la recuperación del estado hídrico del olivo y conseguir situaciones similares a las obtenidas con la metodología recomendada por la FAO. 163 4.2. Discusión General «Una programación de riego basada en la medida del potencial hídrico del tronco, con un umbral alrededor de -1,2 MPa, ha dado lugar a aceites de oliva virgen monovarietales con una calidad y composición minoritaria similar a la metodología FAO, por lo que resulta ser una alternativa factible al cálculo del parámetro ETc para planificar el riego en un olivar joven de cubierta incompleta» A diferencia del ensayo de riego llevado a cabo en el olivar adulto Cornicabra, la ejecución del segundo ensayo de irrigación presentado en esta memoria se ha basado en el hecho de que varios autores (Fereres et al., 2003; Naor, 2003) han descrito recientemente que la estimación matemática del parámetro ETc, en el que se fundamenta la metodología FAO, se encuentra sujeta a numerosas incertidumbres relacionadas con cuestiones meteorológicas y agronómicas como el nivel de carga del olivo, edad del cultivo, estado vegetativo del árbol, etc., por lo que el uso de programaciones de irrigación basadas en medidas del estado hídrico del olivo in situ parece ser una opción más apropiada a este coeficiente agronómico para determinar las dosis de agua a aplicar en el olivar. Dos de los índices que permiten conocer el estado hídrico de la planta, y que han sido utilizados recientemente en olivares, son el potencial hídrico del tronco (stem water potential, SWP) y las fluctuaciones del diámetro del tronco (trunk diameter fluctuations, TDF) (Moriana et al., 2002; Gucci et al., 2007). Aún así, hasta la fecha es muy escasa la información existente sobre el efecto de programaciones de riego basadas en estas medidas del estado hídrico del olivo sobre la composición minoritaria de los aceites de oliva virgen obtenidos (Servili et a., 2007), siendo éste el principal motivo que ha impulsado el estudio de diversas estrategias de irrigación basadas en las medidas del potencial hídrico del tronco (SWP -2,0 y SWP -1,2) y las fluctuaciones del diámetro del tronco (TDF). El estudio se ha planteado en dos olivares jóvenes de cubierta incompleta (Cornicabra y Morisca) situados en áreas geográficas distintas (CastillaLa Mancha y Extremadura), y por tanto bajo condiciones pedoclimáticas diferentes; teniendo como principal propósito evaluar la viabilidad de las técnicas SWP y TDF como posibles alternativas a la metodología FAO actual, en base a la composición y calidad de los aceites de oliva virgen obtenidos. Comentar en primer lugar que los resultados experimentales obtenidos en este ensayo de irrigación han confirmado algunos aspectos observados en las pruebas con el olivar tradicional adulto, como es la ausencia de prácticamente cualquier relación significativa entre el estado hídrico del olivo y los valores de los índices de calidad normalizados evaluados en el aceite de oliva virgen obtenido (grado de acidez, índice de peróxidos y características de absorción en el UV) o con el contenido en tocoferoles del mismo, así como los pequeños cambios producidos por la aplicación de riego en el olivar sobre la composición de ácidos grasos global del producto. 164 4.2. Discusión General Este estudio también ha verificado, independientemente de la variedad de aceituna o de la campaña estudiada, que los niveles de aldehídos y alcoholes C6 (como hexanal, E-2-hexenal y hexan-1-ol) son notoriamente superiores en los aceites de oliva virgen procedentes de frutos que no han sufrido situaciones de estrés hídrico elevadas, mientras que por el contrario el contenido en p-HPEA-EDA y especialmente en los derivados secoiridoideos del hidroxitirosol (3,4-DHPEA-EDA y 3,4-DHPEA-EA) es inferior en esos mismos aceites; encontrándose diferencias significativas casi únicamente entre las muestras obtenidas con el tratamiento SWP -2,0 (nivel de estrés hídrico moderado) y el resto de las estrategias evaluadas, entre las cuales se ha registrado un estado hídrico similar. Además, resulta interesante destacar una estrecha relación entre el contenido en oleuropeína de las drupas, y por consiguiente en los niveles de derivados secoiridoideos presentes en los aceites del ensayo, con los valores de potencial hídrico mínimo registrados en cada programación de riego durante la etapa fenológica III del desarrollo del fruto. De tal forma que posiblemente la actividad de las enzimas responsables de la biosíntesis de precursores fenólicos en la aceituna, como la enzima PAL, está determinada no sólo por el estado hídrico estacional de los olivos, sino también por posibles descensos significativos en el potencial hídrico del árbol desde que comienza la acumulación de aceite en el fruto (etapa fenológica III). A la vista de los resultados presentados en los ensayos de irrigación realizados en los olivares, e independientemente de factores como la “variedad” y el “grado de maduración” de la aceituna, se puede decir que el perfil fenólico y volátil de un aceite de oliva virgen depende considerablemente de la disponibilidad de agua durante el desarrollo del fruto, siendo especialmente decisivo para la actividad de las enzimas responsables de la biogénesis de compuestos fenólicos y volátiles el estado hídrico del olivo durante la etapa fenológica III, que abarca tanto la acumulación de aceite en el fruto como el proceso de maduración del mismo. Por otro lado, y de acuerdo al propósito general planteado en este ensayo de irrigación, se puede proponer la programación de riego basada en la medida del potencial hídrico del tronco, con un umbral de -1,2 MPa (SWP -1,2), como una alternativa factible al cálculo del parámetro ETc para realizar la planificación de las estrategias de irrigación en un olivar joven de cubierta incompleta, puesto que el estado hídrico registrado en los olivos FAO y SWP -1,2 ha sido semejante y por tanto, los AOV monovarietales obtenidos mediante ambas técnicas ofrecieron una calidad y composición minoritaria similar. Por el contrario, la utilización de la estrategia de irrigación basada en las fluctuaciones del diámetro del tronco (TDF), ha generado niveles hídricos considerablemente variables entre las campañas sucesivas estudiadas, presentando en ocasiones valores similares al tratamiento FAO o a la estrategia moderadamente estresada SWP -2,0, por lo que su utilización a priori en el desarrollo de planificaciones de riego parece ser algo imprecisa y por tanto su uso como posible opción al cálculo del parámetro ETc debería continuar bajo estudio. 165 4.2. Discusión General Asimismo, el ensayo realizado ha permitido determinar las posibles ventajas o inconvenientes que supone la aplicación de riego en dos olivares monovarietales localizados en áreas geográficas distintas, siendo importante destacar que los frutos Cornicabra y Morisca originan aceites de oliva virgen con una composición en ácidos grasos, tocoferoles, así como un perfil fenólico y volátil totalmente distinto. En ambos casos el riego permite acentuar las notas sensoriales “verdes” y “frutadas” en el producto al aumentar la presencia de aldehídos y alcoholes C6, disminuyéndose simultáneamente la intensidad del atributo sensorial “amargo” al reducirse la concentración de fenoles complejos, por lo que resulta una práctica agronómica recomendable en olivares que originan AOV caracterizados por un alto contenido fenólico y por tanto con una elevada estabilidad oxidativa, como es el caso de la variedad Cornicabra. Por el contrario, esta técnica agronómica podría afectar negativamente a la calidad sensorial y nutricional de los aceites de la variedad Morisca - que posee un contenido fenólico secoiridoideo inferior y una composición relativa en ácidos grasos poliinsaturados elevada - ya que el descenso en la cantidad de fenoles complejos ocasionado por las técnicas de irrigación, implicaría no sólo la obtención de aceites con escasa intensidad en los atributos sensoriales positivos “amargo” y “picante”, sino también un descenso excesivo en su estabilidad oxidativa que reduciría considerablemente la vida útil del producto, pues debido a su composición acídica los procesos oxidativos se acelerarían. Por esta razón la aplicación de cualquier técnica de riego en la variedad Morisca, así como en cualquier otra caracterizada por un bajo contenido fenólico natural, como por ejemplo la Arbequina, debe tener en especial consideración, no sólo su influencia sobre la calidad sensorial y nutricional del producto final, sino también si cuestiones fenológicas del propio olivo como son la floración y el cuajado de los frutos se ven favorecidas, o bien si el incremento que se produce en la producción del olivar es económicamente rentable. «La composición fenólica y volátil de un aceite de oliva virgen puede modularse en base a la temperatura y tiempo de batido, permitiendo adecuar la intensidad de sus atributos sensoriales “frutado”, “amargo” y “picante” a las necesidades del mercado, además de la ofrecer la posibilidad de aumentar el valor nutricional de este producto» Otro aspecto estudiado en esta Tesis ha sido el efecto que diversas variables durante la etapa tecnológica de batido ejercen sobre la composición minoritaria del aceite de oliva virgen Cornicabra. El tiempo y temperatura de batido son las principales variables a controlar durante esta etapa, de forma que es posible variar potencialmente la composición volátil y fenólica del aceite de oliva virgen obtenido y, por consiguiente, sus características sensoriales. De hecho, una de las principales innovaciones de este estudio es la de combinar estas dos variables en el análisis 166 4.2. Discusión General del perfil fenólico y volátil de la pasta de aceituna y los correspondientes aceites de oliva virgen obtenidos en una Almazara Experimental, con una capacidad de trabajo de 200 Kg/h. El principal propósito de este trabajo se ha dirigido, no sólo a ampliar el conocimiento tecnológico y científico existente sobre los parámetros implicados en esta operación mecánica, sino también en determinar unas condiciones de batido favorables para la variedad Cornicabra mayoritaria en Castilla-La Mancha, de manera que puedan ser aplicadas por las almazaras industriales de la región para optimizar la composición en compuestos minoritarios y por tanto las características sensoriales de este aceite de oliva virgen. El estudio de la composición fenólica de la pasta de aceituna a lo largo de la etapa de batido, indica la rápida e inmediata acción de la enzima β-glucosidasa sobre la oleuropeína presente en el fruto de partida, puesto que su contenido se ve reducido inmediatamente después de la molienda de las aceitunas hasta un 8,5-5,0% de su contenido inicial. Aunque también ha sido observada una ligera disminución en la concentración de este compuesto fenólico a lo largo de la etapa de batido, se puede decir que la actividad hidrolítica de esta enzima queda reducida prácticamente a la etapa inicial de molienda, dando lugar a la génesis mayoritaria de derivados secoiridoideos en la pasta de aceituna obtenida. Por otra parte, el principal compuesto fenólico cuantificado en la pasta de aceituna es la forma 3,4-DHPEA-EDA, cuyo contenido representa entre el 64% y el 76% de los fenoles totales presentes y disminuye significativamente a lo largo de la etapa de batido, posiblemente debido a la degradación oxidativa llevada a cabo por enzimas como polifenoloxidasa (PPO), peroxidasa (POD) o lipoxigenasa (LOX) (Servili et al., 2000). En cambio, los niveles de derivados secoiridoideos del tirosol hallados en las pastas de aceituna representan un pequeño porcentaje del contenido fenólico total, sin observarse ningún cambio o evolución evidente en su contenido a lo largo de la etapa. Respecto a la presencia de los alcoholes fenólicos hidroxitirosol y tirosol, mencionar que solamente fue detectado en concentraciones significativas el hidroxitirosol, cuyo contenido aumentó de forma apreciable a lo largo del proceso de batido, lo que confirma la formación de estos fenoles simples como productos de degradación de los derivados secoiridoideos. El carácter hidrofílico de estos compuestos fenólicos queda obviamente patente al cuantificarse su presencia en el orujo húmedo obtenido tras la centrifugación de las pastas, ya que la mayor parte de estas sustancias fueron retenidas en este sub-producto. Sobre la presencia de fenoles como el verbascósido, la rutina, el luteolin-7-O-glucósido y el apigenin-7-O-glucósido, originariamente presentes en la aceituna, conviene señalar que su contenido se mantiene prácticamente constante durante el batido de la pasta y que tras la etapa de centrifugación sólo se detectan en el orujo húmedo, lo cual indica la retención de estos fenoles complejos en la fase sólida de este sub-producto, como también ha descrito Artajo et al. (2006). 167 4.2. Discusión General Por otro lado, comentar que el contenido de oleuropeína y secoiridoideos del hidroxitirosol detectado en las pastas de aceituna obtenidas en los ensayos de batido han disminuido significativamente al aumentar la temperatura de trabajo desde 20 ºC a 40 ºC y el tiempo desde 30 minutos a 90 minutos, mientras que la forma p-HPEA-EDA ha mostrado un comportamiento opuesto; aspectos que confirman la degradación oxidativa, ya sea química o enzimática, de los compuestos con estructura o-difenólica, puesto que por una parte la actividad de la enzima LOX cataliza la formación de hidroperóxidos y podría estar implicada en la oxidación indirecta de los o-difenoles (Ranalli et al., 2003), ya que es sobradamente conocida la capacidad antioxidante de estos compuestos, frente al tirosol y sus derivados que han demostrado una escasa o inexistente actividad antioxidante (Mateos, 2002; Carrasco-Pancorbo et al., 2005). De igual forma, el trabajo realizado por Toscano et al. (2003) ya había demostrado que la enzima PPO presente en las aceitunas poseía una mayor afinidad por los sustratos con estructura odifenólica que por los monofenoles, que apenas se ven afectados por esta enzima, lo cual también explica el descenso observado en los derivados secoiridoideos del hidroxitirosol presentes en la pasta de aceituna. En base a la evolución observada en la composición fenólica de las pastas en los distintos ensayos tiempo-temperatura de batido, sería de esperar que al aumentar la temperatura de trabajo de 20 ºC a 40 ºC se observara un descenso similar en el contenido de derivados secoiridoideos del hidroxitirosol presente en el AOV al descrito en las pastas de aceituna, pero por el contrario, se observó una tendencia totalmente opuesta, ya que el contenido de estos compuestos aumentó como media alrededor de un 130%, comportamiento que probablemente sea consecuencia de una variación en el equilibrio de partición de estos compuestos fenólicos entre las fases oleosa y acuosa presentes en la pasta de aceituna, ya que temperaturas elevadas implican un incremento de la solubilidad relativa de estas sustancias en la fase oleosa favoreciendo su migración hacia la misma (Rodis et al., 2002), a pesar de que la cantidad de secoiridoideos del hidroxitirosol cuantificada en la pasta sea inferior a altas temperaturas. De forma análoga, la concentración de derivados secoiridoideos del tirosol en los AOV aumentó alrededor de un 65% al subir la temperatura de batido desde 20 ºC a 40 ºC. El tiempo de batido no afecta de forma tan significativa a la cantidad de compuestos fenólicos presentes en el aceite de oliva virgen si se compara con el efecto de la temperatura, aunque sí se registró un descenso en los derivados secoiridoideos del hidroxitirosol del 5% y un aumento entre 15-20% en los secoiridoideos del tirosol al prolongar el tiempo de batido de 30 a 90 minutos. Varios autores, como Di Giovacchino et al. (1991 y 2002), Lercker et al. (1999) o Ranalli et al. (2001), han descrito un comportamiento similar en el contenido fenólico del AOV en función de la temperatura y tiempo de batido al observado en nuestra experiencia. Por lo tanto, estos resultados confirman la posibilidad de modular el contenido fenólico de un AOV en función del tiempo y, especialmente, de la temperatura de batido empleada durante el 168 4.2. Discusión General proceso de batido, lo que supone la posibilidad tanto de aumentar el valor biológico de este producto, como de adecuar los niveles de los atributos positivos “amargo” y “picante” del AOV a las necesidades del mercado, aspecto especialmente importante en la variedad Cornicabra, que tal y como se ha comentado previamente se caracteriza por un elevado amargor. Acerca de la composición volátil C6 cuantificada en las pastas de aceituna Cornicabra durante el proceso de batido, destacar primero la rápida acción biosintética que han mostrado las enzimas de la ruta LOX, puesto que inmediatamente después de la molienda de los frutos se ha generado un perfil aromático que ha permanecido casi inalterado a lo largo de la etapa de batido de la pasta de aceituna, con la excepción de un ligero descenso inicial en la fracción aldehídica C6 a favor de la génesis de sus correspondientes alcoholes, Z-3-hexen-1-ol, E-2hexen-1ol y hexan-1-ol. Por otro lado, comentar que la mayor concentración en volátiles C6 registrada en las pastas de aceituna se obtuvo trabajando a temperaturas de batido próximas a 20 ºC, condiciones que incrementaron la presencia de E-2-hexenal y hexanal, ya que como ha descrito Salas et al. (1999), las bajas temperaturas favorecen la actividad enzimática de la ruta LOX, y especialmente la acción de la enzima HPL, la cual presenta una actividad óptima alrededor de los 15 ºC y disminuye enormemente a temperaturas próximas a 35 ºC. En lo referente a la influencia del tiempo de batido sobre estos compuestos volátiles, apenas se han observado cambios significativos al prolongar el tiempo de trabajo de 30 a 90 minutos, a excepción de un ligero enriquecimiento en el contenido de E-2-hexenal de las pastas. Por último, destacar el hecho de que las diferentes condiciones de trabajo analizadas en este estudio no han afectado significativamente la actividad de la enzima AAT en la variedad Cornicabra, responsable de la presencia de ésteres C6 en el aceite de oliva virgen, ya que en ninguno de los ensayos se ha detectado de forma apreciable esta fracción volátil. De igual forma que los compuestos fenólicos, tras la molienda de los frutos, el contenido de compuestos volátiles del aceite de oliva virgen depende principalmente de los fenómenos de partición de estos componentes minoritarios entre las fases acuosa y oleosa de la pasta de aceituna y que se producen durante el proceso de batido (Angerosa et al., 1998). Por esta razón, el contenido en volátiles C6 cuantificado en los AOV del ensayo al variar la temperatura o tiempo de batido mostró una evolución similar a la composición volátil de la pasta de aceituna de la que procedía. Así, el incremento de la temperatura de trabajo de 20 ºC a 40 ºC supuso una disminución de la fracción aldehídica C6, en especial del E-2-hexenal con una caída del 30%, mientras que los tiempos de batido prolongado favorecieron la presencia de este mismo compuesto, aumentado su concentración alrededor de un 70% entre tiempos de 30 y 90 minutos de batido. Por consiguiente, y al igual que se ha observado en el contenido de compuestos fenólicos, el perfil volátil de un aceite de oliva virgen puede modularse según las condiciones de tiempo y temperatura utilizadas durante el proceso de batido, de forma que es posible seleccionar las 169 4.2. Discusión General variables de trabajo para incrementar la intensidad de las notas sensoriales verdes y frutadas tan apreciadas en este producto. Además de los ensayos realizados en Almazara Experimental, con el objetivo de ampliar los rangos de tiempo-temperatura de batido estudiados se utilizó un sistema de procesado a escala de laboratorio (Abencor). Con la ampliación de estas condiciones se pone de manifiesto que en todos los casos se obtuvieron tendencias similares de evolución volátil y fenólica a las observadas en los aceites de oliva virgen obtenidos en almazara, siendo en algunos casos más o menos acusada. Aunque, en varios estudios llevados a cabo en plantas de extracción pequeñas, como son los trabajos descritos por Servili et al. (1994) o Angerosa et al. (2001), se ha observado un descenso significativo en la concentración de derivados secoiridoideos del hidroxitirosol de los AOV al incrementar la temperatura de batido, lo cual puede atribuirse a una actividad enzimática oxidativa excepcional que supone la degradación de estos compuestos al favorecerse el contacto del O2 atmosférico con la pasta de aceituna, fenómeno que es más evidente al procesar poca cantidad de muestra. En nuestro estudio con el sistema de laboratorio Abencor, donde se ha procesado alrededor de 1 Kg de fruto, no se ha observado esta tendencia. Por último, para poder establecer unas condiciones de batido óptimas en la variedad Cornicabra se deben tener en cuenta varios factores, como son el rendimiento de aceite obtenido durante el proceso de extracción y la calidad sensorial del aceite de oliva virgen, que depende principalmente como se ha comentado en numerosas ocasiones de los perfiles fenólicos y volátiles. Los resultados del estudio realizado sugieren que las condiciones de batido óptimas en esta variedad de aceituna serían temperaturas por debajo de 28 ºC y tiempos superiores a 60 minutos, ya que el reducido contenido fenólico obtenido mejoraría las propiedades sensoriales de este aceite de oliva virgen a través de una disminución en la intensidad del amargor percibido por los consumidores, sin afectar este aspecto de forma significativa a la vida útil del producto, ya que el elevado contenido fenólico natural de esta variedad asegura la estabilidad oxidativa de este aceite. Además, estas condiciones de batido favorecen la presencia de compuestos volátiles de la ruta LOX y consecuentemente las notas sensoriales verdes podrían incrementarse en el producto. Se puede concluir con que los resultados obtenidos en esta memoria de investigación han permitido ampliar el conocimiento existente sobre la influencia que ciertos factores agronómicos y tecnológicos ejercen sobre la composición minoritaria tanto del fruto de partida, como de la pasta de aceituna y sobretodo del aceite de oliva virgen resultante, favoreciendo especialmente el conocimiento de la variedad española Cornicabra, producto de gran repercusión económica en Castilla-La Mancha y en España. Asimismo, se ha puesto en evidencia como estos factores 170 4.2. Discusión General pueden ser utilizados a fin de incrementar la calidad sensorial del aceite de oliva virgen y la presencia de componentes de interés biológico, al permitir la modulación de los perfiles fenólicos y volátiles del mismo, permitiendo de esta forma adecuar los atributos sensoriales de este aceite vegetal a las exigencias de los consumidores y generando productos con una mayor competitividad en el mercado actual. 171 5. CONCLUSIONES 5. Conclusiones I. El estudio de la fracción fenólica de aceitunas de diferentes variedades españolas Arbequina, Cornicabra, Morisca, Picolimón, Picudo y Picual - ha confirmado a la oleuropeína como el compuesto fenólico más abundante de la drupa, así como el carácter de marcador varietal de la demetiloleuropeína, oleósido detectado solamente en la variedad Arbequina. II. Se ha observado una relación bastante heterogénea entre el contenido de oleósidos de la drupa y los compuestos secoiridoideos de los aceite de oliva virgen obtenidos en las diferentes variedades españolas estudiadas, con ratios que van desde 2,3 para el caso de Picudo hasta 28 en la variedad Picolimón. Por lo que se puede establecer que el contenido en derivados secoiridoideos de un aceite de oliva virgen depende principalmente de las actividades enzimáticas responsables de la degradación de los oleósidos y que están presentes en la drupa, las cuales presentan un marcado carácter varietal. III. Los niveles de E-2-hexenal detectados en el aroma de diversos aceites de oliva virgen monovarietales ha permitido su diferenciación en base a la variedad de procedencia. Además, la presencia de ésteres C6 -acetato de Z-3-hexenilo y acetato de hexilo- sólo se ha cuantificado de forma notable en las variedades Morisca, Arbequina y Picual especialmente, confirmando que la actividad de las enzimas de la ruta de la lipoxigenasa (LOX) se encuentra estrechamente asociada a factores genéticos. IV. La maduración del fruto implica un notable descenso en la fracción aldehídica C6 del aroma del aceite de oliva virgen, además de una disminución de su contenido en derivados secoiridoideos del hidroxitirosol y tirosol, a causa de la menor cantidad de precursores fenólicos presentes en la aceituna, como es el caso de la oleuropeína. V. El índice de madurez aconsejable para el procesado de los frutos Cornicabra en base a la evolución de su perfil de compuestos fenólicos y volátiles, se sitúa en valores de I.M entre 3,0 y 4,0. VI. La aplicación de riego en un olivar tradicional adulto Cornicabra ha puesto de manifiesto un aumento significativo de la productividad de los olivos bajo condiciones de riego respecto al secano (alrededor de un 35%), lo cual implica claramente un incremento de la producción global de aceite por hectárea de olivar. Por lo que la aplicación de riego deficitario se convierte en una técnica agronómica aconsejable desde un punto de vista social y económico, incluso en zonas donde las fuentes de agua son limitadas. VII. Se ha confirmado la ausencia de prácticamente cualquier relación significativa entre el estado hídrico del olivo y los índices de calidad normalizados evaluados en el aceite de oliva virgen (grado de acidez, índice de peróxidos y características de absorción en el UV) o con el contenido en tocoferoles del mismo, así como los pequeños cambios producidos por la aplicación de riego en el olivar sobre la composición de ácidos grasos global del producto. 175 5. Conclusiones VIII. El nivel de estrés hídrico registrado en los olivos a lo largo de las distintas campañas olivareras está relacionado directamente con el contenido en fenoles complejos del aceite de oliva virgen obtenido, afectando de manera especial a los derivados secoiridoideos del hidroxitirosol (3,4-DHPEA-EDA y 3,4-DHPEA-EA), e inversamente con la cantidad de aldehídos C6 y alcoholes C6 (como Z-3-hexen-1-ol y hexan-1-ol) cuantificados en el producto. IX. Se ha establecido una estrecha relación entre el contenido en oleuropeína de las drupas, y los niveles de derivados secoiridoideos presentes en los aceites, con los valores de potencial hídrico mínimos en los olivos jóvenes de las variedades Cornicabra y Morisca, durante la etapa fenológica III del desarrollo del fruto. X. Se ha puesto de manifiesto que el riego permite acentuar las notas sensoriales “verdes” y “frutadas” del aceite de oliva virgen, disminuyendo la intensidad del atributo sensorial “amargo”, siendo por tanto esta práctica agronómica aconsejable en aceites caracterizados bien por un bajo contenido en volátiles C6 o por una elevada concentración fenólica, como es el caso de la variedad Cornicabra. Por el contrario, esta técnica podría afectar negativamente a aceites de variedades caracterizadas por un bajo contenido fenólico natural, como Morisca o Arbequina, ya que podría suponer no sólo la obtención de aceites con escasa intensidad en los atributos “amargo” y “picante”, sino también un descenso excesivo en su estabilidad oxidativa que reduciría considerablemente la vida útil del producto. XI. La estrategia de riego deficitario regulado utilizada en el olivar adulto de Cornicabra durante la campaña 2004/05 (RDI-2), en donde la aplicación de riego se ha centrado en la etapa fenológica III del desarrollo del fruto, además de lograr un uso más racional y adecuado del agua disponible, permite recuperar el estado hídrico del olivo y alcanzar situaciones similares a las obtenidas con la metodología de riego recomendada por la FAO. XII. La programación de riego basada en la medida del potencial hídrico del tronco, con un umbral de -1,2 MPa (SWP -1,2), se puede proponer como una alternativa factible al cálculo del parámetro ETc en el que se basa la metodología de riego FAO, para realizar la planificación de las estrategias de irrigación en un olivar joven de cubierta incompleta. Por el contrario, la utilización de estrategias de irrigación basadas en las fluctuaciones del diámetro del tronco (TDF), genera niveles hídricos variables, por lo que su utilización a priori en el desarrollo de planificaciones de riego es imprecisa y por tanto su uso debería continuar bajo estudio. XIII. El estudio de la composición fenólica de la pasta de aceituna a lo largo de la etapa de batido, indica la rápida e inmediata acción de la enzima β-glucosidasa sobre la oleuropeína presente en el fruto de partida, quedando prácticamente reducida su actividad hidrolítica a la etapa inicial de molienda y dando lugar a la génesis mayoritaria de derivados secoiridoideos en la pasta de aceituna obtenida. 176 5. Conclusiones XIV. El incremento de la temperatura de batido de la pasta de aceituna en el proceso de elaboración implica un incremento significativo de los derivados secoiridoideos del hidroxitirosol y tirosol del aceite de oliva virgen, a la vez que se produce un notable descenso de la fracción aldehídica C6 presente en el aroma. XV. Tiempos de batido prolongados de la pasta de aceituna durante la elaboración favorecen la presencia del E-2-hexenal en el aroma del aceite de oliva virgen, mientras que no afecta de forma tan significativa a la cantidad de compuestos fenólicos presentes en el producto como lo hace la temperatura de trabajo, con la excepción de un ligero descenso de los derivados secoiridoideos del hidroxitirosol (3,4-DHPEA-EDA y 3,4-DHPEA-EA) y un aumento de los derivados del tirosol (p-HPEA-EDA y p-HPEA-EA). XVI. La posibilidad de modular el contenido fenólico y volátil de un aceite de oliva virgen en función del tiempo y la temperatura de batido empleados durante el proceso de batido supone la posibilidad tanto de aumentar el valor biológico de este producto, como de adecuar los niveles de los atributos positivos “frutado”, “amargo” y “picante” en el producto final. XVII. Para la variedad Cornicabra se sugieren como condiciones óptimas de batido temperaturas por debajo de 28 ºC y tiempos superiores a 60 minutos, ya que el menor contenido fenólico obtenido mejora las propiedades sensoriales de este aceite a través de una disminución en la intensidad de su amargor, sin afectar este aspecto de forma significativa a su vida útil, ya que el elevado contenido fenólico natural de esta variedad asegura su estabilidad oxidativa. Además, estas condiciones de batido favorecen la presencia de compuestos volátiles de la ruta LOX y por lo tanto las notas sensoriales verdes pueden incrementarse en el producto final. 177 6. BIBLIOGRAFÍA 6. Bibliografía Aeschbach, R., Loliger, J., Scott, B.C., Murcia, A., Butler, J., Halliwell, B. & Aruoma, O.I. (1994). Antioxidant actions of thymol, carvacrol, 6-gingerol, zingerone and hydroxytyrosol. Food and Chemical Toxicology, 32, 31-36. Amiot, M.J., Fleuriet, A. & Macheix, J.J. (1986). Importance and evolution of phenolic compounds in olive during growth and maturation. Journal of Agricultural and Food Chemistry, 34, 823-826. Amiot, M.J., Fleuriet, A. & Macheix, J.J. (1989). Accumulation of oleuropein derivatives during olive maturation. Phytochemistry, 28, 67-69. Andrewes, P., Busch, J., De Joode, T., Groenewegen, A. & Alexandre, H. (2003). Sensory properties of virgin olive oil polyphenols: Identification of deacetoxy-ligstroside aglycone as a key contributor to pungency. Journal of Agricultural and Food Chemistry, 51, 1415-1420. Angerosa, F., d’Alessandro, N., Konstantinou, P. & Di Giacinto, L. (1995). GC-MS Evaluation of phenolic compounds in virgin olive oil. Journal of Agricultural and Food Chemistry, 43, 18021807. Angerosa, F., Lanza, B. & Marsilio, V. (1996a). Biogenesis of “fusty” defect in virgin olive oils. Grasas Aceites, 47, 142-150. Angerosa, F. & Di Giovacchino, L. (1996b). Natural antioxidants of virgin olive oil obtained by two and tri-phase centrifugal decanters. Grasas y Aceites, 47, 247-254. Angerosa, F., Di Giacinto, L. & d´Alessandro, N. (1997). Relationship between aroma components and malaxation time of olive paste. Journal of High Resolution Chromatography, 20, 507-510. Angerosa, F., Camera, L., d’Alessandro, N. & Mellerio, G. (1998a). Characterization of seven new hydrocarbon compounds present in the aroma of virgin olive oils. Journal of Agricultural and Food Chemistry, 46, 648-653. Angerosa, F., d´Alessandro, N., Basti, C. & Vito, R. (1998b). Biogeneration of volatile compounds in virgin olive oil: Their evolution in relation to malaxation time. Journal of Agricultural and Food Chemistry, 46, 2940-2944. Angerosa, F., Basti, C. & Vito, R. (1999a). Virgin olive oil volatile compounds from lipoxigenase pathway and characterization of some Italian cultivars. Journal of Agricultural and Food Chemistry, 47, 836-839. Angerosa, F., Lanza, B., d´Alessandro, N., Marsilio, V. & Cumitini, S. (1999b). Olive oil off-odour compounds produced by Aspergillus and Penicillium. Presentado en el 3º Simposio Internacional “Olive Growing”. Chania, Creta. Acta Horticulturae, 474, pp. 695. 181 6. Bibliografía Angerosa, F. (2000a). En Handbook of Olive Oil: Analysis and properties. Eds. J. Harwood y R. Aparicio, Aspen Publ. Inc. Gaitersburg, Maryland (USA), pp. 355-392. Angerosa, F., Mostallino, R., Basti, C., Vito, R. & Serraiocco, A. (2000b). Virgin olive oil differentiation in relation to extraction methodologies. Journal of Science and Food Agriculture, 80, 2190-2195. Angerosa, F., Mostallino, R., Basti, C. & Vito, R. (2000c). Virgin olive oil odour notes: their relationship with volatile compounds from the lipoxygenase pathway and secoiridoid compounds. Food Chemistry, 68, 283-287. Angerosa, F., Mostallino, R., Basti, C. & Vito, R. (2001). Influence of malaxation temperature and time on the quality of virgin olive oils. Food Chemistry, 72, 19-28. Angerosa, F. (2002). Influence of volatile compounds on virgin olive oil quality evaluated by analytical approaches and sensor panels. European Journal of Lipid Science and Technology, 104, 639-660. Angerosa, F. & Basti, C. (2003). The volatile composition of samples from the blend of monovarietal olive oils and from the processing of mixtures of olive fruits. European Journal of Lipid Science and Technology, 105, 327-332. Angerosa, F., Servili, M., Selvaggini, R., Taticchi, A., Esposto, S. & Montedoro, G.F. (2004). Volatile compounds in virgin olive oil: occurrence and their relationship with the quality. Journal of Chromatography A, 1054, 17-31. Aparicio, R. & Morales, M.T. (1995). Sensory wheels: a statistical technique for comparing QDA panels. Application to virgin olive oil. Journal of Science and Food Agriculture, 67, 247-257. Aparicio, R., Morales, M.T. & Alonso, M.V. (1996). Relationship between volatile compounds and sensory attributes of olive oil by the sensory wheel. Journal of American Oil Chemists Society, 73, 1253-1264. Aparicio, R. & Morales, M.T. (1998). Characterization of olive ripeness by green aroma compounds of virgin olive oil. Journal of Agricultural and Food Chemistry, 46, 1116-1122. Aparicio, R., Rocha, S.M., Delgadillo, I. & Morales, M.T. (2000). Detection of rancid defect in virgin olive oil by the electronic nose. Journal of Agricultural and Food Chemistry, 48, 853860. Aparicio, R. & Luna, G. (2002). Characterisation of monovarietal virgin olive oil. European Journal Lipid Science and Technology, 104, 614-627. Artajo, L.S., Romero, M.P., Suarez, M. & Motilva, M.J. (2006). Partition of phenolic compounds during the virgin olive oil industrial extraction process. European Food Research Technology, 225, 617-625. 182 6. Bibliografía Aziz, N.H., Farag, S.E., Mousa, L.A.A. & Abo Zaid, M.A. (1998). Comparative antibacterial and antifungal effects of some phenolic compounds. Micobios., 93, 43-54. Baldioli, M., Servili, M., Peretti, G. & Montedoro, G.F. (1996). Antioxidant activity of tocopherols and phenolic compounds of virgin olive oil. Journal of American Oil Chemists Society, 73, 1589-1593. Beauchamp, G. K., Keast, R. S. J., Morel, D., Lin, J., Pika, J., Han, Q., Lee, C.-H., Smith, A. B., III & Breslin, P. A. S. (2005). Ibuprofen-like activity in extra virgin olive oil: Enzymes in an inflammation pathway are inhibited by oleocanthal, a component of olive oil. Nature, 437, 45-46. Bedoukian, P.Z. (1971). Seven primary hexenols and their olfactory characteristics. Journal of Agricultural and Food Chemistry, 19, 1111-1114. Beede, R.H. & Goldhamer, D.A. (1994). Olive Irrigation Management. En Olive Production Manual. Eds: Ferguson, L.; Sibetti, G.S.; Martin, G.C., Universidad de California, Oakland, pp. 61-68. Benincasa, C., De Nino, A., Lombardo, N., Perri, E., Sindona, G. & Tagarelli, A. (2003). Assay of aroma active components of virgin olive oils from southern Italian regions by SPMEGC/ion trap mass spectrometry. Journal of Agricultural and Food Chemistry, 51, 733-741. Berenguer, M.J., Vossen, P.M., Grattan, S.R., Connell, J.H. & Polito, V.S. (2006). Tree irrigation levels for optimum chemical and sensory properties of olive oil. Horticultural Science, 41, 427-432. Bianco, A.D., Piperno, A., Romeo, G. & Uccella, N. (1999). NMR experiments of oleuropein biomimetic hydrolisis. Journal of Agricultural and Food Chemistry, 47, 3665-3668. Brenes, M., García, P. & Garrido, A. (1992). Phenolic compounds related to the black colour formed during the processing of ripe olives. Journal of Agricultural and Food Chemistry, 40, 1192-1196. Brenes, M., García, A., García, P., Ríos, J.J. & Garrido, A. (1999). Phenolic compounds in Spanish olive oils. Journal of Agricultural and Food Chemistry, 47, 3535-3540. Brenes, M., Hidalgo, F.J., García, A., Ríos, J.J., García, P., Zamora, R. & Garrido, A. (2000). Pinoresinol, and 1-acetoxypinoresinol, two new phenolic compounds identified in olive oil. Journal of American Oil Chemists Society, 77, 715-720. Briante, R., Patumi, M., Limongelli, S., Febbraio, F., Vaccaio, C., DiSalle, A., LaCara, F. & Nucci, R. (2002). Changes in the phenolic and enzymatic activities content during fruit ripening in two Italian cultivars of Olea europaea L. Plant Science, 162, 791-798. 183 6. Bibliografía Camera, L. & Solinas, M. (1990). Identification of some volatile compounds of olive oil by GCMS. Proceedings del Seminario Internacional “Olive Oil and Table Olives: Technology Aspects and Quality”, Cittá S. Angelo (Italia), pp. 153-168. Caponio, F., Gomes, T., Summo, C. & Pasqualone, A. (2003). Influence of the type of olivecrusher used on the quality of extra virgin olive oils. European Journal of Lipid Science and Technology, 105, 201-206. Carrasco-Pancorbo, A., Cerretani, L., Bendini, A., Segura-Carretero, A., Del Carlo, M., GallinaToschi, T., Lercker, G., Compagnone, D. & Fernández-Gutiérrez, A. (2005). Evaluation of the antioxiadnt capacity of individual phenolic compounds in virgin olive oil. Journal of Agricultural and Food Chemistry, 53, 8918-8925. Cavalli, J.F., Fernandez, X., Lizzani-Cuvelier, L. & Loiseau, A.M. (2004). Characterization of volatile compounds of French and Spanish virgin olive oils by HS-SPME: identification of quality-freshness markers. Food Chemistry, 88, 151-157. Chimi, H., Cillard, J., Cillard, P. & Rahmani, M. (1991). Cinetic of degradation for fatty acids and phenolic compounds in micellar solution. Reveu Francaise des Corps Gras, 38, 225-231. COI, 1987. Consejo Oleícola Internacional. Análisis Sensorial: vocabulário básico general. T. 20/Documento nº 4. COI, 2005. Consejo Oleícola Internacional. Norma comercial aplicable al aceite de oliva y al aceite de orujo de oliva. T.15/Documento nº 3. Comisión Unión Europea. (1991). Reglamentación CEE 2568/91 sobre las características de los aceites de oliva y sus métodos analíticas. Boletín Oficial de las Comunidades Europeas. Comisión Unión Europea. (2002). Reglamentación CE 796/2002. Boletín Oficial de las Comunidades Europeas. Comisión Unión Europea. (2003). Reglamentación CE 1989/2003. Boletín Oficial de las Comunidades Europeas. Comisión Unión Europea. (2008). Reglamentación CE 640/2008. Boletín Oficial de las Comunidades Europeas. Damtoft, S., Franzyk, H. & Jensen, S.R. (1993). Biosynthesis of secoiridoid glucosides in Oleaceae. Phytochemistry, 34, 1291-1299. D´Andria, R., Morelli, G., Martuccio, G., Fontanazza G. & Patumi, M. (1996). Valutazione della produzione e della qualita´dell´olio di Giovanni piante di olivo allevate con diversi regimi idrici. Italus Hortus, 3, 23-31. Deiana, M., Aruoma, O.I., Bianchi, M.P., Spencer, J.P.E., Harparkash, K., Halliwell, B., Haeschbach, R., Banni, S., Dessi, M.A. & Corongiu, F. (1999). Inhibition of peroxynitrile 184 6. Bibliografía dependent DNA base modification and tyrosine nitration by the extra virgin oliveoil-derived antioxidante hydroxytyrosol. Free Radical Biology and Medicine, 26, 762-770. Dettori, S. & Russo, G. (1993). Influencia del cultivar y del régimen hídrico sobre el volumen y la calidad del aceite de oliva. Olivae, 49, 36-43. Di Giovacchino, L. (1991). L´estrazione dell´olio con la centrifugazione diretta delle paste di oliva. Nota I: influenza della gramolazione. Rivista Italiana delle Sostanze Grasse, 68, 314420. Di Giovacchino, L., Solinas, M. & Miccoli, M. (1994). Effect of extraction systems on the quality of virgin olive oil. Journal of American Oil Chemists Society, 71, 1189-1194. Di Giovacchino, L. & Serraiocco, A. (1995). Influenza dei sistemi di lavorazione delle olive sulla composizione dello spazio di testa degli oli. Rivista Italiana delle Sostanze Grasse, 72, 443450. Di Giovacchino, L., Costantini, N., Serraiocco, A., Surricchio, G. & Basti, C. (2001). Natural antioxidants and volatile compounds of virgin olive oils obtained by two or three-phases centrifugal decanters. European Journal of Lipid Science and Technology, 103, 279-285. Di Giovachino L., Sestili S. & Di Vincenzo D. (2002). Influence of olive processing on virgin olive oil quality. European Journal of Lipid Science and Technology, 104, 587-601. Doorenbos, J. & Pruitt, WO. (1977). Crop water requirements. FAO Irrigation and drainage paper nº 24. Food and Agriculture Organization of the United Nations, Roma. Esti, M., Cinquanta, L. & La Notte, E. (1998). Phenolic compounds in different olive varieties. Journal of Agriculture and Food Chemistry, 46, 32-35. Fereres, E. & Goldhamer, D. (1990). Deciduous fruit and nut trees. En Eds. Stewart, B.A., Nielsen, B.A., D.R. Irrigation of Agricultural Crops. Agronomy Monograph nº 30. American Society of Agronomy, USA, pp. 987-1017. Fereres, E., Goldhamer, D.A. & Parsons, L.R. (2003). Irrigation water management of horticultural crops. Horticultural Science, 38, 1036–1042. Fleming, H.P., Walter, W.M. & Etchells, J.L. (1973). Antimicrobial properties of oleuropein and products of its hydrolysis from green olives. Journal of Applied Microbiology, 26, 777-782. Fleuriet, A., Macheix, J.J., Andary, C. & Villemur, P. (1984). Mise en évidence et dosage par chromatographie liquide à haute performance du verbascoside dans le fruit de six cultivars d’Olea europaea. L.C.R. Academy Science Paris, Ser III nº 7, 253-256. Gandul-Rojas, B. & Mínguez-Mosquera, M.I. (1996). Chlorophyll and carotenoid composition in virgin olive oils from various Spanish olive varieties. Journal of Science and Food Agriculture, 72, 31-39. 185 6. Bibliografía García, J.M., Seller, S. & Pérez-Camino, M.C. (1996). Influence of fruit ripening on olive oil quality. Journal of Agricultural and Food Chemistry, 44, 3516-3520. García, J.M., Yousfi, K., Mateos, R., Olmo, M. & Cert, A. (2001). Reduction of oil bitterness by heating of olive (Olea europaea) fruits. Journal of Agricultural and Food Chemistry, 49, 4231-4235. García-González, D. & Aparicio, R. (2002). Classification of defective virgin olive oils by metal oxide sensors. European Food Research and Technology, 215, 118-123. García-González, D. & Aparicio, R. (2003). Virgin olive oil quality classification combining neural network and MOS sensors. Journal of Agricultural and Food Chemistry, 51, 3515-3519. García-González, D., Tena, N. & Aparicio, R. (2007). Characterization of olive paste volatiles to predict the sensory quality of virgin olive oil. European Journal of Lipid Science and Technology, 109, 663-672. Gennaro, L., Piciola Bocca, A., Modesti, D., Masella, R. & Coni, E. (1998). Effect of biophenols on olive oil stability evaluated by thermogravimetric analysis. Journal of Agricultural and Food Chemistry, 46, 4465-4469. Goldhamer, D.A. & Fereres, E. (2001). Irrigation scheduling protocols using continuously recorded trunk diameter measurements. Irrigation Science, 20, 115-125. Gómez-Alonso, S., Savador, M.D. & Fregapane, G. (2002). Phenolic compounds profile of Cornicabra virgin olive oil. Journal of Agricultural and Food Chemistry, 50, 6812-6817. Gómez-Rico, A., Salvador, M.D., La Greca, M. & Fregapane, G. (2006). Phenolic and volatile compounds of extra virgin olive oil (Olea europaea L. Cv. Cornicabra) with regard to fruit ripening and irrigation management. Journal of Agricultural and Food Chemistry, 54, 71307136. Gómez-Rico, A., Salvador, M.D., Moriana, A., Pérez, D., Olmedilla, N., Ribas, F. & Fregapane, G. (2007). Influence of different irrigation strategies in a traditional Cornicabra cv. olive orchard on virgin olive oil composition and quality. Food Chemistry, 100, 568-578. Grosch, W. (1993). Detection of potent odorants in foods by aroma extract dilution analysis. Trends in Food Science and Technology, 4, 68-73. Gucci, R., Lodolini, E. & Rapaport, H.F. (2007). Productivity of olive tress with different water status and crop load. Journal of Horticultural Science & Biotechnology, 82, 648-656. Gutfinger, T. (1981). Polyphenols in olive oils. Journal of American Oil Chemists Society, 58, 966-968. 186 6. Bibliografía Gutiérrez, R., Janer del Valle, C., Janer del Valle, M.L., Gutiérrez-Rosales, F., VazquezRoncero, A. (1977). Relación entre los polifenoles y la calidad y la estabilidad del aceite de oliva virgen. Grasas y Aceites, 28, 101-106. Gutierrez, F., Albi, M.A., Palma, R., Rios, J.J. & Olias, J.M. (2000). Bitter taste of virgin olive oil: Correlation of sensory evaluation and instrumental HPLC analysis. Journal of Food Science, 54, 68-70. Gutiérrez-Rosales, F., Perdiguero, S., Gutiérrez, R. & Olías, J.M. (1992). Evaluation of bitter taste in virgin olive oil. Journal of American Oil Chemists Society, 69, 394-395. Gutiérrez-Rosales, F., Rios, J.J. & Gomez-Rey, M.L. (2003). Main polyphenols in the bitter taste of virgin olive oil. Structural confirmation by on-line high-performance liquid chromatography electrospray ionization mass spectrometry. Journal of Agricultural and Food Chemistry, 51, 6021-6025. Haslam, E. (1993). Shikimic acid: Metabolism and metabolites. Wiley, Chichester. Heredia, A., Fernández, J. & Guillén, R. (1990). Cellulase inhibition by polyphenols in olive fruits. Food Chemistry, 38, 69-73. Impellizzeri, J. & Jianming, L. (2006). A simple high-performance liquid chromatography method for the determination of throat-burning oleocanthal with probated antiinflammatory activity in Extra Virgin Olive Oils. Journal of Agricultural and Food Chemistry, 54, 3204-3208. Inglese, P., Barobe, E. & Gullo, G. (1996). The effect of complementary irrigation on fruit growth, ripening pattern and oil characteristics of olive (Olea europaea L.) cv. Carolea. Journal of Horticultural Science, 71, 257-263. Jiménez Márquez, A., Hermoso Fernández, M. & Uceda Ojeda, M. (1995). Elaboración del aceite de oliva virgen mediante sistema continuo en dos fases. Influencia de diferentes variables del proceso en algunos parámetros relacionados con la calidad del aceite. Grasas y Aceites, 46, 299-303. Jung, D.M., De Ropp, J.S. & Ebeler, S.E. (2000). Study of interactions between food phenolics and aromatic flavors using one- and two dimensional H-1 NMR spectroscopy. Journal of Agricultural and Food Chemistry, 48, 407-412. Kalua, C.M., Allen, M.S., Bedgood, D.R., Bishop, A.G. & Prenzler, P.D. (2005). Discrimination of olive oils and fruit into cultivars and maturity stages based on phenolic and volatile compounds. Journal of Agriculture and Food Chemistry, 53, 8054-8062. Kalua, C.M., Bedgood, D.R., Bishop, A.G. & Prenzler, P.D. (2006). Changes in volatile and phenolic compounds with malaxation time and temperature during Virgin Olive Oil production. Journal of Agricultural and Food Chemistry, 54, 7641-7651. 187 6. Bibliografía Kiritsakis, A. K. (1998a). Flavor components of olive oil - a review. Journal of American Oil Chemists Society, 75(6), 673-681. Kiritsakis, A. K., Nanos, G.D., Polymenopoulos, Z., Thomai, T. & Sfakiotakis. E.M. (1998b). Effect of fruit storage conditions on olive oil quality. Journal of American Oil Chemists Society, 75, 721-724. Kubo, I. & Matsumoto, A. (1984). Molluscicides from Olea europaea and their efficient isolation by countercurrent chromatographies. Journal of Agriculture and Food Chemistry, 32, 687688. Lavee, S., Nashef, M., Wodner, M. & Harshemesh, H. (1990). The effect of complementary irrigation added to old olive trees (Olea europaea L., cv. Souri) on fruit characteristic, yield and oil production. Adv. Horticultural Science, 4, 135-138. Lavee, S. & Wodner, M. (1991). Factors affecting the nature of oil accumulation in fruit of olive (Olea europaea L.) cultivars. Journal of Horticultural Science, 66, 583-591. Lavee, S. & Wodner, M. (2004). The effect of yield, harvest time and fruit size on the oil content in fruits of irrigated olive trees (Olea europaea), cvs. Barnea and Manzanillo. Scientia Horticulturae, 99 (3-4), 267-277. Laübli, M.W. & Bruttel, P.A. (1986). Determination of the oxidative stability of fats and oils by the Rancimat method. Journal of American Oil Chemists Society, 63, 792-795. Lercker, G., Frega, N., Bocci, F & Mozzori, M. (1999). Volatile constituents and oxidative stability of virgin olive oils: influence of the kneading of the olive paste. Grasas y Aceites, 50, 26-29. Limiroli, R., Consonni, R., Ottolina, G., Marsilio, V., Bianchi, G. & Zetta, L. (1995). 1H and 13 C NMR characterization of new oleuropein aglycones. Journal of American Oil Chemists Society, 1, 1519-1523. Litridou, M., Linssen, J., Schols, H., Bergmans, M., Posthumus, M., Tsimidou, M. & Boskou, D. (1997). Phenolic compounds in virgin olive oils: fractionation by solid phase extraction and antioxidant activity assessment. Journal of Science and Food Agriculture, 74, 169-174. Lo Scalzo, R. & Scarpati, M.L. (1993). A new secoidoid from olive wastewaters. Journal of Natural Products, 56, 621-623. Lo Scalzo, R., Scarpati, M.L., Verregnassi, B. & Vita, G. (1994). Olea europaea chemicals repellents to Dacus oleae females. Journal of Chemical Ecology, 20, 1813-1823. Luna, G., Morales, M.T. & Aparicio, R. (2006). Characterisation of 39 varietal virgin olive oils by their volatile compositions. Food Chemistry, 98, 243-252. 188 6. Bibliografía Macheix, J.J., Fleuriet, A. & Billot, J. (1990). Fruit phenolics; CRC Press: Boca Raton, Florida (USA), pp. 1-126. MacRae, W.D. & Towers, G.H.N. (1984). Biological activities of lignans. Phytochemistry, 23, 1207-1220. M.A.P.A. (2004). Anuario de Estadística Agroalimentaria. Ministerio de Agricultura, Pesca y Alimentación. Manna, C., Galletti, V., Cucciolla, P., Montedoro, G.F. & Zappia, V. (1999). Olive oil hydroxytyrosol protects human erythrocytes against oxidative damages. Journal of Nutritional Biochemistry, 10, 159-165. Martin-Moreno, J.M., Willet, W.C., Gorgojo, L., Banegas, J.R., Rodriguez-Artalejo, F., Fernandez-Rodriguez, J.C., Maisonneuve, P. & Boyle, P. (1994). Dietary-fat, olive oil intake and breast-cancer risk. International Journal of Cancer, 58, 774-780. Martínez, J.M., Muñoz, E., Alba, J. & Lanzón, A. (1975). Informe sobre utilización del analizador de rendimiento Abencor. Grasas y aceites, 26, 379-385. Mateos, R. (2002). Caracterización de componentes fenólicos del aceite de oliva y su relación con la estabilidad oxidativa y el amargo. Director Cert, A., Tesis Doctoral, Universidad de Sevilla. Mateos, R., Espartero, J.L., Trujillo, M., Ríos, J.J., León-Camacho, M., Alcudia, F. & Cert, A. (2001). Determination of phenols, flavones and lignans in virgin olive oil by solid-phase extraction and high-performance liquid chromatography with diode array ultraviolet detection. Journal of Agriculture and Food Chemistry, 49, 2185-2192. Mínguez-Mosquera, M.I. & Garrido-Fernández, J. (1989). Chlorophyll and carotenoid presence in olive fruit (Olea europaea). Journal of Agriculture and Food Chemistry, 37, 1-7. Mínguez-Mosquera, M.I., Rejano, L., Gandul, B., Sánchez, A.H. & Garrido-Fernández, J. (1991). Color-pigment correlation in virgin olive oil. Journal of American Oil Chemists Society, 68, 332-336. Myers, B.J. (1998). Water stress integral a link between short-term stress and long term growth. Tree Physiology, 4, 315-323. Montedoro, G.F. & Cantarelli, C. (1969). Investigations on the phenolic substances present in olive oils. Rivista Italiana delle Sostanze Grasse, 46, 115-124. Montedoro, G. & Servili, M. (1991). Chimica e qualità dell’ olio di oliva: i fattori che la condizionano. Libro de abstracts del Congreso “ L’ olio di oliva ed il suo futuro”, Spoleto (Italia), 6-7 Diciembre 1991, pp. 33-55. 189 6. Bibliografía Montedoro, G.F. et al. (1992). Simple and hydrolyzable phenolic compounds in virgin olive oil. 1. Their extraction, separation and quantitative and semiquantitative evaluation by HPLC. Journal of Agriculture and Food Chemistry, 40, 1571-1576. Montedoro, G.F., Servili, M., Baldioli, M., Selvaggiani, R., Miniati, E. & Macchioni, A. (1993). Simple and hydrolyzable compounds in virgin olive oil. 3. Spectroscopic characterizations of the secoiridoids derivatives. Journal of Agriculture and Food Chemistry, 41, 2228-2234. Morales, M.T. & Aparicio, R. (1993). Characterizing some European olive oils varieties by volatiles using statistical tools. Grasas y Aceites, 44, 113-115. Morales, M.T., Aparicio, R. & Rios, J.J. (1994). Dynamic headspace gas chromatographic method for determining volatiles in virgin olive oil. Journal of Chromatography A, 668, 455462. Morales, M.T., Alonso, M., Rios J.J. & Aparicio, R. (1995). Virgin olive oil aroma: relationship between volatile compounds and sensory attributes by chemometrics. Journal of Agricultural and Food Chemistry, 43, 2925-2931. Morales, M.T., Aparicio, R. & Calvente, J.J. (1996). Influence of olive ripeness on the concentration of green aroma compounds in virgin olive oil. Flavour Fragrance Journal, 11, 171-178. Morales, M.T., Ríos, J.J. & Aparicio, R. (1997). Changes in the volatile composition of virgin olive oil during oxidation: flavours and off-flavors. Journal of Agricultural and Food Chemistry, 45, 2666-2673. Morales, M.T. & Tsimidou, M. (2000). The role of volatile compounds and polyphenols in olive oil sensory quality. En Handbook of Olive Oil: Analysis and properties. Eds. J. Harwood y R. Aparicio, Aspen Publ. Inc. Gaitersburg, Maryland (USA), pp. 393-458. Morales, M. T., Luna, G. & Aparicio, R. (2005). Comparative study of virgin olive oil sensory defects. Food Chemistry, 91, 293-301. Morelló, J.R., Romero, M.P. & Motilva, M.J. (2004). Effect of maturation process of the olive fruit on the phenolic fraction of drupes and oils from Arbequina, Farga and Morrut cultivars. Journal of Agricultural and Food Chemistry, 52, 6002-6009. Morelló, J.R., Vuorela, S., Romero, M.P., Motilva, M.J. & Heinonen M. (2005). Antioxidant activity of olive pulp and olive oil phenolic compounds of the Arbequina Cultivar. Journal of Agricultural and Food Chemistry, 53, 2002-2008. Moriana, A. & Fereres, E. (2002). Plant indicator for scheduling irrigation of young olive trees. Irrigation Science, 21, 83-90. 190 6. Bibliografía Moriana, A., Orgaz, F., Fereres, E. & Pastor, M. (2003). Yield responses of mature olive orchard to water deficits. Journal of American Society Horticultural Science, 128, 425-431. Moriana, A., Pérez-López, D., Gómez-Rico, A., Salvador, M.D., Olmedilla, N., Ribas, F. & Fregapane, G. (2007). Irrigation scheduling for traditional, low-density olive orchards: Water relations and influence on oil characteristics. Agricultural Water Management, 87, 171-179. Motilva, M.J., Romero M.P., Alegre, S. & Girona, J. (1999). Effect of regulated deficit irrigation in olive oil production and quality. Acta Horticulturae, 474, 377-380. Motilva, M.J., Tovar, M.J., Romero, M.P., Alegre, A. & Girona, J. (2000). Influence of regulated deficit irrigation strategies applied to olive trees (Arbequina cultivar) on oil yield and oil composition during the fruit ripening. Journal of Science and Food Agriculture, 80, 20372043. Naor, A. (2003). Practical implications in scheduling irrigation of deciduous trees. 4º Simposio Internacional sobre “Irrigation on Horticultural Crops”. Libro de Abstracts, pp. 85. Nergiz, C. & Ünal, K. (1991). Effect of method of extraction on the total polyphenol, 1,2-diphenol content and stability of virgin olive oil. Journal of Science and Food Agriculture, 56, 79-84. Nikaido, T., Ohmoto, T., Kinoshita, T., Sankawa, U., Nishibe, S. & Hisada, S. (1981). Inhibition of cyclic AMP phosphodiesterase by lignans. Chemical and Pharmacological Bulletin, 29, 3586-3592. Ninfali, P., Bacchiocca, M., Biagiotti, E., Servili, M., Begliomini, A.L. & Montedoro, G.F. (2002). Validation of the oxygen radical absorbance capacity (ORAC) parameter as a new index of quality and stability of virgin olive oil. Journal of the American Oil Chemists Society, 79, 977982. Normas UNE (Asociación Española de Normalización y Certificación). (1973). UNE 55032: Materias grasas. Determinación del contenido en materia grasa total del orujo de aceituna. AENOR, Madrid. Olías J.M., Gutiérrez, Dobarganes & Gutiérrez. (1980). Componentes volátiles en el aroma del aceite de oliva. IV. Su evolución e influencia en el aroma durante el proceso de maduración de los frutos en las variedades Picual y Hojiblanca. Grasas y Aceites, 31, 391-402. Olias, J.M., Perez, A.G., Rios, J.J. & Sanz, L.C. (1993). Aroma of virgin olive oil: biogenesis of the “green” odor notes. Journal of Agricultural and Food Chemistry, 41, 2368-2373. Oomad, B.D. & Mazza, G. (1998). Flaxseed products for disease prevention. En Functional foods. Eds. G. Mazza, Technomic Publishing Company, Inc., Lancaster, pp. 91-138. Orgaz, F., Fereres, E. (1997). Riego. En «El cultivo del olivo». Eds. Barranco, D., Fernández Escobar, R., Rallo, L. Mundiprensa, Madrid, pp. 251-271. 191 6. Bibliografía Owen, R.W., Mier, W., Giacosa, A., Hull, W.E., Spiegelhalder, B. & Bartsch, H. (2000a). Identification of lignans as major components in the phenolic fraction of olive oil. Clinical Chemistry, 46, 976-988. Owen, R.W., Giocosa, A., Hull, W.E., Haubner, R., Spiegelhalder, B. & Bartsch, H. (2000b). The antioxidant/anticancer potential of phenolic compounds isolated from olive oil. European Journal of Cancer, 36, 1235-1247. Pannelli, G., Famiani, F., Servili, M. & Montedoro, G.F. (1989). Agro-climatic factors and characteristics of the composition of virgin olive oils. Acta Horticulturae, 286, 477-480. Panizzi, L., Scarpati, M.L. & Oriente, G. (1960). Structure of oleuropein, bitter glycoside with hypotensive action of olive oil. Nota II. Gazz. Chim. Ital. 90, 1449-1485. Papadopoulos, G. & Boskou, D. (1991). Antioxidant effect of natural phenols on olive oil. Journal of the American Oil Chemists Society, 68, 669-671. Pastor, M.J., Castro, M.J., Mariscal, V., Vega, F., Orgaz, F., Fereres, E. & Hidalgo, J. (1999). Respuesta del olivar tradicional a diferentes estrategias y dosis de agua de riego. Investigación Agraria, 14, 393-404. Patumi, M., d´Andria, R., Fontanazza, G., Morelli, G., Giori, P. & Sorrentino, G. (1999). Yield and oil quality of intensively trained trees of three cultivars of olive under different irrigation regimes. Journal of Horticultural Science and Biotechnology., 74, 729-737. Patumi, M., d´Andria, R., Marsilio, G., Fontanazza, G., Morelli, G. & Lanza, B. (2002). Olive and olive oil quality after intensive monocone olive growing (Olea europaea L., cv. Kalamata) in different irrigation regimes. Food Chemistry, 77, 27-34. Pelosi, P. (1994). Odorant-binding proteins. Critical Reviews in Biochemistry and Molecular Biology, 29, 199-228. Petroni, A., Blasevich, M., Salami, M., Papini, N., Montedoro, G.F. & Galli, C. (1995). Inhibition of platelet-aggregation and eicosanoid production by phenolic components of olive oil. Thrombosis Research, 78, 151-160. Raina, B.L. (1995). Production, composition, storage and processing. En Handbook of fruit science and technology. Eds. Salunkhe, D.K., Kadam, S.S., Marcel Dekker, New York (USA). Ranalli, A. & Angerosa, F. (1996). Integral centrifuges for olive oil extraction: The qualitative characteristics of products. Journal of the American Oil Chemists Society, 73, 417-422. Ranalli, A. & Costantini, N. (1998). Nuovi sviluppi della ricerca sui trattamenti enzimatici delle paste di olive. Riflessi sui parametri compositivi dell’olio. Rivista Di Frutticoltura, 7/8, 73-76. 192 6. Bibliografía Ranalli, A., Contento, S., Schiavone, C. & Simone, N. (2001). Malaxing temperature affects volatile and phenol composition as well as other analytical features of virgin olive oil. European Journal of Lipid Science and Technology, 103, 228-238. Ranalli, A., Pollastri, L., Contento, S., Lannucci, E. & Lucera, L. (2003). Effect of paste kneading process time on the overall quality of virgin olive oil. European Journal of Lipid Science and Technology, 105, 57-67. Reineccius, G. (1993). Biases in analytical flavor profiles introduced by isolation method. Flavour measurement, 8, 61-76. Reiners, J. & Grosch, W. (1998). Odorants of virgin olive oils with different flavor profiles. Journal of Agricultural and Food Chemistry, 46, 2754-2763. Rocca, B. & Fitzgerald, G.A. (2002). Cyclooxygenases and prostaglandins: shaping up the immune response. International Immunopharmacology, 2, 603-630. Rodis P.S., Karathanos, V.T. & Mantzavinou, A. (2002). Partitioning of olive oil antioxidants between oil and water phases. Journal of Agricultural and Food Chemistry, 50, 596-601. Romani, A., Mulinacci, N., Pinelli, P., Vincieri, F. & Cimato, A. (1999). Polyphenolic content in five tuscany cultivars of Olea europaea L. Journal of Agriculture and Food Chemistry, 47, 964-967. Romero, M.P., Tovar, M.J., Girona, J. & Motilva, M.J. (2002). Changes in the HPLC phenolic profile of virgin olive oil from young trees (Olea europaea L. cv. Arbequina) grown under different deficit irrigation strategies. Journal of Agricultural and Food Chemistry, 50, 53495354. Rossiter, K.J. (1996). Structure-odor relationships. Chemistry Reviews, 96, 3201-3240. Rotondi. A., Bendini, A., Cerretani, L., Mari, M., Lercker, G. & Gallina-Toschi, T. (2004). Effect of ripening degree on the oxidative stability and organoleptic properties of cv. Nostrana di Brisighella extra virgin olive oil. Journal of Agricultural and Food Chemistry, 52, 3649-3654. Ryan, D. & Robards, K. (1998). Phenolic compounds in olives. Analyst, 123, 31R-44R. Ryan, D., Robards, K. & Lavee, S. (1999). Determination of phenolic compounds in olives by reversed-phase chromatography and mass spectrometry. Journal of Chromatography A, 832, 87-96. Ryan, D., Antolovich, M., Prenzler, P., Robards, K. & Lavee, S. (2002). Biotransformations of phenolic compounds in Olea europaea L. Scientia Horticulturae, 92, 147-176. Salas, J., Pastor, M., Castro, J. & Vega, V. (1997). Influencia del riego sobre la composición y características del aceite de oliva. Grasas y Aceites, 48, 74-82. 193 6. Bibliografía Salas, J.J. & Sánchez, J. (1998). Alcohol dehydrogenases from olive (Olea europaea) fruit. Phytochemistry, 48, 35-40. Salas, J.J. & Sánchez, J. (1999a). The decrease of virgin olive oil flavour produced by high malaxation temperature is due to inactivation of hydroperoxide lyase. Journal of Agricultural and Food Chemistry, 47, 809-812. Salas, J.J. & Sánchez, J. (1999b). Hydroperoxide lyase from olive (Olea europaea) fruits. Plant Science, 143, 19-26. Salas, J.J., Williams, M., Harwood, J. L. & Sánchez, J. (1999c). Lipoxygenase activity in olive (Olea europaea) fruit. Journal of the American Oil Chemists Society, 76, 1163-1168. Salas, J.J. (2004). Characterization of alcohol acyltransferase from olive fruit. Journal of Agricultural and Food Chemistry, 52, 3155-3158. Salvador, M.D., Aranda, F. & Fregapane, G. (1998). Chemical composition of commercial Cornicabra virgin olive oils from 1995/96 to 1996/97 crops. Journal of the American Oil Chemists Society, 75, 1305-1311. Salvador, M. D., Aranda, F. & Fregapane, G. (1999). Contribution of chemical components of cornicabra virgin olive oils to oxidative stability. A study of three successive crop seasons. Journal of the American Oil Chemists Society, 76, 427-432. Salvador, M.D., Aranda, F. & Fregapane, G. (2001). Influence of fruit ripening on Cornicabra virgin olive oil. A study of four crop seasons. Food Chemistry, 73, 45-53. Salvador, M.D., Aranda, F., Gómez-Alonso, S. & Fregapane, G. (2003). Influence of extraction system, production year and area on Cornicabra virgin olive oil: a study of five years. Food Chemistry, 80, 359-366. Sánchez, J. & Salas, J.J. (2000). Biogenesis of olive oil aroma. En Handbook of olive oil: Analysis and properties. Eds. J. Harwood y R. Aparicio, Aspen Publ. Inc. Gaitersburg, Maryland (USA), pp. 79-93. Sánchez, J. & Harwood, J.L. (2002). Byosinthesis of triacylglycerols and volatiles in olives. European Journal of Lipid Science and Technology, 104, 564-573. Scheier, P. (1984). Chromatographic studies of biogenesis of plant volatiles. En: Series of Chromatographic Methods. Eds. W. Bertsch, W.G. Jenning, R.E. Kaiser. Hüthig, Heidelberg (Alemania), pp. 52-147. Scott, G. (1965). Atmospheric oxidation and antioxidants. Ed. Elseiver, London. Servili, M., Baldioli, G. & Montedoro, G. (1994). Phenolic composition of virgin olive oil in relationship to some chemical and physical aspects of malaxation. Acta Horticulturae, 356, 331-336. 194 6. Bibliografía Servili, M., Conner, J. M., Piggott, J. R. & Wither, S. (1995). Sensory characterization of virgin olive oil and relationship with headspace composition. Journal of Science and Food Agriculture, 67, 61-70. Servili, M., Baldioli, M., Miniati, E. & Montedoro, G.F. (1996). Antioxidant activity of new phenolic compounds extracted from virgin olive oil and their interaction with α-tocopherol and βcarotene. Rivista Italiana delle Sostanze Grasse, 73, 55-59. Servili, M., Baldioli, M., Mariotti, F. & Montedoro, G.F. (1999a). Phenolic composition of olive fruit and virgin olive oil: distribution in the constitutive parts of fruit and evolution during oil mechanical extraction process. Acta Horticulturae, 474, 609-613. Servili, M., Baldioli, M., Selvaggini, R., Macchioni, A. & Montedoro, G.F. (1999b). Phenolic compounds of olive fruit: One- and two-dimensional nuclear Magnetic Resonance Characterization of Nüzhenide and its distribution in the constituve parts of fruit. Journal of Agriculture and Food Chemistry, 47, 12-18. Servili, M., Baldioli, M., Begliomini, A., Selvaggini, R. & Montedoro, G.F. (2000). The phenolic and volatile compounds of virgin olive oil: relationship with the endogenous oxidoreductases during the mechanical oil extraction process. En Flavour and Fragrance Chemistry; Proceedings del Phytochemical Society of Europe, Campobasso, Italia, 13-16 Enero 2000; Kluwer Academic: Dordrecht, Noruega, pp. 163-173. Servili, M., Selvaggini, R., Taticchi, A. & Montedoro, G.F. (2001). En Food Flavors and Chemistry: Advances of the New Millennium, Eds. A.H. Spanier, F. Shahidi, T.H. Parliment, C.J. Mussinan, C.T. Ho. The Royal Society of Chemistry Publishers, Cambridge, UK, pp. 236. Servili, M. & Montedoro, G.F. (2002a). Contribution of phenolic compounds to virgin olive oil quality. European Journal of Lipid Science and Technology, 104, 602-613. Servili, M., Piacquadio, P., De Stefano, G., Taticchi, A. & Sciancalepore, V. (2002b). Influence of a new crushing technique on the composition of the volatile compounds and related sensory quality of virgin olive oil. European Journal of Lipid Science and Technology, 104, 483-489. Servilli, M., Selvaggini, R., Taticchi, A., Esposto, S. & Montedoro, G. (2003a). Air exposure time of olive pastes during the extraction process and phenolic and volatile composition of virgin olive oil. Journal of American Oil Chemists Society, 80, 685-695. Servili, M., Selvaggini, R., Taticchi, A., Esposto, S. & Montedoro, G.F. (2003b). Volatile compounds and phenolic composition of virgin olive oil: Optimization of temperature and time of exposure of olive pastes to air contact during the mechanical extraction process. Journal of Agricultural and Food Chemistry, 51, 7980-7988. 195 6. Bibliografía Servili, M., Selvaggini, R., Esposto, S., Taticchi, A., Montedoro, G.F. & Morozzi, G. (2004). Health and sensory properties of virgin olive oil hydrophilic phenols: agronomic and technological aspects of production that affect their occurrence in the oil. Journal of Chromatography A, 1054, 113-127. Servili, M., Esposto, S., Lodolini, E., Selvaggini, R., Taticchi, A., Urbani, S., Montedoro, G.F., Serravalle, M & Gucci, R. (2007). Irrigation effects on quality, phenolic composition and selected volatiles of virgin olive oil cv. Leccino. Journal of Agricultural and Food Chemistry, 55, 6609-6618. Shahidi, F., Janitha, P.K. & Wanasundara, P.D. (1992). Phenolic antioxidants. Critical Reviews in Food Science and Nutrition, 32, 67-103. Soler, M., Chatenaud, L., La Vecchia, C., Franceschi, S. & Negri, S. (1998). Diet, alcohol, coffee and pancreatic cancer: final results from an Italian study. European Journal of Cancer Prevention, 7, 455-460. Solinas, M. & Cichelli, A. (1981). Sulla determinazione delle sostanze fenoliche dell'olio di oliva. Rivista Italiana delle Sostanze Grasse, 58, 159-164. Solinas, M., Angerosa, F. & Cucurachi A. (1987a). Connessione tra i prodotti di neoformazione ossidativa delle sostanze grasse e insorgenza del difetto di rancidità all’esame organolettico. Nota II. Determinazione quantitativa. Rivista Italiana delle Sostanze Grasse, 64, 137-145. Solinas, M., Maesilio, V. & Angerosa, F. (1987b). Evoluzione di alcuni componenti dell´aroma degli oli vergini di oliva in relazione del grado de maturazione delle olive. Rivista Italiana delle Sostanze Grasse, 64, 475-480. Solinas, M., Angerosa, F. & Camera L. (1988). Evoluzione ossidativa di oli vegetali durante la frittura: determinazione dei componenti volatili mediante HRGC e HPLC. Rivista Italiana delle Sostanze Grasse, 65, 567-574. Stoneham, M., Goldacre, M., Seagroatt, V. & Gill, L. (2000). Olive oil, diet and colorectal cancer: an ecological study and a hypothesis. Journal of Epidemiology and Community Health, 54, 756-760. Tognetti, R., d´Andria, R. & Morelli, G. (2005). The effect of deficit irrigation on seasonal variations of plant water use in Olea europaea L. Plant and Soil, 273, 139-155. Toscano, G., Colarieti, M.L. & Greco, G. (2003). Oxidative polymerisation of phenols by a phenol oxidase from green olives. Enzyme and Microbial Technology, 33, 47-54. Tovar, M.J., Romero M.P., J. & Motilva M.J. (2001). Changes in the phenolic composition of olive oil from young trees (Olea europaea L. cv. Arbequina) grown under linear irrigation strategies. Journal of Agricultural and Food Chemistry, 49, 5502-5508. 196 6. Bibliografía Tovar, M.J., Romero M.P., Alegre, S., Girona, J. & Motilva M.J. (2002a). Composition and organoleptic characteristics of oil from Arbequina olive (Olea europaea L) trees under deficit irrigation. Journal of Science and Food Agriculture, 82, 1755-1763. Tovar, M.J., Romero, M.P., Girona, J. & Motilva. M.J. (2002b). L-Phenylalanine ammonia-lyase activity and concentration of phenolics in developing fruit of olive tree (Olea europaea L. cv. Arbequina) grown under different irrigation regimes. Journal of Science and Food Agriculture, 82, 892-898. Tranter, H.S., Tassou, S.C. & Nychas, G.J. (1993). The effect of the olive phenolic compound, oleuropein on growth and enterotoxin B production by Staphylococcus aureus. Journal of Applied Bacteriology, 74, 253-259. Tressl, R. & Drawert, F. (1973). Biogenesis of banana volatiles. Journal of Agricultural and Food Chemistry, 21, 560-565. Tsukamoto, H., Hisada, S. & Nishie, S. (1984). Lignans from bark of the Olea plants. I. Chemical and Pharmaceutical Bulletin, 32, 2730-2735. Tsukamoto, H., Hisada, S. & Nishie, S. (1985). Lignans from bark of the Olea plants. II. Chemical and Pharmaceutical Bulletin, 33, 1232-1241. Tura, D., Prenzler, P. D., Bedgood, D. R., Antolovich, M. & Robards, K. (2004). Varietal and processing effects on the volatile profile of Australian olive oils. Food Chemistry, 84, 341349. Uccella, N. (2001). En Food Flavours and Chemistry: Advances of the New Millennium, Eds. A.H. Spanier, F. Shahidi, T.H. Parliment, C.J. Mussinan, C.T. Ho. The Royal Society of Chemistry Publishers, Cambridge, UK, pp. 253. Uceda, M., Hermoso, M., García-Ortiz, A., Jiménez, A. & Beltrán, G. (1999). Intraspecific variations of oil content and the characteristics of the oils in olive cultivars. Acta Horticulturae, 474, 659-652. Ullrich, F. & Grosch, W. (1988). Identification of the most intense odor compounds formed during autoxidation of methyl linolenate at room-temperature. Journal of American Oil Chemists Society, 65, 1313-1317. Van der Hijden, H.T.W.M. & Bom, J. (1996). Enzymes involved in the metabolic pathway laeding to 3-methylbutanal in tomato fruit. En Flavor Science. Recent Developments, Eds. A.J. Taylor y D.S. Mottram. The Royal Society of Chemistry Publishers, Cambridge, UK, pp. 130-133. Vázquez-Roncero, A., Graciani-Constante, E. & Maestro-Duran, R. (1974). Componentes fenólicos de la aceituna I. Polifenoles de la pulpa. Grasas y Aceites, 25, 269-279. 197 6. Bibliografía Vázquez-Roncero, A., Janer del Valle, M.L. & Janer del Valle, C. (1976). Componentes fenólicos de la aceituna. III. Polifenoles del aceite. Grasas y Aceites, 27, 185-191. Vichi, S., Pizzale, L., Conte, L. S., Buxaderas, S. & Lopez-Tamames, E. (2003a). Solid-phase microextraction in the analysis of virgin olive oil volatile fraction: characterization of virgin olive oils from two distinct geographical areas of northern Italy. Journal of Agriculture and Food Chemistry, 51, 6572-6577. Vichi, S., Castellote, A. I., Pizzale, L., Conte, L. S., Buxaderas, S. & Lopez-Tamames, E. (2003b). Analysis of virgin olive oil volatile compounds by headspace solid-phase microextraction coupled to gas chromatography with mass spectrometric and flame ionisation detection. Journal of Chromatography A, 983, 19-33. Vinha, A.F., Ferreres, F., Silva, B.M., Valentao, P., Gonçalves, A., Pereira, J.A., Oliveira, B., Seabra, R.M. & Andrade, P.B. (2005). Phenolic profiles of Portuguese olive fruits (Olea europaea L.): Influences of cultivar and geographical origin. Food Chemistry, 89, 561-568. Visioli, F., Bellomo, G., Montedoro, G.F. & Galli, C. (1995). Low-density-lipoprotein oxidation is inhibited in-vitro by olive oil constituents. Atherosclerosis, 117, 25-32. Williams, M., Salas, J.J., Sanchez, J. & Harwood, J.L. (2000). Lipoxygenase pathway in olive callus cultures (Olea europaea). Phytochemistry, 53, 13-19. Wyllie, S.G. (1995). Key aroma compounds in melons. En Fruit Flavors: Biogenesis, Characterization and Authentification, Eds. R.L. Rouseff, M.M. Leahy. Washington, DC: American Chemical Society, pp. 248-257. Wyllie, S.G. (1996). Biochemical pathways for the formation of esters in ripening fruit. En Flavor Science. Recent Developments, Eds. A.J. Taylor y D.S. Mottram. The Royal Society of Chemistry Publishers, Cambridge, UK, pp. 52-57. 198