Efecto Fotoeléctrico
Anuncio

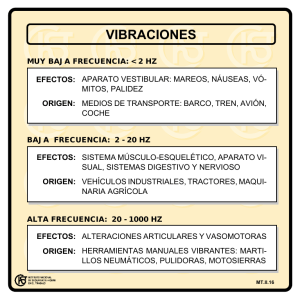
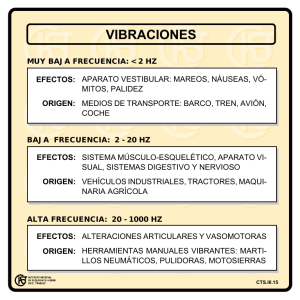
EFECTO FOTOELÉCTRICO Objetivo: Analizar el efecto fotoeléctrico y obtener la constante de Planck Introducción: La emisión y absorción de luz fue tema de investigación del físico Max Planck. Cuando Planck trató de formular una teoría sobre la base del modelo de onda clásico para explicar la distribución espectral de luz emitida se encontró con demasiadas dificultades. La teoría clásica (ley de Rayleigh-Jeans) predice que la cantidad de luz emitida por un cuerpo negro aumenta dramáticamente a medida que la longitud de onda disminuye, mientras el experimento demostraba que la cantidad de luz se aproximaba a cero; es decir, todo lo contrario. Esta discrepancia se conocía como la catástrofe ultravioleta. Los datos experimentales para la radiación de la luz emitida por un cuerpo muy caliente (que brilla intensamente) demuestra que la intensidad máxima de luz emitida tampoco concuerda con los valores clásicos predichos por la ley de Wien. Para reconciliar la teoría con los resultados de laboratorio, Planck se vio forzado a desarrollar un nuevo modelo para la luz llamado modelo cuántico, el cual presupone que la luz se debe emitir en pequeños paquetes (discretos) llamados cuantos. La relación entre la teoría clásica y cuántica para la emisión de la luz puede investigarse empleando el equipo de laboratorio denominado “aparato h/e”. Usando el aparato en combinación con una fuente de luz de vapor de mercurio, se puede determinar con bastante precisión la relación de h/e y determinar de esta forma la constante h, la constante de Planck. Teoría: Teoría cuántica de Planck. En 1901 Planck publicó su ley de radiación. En ella indica que un oscilador o cualquier sistema físico similar tienen un conjunto discreto de valores o niveles posibles de energía, y que las energías entre estos valores o niveles no pueden existir. Planck observó que la emisión y la absorción de la radiación están asociadas con transiciones o saltos entre dos niveles de energía. La energía perdida o ganada por el oscilador se emite o se absorbe como un cuanto de energía radiante, cuya magnitud está expresada por la siguiente ecuación: E=hν donde E es la energía radiante, ν es la frecuencia de la radiación, y h es una constante universal de la Naturaleza llamada constante de Planck. Se ha encontrado que la constante de Planck no solamente es una simple relación entre la frecuencia y la energía de la luz (en general, de las ondas electromagnéticas), sino que esta constante ha resultado ser la piedra angular de la Mecánica Cuántica para explicar el “mundo” atómico y subatómico. Por su trabajo, Planck recibió el premio Nobel de Física en 1918. El efecto fotoeléctrico. En el fenómeno de la llamada emisión fotoeléctrica, un haz de luz al chocar contra un material causa que electrones del material sean emitidos. Por otro lado, el modelo clásico de la onda predice que entre más intensidad tenga un haz de luz mayor será su amplitud y, por tanto, mayor será la energía de la onda. De esta manera, un haz de mayor intensidad al chocar en un material debería inducir emisión de fotoelectrones más energéticos. Por su parte, el modelo cuántico predice que la luz a frecuencias mayores debería producir fotoelectrones de mayor energía, independiente de la intensidad, mientras que al aumentar la intensidad de la luz sólo debe incrementarse el número de electrones emitidos (es decir, la corriente fotoeléctrica). A principios del año 1900 varios investigadores encontraron que la energía cinética de los fotoelectrones depende de la longitud de onda (de la frecuencia), y es independiente de la intensidad, mientras que la magnitud de la corriente fotoeléctrica, o número de electrones, depende de la intensidad de la luz como lo predice el modelo cuántico. Einsten aplicó la teoría de Planck y explicó adecuadamente el efecto fotoeléctrico en términos del modelo cuántico usando su famosa ecuación: E = h ν = Kmax + Wo donde Kmax es la energía cinética máxima de los fotoelectrones emitidos, Wo es la energía necesaria para quitarlos completamente del material (conocida como función trabajo) y E es la energía del cuanto de luz (llamado fotón). El experimento h/e. Un fotón de luz con energía hν incide sobre un electrón del cátodo de un tubo al vacío. El electrón gasta una energía Wo (mínima) para escapar del cátodo e inmediatamente adquiere una energía en forma de energía cinética Kmax. Por lo general, los electrones emitidos alcanzan el ánodo del tubo y pueden medirse como una corriente fotoeléctrica. Sin embargo, aplicando un potencial invertido V entre el ánodo y el cátodo la corriente fotoeléctrica puede anularse. De esta forma, Kmax puede obtenerse midiendo el potencial invertido mínimo necesario (potencial de frenado) para detener a los fotoelectrones y reducir la corriente fotoeléctrica hasta cero. Relacionando la energía cinética con el potencial de frenado se tiene: Kmax = V e Aquí V es el potencial de frenado y e es la magnitud de la carga del electrón. Por lo tanto, usando la ecuación de Einstein: hν = V e + Wo Y resolviendo para V, la ecuación queda como: V = (h/ e ) ν – (Wo/ e ) Graficando V vs ν para diferentes frecuencias de luz se obtiene algo similar a la gráfica de la Figura 1. La intersección V es igual a Wo/ e y la pendiente es h/ e . Acoplando el valor experimental de la relación h/ e con el valor aceptado de e = 1.602 x10 −19 C se puede determinar la constante de Planck. Figura 1. Gráfica de V vs. υ NOTA: En este aparato el potencial de frenado se mide directamente, en vez de monitorear la corriente fotoeléctrica. MATERIAL • • • Equipo para efecto fotoeléctrico (13 accesorios) Multímetro con cables banana-banana Lámpara de Hg Instalación del equipo Identificación del equipo h/e Instalando las baterías. El aparato de h/ e requiere dos baterías de +9 V. El compartimiento para las baterías se abre aflojando los tornillos en la parte trasera del panel y quitando la cubierta. Verificación del voltaje de las baterías. Aunque el aparato de h/ e requiere solamente una cantidad pequeña de corriente y las baterías duran normalmente bastante tiempo, es recomendable comprobar el voltaje de salida antes de cada uso. Los puntos de prueba de la batería están situados en el panel lateral del aparato cerca del interruptor Enc./Apag., ver Figura 2. Las baterías que tienen un nivel por debajo de 6 Voltios pueden dar resultados erróneos en el experimento. Para comprobar el voltaje de las baterías utilice un voltímetro para medir entre el terminal de salida de tierra y cada terminal de la batería (-6V MIN y +6V MIN). Si cualquiera de las baterías está debajo del rango mínimo debe sustituirse. Figura 2. Prueba de la batería Instalación. La instalación estándar para los experimentos de h/ e se muestra en la Figura 3. Los detalles se describen a continuación. 1. El diseño de la fuente de luz permite la conexión simultanea de dos monturas de abertura de luz, uno en el frente y otro por la parte de atrás. Si se utiliza sólo una abertura de luz instala el bloqueador de luz en la canaleta detrás del bloque de luz (Figura 4). Figura 3. Instalación del equipo utilizando una lámpara de vapor de mercurio 2. Desliza la montura de abertura de luz en el centro de la canaleta de la fuente de luz, y fíjalo con los dos tornillos que trae. 3. Coloca la rejilla sobre las barras del soporte de la montura de abertura de luz. (Figura 4). Afloja el tornillo, desliza éste sobre las barras y atorníllalo para mantenerlo fijo. Figura 4. Instalando el bloqueador de luz y detalle de la rejilla en su montura 4. Enciende la fuente de luz y permite que se caliente por cinco minutos, comprueba la alineación de la fuente de luz y la abertura mirando cómo incide la luz en la parte posterior de la rejilla. Si es necesario, ajusta la placa trasera de la montura de abertura aflojando los dos tornillos (Figura 5) deslizando la placa de abertura hacia la izquierda o derecha hasta que la luz brillante incida en el centro de la rejilla. 5. Inserta y fija el soporte de la barra de acoplamiento a la fuente de luz (Fig. 3). 6. Quita el tornillo del poste e insértalo por el orificio de la base del soporte fijando el poste con la base mediante este tornillo. 7. Coloca el aparato de h/ e sobre el poste de la base. 8. Coloca la montura de la base sobre la punta del extremo de la barra acopladora. 9. Conecta un voltímetro a las terminales de salida del aparato, con el medidor en el rango de 2 o 20 V. 10. Coloca el aparato de h/ e enfrente de la fuente de luz de vapor de mercurio. Desliza la rejilla hacia delante o hacia atrás hasta que obtengas una luz brillante en la máscara reflejante del aparato (Figura 5). Figura 5. Ajuste de abertura de la rejilla y tapa de luz h/ e . 11. Rota el protector de luz del aparato para revelar la máscara del fotodiodo blanco dentro del aparato. Rota el aparato de h/ e hasta que la imagen de la abertura este centrada en la ventana de la máscara del fotodiodo. Después aprieta el tornillo del poste de la base para sostener el aparato en ese lugar. 12. Igual que en el paso 10, desliza la rejilla hacía atrás o hacia adelante hasta que se aprecie una imagen clara de abertura sobre la ventana en la mascara del fotodiodo. Aprieta el tornillo y regresa el protector de luz a su lugar. 13. Enciende el aparato y rótalo sobre el eje de la barra de acoplamiento, hasta que uno de los máximos de color del primer orden incida en la ranura de la mascara reflejante. Rota el aparato de h/ e sobre su base hasta que el mismo espectro máximo que incide sobre la abertura de la mascara reflejante blanca también incida sobre la ventana de la máscara del fotodiodo. NOTA: La máscara reflejante blanca del aparato h/ e esta hecha de un material fluorescente especial. Esto permite ver la línea ultravioleta como una línea azul, y que la línea violeta aparezca más azul. Los colores actuales pueden verse utilizando una hoja blanca de material no fluorescente enfrente de la mascara. Es importante que al realizar las mediciones se tenga cuidado de incidir solamente un color sobre la ventana del fotodiodo. No debe haber traslapo de máximos espectrales adyacentes. 14. Presiona el botón “PUSH TO ZERO” sobre el panel del aparato de h/ e para descargar algún potencial acumulado en la unidad electrónica. Esto asegurará que el aparato registre sólo el potencial de la luz que se está midiendo. Observa que la salida de voltaje decae con la ausencia de luz en el fotodiodo. 15. Registra el voltaje de salida con el voltímetro digital, el cual es una medición directa del potencial de frenado para los fotoelectrones. NOTA: Para algunos aparatos es posible que el potencial se lea inicialmente como un valor alto, pero posteriormente decrecerá hasta llegar al potencial de frenado. Figura 6. Los tres ordenes de luz Color Amarillo Verde Azul Violeta Ultravioleta Frecuencia (Hz) 5.18672x1014 5.48996 x1014 6.87858 x1014 7.40858 x1014 8.20264 x1014 λ (nm) 578 546.074 435.835 404.656 365.483 Usando los filtros. El aparato h/ e incluye tres filtros: uno verde y uno amarillo, más un filtro de transmisión variable. Los marcos de cada filtro tienen tiras magnéticas para ser montados en la máscara reflejante del aparato h/ e . Utiliza los filtros verde y amarillo cuando se estén usando las líneas espectrales verde y amarillo. Estos filtros limitan el paso de las frecuencias altas de luz y además evita que la luz ambiental del lugar interfiera y enmascare los resultados reales. Adicionalmente bloquea luz ultravioleta de frecuencias mayores que puedan traslaparse. El filtro de transmisión variable consta de un patrón de puntos y líneas (generado por computadora) que varía la intensidad pero no la frecuencia de la luz incidente. Los porcentajes de transmisión relativos son 100, 80, 60, 40 y 20%. EXPERIMENTO 1: Modelo clásico vs. Modelo cuántico. Según la teoría del fotón de la luz (modelo cuántico), la energía cinética máxima Kmax de los fotoelectrones depende solamente de la frecuencia de la luz incidente pero es independiente de la intensidad. Así, cuanto mayor es la frecuencia de la luz mayor es su energía. En contraste, el modelo clásico de la onda de la luz predice que Kmax dependerá de la intensidad de luz. Es decir, cuanto más brillante sea la luz mayor es la energía de los fotoelectrones. Este experimento analiza ambas aseveraciones. En la parte A se seleccionan dos líneas espectrales de una fuente de luz de vapor de mercurio y se investiga la energía máxima de los fotoelectrones como función de la intensidad. En la parte B se seleccionan diferentes líneas espectrales y se analiza la energía máxima de los fotoelectrones en función de la frecuencia de la luz. Instalación. Instala el equipo como se muestra en la siguiente figura. Enfoca la luz de la lámpara de vapor del mercurio sobre la ranura de la máscara reflejante blanca en el aparato de h/ e . Rueda el protector de luz del aparato para revelar la máscara del fotodiodo blanco dentro del aparato. Desliza la montura de la rejilla hacia adelante o hacia atrás hasta que se aprecie una imagen clara de la abertura centrada sobre la ventana en la máscara del fotodiodo. Asegura la rejilla apretándola con el tornillo. Alinea el sistema rotando el aparato de h/ e sobre su base hasta que la luz del mismo color que incide sobre la abertura de la pantalla entre también por la ventana del fotodiodo. Experimento 1. Instalación del equipo Verifica la polaridad de las terminales del voltímetro digital y conéctalos a las terminales de salida (OUTPUT) con la misma polaridad sobre el aparato de h/ e . Procedimiento: PARTE A 1. Ajusta el aparato de h/ e hasta que sólo uno de los colores espectrales incida sobre la abertura de la mascara del fotodiodo. Si se selecciona la línea espectral verde o amarilla, coloca el filtro de color correspondiente sobre la máscara reflejante blanca del aparato. 2. Coloca el filtro de transmisión variable enfrente de la máscara reflejante blanca (y sobre el filtro de color, si se utiliza) para que la luz pase a través de la sección marcada 100% y alcance al fotodiodo. Registra la lectura de voltaje en la tabla siguiente. Presiona el botón de descarga del instrumento y suéltalo, observa aproximadamente cómo se requiere mucho tiempo para retomar el voltaje registrado. 3. Mueve el filtro de transmisión variable para que la siguiente sección (x %) este enfrente de la luz incidente. Registra la nueva lectura y calcula el tiempo de recarga a partir de que el botón de descarga es presionado y soltado. Repite el paso 3 hasta que se termine con las cinco secciones del filtro. Repite el procedimiento utilizando un segundo color del espectro. Color #1_________ Color #2_________ % Transmisión 100 80 60 40 20 % Transmisión 100 80 60 40 20 Potencial de frenado Tiempo de carga aproximado. Potencial de frenado Tiempo de carga aproximado. PARTE B 1. Ajusta el aparato de h/ e para que una de las cinco bandas amarillas incida sobre la abertura de la mascara del fotodiodo. Coloca el filtro de color amarillo sobre la máscara blanca reflejante. 2. Registra la lectura del voltímetro (voltaje de frenado) en la tabla siguiente. 3. Repite el procedimiento para cada color del espectro. Debes asegurarte de utilizar el filtro verde cuando midas el espectro verde. Análisis. 1. Describe el efecto que ocurre con las diferentes intensidades del mismo color de luz con el potencial de frenado, y a su vez con la energía máxima de los fotoelectrones, así como el tiempo de carga después de presionar el botón de descarga. 2. Describe el efecto que tienen los diferentes colores de luz con el potencial de frenado y con la energía máxima de los fotoelectrones. 3. Determina si este experimento apoya al modelo cuántico o al modelo clásico de onda de la luz basado en los resultados del laboratorio. Explica porqué existe un pequeña caída en el potencial de frenado cuando la intensidad de luz disminuye. Color de la luz Amarillo Verde Azul Violeta Ultravioleta Potencial de frenado EXPERIMENTO 2: Relación entre energía, longitud de onda y frecuencia. Según el modelo cuántico, la energía de la luz es directamente proporcional a su frecuencia; esto es, a una mayor frecuencia mayor energía. Esta parte del experimento permite determinar la constante de Planck, una vez que se eligen diferentes líneas espectrales de mercurio e investigando la energía máxima de los fotoelectrones en función de la longitud de onda y frecuencia de la luz. Instalación Instala el equipo como se muestra en la siguiente figura: Experimento 2. Instalación del equipo Enfoca la luz de la lámpara de vapor del mercurio sobre la ranura de la máscara reflejante blanca en el aparato de h/ e . Rota el protector de luz del aparato para revelar la máscara del fotodiodo blanco dentro del aparato. Desliza la montura de la rejilla hacia adelante o hacia atrás hasta que se aprecie una imagen clara de la abertura centrada sobre la ventana en la máscara del fotodiodo. Asegura la rejilla apretándolo con el tornillo. Alinea el sistema rotando el aparato de h/ e sobre su base hasta que la luz del mismo color que incide sobre la abertura de la pantalla entre también por la ventana del fotodiodo, sin superponer dos bandas. Regresa la tapa a su posición. Verifica la polaridad de las terminales del voltímetro digital y conéctalos a las terminales de salida (OUTPUT) con la misma polaridad sobre el aparato de h/ e . Procedimiento: 1. Ajusta el aparato de h/ e cuidadosamente hasta que sólo un color del primer orden (el orden más brillante) incida sobre la abertura de la máscara del fotodiodo. 2. Para cada color del primer orden, mide el potencial de frenado con un voltímetro y registra las mediciones en la tabla siguiente. Utiliza los filtros amarillo y verde sobre la máscara reflejante del aparato h/ e cuando se midan las líneas espectrales amarilla y verde. 3. Cambia el aparato al segundo orden y repite el procedimiento. Registra los resultados en la tabla. Análisis. Determina la longitud de onda y la frecuencia de cada línea espectral. Grafica el potencial de frenado vs frecuencia. Determina la pendiente y la intersección en el eje de las ordenadas (eje-Y). Interpreta los resultados en términos de la relación h/ e y Wo/ e . Calcula h y Wo. Interpreta los resultados basados en el modelo cuántico de la luz. Color del 1er orden Amarillo Verde Azul Violeta Ultravioleta Color del 2ndo orden Amarillo Verde Azul Violeta Ultravioleta λ nm Frecuencia (1014 Hz) Potencial de frenado (V) λ (nm) Frecuencia (1014 Hz) Potencial de frenado (V)