Enzimas
Anuncio

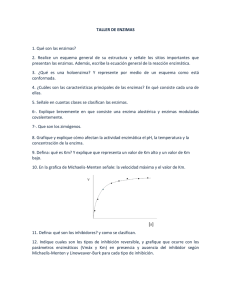
Dr. Luis Rebolledo Enzimas Introducción Las sustancias que aceleran la velocidad de reacción de las reacciones químicas se denominan catalizadores. En el mundo vivo, los catalizadores se denominan enzimas las cuales son proteínas de aspecto globular. El mundo mineral (no vivo) carece de enzimas, pero posee catalizadores inorgánicos, los cuales también actuan en el mundo vivo. Las reacciones químicas orgánicas en una célula son lentas en condiciones de temperatura y presión normales, por ende, las enzimas ayudan acelerando las velocidades de dichas reacciones químicas. Las características propias de la química de diferentes células o de diferentes compartimentos de una célula, pueden derivar del contenido y actividad enzimática diferentes. Estas características enzimáticas propias son el producto de la actividad genética, tanto para su síntesis como para su regulación. Como decíamos en el capítulo anterior de ácidos nucleicos, una mutación puede provocar la aparición de una enzima (proteína) que no actúe correctamente. Prof. Iván Rebolledo Las enzimas se caracterizan por 3 propiedades fundamentales : (a) están presentes en pequeñas cantidades, (b) aumentan la velocidad de las reacciones químicas sin que se consuman o alteren por la reacción, (c) aumentan la velocidad de las reacciones químicas sin alterar el equilibrio químico entre los reactantes y los productos. Nomenclatura y clasificación de las enzimas El sufijo asa identifica a la mayoría de las enzimas con excepción de algunas, como la tripsina, amilopsina, quimiotripsina, etc; que por tradición siguen manteniendo su nomenclatura. Se han asignado, por la Comisión Internacional de Enzimas, 6 clases : 1. Oxido-reductasas : participan en reacciones de óxido-reducción. En estas reacciones se transfiere un electrón (ó un H+) de un donante a un receptor. Caso del NADH+ que entrega electrones a complejo I en la membrana interna de la mitocondria. Enzimas 2. Transferasas : transfieren grupos de un donante a un aceptor. Los grupos transferidos con más frecuencia son el metilo, glucosídico y fosfato. Caso de la glucosiltransferasa (transfiere un monosacárido) y proteín quinasa (transfiere un fosfato). Actividad enzimática La primera enzima aislada en forma cristalina fue la ureasa (J.B. Summer, 1926) que cataliza la hidrólisis de la urea. ureasa (NH2)2–CO + H2O ⇒ CO2 + 2NH3 3. Hidrolasas : participan en reacciones de hidrólisis, es decir, rompimiento de enlaces como C-O, C-N y C-C por adición de agua. Caso de los enlaces glucosídicos (entre monosacáridos) y peptídicos (entre aminoácidos). 4. Liasas : producen dobles enlaces al romper uniones C-O, C-C y C-N. También pueden romper dobles enlaces agregando grupos. Caso de la piruvato descarboxilasa que elimina un CO2 al piruvato. La hidrólisis de la urea puede ocurrir espontáneamente en presencia o ausencia de un catalizador, originando los mismos productos y la misma energía. La velocidad de reacción espontánea puede ser acelerada si se añaden iones H+ como catalizador y puede ser acelerada aún más cuando se añade la ureasa en lugar de los iones H+. 5. Isomerasas : catalizan una redistribución de átomos de los grupos químicos dentro de la misma molécula. Caso de la alanina racemasa que convierte L-alanina en D-alanina. Ambos son isómeros. 6. Ligasas : catalizan la unión de 2 moléculas por hidrólisis de ATP u otro trifosfato (GTP, por ejemplo). El gráfico muestra las relaciones energéticas de la reacción entre urea y agua (reactantes), el logro del estado de transición [ES] y la obtención de los productos (CO2 y NH3). Note la magnitud de la energía de activación. Enzimas El complejo activado enzima– sustrato [ES] tiene menor necesidad de energía de activación; así, habrá más cantidad de moléculas de sustrato que puedan pasar la barrera por unidad de tiempo. Un número pequeño de moléculas de enzima pueden manejar millones de moléculas de sustrato por segundo. Para que la urea pueda reaccionar con el agua debe haber suficiente energía, para que la molécula de urea y el agua lleguen a formar un complejo activado y entren a un estado de transición (estado de alta energía). La energía necesaria para llegar a dicho estado se llama energía de activación, la cual constituye una barrera para que la reacción prosiga. Por tanto, la disminución de la barrera de la energía de activación es mayor en un sistema de reacción catalizada por una enzima; de esta manera, la reacción procede más rápidamente en presencia de ureasa que en presencia de H+ o sin catalizador. En conclusión, la función principal de una enzima es disminuir la barrera de la energía de activación. Las enzimas aumentan la probabilidad de que las moléculas reaccionantes crucen la barrera y prosigan a la consumación de la reacción. Una enzima (E) hace esto al unirse con el sustrato (S), en una asociación temporal (estado de transición [ES] ). Sustrato Enzima + Complejo enzima Sustrato Estado de transición Producto Enzimas La mayor parte de las enzimas opera dentro de un margen estrecho de pH : es el pH óptimo. La gran mayoría de las enzimas tiene su pH óptimo dentro del rango fisiológico de la célula (pH 6.5 a 7.2). Algunas enzimas, como la pepsina del estómago, posee un pH óptimo en el rango ácido (pH 1.0 a 2.0). Enzimas intestinales como la tripsina y lipasas, poseen un pH óptimo en rangos alcalinos, cercano a 10. Como cosa curiosa, hay bacterias termófilas que viven en aguas termales calientes, alrededor de los 80 ºC. Sus sistemas enzimáticos resisten la desnaturalización a altas temperaturas. Velocidad de reacción pepsina Considerando que las enzimas son proteínas, están expuestas a una desnaturalización (cambio en la estructura terciaria) por acción de altas temperaturas. Así, puede producirse una inactivación a causa del rompimiento de varios enlaces débiles. Muchas enzimas se inactivan a 45 ºC y la mayoría se desnaturalizan rápidamente desde los 55 ºC. amilasa tripsina Velocidad de reacción pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Como en cualquier reacción química, el aumento de temperatura de los reaccionantes produce un aumento en la velocidad de reacción, pero en el caso de los sistemas catalizados por enzimas, esto es válido hasta cierto grado de temperatura. T ºC 34 35 36 37 38 39 40 Enzimas Especificidad del sustrato La especificidad está determinada por el sitio activo de la enzima, es decir, un sector de la molécula que contiene los grupos funcionales particulares que le permiten unirse específicamente con el sustrato. Por ejemplo, la quimiotripsina posee una cadena polipeptídica conformada por 245 aminoácidos de los cuales los números 57 (histidina), 102 (ácido aspártico) y 195 (serina) constituyen el sitio activo. El plegamiento (estructura terciaria) de la cadena provoca el acercamiento de estos 3 aminoácidos en una estrecha región: este es el sitio activo de la enzima. Esquema molecular de la quimiotripsina, mostrando el sitio activo de esta enzima. Generalmente el sitio activo se encuentra en una grieta, en una leve depresión en la superficie de la molécula proteica. La geometría del sitio activo está estrechamente relacionada con la conformación tridimensional de la molécula del sustrato. Las enzimas aceleran las reacciones alterando la conformación de sus sustratos para que logren llegar al estado de transición. El modelo más simple para entender esta interacción enzima–sustrato es el modelo de la llave y la cerradura, en el cual el sustrato encaja perfectamente en el sitio activo de la enzima (ver dibujo) Sustrato Enzima Del ejemplo expuesto, el sitio activo ocupa un área relativamente pequeña de la superficie de la molécula de enzima. Esto significa que una pequeña porción de la molécula de enzima participa realmente en la catálisis. Las otras regiones de la superficie de la enzima pueden permitir la unión con otras moléculas involucradas en la regulación de la actividad enzimática En muchos casos, las conformaciones tanto de la enzima como del sustrato son modificadas cuando logran unirse : es el llamado modelo de encaje inducido. Esta alteración de las conformaciones hace que logren llegar más rápido al estado de transición (ver dibujo). Enzimas Cinética enzimática Sustrato Enzima La desnaturalización de una proteína enzimática provoca un desplazamiento de los aminoácidos, alejándolos, con lo cual desaparece el sitio activo. La inactivación enzimática puede explicarse por el desplazamiento de solo un aminoácido. El ó los sitios activos de la molécula de enzima permite, primeramente, orientar a la molécula de sustrato; luego, establecer los enlaces químicos necesarios para la formación del complejo enzimasustrato y, finalmente, romper (o formar) los enlaces químicos necesarios para formar el o los productos. Una vez ocurrida la reacción química, los productos de la reacción catalizada se separan y la enzima queda nuevamente disponible para una nueva catálisis. Así, la ecuación mostrada ejemplifica la generalidad de la reacción : E + S ⇔ [ES] ⇔ P + E El análisis cuantitativo de la actividad enzimática se denomina cinética enzimática. Este análisis puede aportar información útil acerca del modo de acción de una enzima y establecer comparaciones con otras enzimas o de la misma enzima bajo condiciones diferentes. En muchas enzimas la velocidad de catálisis o velocidad de reacción (V) varía de acuerdo a la concentración molar del sustrato. Cuando la concentración del sustrato [S] es baja, la velocidad es linealmente proporcional a la concentración. Pero cuando [S] es alta, V es independiente de [S]. Enzimas En donde Vmax es la velocidad máxima de la reacción y Km es la concentración del sustrato a la que la velocidad de reacción es igual a la mitad de su valor máximo. Es decir, cuando la [S] sea igual a Km entonces la velocidad de la reacción será igual a la mitad de Vmax. Observando el gráfico de la página anterior, a concentraciones bajas del sustrato, cuando [S] es menor que Km , la velocidad de reacción es directamente proporcional a [S]. Leonor Michaelis y Maud Menten (en 1913) propusieron un modelo sencillo para describir la cinética enzimática : es la ecuación de Michaelis-Menten. V = Vmax [S] [S] + Km A concentraciones más altas del sustrato, cuando [S] es mayor que Km, la velocidad viene a ser independiente de [S]. Ahora bien, Km indica la afinidad de la enzima por el sustrato : menor Km mayor afinidad, lo que significa que hay una unión muy fuerte entre la enzima y el sustrato en la formación del intermediario [ES] en la catálisis. La velocidad máxima (Vmax) puede revelar el número de recambio de una enzima, es decir, el número de moléculas de sustrato convertidas a producto por unidad de tiempo, cuando la enzima se encuentre completamente saturada con sustrato. Normalmente, se expresa como el número de moléculas de sustrato que pueden ser convertidas a producto por una molécula de enzima por segundo. Algunos valores ilustrativos : Enzimas Anhidrasa carbónica Catalasa Acetilcolinesterasa Quimiotripsina ADN polimerasa I Nºrecamb/seg 600.000 93.000 25.000 100 15 Enzimas Inhibición de la actividad enzimática La inhibición de la actividad enzimática es el medio importante en el control de los sistemas biológicos. La inhibición puede ser reversible o irreversible. En el primer caso, el inhibidor no modifica las regiones funcionales de la enzima; en el segundo caso, el inhibidor modifica la molécula de enzima y se une tan fuertemente a ella que la disociación de ambas es muy lenta o nula. Varios venenos que actúan sobre el sistema nervioso, incluyendo insecticidas, lo hacen como inhibidores irreversibles de la actividad enzimática. La inhibición reversible puede lograrse mediante 2 mecanismos : competitivo y no-competitivo. Un inhibidor competitivo es el que compite con el sustrato por el mismo sitio activo de la enzima, ya que el inhibidor y el sustrato poseen una estructura química similar. La velocidad de catálisis del sustrato se reduce dado que la cantidad de sustrato que se une a la enzima es menor. sustrato Un inhibidor no-competitivo es el que puede unirse a la enzima en un sitio diferente al sitio activo . Así, tanto el sustrato como el inhibidor pueden unirse simultáneamente a la molécula de enzima. La acción del inhibidor no-competitivo es disminuir el número de recambio de una enzima. Coenzimas Además de unir a sus sustratos, los sitios activos de muchas enzimas, pueden unir otras moléculas que participan en la catálisis. Los llamados grupos prostéticos son pequeñas moléculas que se unen a las proteínas en las cuales juegan un papel muy importante. Por ejemplo, el oxígeno transportado por la hemoglobina se encuentra unido al grupo hem, que viene a ser el grupo prostético. Inhibidor competitivo sustrato Inhibidor no-competitivo Enzimas Además, varias moléculas orgánicas de bajo peso molecular en tipos específicos de reacciones enzimáticas. Estas moléculas se llaman coenzimas debido a que trabajan junto con las enzimas para favorecer a las reacciones catalíticas También, ellas pueden participar en múltiples reacciones enzimáticas. Aplicación médica Todas las enzimas son proteínas y están distribuídas ampliamente en el organismo cumpliendo funciones múltiples. Se darán de ejemplo sólo algunos casos : (1) el páncreas es una glándula que cumple la función de secretar múltiples enzimas que intervienen en la digestión normal : tripsina, quimiotripsina, elastasas, lipasas, amilasas,etc. Cuando el páncreas no secreta estas enzimas conduce a una mala digestión de los alimentos, transtorno llamado dispepsia. En estos casos el paciente presenta náuseas, llenura, distensión abdominal, diarreas, entre otras. (2) si un individuo es “mordido” por una serpiente venenosa, ésta le inocula al paciente múltiples enzimas que tienen la capacidad de destruir glóbulos rojos, factores de coagulación, nervios, músculos, etc.; por lo que el paciente presenta dolor, edema, hemorragias, necrosis y hasta neuropatías. El tratamiento se basa en tratar de destruir estas enzimas nocivas con sueros antiofídicos. (3) la coloración de la piel y el pelo depende de un pigmento llamado melanina. Este pigmento, se produce en una célula de la piel llamada melanocito. Para que este melanocito produzca melanina, requiere de la presencia de una enzima llamada tirosinasa, la cual degrada la tirosina en precursores del pigmento. La falta de actividad de esta enzima tirosinasa, por un defecto genético, causa hipopigmentación de la piel, como en el caso del albinismo. Enzimas 1. ¿Cuáles son las principales funciones de una enzima? 2. ¿Siempre se necesita una molécula de enzima por cada molécula de sustrato? 3. Mencione y explique dos factores que influyen directamente sobre las moléculas de enzimas. 4. ¿Qué explicación molecular tiene la desnaturalización? 5. Molecularmente hablando, ¿qué es el sitio activo de una enzima? 6. ¿Cuáles son las 3 acciones de los aminoácidos que constituyen el sitio activo de la quimiotripsina? 7. ¿Qué indica el Km de una enzima 8. ¿A qué se refiere el número de recambio en las enzimas? 9. ¿Cuándo una inhibición enzimática es competitiva? ¿y no-competitiva?