Fosforilación oxidativa
Anuncio

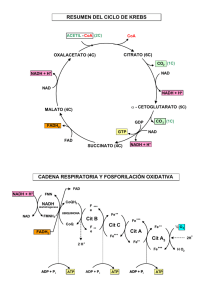
Fosforilación oxidativa Proceso por el cual los electrones se transfieren desde el NADH y FADH2 al O2 a través de tres complejos proteicos de la membrana mitocondrial interna Estructura de las mitocondrias Las membranas externas y sus respectivas caras son diferentes NADH Esquema del transporte de ē a través de los tres complejos NADH-Q oxidorreductasa . Q Q-citocromo c oxidorreductasa Cit c Citocromo c oxidasa O2 Succinato DHQ reductasa La teoría quimiosmótica • Fue desarrollada por Peter Mitchell (19201992) • Le valió el Nobel de 1978 • En los comienzos de la década del 60 se conocía el papel del ATP como moneda de energía, pero se suponía que su síntesis era por fosforilación a nivel de sustrato. En consecuencia, se buscaba un hipotético intermediario de alta energía capaz de fosforilar al ADP. • La teoría postula que la energía para la síntesis de ATP proviene de la formación de un gradiente químico por el cual los H+ son bombeados fuera de la mitocondria. MM Ext Fumarato Succinato MM Int Componentes del sistema de transporte de ē Oxidante o reductor Complejo NADH-Q oxidoreductasa Masa (kd) SU Gr. prostético Lado de la matriz En la membrana 880 ≥ 34 FMN NADH Q 127 4 FAD Succinato Q 250 10 Hemo bH 200 10 Hemo a Lado citosólico Fe-S Succinato-Q reductasa Fe-S Q-citochromo c oxidoreductasa Q Citocromo c Hemo bL Hemo c1 Fe-S Citocromo c oxidasa Hemo a3 CuA y CuB Citocromo c Estructura y estados de reducción de quinonas Estructura y estados de reducción de flavinas Centros hierro-azufre: Fe no hemínico + S ác. lábil (A) 1 Fe unido a 4 Cisteínas (B) Centro 2Fe-2S con puentes sulfuro de Cis (C) Centro 4Fe-4S El grupo hemo: integrante de los citocromos Hemo c Citocromo c Hemo b Hemo a El espectro de absorción de los citocromos permite su identificación y da información sobre su estado 444 420 Red 605 Ox BioqUímica - FCByF La estructura de los citocromos está conservada en especies diferentes Atún Rhodospirillum rubrum Paracoccus denitrificans La secuencia de los citocromos se usa en estudios filogenéticos Determinación de la secuencia de los transportadores de electrones ΔE0´ NAD + + H+ + 2 ē Æ NADH -0.320 NADHDH(FMN) + 2 H+ + 2 ē Æ NADDH(FMNH2) -0.300 UQ + 2 H+ + 2 ē Æ UQH2 0.045 Cit b (Fe3+) + ē Æ Cit b (Fe2+) 0.077 Cit c1 (Fe3+) + ē Æ Cit c1 (Fe2+) 0.220 Cit c (Fe3+) + ē Æ Cit c (Fe2+) 0.254 Cit a (Fe3+) + ē Æ Cit a (Fe2+) 0.290 Cit a3 (Fe3+) + ē Æ Cit a3 (Fe2+) 0.550 ½ O2 + 2 H+ + 2 ē Æ H2O 0.816 ΔE0´ NAD + + H+ + 2 ē Æ NADH -0.320 ½ O2 + 2 H+ + 2 ē Æ H2O 0.816 ½ O2 + NADH + H+ Æ H2O + NAD+ 1.14 ΔG´0 = -n FΔE´0 = -52.6 kcal/mol ADP + Pi Æ ATP + H2O ΔG´0= 7.3 kcal/mol Para el bombeo de 1 H+ ΔG = 2.3 RT [pHin – pHex] + Z F Δψ En hepatocitos el potencial es aprox. 0.168V, da un ΔG = 21.5 kJ/mol. Comparado con alred. de 40 a 50 kJ/mol para la sint. de 1 ATP ⇒ al menos 2 H+, las estimaciones son que casi 3 O2 % Cit red Bi m Uí q o ic a yF B C -F b c1 c a + a3 Succ t rotenona NADH Æ UQ Æ Cit b Æ Cit c1 Æ Cit c Æ Cit (a + a3) Æ O2 Antimicina A NADH Æ UQ Æ Cit b Æ Cit c1 Æ Cit c Æ Cit (a + a3) Æ O2 CNNADH Æ UQ Æ Cit b Æ Cit c1 Æ Cit c Æ Cit (a + a3) Æ O2 COMPLEJO I (NADH-Q 2 H+ Espacio interm. QH2 Q Matriz Bi oq Uí m ica -F CB y F • 880 kDa (43 SU) • FMN • 5 FeS • Aceptor: Q 2x1ē 2x1 ē oxidoreductasa) 2 H+ NADH + H+ NAD+ . FMN + 2 H+ + 2 H- Æ FMNH2 - H+ - ē Æ FMNH - H+ - ē Æ FMN Q + ē Æ Q-. + ē + 2 H+ Æ QH2 4 H+inÆ 4 H+ex COMPLEJO II (Succinato-Q reductasa) Espacio interm. • 127 kDa • FAD • 3 FeS (2/2; 4/4 y 3/4) • cit b560 •Aceptor: Q FeS FeS FeS b560 FADH2 FAD Matriz o Bi Succinato ica m í qU b560 By C -F QH2 Q F Fumarato 2 H+ COMPLEJO III (Q-citochromo c oxidoreductasa) • 500 kDa (dím. 11 SU) • 3 cit (b562, b566, c1) • 1 FeS Cit c 4 H+ Espacio interm. Cit c1 FeS QH2 Cit b562 yF B Cicloa Q - FC Cit b c ími U q Bio 566 • Aceptor: cit c 4 H+inÆ 4 H+ex 4 H+ Matriz CICLO Q H+ H+ Cit c Espacio interm. 1ē QH2 ē QH. Cit b562 ē QH2 Bi U oq Q ica ím C -F F By 2 QH. Cit b566 Q 1 Matriz H+ H+ COMPLEJO IV (cit c oxidasa) 2 H+ Cit c Espacio interm. 2x1ē 2x1ē CitCit a3 a3↔ CuB oq Uí m ic a -F CB y F Cit a ↔ CuA Bi • 400 kDa (dím. 813 SU) • cit (a y a3) • CuA y CuB • Aceptor: O2 4 H+inÆ 4 H+ex ½ O2 + 2 Matriz H+ H 2O Síntesis de ATP • Fo: transmembrana, 8 SU diferentes (3 en E. coli), ab2c10-12, canal de H+ • F1: 9 SU, α3β3γδε, β es la catalítica O O T L T L T L O L O T L O O O T T T O L L L T ΔG ATP aq BioqUímica - FCByF ADP + Pi ATP unido Coordenada de reacción Adenilato translocasa ADP 3ATP 4BioqUímica - FCByF Pi H+ Lanzadera malato/α−cetoglutarato Matriz Mal Mal NAD+ NADH MDH OAA Glu AAT αKG Asp BioqUímica - FCByF Esp. IM NAD+ NADH OAA Glu AAT αKG Asp Lanzadera de glicerofosfato Matriz Esp. IM DHAP FADH2 NADH NAD+ GliceroP Bi o ic a ím U q By C -F F FAD Q QH2 Desacoplantes • Sustancias que disipan el gradiente de H+ • Aumentan el flujo de ē • Cesa la producción de ATP • Pueden ser naturales (valinomicina) o sintéticos (DNF) Noradrenalina Receptor β-adrenérgico Adenilato ciclasa Proteína G GTP ím U termogenina oq Bi ica By C -F F ATP AMPc + Activación de bloqueda por ATP, ADP, GTP, GDP Proteína kinasa dep. de AMPc Proteína kinasa dep. de AMPc ATP Ac. graso libre P Lipasa sensible a hormonas ADP Lipasa sensible a hormonas Inhibidores del transporte de ē • Sustancias inhiben algún componente de la cadena de TEM • Cesa el flujo de ē • Cesa la producción de ATP • Actúan en diferentes lugares: ¾ ¾ ¾ Complejo I: Rotenona, amital, piericidina Complejo III: antimicina, mixotiazol, estigmatelina Complejo IV: cianuro, sulfuro, CO, azida (N3-) Inhibidores de la ATP sintasa • Cesa la producción de ATP • Cesa el flujo de ē • Ejemplos: oligomicina, diciclo hexil carbodiimida (DCCD) Inhibidores de la translocasa • Cesa la producción de ATP • Cesa el flujo de ē • Ejemplos: atractilósido