ESTADO DE MAL EPILÉPTICO
Anuncio

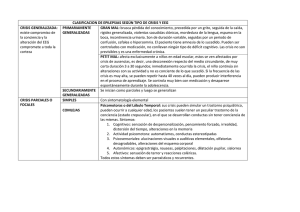
ESTADO DE MAL EPILÉPTICO DRA. MÓNICA FLEITAS Metodología: Búsqueda en pubmed/medline de artículos relacionados hasta 8/2011. Complementado por literatura recomendada por expertos. A las recomendaciones de tratamiento se les asigno un nivel de evidencia según la metodología de la AHA. Para el diagnóstico y manejo del EME se asignó una recomendación según la escala GRADE con 2 grados de recomendación “fuerte o débil”. Definiciones: EME: actividad epiléptica continua, clínica o EEG, de más de 5 min de duración, o la presencia de crisis recurrentes sin recuperación entre episodios. - La mayoría de las convulsiones cesan en 5 min y convulsiones que duran más generalmente no ceden espontáneamente. - Datos en animales: el daño neuronal y la fármaco resistencia ocurre antes de los 30 min de crisis epiléptica. - El tratamiento emergente es de suma importancia en pacientes con crisis epiléptica prolongada. Estado de mal epiléptico convulsivo: Convulsiones que están asociadas con movimientos rítmicos de los miembros. EME convulsivo generalizado: - Movimientos tónico-clónicos generalizados de los 4 MMSS. - Deterioro del estado mental (letargo, confusión, coma). - Déficits neurológicos post ictales (parálisis de Todd, dura de horas a días). Estado epiléptico no convulsivo: Actividad epiléptica que se ve en el EEG sin elementos clínicos de crisis convulsiva generalizada. Fenotipos: - Confusos: o Sd epilépticos crónicos, pronóstico relativamente bueno. - En paciente crítico: afectación severa de la conciencia con o sin movimientos sutiles (contracciones musculares rítmicas, desviación tónica de los ojos). Síntomas negativos: anorexia, afasia/mutismo, amnesia, catatonia, coma, confusión, letargia, mirada fija. Síntomas positivos: agitación/agresividad, automatismos, parpadeo, llanto, delirio, ecolalia, espasmos faciales, risas, nauseas/vómitos, nistagmo/desviación ocular, perseverancia, psicosis y temblores. Estado de mal epiléptico refractario: Pacientes que no responden al TTO estándar para el EME. Pacientes que continúan con crisis epiléptica clínica o EEG luego de haber recibido dosis adecuadas de una BZD inicial y un fármaco antiepiléptico. La duración no sería un criterio para definirlo como EMEr. Estado epiléptico super refractario: EME que continua o recurre 24 hs o más luego del inicio del tto con agentes antiepilépticos anestésicos, condicionando una rápida instalación de los mismos. ETIOLOGÍA: Pasos diagnósticos: Pronostico: Recomendaciones para el diagnóstico y clasificación del EME: 1) El EME se define como 5 min de actividad epiléptica continua clínica o EEG o presencia de crisis reiteradas sin recuperación entre las mismas (R: fuerte, C: moderada). 2) EME debe ser clasificado como EME convulsivo o no convulsivo (R: fuerte, C: alta). 3) EMEr es el EME que no responde a los regímenes de tto estándar, BZD inicial seguido de otro FAE (R: fuerte, C: moderada). 4) La etiología debe ser diagnosticada y tratada tan rápido como sea posible (R: fuerte, C: alta). TRATAMIENTO: Objetivos: El objetivo principal es detener de forma urgente tanto la actividad clínica como electroecefalográfica. Pautas: Evaluación simultánea y manejo de la VA, ventilación y circulación. Tratamiento de ataque con BZD. Detección de la causa subyacente del EME. Tratamiento inmediato de las etiologías que amenazan la vida (MEAS, lesión masa intracraneal). La IOT temprana es aconsejable más aún si los FAE en BIC son necesarios. El tratamiento posterior debe ser guiado por los estudios diagnósticos. El control definitivo del EME debe de realizarse antes de 60 min. Todos los pacientes con EME necesitan un tto emergente inicial con fármacos de 1ª línea, y control urgente con FAE de 2ª línea, terapia de mantenimiento cuando el EME se controla. La terapia del EMEr con FAE de 3ª y 4ª línea se reserva para cuando los de 2ª línea fallan. Cuando es causado por un desorden metabólico, debe ser tratado y puede ser que no sean necesarios FAE de mantenimiento. El tratamiento es un proceso continuo y el cese de la actividad convulsiva urgente es el objetivo en cada etapa. Medidas generales de tratamiento: Terapia inicial emergente: Las BZD deben ser el tto de elección para el tto emergente inicial. Se prefieren IV pero pueden administrarse IV, IM, rectal, nasal, bucal, cuando IV no es factible. Lorazepam IV es el agente preferido. Midazolam IM (es tan eficaz como lorazepam IV a nivel pre hospitalario). Diazepam rectal. Las dosis en la práctica clínica pueden ser mayores que las de la tabla deben ser valorados según clínica y EEG. Terapia de control urgente: En todos los pacientes con EME luego de la BZD de acción corta salvo que la causa sea rápidamente corregida. Objetivos: - En los que el EME ceso, lograr rápidamente niveles terapeúticos del FAE, dosificación del tto de mantenimiento. - En los que no respondieron a la terapia emergente inicial es detener el EME. Los FAE más utilizados son: fenitoína, fosfofenitoína, valproato, fenobarbital, levetiracetam o midazolam en infusión continua. Es preferible la administración IV para yugular la crisis. En un epiléptico conocido se puede utilizar el FAE que venía recibiendo si hay en presentación IV. Recomendaciones de Tratamiento para el EME Tratamiento del estado de mal epiléptico refractario Definición: actividad epiléptica clínica o EEG luego del tto inicial emergente y urgente. Iniciar de inmediato agentes adicionales. ¿Repetir el bolo de FAE o iniciar agentes adicionales? Las recomendación es iniciar el FAE en BIC para suprimir las convulsiones. Puede considerarse la administración de bolos de valproato, levetiracetam, fenitoína, fosfenitoína si no se han utilizado. Del FAE utilizado en BIC puede aumentarse la dosis o realizar bolos adicionales de ser necesario. Se recomiendan para infusión: mizadolam, propofol y pentobarbital. Puede ser necesario IOT, monitorización CV y uso de vasopresores. Intensidad y duración del tratamiento: La intensidad es dictada por el EEGc. La duración óptima de TTO no es conocida. Cuando el control óptimo del EME se mantiene por 24-48 hs se retiran gradualmente los FAE en BIC. Pueden presentar EME recurrente con el descenso de la infusión del FAE que requiere retomar la dosis anterior y aún superior, con o sin la adición de otro FAE. La duración acumulada del tto de FAE en BIC no es indicador del pronóstico a largo plazo. Transición desde infusión a dosis de mantenimiento: La DM puede ser mayor que la dosis objetivo publicada para muchos FAE, debe individualizarse para lograr el control de la crisis y minimizar los efectos adversos. El éxito del tto de mantenimiento depende de: patrón EEG, causa del EME, enfermedad sistémica concurrente, interacción farmacológica. Los que reciben pentobarbital por períodos prolongados están en riesgo de convulsiones por abstinencia al disminuir la concentración en sangre. Altas dosis de fenobarbital (>100 mcg/ml) se pueden utilizar para evitarlo Terapias alternativas para el estado epiléptico refractario: El tto agresivo debe continuar en todas las situaciones hasta que el médico determine que es exitosa o fútil. Realizar ttos prolongados: en pacientes jóvenes con buen estado de salud premórbido, enfermedades auto limitadas, ausencia de lesiones intracraneales de mal pronóstico. Ttos alternativos según la situación clínica individual. Terapia adyuvante para EMEr: infusión de Mg, hipotermia, dieta cetogénica, terapia de estimulación eléctrica, drenaje de LCR, resección neuroquirúrgica del foco epiléptico si se identifico. Terapias alternativas para el EMEr que no responde al tto convencional Recomendaciones: 1) El tto del EME convulsivo debe ocurrir rápido y continuar secuencialmente hasta el cese de las convulsiones clínicas (R: fuerte, C: alta). 2) El tto del EME debe ocurrir rápido y continuar secuencialmente hasta que las convulsiones en el EEG cesen (R: fuerte, C: moderada). 3) Los cuidados críticos deben iniciarse simultáneamente con el TTO emergente y continuar hasta que el tto adicional sea considerado exitoso o inútil (R: fuerte, C: moderada). 4) Opciones de TTO A- Las BZD deben administrarse como terapia inicial emergente (R: fuerte, C: alta). I) El lorazepam es el fármaco de elección para la vía IV (R: fuerte, C: moderada). II) El midazolam es de elección para la vía IM (R: fuerte, C: moderada). III) Diazepam rectal se puede dar cuando no hay acceso IV, la administración IM está contraindicada (R:fuerte, C:moderada). B- FAE de control urgentes: fosfofenitoína/fenitoína IV, valproato o levetiracetam (R: fuerte, C: moderada). C- TTO del EMEr: FAE en infusión continua, pero varía según la condición subyacente de paciente (R: fuerte, C: baja). D- La dosis de FAE en EMEr se ajusta a la cesación EEG de la crisis o supresión de salvas (R:débil, C: muy baja). E- Período de 24-48 hs de control en el EEG previo para iniciar la retirada de los FAE en BIC en el EMEr (R: débil, C: muy baja). F- Durante la transición de los FAE en infusión en el EMEr, se sugiere utilizar FAE de mantenimiento y seguimiento de las convulsiones recurrentes por EEGc durante el período de titulación. (R: fuerte, C: muy baja). G- Las terapias alternativas deben ser consideradas si no se puede lograr el cese de la crisis, se recomienda reservar estas terapias para los pacientes que no responden al tto del EMEr con FAE (R: débil, C: muy baja). Recomendaciones de EEG continuo en el EME: Actividad epiléptica: descarga sincrónica, paroxística, generalizada o focal en forma de espigas (20-70 mseg), ondas agudas (700 a 200 mseg), complejos espiga onda lenta >3 /seg. EME: persistencia mayor a 5 min o la reiteración de la misma. 1) El uso de EEGc se requiere generalmente para el TTO del EME (R: fuerte, C: muy baja). 2) Monitorización EEGc debe iniciarse en 1 hora del inicio del EME si las crisis en curso son sospechosas (R: fuerte, C: baja). 3) La duración del seguimiento EEGc debe ser al menos de 48 hs en pacientes comatosos para evaluar la crisis no convulsiva (R: fuerte, C: baja). 4) La persona que lee EEG en la UCI debe tener una formación especializada en EEGc, incluyendo la capacidad de analizar EEG bruto, así como los trazados EEG cuantitativos (R: fuerte, C: baja). MONITOREO MULTIMODAL EN CUIDADOS NEUROCRÍTICOS Monitoreo clínico. Recomendaciones: 1) Evaluación de la conciencia con la SCG y CUATRO rutinariamente en adultos en coma con ICA (R: fuerte, C: baja). 2) El NRS 0-10 para valoración del dolor en pacientes neurocríticos con estado de vigilia suficiente (R: fuerte, C: baja). 3) En ausencia de un estado de conciencia fiable las escalas BPS o CCPOT para valoración del dolor (R: fuerte, C: baja). 4) El NCS-R en pacientes con graves problemas de conciencia para valorar el dolor. (R: fuerte, C: baja). 5) Seguimiento de la sedación con SAS o RASS (R: fuerte, C: baja) 6) No usar pruebas de despertar en pacientes con HTE a menos que el beneficio sea mayor que el riesgo (R: fuerte, C: baja). 7) Evaluar el delirio con escalas apropiadas, y ante la presencia del mismo buscar nuevas lesiones neurológicas. (R: débil, C: baja). 8) Atención al nivel de vigilia con CILSS para evitar confusión con sedación residual (R: débil, C: baja). Hemodinamia sistémica: Recomendaciones: 1) Uso de MEC y PAI en todos los pacientes inestables o en situación de riesgo en la UCI (R: fuerte, C: moderada). 2) La monitorización hemodinámica debe utilizarse para establecer objetivos que tengan en cuenta FSC y oxigenación dependiendo de la etapa de la enfermedad (R: fuerte, C: moderada). 3) Monitorización hemodinámica adicional (x ej: ecocardiografía, monitores de GC), en pacientes seleccionados con inestabilidad hemodinámica (R: fuerte, C: moderada). 4) La elección de la técnica para la evaluación de la precarga, poscarga, GC y perfusión sistémica global, debe guiarse por la evidencia específica y la experiencia local (R: débil, C: moderada) Presión intracraneana y presión de perfusión cerebral: Recomendaciones: 1) Monitoreo de PIC y PPC en pacientes en riesgo de HTE según la clínica e imagen. (R: fuerte, C: moderada). 2) Monitoreo de PIC y PPC utilizarlo para guiar intervenciones médicas y quirúrgicas y detectar riesgo vital por herniación inminente, el valor umbral es incierto según la literatura (R: fuerte, C: alta). 3) Indicaciones y método de monitorización de PIC deben adaptarse al dg. específico. (R: fuerte, C: baja). 4) Monitorización de PIC como requisito previo para utilizar otros monitores intracraneales. (R: fuerte, C: baja). 5) Protocolos estandarizados de inserción y mantenimiento para garantizar seguridad y fiabilidad de PIC (R: fuerte, C: alta). 6) Monitores de PIC parenquimatosos e intraventriculares proporcionan datos fiables y precisos; en presencia de hidrocefalia se prefiere IV (R: fuerte, C: alta). 7) Evaluación y seguimiento permanente de PIC y PPC incluyendo calidad de la onda. Valorares de PIC deben interpretarse según la tendencia, PPC y clínica (R: fuerte, C: alta). 8) El aumento refractario de PIC es un fuerte predictor de mortalidad, la PIC per se no es un marcador útil de estado funcional. La PIC no debe usarse aislada como marcador pronóstico. (R: fuerte, C: alta). Autorregulación cerebral: Recomendaciones: 1) Se sugiere que el monitoreo y la evaluación de la autorregulación pueden ser útiles en el manejo de los objetivos de perfusión cerebral y en el pronóstico de la injuria cerebral (R: débil, C: moderada). 2) El monitoreo continuo de la autorregulación a la cabecera de la cama, es ahora factible, se debe considerar como parte del MM. La medición de la reactividad de la presión se ha utilizado comúnmente, pero enfoques diferentes pueden ser válidos. (R: débil, C: moderada). Oxigenación sistémica y cerebral: Recomendaciones: 1) Recomendamos la SaO2 sistémica en todos los pacientes y ETCO2 en pacientes en ARM, y gasometría arterial (R: fuerte, C: alta) 2) Recomendamos monitorización cerebral de O2 en pacientes con o en riesgo de isquemia y/o hipoxia cerebral, utilizando oximetría del tejido cerebral (PbtO2) y/o oximetría yugular venosa de O2 (SjVO2), la elección depende de la patología del paciente. (R: fuerte, C: baja) 3) La ubicación de la sonda de PbtO2 y SjVO2 dependen del Dg, el tipo y la localización de las lesiones cerebrales, y la viabilidad técnica (R: fuerte, C: baja). 4) La PbtO2 persistentemente baja y/o los episodios repetidos de desaturación SjVO2 son fuertes predictores de mortalidad, los monitores de O2 cerebral pueden utilizarse como indicadores clínicos junto con otras modalidades de monitoreo para el pronóstico exacto (R: fuerte, C: baja). 5) Monitoreo de O2 cerebral para ayudar en la valoración de los ttos médicos y quirúrgicos, para guiar la terapéutica, identificar la HTA y los umbrales refractarios de tto, ayudar a controlar la isquemia cerebral retardada y seleccionar a los pacientes para terapia de segunda línea (R: débil, C: baja). Flujo sanguíneo cerebral: Recomendaciones: 1) Recomendamos doppler transcaraneano (DTC) o doppler codificado por colores (TCCS) para predecir vasoespasmo angiográfico después de HSA por aneurisma (R: fuerte, C: alta). 2) Las tendencias de DTC o TCCS pueden ayudar a predecir déficits neurológicos isquémicos por vasoespasmo después de HSA por aneurisma (R: débil, C: moderada). 3) TCCS es superior que DTC en la detección, angiográficamente demostrada, de vasoespasmo después de la HSA por aneurisma (R: débil, C: moderada). 4) DTC o un control de TCCS puede ayudar a predecir el vasoespasmo después de la HSA traumática (R: débil, C: muy baja). 5) Sugerimos que unas sonda de flujimetría de difusión térmica (TDF) puede ser utilizada para identificar a los pacientes con riesgo de isquemia focal en el territorio vascular de la sonda (R: débil, C: muy baja). 6) El DTC como screening a través del índice de Lindergaard o comparaciones de la velocidad media de la arteria cerebral media bi-hemisféricas para mejoran la sensibilidad para identificar el daño isquémico asociado a vasoespasmo (R: débil, C: baja). 7) Las sondas de TDF se utilizan para evaluar el riesgo isquémico después de la HSA por aneurisma, debe ser colocada en el territorio vascular del aneurisma roto (R: débil, C: muy baja). Electrofisiología: Recomendaciones: 1) EEG en todos los pacientes con ICA y alteración de la conciencia inexplicable y persistente (R: fuerte, C: baja). 2) EEG urgente en pacientes con crisis subintrantes que no retornan al estado basal dentro de 60 min luego de iniciada la medicación para la crisis de manera urgente (dentro de 60 min), EEG en pacientes con EMEr. (R: fuerte, C: baja). 3) EEG durante la hipotermia terapeútica y dentro de las 24 hs del recalentamiento para excluir crisis epilépticas no convulsivas. En todos los pacientes en coma luego de un PCR (R: fuerte, C: baja). 4) EEG en pacientes en coma y sin una causa neurológica primaria aguda y con deterioro inexplicable del estado de conciencia o déficits neurológicos inexplicables para excluir EMENC, en sepsis severa o insuficiencia renal/hepática (R: débil, C: baja). 5) EEG para detectar isquemia cerebral retardada (ICR) en HSA en estado de coma, en los cuales el examen neurológico es poco fiable. (R: débil, C: baja). 6) Monitorización EEGc como método preferido para el monitoreo de rutina EEG siempre que sea posible en los pacientes ingresados en la UCI en estado de coma y sin causa primaria aguda y deterioro inexplicable del estado de conciencia, o déficits neurológicos inexplicables para excluir EMENC (R: débil, C: baja). Metabolismo cerebral: Recomendaciones: 1) El seguimiento de la microdiálisis cerebral en pacientes con riesgo de isquemia cerebral, hipoxia, falta de energía, y depribación de glucosa. (R: fuerte, C: baja). 2) La ubicación de la sonda de microdiálisis depende del Dg, el tipo y la localización de las lesiones cerebrales y la viabilidad técnica. (R: fuerte, C: baja). 3) La glucosa cerebral persistentemente baja o la relación lactato/piruvato elevada es un fuerte predictor de mortalidad, la microdiálisis cerebral solo se puede utilizar en combinación con indicadores clínicos y otras modalidades de monitoreo para el pronóstico. (R: fuerte, C: baja). 4) Microdiálisis cerebral para ayudar a la valoración de los TTO médicos, control de glicemia sistémica, tto de la isquemia cerebral retardada. (R: débil, C: moderada). 5) Monitoreo de microdiálisis cerebral para ayudar a la valoración de ttos médicos como transfusión, hipotermia terapeútica, hipocapnia, hiperoxia (R: débil, C: baja). Informática, integración de datos, display y análisis: Recomendaciones: 1) Recomendamos las pantallas de datos ergonómicas que presentan información clínica de manera sencilla para reducir la carga cognitiva y mejorar el juicio de los médicos. (R: fuerte, C: moderada). 2) Herramientas de apoyo de decisiones clínicas, como algoritmos que procesan automáticamente múltiples flujos de datos, con resultados que se presentan de forma simple. (R: débil, C: moderada). 3) Adopción de una infraestructura de base de datos que permita la integración de datos fisiológicos de alta resolución (incluyendo EEG) con datos de menor resolución de los sistemas de laboratorio y de salud electrónica (R: fuerte, C: baja) 4) Recomendamos una metodología de diseño centrado en el hombre para las pantallas de visualización complejas para no perjudicar la toma de decisiones clínicas (R: fuerte, C: moderada) 5) Que los fabricantes de dispositivos utilicen estándares de presentación de datos, sincronización en tiempo de todos los dispositivos, para mejorar el uso de los datos (R: fuerte, C: baja). 6) Adoptar alarmas inteligentes en la UCI para ayudar en la fatiga vinculada a alarmas. (R: fuerte, C: baja). El MM es una extensión del examen clínico y del conjunto de habilidades cognitivas del médico, y es tan bueno o tan útil como el equipo clínico que está utilizando el monitor y las opciones terapeúticas disponibles.