la materia y su diversidad
Anuncio

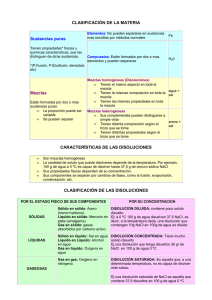
LA MATERIA Y SU DIVERSIDAD La materia es todo aquello que tiene masa y ocupa un espacio, es decir, tiene volumen. Propiedades generales La masa y el volumen, son comunes a toda la materia y no nos sirven para poder definirla. Por ello, las llamamos propiedades generales de la materia. Propiedades específicas Las propiedades que nos permiten distinguir unas sustancias de otras se llaman propiedades específicas. Punto de ebullición, punto de fusión y la densidad. Los estados de la materia Las diferentes formas en que se puede presentar la materia se llaman estados físicos y son: sólido, líquido y gas. Características de los sólidos • Tienen forma propia. Para deformarlos debemos aplicar fuerzas sobre ellos. • Tienen volumen fijo, aunque puede aumentar ligeramente (dilatarse) con el calor, y disminuir si los enfriamos. Características de los líquidos • No tienen forma propia. Se adaptan a la forma del recipiente. • Tienen volumen fijo, aunque, como los sólidos, se dilatan con el calor. • Pueden fluir. Se deslizan si no están contenidos en un recipiente. Características de los gases • No tienen forma propia y pueden fluir igual que los líquidos. • No tienen volumen fijo. Se expanden, ocupando todo el espacio posible, aunque pueden ser contenidos en cualquier recipiente, ya que pueden comprimirse, reduciendo su volumen. La materia está formada por partículas • La materia está formada por pequeñas partículas. • Las partículas que forman la materia se encuentran en continuo movimiento. En los sólidos, las partículas están fuertemente unidas y muy juntas. Al moverse no cambian de posición, solo pueden vibrar; es decir, moverse ligeramente sin cambiar su posición relativa Las partículas de los líquidos están menos unidas, más separadas y menos ordenadas que las de los sólidos. Pueden desplazarse unas sobre otras, lo que permite a los líquidos cambiar de forma y fluir. Las partículas de los gases no están unidas, se encuentran más separadas que las de los líquidos y se pueden mover libremente. Por eso los gases no tienen forma propia y ocupan todo el espacio disponible. Los cambios de estado De sólido a líquido y viceversa El proceso mediante el cual un sólido pasa al estado líquido se llama fusión. El proceso inverso se denomina solidificación. La temperatura de fusión y la de solidificación de una sustancia son la misma. La temperatura a la que se produce el cambio de estado de sólido a líquido se llama temperatura o punto de fusión. Durante el cambio de estado la temperatura no aumenta, aunque sigamos proporcionando calor. De líquido a gas y viceversa El paso de un líquido a gas se llama vaporización y se puede producir por ebullición o por evaporación. El proceso inverso, paso de gas a líquido, se denomina condensación. La temperatura a la que una sustancia hierve se llama temperatura o punto de ebullición, y se mantiene constante durante el cambio de estado. De sólido a gas y viceversa Este paso directo de sólido a gas y de gas a solido se llama sublimación. La temperatura de fusión y de ebullición: propiedades específicas Cada sustancia tiene una temperatura de fusión y de ebullición características, por lo que podemos utilizar los valores de estas temperaturas para distinguir unas sustancias de otras; es decir, se trata de propiedades específicas de la materia, que nos permiten identificarla. Los cambios de estado y la teoría cinética La teoría cinética también nos permite explicar los cambios de estado. • Cuando un sólido se calienta, las partículas adquieren más energía y se mueven más rápidamente hasta que se separan, transformándose en un líquido. • Si seguimos calentando, llega un momento en que las partículas del líquido están tan separadas que se escapan unas de otras y se transforman en gas, mezclándose con las partículas del aire. Las mezclas La mayor parte de la materia que nos rodea está formada por la mezcla de varias sustancias. Mezclas heterogéneas Cuando podemos distinguir a simple vista las sustancias que las componen, se trata de mezclas heterogéneas. Mezclas homogéneas Cuando no podemos distinguir a simple vista las sustancias que las componen, se trata de mezclas homogéneas. Disoluciones. Son un tipo especial de mezclas homogéneas. Las disoluciones más sencillas están formadas por dos componentes: • Disolvente. Es el componente que se encuentra en mayor cantidad en una disolución. • Soluto. Es el componente minoritario de la disolución. Según la cantidad de soluto que se disuelve, las disoluciones pueden ser Disolución diluida: Tiene poco soluto disuelto. Disolución concentrada: Tiene más soluto disuelto que la diluida. Disolución saturada: No se puede disolver más soluto. Según el estado final de la disolución, podemos tener: • Disoluciones líquidas. La mayoría de las disoluciones que conocemos están en estado líquido: el vinagre, el alcohol, el agua de mar, etc. • Disoluciones gaseosas. El aire es una mezcla de gases formando una disolución gaseosa. • Disoluciones sólidas. Las aleaciones metálicas son disoluciones sólidas, como, por ejemplo, el bronce o el acero. Separación de los componentes de una mezcla Separación magnética La separación magnética sirve para separar sólidos que presentan la propiedad de poder ser atraídas por un imán. Por ejemplo para separar las limaduras de hierro de una mezcla con arena Filtración La filtración sirve para separar un sólido mezclado con un líquido en el cual no es soluble. El filtro permite el paso del líquido y retiene las partículas sólidas. Decantación La decantación se utiliza para separar líquidos de diferente densidad que no son solubles entre sí. El embudo de decantación regula la separación. Destilación Sirve para separar dos o más líquidos solubles entre sí. Con un aparato de destilación, hervimos la mezcla y condensamos los vapores que se producen. Los distintos componentes se separan según sus temperaturas de ebullición. Las sustancias puras. Una sustancia pura es aquella que tiene unas propiedades específicas tales como la densidad, la temperatura de fusión y de ebullición, etc., que la caracterizan y que sirven para diferenciarla de otras sustancias. Compuestos químicos Las sustancias puras que se pueden descomponer en otras más sencillas por métodos químicos se llaman sustancias compuestas o compuestos químicos. El agua (H20) es un compuesto químico, ya que podemos descomponerla en oxígeno e hidrógeno, que tienen propiedades diferentes del compuesto que forman cuando se combinan. El agua es líquida, el oxígeno y el hidrógeno son gaseosos. Elementos Las sustancias que no se pueden descomponer en otras más sencillas se llaman sustancias simples o elementos químicos. El oxígeno y el hidrógeno, obtenidos al descomponer el agua, no se pueden descomponer a su vez en ninguna otra sustancia.