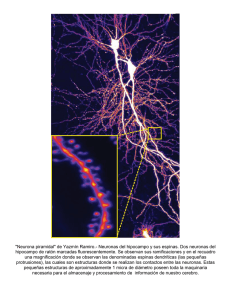
Asta dorsal medular: ¿cuál es su rol en el procesamiento de los
Anuncio

52 REVISIÓN R e v. Soc. Esp. Dolor 5: 52-69, 1998 Asta dorsal medular: ¿cuál es su rol en el procesamiento de los impulsos que generan la sensación dolorosa? L. Vi l l a n u e v a * Villanueva L. The dorsal horn of the spinal cord: hy potheses about its role in the processing of signals that originate pain sensations. Rev Soc Esp Dolor 1998;.5: 52-69. SUMMAR Y Neurobiological studies of the mechanisms underlying pain sensations have shown that the spinal cord is not a simple relay between the periphery and the brain. In fact, several processing mechanisms strongly modify the transmission ol pain signals at the dorsal horn level. Indeed, it seems difficult to separate pain transmission from pain modulatory systems since both are activated when a noxious stimulus occurs. The purpose ot this review is to briefly analyse the role in pain signalling of modulatory mechanisms acting on dorsal horn nociceptive neurons. © 1998 Sociedad Española del Dolor. Published by Arán Ediciones, S.A. Key wor ds: Dorsal horn. Spinal cord. Pain modulation, Brainstem. Homeostasis. RESUMEN Los estudios neurobiológicos de los mecanismos espinales que producen la sensación dolorosa demuestran que el asta dorsal medular no es un simple relevo entre el medio e x t e rno y los centros cerebrales. De hecho, existen numerosos mecanismos de procesamiento que son capaces de modificar significativamente el mensaje nociceptivo generado inicialmente a nivel periférico. En realidad, parece difícil separar los sistemas de transmisión de los sistemas de modulación del dolor, pues ambos son desencadenados durante una estimulación dolorosa. El propósito de esta re v isión es analizar brevemente el rol que juegan los mecanismos moduladores a nivel del asta posterior medular en la p roducción de la sensación dolorosa. © 1998 Sociedad Española del Dolor. Publicado por Arán Ediciones, S.A. Palabras clave: Asta posterior. Médula espinal. Modulación del dolor. Bulbo raquídeo. Homeostasis. * DDS, PhD, Directeur de Recherches. INSERM. París (Francia). Recibido: 1 3-V I-9 7 . Aceptado: 1 8-V I-9 7 . ÍNDICE 1. INTRODUCCIÓN 2. E L ORIGEN DE LA SENSACIÓN DOLOROSA NO PUEDE EXPLICARSE SÓLO MEDIANTE LAS PROPIEDADES DE LOS “NOCICEPTORES PERIFÉRICOS” 3. L A ORGANIZACIÓN DE LAS FIBRAS A F ERENTES PRIMARIAS EN EL A S TA P O S T ERIOR MEDULAR 4. NEUROTRANSMISORES Y N E U R O M O D U L ADORES DEL A S TA POSTERIOR MEDULAR 5. LAS NEURONAS NOCICEPTIVAS DEL A S TA POSTERIOR MEDULAR 5.1. Las neuronas nociceptivas específicas 5.2. Las neuronas nociceptivas inespecíficas 6. LOS CONTROLES SEGMENTA R I O S 7. LOS CONTROLES DESENCADENADOS POR ESTIMULACIÓN DE LOS CORDONES POSTERIORES 8. LOS CONTROLES DE ORIGEN SUPRAMEDULAR 9. LOS CONTROLES INHIBITORIOS DIFUSOS 10. CONCLUSIÓN GENERAL 1. INTRODUCCION A pesar de que existen numerosos vacíos en esta materia, los datos obtenidos por los diferentes grupos que investigan los mecanismos neurobiológicos del dolor han permitido proponer algunos conceptos que sugieren que la elaboración de la sensación dolorosa depende de procesos pasivos y activos. En cuanto a los procesos activos, los mecanismos de proce76 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA samiento periférico, espinal y cerebral juegan un rol fundamental, pues son capaces de modificar el umbral y la intensidad de las sensaciones, actuando al mismo tiempo como filtros y amplificadores. En relación al dolor, los mecanismos moduladores que han sido estudiados en forma más exhaustiva son aquellos que actúan a nivel periférico y espinal. Esto no excluye, que otros controles puedan actuar a nivel de centros supramedulares, sin embargo la información que se posee actualmente sobre la participación de estos centros es relativamente escasa. 2. EL ORIGEN DE LA SENSACIÓN DOLOROSA NO PUEDE EXPLICARSE SÓLO MEDIANTE LAS PROPIEDADES DE LOS “NOCICEPTORES” PERIFÉRICOS Aunque los primeros registros de actividad unitaria de las fibras Aδ y C en el hombre permitieron atribuirles definitivamente un rol en la transmisión de las informaciones que desencadenan el dolor, ya desde comienzos de este siglo Sherrington (1) había sugerido la existencia de “nociceptores” (de nocere: dañar) que jugarían el rol de sistema de alarma capaz de detectar los estímulos potencialmente nocivos para la integridad del organismo. Sin embargo, no se puede generalizar el concepto Sherringtoniano de n o c i c e p t o r-sistema de alarma en forma absoluta. De hecho, a pesar de que estos nociceptores poseen propiedades fisiológicas que les permiten generar y conducir los mensajes nociceptivos, diversos hechos demuestran que la sensación dolorosa no esta estrictamente determinada por la activación de dichas fibras. En primer lugar toda estimulación natural nociceptiva, activa inevitablemente un mosaico de receptores que poseen modalidades y umbrales diferentes. Además, estas fibras no poseen una especificidad en cuanto al tipo de estímulo capaz de activarlas, ya que la mayoría de ellas pueden ser activadas por estimulaciones térmicas, mecánicas o químicas. En cuanto al ser humano, la intensidad inicial capaz de activar los nociceptores en muchos casos es inferior al umbral del dolor; sin embargo sus descargas son más importantes cuando la intensidad alcanza el umbral nociceptivo. Desde el punto de vista psicofísico estímulos de origen diverso pueden generar, al menos bajo ciertas condiciones de laboratorio, sensaciones dolorosas idénticas; por ejemplo los sujetos a menudo son incapaces de distinguir la calidad mecánica o térmica de los estímulos nociceptivos cuando son 77 53 aplicados de manera puntiforme. Por otro lado la aplicación de una estimulación nociceptiva térmica en una área cutánea cada vez más grande provoca un aumento de la sensación dolorosa solamente en una gama limitada de superficies (2,3). Como se verá más adelante, estas observaciones sugieren que el sistema nervioso central analiza la modalidad y la intensidad de un estímulo, no solamente a partir de informaciones codificadas por la frecuencia de descarga de aferencias primarias particulares, sino además teniendo en cuenta el gradiente espacial del estímulo. En ciertas condiciones patológicas el dolor es desencadenado en forma exagerada por estímulos nociceptivos de baja intensidad, es el fenómeno clásico de hiperalgesia descrito inicialmente por Lewis (4), en el cual el punto de partida puede incluir el tejido lesionado (hiperalgesia primaria), y puede involucrar los tejidos sanos adyacentes (hiperalgesia secundaria). Esta hiperalgesia, que se observa a menudo en relación a la aplicación de estimulaciones mecánicas, tiene como substrato fisiológico el fenómeno de sensibilización de una categoría particular de nociceptores, los nociceptores polimodales. Estos constituyen el grupo mayoritario dentro de los nociceptores, que contienen una cantidad importante de neuropéptidos gran parte de los cuales son liberados a nivel periférico y/o central luego de una estimulación nociceptiva. Los nociceptores polimodales además se comportan como quimioreceptores, lo que significa que su actividad puede modificarse una vez que las substancias algógenas sean liberadas a partir de la lesión tisular. Así el mensaje inicialmente generado por los nociceptores periféricos será amplificado por las substancias liberadas en el foco inflamatorio, no solamente en relación a su intensidad, sino además en relación a su dimensión espacial, a través de un reclutamiento adicional de fibras adyacentes activadas o sensibilizadas, por el fenómeno del reflejo axónico desencadenado por estas mismas substancias. Este conjunto de interacciones neuroquímicas generadas desde la periferia, da una base de explicación al fenómeno clásico de hiperalgesia secundaria. Esta amplificación en el sistema global de transducción periférico probablemente facilita el desencadenamiento del sistema de alarma. Sin embargo, al menos bajo ciertas condiciones, es posible imaginar que de una amplificación exagerada, pueda resultar una cierta perturbación en la localización del origen del mensaje. El substrato neurológico de este fenómeno puede probablemente encontrarse en la médula espinal, donde antes de entrar a la substancia gris del 54 L. V I L L A N U E VA asta posterior, las fibras finas se subdividen en ramas ascendentes y descendentes que van a terminar en varios segmentos medulares (ver párrafos posteriores). Así, cualquier alteración de los mecanismos de modulación periférica a causa del exceso de informaciones nociceptivas podría explicar, por ejemplo, la frecuente dificultad para localizar con precisión un foco doloroso en la región oro-facial cuando suceden fenómenos inflamatorios agudos, como las pulpitis (5,6). En relación al dolor visceral, el concepto Sherringtoniano de nociceptor-sistema de alarma también puede ser cuestionado por la observación clásica en clínica de algunos pacientes con grandes lesiones viscerales que evolucionan de manera indolora. Por otro lado, los experimentos electrofisiológicos efectuados en el corazón, el tracto gastro-intestinal o el aparato génito-urinario han demostrado que la gran mayoría de las libras no responden específicamente a estímulos nociceptivos (7-9). Por ejemplo, la distensión del intestino o de la vejiga, a pesar de que puede desencadenar dolor en el hombre, es codificada por la actividad de fibras que responden a gamas de intensidad dolorosas, pero también no dolorosas. Lo más probable es que aquellas fibras juegan además un rol importante en el control de las funciones de llenado de dichos órganos. Otro ejemplo puede citarse a propósito del corazón: sus fibras aferentes primarias pueden ser activadas por una oclusión primaria o por la bradicinina; pero responden también a estímulos no nociceptivos como el aumento de presión arterial. Además existen situaciones fisiopatológicas en las que el dolor no resulta ni siquiera de la activación de nociceptores sino de fibras de mayor diámetro; se trata del fenómeno clásico de alodinia. Es el caso de ciertas neuralgias y neuropatías dolorosas, en las cuales el dolor puede desencadenarse a partir de estimulaciones tan suaves como el frotamiento con un algodón. Los datos descritos en forma sucinta en los párrafos precedentes demuestran evidentemente que, como es el caso de otras modalidades sensoriales, la capacidad de extraer la información que originará la sensación dolorosa no está monopolizada por una sola categoría de fibra periférica, ni tampoco por sus propiedades particulares de transducción. Esto ha sido corroborado recientemente por los estudios que demuestran que la aplicación concomitante de estímulos térmicos calientes y fríos no dolorosos, en un sujeto sano, es capaz de producir un dolor semejante al de una quemadura provocada por un frío intenso (la denominada “thermal grill illusion”) (10). Sin lu- R e v. Soc. Esp. del Dolor, Vol. 5, N.º 1, Enero-Febrero 1998 gar a dudas la actividad de los “nociceptores” es uno de varios elementos que serán considerados a nivel del sistema nervioso central durante el procesamiento de informaciones que pueden desencadenar la sensación dolorosa. Más adelante se analizará como los sistemas de control de origen espinal y supramedular juegan un rol en ese sentido, ya que pueden modificar numerosos parámetros tales como la calidad, el umbral, la intensidad, la extensión y la evolución temporal del d o l o r. Por otro lado se puede imitar o contrarrestar la actividad de dichos sistemas a través de ciertos procedimientos, de manera a “revolver las cartas” e introducir mensajes de error artificiales destinados a disminuir las capacidades del dispositivo de extracción del mensaje nociceptivo, lo que puede suceder a nivel espinal. 3. LA ORGANIZACIÓN DE LAS FIBRAS AFERENTES PRIMARIAS EN EL ASTA POSTERIOR MEDULAR Luego de su trayectoria a nivel periférico, la mayoría de las fibras aferentes primarias entran al sistema nervioso central a través de las raíces posteriores. Estas fibras son la prolongación de las células en T cuyo soma se encuentra a nivel de los ganglios raquídeos (Fig. 1). En la unión radículo-medular, las fibras gruesas se separan de las fibras finas de manera que a la entrada del asta dorsal las fibras amielínicas ocupan la porción ventrolateral de la raíz posterior, mientras que las fibras gruesas ocupan una posición mediodorsal. Esta organización ha permitido tratar de eliminar ciertos dolores a través de la rizotomía posterior selectiva (11 ) . Posteriormente, las fibras Aδ y C se dividen en ramas ascendentes y descendentes que ocupan entre uno a seis segmentos a nivel de la substancia blanca dorsolateral (tracto de Lissauer) para terminar especialmente en las láminas superficiales del asta post e r i o r, incluyendo las láminas I y II. Una parte de las fibras Aδ también terminan en la lámina V. Las aferencias musculares terminan más bien en la lámina I, V y VI, mientras que las aferencias viscerales terminan en las láminas I, V, VII y X, a veces en forma bilateral. Así entonces, podemos constatar la existencia de una convergencia anatómica de las diferentes aferencias nociceptivas en las láminas I y V del asta posterior, zonas que, como se verá más adelante, contienen numerosas neuronas nociceptivas. 78 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA Fig, 1.— Esquema de la organización de las fibras aferentes primarias en el asta posterior medular. Las fibras periféricas cutáneas entran al sistema nervioso central a través de las raíces posteriores para luego distribuirse a nivel de la médula espinal. Su soma se encuentra en un ganglio raquídeo (célula en T) o en el ganglio de Gasser en el caso del sistema trigeminal. La substancia gris medular ha sido dividida en 10 láminas: las primeras 5 láminas corresponden al asta posterior, las láminas VI-VII a la zona intermedia, las láminas VIII-IX al asta ventral, y la lámina X a la zona periependimaria. Las láminas I y II se les ha denominado también zona marginal y substancia gelatinosa. Las fibras mielínicas gruesas (Aβ) se dividen en dos grupos: el primero sube por los cordones posteriores para alcanzar los núcleos gracilis y cuneatus donde activan las neuronas del sistema lemniscal, responsahle de las sensaciones táctiles y propioceptivas. El segundo grupo bifurca y entra a nivel de varios segmentos en la substancia gris medular para terminar principalmente en las láminas III-V. Las fibras mielínicas pequeñas (Aδ) una vez que se distribuyen en el tracto de Lissauer, terminan principalmente en las láminas I, V, y algunas en la lámina II del asta posterior. Las fibras amielínicas terminan en las mismas láminas que las Aδ, pero en una proporción diferente: lámina II>I>V. 4. NEUROTRANSMISORES Y NEUROMODULADORES DEL ASTA POSTERIOR MEDULAR La activación de las fibras aferentes nociceptivas provoca la excitación de neuronas espinales situadas en las láminas superficiales y profundas del asta post e r i o r. Los neurotransmisores liberados a este nivel han sido objeto de numerosos estudios. A c t u a l m e n t e se sabe que existen más de veinte substancias que 79 55 podrían ser liberadas en el asta posterior, y que pueden clasificarse en dos grupos: los aminoácidos excitatorios y los péptidos, fuera del adenosin-trifosfato ( ATP) (Fig. 2). El ATP es muy conocido por su rol en el metabolismo energético celular, pero también podría jugar un rol de neurotransmisor en el sistema nervioso central. Esta substancia está presente en el asta posterior medular, y es capaz de provocar una excitacion neuronal. Sin embargo, su mecanismo de acción no se conoce: el ATP no estimula los receptores a adenosina, pero se une a los receptores de las purinas. Además, las fibras C también pueden liberar ATP a nivel periférico. Dentro del grupo de los aminoácidos excitatorios, existe un sinnúmero de argumentos anatómicos, electrofisiológicos e inmunohistoquímicos que atribuyen al glutamato un rol principal en la transmisión espinal de los mensajes nociceptivos (12-14). El asta posterior medular es rica en L-glutamato y en receptores glutamaérgicos. La estimulación de las fibras aferentes primarias desencadena una liberación de glutamato y aspartato en las láminas superficiales de la médula, y la administración de glutamato aumenta la descarga de las neuronas nociceptivas del asta posterior. Los receptores de glutamato se pueden separar en dos grandes familias: los ionotrópicos y los metabotrópicos. Los receptores ionotrópicos, es decir aquellos acoplados a un canal iónico, están subdivididos según sus ligandos en receptores al N-metil-D-aspartato (NMDA), al alfa-amino-3hidroxi-5-metil-4-isoxalona propionato (AMPA), al kainato y al 2-amino4-fosfobutirato (AP4). Actualmente todos estos receptores han sido clonados. El receptor NMDA ha atraído especialmente la atención pues en reposo está inactivo ya que su canal iónico está obstruído por iones magnesio. Luego de un estímulo nociceptivo intenso, repetitivo o sostenido, la depolarizacion de la neurona conduce a la apertura del canal iónico y a una entrada masiva de calcio al interior de la célula, lo que contribuye finalmente a una aceleración de la depolarización. A partir de estos datos, se puede comprender por qué el receptor NMD A ha sido implicado en los mecanismos centrales de hiperalgesia (13, 15-18). La ketamina es un antagonista de los receptores de tipo NMDA, 1o que explica sus propiedades analgésicas. Los antagonistas de los receptores NMDA podrían enriquecer en el futuro la familia de los analgésicos, sin embargo, su carácter ubicuo, es decir el hecho que están distribuidos en muchas regiones del sistema nervioso central podría multiplicar sus efectos secundarios. Los receptores “metabotrópicos”, ligados a una proteína G, están acoplados a la fosfolipasa C o a la ade- 56 L. V I L L A N U E VA R e v. Soc. Esp. del Dolor, Vol. 5, N.º 1, Enero-Febrero 1998 Fig. 2.— Neurotransmisores y neuromoduladores del asta posterior medular. Cada elemento (fibras aferentes A y C, neurona del asta posterior e interneuronas medulares) representan un grupo de neuronas o fibras. Cada fibra o neurona puede sintetizar varios neurotransmisores o neuromoduladores —en este caso se habla de colocalización— y varios tipos de receptores. Algunos receptores (área punteada) depolarizan la célula mientras que otros (superficie rayada) inhiben la actividad celular. Pueden ser pre o post-sinápticos. Los controles descendentes de origen supramedular modulan la actividad de las neuronas del asta posterior a través de tres mecanismos: a) actuando directamente a nivel de receptores post-sinápticos; b) modulando la actividad de interneuronas medulares que a su vez influencian la actividad de las neuronas ascendentes; c) controlando la liberación de neurotransmisores a partir de las fibras aferentes periféricas C, vía los receptores pre-sinápticos. Las informaciones transmitidas a los centros superiores resultan de un balance entre el conjunto de estos sistemas inhibitorios y excitatorios. (modificada a partir de la ref. 59). nilciclasa. Estos controlan la activación de numerosos “segundos mensajeros” intracelulares, que no son específicos de la nocicepción; hay entrada de calcio al interior de la célula, producción de inositol trifosfato (IP) y diacilglicerol. Enseguida se produce toda una cascada de eventos, entre los cuales está la activación de la sintasa del óxido nítrico (NO sintasa), luego la guanilato ciclasa, que produce la síntesis de NO y de GMPc respectivamente. De esta manera, el NO podría modificar los lípidos de membrana o las proteínas y participar en la eliminación de radicales libres, ciertas modificaciones genómicas y probablemente a la activación de genes de expresión inmediata. El NO es una molécula que pasa fácilmente las membranas, tiene una vida media muy corta, y por ende un campo de acción bastante limitado. Debido a sus propiedades físico-químicas, el NO difunde del elemento postsináptico al presináptico modulando así la liberación de neuromediadores. Esto explica por qué el NO aparece como un modelo de “neuromodulador retrógrado”. Por otro lado, es posible que el NO difunda hacia otras neuronas o células gliales actuando en este caso como un neurotransmisor clásico, y además puede ser producido también como consecuencia de la activación de los receptores ionotrópicos. La síntesis de los llamados genes de expresión inmediata c-fos y c-jun es un fenómeno que no tiene relación específica con la nocicepción, y conduce a la síntesis de proteínas fos y jun, consideradas como terceros mensajeros. Estas proteínas participan a la regulación de la transcripción de numerosos genes, entre los cuales se encuentra el de la proencefalina y el de la prodinorfina. Actualmente, el rol fisiológico de estos genes es desconocido. Por otra parte, son numerosos los péptidos que están presentes en las fibras periféricas aferentes y en las láminas superficiales del asta posterior (12,1922). El péptido más estudiado ha sido la substancia P (SP), que tiene 11 aminoácidos y pertenece al grupo de las neurocininas, que a la vez son miembros de la familia de las taquicininas. La SP actúa preferentemente sobre receptores de la paraneurocinina del tipo NK1, mientras que las neurocininas A y B son más selectivas para los receptores NK2 y NK3. Los genes de estos tres receptores han sido clonados recientemente. A nivel espinal, la SP está concentrada esencialmente en el tracto de Lissauer y las láminas superficiales (I y II) del asta posterior. A partir de estos 80 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA datos, se sugirió que la SP es un neuromediador excitatorio a nivel de las terminaciones de las fibras aferentes finas; pero actualmente dicho rol no parece tan obvio pues la SP no es ni necesaria ni suficiente para provocar un dolor (23). De hecho, la SP e s t á presente en al menos dos otras áreas: en las interneuronas intrínsecas, puramente espinales, donde la SP puede estar colocalizada con las encefalinas, y en las terminaciones de neuronas descendentes bulboespinales originarias del núcleo rafe magnus, donde puede estar colocalizada con otros neuromediadores, como la serotonina. Como lo han demostrado los experimentos de rizotomía posterior, sólo la mitad de la SP que se encuentra en el asta posterior medular es de origen periférico. Las estimulaciones nociceptivas intensas provocan una liberación de SP en el espacio subaracnoídeo, mientras que las estimulaciones no-nociceptivas son ineficaces para liberarla; este aumento es provocado en parte por las fibras aferentes primarias, pero también por interneuronas espinales o las fibras descendentes activadas secundariamente por la estimulación. La aplicación iontoforética de SP r efuerza la actividad de las neuronas del asta posterior de una manera especial: la SP no modifica la actividad espontánea de las neuronas, pero potencializa las d e s c a rgas provocadas por una estimulación nociceptiva. Por esta razón se considera actualmente que la S P es más bien un neuromodulador y no un neurotransmisor de los influjos nociceptivos. En ese sentido, la SP modularía la transmisión sináptica dependiente de los receptores NMDA (24). Es por ello que los antagonistas de la SP pueden bloquear los fenómenos de wind-up, es decir el aumento progresivo de la descarga de las neuronas nociceptivas medulares provocado por una estimulación periférica de alta frecuencia (ver párrafos siguientes). El CGRP (péptido relacionado con el gen de la calcitonina) es un péptido de 37 aminoácidos, derivado del mismo gen que el de la calcitonina, sobre el que existen varios argumentos en favor de su rol excitatorio en la transmisión de los mensajes nociceptivos a nivel espinal. El CGRP se encuentra solamente en las fibras aferentes primarias; se libera por una estimulación nociceptiva, y es capaz de potenciar los efectos excitatorios de la SP (20, 22). A pesar de los numerosos trabajos publicados, el rol de la SP y el CGRP en la transmisión de los mensajes nociceptivos a nivel espinal no ha sido establecido en forma clara. Es muy probable que ciertos parámetros, tales como el tipo o la intensidad de la estimulación sean factores determinantes de la liberación de estos péptidos. 81 57 Muchos otros péptidos están colocalizados en las fibras aferentes primarias y son liberados durante una estimulación nociceptiva. Entre ellos podemos nombrar la somatostatina, colecistoquinina (CCK), neuropéptido FF, neurocinina A, péptido intestinal vasoactivo (VIP), arginina-vasopresina, ocitocina, péptido que libera la gastrina (GRP), galanina, angiotensina II, hormona adrenocorticotrófica (ACTH), dinorfina y las encefalinas que, fuera de sus efectos propios, podrían modular los efectos de otros neuromediadores a nivel del asta posterior (19-22). A este grupo de substancias podemos agregar otros neuromoduladores que actúan a nivel espinal: las aminas cuyo origen es supramedular, el ácido gama aminobutílico (GABA), la acetilcolina y la adenosina. Este substrato bioquímico aporta un peso suplementario a la idea de que el asta posterior medular es mucho más que un simple conector entre la periferia y el cerebro. 5. LAS NEURONAS NOCICEPTIVAS DEL ASTA POSTERIOR MEDULAR Las fibras aferentes primarias establecen conexiones sinápticas con tres tipos de neuronas: las neuronas que proyectan a niveles supramedulares, las neuronas propioespinales, que proyectan a otro nivel m e d u l a r, y las interneuronas medulares excitatorias e inhibitorias (25-28). Las neuronas que envían la información a los centros superiores lo hacen directamente o a través de otras interneuronas. Algunas interneuronas participan en los mecanismos de control, mientras que otras transmiten la información a las motoneuronas. Los estudios electrofisiológicos del asta posterior en diferentes especies animales, han demostrado la existencia de dos grupos neuronales que responden a los estímulos nociceptivos. El primer grupo es activado específicamente por aquellos estímulos; se trata de las “neuronas nociceptivas específicas” que están situadas especialmente en las láminas superficiales del asta posterior. El segundo grupo responde de manera preferencial, pero no exclusiva a una estimulación nociceptiva; se trata de las “neuronas nociceptivas inespecíficas”. El núcleo caudal del trigémino presenta una organización similar a la del asta posterior medular. Se ha demostrado la existencia de neuronas que responden a estimulaciones nociceptivas en el asta anterior medular (en las láminas VII y VIII). Estas neuronas tienen un área receptora bastante grande, y pueden ser activadas por estímulos somáticos y viscerales (29). 58 L. V I L L A N U E VA 5.1. Las neuronas nociceptivas específicas Estas neuronas se encuentran principalmente en la lámina I de la médula (30), una región que además contiene neuronas nociceptivas inespecíficas y otras que responden específicamente al frío. Las neuronas nociceptivas específicas tienen un área receptora muy pequeña y son activadas solamente por fibras Aδ y C cuyo origen es diverso, 1o que puede explicar el hecho que muchas de estas neuronas, al igual que las neuronas nociceptivas inespecíficas, poseen una c o n v e rgencia viscero-somática. En general esta propiedad de convergencia múltiple se considera como uno de los substratos funcionales que explicaría los dolores irradiados. A pesar de que los mecanismos que originan las sensaciones dolorosas y térmicas están bastante relacionados, existen neuronas espino-talámicas en la lámina I que conducen específicamente mensajes nociceptivos, y otras que transmiten específicamente mensajes térmicos. La existencia de estos “canales específicos” de nocicepción y termocepción en la lámina I y la integración simultánea de ambos a niveles talámicos y corticales demuestra una asociación fundamental de ambas modalidades desde un punto de vista anatómico y funcional (31). Esta integración se ha demostrado por el hecho de que las lesiones cerebrales que afectan una de estas sensaciones, afectan en general ambas sensaciones. Probablemente, la sensación de dolor y temperatura están íntimamente ligadas desde el punto de vista funcional pues ambas informan al sistema nervioso central acerca del estado fisiológico del conjunto de tejidos y órganos, de manera que desencadenan mecanismos autonómicos, motores, sensitivos y motivacionales necesarios para la supervivencia. Las proyecciones de las neuronas de la lámina I sugieren que éstas juegan probablemente un rol clave en el procesamiento de informaciones fundamentales para la homeostasis. A nivel espinal, las neuronas de la lámina I establecen conexiones con el sistema simpático toraco-lumbar proporcionando de esta manera, a través de los arcos reflejos somato-simpáticos, un primer nivel de respuesta homeostática. A nivel bulb a r, las proyecciones de la lámina I a nivel de regiones cardiorespiratorias y pre-simpáticas proporciona una base para arcos reflejos somato-simpáticos más generalizados, estableciendo así un segundo nivel de respuesta homeostática. Las proyecciones de la lámina I a nivel de la región A1 y del área parabraquial sirve de relevo de los influjos nociceptivos y térmicos hacia el hipotálamo y la amígdala. La lámina I también proyecta a nivel de la substancia gris peria- R e v. Soc. Esp. del Dolor, Vol. 5, N.º 1, Enero-Febrero 1998 cueductal, una zona mesencefálica implicada en reacciones homeostáticas, motivacionales y respuestas comportamentales coordinadas. A nivel talámico, las neuronas de la lámina I proyectan a dos regiones que envían la información a la corteza insular y cingular. Esta vía espino-talamo-cortical podría intervenir en la discriminación, la memoria, la motivación y afecto generadas por estímulos térmicos y/o dolorosos. En resumen, las características anatómicas y funcionales de las neuronas de la lámina I indican que estas neuronas distribuyen impulsos nociceptivos y térmicos a regiones espinales, bulbares y telencefálicas implicadas en reacciones autonómicas, motivacionales, sensoriales y comportamentales necesarias para el mantenimiento de la integridad del org a n i smo. Estos circuitos podrían contribuir en el ser humano a engendrar el llamado “esquema corporal’’ , dicho de otro modo las “sensaciones” del cuerpo que proporcionan el apoyo para estados emocionales y motivacionales basales. 5.2. Las neuronas nociceptivas inespecíficas A estas neuronas se les ha denominado de muchas formas: neuronas multirreceptivas, a convergencia, o neuronas de gama dinámica amplia (WDR neurons). Se encuentran localizadas principalmente en la lámina V, pero también hay algunas en las láminas superficiales del asta dorsal, y se distribuyen de manera somatotópica. Estas neuronas participarían en el procesamiento del aspecto sensorio-discriminativo del dolor pues aumentan su frecuencia de descarga en relación directa con la intensidad del estímulo, lo que se ha corroborado por experimentos efectuados en monos no-anestesiados, en los que se ha observado que las neuronas nociceptivas inespecíficas son capaces de discriminar de manera bastante precisa diferentes intensidades de estimulación. Se ha demostrado también que las neuronas nociceptivas inespecíficas constituyen uno de los relevos importantes de las diferentes vías supramedulares (25, 26, 28). Sus áreas receptoras cutáneas, es decir la región que desencadena una actividad neuronal, presenta un gradiente de sensibilidad. En la porción central la neurona es activada por todo tipo de estimulación, nociceptiva o no-nociceptiva, mientras que en zonas periféricas solamente las estimulaciones nociceptivas provocan una actividad neuronal (Figs. 3 y 4). El tamaño de las áreas receptoras cutáneas puede modificarse, en parte debido al hecho que la convergencia anatómica de los influjos sobre una misma neurona es mucho más grande que aquella 82 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA 59 Fig. 3.— O rganización esquemática de las influencias periféricas que afectan las neuronas nociceptivas inespecíficas. El área receptora incluye una región cutánea, subdividida en una zona excitatoria (ZE) en la cual el centro (zona negra) es activado por estímulos nociceptivos y no-nociceptivos; y la periferia (zona rayada) es activada solamente por estimulaciones intensas. Además existe una zona inhibitoria (ZI, zona punteada) que es activada solamente por estímulos no-nociceptivos, sobre todo si son aplicados en forma rápida y repetitiva. El área receptora incluye frecuentemente una región visceral y muscular que son activadas solamente por estímulos nociceptivos, lo que ilustra la gran c o n v e rgencia de impulsos sobre una misma neurona. Las influencias periféricas son excitatorias (+) e inhibitorias (-); estas últimas hacen intervenir interneuronas inhibitorias. En algunos casos se puede aliviar el dolor reforzando los controles inhibitorios segmentarios por estimulación eléctrica —alta frecuencia y baja intensidad— de nervios (A) o de los cordones posteriores (B). La estimulación cordonal provoca una sensación táctil (activación ortodrómica hacia los núcleos cuneatus y gracilis, enseguida hacia el sistema lemniscal) y de manera concomitante por activación antidrómica los procesos de inhibición segmentaria en los segmentos medulares subyacentes al sitio de estimulación. Sin emhargo existen otras hipótesis que explican los efectos benéficos de la estimulacion medular (ver texto). que se detecta desde el punto de vista funcional, en condiciones basales. Como se ha visto, las fibras periféricas entran a la médula emitiendo colaterales ascendentes y descendentes a varios metámeros, de manera que existe un cierto recubrimiento de las aferencias a nivel de varios segmentos. Desde un punto de vista funcional, esto significa que en los márgenes del área excitatoria de una neurona, existe una zona en la cual la estimulacion provoca una activación celular infraliminar, es decir una depolarizacion que no se traducirá en una emisión de potenciales de acción. Teniendo en cuenta la importancia de esta noción de franja subliminaria, que constituye un mecanismo determinante de la función de transferencia del sistema global de transmisión por ajuste del umbral de excitación, se ha desarrollado el concepto de sinapsis relativamente ineficaces o en reposo (32, 33). De hecho, es posible restituir la eficacia de estas sinapsis, depolarizando la neurona por inyección iontoforética de un aminoáci83 do excitatorio. En este caso se produce un aumento considerable del tamaño de su área excitatoria (34), lo que se puede lograr suprimiendo química o anatómicamente los mecanismos inhibitorios asegurados por GABA o glicina (35, 36). Esto demuestra la plasticidad potencial de dichos sistemas, que se puede revelar durante ciertos procesos patológicos, ya sean de origen periférico o central. Cuando un estímulo nociceptivo breve, generalmente eléctrico, se repite a una frecuencia rápida (>0,3 Hz), la respuesta aumenta progresivamente de un estímulo al otro, al menos durante las primeras estimulaciones (37). Este fenómeno se ha denominado “wind-up”, e ilustra la existencia de mecanismos de sumación temporal que modulan desde el nivel medular la transmisión de los mensajes nociceptivos. El origen de estos mecanismos se explicaría por el hecho de que los potenciales post-sinápticos generados por la activacion de las fibras C son lentos y que por lo tanto, la llegada de una nueva descarga aferen- 60 L. V I L L A N U E VA R e v. Soc. Esp. del Dolor, Vol. 5, N.º 1, Enero-Febrero 1998 Fig. 4.— O rganización espacial teórica del área receptora cutánea de una neurona nociceptiva inespecífica. A- Un estímulo nociceptivo aplicado en cualquier parte de la zona excitatoria (ZE) activa la neurona, pero el centro (en negro) además es sensible a los estímulos no-nociceptivos. B- En realidad las zonas excitatorias se superponen de manera que un estímulo nociceptivo no solamente activa el centro de un cierto número de superficies receptoras (representado por la superficie 1) sino además los márgenes de muchos otros (representados por las superficies 2, 3 y 4). Cuando un estímulo nociceptivo se aplica en una superficie (en este caso el centro de la zona 1) éste va a activar varias neuronas nociceptivas inespecíficas (4 en este caso) mientras que un estímulo no-nociceptivo activará una cantidad mucho más pequeña (en este caso 1). C- Además de su zona excitatoria (ZE), la neurona posee una zona inhibitoria (ZI) de gran tamaño —sobre todo en su porción proximal— que es activado por estímulos mecánicos no-nociceptivos. D- La aplicación de estimulaciones no-nociceptivas sobre una gran superficie corporal (por ejemplo 1, 2, 3, 4) no sólo va a activar el centro de las zonas excitatorias, pudiendo de esta manera enviar un “falso mensaje nociceptivo”, sino que al mismo tiempo activa numerosas zonas inhibitorias (en este caso pertenecen a las neuronas 2, 3, 4) cuya función será la de atenuar la respuesta global. Por esta razón los métodos físicos de alivio del dolor por estimulación segmentaria de la zona peridolorosa, incluyen una gran superficie corporal —frotamientos, o estimulación eléctrica de troncos nerviosos— de manera que la balanza entre los procesos excitatorios e inhibitorios se incline en favor de estos últimos. te produce su efecto antes que la neurona haya vuelto completamente a su potencial de reposo. De esta manera, la sucesión de descargas aferentes se traduce en una depolarización cada vez más importante, al menos durante las primeras estimulaciones. El wind-up es un fenómeno que nace al cabo de algunos segundos, y que dura alrededor de un minuto. Por analogía con la potencialización a largo plazo observada en el hipocampo, que tiene una duración mucho más larg a , y dada la participacion de los receptores NMDA e n el wind-up, se ha sugerido que este mecanismo tendría un rol clave en el dolor crónico. Según ciertos autores, las sensaciones dolorosas desencadenadas por lesiones tisulares que provocan 84 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA hiperalgesia o alodinia estarían relacionadas con un estado de hiperexcitabilidad de neuronas nociceptivas del asta posterior medular (38, 39), que sería provocado por la activación de los receptores NMDA a partir de estimulaciones nociceptivas persistentes. Sin embargo, esta hipótesis debe ser considerada con mucha prudencia, pues en realidad los experimentos que sugieren la existencia del fenómeno de hiperexcitabilidad medular han sido realizados en animales espinalizados y decerebrados, por lo tanto, su interpretación ignora completamente la existencia de controles descendentes de origen supramedular que actúan a nivel de las neuronas nociceptivas medulares y que podrían incluso contrarrestar dichos efectos (ver párrafos siguientes). En todo caso, estos datos demuestran que las neuronas nociceptivas inespecíficas pueden captar un sinnúmero de informaciones provenientes tanto del medio externo a través de la piel, como de los órg anos internos, pudiendo generar una actividad somestésica basal. Así entonces, al igual que las neuronas nociceptivas específicas es posible que estas neurodas no están solamente implicadas en los procesos dolorosos, sino en forma más general en la homeostasis. Esta actividad somestésica basal significaría en realidad que ninguna perturbación particular ha sido aportada por el medio exterior o interior. De esta manera podemos imaginar que las neuronas nociceptivas inespecíficas también contribuirían a la elaboración del “esquema corporal’’ en el sentido de una captura continua y global de informaciones relacionadas con la integridad corporal. 6. LOS CONTROLES SEGMENTARIOS La activacion de las aferencias cutáneas de gran diámetro, que son responsables de las sensaciones táctiles, puede provocar efectos inhibitorios sobre las respuestas nociceptivas de las neurona espinales. En general se piensa que estas inhibiciones son provocadas solamente por las fibras Aβ, sin embargo son las fibras Aδ las que provocan las inhibiciones más potentes (40). Estos efectos, que son esencialmente de origen metamérico, derivan directamente de las propiedades de las áreas receptoras de las neuronas del asta posterior, en los cuales una zona es excitatoria y otra inhibitoria (Figs. 3 y 4). Cuando estímulos naturales no-nociceptivos son aplicados en forma repetida en el área inhibitoria, se produce una inhibición de las respuestas desencadenadas a partir de una estimulación de la parte excitatoria del área receptora cutánea. 85 61 En esta situación es necesario tener en cuenta la superposición de las áreas excitatorias e inhibitorias, lo que permite comprender el rol de la org a n i zación espacial de la convergencia, en la elaboración de los mensajes que nacen a partir de las neuronas nociceptivas espinales (Figs. 4A y 4B). De hecho, la organización de estas áreas receptivas permite explicar por qué la aplicación de estimulaciones no-nociceptivas sobre una gran superficie corporal, no activa una gran cantidad de neuronas nociceptivas inespecíficas, y no produce de esta manera una suerte de “falso mensaje nociceptivo”, al menos en condiciones fisiológicas (Figs. 4C y 4D). Esta posibilidad está anulada por la activación concomitante de numerosas áreas inhibitorias. Así, la aplicación de estimulaciones no-nociceptivas sobre una gran superficie corporal no va a activar solamente el centro de las áreas excitatorias, sino además muchas áreas inhibitorias cuya función será la de atenuar la respuesta global (Fig. 4D). De esta forma la organización espacial de la convergencia de influencias excitatorias e inhibitorias juega probablemente un rol esencial en la elaboración fisiológica de los mensajes enviados por este tipo de neuronas. Por lo tanto, es posible imaginar que ciertos procesos patológicos serán capaces de desorganizar completamente este equilibrio, especialmente cuando disminuyen los controles inhibitorios. Estos datos experimentales permiten explicar por otro lado los efectos hipoalgésicos obtenidos con métodos de estimulación física conocidos desde tiempos inmemoriales —frotamientos, estimulación eléctrica, etc.— de una superficie corporal que incluye o que se encuentra adyacente a un foco doloroso. Todos sabemos desencadenar dichos mecanismos cuando, por ejemplo, uno se frota la piel enérgicamente para aliviar el dolor producido por una picadura, un traumatismo, etc. En realidad, la interacción de actividades aferentes entre fibras de diámetro fino y grueso se conoce desde hace mucho tiempo (41), pero fueron Melzack y Wall (42) los que propusieron el modelo más preciso en la teoría de la compuerta medular (“Gate control theory”) (Fig. 5). De acuerdo a esta teoría la transmision de mensajes nociceptivos esta regulada por un efecto de balanza entre las influencias excitatorias e inhibitorias, y el dolor se produce cuando hay ruptura del equilibrio en favor de los mensajes excitatorios (ya sea por “exceso de nocicepción”, o por déficit de controles inhibitorios). Así entonces estos autores propusieron que las interneuronas situadas en la llamada substancia gelatinosa, que corresponde a las láminas II y III del asta posterior medular, inhiben la transmisión de los impulsos nociceptivos hacia las neuronas nociceptivas inespecíficas situadas en las lá- 62 L. V I L L A N U E VA R e v. Soc. Esp. del Dolor, Vol. 5, N.º 1, Enero-Febrero 1998 Fig. 5.— La teoría de la compuerta medular (“gate control theory”) A- Resumen de esta teoría de acuerdo a la propuesta inicial de Melzack y Wall (42). Las interneuronas de la substancia gelatinosa (SG) regulan el acceso de las informaciones originadas en la periferia (“input”) hacia las neuronas nociceptivas inespecíficas situadas en las capas más profundas del asta posterior de la médula (T = “Trigger cells”) por un mecanismo de inhihición presináptica. La activación de las aferencias de gran diámetro Aα β aumenta la actividad de dichas interneuronas, cerrando de esta manera la compuerta; la activación de las fibras finas Aδ y C deprime este tono inhihidor, desencadenando así la apertura de la compuerta, y facilitando entonces por desinhibición la activación de las neuronas nociceptivas inespecíficas y enseguida las estructuras supramedulares de integración para generar de esta manera el dolor. Estos mecanismos están bajo control cerebral. B- Resumen de la teoría de la compuerta medular, modificada por Wall (43). El concepto general no ha cambiado. Las interneuronas de la substancia gelatinosa son remplazadas por una pareja de neuronas inhibitorias (círculo blanco) y excitatorias (círculo negro), que están bajo la influencia de controles de origen central. minas más profundas (“trigger cells”) a través de una inhibición pre-sináptica, es decir un bloqueo a nivel de las aferencias que contactan las neuronas nociceptivas inespecíficas. Las células de la substancia gelatinosa constituirían una verdadera compuerta que regularía el acceso al sistema nervioso central del flujo global de informaciones. La activación de las aferencias de gran diámetro aumentaría la actividad de dichas interneuronas, cerrando de esta forma la compuerta, mientras que la activación de las fibras finas deprimiría este tonus inhibidor desencadenando así la apertura de la compuerta. Así, las fibras Aδ y C facilitarían a través de una desinhibición la llegada de influjos sobre las neuronas nociceptivas inespecíficas y por consiguiente la llegada a las estructuras supramedulares de los mensajes generados a nivel periférico. La descripción completa de la teoría incluye la posibilidad de que estos mecanismos estén bajo la influencia de controles de origen supramedular, activados por las fibras de grueso calibre. Muchos aspectos de esta teoría no han sido confirmados desde el punto de vista experimental, lo que condujo a Wall (43) a modificar el esquema inicial (Fig. 5B). A pesar del sinnúmero de controversias existentes sobre esta teoría, es bueno recordar que la teoría de la compuerta medular ha suscitado numerosos ensayos terapéuticos de neuroestimulación con fines antálgicos puesto que ella aportaba una base científica que permitiría activar selectivamente y de manera no invasiva ciertas vías inhibitorias. Esta teoría proporcionó una base hipotética que permite explicar los efectos hipoalgésicos provocados en el ser humano por estimulaciones eléctricas de alta frecuencia y baja intensidad de nervios periféricos ( “ Transcutaneous Electrical Nerve Stimulation”. TENS). Sin embargo muchas observaciones clínicas no pueden explicarse solamente a través de esta hipótesis. Por ejemplo los efectos analgésicos del TENS se producen al cabo de algunos minutos, pero pueden durar más allá del período de estimulación. Al contrario las inhibiciones evocadas a nivel de las neuronas nociceptivas espinales son inmediatos y no persisten después de la estimulación. Por otro lado, el TENS es capaz de inhibir las respuestas nociceptivas de las neuronas espino-talámicas en el mono solamente cuando la intensidad sobrepasa el umbral de activación de las fibras Aδ (40). En el hombre también pueden provocarse efectos analgésicos extra-segmentarios con el TENS, pero son menos intensos que aquellos evocados a nivel segmentario. Estos últimos son más potentes cuando la estimulación se aplica sobre el territorio doloroso, sin embargo se pueden obtener efectos analgésicos extra-metaméricos más intensos, cuando se aplica lo que se llama 86 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA “TENS no-convencional” (“TENS acupuncture-like”) que se caracteriza por una estimulación de baja frecuencia y de fuerte intensidad que provoca contracciones musculares y pone en juego además ciertos mecanismos supramedulares (ver párrafos siguientes). Estos datos sugieren qué mecanismos de control de origen diverso están implicados en los efectos hipoalgésicos del TENS. Es necesario recordar que la indicación más frecuente del TENS convencional son ciertos cuadros de dolor neuropático. Los fenómenos de inhibición segmentaria son producidos por interneuronas de axón corto, cuyos mecanismos bioquímicos aún no han sido bien dilucidados. Es posible que estos controles actúen liberando aminoácidos inhibitorios como la glicina o el ácido gama-aminobutílico (GABA) ya que la administración intratecal de estricnina o bicuculina en dosis sub-convulsivas provoca fenómenos de alodinia. Por otro lado, los opioides endógenos no estarían implicados, pues los efectos hipoalgésicos del TENS no son modificados por la naloxona (44). 7. LOS CONTROLES DESENCADENADOS POR ESTIMULACIÓN DE LOS CORDONES POSTERIORES En general se piensa que las fibras gruesas también juegan un rol esencial en los efectos hipoalgésicos producidos por la estimulacion eléctrica de los cordones posteriores en el hombre (45, 46). De hecho, las fibras cutáneas que entran en los cordones posteriores emiten colaterales que terminan en las láminas III a V del asta posterior medular. Cuando se estimulan los cordones posteriores, una invasión a contra-corriente (“antidrómica”) activaría dichas fibras y enseguida de manera ortodrómica sus colaterales subyacentes, provocando de esta manera una inhibición de las neuronas nociceptivas del asta post e r i o r. Esta inhibición sería análoga a la desencadenada por la estimulación periférica transcutánea de las fibras aferentes primarias, pero perdiendo en este caso su carácter somatotópico (Fig. 3). Como en clínica nunca se conoce exactamente el sitio de estimulación, en lugar de estimulación cordonal ciertos autores prefieren llamarle estimulación medular. Existen ciertas analogías entre la estimulación medular y el TENS convencional, por ejemplo se ha demostrado en el animal que la estimulación cordonal posterior inhibe las neuronas nociceptivas espinales por períodos de tiempo similares a los del TENS. Por otro lado estudios psicofísicos han demostrado analogías entre el TENS y la estimulación medular. En am87 63 bos casos el dolor experimental es atenuado en cuanto a su discriminacion y evaluación, sin que otras modalidades sensoriales sean alteradas, lo que sugiere una modificación selectiva del aspecto sensorio-discriminativo del dolor (45). Sin embargo la reducción del dolor experimental no es muy importante (<20%). Por otro lado, algunos autores han sugerido recientemente que la estimulación medular podría actuar a nivel de mecanismos de control de la actividad del sistema simpático. En este sentido la literatura relacionada con los efectos de la estimulación medular sobre diferentes dolores crónicos, ha demostrado su eficacia sobre los dolores de origen neurogénico, especialmente cuando están asociados a problemas vasculares periféricos. De hecho, fuera de sus efectos hipoalgésicos, la estimulación medular aumenta la circulación periférica arterial lo que ha incitado a utilizarla para el tratamiento de ciertas patologías vasculares periféricas dolorosas como las arteritis de miembros inferiores refractarias a otro tipo de terapia. Desde el punto de vista experimental, Linderoth y Meyerson (46) demostraron que la estimulación cordonal, utilizando parámetros de estimulación similares a aquellos utilizados en el hombre, provoca en el animal un aumento del flujo sanguíneo en las extremidades. Este efecto persiste luego de una sección de las raíces posteriores o bien, luego de una sección de la médula a un nivel superior en relación al sitio de estimulación; al contrario este efecto es abolido luego de un bloqueo de la cadena simpática. En conclusión, la estimulación medular sería capaz de inhibir los mecanismos simpáticos de vasoconstricción a través de vías intramedulares directas, sin la participación de las fibras aferentes primarias. 8. LOS CONTROLES DE ORIGEN SUPRAMEDULAR Los controles más conocidos actualmente son aquellos situados en el bulbo raquídeo, y a pesar de que existen probablemente otros controles, ya sea de origen talámico, hipotalámico o cortical, éstos no han sido estudiados en detalle. La primera evidencia experimental de control supramedular fue descrita por Reynolds (47). Este autor demostró que la estimulación eléctrica de la substancia gris periacueductal (SGPA) permitía efectuar una laparotomía en la rata no anestesiada sin que ésta manifestara signos evidentes de dolor. Enseguida, a partir de numerosos experimentos de estimulación central en el animal, se sugirió la existencia de un “sistema de analgesia endógeno” que sería activado 64 L. V I L L A N U E VA en forma artificial por la estimulación eléctrica supramedular (Fig. 6A) (48,49). Sin embargo, este tipo de analgesia carece de especificidad anatoómica debido a que muchos estudios han demostrado que puede desencadenarse estimulando un sinnúmero de regiones cerebrales que van desde el bulbo hasta el diencéfalo. En realidad es difícil demostrar la existencia de estructuras que tendrían funciones puramente “analgésicas”. En primer lugar se debería utilizar más bien el término antinocicepción pues en todos los experimentos se miden las modificaciones de latencia o de umbral de un reflejo muscular. De esta manera, efectos que son interpretados como “analgésicos” podrían ser la consecuencia de variaciones de funciones diversas R e v. Soc. Esp. del Dolor, Vol. 5, N.º 1, Enero-Febrero 1998 (motoras, autonómicas, etc.) relacionadas o no con los sistemas nociceptivos. En este sentido la SGPA es un buen ejemplo, pues se ha demostrado en los últimos años que la estimulación de esta región provoca además de efectos antinociceptivos, motores, autonómicos y comportamentales que están organizados topográficamente (50). La multiplicidad de reacciones producidas por la estimulación de la SGPA pone en duda la existencia de zonas “analgésicas” puras en esta región, más bien sugiere que la SGPA juega un rol fundamental en el desencadenamiento de reacciones de defensa integradas frente a modificaciones de la homeostasis, incluyendo entre otras causas las estimulaciones nociceptivas. Fig. 6.— Hipótesis sobre el rol modulador de las neuronas de la región bulbar rostro ventral. A- Primera hipótesis de Basbaum y Fields (49): la aplicación de un estímulo nociceptivo (a) activa las neuronas de transmisión medular (T) que envían la información a los centros superiores (b). Una de las consecuencias de esta activación es el desencadenamiento, vía la substancia gris periacueductal (SGPA), de controles inhibitorios descendentes e originarios de la región bulbar rostro-ventral (RBRV). El sistema funcionaría entonces como un circuito de retroalimentación negativa. En este modelo el efecto antinociceptivo de la morfina a nivel de la SGPA resultaría de una inhibición de las neuronas gabaérgicas locales que estarían inhibiendo de manera tónica, las neuronas que envían proyecciones a la RBRV. Estas últimas serían entonces excitadas por desinhibición, provocando enseguida una depresión de la transmisión nociceptiva espinal, por un aumento de los controles inhibitorios descendentes. B- Segunda hipótesis de Fields (51): la existencia de dos tipos neuronales en la RBRV hizo evolucionar el modelo en el sentido de un circuito de retroalimentación positiva: las células “on”, que son excitatorias de las neuronas de transmisión, son activadas por la estimulación nociceptiva; las células “off”, que son inhibitorias de las neuronas de transmisión, son inhibidas por la estimulación nociceptiva; así el sistema de transmisión es facilitado a través de un mecanismo doble de activación (C1) y de desinhibición (C2). La morfina, que suprime el período de pausa de las células “off”, desencadenado por la estimulación nociceptiva, aumentaría así la actividad global de estas células, provocando una depresión de la transmisión nociceptiva espinal por un aumento de controles inhibitorios descendentes. En cuanto a las células “on”, cuya actividad se acelera cuando hay una estimulación nociceptiva, son inhibidas por la morfina lo que suprimiría el tonus facilitador que se ejerce sobre la transmisión espinal. 88 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA Sin embargo algunos autores han postulado que la estimulación de zonas bien precisas como la porción ventro-lateral de la SGPA y especialmente la región bulbar rostro-ventral (RBRV), incluyendo el núcleo Rafe Magnus, serían capaces de inducir una analgesia profunda sin afectar aparentemente otras funciones sensoriales. Esta analgesia podría resultar de la activación de vías inhibitorias descendentes localizadas en el funículo dorsolateral, que bloquean la transmisión espinal de los mensajes nociceptivos, liberando serotonina y opioides endógenos en las láminas superficiales del asta posterior. En realidad la situación es mucho más compleja debido a que se ha demostrado la existencia de dos categorías de neuronas en la RBRV que están conectadas con la médula, las células “off” y “on” (51). Las células “off” presentan una actividad espontánea importante e irregular que es inhibida por cualquier estimulación nociceptiva. Esta inhibición está estrechamente correlacionada con la aparición de una respuesta motora, es decir, un reflejo de evitamiento. Se ha sugerido que la aparición de esta respuesta nociceptiva refleja estaría bajo control directo de las células “off” que, mientras están activas, impiden la ejecución espinal de la operación refleja, la que ocurrirá cuando las células estén inhibidas. Al contrario las células “on”, normalmente silenciosas, son activadas por la estimulación nociceptiva y ejercerían un control facilitador sobre 1a transmisión espinal. De esta manera estos dos tipos celulares estarían implicados en un circuito de retroalimentación positivo (Fig. 6B). Estos experimentos efectuados en el animal, interesaron a algunos neurocirujanos que trataron de obtener en el ser humano efectos analgésicos por estimulación eléctrica intracerebral, para aliviar ciertos dolores refractarios a todo tipo de tratamiento farmacológico o quirúrgico (11). Como la región bulbar contiene importantes centros de control neurovegetativo y por lo tanto no es una región “inocua”, se ha estimulado a un nivel más anterior, especialmente en la substancia gris periventricular a nivel del límite mesencéfalo-diencefálico. Se han publicado algunos resultados positivos, especialmente en pacientes con dolores neoplásicos por exceso de nocicepción. Es interesante recordar que con anterioridad a estos trabajos de estimulación intracerebral, se había ensayado la estimulación de la región ventrobasal del tálamo y de la cápsula interna, especialmente para tratar dolores de desaferentación (52). La eficacia de estos tratamientos ha sido cuestionada, pues la tasa de éxito de dichos procedimientos es muy variable, y de hecho es prácticamente imposible interpretar los resultados especialmente debido a la 89 65 ausencia de ensayos controlados lo que ha provocado una falta de consenso en cuanto a su real eficacia. 9. LOS CONTROLES INHIBITORIOS DIFUSOS En los párrafos precedentes hemos visto que las experiencias de estimulación intracerebral en el animal, demuestran la presencia de sistemas moduladores descendentes, sin embargo estos datos no permiten considerar las circunstancias naturales durante las cuales dichos controles podrían ser activados. Si por un lado los mecanismos de control segmentario pueden ser desencadenados por estimulaciones del metámero correspondiente, ciertos controles inhibitorios de origen supramedular pueden ser activados por estimulaciones nociceptivas de diversas regiones del cuerpo. Por ejemplo, se ha demostrado que las neuronas nociceptivas inespecíficas del asta posterior son intensamente inhibidas, cuando se aplica una estimulación nociceptiva en cualquier región corporal fuera de su campo receptor excitatorio. Este fenómeno se ha denominado controles inhibitorios difusos inducidos por una estimulación nociceptiva (CIDN) (53). Los CIDN ponen en juego un circuito que implica estructuras supramedulares pues, al contrario de las inhibiciones segmentarias, éstos desaparecen en el animal al que se le ha seccionado la médula espinal a nivel cervical. Se sabe que las estructuras supramedulares responsables de dichos controles excluyen al sistema rafe-espinal, y se encuentran en la región más posterior del bulbo raquídeo, incluyendo al Subnucleus Reticularis Dorsalis (SRD) (54). En el ser humano, la estimulación de la región del nervio sural, evoca simultáneamente un reflejo nociceptivo en un músculo flexor del muslo y una sensación dolorosa en el territorio inervado por el sural. Las estimulaciones heterotópicas condicionantes de cualquier tipo (mecánica, térmica, etc.), a condición que sean dolorosas, son capaces de aumentar a la vez el umbral del reflejo y del dolor asociado, lo que demuestra la existencia de los CIDN en el ser humano. Así, un estímulo doloroso condicionante es capaz de reducir un dolor preexistente a nivel de los primeros relevos medulares de la transmisión nociceptiva. El estudio de los CIDN, en pacientes que presentan lesiones del sistema nervioso central, permitió demostrar que, como en el animal, estos controles involucran un circuito de retroalimentación espino-bulbo-espinal, incluyendo estructuras reticulares. Además, los CIDN ponen en juego los sistemas opioides endógenos. De acuerdo a lo expuesto en los párrafos precedentes, un estímulo nociceptivo, a pesar de que va a ser ob- 66 L. V I L L A N U E VA viamente percibido como doloroso, activa ciertos controles inhibitorios descendentes originados en el bulbo raquídeo, que podrían jugar un rol fisiológico en la detección de los mensajes nociceptivos a nivel cerebral. En principio esta interpretación puede parcer paradojal, pero en realidad es operante cuando se tiene en cuenta una propiedad de las neuronas nociceptivas inespecíficas. Estas células responden a la aplicación de estímulos no-nociceptivos (presión, frotamiento del campo excitatorio, etc.) de manera que son activadas en torma aleatoria por la totalidad de estímulos somáticos no-nociceptivos provenientes del medio ambiente (Fig. 7). Esta actividad es transmitida a los centros superiores como un “ruido de fondo” a partir del cual sería difícil extraer un mensaje significativamente nociceptivo. El significado funcional de esta actividad somestésica basal es desconocido pero se puede suponer que dicha actividad, juega un rol importante en la elabo- R e v. Soc. Esp. del Dolor, Vol. 5, N.º 1, Enero-Febrero 1998 ración del llamado esquema corporal. Los CIDN constituirían entonces una especie de filtro gracias al cual podría ser extraída una señal específicamente nociceptiva. De hecho, cuando aparece un foco doloroso, las neuronas nociceptivas espinales son activadas y envían un mensaje excitatorio a los centros cerebrales. Esta señal activa secundariamente los CIDN, que van a inhibir el conjunto de neuronas nociceptivas inespecíficas medulares que no han sido directamente activadas por el estímulo inicial (Fig. 7). Este mecanismo mejora la relación señal-ruido aumentando el contraste entre las actividades de un foco segmentario de neuronas activadas y el silencio del resto de la población neuronal. Como ejemplo ilustrativo, todo sucedería como si en una asamblea un orador puede hacerse escuchar después de haber obtenido el silencio de la sala. Al contrario el murmullo logrará no solamente silenciar al orador, sino incluso hacer pasar completamente desapercibido su mensaje. Fig. 7.— Hipótesis sobre el rol funcional de los CIDN. Interpretación hipotética de la actividad global de las neuronas nociceptivas inespecíficas medulares implicadas en la nocicepción. Debido a la cantidad de influjos que reciben, estas neuronas generarían una “actividad somestésica basal”, cuya información sería enviada al cerebro (A) y en este estado los centros cerebrales tendrían mucha dificultad para extraer un mensaje significativamente nociceptivo. Los CIDN constituirían el filtro gracias al cual una señal nociceptiva es extraída de la actividad somestésica basal: cuando un foco nociceptivo aparece, las neuronas nociceptivas espinales son activadas (B), enviando un mensaje excitatorio hacia los centros superiores (C). Esta señal activa enseguida los CIDN (D), que van a inhibir el conjunto de neuronas nociceptivas inespecíficas que no estaban directamente implicadas por el estímulo inicial (E). Este mecanismo mejora la relación señal/ruido, aumentando el contraste entre las actividades de un grupo segmentario de neuronas activadas, y el silencio de la población residual. Según este modelo, una analgesia puede resultar de la depresión de los CIDN y así la “información somestésica basal” es aumentada y el mensaje nociceptivo es menos detectable. En este sentido los CIDN son reducidos significativamente por la morfina tanto en el animal como en el hombre. Se puede deducir que el efecto analgésico de la morfina resultaría, al menos en parte, por una reducción de los CIDN (F). Administrada por vía sistémica a dosis altas, o por vía intratecal, la morfina bloquea la transmisión espinal de la información nociceptiva, reduciendo aún más el contraste (G). Por otro lado, la estimulación eléctrica de ciertas zonas bulbares, por ejemplo la RBRV, bloquea las actividades de todas las neuronas espinales desencadenando de esta manera una intensa analgesia (H). 90 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA Por otro lado los CIDN permiten explicar la interacción negativa que se produce entre mensajes nociceptivos cuyo origen topográfico es diferente, un fenómeno conocido desde tiempos inmemoriales, en el cual un dolor es capaz de disminuir otro dolor originado de un foco que se encuentra en una región alejada del primero. En este sentido es interesante recordar el aforismo hipocrático que dice “cuando dos sufrimientos ocurren al mismo tiempo, pero en dos puntos diferentes, el más fuerte hará callar el más débil”, pues es la base de ciertos procedimientos analgésicos utilizados en el animal y en el ser humano. Por ejemplo, la aplicación de una presión intensa de la región nasal en los caballos y en los bovinos permite realizar intervenciones bastante dolorosas como las caudectomías o las castraciones sin fármacos. Ciertas técnicas de medicina popular para aliviar el dolor están basadas en el mismo principio, como es el caso de la acupuntura, en la cual los CIDN representan uno de sus substratos neurofisiológicos (55, 56). La eficacia de estas técnicas, clasificadas bajo el término de métodos de “contra-irritación” o de “contra-estimulación” han sido confirmadas en condiciones de objetividad científica. Los CIDN pueden también afectar las respuestas neuronales cuando existe un solo foco nociceptivo, que es en realidad la situación clínica más frecuente. En este sentido, la estimulación nociceptiva de áreas cada vez más grandes, producen efectos opuestos en las neuronas nociceptivas inespecíficas: en el caso de superficies pequeñas, estas neuronas aumentan progresivamente su descarga en relación directa al tamaño del área, pero más allá de una cierta área, estas descargas disminuyen progresivamente, mostrando así que los CIDN pueden actuar como un sistema de retrocontrol negativo (57). Esta observacion permite explicar los resultados citados al comienzo del capítulo que muestran que en el hombre, la aplicación de una estimulación nociceptiva de una área cada vez más grande provoca un aumento progresivo de la sensación dolorosa solamente en una gama restringida de superficies (2, 3). Por otro lado, este sistema de retrocontrol negativo podría explicar también las observaciones clínicas que demuestran frecuentemente, la falta de correlación entre la magnitud de la sensación dolorosa y la extensión de las lesiones (58). 10. CONCLUSIÓN GENERAL Un elemento común a los diferentes estratos del sistema nervioso que están encargados de transmitir los mensajes nociceptivos, ya sea a nivel periférico, 91 67 espinal e incluso en las diversas áreas cerebrales es la capacidad de captar un sinnúmero de informaciones de diversos orígenes. A pesar de esta converg e ncia múltiple, podemos constatar que nuestro cerebro es capaz de “traducir” una información suficientemente significativa para, al menos en condiciones normales, poder “crear” la sensación dolorosa. Esta capacidad de descifrar es posible, en parte gracias a los sistemas de modulación, algunos de los cuales han sido descritos en este capítulo. De hecho, los procesos lógicos de tratamiento de la información —sumación espacial, sumación temporal, retrocontroles, procesamiento paralelo, etc.— son comunes a todos los sistemas sensoriales dependientes de redes neuronales, permitiendo así al sistema nervioso central, al menos en condiciones fisiológicas, “afrontar” el f1ujo concomitante de mensajes de diversos orígenes. Los datos brevemente expuestos en este artículo, muestran que el origen de la sensación dolorosa, no se crea en un sistema de cables unidireccionales específicos en cuanto a su modalidad de activación, sino que más bien sería generada a través de gradientes de actividad entre diversas poblaciones neuronales. Estos gradientes provienen de sistemas periféricos, medulares y supramedulares. Probablemente la organización de una transmisión en volumen, es la que debe considerarse como el mensaje significativo destinado “in fine” a los centros cerebrales responsables de la elaboración de la sensación dolorosa. Obviamente es posible imaginar que un sistema de este tipo pueda desorganizarse durante ciertos procesos patológicos, como es el caso de aquellos que están asociados a los dolores cronicos. AGRADECIMIENTOS Quisiera agradecer a mi colega y gran amiga, la Dra. Teresa Pelissier, por sus amables consejos, que me ayudaron a mejorar este texto. Este trabajo ha sido financiado por l’Institut National de la Santé et de la Recherche Médicale (INSERM). C o rre s p o n d e n c i a . Luis Vi l l a n u e v a . Directeur de Recherches, INSERM U-161, 2, rue d’Alésia, 75014 París (Francia) Tel.: 33/1 40 78 93 50 Fax: 33/1 45 88 13 04 e-mail: [email protected] 68 L. V I L L A N U E VA R e v. Soc. Esp. del Dolor, Vol. 5, N.º 1, Enero-Febrero 1998 BIBLIOGRAFÍA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11 . 12. 13. 14. 15. 16. 17. 18. 19. 20. Sherrington CS. The integrative action ot the nervous system. Scribner’s, New York, 1906. Melzack R, Rose G, McGinty D. Skin sensitivity to thermal stimuli. Exp Neurol 1962; 6: 300-314. Hardy JD, Wo l ff HG, Goodell H. Pain sensations and reactions. 2nd ed. Haff n e r, New York, 1917. Lewis T. Pain, Macmillan, New York, 1942. Mumford JM, Bowsher D. Pain and protopathic sens i b i l i t y. A review with particular reference to the teeth. Pain 1976; 2: 22-24. Sharav Y. Orofacial pain. In: P. D. Wall and R. Melzack (eds.), “Textbook of Pain”, Churchill Livingstone, Edinburgh, 1994; 563-582. Cervero F. Neurophysiology of gastrointestinal pain. Baillieres Clin Gastroenterol 1988; 2: 183-199. Ness TJ, Gebhart GF. Visceral pain: a review of experimental studies. Pain 1990; 41: 167-234. Malliani A. Visceral pain and nociceptors. Tr e n d s Neurosc 1993; 16: 138-140. Craig AD, Reilllan EM, Evans A, Bushnell MC. Functional imaging of an illusion of pain. Nature 1996; 384: 258-260. Gybels JM, Sweet WH. Neurosurgical treatment of persistent pain. In: Ph. L. Gildenberg (ed), “Pain and H e a d a c h e ’’, Karg e r, 1989. Yaksh TL, Malmberg A. Central pharmacology of nociceptive transmission. In: P. D. Wall and R. Melzack (eds.), “Textbook of Pain”, Churchill Livingstone. E d i n b u rgh, 1994, 164-200. Coderre TJ, Katz J, Vaccarino A, Melzack R. Contribution of central neuroplaticity to pathological pain: review of clinical and experimental evidence. Pain 1993; 52: 259-285. Wilcox GL. Excitatory neurotransmitters and Pain. In: M Bond, C Woolf, JE Charlton (eds.), Pain research and clinical management: Proceedings of the Vth world congress on pain. Amsterdam, Elsevier, 1991; 97-11 7 . Haley JE, Wilcox GL. Involvement of excitatory aminoacids and peptides in the spinal mechanisms underlying hyperalgesia. In: Willis W. (ed.), Hyperalgesia and allodynia, New York, Raven Press, 1992; 281-29. Headley PM, Grillner S. Excitalory aminoacids and synaptic transmission: the evidence for a physiological function. Trends Pharmacol Sci 1990; 11: 205 2 11 . Willis WD. Central plastic responses to pain. In: Gebhart GF, Hammond DL, Jensen TS. (eds.) Proceedings of the 7th world congress on pain, Progress in pain research and management, vol. 2, IASP p r e s s , Seattle, 1994; 301-324. Woolf CJ. The dorsal horn: state-dependent sensory processing and the generation of pain. In: PD Wa l l and R Melzack (eds.), “Textbook of Pain”, Churchill Livingstone, Edinburgh, 1994; 101-11 2 . Jessel TM, Dodd J. Functional chemistry of primary a fferent neurons. In: PD Wall and R Melzack (eds.), “ Textbook of Pain”, Churchill Livingstone, Edinb u rgh, 1994; 82-99. Levine JD, Fields HL, Bashaum AI. Peptides and the 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. primary afferent nociceptor. J Neurosci 1993; 13: 2273- 2286. Cuello AC. Peptides as neuromodulators in primary sensory neurons. Neuropharmacology 1987; 26: 971979. Cesselin F, Collin E, Bourgoin S, Pohl M, Mauhorgne A, Benoliel JJ, Hamon M. Pharmacological and physiological modulations of the release of peptides from nociceptors. In: JM Besson, G Guilbaud, H Ollat (eds.). Peripheral neurons in nociception: physiopharmacological aspects, John Libbey eurotext, Paris, 1994; 255-271. Watling KJ, Krause JE. The rising sun Shines on substance P and related peptides. Trends Pharmacol Sci 1993; 14: 81-84. Urban L, Thompson SWN, Dray A. Modulation of spinal excitability: co-operation between neurokinin and excitatory aminoacid neurotransmitters. Tr e n d s Neurosci 1994; 17: 432-438. Besson JM, Chaouch A. Peripheral and spinal mechanisms of nociception, Physiol Rev 1987; 6: 67-186. Willis WD, Coggeshall RE. “Sensory mechanisms of the spinal cord”, Plenum Press, New York, 1991. Brown AG. The dorsal horn of the spinal cord. J Exp Physiol 1982; 67: 193-212. Le Bars D, Dickenson AH, Besson JM, Villanueva L. Aspects of sensory processing through converg e n t neurons, In: T L Yaksh (ed.), “Spinal afferent processing”, Plenum, New York, 1986; 467-504. Cervero F. Visceral pain, In: M Bond, C Woolf JE Charlton (eds.), Pain research and clinical management: Proceedings ot the Vth world congress on pain. Amsterdam, Elsevier, 1991; 216-226. Cervero F, Bennett GJ, Headley PM (eds.). “Processing of sensory information in the superficial dorsal horn of the spinal cord”, NATO ASI series, 1989; vol. 176. Craig AV. Pain, temperature, and the sense of the b o d y. In: O Franzen, O Johansson, L Terenius (eds), Somesthesis and the neurobiology of the somatosensory cortex, Birkhäuser, Basel, 1996; 27-39. Pubols LM. Electrical stimulation reveals relatively i n e ffective sural nerve projections to dorsal horn neurons in the cat. Brain Res l986; 371: 109-122. Woolf CJ, King AE. Subthreshold components of the cutaneous mechanoreceptive fields of dorsal horn neurons in the rat lumbar spinal cord. J Neurophysiol 1989; 62: 907-916. Z i e g l g ä n s b e rger W, Herz A. Changes of cutaneous receptive fields of spino-cervical tract neurones and other dorsal horn neurones by microelectrophoretically administered aminoacids. Exp Brain Res 1971; 13: 126. Yokota T, Nishikawa Y. Actions of picrotoxin upon trigeminal subnucleus caudalis neurons in the monk e y. Brain Res 1979; 171: 369-373. Denny-Brown D, Yanasigawa N. The function of the descending root of the fifth nerve. Brain 1973; 96: 783-814. Mendell LM. Physiological properties of unmyelinated fiber projection to the spinal cord. Exp Neurol 1966; 16: 316-332. Dubner R, Bashaum AI. Spinal dorsal horn plasticity 92 A S TA D O R S A L MEDULAR: ¿CUÁL ES SU ROL EN EL P R O C E S A M I E N TO DE LOS IMPULSOS QUE GENERAN LA SENSACIÓN DOLOROSA 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. following tissue or nerve injury. In: PD Wall, R Melzack (eds.), “Textbook of Pain”, Churchill Livingstone, Edinburgh, 1994; 225-241. Woolf CJ. Recent advances in the pathophysiology of acute pain. Br J Anaesth 1989; 63: 130-146. Lee HK, Chung JM, Willis WD. Inhibition of primate spinothalamic tract cells by TENS. J Neurosurg 1985; 2: 276-287. Noordenbos W. Pain, Elsevier, 1959. Melzack R., Wall PD. Pain mechanisms: a new theo r y. Science 1965; 150: 971-979. Wall PD. The gate control theory of pain mechanisms: a re-examination and re-statement. Brain 1978; 101: 1-18. Willer JC, Roby A, Boulu P, Boureau F. Comparative e ffects of electroacupuncture and transcutaneous stimulation on the human blink reflex. Pain 1982; 14: 267-278. Marchand S, Bushnell MC, Molina-Negro P, Martínez SN, Duncan GH. The effects of dorsal column stimulation on measures of clinical and experimental pain in man. Pain 1991; 45: 249-257. Linderoth BL, Meyerson BA. Dorsal column stimulation: modulation of somatosensory and autonomic function. Sem in the Neurosci 1995; 7: 263-277. Reynolds DV. Surgery in the rat during electrical analgesia induced by focal brain stimulation. Science 1969; 164: 444-445. Liebeskind JC, Giesler GJ Jr, Urca G. Evidence pertaining to an endogenous mechanism of pain inhibition in the central nervous system. In: I Zotterman (ed.), “Sensory functions of the skin in primates”, P e rgamon Press, Oxford, 1976; 561-573. Basbaum AI, Fields HL. Endogenous pain control mechanisms: Review and hypothesis. Annals of Neu- 50. 51. 52. 53. 54. 55. 56. 57. 58. 59. 69 rology 1978; 4: 451-460. Depaulis A, Bandler R (eds.). “The midbrain periaqueductal gray matter”, NATO ASI series, l990; vol. 213. Fields HL. Is there a facilitating component to central pain modulation? APS Journal 1992; 1: 71-78. Mazars G, Merienne L, Cioloca C. Use of thalamic stimulators in the treatment of various types of pain. Ann Med Int 1975; 126: 869-871. Le Bars D, Bouhassira D, Villanueva L. Opioids and D i ffuse Noxious Inhibitory Controls in the rat. In: B Bromm and JE Desmedt (eds). “Pain and the brain: from nociceptor to cortical activity”, Advances in pain research and theraphy, vol 22. Raven Press, 1995; 517-539. Villanueva L, Bouhassira D, Le Bars D. The medullary subnucleus reticularis dorsalis (SRD) as a key link in both the transmission and modulation of pain signals. Pain 1996; 67: 231-240. Mac Donald AJR. Acupuncture analgesia and ther a p y. In: PD Wall and R Melzack (eds.), Textbook of Pain, Churchill Livingstone, Edinburgh, 1989, pp 906-919. Bing Z, Villanueva, L, Le Bars D. Acupuncture and d i ffuse noxious inhibitory controls: naloxone reversible depression of activities of trigeminal converg e n t neurones. Neuroscience 1990; 37: 809-818. Bouhassira D, Gall O, Chitour D, Le Bars D. Dorsal horn convergent neurones: negative feedback triggered by spatial summation of nociceptive aff e r e n t s . Pain 1995; 62: 195-200. Wall PD. On the relation injury to pain. Pain 1979; 6: 25-24. Dickenson A. The pharmacolgy of pain. Trends Pharmacol Sci 1993; vol. l4, poster. REFERATAS E L E F E C TO PLACEBO EN EL T R ATA M I E N TO DE L A CEFALEA AGUDA: KETOROLACO, MEPERIDIN A Y SUERO SALINO EN EL S E RVICIO DE URGENCIAS R. Norman Harden, R. H. Gracely, T. Carter, G. Wa r n e r. Headache 1996; 36: 352-356. Se confirmaron en un estudio prospectivo, doble ciego y randomizado, ketorolaco 60 mg, meperidina 50 mg más prometazina 25 mg y suero salino administrados intramuscular en el tratamiento de las crisis agudas de cefalea. 3 pacientes (6 hombres y 24 mujeres) que se presentaron a un servicio de urgencias urbano con algún tipo de cefalNea benigna fueron randomizados en tres grupos y se les aplicó el cuestionario McGill de dolor con un índice de puntuación de dolor y una escala analógica visual de dolor. Los pacientes recibieron uno de los medicamentos del estudio y se les 93 repitió el cuestionario 1 hora después. El objetivo fue probar la eficacia de ketorolaco en este tipo de pacientes. Los análisis del cuestionario de McGill (total, sensorial afectivo, índices de dolor) y de la escala analógica visual mostraron que los tres tipos de tratamiento produjeron una significativa reducción del dolor (p<0,0001), pero la reducción no definió entre los distintos tratamientos. Esta profunda reducción observada tras la adminitración de placebo impidió una evaluación exacta de los efectos del ketorolaco. La respuesta al placebo debe ser tenida en cuenta en el diseño de futuro s ensayos en los que se use medicación intramuscular en las crisis de cefalea aguda. A d e m á s , es necesario el uso de un analgésico estándar para demostrar tanto la sensibilidad como la magnitud de la respuesta al placebo. M. Mato