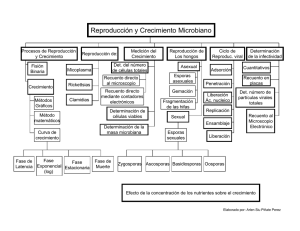
Control Microbiológico de Alimentos
Anuncio

Control Microbiológico de Alimentos Dpto. Química Orgánica GUÍA DE TRABAJOS PRÁCTICOS CONTROL MICROBIOLÓGICO DE ALIMENTOS GUÍA DE TRABAJOS PRÁCTICOS Tema Mohos y levaduras Análisis de leche fluida Análisis de leche en polvo Análisis de mantecas y margarinas Análisis de helados Análisis de carnes y productos cárnicos Análisis de conservas Recuento de filamentos de hongos en conservas- Cámara de Howard Análisis de azúcar Análisis de alimentos deshidratados Tablas de NMP Protocolo de informe Anexo Clave para Identificación de Hongos Bibliografía Reglas básicas de higiene y seguridad en laboratorios 2 Página 3 4 9 17 24 30 45 49 51 54 59 62 63 69 70 MOHOS Y LEVADURAS A- Método de siembra por dilución 1) Preparación de la muestra y las correspondientes diluciones -Pesar asépticamente 10 g del alimento en un Erlenmeyer con 90 ml de agua peptona 0,1% estéril y homogeneizar bien. -Tomar con pipeta estéril 1 ml de esta primera dilución (1/10) y pasar a un tubo con 9 ml de agua peptona 0,1% para obtener la dilución 1/100. De ser necesarias más diluciones, realizar este ultimo procedimiento en tubos conteniendo 9 ml de agua peptona 0,1% hasta llegar a la dilución deseada. 2) Recuento de mohos y levaduras a) Siembra por vertido en placa -Sembrar por duplicado 1 ml de por lo menos dos diluciones sucesivas en placas de Petri. -Agregar agar YGC (Cloramfenicol-Glucosa-Extracto de Levadura) o DCPA (DicloránCloramfenicol-Peptona-Agar) fundido a 44-46ºC y mezclar para homogeneizar el inóculo en el agar. -Dejar solidificar. -Incubar sin invertir a 25 ± 1ºC durante 5-7 días. -Si se hizo el recuento por duplicado, contar las placas que contengan entre 10 y 150 colonias. -Si hay excesivo crecimiento contar la placa de mayor dilución aún cuando contenga menos de 10 colonias. Las colonias sospechosas o dudosas deben confirmarse por observación microscópica. -Informar el resultado como “UFC de mohos y levaduras/g de muestra”. b) Siembra en superficie -Distribuir 1 ml de dilución 1/10 equitativamente en la superficie de cuatro placas de agar YGC o DCPA perfectamente secas. Distribuir con una espátula de Drigalsky cuidadosamente (tener la precaución de enfriar bien la espátula para no matar los microorganismos). -Dejar solidificar. -Incubar sin invertir a 25 ± 1ºC durante 5 días. -Contar el número de colonias en las cuatro placas. Las colonias sospechosas o dudosas deben confirmarse por observación microscópica. Informar el resultado como “UFC de mohos y levaduras/g de muestra”. B- Método de plaqueo directo -Transferir asépticamente los granos o partículas de alimentos a tres placas de Petri con agar DG18 (Diclorán-18% Glicerol), a razón de 5-10 partículas por placa. -Incubar sin invertir a 25 ± 1ºC durante 5-7 días. -Contar el número de partículas infectadas por hongos en las tres placas. -Expresar los resultados como “porcentaje de infección”. C– Observación e identificación de géneros fúngicos -Identificar los diferentes géneros fúngicos presentes en los alimentos analizados. -Realizar observaciones macro y microscópicas e identificar las clases de hongos más comunes en los alimentos mediante la utilización de las correspondientes claves. 3 ANÁLISIS MICROBIOLÓGICO DE LECHE FLUÍDA 1) Toma de muestra Cuando el muestreo de leche fluida se realiza a partir de los tanques o tarros de las granjas utilizados para el transporte a granel, los tanques de almacenamiento de las centrales lecheras o los tanques móviles de almacenamiento deben mezclarse hasta homogeneizar el contenido. Se vierte entonces una cantidad adecuada de leche en condiciones asépticas en los recipientes de muestreo, utilizando para ello un cucharón o tubo de muestreo esterilizado para cada muestra (ICMSF recomienda tomar por lo menos 30 ml de muestra). Estas muestras se enfrían inmediatamente manteniéndolas a una temperatura de 0-4ºC, y se envían al laboratorio. Cuando se trata de un producto final envasado (como la leche pasteurizada), es preferible llevar la muestra al laboratorio sin abrir. Se enfrían y se llevan al laboratorio lo más rápidamente posible para que puedan comenzar los ensayos antes de que transcurran 36 h desde la toma de muestra. Previamente al análisis, se mezcla la muestra cuidadosamente agitando o invirtiendo el recipiente con el fin de lograr una distribución uniforme de los microorganismos en la muestra. 2) Preparación de la muestra -Colocar 1 ml de leche en un tubo de dilución que contiene 9 ml de agua peptona al 0,1%. -Mezclar bien y realizar las diluciones siguientes tomando siempre 1 ml y transfiriendo este volumen a 9 ml de diluyente. Se hacen tantas diluciones como sean necesarias. 3) Metodología de análisis a) Recuento microscópico directo (recuento de bacterias totales en leche) b) Recuento de bacterias aerobias mesófilas c) Recuento de bacterias psicrotróficas d) Recuento de coliformes totales e) Determinación de coliformes totales f) Recuento de coliformes a 45°C g) Determinación de Escherichia coli a) Recuento microscópico directo (recuento de bacterias totales en leche) Método de Breed-Newman (APHA, 1976) El método consiste en contar los microorganismos vivos y muertos de la muestra. La validez de este método se limita a las muestras con recuentos elevados, mientras que aporta escasa información respecto a las muestras que contienen un número reducido de microorganismos. Preparación de la película -Mezclar bien la muestra por agitación. -Transferir 0,01 ml al recuadro de un portaobjeto especial limpio. El recuadro marcado tiene 1 cm de lado. -Distribuir el material sobre el recuadro mediante un ansa cuyo extremo forme un pequeño ángulo recto (ansa en L). -Secar el extendido al aire o bien colocándolo sobre una chapa caliente, cuidando que no sobrepase los 45ºC. -Los extendidos de los alimentos ricos en grasa deben ser desengrasados sumergiéndolos en xileno durante 5 minutos. -Luego de secar al aire se lo fija sumergiéndolo en alcohol absoluto durante 2-3 minutos. 4 -Sin secarlo se lo tiñe con la solución colorante sumergiéndolo durante 30 segundos. El exceso de colorante es eliminado colocando el borde del portaobjeto sobre un papel absorbente. -Secar cuidadosamente al aire y, una vez seco, sumergir en una cubeta con agua común, el tiempo necesario como para que ésta no tome color. Secar nuevamente al aire. Solución colorante Solución madre al 2% de Azul de Metileno en alcohol absoluto 96º. Se toman 30 ml de la solución madre y se diluyen con agua destilada hasta 1 litro. Examen microscópico La película se examina primero con un objetivo seco de gran apertura y después con el objetivo de inmersión. Se calculan los microorganismos presentes en 1 ml de la porción de muestra de la siguiente manera: cuando las células de un mismo tipo morfológico se presentan en racimos, éstas se cuentan como unidades individuales, sólo si la distancia entre las células es igual o mayor al doble del diámetro menor de las dos células que estén más próximas entre sí; las células de morfología diferente o con tinción diferente se cuentan como unidades también diferentes independientemente de su proximidad a las demás células. Para examinar una parte representativa de la película, se escoge un campo de partida situado a la misma distancia de cualquiera de los dos lados (punto medio del preparado sobre uno de los lados) y dos o tres campos adentro a partir del borde (superior o inferior). Se cuentan los campos de una serie a través de la película en forma horizontal, y después se empieza a contar desde el centro que habíamos tomado como punto de partida una serie de campos separados en un sentido perpendicular a la primera serie. Si fuese necesario examinar un número mayor de campos, se repite la selección de campos según la explicación anterior, partiendo de un punto situado a 2 mm de distancia de la primera serie elegida. Se contarán entre 30 y 60 campos. Si el número de microorganismos es menor de 30000 bacterias/ml o g, se efectuará el recuento de 60 campos. Si es de 30000 bacterias/ml o g a 300000 bacterias/ml o g basta el recuento de 20 a 30 campos. Si es mayor a 300000 bacterias/ml o g se recuentan tantos campos como fuesen necesarios para obtener 150 a 200 gérmenes en la suma de todos ellos. Cálculo Se calcula el valor promedio de gérmenes por campo y se multiplica este valor por el factor microscópico (FM) y por (la inversa de la alícuota tomada) el número recíproco de la dilución. Recuento Microscópico = Directo/ml o g Promedio de microorganismos por campo X FM X Recíproca de la dilución Donde FM = 100/A. A es el área del campo microscópico (la mayoría de los microscopios para alumnos tienen un diámetro de campo de 0,16 mm). FM = 4970/cm b) Recuento de bacterias aerobias mesófilas (FIL 100B: 1991) -Verter 1 ml de cada dilución por duplicado en placas de Petri y agregar el agar para recuento (APC) con 0,1 % de leche en polvo descremada ya fundido y mantenido a aproximadamente 44-46ºC. 5 -Mezclar para lograr una distribución homogénea. Siguiendo las mismas indicaciones, sembrar tres diluciones sucesivas. -Cuando las placas estén frías invertirlas e incubarlas a 30 ± 1°C durante 72 ± 3 h. -Contar las colonias y calcular el valor de recuento total siguiendo las pautas dadas en el capítulo de muestreo. -Seleccionar las placas con recuento entre 30 y 300 colonias, multiplicar el número promedio de colonias contadas en las placas por el factor de dilución correspondiente e informar como “UFC de bacterias aerobias mesófilas/ml o g”. c) Recuento de bacterias psicrotróficas (APHA, 1992) Este recuento puede realizarse bajo diferentes combinaciones de temperatura/tiempo -Proceder de la misma forma que para el recuento de aerobios (b) pero incubando a 7ºC durante 10 días (21°C durante 25 h, o 18°C durante 45 h). Se informa como “UFC de bacterias psicrótrofas/ml o g” d) Recuento de coliformes totales (FIL 73 A: 1985) El recuento de coliformes totales puede realizarse por recuento en placa con medio sólido o mediante la técnica de número más probable (NMP) en medio líquido. d.1) Recuento en placa: Agar Bilis Rojo Violeta- Lactosa (ABRV-Lactosa) -Sembrar 1 ml de dos diluciones sucesivas por duplicado en placas de Petri. -Agregar aproximadamente 12 ml de agar ABRV fundido a 44-46ºC. -Mezclar y dejar solidificar completamente. -Agregar entonces 4 ml más de medio fundido. -Dejar enfriar e incubar las placas invertidas a 30ºC durante 22-26 h. -Seleccionar las diluciones que presenten entre 10 y 150 colonias. -Contar las colonias rojas oscuras con diámetro de por lo menos 0,5 mm, características de bacterias coliformes. Confirmación: Tomar entre 5 y 10 colonias del ABRV y transferirlas a tubos de fermentación con caldo Verde Brillante Lactosa 2% de Sales Biliares (cada colonia a un tubo distinto). -Incubar a 30ºC durante 22-26 h. Se consideran positivas aquellas colonias que den producción de gas. -Calcular el resultado en base al número de colonias confirmadas. Se expresa como “UFC de coliformes totales/ml o g”. La confirmación de las colonias es especialmente recomendable para el caso de alimentos que contengan otros azúcares distintos de lactosa. d.2) Técnica del número más probable (NMP). Prueba presuntiva -Inocular por triplicado 1 ml de muestra y de las diluciones sucesivas en tubos de fermentación con caldo Verde Brillante Lactosa 2% de Sales Biliares. -Incubar a 30ºC durante 48 h. Se consideran positivos aquellos tubos que presenten formación de gas en la campanita de Durham. -De ser necesario, inocular 10 ml de muestra en vez de 1 ml. En este caso, se utilizarán tubos doble concentración de caldo Verde Brillante Lactosa 2% de Sales Biliares. Confirmación: Estriar cada tubo presuntamente positivo en agar Agar Eosina Azul de Metileno (EMB). -Incubar a 30ºC durante 22-26 h. Se consideran colonias de coliformes las de aspecto oscuro, rojo/rosado y/o mucoso, con o sin brillo metálico. -Registrar el número de tubos positivos de cada dilución. Con la ayuda de una tabla de Número Más Probable (NMP), calcular el NMP de coliformes totales/ml o g de muestra, teniendo en cuenta los tubos positivos y las diluciones empleadas durante al confirmación. 6 e) Determinación de coliformes totales (Metodología descripta por Mossel, 1985) -Inocular 1 ml de muestra en 10 ml de caldo Triptona Peptona de Soja (CTS). -Incubar a 20-25ºC durante 5-6 h. -Agitar bien y volcar en un tubo que contenga 10 ml de caldo Verde Brillante Lactosa 2% de Sales Biliares doble concentrado (con campanita de Durham). -Incubar a 30 ± 1°C durante 18-24 h. Los tubos en los que no se verifique formación de gas se consideran negativos. En este caso se informa “ausencia de coliformes totales en 1 ml¨ -Agitar bien el contenido de los tubos positivos, resembrar por estría en agar EMB. Incubar a 37 ± 1°C durante 24 horas. Las colonias típicas de coliformes son oscuras, rojas-rosadas o mucosas. Si se verifica crecimiento de estas características, se informa ¨presencia de coliformes en 1 ml¨ f) Recuento de coliformes a 45°C (APHA, 1992) A partir de los tubos positivos de d.2 (coliformes totales a 30°C, por NMP), inocular un tubo de fermentación de caldo EC. -Incubar 24 h a 45°C. La producción de gas en la campanita de Durham confirma coliformes a 45°C (coliformes fecales). -Registrar el número de tubos positivos de cada dilución. Con la ayuda de una tabla de Número Más Probable (NMP), calcular el NMP de coliformes a 45°C/ml o g de muestra, teniendo en cuenta los tubos positivos y las diluciones empleadas. g) Determinación de Escherichia coli (Mossel y Moreno García, "Microbiología de los alimentos. Fundamentos ecológicos para garantizar y comprobar la inocuidad y calidad de los alimentos"; Ed. Acribia, 1985) -Inocular 1 ml de muestra en 10 ml de caldo Triptona Peptona de Soja (CTS). -Incubar a 20-25ºC durante 5-6 h. -Agitar bien y volcar en un tubo que contenga 10 ml de caldo Verde Brillante Lactosa 2% de Sales Biliares doble concentrado (con campanita de Durham). -Incubar a 30 ± 1°C durante 18-24 h. Los tubos en los que no se verifique formación de gas se consideran negativos. En este caso se informa “ausencia de E. coli”. -Agitar bien el contenido de los tubos positivos, resembrar por estría en agar Mac Conkey. -Incubar a 44 ± 0,1°C (preferentemente en baño de agua) durante 30 h. Si existiese crecimiento típico (colonias rojas), tomar colonias aisladas y realizarles las siguientes pruebas: 1- Gram 2- Siembra en tubo de fermentación caldo Verde Brillante 2% Sales Biliares con Lactosa. Incubar a 44°C durante 48 h. 3- Siembra en caldo triptona. Incubar a 44°C durante 48 h. 4- Siembra en agar citrato. Incubar a 30°C durante 48 h. Resultados característicos: 1- Cocobacilo Gram negativo no formador de esporas. 2- Fermentación de lactosa a 44°C con formación de gas. 3- Producción de indol a 44°C. 4- No utiliza citrato. Alternativamente se pueden utilizar las pruebas del IMViC para la identificación 7 De ser posible ensayar el cultivo sospechoso con un sistema de pruebas múltiples (API, MICRO-ID, o semejantes. En caso de confirmarse, informar “presencia de E. coli” en 1 ml de muestra. -Indicar las pruebas de identificación realizadas. 8 ANÁLISIS DE LECHE EN POLVO 1- Toma de muestra Para el muestreo, es preferible tomar como muestra los recipientes o paquetes originales, sin abrir. Cuando haya que muestrear productos a granel, la muestra se tomará en un punto cerca del centro del recipiente que la contiene, si es posible, quitando la capa superficial de polvo con un instrumento esterilizado, y extrayendo después la muestra con una cuchara o varilla esterilizada. ICMSF recomienda para cada producto a granel tomar no menos de 30 g. 2- Preparación de la muestra -Con una cuchara estéril mezclar el contenido del frasco de leche en polvo. -Pesar asépticamente 10 g de muestra en un Erlenmeyer que contenga 90 ml de agua peptona 0,1% previamente calentada a no más de 45ºC. -Agitar hasta disolución de grumos. -Preparar las siguientes diluciones transfiriendo 1 ml a un tubo con 9 ml de diluyente. La mayoría de las leches en polvo pueden ser disueltas en agua peptona al 0,1% o en solución salina de fosfatos tamponada. Las muestras más insolubles (por ejemplo leches de alta acidez) se disuelven bien agregando 1,25% de citrato de sodio a la solución de fosfatos. 3- Metodología de análisis a) Recuento microscópico directo (recuento de bacterias totales en leche) b) Recuento de bacterias aerobias mesófilas c) Recuento de coliformes totales d) Recuento de coliformes a 45°C e) Recuento de Staphylococcus aureus f) Determinación de Salmonella a) Recuento microscópico directo (recuento de bacterias totales en leche) Método de Breed-Newman (APHA, 1976) El método consiste en contar los microorganismos vivos y muertos de la muestra. La validez de este método se limita a las muestras con recuentos elevados, mientras que aporta escasa información respecto a las muestras que contienen un número reducido de microorganismos. Preparación de la película -Mezclar bien la muestra por agitación. -Transferir 0,01 ml al recuadro de un portaobjeto especial limpio. El recuadro marcado tiene 1 cm de lado. -Distribuir el material sobre el recuadro mediante un ansa en L. -Secar el extendido al aire o bien colocándolo sobre una chapa caliente, cuidando que no sobrepase los 45ºC. -Los extendidos de los alimentos ricos en grasa deben ser desengrasados sumergiéndolos en xileno durante 5 minutos. -Luego de secar al aire se lo fija sumergiéndolo en alcohol absoluto durante 2-3 minutos. -Sin secarlo se lo tiñe con la solución colorante sumergiéndolo durante 30 segundos. El exceso de colorante es eliminado colocando el borde del portaobjeto sobre un papel absorbente. -Secar cuidadosamente al aire y, una vez seco, sumergir en una cubeta con agua común el tiempo necesario como para que ésta no tome color. Secar al aire. 9 Solución colorante Solución madre al 2% de Azul de Metileno en alcohol absoluto 96º. Se toman 30 ml de la solución madre y se diluyen con agua destilada hasta 1 litro. Examen microscópico La película se examina primero con un objetivo seco de gran apertura y después con el objetivo de inmersión. Se calculan los microorganismos presentes en 1 ml de la porción de muestra de la siguiente manera: cuando las células de un mismo tipo morfológico se presentan en racimos, éstas se cuentan como unidades individuales, sólo si la distancia entre las células es igual o mayor al doble del diámetro menor de las dos células que estén más próximas entre sí; las células de morfología diferente o con tinción diferente se cuentan como unidades también diferentes independientemente de su proximidad a las demás células. Para examinar una parte representativa de la película, se escoge un campo de partida situado a la misma distancia de cualquiera de los dos lados (punto medio del preparado sobre uno de los lados) y dos o tres campos adentro a partir del borde (superior o inferior). Se cuentan los campos de una serie a través de la película en forma horizontal, y después se empieza a contar desde el centro que habíamos tomado como punto de partida una serie de campos separados en un sentido perpendicular a la primera serie. Si fuese necesario examinar un número mayor de campos, se repite la selección de campos según la explicación anterior, partiendo de un punto situado a 2 mm de distancia de la primera serie elegida. Se contarán entre 30 y 60 campos. Si el número de microorganismos es menor de 30000 bacterias/ml o g, se efectuará el recuento de 60 campos. Si es de 30000 a 300000 gérmenes/ml o g basta el recuento de 20 a 30 campos. Si es mayor a 300000 gérmenes/ml o g se recuentan tantos campos como fuesen necesarios para obtener 150 a 200 gérmenes en la suma de todos ellos. Cálculo Se calcula el valor promedio de gérmenes por campo y se multiplica este valor por el factor microscópico (FM) y por (la inversa de la alícuota tomada) el número recíproco de la dilución Recuento Microscópico = Directo/ml o g Promedio de microorganismos por campo X FM Recíproca de la X dilución Donde FM = 100/A. A es el área del campo microscópico (la mayoría de los microscopios para alumnos tienen un diámetro de campo de 0,16 mm). FM = 4970/cm b) Recuento de bacterias aerobias mesófilas (FIL 100B: 1991) -Verter 1 ml de cada dilución por duplicado en placas de Petri y agregar el agar para recuento (APC) con 0,1 % de leche en polvo descremada ya fundido y mantenido a aproximadamente 44-46ºC. -Mezclar para lograr una distribución homogénea. Siguiendo las mismas indicaciones, sembrar tres diluciones sucesivas. -Cuando las placas estén frías invertirlas e incubar a 30 ± 1°C durante 72 ± 3 h. -Contar las colonias y calcular el valor de recuento total siguiendo las pautas dadas en el capítulo de muestreo. 10 -Seleccionar las placas con recuento entre 30 y 300 colonias, se multiplica el número promedio de colonias contadas en las placas por el factor de dilución correspondiente e informar como “UFC de bacterias aerobias mesófilas/ml o g”. c) Recuento de coliformes totales (FIL 73 A: 1985) El recuento de coliformes totales puede realizarse por recuento en placa con medio sólido o en medio líquido (por la técnica de NMP: número más probable). c.1) Recuento en placa. Agar Bilis Rojo Violeta- Lactosa (ABRV-Lactosa) -Sembrar 1 ml de dos diluciones sucesivas por duplicado en placas de Petri. -Agregar aproximadamente 12 ml de agar ABRV fundido a 44-46ºC. -Mezclar y dejar solidificar completamente -Agregar entonces 4 ml más de medio fundido. -Dejar enfriar e incubar las placas invertidas a 30ºC durante 22-26 h. -Seleccionar las diluciones que presenten entre 10 y 150 colonias. -Contar las colonias rojas oscuras con diámetro de por lo menos 0,5 mm, características de bacterias coliformes. Confirmación: Tomar entre 5 y 10 colonias del ABRV y transferirlas a tubos de fermentación con caldo Verde Brillante Lactosa 2% de Sales Biliares (cada colonia a un tubo distinto). -Incubar a 30ºC durante 22-26 h. Se consideran positivas aquellas colonias que den producción de gas. El resultado se calcula en base al número de colonias confirmadas. Se expresa como “UFC de coliformes totales/ml o g”. La confirmación de las colonias es especialmente recomendable para el caso de alimentos que contengan otros azúcares distintos de lactosa. c.2) Técnica del número más probable (NMP). Prueba presuntiva -Inocular por triplicado 1 ml de muestra y de las diluciones sucesivas en tubos de fermentación con caldo Verde Brillante Lactosa 2% de Sales Biliares. Incubar a 30ºC durante 48 h. -Considerar positivos aquellos tubos que presenten formación de gas en la campanita de Durham. De ser necesario, inocular 10 ml de muestra en vez de 1 ml. En este caso, se utilizarán tubos doble concentrado de caldo Verde Brillante Lactosa 2% de Sales Biliares. Confirmación: Estriar cada tubo presuntamente positivo en agar EMB (Agar Eosina Azul de Metileno). Incubar a 30ºC durante 22-26 h. Se consideran colonias de coliformes las de aspecto oscuro, rojo/rosado y/o mucoso, con o sin brillo metálico. -Registrar el número de tubos positivos de cada dilución. Con la ayuda de una tabla de Número Más Probable (NMP), calcular el NMP de coliformes totales/ml o g de muestra, teniendo en cuenta los tubos positivos y las diluciones empleadas durante la confirmación. d) Recuento de coliformes a 45°C (APHA, 1992) -A partir de los tubos positivos de c.2 (coliformes totales a 30°C, por NMP), inocular un tubo de fermentación de caldo EC. -Incubar 24 h a 45°C. La producción de gas en la campanita de Durham confirma coliformes a 45°C (coliformes fecales). -Registrar el número de tubos positivos de cada dilución. Con la ayuda de una tabla de Número Más Probable (NMP), calcular el NMP de coliformes a 45°C/ml o g de muestra, teniendo en cuenta los tubos positivos y las diluciones empleadas. 11 e) Recuento de Staphylococcus aureus (FIL 145: 1990) Se recomienda realizar el recuento sembrando por duplicado cada dilución. En caso de requerir un inóculo más grande por un valor bajo del requisito microbiológico de aceptación, puede hacerse una siembra combinada de la siguiente forma: -Distribuir 1 ml de dilución 1/10 equitativamente en la superficie de tres placas de agar Baird Parker perfectamente secas. Distribuir con una espátula de Drigalsky cuidadosamente (tener la precaución de enfriar bien la espátula para no matar los microorganismos). -Dejar secar las placas tapadas sin invertir a temperatura ambiente por aproximadamente 15 minutos. Una vez secas, incubarlas invertidas a 37 ± 1ºC durante 24-48 h. -Tomar para enumerar, placas con no más de 150 colonias. -Seleccionar un número representativo de colonias típicas y atípicas; y transferirlas a tubos de caldo infusión Cerebro-Corazón (BHI). -Incubar a 37°C o 35ºC durante 20 a 24h. Las colonias típicas son negras, brillantes y convexas rodeadas de una zona clara, generalmente un halo opaco rodea a la colonia por dentro de la zona clara. Identificación y confirmación Sobre los cultivos puros de 20-24 horas, realizar: - Tinción de Gram - Catalasa - Coagulasa (comparar con cepa patrón): Agregar 0,1 ml del cultivo a aproximadamente 0,3 ml de plasma de conejo reconstituido en un tubo estéril. Incubar a 35-37°C. Examinar después de 4 a 6 horas. El coágulo formado debe ser firme y organizado (3+) o que no se cae al invertir el tubo (4+). -Realizar un control empleando 0,1 ml de caldo BHI estéril en lugar del cultivo. Para que el ensayo sea válido, no debe observarse ningún signo de coagulación. -Complementariamente puede realizarse la prueba de la termonucleasa sobre la misma placa de Baird Parker. S. aureus coagulasa positiva (3 o 4+) son cocos Gram positivos, catalasa y termonucleasa positivo. -Informar “UFC de S. aureus coagulasa positivo/g de muestra”. Para realizar el cálculo contar el número total de colonias confirmadas en las tres placas. f) Determinación de Salmonella (FIL 93 A: 1985) f.1) Preenriquecimiento en medio líquido (enriquecimiento no selectivo) -Preparar un Erlenmeyer con 225 ml de agua destilada con 1 ml de solución de Verde Brillante (0,5 % Verde Brillante en agua; dejar la solución en la oscuridad por lo menos un día para autoesterilizar). -Pesar asépticamente 25 g de muestra en dicho Erlenmeyer. -Dejar a temperatura ambiente durante aproximadamente 1 h sin agitar. -Incubar a 37ºC durante 16-20 h. -Si al cabo de 3 h de incubación todavía no se ha disuelto la leche en polvo, agitar el frasco para mezclar su contenido. f.2) Enriquecimiento en medio líquido (enriquecimiento selectivo) -Transferir 10 ml de enriquecimiento a 100 ml de caldo Tetrationato (Müller Kauffmann). -Incubar a 43 ± 0,5ºC durante 18-24 h. -Transferir 10 ml del preenriquecimiento a 100 ml de caldo Selenito-Cistina. -Incubar a 37 ± 1ºC durante 18-24 h. 12 f.3) Aislamiento en medio sólido -A partir de cada uno de los enriquecimientos estriar una placa de agar Verde Brillante-Rojo Fenol (BPLS) y una de agar Bismuto Sulfito (son cuatro placas en total). -Incubar las placas invertidas a 37 ± 1ºC durante 20-24 h. -De ser necesario, seguir incubando los caldos de enriquecimiento 18-24 h más y volver a estriar en los medios de aislamiento. -Si al cabo del período de incubación el crecimiento en las placas fuera escaso, reincubar por 18-24 h adicionales a la misma temperatura. -Examinar las placas para investigar la presencia de colonias típicas de Salmonella. En agar BPLS, las colonias son rosadas y el medio circundante rojo brillante. En agar Bismuto Sulfito, las colonias típicas son marrones a negras con brillo metálico. Algunas cepas forman colonias verdosas. f.4) Identificación y confirmación -De cada placa seleccionar cinco colonias sospechosas. Estriar en una placa de agar nutritivo (AN) para que desarrollen colonias aisladas. -Incubar a 37 ± 1ºC durante 18-24 h. -Al cabo de la incubación, seleccionar colonias aisladas para proseguir con las pruebas de confirmación bioquímica y serológica. A partir de cada cepa realizar: 1) Tinción de Gram. 2) Prueba de oxidasa. 3) TSI. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 4) LIA. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 5) Sembrar un tubo de caldo urea. Incubar a 37ºC, 24 h. 6) Prueba de la β-galactosidasa: a partir de un cultivo en agar inclinado, tomar un ansa bien cargada y emulsionarla en 0,2 ml de solución salina fisiológica hasta conseguir una suspensión densa. Colocar un disco de ONPG. Incubar a 37ºC durante 20 minutos. Observar hasta las 4 horas de incubación para dar un informe negativo. El color amarillo indica que la reacción es positiva. 7) Inocular un tubo de caldo triptona. Incubar 24 h a 37°C. 8) Inocular un tubo de caldo Clark y Lubs (RMVP). Incubar 24 h a 37°C. Resultados típicos de Salmonella spp. 1) Bacilo coco Gram negativo sin esporas. 2) Oxidasa (-) 3) TSI: profundidad: amarillo o negro, con o sin ruptura del agar por formación de gas/ superficie inclinada: rojo o sin variación. Salmonella es lactosa (-), la mayoría de las cepas, y sacarosa (-), la mayoría de las cepas. 4) LIA: profundidad: violeta o negro (negro en la mayoría de los casos)/superficie inclinada: violeta. Salmonella es lisina decarboxilasa (+). 5) Ureasa (-), sin cambio de color. 6) β-galactosidasa (-) sin cambio de color. (+) se manifiesta por la aparición de color amarillo. 7) Indol (-) 8) Voges Proskauer (-) De ser posible confirmar el resultado con un sistema de pruebas múltiples. 13 f.5) Confirmación serológica -La misma se puede realizar de dos maneras diferentes: a. Aglutinación somática: -Preparación del antígeno: utilizar un cultivo de estrías de 24 h de incubación a 37°C. -Suspender el crecimiento de la estría con 1ml de solución fisiológica. -Reacción: sobre lámina de vidrio depositar una gota de c/u de los 2 sueros polivalentes somáticos y los monovalentes. Colocar al lado de cada suero, una gota de suspensión antigénica. Mezclar con un ansa previamente flameada y enfriada. -Lectura: debe ser inmediata y no después de 5 minutos. Las reacciones tardías o dudosas no deben considerarse. b. Aglutinación flagelar: -Preparación del antígeno: a partir de una colonia de Salmonella, hacer un cultivo de 24 h en caldo. Luego agregar igual volumen de solución formolada al 5%. -Reacción: en distintos tubos de ensayos colocar una gota de cada uno de los sueros polivalentes y monovalentes ciliares. Agregar en cada uno 0,5 ml de la suspensión antigénica. Incubar en baño maría a 50°C. -Lectura: se efectuará al cabo de una hora de incubación. Debe considerarse únicamente la aglutinación de tipo ciliar (flóculos esponjosos, fácilmente disociables). Si una cepa de Salmonella (previamente confirmada por su aglutinación somática), no reacciona con ninguno de los sueros ciliares polivalentes hay que tener en cuenta que puede: a) Tratarse de una variante inmóvil. b) Presentar otro tipo de antígeno ciliar no incluido en la lista. -Emplear una cepa patrón de Salmonella para controlar los medios de cultivo y los medios empleados en las pruebas de confirmación e identificación. -Informar ausencia o presencia de Salmonella en la cantidad de muestra empleada en el análisis (25 g en nuestro caso). -Aclarar modificaciones y pruebas bioquímicas realizadas. 14 REQUISITOS MICROBIOLÓGICOS DEL CÓDIGO ALIMENTARIO ARGENTINO - MERCOSUR LECHE Art. 558 (Res. MSyAS N°047 del 28.01.98): La leche entera pasteurizada, deberá responder a las siguientes exigencias: a) Estar exenta de gérmenes patógenos. Esta exigencia no se dará por cumplida si presenta: 1- Recuento total en placa: >50.000 bacterias mesófilas/cm3 en los meses de abril a septiembre inclusive y >100.000 bacterias/cm3 en los meses de octubre a marzo, inclusive. 2- Bacterias coliformes (recuento en placa con medio agar-violeta-rojo-bilis): >50/cm3. 3- Escherichia coli: presencia en 1 cm3. Deberá ser confirmada por pruebas bioquímicas. 4- Prueba de la fosfatasa positiva. Art. 559 (Res. MSyAS N°047 del 28.01.98): Leche entera seleccionada pasteurizada. Sin haber sido sometida a ningún tratamiento previo, debe presentar un contenido microbiano no mayor de 500.000 bacterias mesófilas/cm3. La leche entera seleccionada pasteurizada deberá estar exenta de gérmenes patógenos. Esta exigencia no se dará por cumplida si presenta: 1- Recuento total en placa: >25.000 bacterias mesófilas/cm3 de abril a septiembre, inclusive y >35.000 bacterias mesófilas/cm3 de octubre a marzo, inclusive. 2- Bacterias coliformes (recuento en placa con medio agar-violeta-rojo-bilis): >10/cm3 3- Escherichia coli: presencia en 1 cm3. Deberá ser confirmada por pruebas bioquímicas. 4- Prueba de la fosfatasa positiva. Art. 559bis (Res. MSyAS N°047 del 28.01.98): Leche entera certificada pasteurizada. Sin haber sido sometida a ningún tratamiento previo, no debe presentar gérmenes patógenos y su contenido microbiano no debe ser superior a 10.000 bacterias mesófilas/cm3. La leche entera certificada pasteurizada deberá estar exenta de gérmenes patógenos. Esta exigencia no se dará por cumplida si presenta: 1- Recuento total en placa: >5.000 bacterias mesófilas/cm3 en el momento de su recepción por el consumidor. 2- Bacterias coliformes presencia en 1 cm3. 3- Prueba de la fosfatasa positiva. Art. 559tris (Res. MSyAS N°328 del 21.05.97): Se entiende por leche ultrapasteurizada a la leche, homogeneizada o no, que haya sido sometida durante por lo menos 2 segundos a una temperatura mínima de 138°C mediante un proceso térmico de flujo continuo, inmediatamente enfriada a menos de 5°C y envasada en forma aséptica en envases estériles y herméticamente cerrados. 15 Deberá responder a las siguientes exigencias: Categoría ICMSF 1- Recuento de mesófilos totales/cm3: 3 2- Recuento de coliformes a 30°C/cm3: 6 3- Recuento de coliformes a 45°C/cm3: 6 4- Prueba de la fosfatasa 5- Prueba de la peroxidasa Valores n=5 c=2 m=102 M=103 n=5 c=2 m<3 M=10 n=5 c=1 m<3 M=10 Negativa Negativa Leche UHT Res MS y AS Nº 110 del 4.04.95 GMC Res. N° 78/94 Microorganismos Criterio De Aceptación Categoria I.C.M.S.F. Microorganismos aerobios mesófilos n=5 c=0 m=100 10 viables/ml Resoluciones MS y AS: N°003 del 11.01.95 y N° 433 del 25.06.97 Leche en polvo Criterios microbiológicos y tolerancias Criterio de Aceptación Microorganismos (Codex, Vol. H CAC/RCP 31-83) Microorganismos aerobios mesófilos n=5 c=2 m=30000 M=100000 viables/g Coliformes (a 30°C)/g n=5 c=2 m=10 M=100 FIL1008: 1991 Categoría I.C.M.S.F. Método De Ensayo 5 FIL100:A 1987 5 Coliformes (a 45°C)/g n=5 c=2 m<3 M=10 5 S. aureus coag.+/g Salmonella spp./25 g n=5 c=1 m=10 M=100 n=10 c=0 m=0 8 11 16 Método De Ensayo FIL 73A: 1985 APHA 1992 Cáp. 24 FIL 60A: 1978 FIL 93A: 1985 ANÁLISIS DE MANTECAS Y MARGARINAS 1- Preparación de la muestra y diluciones: (FIL 73 A: 1985) -Colocar en un tubo estéril con capacidad para 50 ml, la muestra de manteca o margarina, de forma de no superar el 50% de la capacidad del tubo. -Fundir la muestra en baño de agua a 45ºC durante 15 minutos agitando para evitar la separación del suero de la grasa. -Transferir con una pipeta precalentada 10 ml de material fundido a un Erlenmeyer con 90 ml de agua de dilución estéril a 45ºC (dilución 1/10). -Homogeneizar por agitación evitando la separación de las fases. Las diluciones sucesivas se efectúan transfiriendo 1 ml a tubos conteniendo 9 ml de agua de dilución estéril a 45ºC. Alternativamente se puede trabajar solamente con la fase acuosa y sus diluciones. Permitir la separación de las fases (dejar reposar a 45°C por no más de 15 minutos) y tomar de la fase inferior 1 ml (equivale a 1 gramo de manteca). 2- Metodología de análisis a) Recuento de bacterias psicrotróficas b) Recuento de bacterias proteolíticas c) Recuento de bacterias lipolíticas d) Recuento de coliformes totales e) Recuento de coliformes a 45°C (coliformes fecales) f) Determinación de Escherichia coli g) Recuento de hongos y levaduras h) Recuento de Staphylococcus aureus i) Determinación de Salmonella a) Recuento de bacterias psicrotróficas (APHA, 1992) Este recuento puede realizase bajo diferentes combinaciones de temperatura/tiempo. -Proceder de la misma forma que para el recuento de aerobios empleando agar para recuento en placa (APC) con 0,1 % de leche en polvo descremada ya fundido y mantenido a aproximadamente 44-46ºC. -Mezclar para lograr una distribución homogénea. -Siguiendo las mismas indicaciones, sembrar tres diluciones sucesivas. -Incubar a 7ºC durante 10 días (o 21°C durante 25 h, o 18°C durante 45 h). -Informar el resultado como “UFC de bacterias psicrótrofas/ml o g”. b) Recuento de bacterias proteolíticas (APHA, 1992) Medio de cultivo: agar para recuento en placa (APC) con leche al 10%. -Sembrar por duplicado 1 ml de por lo menos dos diluciones sucesivas en placas de Petri. -Agregar el agar fundido a 44-46ºC y mezclar para homogeneizar el inóculo en el agar. -Si el recuento esperado es bajo, puede realizarse un recuento combinado distribuyendo 10 ml de la dilución 1/10 en tres placas de Petri y agregando luego agar de la misma forma que antes. -Dejar solidificar. -Incubar invertidas a 21 ± 2ºC durante 72 horas. -Para revelar, si no se observaran directamente los halos de clarificación, inundar las placas con HCl 1% o ácido acético 10% durante 1 minuto, volcando luego el ácido excedente. -Si el recuento se realizó por duplicado, emplear las placas que contengan entre 30 y 300 colonias. Tener en cuenta la dilución empleada. 17 Si se hizo el recuento combinado, contar el número de colonias en las tres placas, cuyo recuento corresponde al número de bacterias proteolíticas en 1 g de muestra. -Informar como “UFC de bacterias proteolíticas/g”. c) Recuento de bacterias lipolíticas (APHA, 1992) Medio de cultivo: agar Tributirina -Sembrar por duplicado 1 ml de por lo menos dos diluciones sucesivas en placas de Petri. -Agregar el agar fundido a 44-46ºC y mezclar para homogeneizar el inóculo en el agar. -Si el recuento esperado es bajo, puede realizarse un recuento combinado distribuyendo 10 ml de la dilución 1/10 en tres placas de Petri y agregando luego agar de la misma forma que antes. -Dejar solidificar. -Incubar invertidas a temperaturas entre 20 a 30ºC durante 72 horas. La hidrólisis de la Tributirina se evidencia como una zona clara alrededor de las colonias. -Si el recuento se realizó por duplicado, emplear las placas que contengan entre 30 y 300 colonias. Tener en cuenta la dilución empleada. -Si se hizo el recuento combinado, contar el número de colonias en las tres placas, cuyo recuento corresponde al número de bacterias lipolíticas en 1 g de muestra. -Informar como “UFC de bacterias lipolíticas/g”. d) Recuento de coliformes totales (FIL 73 A: 1985) El recuento de coliformes totales puede realizarse por recuento en placa con medio sólido o en medio líquido (por la técnica de NMP: número más probable). d.1) Recuento en placa. Agar Bilis Rojo Violeta- Lactosa (ABRV-Lactosa) -Sembrar 1 ml de dos diluciones sucesivas por duplicado en placas de Petri. -Agregar aproximadamente 12 ml de agar ABRV fundido a 44-46ºC. -Mezclar y dejar solidificar completamente. -Agregar entonces 4 ml más de medio fundido. -Dejar enfriar e incubar las placas invertidas a 30ºC durante 22-26 h. -Seleccionar las diluciones que presenten entre 10 y 150 colonias. Contar las colonias rojas oscuras con diámetro de por lo menos 0,5 mm, características de bacterias coliformes. Confirmación: Tomar entre 5 y 10 colonias del ABRV y transferirlas a tubos de fermentación con caldo Verde Brillante Lactosa 2% de Sales Biliares (cada colonia a un tubo distinto). -Incubar a 30ºC durante 22-26 h. Se consideran positivas aquellas colonias que den producción de gas. El resultado se calcula en base al número de colonias confirmadas. Se expresa como “UFC de coliformes totales/ml o g”. La confirmación de las colonias es especialmente recomendable para el caso de alimentos que contengan otros azúcares distintos de lactosa. d.2) Técnica del número más probable (NMP). Prueba presuntiva -Inocular por triplicado 1ml de muestra y de las diluciones sucesivas en tubos de fermentación con caldo Verde Brillante Lactosa 2% de Sales Biliares. -Incubar a 30ºC durante 48 h. Se consideran positivos aquellos tubos que presenten formación de gas en la campanita de Durham. -De ser necesario, inocular 10 ml de muestra en vez de 1 ml. Se utilizarán tubos doble concentración de caldo Verde Brillante Lactosa 2% de Sales Biliares. 18 Confirmación: Estriar cada tubo presuntamente positivo en agar EMB (agar Eosina Azul de Metileno). Incubar a 30ºC durante 22-26 h. Se consideran colonias de coliformes las de aspecto oscuro, rojo/rosado y/o mucoso, con o sin brillo metálico. -Registrar el número de tubos positivos de cada dilución. Con la ayuda de una tabla de Número Más Probable (NMP), calcular el NMP de coliformes totales/ml o g de muestra, teniendo en cuenta los tubos positivos y las diluciones empleadas. e) Recuento de coliformes a 45°C (APHA, 1992) -A partir de los tubos positivos de d.2 (coliformes totales a 30°C, por NMP), inocular un tubo de fermentación de caldo EC. -Incubar 24 h a 45°C. La producción de gas en la campanita de Durham confirma coliformes a 45°C (coliformes fecales). -Registrar el número de tubos positivos de cada dilución. Con la ayuda de una tabla de Número Más Probable (NMP), calcular el NMP de coliformes a 45°C/ml o g de muestra, teniendo en cuenta los tubos positivos y las diluciones empleadas. f) Determinación de Escherichia coli (Mossel y Moreno García, "Microbiología de los alimentos. Fundamentos ecológicos para garantizar y comprobar la inocuidad y calidad de los alimentos"; Ed. Acribia, 1985) -Inocular 1 g de muestra en 10 ml de caldo Triptona Peptona de Soja (CTS). -Incubar a 20-25ºC durante 5-6 h. -Agitar bien y volcar en un tubo que contenga 10 ml de caldo Verde Brillante Lactosa 2% de Sales Biliares doble concentrado (con campanita de Durham). -Incubar a 30 ± 1°C durante 18-24 h. Los tubos en los que no se verifique formación de gas se consideran negativos. En este caso se informa “ausencia de E. coli en 1 gramo”. -Agitar bien el contenido de los tubos positivos, resembrar por estría en agar Mac Conkey. -Incubar a 44 ± 0,1°C (preferentemente en baño de agua) durante 30 h. Si existiese crecimiento típico (colonias rojas), tomar colonias aisladas y realizarles 1-Gram 2- Siembra en tubo de fermentación caldo verde brillante 2% sales biliares con lactosa. Incubar a 44°C por 48 horas. 5- Siembra en caldo triptona. Incubar a 44°C por 48 horas 6- Siembra en agar citrato. Incubar a 30°C por 48 horas. Resultados característicos: 5- Coco bacilo Gram negativo no formador de esporas. 6- Fermentación de lactosa a 44°C con formación de gas. 7- Producción de indol a 44°C 8- No utiliza citrato Alternativamente se pueden utilizar las pruebas del IMViC para la identificación De ser posible ensayar el cultivo sospechoso con un sistema de pruebas múltiples (API, MICRO-ID, o semejantes. En caso de confirmarse, informar “presencia de E. coli” en 1 ml de muestra. Indicar las pruebas de identificación realizadas. 19 g) Recuento de mohos y levaduras (FIL 94 B: 1990) -Sembrar por duplicado 1 ml de por lo menos dos diluciones sucesivas en placas de Petri. -Agregar agar YGC (cloramfenicol-glucosa-extracto de levadura) fundido a 44-46ºC y mezclar para homogeneizar el inóculo en el agar. -Si el recuento esperado es bajo, puede realizarse un recuento combinado distribuyendo 10 ml de la dilución 1/10 en tres placas de Petri y agregando luego agar YGC de la misma forma que antes. -Dejar solidificar. Incubar sin invertir a 25 ± 1ºC durante 5 días. -Si se hizo el recuento por duplicado, contar las placas que contengan entre 10 y 150 colonias. -Si hay excesivo crecimiento contar la placa de mayor dilución aún cuando contenga menos de 10 colonias. -Si se hizo el recuento combinado, contar el número de colonias en las tres placas cuyo número corresponde al número de hongos y levaduras en 1 g de muestra. Las colonias sospechosas o dudosas deben confirmarse por observación microscópica. Informar el resultado como “UFC de mohos y levaduras/g de muestra”. h) Recuento de Staphylococcus aureus (FIL 145: 1990) h.1) Aislamiento y recuento Se recomienda realizar el recuento sembrando por duplicado cada dilución. -En caso de requerir un inóculo más grande por un valor bajo del requisito microbiológico de aceptación, puede hacerse una siembra combinada de la siguiente forma: -Distribuir 1 ml de dilución 1/10 equitativamente en la superficie de tres placas de agar Baird Parker perfectamente secas. Distribuir con una espátula de Drigalsky cuidadosamente (tener la precaución de enfriar bien la espátula para no matar los microorganismos). -Dejar secar las placas tapadas sin invertir a temperatura ambiente por aproximadamente 15 minutos. Una vez secas, incubarlas invertidas a 37 ± 1ºC durante 24-48 h. -Tomar para enumerar, placas con no más de 150 colonias. Seleccionar un número representativo de colonias típicas y atípicas; y transferirlas a tubos de caldo infusión CerebroCorazón. -Incubar a 37°C o 35ºC durante 20 a 24 h. Las colonias típicas son negras, brillantes y convexas rodeadas de una zona clara, generalmente un halo opaco rodea a la colonia por dentro de la zona clara. h.2) Identificación y confirmación Sobre los cultivos puros de 20-24 horas, realizar: - Tinción de Gram - Catalasa - Coagulasa (comparar con cepa patrón): Agregar 0,1 ml del cultivo a aproximadamente 0,3 ml de plasma de conejo reconstituido en un tubo estéril. Incubar a 35-37°C. Examinar después de 4 a 6 horas. El coágulo formado debe ser firme y organizado (3+) o que no se cae al invertir el tubo (4+). Realizar un control empleando 0,1 ml de caldo BHI estéril en lugar del cultivo. Para que el ensayo sea válido, no debe observarse ningún signo de coagulación. -Complementariamente puede realizarse la prueba de la termonucleasa sobre la misma placa de Baird Parker. S. aureus coagulasa positiva (3 o 4+) son cocos Gram positivos, catalasa y termonucleasa positivo. -Informar “UFC /g de muestra”. Para realizar el cálculo contar el número total de S. aureus coagulasa positivo de colonias confirmadas en las tres placas. 20 i) Determinación de Salmonella (FIL 93 A: 1985) i.1) Preenriquecimiento en medio líquido (enriquecimiento no selectivo) -Preparar un Erlenmeyer con 225 ml de agua destilada con 1 ml de solución de Verde Brillante (0,5% Verde Brillante en agua; dejar la solución en la oscuridad por lo menos un día para autoesterilizar). -Pesar asépticamente 25g de muestra en dicho Erlenmeyer. -Dejar a temperatura ambiente durante aproximadamente 1 h sin agitar. -Incubar a 37 ± 1ºC durante 16-20 h. i.2) Enriquecimiento en medio líquido (enriquecimiento selectivo) -Transferir 10 ml de enriquecimiento a 100 ml de caldo Tetrationato (Müller Kauffmann). -Incubar a 43 ± 0,5ºC durante 18-24 h. -Transferir 10 ml del preenriquecimiento a 100 ml de caldo Selenito-Cistina. -Incubar a 37 ± 1ºC durante 18-24 h. i.3) Aislamiento en medio sólido -A partir de cada uno de los enriquecimientos estriar una placa de agar Verde Brillante-Rojo Fenol (BPLS) y una de agar Bismuto Sulfito (son cuatro placas en total). -Incubar las placas invertidas a 37 ± 1ºC durante 20-24 h. -De ser necesario, seguir incubando los caldos de enriquecimiento 18-24 h más y volver a estriar en los medios de aislamiento. -Si al cabo del período de incubación el crecimiento en las placas fuera escaso, reincubar por 18-24 h adicionales a la misma temperatura. -Examinar las placas para investigar la presencia de colonias típicas de Salmonella. En agar BPLS, las colonias son rosadas y el medio circundante rojo brillante. En agar Bismuto Sulfito, las colonias típicas son marrones a negras con brillo metálico. Algunas cepas forman colonias verdosas. i.4) Identificación y confirmación -De cada placa seleccionar cinco colonias sospechosas. -Estriar en una placa de agar nutritivo para que desarrollen colonias aisladas. -Incubar a 37 ± 1ºC durante 18-24 h. -Al cabo de la incubación, seleccionar colonias aisladas para proseguir con las pruebas de confirmación bioquímica y serológica. A partir de cada cepa realizar: 1) Tinción de Gram. 2) Prueba de oxidasa. 3) TSI. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 4) LIA. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 5) Sembrar un tubo de caldo urea. Incubar a 37ºC, 24 h. 6) Prueba de la β-galactosidasa: a partir de un cultivo en agar inclinado, tomar un ansa bien cargada y emulsionarla en 0,2 ml de solución salina fisiológica hasta conseguir una suspensión densa. Colocar un disco de ONPG. Incubar a 37ºC durante 20 minutos. Observar hasta las 4 horas de incubación para dar un informe negativo. El color amarillo indica que la reacción es positiva. 7) Inocular un tubo de caldo triptona. Incubar 24 h a 37°C. 8) Inocular un tubo de caldo Clark y Lubs (RMVP). Incubar 24 h a 37°C. 21 Resultados típicos de Salmonella spp. 1) Bacilo coco Gram negativo sin esporas 2) Oxidasa (-) 3) TSI: profundidad amarillo o negro, con o sin ruptura del agar por formación de gas/ superficie inclinada rojo o sin variación. Salmonella es lactosa (-), la mayoría de las cepas, y sacarosa (-), la mayoría de las cepas. 4) LIA: profundidad violeta o negro (negro en la mayoría de los casos)/superficie inclinada: violeta. Salmonella es lisina decarboxilasa (+). 5) Ureasa (-), sin cambio de color. 6) β-galactosidasa (-) sin cambio de color. (+) se manifiesta por la aparición de color amarillo. 7) Indol (-) 8) Voges Proskauer (-) De ser posible confirmar el resultado con un sistema de pruebas múltiples. i.5) Confirmación serológica -La misma se puede realizar de dos maneras diferentes: a. Aglutinación somática: -Preparación del antígeno: utilizar un cultivo de estrías de 24 h de incubación a 37°C. Suspender el crecimiento de la estría con 1ml de solución fisiológica. -Reacción: sobre lámina de vidrio depositar una gota de c/u de los 2 sueros polivalentes somáticos y los monovalentes. Colocar al lado de cada suero, una gota de suspensión antigénica. Mezclar con un ansa previamente flameada y enfriada. -Lectura: debe ser inmediata y no después de 5 minutos. Las reacciones tardías o dudosas no deben considerarse. b. Aglutinación flagelar: -Preparación del antígeno: a partir de una colonia de Salmonella, hacer un cultivo de 24 h en caldo. Luego agregar igual volumen de solución formolada al 5%. -Reacción: en distintos tubos de ensayos colocar una gota de cada uno de los sueros polivalentes y monovalentes ciliares. Agregar en cada uno 0,5 ml de la suspensión antigénica. Incubar en baño maría a 50°C. -Lectura: se efectuará al cabo de una hora de incubación. Debe considerarse únicamente la aglutinación de tipo ciliar (flóculos esponjosos, fácilmente disociables) Si una cepa de Salmonella (previamente confirmada por su aglutinación somática), no reacciona con ninguno de los sueros ciliares polivalentes hay que tener en cuenta que puede: a) Tratarse de una variante inmóvil. b) Presentar otro tipo de antígeno ciliar no incluido en la lista. -Emplear una cepa patrón de Salmonella para controlar los medios de cultivo y los medios empleados en las pruebas de confirmación e identificación. -Informar ausencia o presencia de Salmonella en la cantidad de muestra empleada en el análisis (25 g en nuestro caso). -Aclarar modificaciones y pruebas bioquímicas realizadas. 22 REQUISITOS MICROBIOLÓGICOS DEL CÓDIGO ALIMENTARIO ARGENTINO -MERCOSURManteca Art. 596 Res MS y AS Nº 003 del 11.01.95 Criterios microbiológicos y tolerancias Coliformes totales/g Criterio de Aceptación (codex, vol. H cac/rcp 31-83) n=5 c=2 m=10 M=100 Categoria I.c.m.s.f. 5 Coliformes (a 45°C)/g n=5 c=2 m<3 M=10 5 S. aureus coag. +/g Salmonella spp./25 g n=5 c=1 m=10 M=100 n=5 c=0 m=0 8 10 Microorganismos Margarina Art. 551 (Res. 511. 9.4.86) Deberá responder a las siguientes características microbiológicas: Bacterias coliformes: máximo 10/g Escherichia coli: ausencia en 1 g Bacterias proteolíticas: máximo 50/g Bacterias lipolíticas: máximo 50/g Hongos y levaduras: máximo 50/g 23 Método de ensayo FIL 73ª 1985 APHA 1992 Cáp. 24 FIL 145 1990 FIL 93ª 1985 ANÁLISIS MICROBIOLÓGICO DE PRODUCTOS LÁCTEOS HELADOS Los productos lácteos congelados son responsables de algunas intoxicaciones e infecciones intestinales. Con la denominación genérica de helados se entiende los productos elaborados por la congelación de mezclas líquidas constituidas por leche, leche en polvo, leche condensada, leche evaporada, manteca, crema de leche, zumos o jarabes de frutas, huevos frescos, conservados, yemas de huevo, café, frutas naturales o confitadas, chocolate, colorantes y demás sustancias de uso permitido. Las mezclas deben ser pasteurizadas. El origen de las bacterias y otros microorganismos en los helados son las distintas materias primas con las que se las prepara, utensilios que se emplean en el manipuleo y cualquier contaminación que pueda llegar a ellos durante las operaciones. 1- Preparación de la muestra y las correspondientes diluciones (FIL 73 A: 1985) -Colocar el helado en un baño de agua caliente a 37°C, impedir que la muestra exceda esta temperatura. Agitar para favorecer que se derrita y tomar la muestra de análisis ni bien se derrita totalmente. -Pesar 10 g de helado en un Erlenmeyer que contiene 90 ml de agua peptona 0,1% estéril. -Homogeneizar completamente. -A partir de esta dilución (1/10) preparar las siguientes transfiriendo 1 ml a tubos con 9 ml de agua peptona 0,1%. -Homogeneizar en agitador. 2- Metodología de análisis a) Recuento de bacterias aerobias mesófilas b) Recuento de coliformes totales c) Recuento de coliformes a 45°C (coliformes fecales) d) Determinación de Salmonella e) Recuento de Staphylococcus aureus coagulasa positiva f) Recuento de mohos y levaduras a) Recuento de bacterias aerobias mesófilas (FIL 100 B: 1991) -Verter 1 ml de cada dilución por duplicado en placas de Petri y se agrega el agar para recuento (APC) con 0,1 % de leche en polvo descremada ya fundido y mantenido a aproximadamente 44-46ºC. Se mezcla para lograr una distribución homogénea. Siguiendo las mismas indicaciones, sembrar tres diluciones sucesivas. -Invertir las placas cuando estén frías e incubar a 30 ± 1°C durante 72 ± 3 h. -Contar las colonias y calcular el valor de recuento total siguiendo las pautas dadas en el capítulo de muestreo. Seleccionar las placas con recuentos entre 30 y 300 colonias, multiplicar el número promedio de colonias contadas en las placas por el factor de dilución correspondiente e informar como “UFC de bacterias aerobias mesófilas/ml o g”. b) Recuento de coliformes totales (FIL 73 A: 1985) El recuento de coliformes totales puede realizarse por recuento en placa con medio sólido o en medio líquido mediante la técnica de número más probable (NMP) 24 b.1) Recuento en placa. Agar Bilis Rojo Violeta- Lactosa (ABRV-Lactosa) -Sembrar 1 ml de dos diluciones sucesivas por duplicado en placas de Petri. -Agregar aproximadamente 12 ml de agar ABRV fundido a 44-46ºC. -Mezclar y dejar solidificar completamente. -Agregar entonces 4 ml más de medio fundido. -Dejar enfriar e incubar las placas invertidas a 30ºC durante 22-26 h. -Seleccionar las diluciones que presenten entre 10 y 150 colonias. Contar las colonias rojas oscuras con diámetro de por lo menos 0,5 mm, características de bacterias coliformes. Confirmación: Tomar entre 5 y 10 colonias del ABRV y transferirlas a tubos de fermentación con caldo Verde Brillante Lactosa 2% de Sales Biliares (cada colonia a un tubo distinto). -Incubar a 30ºC durante 22-26 h. Se consideran positivas aquellas colonias que den producción de gas. -Calcular el resultado en base al número de colonias confirmadas. -Expresar como “UFC de coliformes totales/ml o g”. La confirmación de las colonias es especialmente recomendable para el caso de alimentos que contengan otros azúcares distintos de lactosa. b.2) Técnica del número más probable (NMP). Prueba presuntiva -Inocular por triplicado 1 ml de muestra y de las diluciones sucesivas en tubos de fermentación con caldo Verde Brillante Lactosa 2% de Sales Biliares. -Incubar a 30ºC durante 48 h. Se consideran positivos aquellos tubos que presenten formación de gas en la campanita de Durham. -De ser necesario, inocular 10 ml de muestra en vez de 1 ml. En este caso se utilizarán tubos doble concentración de caldo Verde Brillante Lactosa 2% de Sales Biliares. Confirmación: Estriar cada tubo presuntamente positivo en agar EMB (agar Eosina Azul de Metileno). Incubar a 30ºC durante 22-26 h. Se consideran colonias de coliformes las de aspecto oscuro, rojo/rosado y/o mucoso, con o sin brillo metálico. -Registrar el número de tubos positivos de cada dilución. Con la ayuda de una tabla de Número Más Probable (NMP), calcular el NMP de coliformes totales/ml o g de muestra, teniendo en cuenta los tubos positivos y las diluciones empleadas. c) Recuento de coliformes a 45°C (APHA, 1992) -A partir de los tubos positivos de b.2 (coliformes totales a 30°C, por NMP), inocular un tubo de fermentación de caldo EC. -Incubar 24 h a 45°C. La producción de gas en la campanita de Durham confirma coliformes a 45°C (coliformes fecales). -Registrar el número de tubos positivos de cada dilución. Con la ayuda de una tabla de Número Más Probable (NMP), calcular el NMP de coliformes a 45°C/ml o g de muestra, teniendo en cuenta los tubos positivos y las diluciones empleadas. d) Determinación de Salmonella d.1) Preenriquecimiento en medio líquido (enriquecimiento no selectivo) -Preparar un Erlenmeyer con 225 ml de agua destilada con 1 ml de solución de Verde Brillante (0,5% Verde Brillante en agua; dejar la solución en la oscuridad por lo menos un día para autoesterilizar). -Pesar asépticamente 25g de muestra en dicho Erlenmeyer. -Dejar a temperatura ambiente durante aproximadamente 1 h sin agitar. -Incubar a 37 ± 1ºC durante 16-20 h. 25 d.2) Enriquecimiento en medio líquido (enriquecimiento selectivo) -Transferir 10 ml del preenriquecimiento a 100 ml de caldo Tetrationato (Müller Kauffmann). -Incubar a 43 ± 0,5ºC durante 18-24 h. -Transferir 10 ml del preenriquecimiento a 100 ml de caldo Selenito-Cistina. -Incubar a 37 ± 1ºC durante 18-24 h. d.3) Aislamiento en medio sólido A partir de cada uno de los enriquecimientos estriar una placa de agar Verde Brillante-Rojo Fenol (BPLS) y una de agar Bismuto Sulfito (son cuatro placas en total). -Incubar las placas invertidas a 37 ± 1ºC durante 20-24 h. -De ser necesario, seguir incubando los caldos de enriquecimiento 18-24 h más y volver a estriar en los medios de aislamiento. -Si al cabo del período de incubación el crecimiento en las placas fuera escaso, reincubar por 18-24 h adicionales a la misma temperatura. -Examinar las placas para investigar la presencia de colonias típicas de Salmonella. En agar BPLS, las colonias son rosadas y el medio circundante rojo brillante. En agar Bismuto Sulfito, las colonias típicas son marrones a negras con brillo metálico. Algunas cepas forman colonias verdosas. d.4) Identificación y confirmación -De cada placa seleccionar cinco colonias sospechosas. -Estriar en una placa de agar nutritivo para que desarrollen colonias aisladas. -Incubar a 37 ± 1ºC durante 18-24 h. -Al cabo de la incubación, seleccionar colonias aisladas para proseguir con las pruebas de confirmación bioquímica y serológica. A partir de cada cepa realizar: 1) Tinción de Gram. 2) Prueba de oxidasa. 3) TSI. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 4) LIA. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 5) Sembrar un tubo de caldo urea. Incubar a 37ºC, 24 h. 6) Prueba de la β-galactosidasa: a partir de un cultivo en agar inclinado, tomar un ansa bien cargada y emulsionarla en 0,2 ml de solución salina fisiológica hasta conseguir una suspensión densa. Colocar un disco de ONPG. Incubar a 37ºC durante 20 minutos. Observar hasta las 4 horas de incubación para dar un informe negativo. El color amarillo indica que la reacción es positiva. 7) Inocular un tubo de caldo triptona. Incubar 24 h a 37°C. 8) Inocular un tubo de caldo Clark y Lubs (RMVP). Incubar 24 h a 37°C. Resultados típicos de Salmonella spp. 1) Bacilo coco Gram negativo sin esporas 2) Oxidasa (-) 3) TSI: profundidad amarillo o negro, con o sin ruptura del agar por formación de gas/ superficie inclinada rojo o sin variación. Salmonella es lactosa (-), la mayoría de las cepas, y sacarosa (-), la mayoría de las cepas. 4) LIA: profundidad violeta o negro (negro en la mayoría de los casos)/ superficie inclinada violeta. Salmonella es lisina decarboxilasa (+). 5) Ureasa (-), sin cambio de color. 26 6) β-galactosidasa (-) sin cambio de color. (+) se manifiesta por la aparición de color amarillo. 7) Indol (-) 8) Voges Proskauer (-) De ser posible confirmar el resultado con un sistema de pruebas múltiples. d.5) Confirmación serológica -La misma se puede realizar de dos maneras diferentes: a. Aglutinación somática: -Preparación del antígeno: utilizar un cultivo de estrías de 24 h de incubación a 37°C. Suspender el crecimiento de la estría con 1ml de solución fisiológica. -Reacción: sobre lámina de vidrio depositar una gota de c/u de los 2 sueros polivalentes somáticos y los monovalentes. Colocar al lado de cada suero, una gota de suspensión antigénica. Mezclar con un ansa previamente flameada y enfriada. -Lectura: debe ser inmediata y no después de 5 minutos. Las reacciones tardías o dudosas no deben considerarse. b. Aglutinación flagelar: -Preparación del antígeno: a partir de una colonia de Salmonella, hacer un cultivo de 24 h en caldo. Luego agregar igual volumen de solución formolada al 5%. -Reacción: en distintos tubos de ensayos colocar una gota de cada uno de los sueros polivalentes y monovalentes ciliares. Agregar en cada uno 0,5 ml de la suspensión antigénica. Incubar en baño maría a 50°C. -Lectura: se efectuará al cabo de una hora de incubación. Debe considerarse únicamente la aglutinación de tipo ciliar (flóculos esponjosos, fácilmente disociables). Si una cepa de Salmonella (previamente confirmada por su aglutinación somática), no reacciona con ninguno de los sueros ciliares polivalentes hay que tener en cuenta que puede: a) Tratarse de una variante inmóvil. b) Presentar otro tipo de antígeno ciliar no incluido en la lista. -Emplear una cepa patrón de Salmonella para controlar los medios de cultivo y los medios empleados en las pruebas de confirmación e identificación. -Informar ausencia o presencia de Salmonella en la cantidad de muestra empleada en el análisis (25 g en nuestro caso). -Aclarar modificaciones y pruebas bioquímicas realizadas. e) Recuento de S. aureus (FIL 145:1990) Se recomienda realizar el recuento sembrando por duplicado cada dilución. En caso de requerir un inóculo más grande por un valor bajo del requisito microbiológico de aceptación, puede hacerse una siembra combinada de la siguiente forma: -Distribuir 1 ml de dilución 1/10 equitativamente en la superficie de tres placas de agar Baird Parker perfectamente secas. Distribuir con una espátula de Drigalsky cuidadosamente (tener la precaución de enfriar bien la espátula para no matar los microorganismos). -Dejar secar las placas tapadas sin invertir a temperatura ambiente por aproximadamente 15 minutos. Una vez secas, incubarlas invertidas a 37 ± 1ºC durante 24-48 h. -Tomar para enumerar, placas con no más de 150 colonias. Seleccionar un número representativo de colonias típicas y atípicas; y transferirlas a tubos de caldo infusión CerebroCorazón (BHI). -Incubar a 37°C o 35ºC durante 20 a 24 h. 27 Las colonias típicas son negras, brillantes y convexas rodeadas de una zona clara, generalmente un halo opaco rodea a la colonia por dentro de la zona clara. Identificación y confirmación Sobre los cultivos puros de 20-24 horas, realizar: - Tinción de Gram - Catalasa - Coagulasa (comparar con cepa patrón): Agregar 0,1 ml del cultivo a aproximadamente 0,3 ml de plasma de conejo reconstituido en un tubo estéril. Incubar a 35-37°C. Examinar después de 4 a 6 horas. El coágulo formado debe ser firme y organizado (3+) o que no se cae al invertir el tubo (4+). -Complementariamente puede realizarse la prueba de la termonucleasa sobre la misma placa de Baird Parker. S. aureus coagulasa positiva (3 o 4+) son cocos Gram positivos, catalasa y termonucleasa positivo. -Informar “UFC de S. aureus coagulasa positivo/g de muestra”. Para realizar el cálculo, contar el número total de colonias confirmadas en las tres placas. f) Recuento de mohos y levaduras (FIL 94 B: 1990) -Sembrar por duplicado 1 ml de por lo menos dos diluciones sucesivas en placas de Petri. -Agregar agar YGC (cloramfenicol-glucosa-extracto de levadura) fundido a 44-46ºC y mezclar para homogeneizar el inóculo en el agar. -Si el recuento esperado es bajo, puede realizarse un recuento combinado distribuyendo 10 ml de la dilución 1/10 en tres placas de Petri y agregando luego agar YGC de la misma forma que antes. -Dejar solidificar. Incubar sin invertir a 25 ± 1ºC durante 5 días. -Si se hizo el recuento por duplicado, contar las placas que contengan entre 10 y 150 colonias. -Si hay excesivo crecimiento contar la placa de mayor dilución aún cuando contenga menos de 10 colonias. -Si se hizo el recuento combinado, contar el número de colonias en las tres placas, el cual corresponde al número de hongos y levaduras en 1 g de muestra. Las colonias sospechosas o dudosas deben confirmarse por observación microscópica. -Informar el resultado como “UFC de mohos y levaduras/g de muestra”. 28 REQUISITOS MICROBIÓLOGICOS DEL CÓDIGO ALIMENTARIO ARGENTINO –MERCOSURHelados Art. 1078 (Res 2141, 5.9.83): Los distintos tipos de helados deberán responder a las siguientes exigencias microbiológicas: I. Helados de elaboración industrial: a) Ausencia de gérmenes patógenos. Esta exigencia se dará por no cumplida si el producto presenta: 1. Recuento de bacterias aerobias mesófilas (PCA, 30ºC, 72 h): >100000/g 2. Bacterias coliformes: >100/g 3. Bacterias coliformes fecales: >1/g 4. Staphylococcus aureus coagulasa positiva: >500/g 5. Salmonella: presencia en 50 g 6. (Res. 23, 30.01.95): “Cuando el recuento de hongos y levaduras supere 100/g sólo podrá recomendarse verificar las prácticas de elaboración y la calidad de las materias primas utilizadas, no siendo este indicador habilitante para declarar al producto “No Apto para el Consumo”. b) Ausencia de toxinas microbianas. II. Helados de elaboración artesanal: a) Ausencia de gérmenes patógenos. Esta exigencia se dará por no cumplida si el producto presenta: 1. Recuento de bacterias aerobias mesófilas (PCA, 30ºC, 72 h): >200000/g 2. Bacterias coliformes: >150/g 3. Bacterias coliformes fecales: <1/g 4. Staphylococcus aureus coagulasa positiva: >500/g 5. Salmonella: presencia en 50 g 6. (Res. 23, 30.01.95): “Cuando el recuento de hongos y levaduras supere 100/g sólo podrá recomendarse verificar las prácticas de elaboración y la calidad de las materias primas utilizadas, no siendo este indicador habilitante para declarar al producto “No Apto para el Consumo”. b) Ausencia de toxinas microbianas. 29 ANÁLISIS DE CARNES Y PRODUCTOS CÁRNICOS 1) Preparación de la muestra y diluciones (APHA 1992) -Pesar 10 g de la muestra, mezclar asépticamente, en una mezcladora esterilizada y añadir 90 ml de agua peptona 0,1%. -Agitar a la velocidad 15000-20000 rpm durante 2,5 minutos como máximo. -Mezclar el alimento homogeneizado, agitándolo; tomar 1 ml con una pipeta y verter en un tubo que contenga 9 ml de agua peptona 0,1%. -Homogeneizar cuidadosamente. -Preparar las diluciones sucesivas transfiriendo 1 ml a tubos conteniendo 1 ml de agua de dilución estéril. 2) Metodología de análisis a) Recuento de bacterias aerobias mesófilas b) Determinación de coliformes totales, coliformes fecales y Escherichia coli c) Recuento de Staphylococcus aureus coagulasa positiva d) Determinación de Salmonella e) Determinación de Listeria monocytogenes f) Determinación de Escherichia coli O157: H7 a) Recuento de bacterias aerobias mesófilas (ICMSF 1983) -Verter 1 ml de cada dilución por duplicado en placas de Petri y agregar el agar para recuento (APC) fundido y mantenido a aproximadamente 44-46ºC. -Mezclar para lograr una distribución homogénea. Siguiendo las mismas indicaciones, sembrar tres diluciones sucesivas. -Cuando las placas estén frías, invertir e incubar a 35 + 1ºC durante 48 h. -Contar las colonias y calcular el valor de recuento total siguiendo las pautas dadas en el capítulo de muestreo. -Seleccionar las placas con recuento entre 30 y 300 colonias, multiplicar el número promedio de colonias contadas en las placas por el factor de dilución correspondiente e informar como “UFC de bacterias aerobias mesófilas/g de muestra”. b) Enumeración de coliformes totales, coliformes fecales y Escherichia coli (FAO 1992) b.1) Prueba presuntiva -Inocular por triplicado 1ml de diluciones sucesivas de la muestra en tubos de fermentación con caldo Lauril Sulfato. Incubar a 35ºC durante 48 h. Se consideran positivos aquellos tubos que presenten formación de gas en la campanita de Durham. b.2) Confirmación de coliformes totales -Transferir una ansada de los tubos positivos del ensayo anterior a tubos con Caldo Verde Brillante Bilis 2% (BGB). -Incubar 24 h a 35ºC. Considerar positivos los tubos con producción de gas. -Calcular el NMP de coliformes totales/g. b.3) Confirmación de coliformes fecales -A partir de los tubos positivos en BGB inocular un tubo de fermentación de caldo EC. -Incubar 24 h a 45,5 + 0,2°C. La producción de gas en la campanita de Durham confirma coliformes fecales. En caso negativo reexaminar a las 48 h. -Registrar el número de tubos positivos de cada dilución. -Calcular el NMP de coliformes a fecales/g de muestra. 30 b.4) Confirmación de Escherichia coli -Estriar una ansada de los tubos positivos en EC en EMB. -Incubar 18-24 h a 35ºC. -Transferir colonias típicas a AN y efectuar ensayos de confirmación (IMViC y producción de gas de lactosa) o set de pruebas múltiples. -Calcular el NMP de Escherichia coli/g de muestra en base a los tubos de EC confirmados. c) Recuento de Staphylococcus aureus coagulasa positiva (APHA 1992) c.1) Siembra y aislamiento en medio sólido -Transferir 0,25 ml de la dilución adecuada a una placa de agar Baird Parker. -Realizar un duplicado. -Distribuir el inóculo con espátula de Drigalsky para obtener colonias aisladas. -Incubar a 35ºC durante 48 h. -Considerar las placas que contengan 20 y 200 colonias. -Seleccionar un número representativo de colonias sospechosas y transferirlas a tubos de caldo infusión-Cerebro-Corazón (BHI). -Incubar a 35ºC durante 24 h. El volumen y las diluciones empleadas dependen de la contaminación que se espere en la muestra. Incluso puede realizarse un recuento combinado sembrando un volumen mayor y repartido en varias placas. Recordar que no se recomienda sembrar más de 3 ó 4 ml por placa. c.2) Identificación y confirmación Sobre los cultivos puros de 24 h realizar: - Tinción de Gram - Catalasa - Coagulasa - Termonucleasa (en la misma placa de Baird - Parker) -Sembrar en paralelo una cepa patrón para comparar con un positivo. Para realizar los cálculos tener en cuenta las diluciones y las alícuotas sembradas. -Aclarar las modificaciones y pruebas bioquímicas realizadas. Informar “UFC de S. aureus coagulasa positiva/g de muestra”. d) Determinación de Salmonella (ISO 6579: 1993) d.1) Preenriquecimiento en medio líquido -Pesar asépticamente 25 g de muestra en un Erlenmeyer con 225 ml de agua peptona tamponada. -Agitar para homogeneizar. -Incubar a 37ºC durante 16-20 h. d.2) Enriquecimiento en medio líquido. -Transferir 0,1 ml de enriquecimiento a 10 ml de caldo Rappaport-Vassiliadis (RV). -Incubar a 42 ± 1ºC durante 18-24 h. -Transferir 1 ml del preenriquecimiento a 10 ml de caldo Selenito-Cistina. -Incubar a 36-38ºC durante 18-24 h. d.3) Aislamiento en medio sólido -A partir de cada uno de los enriquecimientos estriar una placa de agar Verde Brillante-Rojo Fenol (BPLS) y una de agar MLCB (Manitol-Lisina-Cristal Violeta-Verde Brillante). -Incubar las placas invertidas a 36-38ºC durante 20-24 h. -De ser necesario, seguir incubando los caldos de enriquecimiento 18-24 h más y volver a estriar en los medios de aislamiento. 31 -Si al cabo del período de incubación el crecimiento en las placas fuera escaso, reincubar por 18-24 h adicionales a la misma temperatura. -Examinar las placas para investigar la presencia de colonias típicas de Salmonella. En agar BPLS, las colonias son rosadas y el medio circundante rojo brillante. En agar MLCB, las colonias típicas son violetas y, a veces, con centro negro. d.4) Identificación y confirmación -De cada placa seleccionar cinco colonias sospechosas. -Estriar en una placa de agar nutritivo para que desarrollen colonias aisladas. -Incubar a 37 ± 1ºC durante 18-24 h. -Al cabo de la incubación, seleccionar colonias aisladas para proseguir con las pruebas de confirmación bioquímica y serológica. A partir de cada cepa realizar: 1) Tinción de Gram. 2) Prueba de oxidasa. 3) TSI. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 4) LIA. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 5) Sembrar un tubo de caldo urea. Incubar a 37ºC, 24 h. 6) Prueba de la β-galactosidasa: a partir de un cultivo en agar inclinado, tomar un ansa bien cargada y emulsionarla en 0,2 ml de solución salina fisiológica hasta conseguir una suspensión densa. Colocar un disco de ONPG. Incubar a 37ºC durante 20 minutos. Observar hasta las 4 horas de incubación para dar un informe negativo. El color amarillo indica que la reacción es positiva. 7) Inocular un tubo de caldo triptona. Incubar 24 h a 37°C. 8) Inocular un tubo de caldo Clark y Lubs (RMVP). Incubar 24 h a 37°C. Resultados típicos de Salmonella spp. 1) Bacilo coco Gram negativo sin esporas 2) Oxidasa (-) 3) TSI: profundidad amarillo o negro, con o sin ruptura del agar por formación de gas/ superficie inclinada rojo o sin variación. Salmonella es lactosa (-), la mayoría de las cepas, y sacarosa (-), la mayoría de las cepas. 4) LIA: profundidad violeta o negro (negro en la mayoría de los casos)/superficie inclinada violeta. Salmonella es lisina decarboxilasa (+). 5) Ureasa (-), sin cambio de color. 6) β-galactosidasa (-) sin cambio de color. (+) se manifiesta por la aparición de color amarillo. 7) Indol (-) 8) Voges Proskauer (-) De ser posible confirmar el resultado con un sistema de pruebas múltiples. d.5) Confirmación serológica -La misma se puede realizar de dos maneras diferentes: a. Aglutinación somática: -Preparación del antígeno: utilizar un cultivo de estrías de 24 h de incubación a 37°C. Suspender el crecimiento de la estría con 1ml de solución fisiológica. -Reacción: sobre lámina de vidrio depositar una gota de c/u de los 2 sueros polivalentes somáticos y los monovalentes. Colocar al lado de cada suero, una gota de suspensión antigénica. Mezclar con un ansa previamente flameada y enfriada. 32 -Lectura: debe ser inmediata y no después de 5 minutos. Las reacciones tardías o dudosas no deben considerarse. b. Aglutinación flagelar: -Preparación del antígeno: a partir de una colonia de Salmonella, hacer un cultivo de 24 h en caldo. Luego agregar igual volumen de solución formolada al 5%. -Reacción: en distintos tubos de ensayos colocar una gota de cada uno de los sueros polivalentes y monovalentes ciliares. Agregar en cada uno 0,5 ml de la suspensión antigénica. Incubar en baño maría a 50°C. -Lectura: se efectuará al cabo de una hora de incubación. Debe considerarse únicamente la aglutinación de tipo ciliar (flóculos esponjosos, fácilmente disociables) Si una cepa de Salmonella (previamente confirmada por su aglutinación somática), no reacciona con ninguno de los sueros ciliares polivalentes hay que tener en cuenta que puede: a) Tratarse de una variante inmóvil. b) Presentar otro tipo de antígeno ciliar no incluido en la lista. -Emplear una cepa patrón de Salmonella para controlar los medios de cultivo y los medios empleados en las pruebas de confirmación e identificación. -Informar ausencia o presencia de Salmonella en la cantidad de muestra empleada en el análisis (25 g en nuestro caso). -Aclarar modificaciones y pruebas bioquímicas realizadas. e) Determinación de Listeria monocytogenes (USDA, FSIS. Laboratory Communication Nº57, revised 1989) e.1) Enriquecimiento Enriquecimiento primario: -Colocar 25 ml (o g) de muestra en 225 ml de caldo UVM. Homogeneizar durante 2 minutos. -Incubar durante 20 a 24 horas a 30°C. Enriquecimiento secundario: -Transferir 0,1 ml del cultivo anterior a un tubo con 10 ml de caldo Fraser. -Incubar 26 + 2 horas a 35°C. -Comparar la coloración de los tubos incubados con uno sin sembrar. -Observar tubos oscurecidos o ennegrecidos por la hidrólisis de esculina. Si el tubo no muestra oscurecimiento se informa como "L. monocytogenes negativo". En caso de muestras sospechosas de haber causado enfermedad, debe continuarse el análisis estriando en agar de aislamiento y preincubando el caldo Fraser por otras 24 horas para realizar otro aislamiento. e.2) Aislamiento en medio sólido -A partir de los tubos oscurecidos estriar placas de agar MOX (*). -Incubar 24-48 horas a 35°C. Las colonias típicas están rodeadas de una zona negra por hidrólisis de la esculina. Complementariamente pueden emplearse otros ágares de aislamiento: - Agar MMA (Mc Bride Modificado): se incuba en condiciones anaeróbicas a 35°C durante 24-48 horas. Las colonias típicas aparecen azul-gris o gris verdoso observadas con iluminación de Henry con luz incidente a 45°. - Agar PALCAM: se incuba a 35°C durante 24-48 horas. Las colonias típicas son de color gris verdoso con halo negro-parduzco (por hidrólisis de la esculina), sobre fondo rojo (porque no fermenta manitol). 33 - Agar Oxford: se incuba durante 24-48 horas a 35°C. Las colonias típicas están rodeadas de una zona negra por hidrólisis de la esculina. (*) En el caso del agar MOX utilizar hisopo estéril para sembrar la mitad de la placa y estriar la otra mitad en ángulo recto. e.3) Selección de colonias y reestriado en agar de hemólisis -Picar sucesivamente 5 colonias sospechosas de agar MOX. -Estriar este inóculo en una placa de agar base sangre con sobrecapa del mismo agar con 0,4% de sangre de caballo (las placas deben ser finas para visualizar bien la hemólisis). -Incubar durante la noche a 35°C. -Examinar las placas con luz fluorescente. -Sostener la placa en ángulo recto a la luz fluorescente. -Seleccionar colonias típicas de Listeria monocytogenes: colonias translúcidas de 1 a 2 mm de diámetro con una delgada zona de β-hemólisis alrededor de la colonia y completo aclaramiento del medio por debajo. -Las colonias características bien aisladas se pican y se transfieren a un tubo de caldo BHI y a un tubo de agar para movilidad (alternativamente puede emplearse agar SIM) por punción con ansa recta. -Incubar durante la noche a 20-25°C. Sobre los cultivos ensayar: - Tinción de Gram - Catalasa - Movilidad típica: A) En agar, observar línea de siembra difusa con forma típica de sombrilla invertida. B) En caldo: por la gota pendiente o en fresco. Si se trata de una cepa bien aislada y pura, bacilo corto Gram positivo no formador de esporas, catalasa (+), de movilidad característica y hemolítica; se procede a la identificación. A partir de cultivos puros, realizar pruebas para diferenciar L. monocytogenes de las otras especies hemolíticas: - Camp Test - Fermentación de ramnosa - Fermentación de xilosa Camp Test Se realiza sobre una placa de agar sangre. Se inocula en forma de fina estría un cultivo fresco de Staphylococcus aureus y otra línea paralela de un cultivo fresco de Rhodococcus equi. En forma transversal se estrían, también como finas líneas y sin llegar a atravesar las estrías ya hechas, cepas de Listeria monocytogenes, L. seeligeri, L. ivanovii (las tres hemolíticas) y L. innocua (no hemolítica). Una reacción Camp positiva se observa por aumento de la hemólisis en la zona cercana a S. aureus o R. equi. 34 Resultados característicos: Especies L. monocytogenes L. seeligeri L. ivanovii Camp Test S. aureus R. equi + + -/+ + Xilosa Ramnosa + + + - Se pueden realizar las siguientes pruebas complementarias características de Listeria spp. - Hidrólisis de esculina (+) - Utilización de glucosa: medio O/F (+) - Fermentación de manitol (-) - Reducción de nitrato (-). - Rojo de Metilo-Voges Proskauer (+/+) - Oxidasa (+) f) Determinación de Escherichia coli 0157: H7 (USDA, FSIS. Laboratory Communication #38, revision 4) f.1) Enriquecimiento -Pesar 25 g en 225 ml de caldo EC modificado con novobiocina. -Agitar para homogeneizar. -Incubar a 35°C durante 18-24 horas. -Incluir por lo menos un control positivo por cada grupo de muestras ensayadas. El inóculo debe ser de aproximadamente 30-300 UFC por el volumen total de enriquecimiento. -Registrar todas las reacciones observadas en el control. f.2) Test de screening -Emplear dispositivos comerciales de ensayos rápidos para demostrar la presencia de cepas con antígeno O157 en el caldo de enriquecimiento (a). Para las muestras negativas se informa ¨ausencia de Escherichia coli O157: H7 en 25 gramos¨. Las muestras positivas se continúan analizando. f.3) Aislamiento en medios sólidos -Diluir el caldo de enriquecimiento positivo en (b) con diluyente fosfatado Butterfield´s. -Inocular placas de agar MSA-BCIG con 0,1 ml de diluciones 10-4, 10-5, 10-6 y 10-7. -Distribuir homogéneamente con espátula de vidrio. -Incubar a 42°C durante la noche. -Observar las placas de MSA-BCIG. Las colonias características de Escherichia coli O157: H7 son blancas (sorbitol negativas) y no son fluorescentes (β-glucuronidasa negativas). -Preparar un juego de PRS-MUG y EMB para cada muestra sospechosa. -Dibujar sobre el vidrio, en la parte de atrás de la placa, una grilla de 12 secciones y numerarlas. -Tomar aproximadamente 12 colonias sospechosas y estriar en la zona central de la sección de EMB y hacer una punción en la zona correspondiente de PRS-MUG. -Incubar las placas a 35°C durante la noche. -Examinar los pares de placas. -Continuar analizando solamente aquellos aislados que den colonias características en ambos medios. 35 Las colonias características de Escherichia coli O157: H7 resultan: Agar PRS-MUG: colonias sin cambio de color (color amarillo significa que fermentó sorbitol) y sin fluorescencia a la luz UV (β- glucuronidasa negativas). Agar EMB: colonias típicas de Escherichia coli: oscuras con o sin brillo metálico. f.4) Confirmación serológica de antígeno O157 -Las colonias que resultan sospechosas se ensayan para detectar el antígeno O157. -Se estudian las colonias que crecieron en PRS-MUG. -Se continúa la identificación para los aislados O157 positivos. f.5) Confirmación Se realizan las siguientes pruebas (reacción característica de Escherichia coli O157: H7) - TSI (amarillo/amarillo, H2S negativo) - Fermentación de sorbitol (negativo) - Fermentación de celobiosa (negativo) - Caldo triptona (indol positivo) - Medio RM-VP (RM: positivo; VP: negativo) - Citrato de Simmons (negativo)* - Lisina decarboxilasa (positivo)* - Ornitina decarboxilasa (positivo)* - Medio decarboxilasa base (negativo) - Medio movilidad (+/-) Todos los medios se incuban a 35°C. Los azúcares deben leerse a las 24 horas. *Los caldos decarboxilasa deben llevar un sello de vaselina. Los positivos son púrpura (medio básico por decarboxilación) y el negativo es amarillo (por acidificación por fermentación de la glucosa del medio). f.6) Serología de antígeno H7 -Sobre los aislados que hayan dado reacciones típicas de Escherichia coli O157: H7, realizar una prueba de aglutinación para H7. 36 REQUISITOS MICROBIOLÓGICOS DEL CÓDIGO ALIMENTARIO ARGENTINO -MERCOSURANEXO I Texto de los artículos 156 tris, 255 y 302 del Código Alimentario Argentino (según la modificación/ inclusión por la Resolución Conjunta SPyRS/ SAGPyA Nº 79/04 y 500/04) “Art 156 tris: Los productos preparados a base de carne picada, tales como chacinados frescos embutidos o no embutidos, y otras preparaciones a base de carne picada (albóndigas, empanadas, pasteles, arrollados o similares) precocidas o no, una vez cocidos y listos para consumir, ya sea que se dispensen inmediatamente después de finalizada la cocción, en el establecimiento elaborador o sean enviados a domicilio, deberán responder a las siguientes especificaciones microbiológicas: Criterio complementario Determinación Resultados Método de Análisis ICMSF o equivalente Microorganismos de los Recuento de aerobios mesófilos/g n=5 c=2 Alimentos- Vol I- Técnicas de m=104 M=105 análisis microbiológicos- Parte IIEnumeración de microorganismos aerobios mesófilos- Métodos de Recuento en Placa ICMSF o equivalente Recuento de coliformes/g n=5 c=2 m=100 M=500 Microorganismos de los Alimentos- Vol I- Técnicas de análisis microbiológicos- Parte IIBacterias coliformes ICMSF o equivalente Microorganismos de los E. coli/g Ausencia/g Alimentos- Vol I- Técnicas de análisis microbiológicos- Parte IIBacterias coliformes 37 ICMSF o equivalente Microorganismos de los Recuento de S. aureus n=5 c=1 Alimentos- Vol I- Técnicas de coagulasa +/g m<100 M=500 análisis microbiológicos- Parte IIS. aureus- Recuento de estafilococos coagulasa positiva Criterio obligatorio Determinación Resultados Método de Análisis USDA-FSIS Guía de Laboratorio de Microbiología- capítulo 5 – E. coli O157: H7/NM n=5 c=0 Detección, aislamiento e Ausencia/65 g identificación de E. coli O157:H7/NM en productos cárnicos o equivalente n=5 c=0 Salmonella spp. Ausencia/25 g Manual de Bacteriología Analítica de FDA (BAM) Capítulo 5 Salmonella o equivalente Podrán investigarse otros microorganismos cuando las circunstancias lo hicieran necesario. 38 “Art. 255: Con la designación de carne triturada o picada, se entiende la carne apta para consumo dividida finamente por procedimientos mecánicos y sin aditivo alguno. Debe prepararse en presencia del interesado salvo en aquellos casos en los que por la naturaleza del establecimiento o volumen de las operaciones sean autorizados expresamente por la autoridad competente. La carne picada fresca deberá responder a las siguientes especificaciones microbiológicas: Criterio complementario Determinación Resultados Método de Análisis ICMSF o equivalente Microorganismos de los Alimentos-Vol I- Técnicas de Recuento de aerobios n=5 c=3 análisis microbiológicos- Parte mesófilos/g m=106 M=107 II- Enumeración de microorganismos aerobios mesófilos- Métodos de Recuento en Placa ICMSF o equivalente Recuento de E. coli/g n=5 c=2 m=100 M=500 Microorganismos de los Alimentos- Vol I- Técnicas de análisis microbiológicos- Parte II- Bacterias coliformes ICMSF o equivalente Microorganismos de los Recuento de S. aureus n=5 c=2 coagulasa +/g m=100 M=1000 Alimentos- Vol I- Técnicas de análisis microbiológicos- Parte II- S. aureus- Recuento de estafilococos coagulasa positiva 39 Criterio obligatorio Determinación Resultados Método de Análisis USDA-FSIS Guía de Laboratorio de Microbiología- capítulo 5 – E. coli O157: H7/NM n=5 c=0 Detección, aislamiento e Ausencia/65 g identificación de E. coli O157:H7/NM en productos cárnicos o equivalente n=5 c=0 Salmonella spp. Ausencia/10 g Manual de Bacteriología Analítica de FDA (BAM) Capítulo 5 Salmonella o equivalente Podrán investigarse otros microorganismos cuando las circunstancias lo hicieran necesario” 40 “Art. 302: Se entiende por chacinados, los productos preparados sobre la base de carne y/o sangre, vísceras u otros subproductos animales que hayan sido autorizados para el consumo humano, adicionados o no con substancias aprobadas a tal fin. Los chacinados frescos deberán responder a las siguientes especificaciones microbiológicas: Criterio complementario Determinación Resultados Método de Análisis ICMSF o equivalente Microorganismos de los AlimentosVol I- Técnicas de análisis Recuento de aerobios n=5 c=3 mesófilos/g m=106 M=107 microbiológicos- Parte II- Enumeración de microorganismos aerobios mesófilos- Métodos de Recuento en Placa ICMSF o equivalente Recuento de E. coli/g Microorganismos de los Alimentos- n=5 c=2 m=100 M=500 Vol I- Técnicas de análisis microbiológicos- Parte IIBacterias coliformes ICMSF o equivalente Microorganismos de los Alimentos- Recuento de S. aureus n=5 c=2 Vol I- Técnicas de análisis coagulasa +/g m=100 M=1000 microbiológicos- Parte II-S. aureusRecuento de estafilococos coagulasa positiva 41 Criterio obligatorio Determinación Resultados Método de Análisis USDA-FSIS Guía de Laboratorio de Microbiología- capítulo 5 – E. coli O157: H7/NM n=5 c=0 Detección, aislamiento e Ausencia/65 g identificación de E. coli O157:H7/NM en productos cárnicos o equivalente n=5 c=0 Salmonella spp. Ausencia/10 g Manual de Bacteriología Analítica de FDA (BAM) Capítulo 5 Salmonella o equivalente Podrán investigarse otros microorganismos cuando las circunstancias lo hicieran necesario 42 43 SE.NA.SA COAGULASA + Escherichia coli Salmonella sp. Staphylococcus aureus LEVADURAS LACTOBACILOS FLORA MICOTICA TOTAL Bacillus cereus AEROBIOS MESOFILOS ENTEROBACTERIAS COLIFORMES ESTREPTOCOCOS GRUPO D CLOSTRIDIOS SULFITOREDUCTORES (Decreto 42.38/68) 20 col/g No considerar No considerar 200 col/g 100 col/g Ausente en 0.1 g Ausente en 25 g < 100 col/ g No considerar No considerar 600 col /g 500 col/g Ausente en 0,1 g Ausente en 25 g < 100 col/ g 100 col/g 100 col/ g 20 col/ g 500.000 col/ g 200 col/g 100 col/g 800.000 col/ g 500 col/ g 200 col/ g < 100 col/ g No considerar No considerar 200 col/g 100 col/g Ausente en 0.1 g Ausente en 25 g 20 col/g 100 col/g Crustáceos escaldados Moluscos valvados Pescados, moluscos no valvados, y crustáceos crudos 1.000.000 col/g 200 col/g 100 col/ g PRODUCTOS DE LA PESCA < 100 col/ g No considerar No considerar 1100 col/ g 1000 col/ g Ausente en 0.1 g Ausente en 25 g 20 col/g No considerar 1.000.000 col/g 500 col/ g 300 col/ g Vacuna < 100 col/ g No considerar No considerar 1100 col/g 1000 col/ g Ausente en 0.1 g Ausente en 25 g 20 col/g No considerar 1.000.000 col/g 1000 col/ g 500 col/ g Porcina MATERIAS PRIMAS < 100 col/ g No considerar No considerar 1100 col/g 1000 col/ g Ausente en 0.1 g Ausente en 25 g 100 col/g 5000 col /g 5.000.000 col/ g 10.000 col/g 5000 col /g Tripas naturales 44 No considerar* 2.000 col/ g 1.000 col/ g 200.000 col /g 50 col/ g 30.000.000 col/ g 25.000 col/ g 10.000 col/ g 10.000 col/ g 100 col/ g 1.100 col/ g No considerar Sin límite Ausente en 0.1 g Ausente en 25 g < 100 col/ g 2.200 col/ g 2.000 col/ g Ausente en 0,1 g Ausente en 25 g < 100 col/ g < 100 col/ g 1.000 col/ g Ausente en 0.1 g Ausente en 25 g 400 col/ g Sin límite 20 col/ g 100 col/ g 800.000 col/ g 200 col/ g 100 col/ g Bondiola, jamón crudo, panceta, pastrón, etc. Salazones secas 400 col/ g Sin límite No considerar No considerar Salame, salamín, longaniza, chorizos españoles, etc. Chorizos, salchichas y longanizas parrilleras. Embutidos frescos Embutidos secos *Debe predominar la flora de maduración COAGULASA + Escherichia coli Salmonella sp. Staphylococcus aureus LEVADURAS LACTOBACILOS FLORA MICOTICA TOTAL Bacillus cereus AEROBIOS MESOFILOS ENTEROBACTERIAS COLIFORMES ESTREPTOCOCOS GRUPO D CLOSTRIDIOS SULFITOREDUCTORES SE.NA.SA (Decreto 42.38/68) < 100 col/ g 1.000 col/ g Ausente en 0.1 g Ausente en 25 g 1.100 col/ g 400 col/ g No considerar 20 col/ g 100 col/ g 10.000 col/ g 200 col/ g 100 col/ g < 100 col/ g 100 col/ g Ausente en 0.1 g Ausente en 25 g 200 col/ g 400 col/ g No considerar 20 col/ g 100 col/ g < 100 col/ g 100 col/ g Ausente en 0.1 g Ausente en 25 g 200 col/ g 400 col/ g No considerar 20 col/ g 100 col/ g Salchicha tipo Viena, Extracto de carne, salchichón, gelatina. mortadela, morcilla, matambre, etc. 10.000 col/ g 10.000 col/ g 200 col/ g 100 col/ g 100 col/ g 100 col/ g Jamón, paleta, lomo de cerdo cocido. Subproductos comestibles Chacinados cocidos Salazones húmedas ANÁLISIS MICROBIOLÓGICO DE CONSERVAS ALTERADAS (APHA 1992) 1) Preparación de las latas -Sacar las etiquetas y guardarlas; numerar las latas del lado que no se va a abrir. -Registrar los datos del envase; pesar la lata y comparar con lo indicado. -Examinar el exterior en busca de fallas de suturas, fugas, abolladuras, corrosión, etc. -Lavar con agua y jabón, enjuagar bien y secar. 2) Apertura de las latas a) Latas abombadas: deben tomarse precauciones para evitar proyecciones del contenido al perforar la lata. Se recomienda enfriarlas previamente durante unas horas. -Desinfectar la tapa bañándola con una solución de hipoclorito 2% durante 15 minutos; retirar el exceso y secar con toalla estéril, o en flujo laminar. “No flamear”. -Colocar la lata dentro de un recipiente con un poco de hipoclorito de sodio al 2% y cubrirla con un embudo de vidrio cuyo vástago esta cerrado con algodón, a través del cual pasa una varilla puntiaguda o punzón (todo el conjunto esterilizado). -Perforar el centro de la lata con un golpe seco del punzón, y de ser posible, recoger el gas que emana con un tubo invertido. -Retirar el embudo cuando las presiones se hayan igualado y abrir la lata en forma normal con un abrelatas estéril. -Cubrir la superficie con una placa de Petri estéril. b) Latas no abombadas: -Desinfectar con hipoclorito 2% durante 15 minutos; retirar el exceso y flamear hasta sequedad. -Abrir con abrelatas estéril y cubrir con una placa de Petri estéril. 3) Toma de material La técnica utilizada para obtener material y el punto de donde hay que tomarlo varían según la naturaleza del producto. - líquidos: con pipeta estéril, sembrando directamente en los medios de cultivo. - semilíquidos: con pipeta de boca ancha, sembrando directamente en los medios de cultivo o diluyendo con agua estéril. - sólidos en líquidos: tomar de ambas partes; 10 ml del líquido con pipeta estéril y 10 g de sólido con espátula estéril. - sólidos: con espátula estéril o con sacabocados estéril, descargándolo con ayuda de una varilla de vidrio flameada. Los líquidos y semilíquidos se siembran directamente en los medios, a razón de 1-2 ml cada 10 ml de medio. Los sólidos se transfieren a un recipiente estéril de boca ancha de 100 ml, que contiene 50 ml de agua destilada estéril. Se agita para homogeneizar. Se recomienda guardar parte de la muestra para repetir análisis en caso necesario. 4) Examen del contenido -Registrar el olor y aspecto del alimento y compararlos con las características del producto normal. -Medir el pH. 45 5) Examen microscópico -Tomar material con un ansa y hacer un extendido, secarlo, fijarlo y colorearlo con cristal violeta. -Si el alimento es graso, enjuagar con xilol luego de fijarlo. -Si se dispone de microscopio de contraste de fases, realizar un montaje húmedo, de una ansada del material con agua, cubrir con cubre-objetos y observar. 6) Cultivo (Todas las determinaciones se efectúan por duplicado) 6.a) Alimentos de pH mayor que 4,6 Microorganismos aerobios -Sembrar 2 placas de agar triptona-glucosa (GTA), por estría, incubándolas 4 días a 30-35°C y a 55°C respectivamente. -También pueden utilizarse tubos con caldo triptona-glucosa (GTB), sembrando 1 ml o 1 g del alimento. Microorganismos anaerobios -Tomar 2 tubos de medio PE-2 o carne cocida (CMM), calentar en baño María 20 minutos, enfriar y sembrar 1 g o 1 ml del alimento sin burbujear. -Sellar uno de ellos con Vas-par (vaselina- parafina 50-50%) e incubarlo hasta 10 días a 35°C. -Sellar el otro con agar al 2,5 % fundido. -Dejar solidificar y llevar a baño de 55°C para preincubar. -Luego incubar en estufa de 55°C, 4 días. La marcha continúa según se indica en el esquema de la página siguiente. 6.b) Alimentos de pH menor que 4,6 Microorganismos aerobios -Sembrar 2 placas de agar termoacidurans (TAA), por estría e incubarlas a 35 y 55°C respectivamente. -O bien sembrar 2 tubos de caldo suero de naranja (OSB) con 1g o 1 ml del alimento e incubarlos 4 días a dichas temperaturas. Microorganismos anaerobios -Fundir el agar termoacidurans (TAD) en tubos, enfriar a 45°C y sembrar 1 ml del alimento al fondo sin burbujear. -Dejar solidificar e incubar 5 días a 30-35°C. Hongos -Sembrar por estría una placa de agar para recuento de hongos. -Incubar 5-7 días a 28°C. 46 ANÁLISIS MICROBIOLÓGICO DE CONSERVAS DE BAJA ACIDEZ MARCHA AEROBIA MUESTRA GTA /GTB Aerobiosis 30 – 35°C (hasta 4 días) crecimiento + 55°C (hasta 4 días) crecimiento + Cultivo mixto Bacilos, cocos, hongos y levaduras Indica contaminación post-proceso NAMn 55°C (hasta 10 días) crecimiento + Solo bacilos NAMn 30-35ºC (hasta 10 días) crecimiento + Esporas + Shock térmico 80ºC 10min Esporas + Esporas – NAMn 30-35ºC 4 días Crecimiento + Bacillus sp. mesófilo Proceso térmico insuficiente 55°C 4 días Crecimiento + Bacillus sp. termófilo Enfriado insuficiente o temperatura muy alta de almacenamiento Crecimiento + a 30 y 55°C Bacillus sp. termófilo facultativo 47 Esporas - ANÁLISIS MICROBIOLÓGICO DE CONSERVAS DE BAJA ACIDEZ MARCHA ANAEROBIA MUESTRA PE-2 o CMM Anaerobiosis 30- 35ºC (hasta 10 días) Crecimiento + 55ºC (hasta 4 días) Cultivo mixto: cocos, bacilos, hongos y levaduras Posible contaminación post- proceso Bacilos con esporas Bacilos sin esporas Indica posible contaminación post- proceso LVA 30- 35ºC 4 días Aerobiosis Crecimiento + Bacillus sp. mesófilo Crecimiento + Anaerobios termófilos o formadores de SH2 Indica insuficiente enfriamiento o temperatura de almacenamiento muy alta Anaerobiosis Crecimiento + Clostridium sp. mesófilo* Posible inadecuado proceso térmico Crecimiento + Aerobiosis y anaerobiosis Cultivo puro Anaerobio facultativo * Buscar toxina botulínica en el cultivo Cultivo mixto* 48 MÉTODO DE CÁMARA DE HOWARD PARA RECUENTO DE FILAMENTOS DE HONGOS EN CONSERVAS (AOAC 984.29, 1990) 1) Recuentos de hongos en conservas de tomate -Por ser los tomates de naturaleza ácida, es más fácil preparar sus conservas que las de otros alimentos. -Los tiempos y temperaturas de calentamiento son relativamente bajos. -Si el productor emplea tomates sanos, se obtiene un producto de alta calidad que llena los requisitos estipulados por las reglamentaciones, pero si no lo son y hay crecimiento fúngico en ellos, el producto no resulta de buena calidad. -El recuento de mohos en cámara de Howard es una forma de conocer la calidad de los productos terminados. Por este método se determina microscópicamente el porcentaje de campos que contienen filamentos de hongos en una muestra de conservas de tomates. 2) Materiales -Se emplea un portaobjetos especial en el centro consta de un rectángulo de 15 x 20 mm que está limitado a cada lado por depresiones y soportes paralelos. Estos están 0,1 mm más altos que el rectángulo el cubre objeto queda apoyado sobre estas barras. El rectángulo, los soportes y el cubreobjetos tienen superficies planas. -Para facilitar la calibración del microscopio, el rectángulo tiene dos líneas paralelas separadas a 1,382 mm. -Para el recuento de mohos el campo del microscopio debe tener 1,5 mm2 (una circunferencia de 1,382 mm de diámetro) y debe utilizarse una magnificación comprendida entre 90 y 125 aumentos totales (Fig. 1). 3) Preparación de la muestra -Tratándose de jugo de tomate o de salsa ketchup la muestra es examinada tal como viene en el envase. -Pesar 20 g de muestra y colocarlo en un vaso de precipitados. -Agregar 50 ml de agua estéril y mezclar. -En el caso de puré o pasta de tomates se agrega agua para obtener 8,37%-9,37% de sólidos totales, lo cual puede verificarse midiendo el índice de refracción a 20°C (1,3447-1,3460). -Para facilitar la observación microscópica se recomienda usar como diluyente un colorante que se prepara de la siguiente forma: disolver 0,1 g de azul de algodón en 100 ml de lactofenol (partes iguales de fenol, glicerina ácido láctico y agua). -No se colorean los protoplasmas viejos, pero si los elementos anatómicos del tomate. -Debe limpiarse la cámara de Howard de modo que se produzcan anillos concéntricos con los colores del arco iris, los cuales se pueden observar sosteniendo el portaobjetos en un ángulo tal que la luz se refleje sobre el cubreobjetos. -Los anillos de Newton se deben a la descomposición de la luz cuando se adosan perfectamente dos cristales de superficies pulidas. -Sobre el portaobjetos se coloca una porción de la muestra bien homogeneizada, de modo tal que cubra exactamente el centro y cuyo espesor sea suficiente para llenar completamente el espacio existente entre porta y cubreobjetos. -Es necesario evitar derrames laterales y en el preparado no deben quedar burbujas de aire. -La iluminación debe ser normal ya que demasiada luz impide una observación adecuada. -La preparación se lleva al microscopio y se observan 25 campos normalizados. -Para tal fin con el objetivo de 10 aumentos se regula el ocular adecuado (8x, 10x, 12x) de forma tal que las dos líneas paralelas grabadas en el portaobjetos sean tangentes al campo. -Dicho campo normalizado tiene un diámetro de 1,382 mm y una superficie de 1,5 mm2. 49 -Los 25 campos deben observarse de modo tal que el resultado obtenido sea representativo del total del preparado (método oficial). -La distribución de campos ideal corresponde a la Figura 2. -Se deben examinar por lo menos dos preparados. -Cada campo se observa anotando la ausencia o presencia de filamentos fúngicos; cuando la identificación es difícil se usa un aumento de 200x. -Debe usarse el tornillo micrométrico para observar filamentos en todos los planos del preparado. -En el caso de observarse filamentos cortos, se consideran positivos aquellos campos en los cuales la longitud agregada de no más de tres filamentos exceda 1/6 del diámetro del campo. 4) Cálculo Se informa el porcentaje de campos positivos de la muestra. 4.1) Reglamentación bromatológica En las conservas de tomate se establecen las siguientes tolerancias en el recuento de filamentos en cámara de Howard (EE.UU.y Canadá): A-Los jugos de tomate examinados, no deben tener más del 25% de campos positivos. B-Las latas de tomates, ketchup, los purés de tomates, no deben superar el 60% de campos positivos. 4.2) Reglamentación Bromatológica Nacional Todas las muestras de conservas de tomates (jugos, salsas, puré, extracto, ketchup) examinadas al microscopio por el método de Howard diluidas de tal manera que contengan 8,37%-9,37% de residuo sólido, no acusarán más del 50% de campos con filamentos de hongos. Figura 1 Figura 2 50 ANÁLISIS MICROBIOLÓGICO DE AZÚCAR Tan pronto se estableció que el azúcar puede contener bacterias, levaduras y hongos, que al proliferar pueden producir deterioro en los alimentos enlatados y en las bebidas sin alcohol en que se usa, se desarrollaron métodos adecuados para su recuento. Análisis de azúcar para productos enlatados Los laboratorios de la National Canners Association de USA pusieron a punto una serie de ensayos, que, junto con otros, nos permiten reconocer la calidad del azúcar que se examina. 1) Muestreo -Tomar muestras de 250 g de 5 bolsas de cada lote. Estas muestras deben enviarse al laboratorio en envases limpios y cerrados. 2) Preparación de las muestras -Colocar 20 g del azúcar en un erlenmeyer estéril de 150 ml marcado al nivel de 100 ml. -Agregar agua estéril hasta la marca, llevar rápidamente a ebullición y mantenerla por 5 minutos. -Reemplazar el agua evaporada por agua estéril. 3) Metodología de análisis a) Esporas del “flat sour “o fermentación simple b) Recuento total de esporas termófilas c) Termófilos anaerobios que no producen SH2 d) Termófilos anaerobios que producen SH2 a) Esporas del “flat sour “o fermentación simple -Utilizar 5 placas de Petri y pipetear en cada una 2 ml de la solución hervida del azúcar. -Cubrir y mezclar el inóculo con agar triptona glucosa. -Incubar las placas a 55°C durante 48 h. -El recuento combinado de las 5 placas representa el número de esporas en 2 g de azúcar original. Se multiplica esta cuenta por 5 para expresar los resultados como: “Nº de esporas/10 g de azúcar”. -Las esporas del “flat sour” son características: circulares y miden de 2 a 5 mm de diámetro. Tienen un centro típico opaco y debido a la producción de ácido, en presencia del indicador, habitualmente están rodeadas de un halo amarillo. Este halo puede ser insignificante y aún faltar en algunos tipos que producen muy poca acidez. Las colonias sub-superficiales aparecen como colonias puntiformes. Cuando las cajas tienen un exceso de colonias y no pueden contarse las colonias típicas del “flat-sour” se hará una segunda placa usando una dilución mayor. Para fines prácticos basta hacer notar que los recuentos de las muestras están por encima del estándar exigido. b) Recuento total de esporas termófilas El recuento total de esporas termófilas se hace a partir de las mismas placas de Petri. El cálculo se hace en la misma forma que para las esporas del “flat sour” incluyendo todas las esporas visibles. 51 c) Termófilos anaerobios que no producen SH2 -Dividir 20 ml de la solución del azúcar en 6 porciones aproximadamente iguales y sembrarlas en 6 tubos de caldo hígado. -Estratificar el medio con agar triptona. -Solidificar el medio inmediatamente por inmersión parcial en agua fría. -Cuando se ha solidificado el medio precalentar a 55°C e incubar a esta temperatura por 48 h. -En estas condiciones se produce rotura del agar y formación de ácido. A veces se produce olor a queso. -Es un método cualitativo con una aproximación cuantitativa lejana. -Los resultados se expresan como + o -. Por ejemplo: +++, ---. d) Termófilos anaerobios que producen SH2 -Entre ellos predomina el Clostridium nigrificans. -Se dividen otros 20 ml de la solución del azúcar en 6 porciones aproximadamente iguales y se las siembra en agar sulfito. -Los tubos deben ser hervidos por 5 minutos antes de la siembra y enfriados a 55°C. -Se incuban a esa temperatura durante 48-72 h. -El medio debe estar sólido antes de llevarlo a la estufa. -Los microorganismos característicos se ponen de manifiesto por formación de áreas negras típicas. Se las cuenta en los 6 tubos y multiplica el dato por 2,5; expresando el resultado como “Nº de esporas de bacterias productoras de SH2 en 10 g de azúcar”. Normas aceptadas por la National Canners Association para usar en productos enlatados 1) Recuento total de esporas termófilas: De 5 muestras de un lote de azúcar ninguna debe tener más de 150 esporas en 10 g y el promedio de las muestras no debe ser superior a 125 esporas en 10 g. 2) Esporas del “flat sour”: De 5 muestras ninguna debe tener más de 75 esporas en 10 g y el promedio para todas las muestras no debe ser superior a 50 esporas en 10 g. 3) Esporas termófilas anaerobias: No más de 3 de las 5 muestras contendrán de estas esporas (60%) y de cada muestra no deberá haber más de 4 tubos + de cada 6 (65 %). 4) Esporas de alteración sulfhídrica: No deberá haber más de 2 muestras + sobre las 5 muestras y cada muestra no deberá dar más de 5 colonias en 10 g (equivalente a 2 colonias por cada 6 tubos). 52 Análisis del azúcar para bebidas sin alcohol Teniendo en cuenta la flora más corriente en el azúcar industrial, The American Bottlers of Carbonated Beverages (1953) de USA estableció el siguiente procedimiento de análisis: 1) Preparación de las muestras: -Colocar 100 g del azúcar en un erlenmeyer de 250 ml, que contenga 102,5 ml de agua destilada estéril. Se deja disolver el azúcar. 2) Metodología de análisis 2.a) Bacterias mesófilas -Pipetear 2,1 ml de la solución en cada una de dos placas de Petri. -Cubrir y mezclar el inóculo con aproximadamente 12-14 ml de agar nutritivo. -Incubar las placas durante 48 h a 30 °C. -Finalizado ese lapso el recuento combinado en ambas placas representa el número de bacterias en aproximadamente 2,5 g del azúcar original. El resultado se expresa por 10 g de azúcar. 2.b) Levaduras y mohos -Pipetear 2,1 ml de la solución de azúcar antes preparada en cada una de 4 placas de Petri. -Cubrir mezclando con 12-14 ml de agar para recuento de mohos ajustado a pH 4,5-4,8 con ácido láctico 10 % justo antes de su uso. -Incubar las placas a 30°C durante 2 a 3 días. Al final de ese lapso el recuento combinado de colonias desarrolladas en la placa representa el número de levaduras y mohos en aproximadamente 5 g de azúcar original. Se expresan los resultados por 10 g de azúcar. Normas aceptadas por The American Bottlers of Carbonated Beverages 1) Bacterias mesófilas 200/10g 2) Levaduras 10/10g 3) Mohos 10/10g 53 ANÁLISIS MICROBIOLÓGICO DE ALIMENTOS DESHIDRATADOS 1. Preparación de la muestra y diluciones -Pesar asépticamente 10 g del alimento en un Erlenmeyer con 90 ml de agua peptona 0,1% estéril y homogeneizar bien. -Tomar con pipeta estéril 1 ml de esta primera dilución y pasar a un tubo con 9 ml de agua peptona 0,1% para obtener la dilución 1/100. -De ser necesarias más diluciones, realizarlas en tubos conteniendo 9 ml de agua peptona 0,1%. 2) Metodología de análisis a) Recuento de bacterias aerobias mesófilas b) Recuento de coliformes totales c) Recuento de Clostridium perfringens d) Determinación de Salmonella e) Recuento de Staphylococcus aureus coagulasa positiva f) Determinación de Bacillus cereus a) Recuento de bacterias aerobias mesófilas -Verter 1 ml de cada dilución por duplicado en placas de Petri y agregar el agar para recuento (APC) fundido y mantenido a aproximadamente 44-46ºC. -Mezclar para lograr una distribución homogénea. -Invertir las placase incubar a 37 ºC durante 48 h. -Contar las colonias y calcular el valor de recuento total siguiendo las pautas dadas en el capítulo de muestreo. -Seleccionar las placas con recuento entre 30 y 300 colonias, multiplicar el número promedio de colonias contadas en las placas por el factor de dilución correspondiente e informar como “UFC de bacterias aerobias mesófilas/g de muestra”. b) Recuento de coliformes totales b1) Medio líquido Medio de cultivo: caldo verde brillante 2% de Sales Biliares o caldo Mc Conkey. -Como trabajo de rutina se usan 2 tubos por cada dilución. Si fuera necesaria más precisión, realizar el NMP usando series de 5 tubos. Sembrar: 2 tubos con 10 ml de la dilución 1/10 (1 g) en caldo doble concentración. 2 tubos con 1 ml de la dilución 1/100 (0,1 g) en caldo simple concentrado. 2 tubos con 1 ml de la dilución 1/100 (0,01 g) en caldo simple concentrado. -Incubar a 37°C durante 48 h. -Anotar el número de tubos positivos y calcular el número de bacterias coliformes por gramo de producto empleando las tablas de NMP. b2) Recuento en placa Medio de cultivo: agar bilis rojo violeta (ABRV). -Sembrar dos placas de la dilución 1/10 y dos placas de la dilución 1/100 agregando una sobrecapa del agar al medio solidificado. -Incubar 24 h a 35°C. -Calcular el número de bacterias coliformes por gramo de producto. 54 c) Recuento de Clostridium perfringens c.1) Siembra y aislamiento -Sembrar 1 ml de la dilución 1/10 en el fondo de dos bolsitas plásticas. -Volcar a través del cuello de cada una 30 ml de agar TSN. -Homogeneizar bien el inóculo rotando la bolsita mientras se mantiene presionado el cuello. -Dejar solidificar el agar en un separador. -Incubar a 37°C durante 24 h. -Sembrar en placas de Petri e incubar en anaerobiosis. -También puede realizarse por NMP en forma similar al recuento de anaerobios sulfito reductores realizado en el análisis de carnes y productos cárnicos. c.2) Identificación y confirmación -Pasar un número representativo de colonias sulfito reductoras a tubos con 10 ml de caldo tioglicolato. -Incubar 24 h a 37°C observando si hay crecimiento vigoroso entre 4 y 6 horas con producción de abundante gas. -A partir de tubos con buen crecimiento realizar: a) Tinción de Gram. b) Licuación de la gelatina en tubos con discos de gelatina-carbón: Sembrar 0,2 ml en el fondo de los tubos conteniendo el medio previamente de aireado e incubar 18 h a 37°C. c) Movilidad y reducción de nitrato-movilidad-bufferado: Sembrar por punción e incubar durante 24 h a 37°C. d) Fermentación de la lactosa en medio para fermentación de azúcares: Sembrar 0,2 ml en el fondo de tubos previamente de aireados e incubar a 37°C durante 24 h. -Informar como “UFC/g de muestra o NMP/g de muestra” de acuerdo a la técnica empleada. -Tener en cuenta para los cálculos, las diluciones empleadas y el número de colonias confirmadas. d) Determinación de Salmonella d.1) Preenriquecimiento en medio líquido -Pesar asépticamente 25 g de muestra en un Erlenmeyer con 225 ml de agua peptonada tamponada. -Agitar para homogeneizar. -Incubar a 37ºC durante 16-20 h. d.2) Enriquecimiento en medio líquido -Transferir 1 ml de caldo de pre-enriquecimiento a 10 ml de caldo Tetrationato (Müller Kauffmann). -Incubar a 42,5-43,5ºC durante 18-24 h. -Transferir 1 ml de caldo de pre-enriquecimiento a 10 ml de caldo Selenito-Cistina. -Incubar a 36-38ºC durante 18-24 h. d.3) Aislamiento en medio sólido -A partir de cada uno de los enriquecimientos estriar una placa de agar Xilosa-LisinaDecarboxilasa (agar XLD) y una de agar Bismuto Sulfito. -Incubar las placas invertidas a 36-38ºC durante 20-24 h. -De ser necesario, seguir incubando los caldos de enriquecimiento 18-24 h más y volver a estriar en los medios de aislamiento. 55 -Si al cabo del período de incubación el crecimiento en las placas fuera escaso, reincubar por 18-24 h adicionales a la misma temperatura. -Examinar las placas para investigar la presencia de colonias típicas de Salmonella. -En agar XLD, las colonias son rojas y con centro negro en la mayoría de los casos. -En agar Bismuto sulfito las colonias son marrones a negras con brillo metálico. d.4) Identificación y confirmación -De cada placa seleccionar cinco colonias sospechosas. -Estriar en una placa de agar nutritivo para que desarrollen colonias aisladas. -Incubar a 37 ± 1ºC durante 18-24 h. -Al cabo de la incubación, seleccionar colonias aisladas para proseguir con las pruebas de confirmación bioquímica y serológica. A partir de cada cepa realizar: 1) Tinción de Gram. 2) Prueba de oxidasa. 3) TSI. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 4) LIA. Sembrar por punción y en superficie. Incubar a 37ºC, 24 h. 5) Sembrar un tubo de caldo urea. Incubar a 37ºC, 24 h. 6) Prueba de la β-galactosidasa: a partir de un cultivo en agar inclinado, tomar un ansa bien cargada y emulsionarla en 0,2 ml de solución salina fisiológica hasta conseguir una suspensión densa. Colocar un disco de ONPG. Incubar a 37ºC durante 20 minutos. Observar hasta las 4 horas de incubación para dar un informe negativo. El color amarillo indica que la reacción es positiva. 7) Inocular un tubo de caldo triptona. Incubar 24 h a 37°C. 8) Inocular un tubo de caldo Clark y Lubs (RMVP). Incubar 24 h a 37°C. Resultados típicos de Salmonella spp. 1) Bacilo coco Gram negativo sin esporas 2) Oxidasa (-) 3) TSI: profundidad amarillo o negro, con o sin ruptura del agar por formación de gas/ superficie inclinada rojo o sin variación. Salmonella es lactosa (-), la mayoría de las cepas, y sacarosa (-), la mayoría de las cepas. 4) LIA: profundidad violeta o negro (negro en la mayoría de los casos)/superficie inclinada violeta. Salmonella es lisina decarboxilasa (+). 5) Ureasa (-), sin cambio de color. 6) β-galactosidasa (-) sin cambio de color. (+) se manifiesta por la aparición de color amarillo. 7) Indol (-) 8) Voges Proskauer (-) De ser posible confirmar el resultado con un sistema de pruebas múltiples. d.5) Confirmación serológica -La misma se puede realizar de dos maneras diferentes: a. Aglutinación somática: -Preparación del antígeno: utilizar un cultivo de estrías de 24 h de incubación a 37°C. Suspender el crecimiento de la estría con 1ml de solución fisiológica. 56 -Reacción: sobre lámina de vidrio depositar una gota de c/u de los 2 sueros polivalentes somáticos y los monovalentes. Colocar al lado de cada suero, una gota de suspensión antigénica. Mezclar con un ansa previamente flameada y enfriada. -Lectura: debe ser inmediata y no después de 5 minutos. Las reacciones tardías o dudosas no deben considerarse. b. Aglutinación flagelar: -Preparación del antígeno: a partir de una colonia de Salmonella, hacer un cultivo de 24 h en caldo. Luego agregar igual volumen de solución formolada al 5%. -Reacción: en distintos tubos de ensayos colocar una gota de cada uno de los sueros polivalentes y monovalentes ciliares. Agregar en cada uno 0,5 ml de la suspensión antigénica. Incubar en baño maría a 50°C. -Lectura: se efectuará al cabo de una hora de incubación. Debe considerarse únicamente la aglutinación de tipo ciliar (flóculos esponjosos, fácilmente disociables) Si una cepa de Salmonella (previamente confirmada por su aglutinación somática), no reacciona con ninguno de los sueros ciliares polivalentes hay que tener en cuenta que puede: a) Tratarse de una variante inmóvil. b) Presentar otro tipo de antígeno ciliar no incluido en la lista. -Emplear una cepa patrón de Salmonella para controlar los medios de cultivo y los medios empleados en las pruebas de confirmación e identificación. -Informar ausencia o presencia de Salmonella en la cantidad de muestra empleada en el análisis (25 g en nuestro caso). -Aclarar modificaciones y pruebas bioquímicas realizadas. e) Recuento de Staphylococcus aureus coagulasa positiva e.1) Siembra y aislamiento en medio sólido -Transferir 0,1 ml de la dilución adecuada a una placa de agar Baird Parker. -Realizar un duplicado. Distribuir el inóculo con espátula de Drigalsky para obtener colonias aisladas. -Incubar a 35ºC durante 44-48 h. -Considerar las placas que contengan menos de 150 o 200 colonias. -Seleccionar un número representativo de colonias sospechosas y transferirlas a tubos de caldo infusión-Cerebro-Corazón (BHI). -Incubar a 35ºC durante 24 h. El volumen y las diluciones empleadas dependen de la contaminación que se espere en la muestra. Incluso puede realizarse un recuento combinado sembrando un volumen mayor y repartido en varias placas. -Recordar que no se recomienda sembrar más de 3 o 4 ml por placa. e.2) Identificación y confirmación Sobre los cultivos puros de 24 h realizar: - Tinción de Gram - Catalasa - Coagulasa - Termonucleasa (en la misma placa de Baird-Parker) Sembrar en paralelo una cepa patrón para comparar con un positivo -Para realizar los cálculos tener en cuenta las diluciones y las alícuotas sembradas. -Aclarar las modificaciones y pruebas bioquímicas realizadas. -Informar “UFC de S. aureus coagulasa positiva/g de muestra” 57 f) Determinación de Bacillus cereus (APHA 1992) Medio de cultivo: agar manitol-yema de huevo-polimixina (MYP). -Sembrar en superficie 0,1 ml de dos diluciones por duplicado con un rastrillo para cada dilución. -Después de sembrar dejar secar e incubar por 20 o 24 h a 30 ± 2oC. -Transferir un número representativo de colonias típicas a agar nutritivo. -Incubar 24-48 h a 37ºC. En estos cultivos puros ensayar: - Gram - catalasa - tinción de esporas - fermentación de glucosa (en caldo rojo fenol en anaerobiosis) - caldo nitrato - caldo Voges-Proskauer modificado -Calcular el número de colonias de B. cereus teniendo en cuenta las diluciones empleadas y las colonias confirmadas. -Informar como “UFC de B. cereus/g de muestra”. 58 Ferramola, “Examen bacteriológico de aguas”,1947 59 1 ml 1 1 2 2 3 0 0 1 1 1 2 2 3 3 0 0 0 0 1 1 1 1 2 2 2 2 2 3 3 3 3 3 3 4 4 4 4 4 4 5 5 5 5 5 10 ml 0 0 0 0 0 1 1 1 1 1 1 1 1 1 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 1 2 3 4 2 3 4 5 0 3 4 5 0 1 3 4 0 1 2 2 3 0 1 2 1 2 3 0 1 0 1 0 1 0 0 1 0 1 2 0 1 0 1 0 0.1 ml Número de tubos positivos ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 6,9 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 30 6,5 ….. 14 ….. ….. 4,9 ….. ….. ….. ….. 0 1 0 0 2 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 95 ….. ….. 240 ….. ….. ….. ….. ….. 30 6,4 13 14 22 ….. 4,9 9,7 ….. ….. ….. 1 1 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 69 ….. 21 ….. ….. ….. 24 6,1 ….. 13 ….. ….. 4,7 ….. 9,5 ….. ….. 0 2 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 300 ….. ….. 52 ….. ….. 66 140 21 29 ….. ….. 24 6,0 12 13 20 ….. 4,6 9,3 9,5 14 ….. 1 2 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 210 ….. 240 690 ….. 50 95 ….. 62 130 21 29 ….. ….. 23 6,0 12 13 20 28 4,6 9,2 9,4 14 ….. 2 2 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 190 280 200 450 1.100 48 91 140 57 120 21 28 ….. ….. 23 6,0 12 13 20 27 4,6 9,2 9,4 14 ….. 3 2 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 1.400 ….. ….. ….. ….. 180 260 180 360 700 46 87 140 54 110 20 28 ….. ….. 22 5,9 12 13 20 27 4,6 9,2 9,3 14 ….. 4 2 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 920 1.600 ….. ….. ….. 170 240 160 300 510 45 83 130 51 110 20 28 ….. ….. 22 5,9 12 13 19 27 4,6 9,1 9,3 14 ….. 5 2 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 110 ….. ….. ….. ….. ….. 45 ….. 19 ….. 28 ….. 20 5,7 ….. 12 ….. ….. 4,5 ….. 9,1 ….. 14 0 3 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 340 ….. ….. ….. ….. 100 170 ….. 38 ….. ….. 43 81 19 27 28 36 20 5,7 12 12 19 ….. 4,4 8,9 9,1 14 14 1 3 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 280 690 ….. 120 ….. 98 160 230 38 65 ….. 42 77 19 26 27 36 20 5,6 12 12 19 26 4,4 8,8 9,0 14 14 2 3 2 Combinación de tubos sembrados ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 290 ….. 240 410 1.100 120 160 93 150 210 37 63 95 41 74 19 26 27 35 20 5,6 12 12 18 25 4,4 8,8 9,0 14 14 3 3 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. 1.400 ….. ….. ….. ….. 270 350 210 290 700 110 150 89 140 200 36 61 92 40 72 19 26 27 35 19 5,6 12 12 18 25 4,4 8,8 8,9 14 14 4 3 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. 920 1.600 ….. ….. ….. 260 340 190 220 510 110 150 85 140 190 35 59 90 39 69 19 26 27 35 19 5,5 11 12 18 25 4,4 8,7 8,9 13 14 5 3 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 140 ….. ….. ….. ….. 69 ….. ….. ….. ….. ….. 35 ….. 18 ….. 26 ….. 18 5,4 ….. 11 ….. ….. 4,3 ….. 8,7 ….. 14 0 4 2 10, 1 y 0,1 ml respectivamente ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 370 ….. ….. ….. 130 190 ….. ….. ….. 67 100 ….. 32 ….. ….. 34 57 18 25 26 33 18 5,4 11 11 18 ….. 4,2 8,5 8,7 13 14 1 4 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 300 690 ….. ….. 130 180 250 85 ….. 65 100 140 31 50 ….. 34 56 18 25 25 33 18 5,3 11 11 17 24 4,2 8,5 8,6 13 13 2 4 2 31 49 72 33 54 18 24 25 33 17 5,3 11 11 17 24 4,2 8,4 8,6 13 13 3 4 2 ….. ….. ….. ….. 1.100 ….. ….. ….. ….. 300 ….. ….. 270 470 170 ….. 120 170 230 83 110 63 97 140 Tabla I. - Número más probable (N.M.P.) de bacterias coliformes por 100 ml de la muestra, sembrando porciones en no más de tres diluciones ….. ….. ….. ….. 700 1.400 ….. ….. ….. 280 360 ….. 240 390 170 210 110 160 220 80 110 61 94 130 30 48 71 33 53 18 24 25 32 17 5,3 11 11 17 24 4,2 8,4 8,5 13 13 4 4 2 ….. ….. ….. ….. 510 920 1.600 ….. ….. 270 340 420 220 330 160 200 110 160 210 78 110 59 91 130 30 47 69 32 51 18 24 25 32 17 5,2 11 11 17 23 4,2 8,4 8,5 13 13 5 4 2 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 160 ….. ….. ….. 90 ….. ….. ….. ….. 52 ….. ….. ….. ….. ….. 29 ….. 17 ….. 24 ….. 16 5,1 ….. 11 ….. ….. 4,1 ….. 8,3 ….. 13 0 5 2 ….. ….. ….. ….. ….. ….. ….. ….. 390 ….. ….. ….. 150 210 ….. ….. 89 120 ….. ….. ….. 51 77 ….. 27 ….. ….. 29 46 17 23 24 31 16 5,1 10 11 16 ….. 4,1 8,1 8,3 12 13 1 5 2 720 ….. ….. ….. 260 ….. ….. ….. 330 ….. ….. ….. 150 200 ….. ….. 86 120 160 66 ….. 50 75 100 27 42 ….. 29 45 17 23 24 31 16 5,1 9,9 11 16 22 4,0 8,1 8,3 12 13 2 5 2 480 1.100 ….. ….. 240 310 ….. ….. 290 190 ….. ….. 140 190 130 ….. 84 120 150 65 87 49 73 99 27 41 58 28 45 17 23 24 30 16 5,1 9,9 11 16 22 4,0 8,1 8,2 12 13 3 5 2 400 700 1.400 ….. 230 290 370 ….. 260 180 220 ….. 140 190 130 150 81 110 150 64 86 48 71 96 26 40 57 28 44 17 23 23 30 15 5,1 9,9 11 16 22 4,0 8,1 8,2 12 13 4 5 2 350 540 920 1.600 220 280 350 430 240 180 210 250 130 170 120 150 79 110 140 62 84 47 70 94 26 40 56 28 43 17 23 23 30 15 5,1 9,9 10 16 22 4,0 8,0 8,2 12 13 5 5 2 Ferramola, “Examen bacteriológico de aguas”,1947 60 2 2 2 3 3 3 3 3 3 4 4 4 4 4 4 5 5 5 5 5 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 4 4 5 5 5 2 2 2 2 2 1 1 2 2 2 1 2 2 3 3 2 2 2 2 2 3 3 3 3 3 3 3 0 0 1 1 1 2 2 2 0 0 0 0 1 1 0 1 2 2 0 1 1 1 1 3 3 3 3 3 1 ml 10 ml 0 1 2 3 4 1 2 3 4 5 2 3 4 5 0 3 4 5 0 1 1 2 0 1 2 0 1 2 3 0 0 1 0 1 2 1 0 1 0 1 0 1 0 1 0 0 0 0 0 1 0.1 ml Número de tubos positivos ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 11 ….. ….. ….. 4,1 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 34 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 10 ….. 17 3,3 3,9 8,1 ….. ….. 0 1 0 0 3 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 33 95 ….. ….. ….. ….. ….. ….. ….. ….. 24 ….. ….. ….. ….. ….. ….. 10 16 17 3,3 3,9 8,0 ….. ….. 1 1 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 28 ….. ….. ….. 71 ….. ….. ….. ….. ….. ….. 23 ….. ….. ….. ….. ….. 9,8 ….. 16 3,2 3,8 7,7 12 ….. 0 2 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 140 ….. 300 ….. ….. 27 53 ….. ….. 66 ….. ….. ….. ….. ….. 22 23 30 ….. ….. ….. ….. 9,8 15 16 3,2 3,7 7,7 12 16 1 2 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 130 210 240 700 ….. 27 51 95 ….. 63 ….. ….. ….. ….. ….. 22 23 30 ….. ….. ….. ….. 9,7 15 16 3,2 3,7 7,7 12 16 2 2 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 110 ….. ….. 24 ….. ….. ….. 46 ….. ….. ….. ….. ….. ….. 21 ….. 29 ….. 16 ….. 9,3 ….. 15 3,1 3,6 7,4 12 ….. 0 3 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 340 ….. 81 ….. 100 170 ….. 24 40 ….. ….. 45 ….. ….. ….. ….. ….. 21 21 28 29 37 16 20 9,3 15 15 3,1 3,6 7,4 11 16 1 3 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 280 690 78 120 98 160 230 23 39 65 ….. 44 ….. ….. ….. ….. ….. 21 21 28 29 36 16 20 9,2 14 15 3,1 3,6 7,4 11 15 2 3 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 1.100 ….. ….. ….. ….. 290 ….. ….. 240 460 75 120 93 150 210 23 39 64 95 43 ….. ….. ….. ….. ….. 20 21 28 29 36 16 20 9,1 14 14 3,0 3,6 7,3 11 15 3 3 3 Combinación de tubos sembrados ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 700 1.400 ….. ….. ….. 270 350 ….. 210 370 72 110 89 140 200 23 38 62 92 42 ….. ….. ….. ….. ….. 20 21 27 28 36 16 20 9,1 14 15 3,0 3,6 7,3 11 15 4 3 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 530 920 1.600 ….. ….. 260 330 420 190 320 70 110 85 130 190 23 37 60 90 41 ….. ….. ….. ….. ….. 20 21 27 28 36 16 20 9,1 14 15 3,0 3,5 7,3 11 15 5 3 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 140 ….. ….. ….. 69 ….. ….. 21 ….. ….. ….. 37 35 ….. ….. ….. ….. ….. 20 ….. 27 ….. 15 ….. 8,9 ….. 14 3,0 3,5 7,2 11 ….. 0 4 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 370 ….. ….. ….. 130 190 59 ….. 67 100 ….. 21 34 ….. ….. 36 35 43 ….. ….. ….. 20 20 26 27 34 15 19 8,8 14 14 3,0 3,5 7,1 11 15 1 4 3 10, 1 y 0,1 ml respectivamente ….. ….. ….. ….. ….. 710 ….. ….. ….. ….. 250 ….. ….. ….. 300 ….. ….. ….. 130 180 57 85 65 100 140 21 33 51 ….. 36 35 43 ….. ….. ….. 19 20 26 27 34 15 19 8,8 14 14 3,0 3,5 7,1 11 15 2 4 3 ….. ….. ….. ….. ….. 470 1.100 ….. ….. ….. 230 300 ….. ….. 270 170 ….. ….. 120 170 56 83 63 97 140 21 33 50 73 35 35 42 ….. ….. ….. 19 20 26 27 34 15 19 8,7 14 14 3,0 3,4 7,1 11 15 3 4 3 ….. ….. ….. ….. ….. 390 700 1.400 ….. ….. 220 280 360 ….. 240 170 210 ….. 110 160 54 81 61 94 130 21 32 49 71 35 34 42 ….. ….. ….. 19 20 26 27 33 15 19 8,7 14 14 3,0 3,4 7,1 11 15 4 4 3 ….. ….. ….. ….. ….. 330 540 920 1.600 ….. 210 270 340 420 220 160 210 240 110 160 53 78 59 91 130 20 32 48 69 34 34 42 ….. ….. ….. 19 20 26 26 33 15 19 8,7 13 14 2,9 3,4 7,0 11 15 5 4 3 ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. ….. 160 ….. ….. ….. 92 ….... ….. ….. 51 ….. ….. 19 ….. ….. ….. 32 33 ….. 42 ….. ….. ….. 19 ….. 26 ….. 15 ….. 8,5 ….. 13 2,9 3,4 6,9 11 ….. 0 5 3 Tabla II. - Número más probable (N.M.P.) de bacterias coliformes por 100 ml de la muestra, sembrando porciones en no más de tres diluciones 390 ….. ….. ….. ….. 210 ….. ….. ….. ….. ….. ….. ….. ….. 150 ….. ….. ….. 89 120 47 ….. 50 77 ….. 19 29 ….. ….. 31 33 40 41 49 ….. 19 19 25 25 32 15 18 8,5 13 13 2,9 3,4 6,9 11 14 1 5 3 330 720 ….. ….. ….. 200 260 ….. ….. ….. 160 ….. ….. ….. 150 ….. ….. ….. 86 120 46 67 49 75 100 19 29 43 ….. 31 33 40 41 49 57 18 19 25 25 32 15 18 8,4 13 13 2,9 3,3 6,9 11 14 2 5 3 290 480 1.100 ….. ….. 190 240 310 ….. ….. 150 190 ….. ….. 140 130 ….. ….. 83 120 46 65 48 73 99 19 29 42 59 30 32 39 41 48 56 18 19 24 25 31 15 18 8,4 13 13 2,9 3,3 6,8 11 14 3 5 3 260 400 700 1.400 ….. 180 230 290 370 ….. 150 180 220 ….. 140 130 150 ….. 81 110 45 64 47 71 97 19 29 41 58 30 32 39 40 48 56 18 19 24 25 31 14 18 8,3 13 13 2,9 3,3 6,8 11 14 4 5 3 240 350 540 920 1.600 170 220 280 350 430 140 180 210 250 130 120 150 180 79 110 44 63 46 69 94 19 28 40 57 30 32 39 40 48 56 18 19 24 25 31 14 18 8,3 13 13 2,9 3,3 6,8 10 14 5 5 3 MPN index and 95% confidence limits for various combinations of positive results when various numbers of tubes are used. (Inocula of 0.1, 0.01, and 0.001g) Combination of positives 0-0-0 0-0-1 0-1-0 0-2-0 1-0-0 1-0-1 1-1-0 1-1-1 1-2-0 2-0-0 2-0-1 2-1-0 2-1-1 2-2-0 2-2-1 2-3-0 3-0-0 3-0-1 3-0-2 3-1-0 3-1-1 3-1-2 3-2-0 3-2-1 3-2-2 3-3-0 3-3-1 3-3-2 3-3-3 3 Tubes per dilution 5 Tubes per dilution 95% Confidence limits 95% Confidence limits MPN index per g <3 3 3 4 7 7 11 11 9 14 15 20 21 28 23 39 64 43 75 120 93 150 210 240 460 1,100 >1,100 Lower Upper MPN index per g Lower Upper <0.5 <0.5 <0.5 <0.5 1 1 3 3 1 3 3 7 4 10 4 7 15 7 14 30 15 30 35 36 71 150 >150 <9 9 13 20 21 23 36 36 36 37 44 89 47 150 120 130 380 210 230 380 380 440 470 1,300 2,400 4,800 >4,800 <2 2 2 4 2 4 4 6 6 5 7 7 9 9 12 8 11 11 14 14 17 - <0.5 <0.5 <0.5 <0.5 <0.5 <0.5 <0.5 <0.5 <0.5 <0.5 1 1 2 2 3 1 2 2 4 4 5 - <7 7 7 11 7 11 11 15 15 13 17 17 21 21 28 19 25 25 34 34 46 - FAO, “Manual of Food Control Quality. Microbiological Analysis”, 1992. 61 PROTOCOLO DE INFORME ANÁLISIS MICROBIOLÓGICO Fecha de informe: Solicitante: DATOS DE LA MUESTRA: Tipo de muestra: Marca: Fecha de elaboración: Fecha de vencimiento: Lugar de elaboración: Nº de lote: Fecha de recepción de muestra: Fecha de inicio de análisis: Características de la muestra*: *Consignar datos relevantes, por ejemplo, si es refrigerada, congelada, temperatura de recepción, si tiene signos de alteración, etc. RESULTADOS DE LOS ANÁLISIS: Recuento o determinación (Metodología): resultado* *Ejemplo: Recuento de coliformes a 30ºC. Recuento en placa (FIL 73 A: 1985): 1,2.103 UFC/ml PATRÓN MICROBIOLÓGICO: CONCLUSIONES: Firma y aclaración del analista 62 Control Microbiológico de Alimentos Dpto. Química Orgánica ANEXO CLAVE PARA IDENTIFICACIÓN DE HONGOS 63 CLAVE PARA LAS CLASES DE HONGOS MAS COMUNES EN LOS ALIMENTOS (Adaptación de la clave propuesta por Onions y col. en "Smith's Introduction to Industrial Mycology", 7º Edición, 1981) 1. 1'. 2. 2'. 3. 3'. 4. Presencia de micelio solamente……………………………….. Esporas o conidios presentes………………………………….. Esporas en receptáculos cerrados……………………………... Esporas no en receptáculos……………………………………. Esporas en esporangios, micelio no septado………………….. Esporas no en esporangios, micelio septado…………………... Esporas en ascos (grupos generalmente de 8) producidos en el micelio o encerrados en cuerpos fructíferos………………………………………… Mycelia sterilia 2 3 Hyphomycetes Zygomycetes 4 Ascomycetes Clase Zygomycetes a) Crecimiento rápido (especialmente en alimentos de alta aw) b) Micelio no septado c) Reproducción por esporangiosporas Los hongos de esta clase que se encuentran en los alimentos pertenecen al orden Mucorales. La forma usual de reproducción asexual es por esporas (esporangiosporas), producidas en gran número dentro de estructuras globosas (esporangios), soportadas por hifas (esporangióforos), que pueden ramificarse en diversas formas (ver esquemas). Una clave muy sencilla para los hongos de esta clase comunes en alimentos permite diferenciar los siguientes géneros: I II Con esporangiolos…………………………………………………. Sin esporangiolos A) Con rizoides y estolones 1) Los esporangióforos se desarrollan en los nódulos……………. 2) Los esporangióforos crecen en las porciones internodulares….. B) Sin rizoides ni estolones…………………………………………… Clase Ascomycetes a) Produce ascosporas dentro de un asco b) Micelio septado c) Presencia de ascocarpos (por ej. cleistotecios) 64 Thamnidium Rhizopus Absidia Mucor Clase Hyphomycetes Diferentes tipos de esporas (conidios) Amerosporas (sin septo) Didimosporas (un septo) Fragmosporas Dictiosporas (dos o más septos (septos transversales y transversales) longitudinales) Géneros de Hyphomycetes comunes en alimentos Géneros con dictiosporas: Conidios oscuros, con septos transversales y longitudinales, que nacen en cadenas, redondeados en la base, con un poro apical………………………………. Alternaria Géneros con fragmosporas: Conidios hialinos, fusiformes, tabicados sólo transversalmente, con célula pie………………………………………………………………Fusarium Géneros con didimosporas: Conidios hialinos, con un solo septo transversal, colonias rosadas…………………………………………Trichotecium Géneros con amerosporas: a) Fialídicos: Conidios en cadenas que parten de fiálides………………………………..Aspergillus Penicillium Scopulariopsis Paecylomyces b) No fialídicos: Conidios producidos por fragmentación de la hifa (artrosporas), colonia levaduriforme………………………………………Geotrichum Conidios agrupados en racimos en el ápice del conidióforo……………………………………………………….Botrytis Conidios producidos por brotación, en cadenas ramificadas; cabezuelas arbóreas, colonias flocosas, de crecimiento rápido, color rosado o anaranjado………………………………………………….Monilia 65 Conidios piriformes aislados o en pequeños racimos…………………………………………………………Sporotrichum Conidios (y micelio) oscuros, formados por gemación, en cadenas ramificadas, con aspecto de ramificación arbórea………………………………………….Cladosporium CLASE ZYGOMYCETES Rhizopus Mucor Diagrama de Absidia mostrando la localización de esporangióforos y rizoides Thamnidium 66 CLASE HYPHOMYCETES Aspergillus Penicillium Scopulariopsis Paecilomyces Alternaria Trichothecium 67 Geotrichum Fusarium Neurospora (Monilia) Botrytis Sporotrichum Cladosporium 68 BIBLIOGRAFÍA AOAC, “Official Methods of Analysis”, 1995. APHA."Compendium of Methods for the microbiological examination of foods",1st Ed. (1976), 3rd Ed (1992). Código Alimentario Argentino de la Canal, J.J., 1995. FAO, “Manual of Food Quality Control. 4. Rev.1. Microbiological analysis”, 1992. ICMSF, "Microorganismos en los Alimentos. Vol. I. Técnicas de análisis microbiológico". Ed. Acribia 1983. Methods for the examination of water and waste waters. APHA 18th ED, 1992. . Mossel y Moreno García, "Microbiología de los alimentos. Fundamentos ecológicos para garantizar y comprobar la inocuidad y calidad de los alimentos."; Ed. Acribia, 1985. Normas FIL-IDF: 73A: 1985, 93A: 1985, 94B: 1990 y 145: 1990. USDA, FSIS, Microbiology Division Beltsville, MD. “Method for the isolation and identification of Listeria monocytogenes from processed meat and poultry products” 69 REGLAS BÁSICAS DE HIGIENE Y SEGURIDAD PARA ALUMNOS DE LABORATORIOS DE QUÍMICA Y BIOLOGÍA - PAUTAS DE ACTUACION EN CASOS DE EMERGENCIAS FACULTAD DE CIENCIAS EXACTAS Y NATURALES - SERVICIO DE HIGIENE Y SEGURIDAD _____________________________ Las prácticas que se realizan en los laboratorios presentan riesgos propios de cada actividad. Las reglas básicas aquí indicadas son un conjunto de normas destinadas a proteger la salud de los alumnos y a evitar accidentes y contaminaciones tanto dentro del ámbito de trabajo, como hacia el exterior. Es un elemento clave en la seguridad la información que permita reconocer y minimizar o evitar los riesgos presentes en el laboratorio. Será fundamental respetar la metodología de cada técnica, y trabajar con cuidado y en forma ordenada. MEDIDAS GENERALES 1. Se deberá conocer la ubicación de los elementos de seguridad en el lugar de trabajo, tales como: matafuegos, salidas de emergencia, mantas ignífugas, lavaojos, gabinete para contener derrames, accionamiento de alarmas, etc. 2. No se debe comer, beber, fumar o maquillarse en el laboratorio. 3. No se debe guardar alimentos en heladeras que contengan drogas o preparados. 4. Se debe utilizar vestimenta apropiada para realizar trabajos de laboratorio, guardapolvo abrochado (preferentemente de algodón y de mangas largas) y zapatos cerrados. Evitar el uso de accesorios colgantes (aros, pulseras, collares, etc.). Llevar el cabello recogido. 5. Las mesadas de trabajo, deben estar despejadas, sin libros, ni abrigos ni objetos personales. Es imprescindible mantener el orden y la limpieza. Cada persona es responsable directa de la zona que le ha sido asignada y de todos los lugares comunes. 6. Las manos deben lavarse cuidadosamente después de cualquier manipulación de laboratorio y antes de retirarse del mismo. 7. Se deben utilizar guantes apropiados para evitar el contacto con sustancias química o material biológico. Toda persona cuyos guantes se encuentren contaminados no deberá tocar objetos, ni superficies, tales como: teléfono, lapiceras, manijas de cajones o puertas, cuadernos, etc. 8. No se permite correr en los laboratorios. 9. No se deben bloquear las rutas de escape o pasillos con bancos, sillas, equipos, máquinas u otros elementos que entorpezcan la correcta circulación. 10. De aviso inmediato al docente responsable si encuentra instalaciones eléctricas y de gas precarias o provisorias. 11. No utilice equipos (Ej. Rotavap, columnas de destilación, sonicadores, hornos etc.) sin haber recibido entrenamiento previo y sin supervisión durante su uso. 70 12. Toda herida o abrasión, aún los pequeños cortes que puedan producirse durante el trabajo práctico deben ser informados al Docente. Los laboratorios cuentan con un botiquín de primeros auxilios con los elementos indispensables para atender casos de emergencia. 13. Respete las señales de advertencia (ej.: riesgo eléctrico, alta temperatura, radiaciones, etc.) 14. Todo residuo generado debe colocarse en los recipientes destinados para tal fin según las indicaciones del docente (ver Pautas para Gestión de Residuos) 71 LABORATORIOS DE QUÍMICA 1. No se permite pipetear con la boca. 2. Siempre que sea necesario proteger los ojos y la cara de salpicaduras o impactos se utilizarán anteojos de seguridad, viseras o pantallas faciales u otros dispositivos de protección. Cuando se manipulen productos químicos que emitan vapores o puedan provocar proyecciones, se evitará el uso de lentes de contacto. 3. No utilice el contenido de un recipiente que no este identificado. Los envases que contengan agentes químicos deben adecuadamente etiquetados con la denominación del compuesto y el tipo de riesgo (Ej.: corrosivo, tóxico, inflamable, oxidante, radiactivo, explosivo o nocivo). 4. Cuando sea necesario manipular grandes cantidades de materiales inflamables (más de 5 litros) deberá tenerse a mano un extintor apropiado para ese material en cuestión. 5. Al almacenar sustancias químicas se debe considerar las incompatibilidades que dan lugar a reacciones peligrosas. Consultar con el Docente. 6. No almacenar en estantes sobre mesadas sustancias corrosivas y en caso de ácidos o álcalis concentrados (mayor de 2N) deben ser mantenidos en bandejas de material adecuado. 7. Las prácticas que produzcan gases, vapores, humos o partículas, y que puedan ser riesgosas por inhalación deben llevarse a cabo bajo campana. 8. Se debe verificar la ausencia de vapores inflamables antes de encender una fuente de ignición. 9. No se debe trabajar con materiales inflamables o solventes sobre llamas directas o cerca de las mismas. Para calentamiento, sólo se utilizarán resistencias eléctricas o planchas calefactoras blindadas. Se prestará especial atención al punto de inflamación y de autoignición del producto. 72 10. Está prohibido descartar líquidos inflamables o tóxicos o corrosivos por los desagües de las piletas, sanitarios o recipientes comunes para residuos. Se deben seguir las pautas para la gestión de residuos. 11. Los cilindros de gases comprimidos y licuados deben estar en posición vertical sujetos con correas o cadenas a la pared en sitios de poca circulación, de ser posible fuera del lugar de trabajo, protegidos de la humedad y fuentes de calor. 12. El material de vidrio roto no se depositará con los residuos comunes. Será conveniente envolverlo en papel y ubicarlo en cajas resistentes, 13. Todo recipiente que hubiera contenido agentes químicos puede ser descartado junto a los residuos comunes vaciado totalmente, enjuagado apropiadamente y sin etiquetas. 14. Está terminantemente prohibido hacer experimentos no autorizados por el Docente. No substituya nunca un producto químico por otro en una práctica. LABORATORIOS DE BIOLOGIA 1. Leer Reglas Básicas para Laboratorios de Química. 2. Se deben utilizar mascarillas descartables cuando exista riesgo de producción de aerosoles (mezcla de partículas en medio líquido) o polvos durante operaciones de pesada de sustancias tóxicas o biopatógenas, apertura de recipientes con cultivos después de agitación, etc. 3. Está prohibido descartar material biológico por los desagües de las piletas, sanitarios o recientes comunes para residuos. En cada caso se deberán seguir los procedimientos establecidos para la gestión de residuos. 4. La superficie de trabajo se deberá descontaminar una vez terminadas las tarea o luego de cada derrame de material viable, utilizando productos probadamente efectivos contra los agentes con que se trabaja. 5. El derrame o caída de muestras contaminadas, diluciones y medios sembrados o inoculados será informada al docente de inmediato. Se procederá a tratar el área afectada con la solución desinfectante que corresponda, la cual se dejará actuar y se recogerá con papel absorbente que será luego descartado con los residuos patogénicos. 6. En caso de rotura del recipiente de vidrio que contiene microorganismos, proceder de igual forma pero no tocar los residuos antes que el desinfectante haya actuado. 7. Cuando proceda a la limpieza de una superficie con alcohol, verifique que no haya mecheros encendidos. 8. Consulte con el Docente si el material biológico debe ser descontaminado previo a su descarte en recipiente de residuos patogénicos (bolsa roja). PAUTAS PARA LA GESTIÓN DE RESIDUOS PELIGROSOS Y PATOGÉNICOS Peligrosos (ácidos, álcalis, oxidantes, corrosivos, guantes, trapos, etc.): -Los residuos líquidos se deberán acumular en bidones provistos por el Servicio de Higiene y Seguridad. -Mantenerlos tapados. 73 -No mezclar sin consultar al Docente. -Los residuos sólidos se deberán acumular en bolsas negras dentro de cajas provistas por el Servicio de Higiene y Seguridad. -No tirar residuos domésticos. Patogénicos (tips, guantes, cajas de petri, etc.): -Los residuos biológicos (sangre, tejidos animales o humanos y todo el material que haya estado en contacto con ellos) se deberán acumular en bolsas rojas dentro de cestos con tapa provistos por el Servicio de Higiene y Seguridad. -Quedan exceptuados los elementos corto-punzantes (agujas, hojas de bisturíes), que se recogerán en contenedores especiales. ANTE CUALQUIER DUDA CONSULTE CON EL DOCENTE La seguridad la disfrutamos todos. Actuemos responsablemente PAUTAS DE ACTUACIÓN EN CASO DE EMERGENCIAS En caso de accidente, avisar inmediatamente al Docente. EMERGENCIAS MÉDICAS Si ocurre una emergencia tal como cortes o abrasiones, quemaduras o ingestión accidental de algún producto químico, tóxico o peligroso, se deberá proceder en la siguiente forma: 1. A los accidentados se les proveerá los primeros auxilios 2. Se da aviso al Departamento de Seguridad y Control (Int. 311 Emergencias) 3. El Docente responsable del turno o una autoridad del Departamento, deberá completar el Formulario de Incidentes y enviarlo al Servicio de Higiene y Seguridad para su conocimiento y evaluación. CENTROS PARA REQUERIR AYUDA MEDICA -Hospital Pirovano Av. Monroe 3555 Tel. 4542-5552 / 9279 INTOXICACIONES: -Hospital de Niños. Dr. R. Gutiérrez Sánchez de Bustamante 1399. Capital Federal. Tel: 4962-6666. -Hospital de Niños. Dr. P. de Elizalde Av. Montes de Oca 40 Tel. 4307-7491 Toxicología 4300-2115 QUEMADURAS: -Hospital de Quemados P. Goyena 369 Tel. 4923-4082 / 3022 74 OFTALMOLOGÍA -Hospital Santa Lucía San Juan 2021 Tel. 4941-7077 -Hospital Dr. P. Lagleyze Av. Juan B. Justo 4151 Tel. 4581-0645 / 2792 1. Quemaduras Las pequeñas quemaduras producidas por material caliente, baños, placas o mantas calefactoras, etc., se trataran lavando la zona afectada con agua fría durante 10-15 minutos. Las quemaduras más graves requieren atención médica inmediata. No utilices cremas y pomadas grasas en las quemaduras graves. 2. Cortes Los cortes se tienen que lavar bien, con abundante agua corriente, durante 10 minutos como mínimo. Si son pequeños y dejan de sangrar en poco tiempo, lávalos con agua y jabón y tápalos con una venda o apósito adecuados. Si son grandes y no paran de sangrar, requiere asistencia médica inmediata. 3. Derrame de productos químicos sobre la piel Los productos químicos que se hayan vertido sobre la piel han de ser lavados inmediatamente con agua corriente abundante, como mínimo durante 15 minutos. Es necesario sacarle toda la ropa contaminada a la persona afectada lo antes posible. El lavado es muy importante para reducir la gravedad y la extensión de la herida. Requiere asistencia médica. 4. Actuación en caso de producirse corrosiones en la piel Por ácidos. Sacar o cortar lo más rápidamente posible la ropa. Lavar con agua corriente abundante la zona afectada. Neutralizar la acidez con bicarbonato sódico durante 15-20 minutos. Esperar la asistencia médica. Por álcalis. Lavar la zona afectada con agua corriente abundante y luego con una solución saturada de ácido bórico. Secar y esperar la asistencia médica. 5. Fuego en el cuerpo Si se te incendia la ropa, pide ayuda. El afectado no correrá, tiene que tirarse en el suelo y rodar sobre si mismo para apagar las llamas. Es tu responsabilidad ayudar a alguien que se esté quemando. Cubrirlo con una manta antifuego, conducirlo hasta la ducha de seguridad, si está cerca. No utilices nunca un extintor sobre una persona. Una vez apagado el fuego, mantener a la persona tendida, hasta que llegue la asistencia médica. 75 6. Actuación en caso de producirse corrosiones en los ojos En este caso el tiempo es esencial (menos de 10 segundos). Cuanto antes se lave el ojo, menos grave será el daño producido. Lavar los dos ojos con agua corriente abundante durante 15 minutos como mínimo en una ducha de ojos, o con solución fisiológica. Es necesario mantener los ojos abiertos con la ayuda de los dedos para facilitar el lavado debajo de los párpados. Es necesario recibir asistencia médica, por pequeña que parezca la lesión. 7. Actuación en caso de ingestión de productos químicos Antes de cualquier actuación concreta pide asistencia médica. Si el paciente está inconsciente, ponerlo en posición inclinada, con la cabeza de lado. Si está consciente, mantenerlo apoyado. No dejarlo sólo. No provocar el vómito si el producto ingerido es corrosivo. 8. Actuación en caso de inhalación de productos químicos Identificar el vapor tóxico. Si se trata de un gas, utilizar el tipo adecuado de máscara para gases durante el tiempo que dure el rescate del accidentado. No arriesgarse. Conducir inmediatamente la persona afectada a un sitio con aire fresco. Requiere asistencia médica lo antes posible. Ante el primer síntoma de dificultad respiratoria, iniciar la respiración artificial boca a boca. INCENDIOS 1. Fuego en el laboratorio Mantenga la calma. Informe al docente responsable. Se dará aviso inmediatamente al Dpto. de Seguridad y Control (Interno 311) informando el lugar y las características del siniestro 2. Fuegos pequeños Si el fuego es pequeño y localizado, y sabe utilizar un extintor, trate de apagarlo utilizando un extintor adecuado, arena, o cubriendo el fuego con un recipiente de tamaño adecuado que lo ahogue. Retirar los productos químicos inflamables que estén cerca del fuego. No utilices nunca agua para extinguir un fuego provocado por la inflamación de un solvente. 3. Fuegos grandes Si el fuego es de consideración, no se arriesgue y manteniendo la calma ponga en marcha el plan de evacuación. Apague los equipos eléctricos y cierre las llaves de gas y ventanas. Acate las indicaciones de los brigadistas. Evacue la zona por la ruta asignada. 76 No corra, camine rápido, cerrando a su paso la mayor cantidad de puertas. No utilice ascensores. Descienda siempre que sea posible. No lleve consigo objetos, pueden entorpecer su salida. Si pudo salir por ninguna causa vuelva a entrar. Deje que los equipos especializados se encarguen. DERRAME MAYORES DE PRODUCTOS QUÍMICOS − Avise al Departamento de Seguridad y Control (int. 311 Emergencias) − Atender a cualquier persona que pueda haber sido afectada. − Notificar a las personas que se encuentren en las áreas cercanas acerca del derrame. Buscar los elementos en el Gabinete para contener derrames. − Coloque la cinta de demarcación para advertir el peligro. − Evacuar a toda persona no esencial del área del derrame. − Si el derrame es de material inflamable, apagar las fuentes de ignición, y las fuentes de calor. − Evite respirar los vapores del material derramado, si es necesario utilizar una máscara respiratoria con filtros apropiados al tipo de derrame. − Ventilar la zona. − Utilizar los elementos de protección personal tales como equipos de ropa resistente a ácidos, bases y solventes orgánicos y guantes. − Confinar o contener el derrame, evitando que se extienda. Para ello extender los cordones en el contorno del derrame. − Luego absorber con los paños sobre el derrame. − Deje actuar y luego recoger con pala y colocar el residuo en la bolsa roja (patogénicos) o negra (peligrosos) y ciérrela. − Si el derrame es de algún elemento muy volátil deje dentro de la campana hasta que lo retire para su disposición. − Disponer la bolsa con los residuos (consultar al Servicio de Higiene y Seguridad, int. 275) − Lave el área del derrame con agua y jabón. Seque bien. − Cuidadosamente retire y limpie todos los elementos que puedan haber sido salpicados por el derrame. − Lave los guantes, la máscara y ropa. 77 Fecha: .................................................................. Declaro haber leído las REGLAS BÁSICAS DE HIGIENE Y SEGURIDAD EN LABORATORIOS DE QUÍMICA Y BIOLOGÍA– PROCEDIMIENTOS ANTE EMERGENCIAS que aparecen en la guía de Trabajos Prácticos de la Materia. Turno de Laboratorio: ........................................ Firma:................................................................... Aclaración:............................................................ L.U. Nº: ............................................................... 78