Microtainer® Tubes with K2EDTA
Anuncio

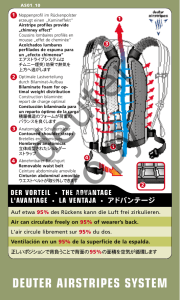
Microtainer® Tubes with K2EDTA (K2E) For Determinations of Hemotology Parameters and Blood Lead* Symbol Key Manufacturer Fabricante Fabricant Fabricante REF Catalog Number Número de Catálogo Réference du Catalogue Referêcia de Catálogo Keep Out of Sunlight Mantener Fuera de Luz Solar Ne pas Exposer aux Rayons Solaires Mantere Afastado da Luz Solar REF 365974 In Vitro Diagnostic medical device Producto sanitario para diagnóstico in vitro Dispositif médical de diagnostic in vitro Dispositivo médico para diagnóstico in vitro Lot Code Codigo de Lote Code du Lot Código do Lote Tubo con K 2EDTA • Tube avec K 2EDTA • Tubo com K 2EDTA Use By Date Fecha de Caducidad Utíliser Jusque Prazo de Validade Pour la Détermination des Paramètres Hémotologiques et le Dosage du Plomb* • Para Determinacíon de Parámetros Hemolólicos y Plomo en Sangre* • Para Determinação de Parâmetros Hematológicos e Concetraca o Sérica de Chumbo* Consult Instructions For Use Consulte las instrucciones de uso Consulter les instructions d'utilisation Consulte as instuções de utilização 25C Non-Sterile *Contains less than 1 ng lead per tube • *Contient moins de 1 ng de plomb par tube • *Contiene menos de 1ng de plomo por tubo • *Contem de 1 ng de chumbo por tubo Upper limit of temperature Límite superior de temperatura Limite supériore di température Limite superior de temperatura Fragile, Use Caution Frágil, Manipular con Precaución Fragile, Manipular avec Précautions Fragil, Manusear com Cuidado Fig. 1 Fig. 3 Plastic Components Composants Plastiques Componentes de Plástico Componentes Plásticos Collection Technique Technique de Recueil Ténica para la Toma Técnicas de Coleta Fig. 2 Fig. 4 Extender (Optional) Prolongateur (Option) Extensíon (Opcional) Extensor (Opcional) Becton, Dickinson and Company, Franklin Lakes, NJ USA Made in USA www.bd.com BD, BD Logo and all other trademarks are property 3/2010 of Becton, Dickinson and Company. ©2010 BD 8362628 BD Microtainer® Tubes with K2 EDTA - EN INTENDED USE: The BD Microtainer®Tubes with K 2 EDTA (REF 365974) are used to collect, anticoagulate, transport and store skin puncture blood specimens for measurement of the following hematology parameters: Automated: WBC, RBC, Hb, HCT, MCV, MCH, MCHC, platelets, 5-part WBC differential including neutrophilis, lymphocytes, monocytes, eosinophilis, and basophilis Manual: WBC differential, reticulocytes, microhematocrit (PVC) and whole blood lead by graphite furnace atomic absorption spectroscopy (GFAAS) and Anodic Stripping Voltametry (ASV) SYSTEM COMPONENTS: The BD Microtainer®Tubes consist of a plastic reservoir and lavender closure indicating the presence of EDTA. (Fig 1). The interior surface of the reservoir is spray-coated with K 2 EDTA solution, which is then dried. The upper edge of the reservoir serves as a collector. Markings on the reservoir show the 250 µL and 500 µL fill levels. The lavender closure fits snugly over the upper edge of the reservoir, to reduce the potential for sample contact when the cap is removed. To remove the closure, grasp the ribbed edge and twist while pulling it off. To reinsert, twist the closure while pushing it onto the reservoir. Note the snap when the closure is properly positioned on the reservoir. An optional extender (Fig. 2) is available (REF 365976). It fits into the bottom of the reservoir and increases the tube length to about 75 millimeters (mm). With this extender, the tube fits in a standard 13x75 mm test tube rack. The extender also provides a larger area for specimen labeling. ANTICOAGULANT: Each tube contains sufficient K 2 EDTA to anticoagulate 500 µL of skin puncture blood. EDTA functions as an anticoagulant by chelating mono- and di-valent cations. Calcium is chelated by EDTA, which prevents its activity in the coagulation process. EDTA also reduces platelet activation but does not eliminate it completely. Note: Some patients have shown a sensitivity to EDTA, resulting in significant and irreversible platelet clumping. This clumping may also artifactually elevate WBC counts. STABILITY: Store product below 25°C and use prior to expiration date. Specimens collected in the BD Microtainer® Tubes with K 2 EDTA will provide accurate and clinically useful test results for up to 4 hours after collection for hematology parameters listed above. Specimens may be stored in racks or continuously mixed during this time. Bring specimens to room temperature before analysis. Analyze specimens for hematology testing within 4 hours of collection. For lead, other analytes or alternate test methods, users must establish, to their satisfaction, that test results meet their institution’s criteria for clinically acceptable values. The user should consult their instrument manufacturer for expected specimen stability. LIMITATIONS: Blood collected by skin puncture should only be used for lead screening. Elevated blood lead results obtained on capillary specimens should be considered presumptive and must be confirmed using venous blood1. When lead testing is performed by ASV, specimens should be analyzed as soon as possible. When ASV is used, see section 9 in the instrument operating manual: Sample Related Causes Of Invalid Lead Reports. Follow manufacture’s directions in section 9.4.1: Using EDTA Stabilized Blood, for processing all specimens collected in this BD Microtainer® Tube2. An artifactual decrease in lead concentration will result if procedures for specimens with EDTA in excess of 1.8 mg/mL are not followed. Flame Atomic Absorption Spectroscopy is not recommended since EDTA may cause reduced recoveries of lead with this method. When tested by GFAAS, samples collected from normal donors in BD Microtainer® Tubes with K 2 EDTA have been shown to be stable for up to 7 days3. It is the laboratory’s ultimate responsibility to determine reference intervals for all analytes based upon the tubes used for sample collection by that laboratory. The clinical laboratory should establish or verify its reference ranges if changing specimen collection tube types and sizes, as this could potentially affect analytical results from patient samples. 3.Allow site to dry. Do not dry by wiping, as disinfection occurs during airdrying. 4.Remove closure from tube and place on a convenient (lead-free) surface. The closure may be nested on the base of the tube (Fig. 3). 5.Puncture skin with the appropriate lancet, following instructions supplied by manufacturer. Dispose of lancet in approved sharps container. Wipe away first drop of blood with gauze. 6.Hold BD Microtainer® Tubes at 30°-45° angle from surface of puncture site. (Fig. 3). Touch collector end reservoir to drop of blood. After collecting 2 or 3 drops, blood will freely flow down reservoir wall to bottom of tube. CAUTION: “Milking” of skin puncture may cause hemolysis and adversely affect test result accuracy. 7.Fill the tube to between the 250 µL and 500 µL marks on the reservoir. Over- or under filling of tube may result in clotting and/or erroneous test results. 8.Replace closure by twisting and pushing cap downward until a snap is heard. Immediately after collection mix the sample by inverting filled tube a minimum of 10 times. 9.Fill other BD Microtainer® Tubes as required following directions provided in their respective product circulars. NOTE: If capillary blood gas test is to be done, the capillary tubes used to collect samples must be filled before other samples are collected. Otherwise, the EDTA samples for hematology testing should be the first tube collected. 10.Dispose of used lancet into an approved sharps container if this has not been done. Dispose of any contaminated materials into appropriate container. 11.The specimen should mixed thoroughly just before analysis. A minimum of 20 manual inversions is recommended. WARNINGS: Practice universal precautions, using gloves and appropriate apparel for protection from exposure to blood-borne pathogens. CAUTION: Handle all biologic samples and blood collection products in accordance with policies and procedures of your facility. Obtain appropriate medical attention in the event of any exposure to biologic samples (e.g., through a puncture injury) as samples may transmit HBV (viral hepatitis), HIV (AIDS), or other infectious diseases. Discard all products contaminated with blood in biohazard containers approved for their disposal. REFERENCES: 1.Preventing Lead Poisoning in Young Children. A Statement by the Centers for Disease Control – October 1991, U.S. Department of Health and Human Services. p.41. 2.Operating Manual Model 3010B Lead Analyzer, ESA Inc. Chelmsford, MA. 01824-4171, December 1992. 3. Data on file, BD Vacutainer®. MATERIALS REQUIRED BUT NOT PROVIDED: 1. Gloves for the person performing the collections. 2. Alcohol swabs (lead-free if lead testing is performed). 3. Dry sterile gauze pads. 4. Lancet as appropriate for site and volume of blood required. 5. Sharps and contaminated materials disposal container. 6.FOR BLOOD LEAD: soap and water to wash and dry site thoroughly before puncture to minimize surface contamination of skin by environmental lead. OPTIONAL MATERIALS FOR SPECIMEN COLLECTION: 1.Warming device if required, dependent on the volume of blood and test to be performed. 2.Adhesive bandage. Avoid use of bandages with patients likely to place fingers or feet in their mouths, as ingestion/aspiration may occur. DIRECTION FOR USE: 1. Gloves must be worn during skin puncture blood collection. 2.Select puncture site, warm as appropriate, and cleanse with alcohol. FOR BLOOD LEAD: Wash area with soap and water and dry thoroughly to minimize surface contamination of skin by environmental lead. Cleanse with lead-free alcohol swab. Institutional protocols for collection of specimens for blood lead should be followed. Becton, Dickinson and Company, Franklin Lakes, NJ USA BD Microtainer® Tube avec K2 EDTA - FR UTILISATION : Le tube BD Microtainer®K2 EDTA (référence 365974) permet de recueillir le sang capillaire sur anticoagulant, de le transporter et de le conserver, dans le but de déterminer les paramètres hématologiques cités ci-après : automatiquement : lymphocytes, érythrocytes, hémoglobine, hématocrite, volume globulaire moyen, teneur corpusculaire moyenne en hémoglobine, concentration corpusculaire moyenne en hémoglobine, plaquettes, formule leucocytaire (éosinophiles, basophiles, neutrophiles, lymphocytes, monocytes) manuellement : formule leucocytaire, réticulocytes, microhématocrite (VGC) et de doser le plomb sur sang total par spectroscopie d‘absorption atomique en four à graphite (SAA) et par voltamétrie à préconcentration anodique (VPA). COMPOSANTS DU SYSTÈME : Le tube BD Microtainer® se compose d‘un tube en plastique et d’un bouchon sécurité (Fig. 1) de couleur mauve, code couleur indiquant la présence d‘EDTA. Ce dernier a été pulvérisé puis séché sur la surface interne du tube. La partie supérieure du tube est utilisée comme collecteur. Les deux lignes sur le corps du tube indiquent le 2 niveaux de remplissage (250 µl et 500 µl). Le bouchon mauve s‘adapte directement sur la partie supérieure du tube (collecteur). La forme de ce dernier a été spécialement conçue pour minimiser le risque d‘exposition accidentelle au sang lors de l’ouverture. Pour retirer le bouchon, saisir sa partie rainurée puis la tourner tout en tirant vers le haut. Pour refermer le tube, pousser le bouchon dans le tube ; un « clic » sonore se fera entendre lors de la fermeture. Un prolongateur optionnel (Fig. 2) est disponible (réf. 365976). Il s‘adapte au bas du tube afin d‘obtenir une longueur totale d‘environ 75 mm. L‘utilisation du prolongateur permet de placer le tube sur un portoir standard pour tube de 13 mm x 75 mm et offre une superficie plus importante pour son étiquetage. ANTICOAGULANT : Chaque tube contient une quantité suffisante de K2 EDTA pour anticoaguler 500 µl de sang capillaire. L‘EDTA est un agent anticoagulant qui chélate les cations mono et divalents. L‘EDTA se lie au calcium ionisé empêchant la coagulation de l‘échantillon. L‘EDTA réduit également l‘activation plaquettaire sans toutefois l’éliminer totalement (certains échantillons de patient montrent une sensibilité à l‘EDTA, qui se traduit par une agrégation plaquettaire importante et irréversible, pouvant aussi élever artificiellement la numération leucocytaire. STABILITÉ : Conserver le produit à une température inférieure à 25 °C et l’utiliser avant la date de péremption. Les échantillons recueillis avec le tube BD Microtainer® avec K2 EDTA fourniront des résultats de test exacts et utiles cliniquement jusqu‘à 4 heures après prélèvement pour les paramètres hématologiques précédemment mentionnés. Les échantillons peuvent être conservés dans des portoirs ou mélangés continuellement pendant ce temps et doivent être à température ambiante avant analyse. Les échantillons testés pour les paramètres hématologiques doivent être analysés dans les 4 heures qui suivent le prélèvement. Pour le dosage du plomb, de tout autre analyte ou pour les méthodes de tests alternatifs, l‘utilisateur établira que les résultats de test correspondent aux critères de valeurs acceptables cliniquement de l’établissement. Il est recommandé à l‘utilisateur de consulter le fabricant de l’instrument pour la stabilité requise de l’échantillon. LIMITATIONS : Le sang recueilli par prélèvement capillaire pour le dosage du plomb ne doit être utilisé que dans un but de dépistage. Une plombémie élevée sur sang capillaire doit être considérée avec précaution et confirmée par dosage à partir d’un échantillon de sang veineux1. Lorsque le dosage du plomb est réalisé par VPA, l’échantillon doit être analysé le plus rapidement possible. En cas d’utilisation de la technique VPA, l’opérateur doit se reporter à la section 9 du manuel opératoire de la méthode VPA : Sample Related Causes of Invaild Lead Reports (Causes d’Interférences liées à l’échantillon) et suivre les recommandations du fabricant de l’instrument (section 9.4.1) : Using EDTA Stabilized blood for processing all specimens collected in this BD Microtainer® Tubes (Utilisation de sang anticoagulé par l‘EDTA pour l’analyse des échantillons prélevés sur tube BD Microtainer®) 2. En cas d’échantillon inférieur à 250 µl, la concentration d’EDTA dépasserait 1,8 mg par ml de sang, entraînant une baisse artificielle de la plombémie dans l’échantillon. La spectroscopie par absorption atomique de flamme n‘est pas une méthode recommandée ; des interférences avec l’EDTA étant possibles. Avec la méthode SAA, les échantillons prélevés avec des tubes BD Microtainer® K2 EDTA chez des donneurs normaux sont stables jusqu’à 7 jours3. La détermination de valeurs de référence pour tous les dosages effectués relève de la responsabilité du laboratoire. Cette détermination doit être réalisée à partir d’échantillons prélevés sur les tubes utilisés en routine au laboratoire. Pour tout changement de type ou de taille du tube, le laboratoire doit établir à nouveau ou vérifier ses valeurs de référence (en raison de modifications potentielles des résultats). MATERIEL REQUIS MAIS NON COMPRIS : 1. Gants pour la personne effectuant le prélèvement. 2. Tampons alcoolisés (sans plomb si un dosage du plomb est réalisé). 3. Compresses stériles. 4. Lancette de taille appropriée pour le site et le volume de sang requis. 5. Collecteur pour objets tranchants et matériels souillés. 6.POUR LE DOSAGE DU PLOMB : utiliser de l’eau et du savon pour laver le site de ponction et le sécher précautionneusement (afin de réduire la contamination de la surface de prélèvement par le plomb du milieu ambiant). MATERIEL FACULTATIF POUR LE PRÉLÈVEMENT DES ÉCHANTILLONS : 1.Matériel pour chauffer le site de ponction au besoin, selon le volume de sang et l’analyse à réaliser. 2.Pansement adhésif. L’usage de pansements adhésifs doit être évité chez les patients susceptibles de porter leurs doigts ou pieds à la bouche, de par le risque d’ingestion ou d’aspiration du pansement (services de pédiatrie). INSTRUCTIONS D’UTILISATION : 1. Le port de gants est nécessaire pour effectuer le prélèvement. 2. Choisir le site de ponction, le réchauffer et le désinfecter à l’alcool. 3. Laisser sécher le site de ponction sans l’essuyer. POUR LE DOSAGE DU PLOMB : Laver le site de ponction avec de l’eau et du savon, le sécher avec précaution afin de réduire le risque de contamination du site par le plomb de milieu ambiant. Désinfecter avec un tampon alcoolisé sans plomb. Dans tous les cas, les protocoles de prélèvement établis dans le cadre du dosage du plomb doivent être scrupuleusement suivis. 4. Retirer le bouchon du tube et le placer sur une surface sans plomb ou le fixer sur la partie inférieure du tube (Fig 3). 5. Ponctionner le site à l’aide d’une lancette appropriée en se référant aux instructions du fabricant. Jeter la lancette dans un collecteur pour objets tranchants. Eliminer la première goutte de sang. 6. Maintenir le tube BD Microtainer® à un angle de 30° à 45° par rapport à la surface de la peau (Fig. 3). Mettre en contact la partie supérieure du collecteur avec la goutte de sang. Après le prélèvement de 2 ou 3 gouttes de sang, celui-ci s’écoule librement des parois du tube jusqu’au fond. ATTENTION : appuyer trop fort sur le site de ponction risque de provoquer une hémolyse qui affecte la qualité des résultats. 7. Remplir le tube le niveau de sang devant se situer entre les 2 lignes de remplissage (250 µl et 500 µl). Un sur ou un sous-remplissage du tube peut être responsable de résultats erronés et/ou provoquer la coagulation de l’échantillon. 8.Remettre en place le bouchon en le poussant et en le tournant vers le bas jusqu’à ce qu’un « clic » sonore se fasse entendre. Immédiatement après, homogénéiser l’échantillon en retournant le tube 10 fois minimum. 9.Remplir les autres tubes BD Microtainer® en suivant les instructions spécifiques fournies dans la circulaire jointe aux produits. NOTE : En cas de demande de gaz du sang par voie capillaire, l’échantillon destiné à cette analyse doit être prélevé en premier. Dans tout autre cas, commencer par le tube EDTA 10. E liminer la lancette après usage dans un collecteur pour objets tranchants si cela n’a pas déjà été fait et le matériel contaminé dans des collecteurs appropriés. 11.Homogénéiser parfaitement l’échantillon avant de réaliser les analyses par 20 retournements manuels du tube au minimum. AVERTISSEMENTS : Respecter les procédures en vigueur, utiliser des gants et le matériel approprié pour une protection contre les risques d’exposition au sang. ATTENTION : Tout échantillon biologique, tout matériel de prélèvement de sang doit être manipulé en respectant les règlements et procédures en vigueur dans votre établissement. Une attention particulière doit être apportée pour éviter toute exposition au sang ou autres liquides biologiques, ceux-ci pouvant transmettre les virus HBV (Hépatite), HIV (SIDA) ou d‘autres maladies infectieuses. Jeter tout produit contaminé par du sang dans un collecteur approprié pour son élimination. REFERENCES : 1. Preventing Lead Poisoning in Young Children. A Statement by the Centers for Disease Control – October 1991, U.S. Department of Health and Human Services. p. 41. 2. Operating Manual Model 3010 B Lead Analyzer, ESA Inc., Chelmsford, MA, 01824-4171, USA, December 1992. 3. Données disponibles – BD Diagnostics – Preanalytical Systems. Becton, Dickinson and Company, Franklin Lakes, NJ USA BD Microtainer® Tubos con EDTA K2 - ES USO PROPUESTO: El tubo BD Microtainer® con EDTA K 2 (REF.365974) se usa para la recolección, anticoagulación, transporte y almacenamiento de muestras de sangre obtenidas por punción capilar para la determinación de los siguientes parámetros hematólogicos: Automatizados: leucocitos, eritrocitos, hemoglobina, hematocrito, volumen corpuscular medio, hemoglobina corpuscular media, concentración de hemoglobina corpuscular media , plaquetas, diferencial de leucocitos (5 partes: neutrófilos, linfocitos, monocitos, eosinófilos y asófilos). Manual: diferencial de leucocitos, reticulocitos, microhematocrito; y determinación de plomo en sangre total mediante espectroscopía de absorción atómica en hornos de grafito o voltimetría anódica. COMPONENTES DEL SISTEMA: El tubo BD Microtainer® consiste en un reservorio de plástico y un tapón de color lila (Fig. 1), el cual indica la presencia de EDTA. La superficie interior del reservorio está rociada con EDTA K 2, el cual se seca posteriormente. El borde superior del reservorio sirve como receptáculo. En el reservorio hay líneas marcadas que indican niveles de llenado de 250 µL y 500 µL. El tapón de color lila se ajusta perfectamente al borde superior del reservorio para reducir la posibilidad de contacto con la muestra al quitar el tapón. Para quitar el tapón, tómelo firmemente de la parte estriada girando al mismo tiempo que lo jala. Para reinsertarlo, gírelo al mismo tiempo que lo presiona hacia el reservorio. Se escuchará un “click” que indicará que el tapón se encuentra correctamente colocado sobre el reservorio. Se dispone de una ampliación opcional (Fig. 2, REF. 365976) que se ajusta a la parte inferior del reservorio y aumenta la longitud del tubo hasta unos 75 milímetros (mm). Con esta ampliación, el tubo cabe en una gradilla estándar de 13 x 75 mm. Además, la ampliación ofrece un área mayor para rotular las muestras ANTICOAGULANTE: Cada tubo contiene suficiente EDTA K 2 para anticoagular 500 µL de sangre capilar. El EDTA actúa como anticoagulante mediante la quelación de cationes mono- y divalentes. El EDTA quela el calcio, impidiendo así su actividad en el proceso de coagulación. El EDTA también reduce la activación plaquetaria, pero no la elimina completamente. NOTA: Se ha observado insensibilidad al EDTA en algunos pacientes, lo que da lugar a una aglutinación plaquetaria significativa e irreversible. Dicha aglutinación puede asimismo elevar artificialmente el recuento de leucocitos. ESTABILIDAD: Conserve el producto por debajo de 25 °C y su uso antes de la fecha de caducidad. Las muestras recolectadas con el tubo BD Microtainer® con EDTA K 2 ofrecerán resultados de análisis confiables y clínicamente útiles hasta un máximo de 4 horas después de haber sido recolectadas para los parámetros hematológicos indicados anteriormente. Las muestras se pueden conservar en gradillas o en mezcladores continuos durante este tiempo. Lleve las muestras a temperatura ambiente antes del análisis. Las muestras para hematología deben analizarse dentro de las 4 horas posteriores a su recolección. Para el plomo, otros analitos u otros métodos de análisis, los usuarios deben confirmar que los resultados del análisis cumplen satisfactoriamente los criterios de su institución sobre valores clínicamente aceptables. El usuario debe consultar al fabricante del instumento en lo relacionado con la estabilidad esperable de la muestra. LIMITACIONES: La sangre recolectada por punción capilar sólo puede usarse para tamiz cernimiento de detección de plomo. Los valores de plomo elevados que se obtengan de muestras de sangre capilar deben considerarse presuntivos y deben confirmarse usando sangre venosa1. Cuando el análisis de plomo se realice mediante voltimetría anódica, las muestras deben analizarse lo antes posible. Cuando se utilice voltimetría anódica, consulte la sección 9 del manual de operación del instrumento (“Causas de invalidez de los resultados de plomo relacionadas con la muestra”). Para el procesado de todas las muestras recolectadas con estos tubos BD Microtainer®, deben seguirse las indicaciones del fabricante que se detallan en la sección 9.4.1 (“Uso de sangre estabilizada con EDTA”) 2. Si no se siguen los procedimientos establecidos para las muestras que tienen más de 1.8 mg/mL de EDTA, se obtendrá una concentración de plomo artificialmente reducida. No se recomienda la espectroscopía de absorción atómica de llama, ya que en este metodo el EDTA puede hacer que disminuya la recuperación de plomo. Cuando el análisis se hace mediante espectroscopía de absorción atómica en hornos de grafito, se ha comprobado que las muestras de donantes normales recolectadas con tubos BD Microtainer® con EDTA K2 son estables durante un máximo de 7 días3. El laboratorio es quien tiene la última responsabilidad de determinar los intervalos de referencia para todos los analitos en función de los tubos usados por dicho laboratorio para recolección de muestras de sangre capilar. Si se cambia el tipo o tamaño de los tubos para la recolección de la muestra, el laboratorio clínico debe establecer o confirmar sus intervalos de referencia, ya que tal cambio puede afectar los resultados analíticos de las muestras de los pacientes. MATERIALES NECESARIOS PARA LA TOMA DE MUESTRA (NO PROPORCIONADOS) 1. Guantes para la persona que toma las muestras. 2. Alcohol isopropílico (libre de plomo si se va a hacer un análisis de plomo). 3. Gasas secas estériles. 4. Lanceta adecuada para el sitio y volumen de sangre requerido. 5. Contenedores para desecho de material infeccioso y punzocortante. 6. PARA DETERMINAR PLOMO EN SANGRE: agua y jabón para lavar y secar bien el área antes de la punción, con el fin de minimizar la contaminación de la superficie con plomo del ambiente. MATERIALES OPCIONALES PARA LA RECOLECCIÓN DE LA MUESTRA 1. Dispositivo para calentamiento, si se requiere, en función del volumen de sangre y de los análisis que vayan a realizarse. 2. Cintas adhesivas. Evite el uso de cintas adhesivas en los pacientes que vayan probablemente a meterse los dedos o los pies a la boca, ya que puede producirse una aspiración o ingestión de las mismas. INSTRUCCIONES DE USO 1. Se deben usar guantes durante la recolección de la muestra capilar. 2. Seleccione el sitio de la punción, precaliéntelo y límpielo con alcohol. PARA DETERMINAR PLOMO EN SANGRE: Lave el área con agua y jabón y séquela perfectamente para minimizar el riesgo de contaminación de la superficie de piel con plomo del ambiente. Limpie con una torunda empapada en alcohol libre de plomo. Deben seguirse los protocolos institucionales para la recolección de muestras para determinación de plomo en sangre. 3. Deje que el sitio de la punción se seque. No frote para secar, ya que la desinfección se produce durante el secado al aire libre. 4. Quite el tapón del tubo y colóquelo en una superficie cercana adecuada (libre de plomo). El tapón puede colocarse en la parte inferior del tubo (Fig. 3). 5. Puncione la piel con una lanceta apropiada, siguiendo las instrucciones del fabricante. Deseche la lanceta en un contenedor adecuado. Elimine la primera gota de sangre con una gasa. 6. Sostenga el tubo BD Microtainer® en un ángulo de 30° a 45° en relación con Zla superficie del sitio de punción (Fig. 3). Haga que el extremo de recolección del reservorio toque la gota de sangre. Después de recolectar 2 ó 3 gotas, la sangre fluirá fácilmente por la pared del reservorio hasta el fondo del tubo. PRECAUCION: “Exprimir” el sitio de la punción puede causar hemólisis de la muestra y afectar la calidad de los resultados. 7. Llene el tubo entre las marcas de 250 µL y 500 µL que figuran sobre el reservorio. Llenar demasiado o insuficientemente el tubo puede hacer que se formen coágulos o se obtengan resultados erróneos. 8. Vueva a colocar el tapón, girándolo y presionándolo hasta escuchar un “click“. Inmediatamente después de recolectar la muestra, invierta suavemente el tubo un mínimo de 10 veces para mezclarla. 9. Siguiendo las instrucciones de sus respectivos folletos, llene los otros tubos BD Microtainer® que se requieran. NOTA: Si se van a analizar gases en sangre capilar, los tubos para recolectar estas muestras deberán llenarse antes que los del resto de las muestras. Si no fuera el caso, el primer tubo que deberá llenarse es el que tiene EDTA para hematología. 10. Si todavía no lo ha hecho, deseche la lanceta usada en un contenedor aprobado para objetos punzocortantes y deseche los materiales contaminados en un contenedor adecuado. 11. L a muestra debe mezclarse a conciencia inmediatamente antes del análisis. Se recomienda invertirla manualmente un mínimo de 20 veces. ADVERTENCIAS: Tome las precauciones universales. Use guantes y equipamiento adecuado para protegerse de la exposición a patógenos hemotransmisibles. PRECAUCIÓN: Manipule todas las muestras biológicas y todos los productos para la recolección de sangre según las normas y procedimientos de su lugar de trabajo. Obtenga atención médica adecuada en caso de exposición a muestras biológicas (por ejemplo una punción accidental), ya que las muestras pueden transmitir el VHB (hepatitis viral), el VIH (SIDA) y otras enfermedades infecciosas. Deseche todos los productos contaminados con sangre en contenedores de productos biopeligrosos aprobados para este fin. REFERENCIAS: 1. Preventing Lead Poisoning in Young Children. A Statement by the Centers for Disease Control – October 1991, U.S. Department of Health and Human Services. p.41. 2. Operating Manual Model 3010B Lead Analyzer, ESA Inc. Chelmsford, MA. 01824-4171, December 1992. 3. Datos de archivo, BD Diagnostics – Preanalytical Systems. Becton, Dickinson and Company, Franklin Lakes, NJ USA BD Microtainer® Tubo com K2 EDTA - PT INSTRUÇÕES DE USO: O Tubo BD Microtainer® com K2 EDTA (REF 365974) é usado para coleta, fator de anticoagulação, transporte e armazenagem de amostras de sangue para medir os seguintes parâmetros hematológicos: Automatizado: WBC, RBC, Hb, HCT, MCV, MCH, MCHC, plaquetas, contagem diferencial de glóbulos brancos, em 5 partes incluindo neutrófilos, linfócitos, monócitos, eosinófilos e basófilos Manual: Diferencial WBC, reticulócitos e microhematócritos (PVC)e chumbo no sangue total por Espectofotometria de Grafite (EG) e Voltometria por Fita Anódica (VFA). COMPONENTES DO SISTEMA: O Tubo BD Microtainer® consiste em um reservatório plástico e rolha cor roxa (Fig. 1) que indica a presença de EDTA. A parede do interior do tubo leva uma camada de K2 EDTA que é então desidratada. A borda superior do reservatório serve como um coletor. Marcas no reservatório indicam níveis de aspiração que variam de 250 µL a 500 µL. A rolha roxa encaixa-se na borda superior do reservatório reduzindo o contato potencial de amostra quando a tampa for removida. Para remover a tampa segure a borda com ranhuras salientes e gire-a enquanto a retira. Para recolocar, gire a tampa enquanto a empurra em direção ao reservatório. Perceba o clique quando a rolha estiver propriamente posicionada no reservatório. Um extensor opcional (Fig. 2) está disponível (REF 365976). O mesmo encaixa-se no fundo do reservatório e aumenta o comprimento do tubo em aproximadamente 75 mm. Com esse extensor, o tubo encaixa-se em uma estante padrão de 13x75 mm. O extensor também proporciona uma maior área para a rotulação. ANTICOAGULANTE: Cada tubo contém K2 EDTA suficiente para anticoagular 500 µL de sangue. O EDTA age como um anticoagulante seqüestrando o cálcio. O cálcio é sequestrado pelo ETDA prevenindo sua atividade no processo de coagulação. O EDTA também reduz a ativação das plaquetas, mas não a elimina completamente. NOTA: Alguns pacientes têm mostrado uma sensibilidade ao EDTA, resultando em um significante e irreversível aumento de plaquetas. Este aumento pode também elevar artificialmente o número de glóbulos brancos. ESTABILIDADE: Armazene o produto a menos de 25°C e utilize antes do final do prazo de validade. Amostras coletadas no tubo BD Microtainer® com K2 EDTA fornecerão resultados precisos e clinicamente úteis, para os parâmetros listados acima, mesmo 4 horas após a coleta. As amostras devem ser armazenadas em estantes ou continuamente homogeneizadas durante este tempo. Coloque as amostras em temperatura ambiente antes da análise. Analise as amostras para teste de hematologia dentro de 4 horas após a coleta. Para chumbo, outros analitos e métodos de testes alternados, os usuários devem estabelecer, para sua própria satisfação, que os resultados dos testes estejam de acordo com os critérios de valores clinicamente aceitáveis pela sua instituição. O usuário deve consultar o fornecedor do seu equipamento para a estabilidade esperada da amostra. LIMITAÇÕES: O sangue coletado através de punção na pele deve ser usado somente para detecção da presença de chumbo. Os resultados, indicando altas taxas de chumbo no sangue colhido através de tubos capilares, devem ser considerados como hipóteses a serem confirmadas através de coleta de sangue venoso1. Quando o teste de chumbo é feito por VFA, as amostras devem ser analisadas o mais rápido possível. Quando o VFA é usado, veja a seção 9 do manual de instruções do instrumento: Sample Related Causes Of Invalid Lead Reports (Relatórios de Causas de Invalidade de Amostras Relacionadas ao Chumbo). Siga as instruções do fornecedor na seção 9.4.1: usando sangue estabilizado com EDTA, para processo de Amostras coletadas no Tubo BD Microtainer®2. Haverá uma redução artificial na concentração de chumbo se os procedimentos para coletas com EDTA superior a 1,8 mg/mL não forem seguidos. A Espectroscopia de Chama não é recomendada, já que o EDTA pode causar redução de chumbo. Quando testadas no EG, amostras coletadas de doadores normais nos Tubos Microtainer® com K2 EDTA mostraram-se estáveis por períodos acima de 7 dias3. É responsabilidade final do laboratório determinar os intervalos de referência para todas as análises, com base nos tubos utilizados para coleta de amostra naquele laboratório. O laboratório clínico deve determinar ou verificar suas faixas de referência, em caso de mudança dos tipos e tamanhos dos tubos de coleta, uma vez que isso poderia afetar os resultados analíticos das amostras dos pacientes. MATERIAIS OPCIONAIS PARA COLETA DE AMOSTRA: 1.Dispositivo para aquecimento, se necessário, dependendo do volume de sangue e testes a serem realizados. 2.Bandagem adesiva. Deve-se evitar o uso de bandagens em pacientes que possam colocar os dedos ou pés na boca, pois pode ocorrer ingestão/ aspiração. INSTRUÇÕES DE USO: 1.Luvas devem ser utilizadas durante a punção. 2.Selecione a região de punção, aqueça apropriadamente e faça a antissepsia. PARA DETECTAR CHUMBO NO SANGUE: Lavar o local com sabão e água e enxugar cuidadosamente antes da punção, para minimizar a contaminação da pele pelo chumbo presente no ambiente. Limpar com esponja embebida em álcool, isenta de chumbo. Recomenda-se seguir os protocolos institucionais para coleta de amostras para detecção de chumbo no sangue. 3.Deixe secar. Não seque esfregando, uma vez que a desinfecção ocorre durante a ação do ar. 4.Remova a rolha do tubo e coloque-a em uma (sem chumbo) superfície conveniente. A rolha deve ser encaixada na base do tubo (Fig. 3). 5.Puncione a pele com uma lanceta apropriada seguindo as instruções do fornecedor. Descarte a lanceta em um descartador apropriado. Despreze a primeira gota de sangue com uma gaze. 6.Segure o tubo BD Microtainer® num ângulo entre 30° e 45° da área de punção (Fig. 3). Encoste a ponta do coletor do reservatório para a queda do sangue. Depois de aspirar 2 ou 3 gotas, o sangue irá cair pela parede do reservatório para dentro do tubo. CUIDADO: Se a região de punção estiver espumada poderá causar hemólise e afetar o resultado dos testes. 7.Preencha o tubo entre as marcas de 250 µL e 500 µL do reservatório. O preenchimento acima ou abaixo da marca pode causar a coagulação do sangue e/ou resultados errados. 8.Recoloque a tampa torcendo-a e empurrando-a para baixo até ouvir um clique. Imediatamente após a coleta misture a amostra invertendo o tubo no mínimo 10 vezes. 9.Encha outros tubos BD Microtainer® conforme solicitado seguindo as instruções dos folhetos informativos. NOTA: Se algum teste de gasometria tem que ser feito, os tubos capilares usados para colher as amostras devem ser preenchidos antes de outras amostras. De outra forma as amostra com EDTA para testes de Hematologia devem ser os primeiros a serem colhidos. 10.Descarte a lanceta usada em um descartador apropriado, se isto não tiver sido feito. Descarte todo material contaminado em um descartador apropriado. 11.A amostra deve ser homogeneizada antes da análise. É recomendado um mínimo de 20 inversões manuais. PRECAUÇÕES: Deve-se seguir as precauções universais, utilizando luvas e vestuário adequado para proteger-se contra a exposição aos agentes infecciosos transmitidos pelo sangue. ATENÇÕES: Manuseie todas as amostras biológicas e produtos de coleta de sangue de acordo com as políticas e procedimentos usuais. Dê apropriada atenção médica na eventualidade de qualquer exposição biológica às amostras (por exemplo, através de picada de agulha), uma vez que as amostras podem transmitir HBU (Hepatite), HIV (AIDS) ou outras doenças infecciosas. Descarte todos os produtos contaminados em coletadores aprovados. REFERÊNCIAS: 1. Prevenção à intoxicação de Crianças por Chumbo, Relatório dos Centros de Controle de Doenças, Outubro de 1991 e Departamento de Saúde e Serviços Humanos dos Estados Unidos, pág. 41. 2. Manual de Operação Modelo 3010B, Analisador de Chumbo, ESA Inc. Chelmsford MA, 01824-4171, Dezembro de 1992. 3. Dados de arquivo da BD Diagnostics – Preanalytical Systems. MATERIAIS NECESSÁRIOS MAS NÃO FORNECIDOS: 1. Luvas para coletadores. 2.Esponja com álcool (sem chumbo, no caso de teste de detecção de chumbo). 3. Gazes estéreis secas. 4. Lancetas apropriadas para o volume de sangue necessário. 5.Decartador de agulhas e materiais contaminados. 6.PARA DETECTAR CHUMBO NO SANGUE: Lavar o local com sabão e água e enxugar cuidadosamente antes da punção, para minimizar a contaminação da pele pelo chumbo presente no ambiente. Becton, Dickinson and Company, Franklin Lakes, NJ USA マイクロティナ - JA 適用: K 2 EDTA入りマイクロティナ チューブ(カタログ番号365974)は、下記の血液 検査項目測定のための、皮膚 穿刺血液の採取、抗凝固、輸送、保管に使用します。 自動分析法: WBC、RBC、Hb、HCT、MCV、MCH、MCHC、血小 板、5分画白血球分類(好中球、リンパ球、単球、好酸球、好塩基球) 手動: 白血球分類、網状赤血球、 マイクロヘマトクリット(PVC)、およ びGFAAS(graphite furnace atomic absorption spectroscopy) とASV(Anodic Stripping Voltametry)による血中鉛測定 製品構成: マイクロティナ チューブは、プラスチック製チューブ本体と紫色のキャップ から成り、紫色のキャップはEDTA入りであることを示しています(FIG.1)。チ ューブの内壁にはK 2 EDTA液をスプレーコーティングし、乾燥してあります。チ ューブ上部の採取口は、検体の採取に使用できます。チューブ本体には250 µL と500 µLの容量レベルが表示されています。紫色のキャップは、採取口にぴっ たりとフィットし、キャップをはずす際に検体に接触する危険を防ぎます。 キャップを外すには、キャップのリブをつかみ、回しながら引っ張 ります。キャップを閉めるには、回しながらチューブに押し込みます。キ ャップがチューブに正しくはまるときには、パチンと音がします。 オプションとしてエクステンダー(FIG.2)も用意されています (REF 365976)。これをチューブ本体の下部に取り付けると、チューブ 長さを約75 mmに延ばすことができます。エクステンダーを付けても チューブは標準の13×75 mm採血管用ラックに収まります。また、エクス テンダーを用いると、検体ラベルの貼付場所が大きくなります。 抗凝固剤: 個々のチューブには、皮膚穿刺による血液500 µLの凝固を防ぐのに十分な量 のK 2 EDTAが含まれています。EDTAは、一価および二価の陽イオンとキレート結 合することにより、抗凝固剤として機能します。EDTAはカルシウムとキレート結合 し、血液凝固プロセスにおけるカルシウムの働きを防止します。また、EDTAは血小 板の活性化を弱めますが、完全に活動を阻害するわけではありません。注: 患者の 中には、EDTAに過敏な人もおり、不可逆的かつ顕著な血小板凝集を起こすことが あります。この血小板凝集により、見かけ上、白血球数が増加することがあります。 安定性: 25°C 未満で保管し、有 内に使用してください。 K 2 EDTA入りマイクロティナ チューブに採取した検体は、4時間以 内に検査することにより、上記血液検査の正確な結果が得られます。検 体は検査までの間、室温でラックに保管するか、または連続的に混和 させます。検体は、分析にかける前に室温に戻しておいてください。 検体の採取から4時間以内に、血液分析検査を行ってください。血中鉛検 査で、前記以外の検査方法をとる場合は、検査結果が各医療機関の臨床検査 許容基準に適合することを十分に確認して手法を確立してください。また、検 体の安定性予測については、ご使用の検査機器メーカーにご相談ください。 5.適切なランセットで、そのメーカーの取扱説明書に従い、皮膚を穿刺します。ランセ ットは廃棄容器に捨てます。最初の1滴はガーゼで拭き取ります。 6.マイクロティナチューブを穿刺部位に対して30°~45° の角度に持ちます (FIG.3)。 穿刺部位に採取口を付けて血液を採取します。2~3滴採取すると、血液はチューブ の壁面に沿って自然に流れ落ちていきます。注意: 皮膚穿刺箇所で血液を絞り取る と、溶血を起こし、検査結果の精度に影響を及ぼすおそれがあります。 7.チューブ本体の250 µLと500 µLの印の間になるように、血液を採取します。採血 量が多すぎたり少なすぎたりすると、血液が凝固したり、正しい検査結果が出ない ことがあります。 8.キャップをチューブに押し込むようにして回し(パチンと音がするまで)、取り付けま す。採血後、ただちにチューブを最低10回、転倒混和してください。 9.必要に応じて、それぞれの製品説明書の指示に従い、他のマイクロティナ® チューブ に採血を行います。注意: 毛細血管の血液ガス検査を行う場合は、他の検査用に 採血を行う前にキャピラリーチューブに採血する必要があります。毛細血管の血液 ガス検査を行わない場合は、最初に血液検査用EDTA入りチューブに採血します。 10.使 用したランセットなど、まだ廃棄していないディスポーザブル器材があれば、廃 棄容器に捨てます。採血で汚染されたものは、すべて廃棄容器に捨てます。 11.検体は分析直前に十分に混和してください。最低20回は転倒混和を行ってくださ い。 警告: 血液による病原性物質に曝露するのを防ぐため、手袋や適切な衣 類を着用するなどの一般的な注意事項を励行してください。 注意: 生物学的検体および採血器具類はすべて、各施設の方 針および手順に従って取り扱ってください。 生物学的検体に接触した場合 (例えば針刺し事故 など) は医師に連絡してください。検体にHBV (肝炎ウイルス)、HIV (エイズ) ウイルスなどの伝染 性病原菌が含まれているおそれがあります。 血液で汚染した製品はすべて、バイオハザード (生物学的危 険物質) 廃棄用に定められた容器に廃棄してください。 参考文献: 1.Preventing Lead Poisoning in Young Children.A Statement by the Centers for Disease Control – October 1991, U.S. Department of Health and Human Services. p.41. 2.Operating Manual Model 3010B Lead Analyzer, ESA Inc. Chelmsford, MA.01824-4171, December 1992. 3. Data on file, BD Diagnostics – Preanalytical Systems. 本製品の制約: 皮膚穿刺によって採取された血液は、血中鉛のスクリーニング検 査用として使用してください。毛細血管血で得られた血中鉛の値が高い 場合は、参考値として扱い、静脈血で確認する必要があります1。 ASVによる血中鉛検査は、検体採取後ただちに行ってください。ASVを使用す る場合は、検査機器使用説明書の第9章 ”Sample Related Causes Of Invalid Lead Reports” を参照してください。また、 マイクロティナ チューブに採取したあら ゆる検体の処理については、メーカー指示書の9.4.1項 ”Using EDTA Stabilized 2 Blood” を参照してください 。EDTA濃度が1.8 mg/mL以上の検体で処理を行 わなかった場合は、血中鉛の濃度が人為的原因で低く検出されることになります。 FAAS(Flame Atomic Absorption Spectroscopy)は、EDTA によって血中鉛の検出濃度が低く出ることがあるため、適していませ ん。GFAASによる検査の場合は、K 2 EDTA入りマイクロティナ チューブに 採取した正常の検体で、最長7日間まで安定した結果が得られます3。 検体採取を比較対照するために基準値の範囲を決定する作業 は、各検査室で行わなければなりません。検体を採取するチューブの タイプやサイズを変更すると、検体の検査結果に影響を与えることが あります。従って、チューブのタイプやサイズを変える場合、基準値の範 囲を決定・検証する作業は、各検査室で行う必要があります。 用意する必要のある材料: 1. 採血者が使用する手袋 2. アルコール消毒綿(血中鉛検査を行う場合は無鉛のもの) 3. 滅菌済みの乾いたガーゼ 4. 採血部位と採血量に適したランセット 5. ランセットや汚れた器材などを入れる廃棄容器 6.血中鉛測定用: 皮膚に付着している環境中の鉛の混入を最小限にするために、 穿刺部位を水と石鹸でよく洗い、完全に乾かしてください。 検体採取には次のものが必要な場合があります: 使用方法: 1. 皮膚穿刺による採血時には手袋を着用してください。 2.穿刺部位を決定し、必要であれば温め、アルコールで拭きます。血中鉛測定用: 皮膚に付着している環境中の鉛の混入を最小限にするために、穿刺部位を水と 石鹸でよく洗い、完全に乾かしてください。無鉛のアルコール綿で拭いてくださ い。各施設の、血中鉛検査の検体採取手順に従ってください。 3.アルコールを乾かします。風乾中に消毒が行われますので、アルコールを拭き取 らないでください。 4.キャップをはずし、適切な(鉛のない)場所に置きます。キャップはチューブ本体 の底に付けておくこともできます(FIG.3)。 Becton, Dickinson and Company, Franklin Lakes, NJ USA