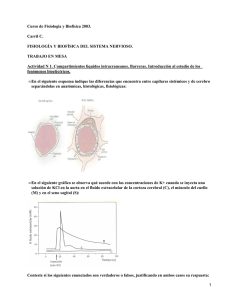
Líquidos y electrólitos
Anuncio

UNIVERSIDAD DE ANTIOQUIA FISIOLOGIA HUMANA LIQUIDOS Y ELECTROLITROS FACULTAD DE QUIMICA FARMACEUTICA QUIMICA FARMACEUTICA Medellín, octubre 2003 LIQUIDOS Y ELCTROLITOS El agua es el constituyente más abundante en los seres vivos. Ella representa en un individuo adulto entre el 5Oy 60% de su peso corporal, el porcentaje restante, entre 40 y 50%, corresponde al tejido adiposo y a los tejidos de sostén. • Distribución de líquidos y sólidos por edad y sexo Hombre Mujer Senil Agua 60 50 55 Tejido adiposo 18 32 30 Tejido de sostén 22 18 1 15 La mayor proporción de agua con respecto al peso se encuentra en la etapa fetal, en promedio un 90%, con un rango entre 85 y 95%. En el recién nacido, el agua corporal total tiene un valor medio de 75% y su rango oscila entre el 65 y el 85%. Con el crecimiento, debido al incremento del numero de células, del tamaño de los tejidos y del contenido graso, el contenido de agua corporal total acentúa su disminución, encontrándose al final del tercer mes de vida un valor promedio de 70% entre 65 y 75%. A partir de este momento, y hasta el primer año de vida, la disminución del agua corporal total es alrededor de un 10%, alcanzando al final del año las mismas proporciones del adulto; con pequeñas fluctuaciones se mantendrá así hasta la adolescencia, cuando por acción predominantemente hormonal aparece la diferencia por sexo en el contenido de agua corporal total, en promedio un 60% (55−65%) en el hombre y un valor medio de 50% (45 y 55%) en mujeres. Ahora bien, los cambios inherentes al proceso del envejecimiento, como la desecación y la atrofia tisular, producen una disminución adicional del contenido hídrico de aproximadamente un 5% Se ha dado unos rangos muy amplios en el contenido del agua corporal total, que podrían hacer pensar que el contenido hídrico de un individuo aislado es variable; pero esto no es correcto, ya que el peso corporal y, por lo tanto, el contenido de agua son constantes de un día a otro en el individuo normal, en equilibrio calórico, a pesar de las fluctuaciones notables en la ingestión líquida Podemos decir que la variación del agua corporal total en relación con el peso del cuerpo determinado de un grupo de individuos es, sobre todo, función de la cantidad de tejido graso. En sujetos delgados, la proporción de agua corporal total es alta; en sujetos obesos, por el contrario, es baja. Al parecer, la mayor proporción de grasa en la mujer es lo que hace que su contenido hídrico sea menor DISTRIBUCIÓN HIDRICA • ADULTO El agua corporal total está distribuida principalmente en dos compartimientos, que difieren en su composición y se designan como el compartimiento del líquido intracelular y el compartimiento del líquido extracelular. La barrera límite que separa los dos compartimientos mencionados es la membrana celular. Líquido intracelular En el adulto, su volumen representa del 33 al 40% de su peso corporal o las dos terceras partes del agua corporal total. Para fines prácticos, al volumen del compartimiento intracelular se le asigna un valor promedio de 40%. El líquido intracelular no es una fase continua ni homogénea, pues representa la suma del contenido de todas las células del cuerpo, no todas con la misma composición. Los eritrocitos, las células musculares, los hepatocitos, contienen evidentemente proteínas funcionales muy distintas, por lo cual su composición hídrica difiere. Sin embargo, los líquidos intracelulares son cualitativamente semejantes. Los cationes principales, como veremos más adelante, son el potasio y el magnesio, mientras que la concentración de sodio es relativamente baja. El cloro se encuentra en concentración menor en el agua intracelular y se cree que falta prácticamente en las células musculares. Del mismo modo, el bicarbonato suele hallarse en concentración mucho más baja, lo que indica un pH menor intracelular. Los aniones principales son las proteínas, los fosfatos y los sulfatos, Aproximadamente el 75% del volumen celular corresponde al agua, pero la proporción 2 de ella varía de un tejido a otro: es mínimo en la dentina (10%) y máxima en la sustancia gris (85%). Liquido extracelular El volumen de este compartimiento representa aproximadamente del 18,5 al 27% del peso corporal del adulto, o una tercera parte del agua corporal Total; para fines prácticos el valor asignado es de 20%. al compartimiento intracelular pertenecen todas las células del cuerpo, a pesar de su localización, entre las cuales se incluyen células musculares, las células viscerales, las células sanguíneas y la piel. Considera como tejidos extracelulares el esqueleto, el tejido conectivo densovaina, fascia y tendón, el colágeno y el tejido elástico. El compartimiento del liquido extracelular se divide, a su vez, en dos grandes subcompartimientos: el compartimiento del liquido plasmático y el compartimiento Del líquido intersticial. El compartimiento del líquido plasmático varía muy poco de un individuo a otro; su valor es de aproximadamente 4,5% del peso corporal. Aunque el valor promedio asignado es del 5%. El principal catión del plasma es el sodio y los aniones más importantes son el cloro, el bicarbonato y las proteínas. A causa de su gran tamaño, las proteínas ocupan un volumen desproporcionado en relación con su concentración molar. En concentraciones normales, el agua sólo representa el 93% del volumen total del plasma, mientras que el otro 7% está ocupado por las proteínas. La mayoría de los iones y de las proteínas están disueltos en la fase acuosa del plasma y sus actividades químicas están en función de sus concentraciones. Liquido intersticial. Este compartimiento tiene un valor entre el 14 y el 22,5% del peso corporal; con un valor promedio asignado del 15%. El liquido intersticial es un ultrafiltrado del plasma; por lo tanto, su composición es semejante. Se podría esperar que la concentración de los solutos difusibles fuese idéntica a la del plasma esto es cierto sólo para partículas sin carga, pues la distribución de los iones a través de las paredes capilares está sujeta a ciertas restricciones como resultado del efecto anterior, la concentración de cationes es algo menor que la de aniones. Hasta hace poco se consideraba como un fluido libre, pero en la actualidad se sabe que se halla en estado de gel; en consecuencia, el agua se encuentra en pequeños espacios rodeados de proteoglicano y sólo el 1% puede circular libremente. Recordemos que un gel se caracteriza por la inversión de las fases del coloide, el agua pasa a constituir la fase dispersa y las sustancias coloidales el medio de dispersión: su consistencia recuerda al estado sólido. Aproximadamente el 89% del volumen del líquido intersticial corresponde al agua. Si bien el compartimiento del liquido intersticial ha sido dividido a su vez en varios subcompartimientos, esta división es más funcional que anatómica y está basada, fundamentalmente, en la rapidez de intercambio con el compartimiento plasmático. Se habla, en consecuencia, de: agua ósea (o inaccesible), cuyo intercambio con el compartimiento plasmático es demasiado lento; agua del tejido conectivo denso y cartilago, la cual presenta un intercambio lento con el plasma; agua intersticial propiamente dicha o efectiva, de rápido intercambio con el pluma y agua linfática (o linfa), constituida por el líquido intersticial que penetra a los vasos linfáticos. Líquido transcelular Su volumen representa aproximadamente el 1,5% del peso corporal total. Algunos consideran que el 3 compartimiento del líquido transcelular es una parte especializada del extracelulan otros, en cambio, prefieren designarlo como un tercer compartimiento. Comprende este compartimiento los líquidos: cefalorraquídeo. intraoculares, auditivos, pleural, pericárdico, peritoneal, sinovial y las secreciones digestivas. Lo que distingue al líquido transcelular del extracelular es que sus distintas fracciones discontinuas se encuentran separadas del pluma sanguíneo, no sólo por el endotelio capilar sino, además, por una capa de células epiteliales que modifican en grado variable la composición de este líquido con respecto a la del extracelular. • NIÑO La distribución del agua corporal en los diferentes compartimientos varía fundamentalmente en el niño hasta el cuarto año de vida, cuando la distri-bución es más o menos semejante a la del adulto. En el recién nacido a término el agua intracelular representa el 35% y la extracelular el 40%; en esta última. El líquido intersticial contribuye con un 35% mientras que el líquido plasmático sólo lo hace con un 5%. Con el crecimiento y desarrollo, la cantidad relativa de agua intracelular aumenta progresivamente. disminuyendo en cambio, la extracelular. Hacia el final del tercer mes de vida, la distribución de agua corporal total se ha modificado sustancialmente. El agua extracelular ha presentado una rápida caída y sólo representa el 30%. mientras que la intracelular el 40%. El cambio se ha debido, fundamentalmente, a la disminución del líquido intersticial, ya que el volumen del líquido plasmático no ha experimentado variación. El líquido intersticial continúa progresivamente disminuyendo hasta alcanzar los valores del adulto, esto es. de un 15% Medición de los compartimientos hídricos En el hombre y en los animales de experimentación se puede medir el contenido del agua del cuerpo y los volúmenes de varios compartimientos líquidos con diversos grados de precisión, utilizando el método de dilución con un indicador. El principio en que se basa esta medición es sencillo; sin embargo, en su aplicación práctica surgen dificultades. Supongamos que se desea medir el volumen que el agua ocupa en un recipiente de forma rara y de dimensiones indeterminadas. Si agregamos al agua una cantidad conocida de un indicador (Q) y se deja transcurrir el tiempo suficiente para que su distribución sea uniforme, se puede estimar el volumen del agua (1'), determinando la concentración del indicador (C). y = Q/C La medición del volumen de un compartimiento, utilizando la técnica de dilución de un indicador, sólo proporciona la estimación exacta del volumen de dicho compartimiento si satisface ciertas condiciones: 1. El indicador debe estar distribuido uniformemente en el compartimiento en cuestión y no deberá penetrar a ningún otro compartimiento. 2. Si en el intervalo durante el cual se hace la medición ocurre excreción o degradación metabólica de la sustancia. Es necesario la estimación exacta cíe este fenómeno con el fin de poder aplicar la corrección adecuada. 3. La sustancia indicadora debe ser de fácil medición, no tóxica y no debe alterar la distribución del agua del cuerpo. 4 La manera más cómoda de efectuar la corrección por la pérdida eventual del indicador es obtener varias muestras de plasma a intervalos cronometrados. La desaparición del indicador en el plasma sigue de ordinario una cinética de primer orden esto es, su velocidad de desaparición es proporcional a la concentración y, la gráfica semilogaritmica de la concentración en función del tiempo se vuelve lineal una vez el indicador se haya dispersado en su volumen de distribución. La extrapolación de esta porción lineal de la curva a un tiempo cero da la concentración del indicador en el plasma que se hubiera hallado de haber ocurrido mezcla instantánea y uniforme del indicador en su volumen de distribución, sin excreción ni destrucción. Agua corporal total Las sustancias que se emplean comúnmente para su medición son la antipirina y sus derivados y las dos clases de agua pesada, el óxido de deuterio y el agua tritiada. Se determina la cantidad de óxido de deuterio por su efecto sobre la densidad del agua y la del agua tritiada, que es radioactiva, en un contador de centelleo de fase líquida. La antipirina se determina mediante análisis químico y. debido a la facilidad de su medición, es la sustancia de elección. Las sustancias anteriormente mencionadas se distribuyen de un modo rápido y uniforme, de ordinario es necesario un lapso de dos horas o menos para lograr el equilibrio que permitirá la determinación razonablemente exacta del agua corporal. El cálculo final debe corregirse por la pérdida de agua excretada en orina, heces, sudor y respiración durante el período experimental. Volumen plasmático La sustancia comúnmente empleada para la determinación del volumen plasmático es la albúmina humana marcada con yodo radioactivo o con el colorante azul de Evans. Como la albúmina no queda confinada en el espacio intravascular sino que algo de ella pasa al líquido intersticial, el tiempo escogido para el equilibrio debe ser relativamente corto o se debe interpolar a un tiempo cero. Suele utilizarse, igualmente. Glóbulos rojos marcados con isótopos del fósforo (>32) o con cromo (Cr51). Los indicadores se incorporan rápidamente a la circulación y se distribuyen unifor-memente por el compartimiento vascular en un intervalo de diez a quince minutos. Cuando se utilizan eritrocitos, ellos se extraen del sujeto problema y posteriormente se exponen a cromo o a fósforo radioactivo para ser luego inyectados y medir así su volumen de distribución. Como el volumen de sangre circulante es igual al volumen de plasma más el volumen de eritrocitos, puede estimarse el volumen de sangre utilizando la fórmula dada a continuación: VS = VP 100 − 0,96 lito Donde VS representa el volumen sanguíneo, VP el volumen plasmático, lito el valor del hematocrito, y 0,96 es el factor de corrección Volumen del liquido extracelular El compartimiento del liquido extracelular se ha definido convencionalmente como el volumen de liquido externo a las células con el cual se establece el equilibrio por medio de la difusión. No es de sorprender que su volumen no pueda ser medido con precisión, ya que existe el problema de no encontrar una Sustancia que reúna las características necesarias para poder difundirse por todo el espacio intersticial sin penetrar al intracelular. El volumen medido depende, pues, de la sustancia de referencia empleada y podríamos expresamos con más precisión, aunque con menor significado fisiológico, si habláramos del volumen de distribución de un indicador específico en vez del volumen extracelular per se. Para la estimación del volumen extracelular se ha utilizado numerosas sustancias, entre ellas: inulina, sacarosa. manitol, sulfato de radio, tiosulfato, tiocianato. Bromuro radioactivo y radiosodio. Las estimaciones del volumen extracelular varían 5 desde el 16% hasta el 27% del peso corporal. Volumen del liquido Intracelular El volumen del liquido intracelular no puede ser medido directamente sino que se calcula como la diferencia entre el agua total del cuerpo y el agua extracelular. Por ello, su estimación esta limitada por las incertidumbres de ambas mediciones. Liquido intracelular = agua corporal total − agua extracelular Volumen del líquido intersticial El liquido intersticial se define como la porción extravascular del líquido extracelular. Su cálculo está sujeto a la misma incertidumbre que la del líquido intracelular. Líquido intersticial = líquido extracelular − líquido plasmático BALANCE HÍDRICO • Balance hídrico en el adulto Ganancia hídrica La ganancia hídrica en condiciones normales proviene por completo de las sustancias que ingresan al organismo a través del tracto gastrointestinal. Esta ganancia comprende: Agua bebida Son los líquidos acuosos que ingresan como tales, los cuales proporcionan de 500 a 1600 ml/día. Sin embargo, la cantidad de agua bebida varía de un día a otro en una misma persona y es diferente en los individuos. Es mayor durante el ejercicio y se incrementa con el aumento de la temperatura ambiental, es así como en climas templados oscila entre 800 a 2500 ml/día. La absorción del agua ingerida ocurre en el tracto gastrointestinal, en res-puesta al transpone activo de solutos desde la luz intestinal hacia el plasma. Agua liberada El agua liberada de los alimentos es la cantidad de agua que contienen los alimentos sólidos o semisólidos, los cuales proporcionan de 750 a 1000 ml/día. Con referencia a lo anterior, anotemos que la carne magra contiene de 50 a 75% de su peso en agua, las legumbres de un 90 a 97% y el pan de 35 a 38%. Agua de oxidación endógena La oxidación de nutrientes es la fuente de una cantidad de agua que alcanza de 200 a 350 ml/día. La oxidación de 100 g de grasa produce 100 ml de agua, la de 1(X) g de carbohidrato produce 60 ml y la oxidación de 100 g de proteína produce 45 ml. Como regla general, la producción endógena de agua es de 10 ml de agua por cada 100 cal. De estas fuentes de ganancia hídrica sólo la ingestión líquida puede ser modificada en respuesta a la sensación de sed, de acuerdo a las nece-sidades corporales Pérdida hídrica 6 La pérdida, eliminación o excreción de agua en condiciones normales ocurre a través del tracto respiratorio, la piel, el tracto digestivo y los riñones. Eliminación hídrica por el tracto respiratorio (vía bucal, nasal y pulmonar) Es un fenómeno físico, debido a la diferencia de tensión de vapor de agua entre el aire inspirado y cl espirado, dado que el aire inspirado a temperatura y humedad del ambiente, pasa a través de las vías de conducción saturandose en su recorrido de vapor de agua. Como se deduce claramente, esta pérdida se modifica fundamentalmente por factores ambientales como la temperatura y la humedad; depende de la temperatura corporal y de la frecuencia respiratoria y es de 400 ml/día en condiciones normales. Es importante anotar que la pérdida es exclusivamente de agua sin electrólitos. Eliminación hídrica por la piel Varía fundamentalmente con la temperatura ambiental. A temperaturas por debajo de 30C, una pequeña cantidad de agua se desplaza pasivamente a través de la epidermis hacia la superficie cutánea, donde es evaporada. Esta pérdida es casi imperceptible, por lo cual se le denomina perspiración insensible o difusión transcutanea; se registran cambios con la temperatura y la humedad ambientales. La velocidad de evaporación está en función de la superficie cutánea. A temperaturas por encima de 30W ocurre un aumento lineal en la perspiración e igualmente se estimula la sudoración, transpiración visible que, a diferencia de la perspiración insensible, es un proceso activo gracias al cual se elimina agua y algo de electrólitos a través de la superficie cutánea. Dicha eliminación es efectuada por las glándulas sudoríparas exocrinas especializadas, cuya actividad es estimulada por vía nerviosa simpática. El ritmo de secreción del sudor varía según los individuos y se encuentra modificado, al igual que la perspiración, por la temperatura y la humedad ambientales. Además, la actividad muscular que se esté efectuando afecta el ritmo de secreción del sudor. Las diferencias en la cantidad de sudor entre las diversas razas es de tipo ambiental. En épocas frías, la pérdida de agua en forma de sudor es baja cuando el sujeto descansa tranquilo y sólo ocurre en sitios de aposición de la piel como en las axilas, las ingles y los pliegues mamarios. La composición del sudor es cualitativamente parecida a la del líquido extracelular, con sodio y cloro como componentes iónicos predominantes, pero casi siempre hipotónica con relación al plasma. Sin embargo, su com-posición puede ser muy variable, ya que las concentraciones relativas de sodio y potasio están bajo el control hormonal de la aldosterona. Las pérdidas hídricas por la piel varían de 400 a 800 ml/día. Las pérdidas hídricas por la piel y los pulmones reciben el nombre de pérdidas insensibles. Su función principal es disipar cl calor, con el objeto de mantener constante la temperatura corporal. Composición electrolítica del sudor Sodio Potasio Obro Amoniaco Urea Intervalo 10−77 4−9 5−65 2−6 6−12 Promedio 48 6 40 4 7 La evaporación acuosa consume aproximadamente el 25% de la producción calórica total del organismo. 7 Las pérdidas insensibles pueden aumentarse en estados febriles las pérdidas de agua en el adulto aumentan de 100 a 150 ml/día por cada grado centígrado que aumente la temperatura corporal, con el ejercicio violento, o bajo condiciones ambientales extremas. Eliminación hídrica por tracto gastrointestinal Es otra vía a través de la cual se elimina agua. Los intercambios diarios de agua y electrólitos entre el compartimiento extracelular y el conducto gastrointestinal son bastante grandes. Normalmente la mayor parte del liquido es absorbido y la pérdida neta es pequeña o casi nula, en adultos con una dieta promedio es de unos 50 a 200 ml/día. Una dieta rica en vegetales aumenta esta pérdida, la constipación por desecación de las fecales la disminuye. Evidentemente. el conducto gastrointestinal puede convenirse en una importante vía de eliminación de agua y electrólitos si disminuye su absorción. Es obvio que las copiosas eliminaciones que suelen ocurrir en el vómito, en la diarrea, etc., en una fístula intestinal, conducen rápidamente a una profunda disminución del líquido extracelular, además de una distorsión considerable en su composición electrolítica. Exceptuando la saliva que es hipotónica, la concentración total de solutos en la mayoría de las secreciones gastrointestinales es muy similar a la del líquido extracelular, su pérdida, en consecuencia, ocasiona deficiencias isotónicas. No obstante, la concentración de cada uno de los electrólitos en las diversas secreciones del conducto gastrointestinal es variable. Así por ejemplo, la secreción gástrica contiene menos sodio y cloro que el plasma, pero es más rica en potasio e hidrogeniones que él. El jugo pan-creático es rico en bicarbonato, tiene la misma concentración plasmática de sodio y potasio pero su contenido de cloro es más bajo. Las secreciones ileal y cecal contienen abundante potasio. Con respecto a la primera podemos anotar que su contenido de cloro está un poco por debajo del contenido plasmático de este ion, el de sodio, por el contrario, está muy por debajo Por lo expuesto anteriormente, podemos damos cuenta que los transtornos electrolíticos específicos dependen del líquido que se elimine. Además del trastorno hidroelectrolitico que se presenta, suelen ocurrir concomitantemente alteraciones del equilibrio ácido−básico: la clase de trastorno depende igualmente del liquido que se elimine. Volumen y composición de las secreciones gastrointestinaler Saliva Gástrica Duodeno−yeyuno lleon Jugo biliar Jugo pancreático Total Volumen 1,5 2,5 2 1 1 1 9 Nt 20 60 105 115 145 140 585 IÇ 15 10 5 5 5 5 45 a 15 90 100 105 100 80 490 Eliminación hídrica por riñones Puede considerarse, en términos amplios, como la verdadera regulación hidrica corporal, ya que las pérdidas hídricas diarias por el conducto gastrointestinal y por evaporación son, como hemos visto, en su mayor parte inevitables y de difícil control. La excreción acuosa renal representa básicamente la diferencia entre la cantidad ingerida y las pérdidas por heces, piel y pulmones. 8 El riñón es el órgano efector del mecanismo homeostático encargado de la regulación hídrica, gracias al cual la constancia del medio interno se mantiene. En circunstancias fisiológicas, el volumen de orina puede variar ampliamente y la velocidad de excreción de solutos puede regularse de manera independiente, en respuesta a los requerimientos del balance hidroelectrolítico Pérdida hídrica diaria en adultos Tracto digestivo Tracto respiratorio Tracto urinario Piel Subtotal Limite de pérdida Obligatario 60−200 400 600 400−Bco 1450−2000 1450−3600 Faculta Uva 1000−1600 1000−1600 Balance hídrico en el niño Como acabamos de ver, en el adulto normal la ganancia hídrica diaria (1450−a 3600 ml) sólo representa del 2 al 4% de su peso corporal total. Como veremos más adelante, en los niños dicha ganancia hídrica corresponde entre un 10 a un 15% de dicho peso. En condiciones normales, el calor producido por la actividad celular requiere de vados mecanismos para su disipación: evaporación de agua (calentamiento y humectación del aire inspirado. (perspiración y transpiración) mediante la cual se disipa el 30% del calor, radiación, la cual es responsable del 50% de la disipación del calor, mientras que la convección contribuye aproximadamente con un 15%. Finalmente, la conducción contribuye a la pérdida del calor con un 3%. El 2% restante es disipado concomitantemente con la excreción de heces y orina. Por cada 100 calorías metabolizadas por un organismo normal la demanda de agua es de 110 a 150 ml. La posibilidad de ser una u otra cantidad está dada por el funcionamiento renal. Si el riñón concentra la orina a una densidad aproximada de 1020. sólo necesitará 40 ml de agua por cada 100 calorías para poder eliminar la carga osmolar que ellas significan. Si por el contrario, el riñón concentra a una densidad de 1010, necesitará el doble (80 ml) para excretar la misma carga osmolar. Ahora bien, en niños la mejor manera de expresar sus necesidades hídricas es relacionándolas con el consumo calórico. Requerimientos hídricos por cada cien calorías metabolizadas Tracto digestivo Tracto respiratorio Tracto urinario Piel Requerimientos Agua 8 14 40−80 48 10−150 Ganancia hídrica 9 Si bien las necesidades calóricas pueden calcularse a partir de la superficie corporal, mejor que por la edad o por el peso, el conjunto final de las necesidades depende del ritmo de crecimiento, de la sensación de bienestar y de saciedad. Se ha calculado una necesidad calórica diaria de 100 a 120 cal/kg de peso para el primer año de vida. Esta cifra disminuye durante el período de crecimiento y desarrollo en 10 cal cada tres años, con excepción del período de la pubertad, cuando ocurre un incremento de estas necesidades Es conveniente agregar que durante el ayuno el consumo calórico se hace a expensas de las grasas y las proteínas, por lo cual la carga osmolar renal es mayor, productos nitrogenados de desecho, los requerimientos hídricos aumentan proporcionalmente. Ahora es posible entender porqué el niño necesita proporcionalmente mas agua que el adulto: su metabolismo celular y por ende el consumo calórico es mayor, al igual que su superficie corporal, lo que incrementa la pérdida hídrica a través de la piel. Aproximadamente del 0,5 al 3% del liquido ingerido diariamente es retenido, lo cual significa que el niño en condiciones normales presenta un Consumo de balance hídrico positivo, que en ningún momento se acompaña de las manifestaciones clínicas de la sobrehidratación. La magnitud de esta retención hídrica está dada por la velocidad de crecimiento. Necesidad diaria de calorías y agua en finos Lactante años 1−3 4−6 7−9 10−12 13−15 Calórico 110 Agua mL/'kg 150 100 90 80 70 80 125 100 75 75 50 Pérdida hídrica La pérdida, eliminación o excreción de agua en niños se efectúa a través de las mismas vías que en el adulto, pero con algunas diferencias que revisten importancia, dado que en niños las pérdidas insensibles son proporcionalmente mayores. La pérdida hídrica diaria es alrededor de 600 mlJm2 de superficie corporal hasta los dos años de edad, en niños mayores es de 500 ml/m Por peso corporal, la pérdida es de 75 a 300 ml/día en niños con 2 a 10 kg de peso y de 300 a 600 ml/día en niños con un peso mayor a 10 kg. En términos generales, podemos decir que la pérdida hídrica por la piel es del 40 al 50%, por el tracto gastrointestinal la pérdida es del 3−10% y por el riñón es cl 40−50% restante. Como habíamos mencionado, la velocidad de evaporación esta en función de la superficie cutánea y por ello las pérdidas insensibles son mucho mayores en los niños lactantes y en los pequeños, en los cuales la relación entre superficie corporal y peso es mucho mayor que en el adulto. Este es un factor importante en el desarrollo de la deshidratación, mucho más rápida y grave cuando se produce en lactantes y niños a los cuales se les ha restringido la ingesta hídrica. 10 La cantidad de agua que se pierde por heces es un poco menor que en el adulto. En niños de 2 a 10 kg de peso se pierde, en promedio, de 25 a 40 ml/día, en niños con un peso corporal entre 10 y 40 kg la pérdida es de 40−110 ml/día. Finalmente, la eliminación urinaria en niños con un peso corporal menor de 10 kg varía entre 200 a 500 ml/día, en niños de 10 a 40 kg la pérdida va de 500 a 800 ml/día MEMBRANAS CORPORALES L as propiedades de los componentes de una membrana biológica deben ser tenidas en cuenta al intentar una descripción de la organización de ellos en la membrana plasmática. Las teorías sobre la estructura molecular de la membrana plasmática, sustentadas con anterioridad a su aislamiento, estaban generalmente basadas en evidencias indirectas. Las primeras indicaciones de que los lípidos podrían ser un componente importante de la membrana aparecieron en los últimos años del siglo XIX. Overton, en 1895, publicó un informe sobre las propiedades de permeabilidad de varias membranas donde observó cuán fácilmente eran penetradas por sustancias solubles en lípidos, en comparación con su relativa impermeabilidad a las sustancias solubles en agua. Sobre la base de que lo similar disuelve lo similar, Overton llegó a la conclu-sión de que la barrera externa de permeabilidad de las células debía ser profundamente lipidica como tal, sólo sería fácilmente penetrada por sustancias solubles en lípidos como el éter, la acetona, el etanol, el cloroformo. Membrana celular La teoría de membranas internas, por lo cual todos los lípidos extraídos, se suponía, provenían de la membrana externa. Goter y Grendel, utilizando la balanza de Lamgmuir, encontraron una superficie total de la capa lipidica de 200 micrones cuadrados por célula, aproximadamente el doble de la superficie estimada del eritrocito; en consecuencia, llegaron a la conclusión de que habla en cada célula lípidos suficientes como para cubrirla dos veces; por lo tanto, esos lípidos estaban asociados a una doble capa. Ahora bien, la propuesta de la doble capa por sí sola no explicaba todos los hechos conocidos; por ejemplo, los eritrocitos no siempre se comportan como si tuviesen un exterior lipfdico; su tensión superficial, que es una medida de la tenacidad con que las moléculas de la superficie se adhieren a otras de su mismo tipo, era demasiado baja. Si bien las grasas y los aceites en medios acuosos tienen tensiones superficiales altas a causa de sus uniones hidrofílicas. no ocurre así con los lípidos extraídos de los eritrocitos. En 1935 Danielli y Davson, sugirieron que la tensión superficial anormalmente baja de los lípidos de los eritrocitos se debía a la contaminación con proteínas, las cuales, como es natural, buscarían la superficie de una gota de lípidos y cambiarían, en consecuencia, su carácter. En este modelo, los fosfolípidos se hallaban orientados en dos capas moleculares con sus colas hidrofóbicas hacia el interior de la estructura y sus fosfatos hidrofilicos en la superficie, en contacto con las capas de proteína. Los fundamentos de esta estructura son aceptados aun hoy aunque con algunas modificaciones importantes En 1950, Robertson encontró una forma de clarificar los rasgos fundamentales del modelo de Danielli utilizando el microscopio electrónico. Diseñé técnicas de tinción que permitieron observar las membranas como dos líneas distinguibles en la fotomicrografía. puesto que hasta ese momento tanto los microscopios ópticos como los electrónicos habían mostrado sólo líneas simples. El modelo original de Robertson tenía capas de proteínas bastante finas en ambas superficies, lo cual era más compatible con una estructura expandida de las proteínas que con las proteínas globulares compactas sugeridas por Danielli. Más aún, el modelo de Robertson no es necesariamente simétrico, puesto que la superficie interior del modelo está cubierta por proteínas, la exterior puede estar revestida por glucoproteínas. Estas características, junto con una doble capa lipídica de aproximadamente unos 0.4 a 6,4 nm de grosor, identifican el modelo de unidad de membrana, nombre que implica una homogeneidad de la estructuras 11 CONSTITUYENTES Los componentes más importantes de las membranas biológicas son los lípidos, las proteínas y los glúcidos. Las membranas plasmáticas, es decir, aquéllas que aislan el citoplasma del medio, contienen, en general, de un 20 a un 70% de su peso en proteína, del 30 al 70% de lípidos y el resto del peso corresponde a glúcidos (7%) y a otros componentes menos importantes. Lípidos Aparte de pequeñas cantidades de triglicéridos (grasas neutras), las membranas biológicas contienen colesterol y diversas clases de fosfolipidos y glucolipidos. Los fosfolipidos presentes en las membranas celulares pueden ser neutros o ácidos. Los fosfolipidos neutros son aquellos que no tienen carga a un pH neutro, como por ejemplo la fosfatidilcolina clasificada como una lecitina; la fosfatidiletanolamina perteneciente al grupo de las cefalinas; y la esfingomielina perteneciente al grupo de los esfingolipidos. Los fosfolipidos ácidos, por el contrario, poseen una carga eléctrica negativa: ejemplo de ellos los tenemos en el fosfatidilinositol clasificado en el grupo de los lipositoles; la fosfatidilserina perteneciente al grupo de las cefalinas; el fosfatidilglicerol. Todos estos compuestos tienen bajo peso molecular y son antipáticos, es decir, su molécula posee un extremo polar hidrofílico y un extremo no polar bidrofóbico. Dado que las dos partes de una molécula lipidica tienen solubilidades incompatibles, los lípidos en solución se organizan espontáneamente, en forma de un doble nivel o una doble capa; de este modo la porción hidrofóbica de la molécula está protegida del agua. mientras que las porciones hidrofílicas están inmersas en ella. Por lo tanto, una doble capa laminar es la configuración de mínima energía para una suspensión de lípidos. En el único punto en que las colas no polares deben interactuar con el agua es en el borde de la lámina; incluso este contacto desfavorable puede evitarse mediante un simple plegamiento de la doble capa para formar una vesícula cerrada que no presente bordes. De la descripción anterior podríamos deducir que una doble capa de lípidos se parece a una hoja de papel, en cuyos bordes las cadenas alifáticas de los lípidos están expuestas al agua: esta ordenación origina una inestabilidad de la doble capa que tiende a evitar, cerrándose sobre sí misma para formar vesículas. De esta manera son más estables ya que su superficie está completamente cerrada La estabilidad de la doble capa lipídica proviene de la energía de interacción hidrofóbica y de tipo Van der Waals entre las cadenas alifáticas. de las fuerzas electrostáticas y de las uniones de tipo hidrógeno entre la cabeza polar de los fosfolípidos, el agua y sus solutos. Estas interacciones. todas ellas no covalentes, dan origen a lo que podría clasificarse como soluciones bidimensionales de lípido en lípido, puesto que todos los componentes de la disolución están confinados en un plano de doble capa. Un hecho que merece ser considerado se refiere al estado físico, sólido o líquido, en que puede presentarse la doble capa lipidica. Como es obvio, el paso de uno a otro se produce cuando la temperatura se incrementa por encima del punto de fusión de los lípidos, que es prácticamente el mismo de sus cadenas alifáticas. La energía térmica necesaria para alcanzarla será por lo menos igual a la energía de las interacciones hidrofóbicas entre cadenas. Este tipo de interacción requiere la separación de las cadenas alifáticas de los lípidos a distancias similares a las interatómicas. La energía de Gibbs asociada es aproximadamente de dos kilocalorías Joules por mol de radical CH2. Es fácil deducir entonces que, por razones estrictamente geométricas, la cohesión y el orden serán mayores en una doble capa de lípidos con ácidos grasos saturados de cadenas alifáticas largas y rectas, que en una doble capa con ácidos grasos insaturados, cuyas cadenas hidrocarburadas se quebrarán a la altura de los dobles enlaces cis, disminuyendo así el efecto hidrofóbico. 12 En resumen, los ácidos grasos de cadena corta e insaturados disminuyen el punto de fusión y aumentan la fluidez de la doble capa lipidica. Si se agrega colesterol a una doble capa de fosfolípidos, el esteroide se acomoda con el grupo alcohólico orientado hacia la cabeza polar del fosfolípido y los anillos en contacto con las zonas de las cadenas alifáticas más cercanas a la cabeza polar, inmovilizandolas De esta manera, el colesterol agrega orden a la doble capa sin solidificarla, pues deja muy flexibles las zonas de las cadenas alifáticas cercanas al extremo no polar. En consecuencia, es de esperar que una doble capa que contenga colesterol sea más fluida en el interior que en las zonas cercanas al disolvente. En condiciones fisiológicas la doble capa lipídica de la membrana celular se mantiene en estado líquido; este estado es necesario para que no se interrumpa la función celular. La viscosidad de la doble capa es del orden de los 100 centipoises, es decir, posee una fluidez similar al del aceite de oliva. Las células pueden regular la fluidez de la membrana plasmática, y la manera de conseguirlo parece ser la introducción de los dobles enlaces en los restos de ácidos grasos. La doble capa no permanece estática; las moléculas lipídicas se difunden lateralmente, cambiando de posición un millón de veces por segundo. En la tercera dimensión la movilidad está severamente restringida. Para que una molécula de lípidos salte de un nivel a otro Flip−Flop, la cabeza polar debe pasar a través de la parte central hidrofóbica de la membrana en la cual es insoluble: la tasa de Flip−Flop es baja: no más de uno al mes. Finalmente, es de anotar que la composición de la doble capa lipídica ha resultado ser asimétrica en todas las membranas biológicas estudiadas. Esta distribución asimétrica de los lípidos implica una diferencia significativa de carga dada por la cabeza polar entre las capas de una membrana citoplasmática y, en consecuencia, diferente potenciales transmembránicos. Proteínas El estudio de las proteínas constitutivas de las membranas avanzó considerablemente en el decenio de 1970, aunque es poco aún lo que se sabe en referencia a la composición y estructura de ellas. Basándose en sus propiedades generales y en la naturaleza de asociación en la membrana, puede distinguirse dos clases de proteínas: periféricas o extrínsecas e inte-grales constitutivas o transmembránicas. Las primeras se caracterizan porque: 1) se solubilizan en condiciones suaves, 2) son solubles en disoluciones acuosas a pH neutro y 3) solución están libres de lípidos luego de su extracción. Las proteínas integrales, en cambio, se caracterizan porque: 1) se pueden extraer de la membrana pero con tratamientos relativamente drásticos, como el uso de detergentes o disolventes etánicos; 2) son hidrofóbicas y, en consecuencia, coagulan rápidamente; 3) permanecen asociadas a algunas moléculas de lípidos aun después de su aislamiento. Estas propiedades permiten hacer una clara distinción de la naturaleza que estabiliza la unión de las diferentes proteínas con la membrana. En las proteínas periféricas las fuerzas que las mantienen unidas a la matriz lipídica de la membrana son de naturaleza colúmbica, mientras que en las proteínas integrales son las fuerzas de interacción hidrofóbicas las que en mayor grado dan estabilidad a la unión de las proteínas con los lípidos. Las proteínas constitutivas, o integrales, tienen una porción molecular incluida en la doble capa lipidica. Se ha encontrado que todas las proteínas constitutivas estudiadas detalladamente abarcan la anchura de la doble capa y poseen, así mismo, regiones que sobresalen a ambos lados de la membrana. Las proteínas periféricas, por el contrario, no se encuentran insertadas en la doble capa y todas ellas se sitúan en una u otra superficie. Generalmente, cada proteína periférica suele estar ligada a una proteína constitutiva. Todas las proteínas constitutivas se hallan insertadas asimétricamente, de modo que cada molécula de las de un determinado tipo de proteína tiene una orientación idéntica en la doble capa lipídica; ya vimos que la doble capa lipldica es, a su vez, asimétrica. Las proteínas periféricas suelen ubicarse preferentemente en la cara citoplasmática. 13 En las proteínas las interacciones de los grupos químicos hidrofílicos e hidrofóbicos no son menos importantes que en los lípidos. Las proteínas, recordemos, son polímeros, formados por aminoácidos unidos en una secuencia lineal. De los veinte aminoácidos especificados por el código genético, seis son fuertemente hidrofóbicos: alanina, isoleucina. leucina, metionina, fenilalanina y prolina, y dos débilmente hidrofóbicos: triptófano y valina. El resto son hidrofílicos: arginina. tirosina. treonina, serina, Usina. glicina. histidina. glutamina y cistefna. Si consideramos la proteína como una mera cadena lineal de aminoácidos costará distinguir entre las unidades hidrofóbicas e hidrofílicas de la secuencia. Sin embargo, la configuración inicial de la molécula proteica no es la de una simple cadena, sino la de una estructura densamente plegada. De este modo. las proteínas solubles en el citoplasma celular poseen abundantes unidades hidrofílicas; en cambio, su zona interna excede en unidades hidrofóbicas. Glucidos En las células de mamíferos, los glúcidos rara vez representan más del 10% de la masa de una membrana plasmática. Casi todos son oligosacáridos, la mayoría están asociados a proteínas, formando glucoproteínas, y el resto a lípidos, formando los glucolípidos: glucoesflngolípidos. gangliósidos y cerebrósidos Estos compuestos se encuentran, invariablemente en la superficie externa de la membrana plasmática y son, en su mayor parte glucosa, galactosa, manosa, fucosa, glucosamina y el ácido ciélico, o neuramínico. El ácido ciálico es. casi siempre, terminal y es la causa de la carga superficial negativa que en medios neutros caracteriza la mayoría de las células de mamíferos. Los carbohidratos desempeñan un pape] importante en la estabilidad de la estructura proteica y en la orientación de las glucoproteínas. Al parecer intervienen en los procesos de reconocimiento celular, aunque poco se sabe de esta función. PROPIEDADES Como acabamos de ver, la membrana que rodea una célula es algo más que una envoltura o un simple receptáculo. No sólo define la extensión de la célula sino que actúa manteniendo una diferencia entre el interior y el exterior. Algunos iones son bombeados hacia el interior de la célula mediante grandes moléculas incrustadas en la membrana, mientras que otros sufren el efecto contrario: son bombeados hacia afuera. La célula toma los nutrientes y los concentra en el interior, gracias a la acción de los componentes de la misma. Para que una membrana pueda mantener tales gradientes de concentración, se precisa como exigencia absoluta que forme una vesícula cerrada. Todas las membranas biológicas conocidas forman compartimientos cerrados. Vimos como esa propiedad de formar vesículas es debida, fundamentalmente, al componente lipidico de la membrana plasmática. La doble capa lipídica se cierra sobre sí misma, con el objeto de adquirir de esta manera la mayor estabilidad, esto es, la mínima energía para una suspensión de lípidos. Vemos, entonces, que cualquier orificio en ella es poco probable. Otra propiedad esencial intrínseca de la membrana celular es su estabilidad, la cual depende fundamentalmente del componente lipídico. Las fuerzas electrostáticas y de unión por puentes hidrógeno entre la cabeza polar y el disolvente que lo rodea, al igual que la energía de interacción hidrofóbica y de tipo Van der Waals de las cadenas alifáticas, conlleva a esta estabilidad. Otra propiedad de la membrana estriba en su Lateralidad La superficie interior, en contacto con el citoplasma, y la superficie exterior, en contacto con el líquido extracelular, deben cumplir funciones distintas. Si no fuera así, una molécula bombeada hacia el interior en un punto, podría ser impulsada hacia afuera en otro, con el derroche energético correspondiente. 14 Este carácter de lateralidad se presenta, igualmente, los receptores de hormonas y de otros agentes químicos. los cuales actúan como marcadores que identifican las células ante sus vecinos. Estos elementos de comunicación intercelular deben ser accesibles en la superficie externa, en el interior serian inútiles. Hace ya algunos años quedó establecido que la asimetría funcional de que la membrana refleja una asimetría estructural subyacente. Ya vimos que no sólo en la doble capa lipídica sino también en la parte proteica existe esa asimetría. Las moléculas proteicas incrustadas en la membrana, o ligadas a ella, ofrecen una orientación fija: unas se presentan sobre la superficie interior, otras sobre la superficie exterior, otras, por fin, se extienden por el espesor de la membrana, pero todas se encuentran, invariablemente, en una orientación fija y asimétrica. Las proteínas de un mismo tipo se orientan en una misma dirección. Se ha encontrado que las moléculas de fosfolipidos más pequeñas, que constituyen la matriz es-tructural de las membranas, presentan también una distribución asimétrica, si bien en éstas la asimetría es parcial y no absoluta. La permeabilidad de la doble capa lipídica a iones y partículas eléctricamente cargadas es muy baja; ocurre lo contrario si las moléculas son solubles en disolventes no polares. De lo anterior se infiere que la perrneabilidad a los solutos cargados o hidrosolubles, que poseen normalmente las membranas biológicas, debe atribuirse en su totalidad a sus componentes no lipídicos, esto es, a las proteínas. El transporte de sustancias a través de la membrana celular es posible gracias a la presencia en ella de moléculas proteicas especiales, las cuales, actuando de diferentes maneras, permiten el paso de sustancias a lo largo de la doble capa lipídica. Dichas moléculas proteicas, denominadas genéricamente proteínas transportadoras, son las responsables del transporte de un soluto especial a través de la membrana; muchas de ellas actúan ya sea como enzimas, con sitios de unión específicos con la sustancia a transportar, o como simples catalizadores, facilitando de esta manera el transporte. Por otra parte, otras proteínas, luego de sufrir cambios conformacionales secundarios a la hidrólisis del ATP o a la ligadura iónica, actúan como bombas, permitiendo el paso de sustancias en contra de gradientes. Finalmente, un tipo diferente de proteínas puede servir como canales. a través de los cuales moléculas pequeñas atraviesan la membrana. DISTRIBUCIÓN IÓNICA EN LOS COMPARTIMIENTOS Y GRADIENTES ELÉCTRICOS Y DE CONCENTRACIÓN. Se considera que una molécula o un átomo se halla distribuido en n compartimientos cuando forma parte de especies químicas diferentes. COMPARTIMENTOS FISICOS: núcleo, citoplasma y mitocondrias. COMPARTIMENTOS QUÍMICOS: incorporación a especies químicas diferentes. Los electrolitos en solución se disocian en mayor o menor grado en sus iones, la forma no disociada y cada uno de los iones tiene distinta capacidad para atravesar la membrana celular; la membrana tiene grupos cargados que crean campos eléctricos y esto influye sobre la permeabilidad iónica; esta influencia establecer una gamma de movilidades de iones en el seno de la membrana que provocan aparición de potenciales eléctricos, los cuales influyen a la vez en la permeabilidad. El origen de los potenciales eléctricos en las membranas biológicas son: • Potenciales de tipo Donnan, provocadas por distribución particular de iones móviles debido a la existencia de sustancias de movilidad restringida y distribución asimétrica. Normalmente sustancias como sales disocian y los iones tienden a distribuir se uniformemente entre los compartimientos, sistema en equilibrio; pero si por alguna razón las especies iónicas no alcanzan distribución 15 homogénea y queda restringida a una parte del sistema se alcanzaran tipos diferentes de equilibrio : equilibrio Donan. Las razones por las que una especie queda restringida a una parte del sistema puede ser − Tratarse de una macromoleculas que no pueda atravesar la membrana quedando limitada a un compartimiento; estas sustancias provocan una redistribución de los iones móviles que dan origen, a potenciales eléctricos : Potenciales Donan. La existencia de una población de una población de cargas que no pueden distribuirse homogéneamente en el sistema porque están fijos a una membrana, ( porque están fijas a una partícula no permeable, etc ) hacen que los electrolitos difusibles se distribuyan asimétricamente. Esta desigualdad de las concentraciones a ambos lados de la membrana origina una diferencia de potencial. Como las membranas celulares tienen cargas eléctricas fijas, existirá entre ellas y cada una de las dos soluciones en contacto con sus caras un equilibrio de tipo Donan ; la existencia de más cargas eléctricas fijas de un lado que de otro de la membrana origina una diferencia de potencial y como el protoplasma celular no tiene la misma composición que el medio que varia las celulas, el potencial en la interfase membrana−protoplasma, no es de la misma magnitud que el de la interfase membrana− medio, en este caso existe una diferencia de potencial entre ambos lados de la membrana. De esta manera en las membranas celulares hay varias causas capaces de producir asimetría en la distribución de iones difusibles, y por lo tanto potenciales Donan: • La presencia de aniones no difusibles en el protoplasma celular. • La existencia de cargas eléctricas fijas en el seno de la membrana. La distribución asimétrica de iones difusibles puede ser tambien originada por un proceso de transporte activo. POTENCIALES DE DIFUSIÓN Si los compartimientos separados por membranas permeables, contienen solución de diferentes concentraciones de electrolitos, los iones difunden de la solución mas concentrada a la mas diluida hasta que tengan las mismas composiciones. Pero si la movilidad de los iones en la membrana es distinta se producirá una diferencia de potencial eléctrico entre los compartimientos; este potencial generado por difusión de iones de distinta movilidad se llama : potencial de difusión y dura lo que duran los gradientes de concentración, esta situación es muy común en membranas biológicas. Cuanto mayor sea la diferencia entre la movilidad de los iones tanto será mayor la diferencia de potencial eléctrico. La diferencia de potencial de una membrana entre dos soluciones de iones que difunden con distinta movilidad, es función de las movilidades y concentraciones de los iones presentes. Los iones que tiene una partición preponderante en la génesis de los potenciales de difusión son : K+, Na+, Cl. Una de las propiedades mas interesantes de las membranas semipermeables es la de producir retencion selectiva a la movilidad de los iones de acuerdo con el signo y fuerza del cambio eléctrico desarrollado. PRINCIPALES IONES: Sodio (Na) Distribución E 16 Es el catión más abundante de los líquidos extracelulares. En el plasma tiene una concentración de 140 mEq/l (±5), mientras que en el citoplasma su concentración es sólo de 10 mEq/l. Aproximadamente un 50% del sodio corporal total se encuentra en huesos y dientes. Un 45% se distribuye en los líquidos extracelulares y el 5% restante se localiza en líquidos intracelulares. Aproximadamente el 70% del sodio corporal total es intercambiable, la mayor parte de él proviene del líquido extracelular (60%). Metabolismo En el adulto existen alrededor de 40 a 80 meq/kg, en promedio 60 meq/kg. Su ingestión diaria, aunque variable, es de aproximadamente unos 100 a 170 meq (entre 7 y 10 g). Dicha ingesta excede los requerimientos diarios, los cuales son básicamente compensados por una pérdida de 80 a 100 meq/dia. El sodio ingerido es absorbido principalmente en el yeyuno, allí el sodio penetra al interior de la célula a favor de un gradiente electroquimico acoplado al transporte de glucosa o aminoácidos. El sodio se transporta activamente fuera de la célula intestinal por bombas iónicas localizadas en las paredes basolaterales del íleon, yeyuno y colon, allí el transporte es facilitado por la aldosterona. Ocurren pérdidas de sodio por heces, sudor y orina. Las pérdidas por sudor son mínimas, de sólo 20 meq/día. Importancia fisiológica Su importancia fisiológica radica en que concomitantemente con el cloro, es el responsable directo de la osmolalidad plasmática. Ahora bien, como la concentración de sales de sodio en el líquido extracelular da cuenta de más del 90% del soluto osmóticamente activo, el sodio es el factor determinante de la fuerza osmótica a este nivel: por lo anterior, resulta claro que es también el responsable del volumen de dicho compartimiento. Es igualmente indispensable en el mantenimiento de la actividad eléctrica celular y en la respuesta del sistema cardiovascular a los agentes presores endógenos. HOMEOSTASIS La concentración plasmática del sodio está en función de dos sistemas interrelacionados: los equilibrios interno y externo del mismo. Sólo cuando uno u otro sistema se altera se producen cambios notables en la concentración plasmática de este ion. El término de equilibrio interno de un electrólito hace referencia a su distribución en los compartimientos del líquido intracelular y extracelular numerosos factores modifican dicha distribución sin alterar el equilibrio externo del mismo, esto es, el contenido corporal total dado por el balance entre la ingestión y la excreción del ion. Equilibrio interno La distribución del sodio en los líquidos de los dos grandes compartimientos corporales es afectada por muy pocos factores. La salida de sodio y la entrada de potasio a la célula están entrelazadas y dependen básicamente de la energía proporcionada por el desdoblamiento del ATP generado por el metabolismo celular. Por lo tanto, la interferencia de estos procesos por la hipoxemia. los tóxicos metabólicos, el ácido yodoacético, el flour. el dinitrofenol y los glucósidos cardiotánicos. Perturba el transporte iónico. Equilibrio externo El balance neto de sodio en condiciones normales es cero, esto es, diariamente la ingestión es igual a la 17 excreción. Dado que las pérdidas por heces y sudor son de poca magnitud, la excreción renal del sodio es el factor primordial en el equilibrio externo de este ion. En condiciones normales el riñón filtra diariamente una cantidad de sodio cien veces mayor que la ingerida y cinco veces mayor que el contenido sódico total; sin embargo, la cantidad excretada es menor del 1% de la cantidad filtrada ya que se reabsorbe el 99%. La capacidad del riñón para excretar sodio varia dentro de grandes límites, de manera que la cantidad excretada de sodio se ajusta a la cantidad ingerida en un amplio margen de ingestión dietética. Así, la excreción urinaria de sodio va de menos de 1 meq/día con una dieta baja en sal, hasta 400 meq/día o más cuando la ingestión de ella es alta. Esta variación en la excreción sódica es secundaria a los cambios en las cantidades reabsorbidas tanto a nivel proximal como distal. Cuando la carga tubular de sodio disminuye, secundariamente a una baja en la rata de filtración glomerular, la cantidad total reabsorbida en el túbulo contorneado proximal aumenta; de manera contraria, cuando la carga tubular de sodio aumenta, la cantidad total reabsorbida en el tibulo proximal disminuye, dado que él tiende a reabsorber una fracción constante de la cantidad filtrada (fracción de filtración F1Na~). Los mecanismos renales involucrados en lo que se ha denominado balance glomérulo−tubular, no han sido identificados todavía, pero parecen intervenir la presión oncótica e hidrostática de los capilares peritubulares. la tasa de secreción de los hidrogeniones y la hormona natriurética. La reabsorción de sodio en los tubulos contorneado distal y colector está en función de las necesidades corporales, en respuesta a la presencia hormonal de la aldosterona. Potasio (K) Distribución El potasio es el catión más abundante de los líquidos intracelulares, con una concentración en ellos de 150 meq/l (±6). En contraste, sólo tiene una concentración plasmática de 4,5 meq/I (±1). Aproximadamente el 98% del potasio corporal total es intracelular y sólo el 2% restante se localiza es extracelular. El 90% del potasio corporal total es intercambiable, dicha cantidad es menor en mujeres y en ambos sexos declina ligeramente con la edad. Metabolismo En el adulto existen entre 40 y 60 meq/kg, en promedio 50 meq/kg. La ingestión diaria de este ion es de 50 a 150 meq. la cual es superior a los requerimientos que son sólo de 40 a 60 meq. Las pérdidas diarias en promedio son de 40 a 60 meq. El potasio ingerido es absorbido en el intestino. El movimiento neto de potasio es proporcional a la diferencia de potencial entre la sangre y la luz intestinal. En el yeyuno, dicha diferencia es de 5 mV, en el lleon es de 25 mV y de aproximadamente 50 mV en el colon. Por lo anteriormente expuesto el yeyuno, el íleon y el colon son órganos netamente secretores de potasio. Perdemos potasio por heces (8 a 15 meq/día), sudor (5 a 15 meq/l) y orina. Estas pérdidas están influenciadas por la aldosterona. Importancia fisiologica Dado que en las células las sales de potasio representan más del 90% del soluto osmóticamente activo. el 18 potasio es el responsable directo de su osmolalidad y de su volumen. Igualmente, el potasio es el responsable del potencial de reposo de la membrana celular. Desempeña papel importante en la transmisión del impulso nervioso y en la respuesta contráctil, al igual que en la glucogenogénesis y en la anabolia proteica. Se requieren 0,3 meq de potasio por cada gramo de glucógeno formado y 3 meq de este ion por cada gramo de nitrógeno sintetizado. HOMEOSTASIS Equilibrio interno Se conocen diversos factores que tienen efectos directos sobre el equilibrio interno del potasio: la insulina, los mineralocorticoides, las catecolaminas, al igual que el equilibrio ácido−básico y la tonicidad de los líquidos corporales. La insulina estimula la captación neta de potasio por el músculo esquelético y las células hepáticas: las Catecolaminas también incrementan esta captación. Recordemos que la captación de glucosa se acomoda al flujo intracelular de potasio. La aldosterona hace más receptiva la célula a la captación de potasio, subsecuentemente a una carga ayuda de este ion. La pérdida de proteínas celulares durante la inanición, las infecciones o los traumatismos, va asociada a la liberación intracelular de potasio. Los cambios ácido−básicos pueden influir en la concentración plasmática del potasio, independientemente de las alteraciones del equilibrio externo. El efecto de la acidosis metabólica crónica depende de la naturaleza del ácido causante de la acidosis y de la duración del trastorno. Es así como los ácidos minerales ácido clorhídrico producen hiperpotasemias mayores que los ácidos orgánicos láctico. Finalmente, la concentración plasmática del potasio varía de 0,3 a 1,3 meq/l por cada cambio de 0,1 en el pH. Los efectos de la alcalosis metabólica sobre el equilibrio interno del potasio parecen ser el reflejo de las alteraciones en el equilibrio externo del ion. Los trastornos ácido−básicos respiratorios tienen efectos insignificantes sobre la concentración plasmática del potasio. La hipertonicidad parece tener un efecto directo sobre el equilibrio interno del potasio. La hiperpotasemia es independiente de los cambios acompañantes del pH y de la naturaleza del soluto que produce la hipertonicidad. Los mecanismos involucrados no se han dilucidado; posiblemente la deshidratación celular, secundaria a la hipertonicidad, incrementa la concentración intracelular del potasio y en consecuencia su gradiente, lo cual favorecería la salida neta de este ion. Equilibrio externo Como la ingestión dietética suele ser relativamente constante y dado que las pérdidas intestinales son relativamente pequeñas (15 meq/dia), la excreción renal de potasio es el factor dominante del cual depende el equilibrio externo del mismo. Como sucede con el sodio, la capacidad del riñón para excretar potasio varía dentro de grandes límites. La mayor parte del potasio plasmático se filtra libremente en el glomérulo. Casi todo el potasio filtrado se reabsorbe en el túbulo contorneado proximal y en el asa de Henle, de una manera obligatoria e independientemente de las necesidades corporales, de modo que sólo un 10 a un 15% de la carga filtrada ingresa al túbulo contorneado distal; así pues, la cantidad de potasio que llega a este ultimo es relativamente constante a pesar de las variaciones en la ingestión diaria. Cuando se requiere, la reabsorción continúa en la nefrona distal, ocurre por el contrario secreción. En la actualidad se acepta que todo el potasio urinario proviene de la secreción. 19 La secreción de potasio en el túbulo contorneado distal y la magnitud de dicha secreción varía de acuerdo a la cantidad ingerida de este ion, a la intensidad del flujo tubular distal. a la presencia de la aldosterona, al estado ácido−básico y a la carga tubular de sodio. No se ha aclarado el mecanismo mediante el cual la acidemia aguda disminuye la secreción de este ion mientras que se encuentra aumentada en la alcalemia. Cloro (Cl) Distribución El cloro es el anión más abundante de los líquidos extracelulares con una concentración en plasma de 104 meq/l (±8) y una concentración intracelular variable, en promedio de 25 meq/l. aproximadamente el 88% del cloro corporal total se encuentra en los líquidos extracclulares y sólo el 12% restante es intracelular. Algunas células, como las testiculares, las de la mucosa gástrica y los eritrocitos, poseen un alto contenido de este ion; por el contrario, las células musculares al parecer carecen de éL Sólo el 40% del cloro extracelular es intercambiable. Metabolismo El cloro corporal total es en promedio unos 30 meq/dia. La ingestión diaria, semejante a la del sodio, es de 100 a 170 meq. Los requerimientos que compensan las pérdidas son de 50 a 150 meq/dia. La absorción se realiza primordialmente en el ileon y el colon mediante un fenómeno activo de tipo intercambio en el cual ocurre secreción de bicarbonato, lo que tiende a volver más alcalino el contenido intestinal. En otros segmentos del intestino la absorción de cloro parece ser pasiva, secundaria a la absorción del sodio. Se pierde cloro por las heces, el sudor y la orina. La cantidad perdida por el sudor es similar a la del sodio. Importancia fisiológica Siendo el cloro el anión más abundante de los líquidos extracelulares, sería el responsable de la osmolalidad plasmática. Ahora bien, dado que las membranas celulares poseen una mayor permeabilidad para el cloro que para el sodio, su poder osmótico es menor y por ende su papel en el mantenimiento del volumen del compartimiento extracelular no es muy marcado. El cloro desempeña un papel importante en la producción de la secreción gástrica, y en el mantenimiento de la neutralidad eléctrica a través de las membranas celulares. Es el responsable del PH intracelular. Homeóstasis Equilibrio interno La concentración normal de cloro en el compartimiento del líquido extra−celular, y especialmente en el plasmático, es afectada primordialmente por la concentración del ion bicarbonato (HCO3). El aumento en la concentración eritrocítica del ion bicarbonato favorece su difusión hacia el plasma. De esta manera, un 70% del bicarbonato formado en el eritrocito pasa finalmente al plasma. Con el fin de mantener la neutralidad electroquímica, se requiere que el eritrocito pierda cargas positivas o gane cargas negativas. Puesto que los aniones proteicos no atraviesan la membrana celular y dado que la bomba sodio−potasio evita la difusión libre de estos dos iones, por cada ion bicarbonato que sale penetra al eritrocito un ion cloro. 20 Como consecuencia de lo anterior, la concentración plasmática del cloro disminuye en la alcalosis alcalosis hipoclorémica y aumenta en la acidosis acidosis hiperclorémica. Equilibrio externo Al igual que con el sodio y el potasio, la excreción renal del cloro es el factor primordial en el equilibrio externo de este ion y gracias a ella, la cantidad excretada es igual a la cantidad ingerida. Los iones de cloro son reabsorbidos en forma pasiva, tanto en el tübulo proximal como en el distal y siempre secundariamente a la reabsorción de sodio. Esta reabsorción pasiva puede explicar los movimientos de cloro en la mayoría de las situaciones. Ella parece disminuir cuando aumenta la reabsorción del bicarbonato. Por otro lado existe, al parecer, un transporte activo de cloro en la rama ascendente del asa de Henle. el cual es inhibido por la furosemida. Calcio (Ca) Distribución La concentración del calcio en los subcompartimientos del liquido extracelular es diferente. Su concentración plasmática es de 5 meq/l o 10mg% y en el intersticial es sólo de 2,5 meq/l (5 mg%), lo anterior como resultado del equilibrio de Gibbs−Donnan. La concentración intracelular del calcio iónico es menor de 0,001 mg. El 99% del calcio corporal total se encuentra en los huesos y los dientes, sólo el 1% restante se localiza en los líquidos corporales donde aproximadamente del 40 al 45% del calcio se encuentra unido a la albúmina y a las globulinas; entre el 5 y el 15% se presenta en forma de complejo iónico con el citrato, el bicarbonato y el fosfato; dicho calcio es difusible pero no ionizado. Finalmente, entre el45 y el 50% del calcio restante se encuentra en forma libre, ionizada (Ca) y por lo tanto difusible. Metabolismo El calcio corporal total es de aproximadamente 20 g/kg. Su ingestión diaria es variable. Los requerimientos en adultos son de aproximadamente 1 g/día. Los niños en crecimiento incrementan sus requerimientos a 2 g/día. Las pérdidas diarias son de 1 g/día, y ocurren a través de las heces, el sudor y la orina. El calcio de los alimentos es absorbido mediante un fenómeno activo, en el cual interviene una ATPasa dependiente del calcio y localizada en el borde velloso de las células intestinales del duodeno y del yeyuno. Dicha absorción es modificada por numerosos factores: aumentar la absorción el 1,25 dihidroxicolecalciferol, la acidez gástrica, hormona del crecimiento y la parathormona. esta última de manera indirecta. Por el contrario, ella disminuye cuando la absorción o la digestión de las grasas se altera o, cuando existe un exceso de citratos, fosfatos y oxalatos en la alimentación. Importancia fisiologica Sólo posee importancia fisiológica la fracción iónica, la cual desempeña papel importante en la coagulación sanguínea, donde actúa como cofactor de varias reacciones enzimáticas. Es también un elemento indispensable en la agregación plaquetaria. La fuerza de la contracción muscular depende de la concentración intracelular de los iones de calcio y la 21 rapidez de dicha contracción depende de la velocidad con que ellos desaparezcan del citoplasma El calcio interviene, además, en la transmisión sináptica y en la excitabilidad de las membranas. Su disminución ocasiona hiperexcitabilidad neuromuscular, su aumento tiene efecto opuesto. Numerosos procesos secretorios son calcio dependientes. En la glucogenólisis, el calcio es necesario para la transformación de la fosforilasa a en fosforilasa E,. En los últimos años se han acumulado pruebas experimentales que señalan al calcio como un elemento indispensable en la activación de numerosas vías metabólicas, asignandolee el papel de un segundo mensajero. Homeóstasis Equilibrio interno Algunos factores se encuentran implicados en la distribución clínicamente importante del calcio a través de la membrana celular. La hipoalbuminemia produce una disminución del calcio sérico total, pero no altera la fracción ionizada. La alcalosis incrementa la fijación del calcio a las proteínas y reduce, en consecuencia, la concentración del calcio ionizado. El paciente manifiesta signos y síntomas de hipocalcemia a pesar de tener una concentración sérica normal: en la acidosis ocurre lo contrario. La hipomagnesemia severa disminuye la secreción de hormona paratiroidea y parece interferir con la respuesta ósea a la presencia hormonal; por lo tanto, la hipomagnesemia se asocia a hipocalcemia. Los trastornos de la vitamina D y de sus metabolitos en las enfermedades gastrointestinales, en las hepatopatías o en las nefropatías originan hipocalcemias. Equilibrio externo El riñón es el órgano encargado de compensar los cambios secundarios a las alteraciones en la ingestión de este ion. La excreción urinaria del calcio esta en función de su concentración sérica y de su reabsorción tubular. En condiciones normales, el 99% de la carga filtrada de calcio se reabsorbe en la nefrona. La reabsorción en el túbulo contorneado proximal es de aproximadamente un 60% y, en la rama ascendente del asa de Henle, parece estar relacionada con el transporte de sodio y, por lo tanto, los factores que alteran la reabsorción de sodio también modifican la de calcio. En el bulbo contorneado distal la reabsorción del calcio es incrementada, en función de las necesidades corporales, por la hormona paratiroidea y por el 1,25 de dihidroxicolecalciferol; es disminuida por la calcitonina. Fosfatos (P043) Distribución La concentración extracelular de los fosfatos inorgánicos es de 3,0 a 4.0 mg% mientras que la concentración, a este mismo nivel. del fosfato total orgánico e inorgánico es de 12 mg%. El contenido intracelular de fosfatos, tanto orgánico como inorgánico, es mayor. Hay aproximadamente de 80 a 110 meq/1 de fosfato inorgánico. Del 85 al 90% del fosfato corporal total se encuentra en huesos y dientes, sólo del 10 al 15% se halla en los líquidos corporales: aproximadamente dos tercios se encuentran formando compuestos orgánicos fosfolípidos, 22 ésteres fosfóricos, fosfato de ácidos nucleicos. El tercio restante se encuentra como fósforo inorgánico PO3, HPO42, H2PO4 Metabolismo El contenido corporal total de fosfato es de aproximadamente unos 500 a 800 g. Bajo ingestión dietética normal, de 900 mg al día, aproximadamente un tercio (300 mg) sufre excreción fecal, los dos tercios restantes (600 mg) son excretados por el riñón. De la carga ingerida se absorbe entre un 60 y un 90% en el intestino delgado. La absorción es incrementada por el 1,25 dehidroxicolecalciferoll y la parathormona y disminuida por la calcitonina y los agentes quelantes. Prácticamente se desconoce la deficiencia de fosfatos, pues casi todos los alimentos son ricos en él. Importancia fisiológica Los fosfatos son un elemento importantísimo en el organismo, pues son los componentes estructurales de muchos sistemas metabólicos de intercambio de alta energía difosfato y monofosfato de adenosina, fosfocreatina, glucosa 6 fosfato, difosfoglicerato, etc.. En el plasma, parte del sistema amortiguador corresponde al conjunto fosfato monobásico y fosfato dibásico (HPO4 ). Los fosfatos son componentes estructurales de células y tejidos, ellos se encuentran en las membranas celulares, en las vainas de mielina, etc. En el hueso, las sales de fosfato de calcio, bajo la forma de cristales de hidroxiapatita, representan casi el 12% del peso seco del hueso. No olvidemos que en el plasma ellos se encuentran unidos a las proteínas y a los lípidos. Los fosfatos orgánicos y en menor grado los inorgánicos fijan la hemoglobina y reducen su afinidad por el oxígeno. Homeóstasis Equilibrio interno La concentración del fosfato inorgánico extracelular es un factor determinante en la concentración de este electrólito en el interior de la célula; éste, a su vez, es utilizado pan la síntesis de compuestos macroérgicos, fosfolipidos. etc. Bajo la influencia de infusiones de glucosa, de insulina, de catecolaminas o durante la alcalosis se presenta una estimulación de la vía metabólica de Embden Meyerhof: en consecuencia, la concentración de fosfatos orgánicos aumenta a expensa de los fosfatos inorgánicos extracelulares y la hipofosfatemia se hace manifiesta. La concentración plasmática del fosfato inorgánico es también modificada por la parathormona que lo deposita o lo liberan del hueso. En consecuencia, todos los factores que afecten la concentración hormonal alteran, a su vez, el equilibrio interno del fosfato. Equilibrio externo Al igual que con los otros electrólitos, el riñón es el órgano encargado de compensar las alteraciones del contenido del fosfato. La regulación renal del fosfato es muy precisa. Normalmente se produce una reabsorción del 90%. La mayor parte de ella ocurre en el tubulo contorneado proximal (60−70%), mediante un mecanismo activo con capacidad limitada. La hormona del crecimiento y la vitamina D aumentan la reabsorción proximal. En presencia de la parathormona, la reabsorción se reduce en un 10%. Al parecer, la calcitonina aumenta la excreción urinaria del fosfato ejerciendo su efecto en el lobulo contorneado proximal. 23 Magnesio (Mg) Distribución La concentración del magnesio en los líquidos intracelulares es de 26 meq/l. Su concentración plasmática es sólo de 2 meq/l (±1). Aproximadamente el 50% del magnesio corporal total se encuentra en los huesos, el 50% restante se encuentra en los líquidos corporales, localizándose preferentemente en el interior de la célula. El 20% del magnesio se halla unido a las proteínas, un 25% se encuentra formando complejos difusibles pero no ionizados y un 55% se encuentra en forma libre, ionizada. Del magnesio corporal total aproximadamente un 45% es intercambiable (20% óseo, 25% intracelular). Metabolismo El magnesio corporal total lo constituyen 30 mEq/kg. Su ingestión diaria promedio es de aproximadamente 300 mg, un 40% de esta cantidad es absorbida mediante un fenómeno pasivo, al parecer a todo lo largo del intestino delgado, esta absorción es incrementada por la vitamina D y la parathormona; disminuye en cambio por acción del calcio y el fósforo. El 60% restante (aproximadamente 180 mg) es excretado en las heces. La excreción urinaria diaria es de 120 mg. Los requerimientos diarios del magnesio se han fijado entre 300 y 350 mg. Importancia fisiologica Su importancia fisiológica radica en que activa los sistemas enzimáticos para la transferencia de radicales fosfato, al igual que los sistemas enzimáticos de la piruvato oxidasa. Actúa como cofactor en la síntesis de proteínas ribosómicas. La contractibilidad del músculo esquelético y cardiaco depende del equilibrio entre los iones de calcio y magnesio. El magnesio es curarizante, niveles altos de magnesio deprimen el sistema nervioso y la contracción muscular, pues interfiere con la liberación presináptica del neurotransmisor. Es antagonizado por el calcio y el potasio; es potencializado, en cambio, por la prostigmina y la neostigmina. HOMEOSTASIS Equilibrio interno Se conocen algunos factores que tienen efectos sobre el equilibrio interno del magnesio, esto es, modifican su distribución en los líquidos corporales. La insulina, por ejemplo, favorece el transpone del magnesio a través de la membrana celular. En la alcalosis metabólica, la concentración plasmática del magnesio disminuye; en ocasiones, la hipomagnesemia puede ser sintomática, ella semeja el cuadro clínico de la tetania hipocalcémica. La concentración plasmática del magnesio no se ve afectada durante la alcalosis respiratoria. En la acidosis, independientemente de la causa, aparece hipermagnesenlia leve. Equilibrio externo Las alteraciones del magnesio debidas a la ingestión son poco frecuentes dado que los vegetales son ricos en él. 24 Básicamente el equilibrio externo del magnesio es regulado primordialmente por el riñón. En condiciones normales se reabsorbe el 95% del magnesio filtrado. Cuando los niveles plasmáticos del magnesio aumentan, su reabsorción disminuye. Ocurre reabsorción de magnesio en el túbulo contorneado proximal. al parecer, por transporte pasivo, secundario a la resorción de sodio. La hormona paratiroidca y la calcitonina aumentan su reabsorción; la aldosterona. por el contrario, la disminuye. En el asa de Henle existe posiblemente un transpone competitivo entre el calcio y el magnesio, la importancia fisiológica de este hecho no se ha dilucidado aún. Sulfatos En el organismo se forma sulfato durante el metabolismo de los ácidos aminados que contienen azufre. Dicho sulfato puede entrar a formar parte del cartílago, como sulfato de condroitina. o puede servir para la síntesis de cistina, homocisteína y metionina; también puede participar en la formación de algunos cerebrósidos. Los ésteres sulfúricos orgánicos formados en el hígado participan en las reacciones de destoxificación. Su concentración plasmática es de 0,5 a 1.5 meq/l (50 a 150 um/I). El sulfato es reabsorbido en el riñon mediante un mecanismo activo con capacidad limitada. Su reabsorción disminuye al aumentar la del fosfato y la de la glucosa. En condiciones normales, se reabsorbe sulfato y se secreta en cambio tiosulfato. IONOGRAMA: El estudio del ionograma informa rápidamente de la existencia de hipoelectrolitemia o hiperelectrolitemia, osea, hipoosmolaridad o hiperosmolaridad; de si existe acidocis o alcalosis, esto es si hay predominio de los aniones sobre los cationes, y de si existe hipoproteinemia o hiperproteinemia. La concentración de los diferentes electrolitos suele expresarse en miligramos por cien centímetros cúbicos de liquido (mg/100cc), o en miliequivalentes por litro (meq/l): en la actualidad se acepta mas esta valorización. INDICE SERICO DE LOS ELECTROLITOS MÁS IMPORTANTES EN LA CLINICA CATIONES SODIO POTASIO CALCIO MAGNESIO ANIONES CLORO FOSFATOS SULFATOS BICARBONATO ESTÁNDAR PROTEINAS ACIDOS ORGANICOS LIMITES NORMALES Mg/100 315−350 18−22 9−11.5 1.8−3.6 350−370 3.0−4.5 0.3−2.0 25−29 7000 Meq/l 135−153 4−5.8 4.5−5.5 1.5−3.0 98−108 1.8−2.3 0.2−1.3 25 14−19.4 6 MOVIMIENTO DE SOLVENTE Y DE SOLUTOS ENTRE LOS COMPARTIMENTOS OSMOLALIDAD 25 Expresa la concentración de los solutos, o sea la tonicidad o relación entre los solutos y el agua de los líquidos extracelular e intracelular. La osmolalidad se refiere por tanto al numero de osmoles de soluto por kilogramo de agua o de solvente. La osmolalidad corporal depende de la osmolalidad del plasma, la cual a su vez depende de la concentración de Na+. El Na+ es un indicador de volumen de agua corporal. Los principales solutos que establecen la osmolalidad son : Na+, glucosa, urea. Una solución molal determinada no varia con la temperatura a diferencia de la solución molar y por lo tanto es un índice más preciso en cualquier calculo de soluciones. Regulación de la osmolalidad plasmática: En el hombre normal la osmolalidad, esto es. la concentración corporal de solutos osmóticamente activos, se mantiene constante a pesar de las grandes variaciones en la ingesta y en la excreción de agua y solutos. Cada kilogramo de agua corporal contiene, en promedio, 300 mosa de solutos, formados en su mayor parte por sales de sodio que se encuentran en el espacio extracelular y por sales de potasio que se encuentran en el espacio intracelular. La identidad de la osmolalidad entre los espacios intracelular y extracelular se mantiene gracias al paso del agua a través de las membranas celulares, siguiendo únicamente los imperativos de la presión osmótica (x). La única excepción de este movimiento libre de las moléculas de agua se halla en el control de la permeabilidad que ejerce la hormona antidiurética de los mamíferos en la porçión distal de la nefrona. En la práctica clínica diaria la osmolaridad plasmática puede ser cal-culada a partir de las concentraciones plasmáticas del sodio, la glucosa y el nitrógeno ureico: mOsm/kg = 2 [Na] + [glucosa]/18 + [BUN]/2,8 Los valores oscilan entre 275 y 290 mOsm/l. Ya hemos mencionado que la osmolaridad plasmática puede medirse directamente por determinación del descenso crioscópico del plasma. El mecanismo de regulación de la osmolalidad comprende: 1. Osmorreceptores, situados en el hipotalámico y la carótida que responden a cambios en la osmolalidad tan pequeños como del 1%. 2. Receptores de volumen o de estiramiento, localizados en las aurículas, los ventrículos, los vasos pulmonares, la desembocadura de las gran-des venas, el seno carotídeo y el arco aórtico; ellos responden a cambios en el volumen sanguíneo o en la presión arterial. 3. Un mecanismo integrador, situado en el eje hipotálamo−hipófisis 4. Un mecanismo neurosecretor que libera hormona antidiurética, en cantidades que dependen de la necesidad de la conservación hídrica. 5. Un órgano efector situado en el riñón, que se encarga de dicha conservación hídrica. 26 PRESION OSMOTICA: La precio necesaria para evitar la migración de solvente de la solución. Esta presión depende del numero de partículas en una solución y no del tipo de las mismas, es decir se trata de una propiedad coligativa fundamental de las soluciones. PRESION COLOIDO−OSMOTICA~PRESION ONCOTICA La estructura de la estructura de la pared capilar varía de un lecho capilar a otro, sin embargo en el músculo esquelético, el agua y relativamente pocos solutos son las únicas sustancias que cruzan esta pared con facilidad. Las aperturas en la pared son demasiado pequeñas para permitir que las proteínas plasmaticas y otros coloides importantes las atraviesen en cantidades importantes. Los coloides tienen peso molecular grande, pero están presentes en cantidades importantes. Cantidades escasas cruzan la pared capilar por transporte vesicular, pero sus efectos son leves. Por esa razón, la pared capilar se comporta como una membrana impermeable a los coloides, que ejercen una presión osmotica de alrededor de 25mm de Hg. La presión coloido osmotica debida a los coloides plasmatico recibe el nombre de presión oncotica. La filtración a través de la membrana de los capilares, como resultado de la presión hidrostática que existe en el sistema vascular, se opone a la presión oncotica. OLIGOELEMENTOS • COBALTO: La unica función conocida del cobalto en los animales es su papel como componente de la cobalamina, Vit B12 El cobalto debe suministrarse a los mamíferos en forma de vit B12, aunque teóricamente el cobalto elemental de la dieta podría convertirse en cobalamina por la acción de las bacterias intestinales. El cobalto elemental es bien absorbido en el intestino y al parecer comparte un mecanismo de transporte con el hierro. La absorción del cobalto, al igual que la del Hierro, esta aumentada en forma significativa en los elementos con insuficiencia hepática (sobrecarga de Hierro y hemocromatosis idiopatica). El cobalto se excreta primariamente en la orina y tiene un orden bajo de toxicidad en todas las especies estudiadas. • COBRE: El cuerpo del adulto contiene aproximadamente 100mg de cobre; las concentraciones mas altas se encuentran en hígado, cerebro, riñón y corazón. La absorción de cobre en el aparato digestivo requiere un mecanismo especifico, a causa de la naturaleza fuertemente insoluble de los iones cúpricos (Cu2+) para mantenerlo soluble en el pH del liquido intestinal. En las células mucosas del intestino es posible que el cobre se asocie a una proteína fijadora de metales, de peso molecular bajo, llamada matalotioneina. El cobre entra al plasma, donde se une a aminoácidos, en particular a la histidina, y ala albumina serica en un solo sitio de union fuerte. En menos de una hora, el cobre recientemente absorbido es eliminado de la circulación por el hígado. El hígado procesa al cobre a través de dos rutas. El cobre es excretado en la bilis al aparato digestivo, desde el cual no es reabsorbido. De hecho la homeostasis del cobre es mantenida en forma exclusiva por medio de la excreción biliar,; mientras mayor sea la dosis de cobre, mayor cantidad se excreta en las heces. En condiciones normales, la orina humana solo contiene huellas de cobre. La segunda ruta del metabolismo del cobre en el hígado es su incorporación como parte integral de la ceruloplasmina, una glucoproteina sintetizada de manera exclusiva por el hígado. La ceruloplasmina es una fenoxidasa dependiente del cobre. da cuenta del 95% del cobre total en el plasma humano. La ceruloplasmina no es una proteína transportadora de cobre, puesto que el cobre de este compuesto no es intercambiado con el ion cobre o con el cobre unido a otras moleculas. 27 • HIERRO: Este es uno de los elementos mas abundantes en la corteza terrestre, pero el organismo de un adulto normal que pese 70Kg contiene únicamente entre 3 y 4g de hierro. El hierro se utiliza principalmente en el transporte de oxigeno por la hemoglobina. Ambos iones, el ferroso y el férrico, son solubles a pH neutro y por lo tanto se requieren sistemas especiales para su transporte y para insertar estos iones en los sitios donde actúan. El hierro de la alimentación se encuentra de manera predominante como ion férrico fuertemente unido a moléculas orgánicas. En el estomago donde el pH es 4 el Fe3+ puede disociarse y reaccionar con sustancias de peso molecular bajo como fructuosa, ácido ascorbico, ácido cítrico y aminoácidos para formar complejos que permitirán al Fe3+ permanecer soluble a pH neutro del liquido intestinal. El hierro no se desprende del hem en el estomago sino que es llevado como tal al intestino. Normalmente, la perdida de hierro procedente de un organismo de un hombre se limita a 1mg/dia como resultado de la descamación del intestino y de otras células que contienen hierro. Las mujeres pierden hierro durante la menstruación. En consecuencia, el solo mecanismo por el cual las reserva corporales totales de hierro pueden ser reguladas es a nivel de la absorción d este ion, En la alimentación ordinaria, se ingieren entre el 10 y 20mg de hierro cada ida, pero de esta cantidad se absorbe menos del 10%. Así en condiciones normales, muy poco del hierro dietético es absorbido, las cantidades excretadas en la orina son mínimas y una porción elevada del hierro total del organismo es redistribuida de manera continua de diversos circuitos metabólicos. La necesidad mayor de hierro ocurre en la infancia y la adolescencia; los niños en estas etapas del desarrollo absorben un porcentaje mas alto del hierro de los alimentos que los adultos. La deficiencia de hierro en niños, adolescentes, mujeres que menstrúan puede atribuirse a una alimentación inadecuada. La deficiencia en el hombre adulto puede atribuirse, por lo general a un sangrado sustancial. El Hierro del hem es absorbido por la célula mucosa intestinal intacta y a continuación el hem es desintegrado y el hierro se libera dentro de l célula. El hierro que no procede del hem es absorbido en el estado ferroso. El fe2+ se absorbe en la célula mucosa del duodeno y del yeyuno proximal y es oxidado rápidamente a Fe3+ . El ion férrico es fijado por una molécula intracelular transportadora. Dentro de la célula,, la molécula transportadora libera Fe3+ a las mitocondrias y entonces, dependiendo del metabolismo del individuo, se distribuye el hierro Fe3+ en proporciones especificas a la apoferretina o a la apotransferrina. En el adulto bajo condiciones normales, cuando la absorción diaria de hierro es de 1mg aprox., el transportador intracelular de este ion en la célula mucosa casi esta saturado. Transfiere cantidades significativas de hierro a la apoferrina para formar ferritina y transfiere la cantidad habitual de hierro a las mitocondrias. El resto es transportado a través de la superficie serosa de los vasos de la apotransferrina. En los estados con deficiencia de Hierro, la capacidad del transportador intracelular de hierro se expande y se absorberá mas de el si esta disponible en la alimentación. Aunque las mitocondrias reciben el suministro usual de hierro, en la célula no se forma ferritina y la mayor parte de este es transportado al compartimiento expandido de la apotransferina en el plasma. En el caso de sobrecarga de hierro, el transportador esta sencillamente disminuido en capacidad y se satura. • MOLIBDENO: Aunque se desconocen los requerimientos humanos de molibdeno, es evidente que este metal es necesario para la función de las metaboenzimas Xantina oxidasa, aldehido oxidasa y sulfito oxidasa. En condiciones normales no ha sido observada la deficiencia de molibdeno ni en el hombre, ni en cualquier otra especie. Esencialmente no se conoce el metabolismo de este metal. Excepto que las formas hexavalentes solubles en agua se absorben a través del intestino. La orina es la principal vía de excreción del molibdeno. Existe cierta evidencia que el molibdeno interfiere con el metabolismo del cobre mediante la disminución de la eficiencia en la utilización de este elemento y tal vez aun por la movilización del cobre de los tejidos. 28 • SELENIO: Es un componente integral de la glutation peroxidasa, una enzima con un papel intracelular de antioxidante muy semejante a la función relacionada de la vit E o alfa−tocoferol. No se han reportado casos de deficiencia en los seres humanos, pero esta xiste en animales como el ganado. Puede ocurrir intoxicación por selenio en animales y en el hombre, aunque su mecanismo no se comprende. • MANGANESO: Existe en cantidades elevadas en la mitocondria y funciona como un factor necesario para la activación de las glucosiltransferasas que se ocupan de la sintesis de oligosacaridos, glucoproteinas y proteoglucanos. El manganeso es bien absorbido en todo el intestino delgado por un mecanismo semejante al que se describió para el hierro, con intervención de una transferencia a través de las células de la mucosa hacia la sangre del sistema portal. De hecho la absorción de Mn2+ esta aumentada en la deficiencia de hierro y puede ser inhibida por este. La presencia de etanol en el intestino puede incrementar de modo importante la absorción de Mn2+. Los iones de Mn2+ son entregados al hígado procedentes de la circulación portal y ahí se equilibran rápidamente con el Mn2+ de las mitocondrias hepáticas. Al parecer, la deficiencia de manganeso reduce profundamente la síntesis de oligosacaridos y la formación de glucoproteinas y de proteoglucanos. Además resultan afectadas varias metaloenzimas que poseen Mn2+ como hidrolasas, cinasas, descarboxidasas y transferasas. • CINC: Existen tal vez dos docenas de metaloenzimas que contienen cinc, incluyendo la anhidrasa carbonica, la superoxido dismutasa y la timidincinasa. Así, no es de sorprender que una deficiencia de cinc vaya acompañada de una disfunción multigeneralizada. En el lumen intestinal hay un factor fijador de cinc, que al parecer es secretado por el páncreas, que promueve la absorción del metal. El cinc, al igual que el Hierro, puede ser secuestrado en la célula por proteínas fijadoras de cinc especificas. En forma subsecuente es transferido a la molécula de albúmina, en el lado seroso de la membrana de la célula mucosa. El cobre puede interferir en la absorción de cinc por competir con este por los sitios de unión de la molécula de albúmina dentro del espacio intravascular. Cifras elevadas de fosfato y de calcio agravan la deficiencia de cinc. Este ion es secretado en el jugo pancreático y en pequeña proporción en la bilis, y por lo tanto las heces son la vía principal de excreción. No obstante, se pueden tener cantidades importantes de cinc en el sudor. El cinc, de la misma manera que el cobre, puede fijarse por la metalotioneina hepática cuando la ingestion del metal aumenta. La deficiencia de cinc puede aumentar como transtorno primario de su absorción en la acrodermatitis enteropatica, una rara enfermedad autosomica recesiva caracterizada por signos dermatologicos, oftalmicos, gastrointestinales y neuropsiquiatricos, junto con retardo del crecimiento e hipogonodismo. La deficiencia secundaria de cinc puede presentarse en la malaabsorción de cualquier origen o por aumento en su excresion urinaria. • CROMO: Se piensa que interviene en la regulación del metabolismo de la glucosa, tal vez como un componente del factor de tolerancia a la glucosa. La forma trivalente del cromo puede mejorar la tolerancia a la glucosa en individuos que sufren de desnutrición calorico−proteica. Se ha sugerido que el cromo es importante para el metabolismo de proteínas y lípidos, en particular el colesterol. El cromo se absorbe en el intestino delgado por una vía que parece compartir con el cinc. Es transportado a los tejidos unido a la transferrina y aparece en las mitocondrias, microsomas y citosol del hepatocito. El cromo se excreta principalmente en la orina. El cromo hexavalente es mucho mas tóxico que el trivalente. REGULACIÓN DE LA OSMOLALIDAD 29 OSMORRECEPTORES Los osmorreceptores hipotalámicos. situados en la vecindad del núcleo supraóptico y paraventricular. son estimulados por cambios pequeños de la osmolalidad plasmática. Su estimulación aumenta la síntesis y liberación de la hormona, dando como resultado una mayor reabsorción de agua en la nefrona distal; la ganancia corporal de agua aumenta el volumen extracelular, el cual. concomitantemente, disminuye su osmolalidad. Por el contrario, como la eliminación urinaria de solutos permanece constante y el volumen urinario ha disminuido se observa un aumento de la osmolaridad urinaria. El mecanismo contrario ocurre cuando disminuye la síntesis y la liberación de la hormona antidiurética. Mecanismo de la sed La sed es la impresión sensorial subjetiva que activa el deseo de ingerir agua; el mecanismo de la sed es complejo y todavía no se ha aclarado por completo. La sed puede ser inducida por muchos factores pero aparece como fenómeno general la disminución de la secreción salival, por lo que resulta evidente que la sequedad en la boca y en la garganta es causa directa de la sensación de sed. La sed guarda relación con la concentración de solutos en los líquidos corporales; el aumento de la osmolalidad efectiva de los líquidos extracelulares conduce a la deshidratación celular lo que produce la sensación de sed. Se podría especular que la deshidratación de los receptores de la sed es el factor determinante de su estimulación. Sin embargo, también puede producirse sed sin que exista la deshidratación celular. La reducción del volumen vascular puede ir acompañada de sed intensa, aunque no se presenten cambios en la osmolalidad efectiva. Este efecto parece estar mediado por el sistema renina−angiotensina. La angiotensina 11 actúa sobre el órgano subtrigonal, produciendo la estimulación de las áreas hipotalámicas posteriores relacionadas con la sed; la aparición de la sensación de sed induce un aumento en la ingesta líquida. Estimulación e inhibición de la sed El mayor estimulo fisiológico de la sed es un descenso entre el 1 y el 2% del agua corporal total con un aumento proporcional en la osmolaridad de los líquidos corporales. El incremento del volumen y de la osmolalidad también aumentará significativamente la sensación de sed. Por otra parte. la disminución del volumen extracelular sin cambio en la osmolalidad es también un estímulo para esta sensación. De manera paradójica, la sed puede suscitarse a pesar de presentarse un aumento masivo en el agua corporal total, aun cuando haya hipoosmolalidad, en aquellas circunstancias en las cuales hay un descenso en el volumen efectivo de sangre circulante, como por ejemplo, un descenso en la presión arterial o en el gasto cardiaco. REGULACION DEL VOLUMEN: Receptores de volumen o de estiramiento Hay dos grupos de receptores de volumen o de estiramiento que alteran la síntesis y liberación de la hormona antidiurética. El primer grupo está localizado en las aurículas, los ventrículos, los vasos pulmonares y en la desembocadura de las grandes venas y son estimulados por el volumen sanguíneo de retorno, por lo cual han sido llamados receptores de baja presión. Ahora bien, existen dos tipos de mecanorreceptores. El tipo A, localizado preferentemente en la entrada de las 30 grandes venas se descarga principalmente durante la sístole auricular y por lo tanto la actividad de este receptor no es afectada por los cambios de volumen de las aurículas. Los receptores tipo B se descargan tardíamente en la diástole, respondiendo primariamente a la distensión de las paredes auriculares. La distensión auricular derecha disminuye la concentración plasmática de renina y no modifica la concentración plasmática de la hormona antidiurética; mientras que, la distensión auricular izquierda suprime la liberación de hormona antidiurética y no afecta la secreción de renina. El segundo grupo tiene dos localizaciones, unos se encuentran en el seno carotídeo y los otros en el arco aórtico. A los receptores de este segundo grupo se les denomina receptores de alta presión. Son estimulados por un aumento en la presión arterial sistémica. Receptores de baja presión Un aumento del volumen sanguíneo, independientemente de los cambios concomitantes de la osmolalidad o de la presión, incrementa la presión venosa sistémica y secundariamente la presión en la aurícula izquierda; los receptores de volumen son, entonces, estimulados y los impulsos que en ellos se originan viajan vía vagal; una vez integrados éstos en el hipotalamo, originan una inhibición tónica de la descarga neuronal, la cual finalmente disminuye la liberación de hormona antidiurética. Se reduce, en consecuencia, la concentración plasmática de la hormona, lo cual conlleva a una disminución en la reabsorción distal de agua, aumentando, por ende, la eliminación urinaria y disminuyendo el volumen extracelular. El mecanismo contrario se observa cuando disminuye el volumen sanguíneo. Los cambios posturales y de temperatura ambiental, que permiten una redistribución del volumen sanguíneo central, activan de esta manen los receptores de volumen. Así, por ejemplo, un cambio de la posición reclinada a la sentada decrece momentaneamente la presión en la aurícula izquierda, como consecuencia de la disminución del retomo venoso; esto incrementa, por vía vagal. la liberación hipotalámica de la hormona antidiurética. Al cambiar a la posición erecta, la disminución del retomo venoso es mayor y la concentración plasmática de la hormona antidiurética se incrementa. La redistribución del volumen sanguíneo secundaria a la vasoconstricción periférica, en respuesta a una baja temperatura ambiental, origina un aumento de la presión venosa sistémica lo que disminuye la liberación de la hormona antidiurética. El mecanismo contrario se observa cuando hay un aumento de la temperatura ambiental. Receptores de alta presión o barorreceptores del arco aórtico y del seno carotídeo Un aumento de la presión arterial sistémica es el estímulo para los receptores allí localizados. Los impulsos aferentes vía glosofaríngeo y vago son integrados en el centro vasomotor, donde la inhibición de los núcleos simpáticos centro cardioacelerador y vasoconstrictor da como resultado una vasodilatación periférica y una disminución en la presión arterial. La estimulación secundaria del núcleo parasimpático centro cardioinhibidor, contribuye a la disminución de la presión arterial ya que ocasiona bradicardia. La integración de los impulsos en los núcleos supraópticos del hipotálamo determina, concomitantemente, una disminución de la liberación de la hormona antidiurética. Esta disminución trata de compensar el aumento del volumen vascular, pues reduce la reabsorción del agua y aumenta, en cambio, su excreción urinaria. El mecanismo contrario se observa cuando ocurre una disminución de la presión arterial sistémica. Regulación del volumen plasmático 31 Siendo el potasio el catión intracelular más abundante y el sodio el más abundante a nivel extracelular, la presión osmótica por ellos ejercida determina básicamente el flujo del agua a través de estos dos compartimientos y, por ende, el volumen de cada compartimiento. Como mencionamos anteriormente, sólo las pérdidas renales de agua y electrólitos están bajo control hormonal. En condiciones normales, este órgano es el encargado de los ajustes homeostáticos del volumen y de la osmolalidad corporal. Dado que la homeóstasis hídrica es esencial para mantener la estabilldad circulatoria, no es de extrañar que los receptores implicados sean numerosos y de amplia distribución. El mecanismo de regulación del volumen comprende: 1. Osmoreceptores, localizados en la región de la mácula densa y en el hígado, los cuales son sensibles a los cambios de concentración sódica. 2. Receptores de volumen, localizados principalmente en la pared media de la arteriola aferente del corpúsculo renal, los cuales responden a los cambios de la presión arterial y los receptores de volumen, localizados en la aurícula derecha, los cuales desempeñan un papel importante en el control de la secreción de renina. 3. Un mecanismo secretor, que liben aldosterona en cantidades que dependen de las necesidades corporales de sodio. 4. Un órgano efector, localizado en el riñón que se encarga de dicha regulación. Osmorreceptores Receptores de la mácula densa Una disminución de sodio en el fluido tubular que perfunde las células de la mácula densa, localizadas al inicio de la parte contorneada del túbulo distal, constituye el estímulo para que las células receptoras tubulares, mediante un mecanismo desconocido, estimulen la liberación de renina por las células granulares, localizadas en la pared media de la arteriola aferente. Un incremento de la concentración de sodio en el fluido tubular determina el mecanismo opuesto. Receptores hepáticos La evidencia actual parece demostrar que el hígado desempeña un papel importante en la regulación de la concentración plasmática del cloruro de sodio. Dichos receptores parecen estar localizados en la vena porta y sus estímulos parecen ser transmitidos por vía vagal. Su efecto fisiológico, al parecer, es modificar la excreción urinaria de sodio. La vagotomía anula esta respuesta natiuretica. Receptor vascular intrarrenal Cualquier factor que disminuya la presión de perfusión renal por debajo de 60 mg. con la disminución subsiguiente de la tensión transmural de la arteriola aferente del corpúsculo renal, se constituye en la señal de estímulo para el receptor vascular. Se estimulan, entonces, las células granulares las cuales aumentan la liberación de renina. La renina secretada actúa sobre el sustrato plasmático angiotensinógeno con la subsiguiente formación de la angiotensina 1; ella es convenida en angiotensina II, que además de ser el agente vasoconstrictor más potente 32 conocido, constituye el principal estímulo para la liberación de aldosterona por la corteza suprarrenal. En el tubulo contorneado distal y en el tubulo colector, la aldosterona aumenta la reabsorción renal de sodio al igual que la secreción de potasio. Entre los muchos factores que alteran la tensión de la arteriola aferente, causando modificaciones en la rata de secreción de la renina están: los cambios en la actividad simpática, los factores miogénicos, los cambios en la elasticidad de la pared arterial y los cambios en la presión transmural. En términos generales. la liberación de renina por las células granulares está inversamente relacionada con el grado de estiramiento de la pared del vaso. Los trabajos experimentales demuestran que el sistema nervioso simpático desempeña un papel importante. aunque no esencial, en la liberación de renina. Este efecto es mediado posiblemente por los beta receptores. Pero, el papel ejercido por el sistema nervioso simpático es dual. Por un lado controla el grado de constricción arteriolar y por lo tanto la presión efectiva de filtración; por otro, regula el tono vasomotor de la arteriola tanto de la aferente como de la eferente, determinando de esta manera la rata de filtración glomerular, lo cual, a su vez, determina la carga sódica. Receptores de baja presión Ya hemos mencionado que los receptores de baja presión y específicamente aquéllos localizados en la aurícula derecha modifican, por vi a aún no esta-blecida. la secreción de renina. Ahora bien, otros receptores de presión también de localización auricular, pero aún no identificados plenamente, parecen estar implicados en la excreción urinaria de sodio, y por ende, en la disminución del volumen. Durante varios años, numerosas observaciones experimentales apoyaron la existencia de un factor natiuretico que promovía la excreción urinaria de sodio en respuesta a la expansión del volumen. Estudios recientes han permitido la caracterización de un péptido peso molecular de 5000 daltones procedente de homogenizados auriculares, que disminuye la reabsorción proximal de sodio y cuya acción dura 20 mm aproximadamente. Los receptores implicados en su secreción responden al estiramiento y se encuentran localizados en las aurículas. En la actualidad se denomina factor natriurético auricular. ALTERACIONES DEL EQUILIBRIO−HIDROELECTROLITICO Deshidratación La deshidratación puede definirse como el estado corporal que resulta de la pérdida excesiva de líquidos. Es importante recordar que la deshidratación significa invariablemente pérdida de agua y electrólitos. De manera análoga, es evidente que no puede corregirse exclusivamente por la reposición de agua, deben también reponerse los electrólitos. El trastorno de una o más vías por las cuales se ingieren o se pierden líquidos suele conducir a la deshidratación. Causas 1. Ingreso hídrico insuficiente: falta de agua 2. Absorción insuficiente: diarrea 33 3. Pérdidas por el aparato gastrointestinal: vómito, fístula, etc. 4. Excreción renal excesiva: alteraciones en la reabsorción tubular 5. Sudoración excesiva 6. Pérdidas por heridas, y quemaduras Grados La pérdida de agua corporal total, independientemente de la causa, ocasiona una pérdida de peso. Esta disminución del peso corporal se toma como base para la clasificación del estado de la deshidratación. Se considera que una pérdida de peso hasta de un 5% se origina por una deshidratación leve o grado 1, una pérdida de peso del 10% es causada por una deshidratación moderada o grado II y una deshidratación grave o grado III se origina por una pérdida de peso hasta del 15%. Se pueden tolerar pérdidas entre el 1O y el 15% del peso en agua, pero pérdidas mayores conducen a la muerte. De acuerdo con el tiempo que tarde el proceso patológico subyacente en desencadenar el cuadro clínico de la deshidratación, ésta suele clasificarse en aguda o crónica: aunque no hay una definición precisa de la una o de la otra, una deshidratación aguda es aquella que se establece en un lapso no mayor de 72 horas. En una deshidratación aguda, el 85% del volumen perdido pertenece al líquido extracelular y sólo el 15% proviene del compartimiento intracelular, la corrección del déficit requiere un lapso aproximado de veinticuatro horas. Por el contrario, en una deshidratación crónica el 65% del volumen perdido es extracelular y el 35% restante es intracelular; en consecuencia, la corrección del déficit requiere más tiempo, aproximadamente cinco días. Clases La deshidratación puede clasificarse en tres tipos generales, a saber: • Deshidratación hipertónica. Estados en los cuales la deficiencia de agua excede a la de sal, sobresalen la falta de ingreso, la sudoración excesiva, y la diabetes insípida. • Deshidratación hipotónica. Estados en los cuales la deficiencia de sal excede a la del agua; ocasionados por la deficiencia corticosuprarrenal, las enfermedades renales con pérdida de sal, y las enfermedades cerebrales con pérdida de sal. 3. Deshidratación isotónica. Estados en los cuales la deficiencia de agua y sal ocurre en proporción balanceada; ocasionados por los trastornos gastrointestinales la hemorragia, y la pérdida de plasma. Deshidratación hipertónica Es ocasionada por una pérdida hidroelectrolitica en la cual la deficiencia hídrica predomina. Cuando un individuo previamente normal, esto es, en balance hídrico, se ve privado de agua por cualquier motivo sufre una deficiencia acuosa a causa de que las pérdidas constantes por pulmones. piel y heces continúan. Esto ocasiona inicialmente una disminución del liquido intracelular lo que conlleva a una pérdida de la turgencia de la piel, a la sequedad de las mucosas y a una pérdida de peso corporal signos clínicos de la deshidratación 34 La pérdida de agua extracelular aumenta la osmolalidad y por ende la presión osmótica, lo cual implica: • Paso de agua del compartimiento intracelular al extracelular con el fin de Igualar la concentración osmo1ár de los dos compartimientos. Una vez establecido el equilibrio osmótico, el volumen intracelular ha disminuido y los dos tercios del volumen total perdido proceden de este compartimiento; el tercio restante proviene del extracelular. • Estimulación de los osmorreceptores hipotalámicos y en consecuencia aumento de la secreción neurohipofisiaria de la hormona antidiurética; la eliminación urinaria de agua disminuye y la de solutos continúa, aparece otro signo clínico de la deshidratación, la oliguria. • Estimulación del centro hipotalamico de la sed, lo que lleva al individuo a aumentar la ingestión de agua; si a pesar de ello la deficiencia hídrica persiste, la osmolalidad creciente del liquido extracelular ocasiona la deshidratación celular, la sed se hace intensa, la secreción de la hormona antidiurética es máxima y la eliminación urinaria disminuye aún más o se suspende anuria. La disminución del volumen extracelular, es moderada, de sólo un tercio, inusual puede reducir elgasto cardiaco y. la presión arterial. Sin embargo es necesario anotar que en la deshidratación hipertónica el colapso vascular es extremadamente raro. Ahora bien, la desnutrición en la presión de perfusión en la arteriola aferente del corpúsculo renal aumenta la liberación de renina, con la consiguiente formación de angiotensina II, la cual estimula la liberación adrenocortical de aldosterona. Se reabsorbe, en consecuencia, agua y sodio en un intento por reponer el volumen sanguíneo, contribuyendo, de esta manera, a la hiperosmolalidad. La hipernaremia creciente agrava la deshidratación celular y es la responsable de la aparición del delirio. Deshidratación hipotónica Es ocasionada por una pérdida hidroelectrolltica en la cual la deficiencia de sal prodomina. La disminución de la concentración de sodio en los liquidos extracelulares ocasiona la pérdida de la osmolalidad. lo anterior determina el desplazamiento de dicho líquido hacia el interior de la célula, lo que disminuye más aún el volumen extracelular, mientras que el volumen intracelular aumenta La pérdida inicial del volumen extracelular ocasiona los signos ya mencionados de pérdida de la textura de la piel, sequedad de mucosas y pérdida de peso corporal. La hipovolemia, por su parte, agrega otros signos: la taquicardia, la hipotensión franca o postural. la frialdad y la palidez por vasoconstricción. La hipovolemia estimula la liberación de la hormona antidiurética, lo que aumenta la reabsorción de agua con el fin de conservar el volumen extracelular pero sacrifica, aun más, la osmolalidad. La hiponatremia estimula la secreción de aldosterona y aumenta, en consecuencia, la reabsorción de sodio y agua en un intento por reponer el volumen extracelular. Si la deficiencia sódica continúa, el colapso circulatorio suele ser notable, hay disminución del gasto cardiaco, la presión arterial cae y el pulso se vuelve rápido y débil. La secreción de aldosterona y de hormona antidiurética es máxima y por ende la excreción hidrosalina se reduce aún más. Si la deficiencia sódica continúa sobreviene la muerte. Deshidratación isotónica La pérdida de agua y electrólitos en cantidades osmóticamente equivalentes es la causa más frecuente de la deshidratación. La alteración fundamental en este tipo de deshidratación es la disminución del volumen, puesto que la osmolalidad en ambos compartimientos corporales se conserva. Inicialmente, la pérdida del volumen extracelular origina los signos clínicos de la deshidratación: pérdida de la textura de la piel, sequedad de mucosas y pérdida del peso corporal. Con el objeto de corregir el déficit, varios 35 mecanismos homeostáticos son puestos en ejecución: • Estimulación del centro hipotalámico de la sed, que obliga al individuo a aumentar la ingestión de líquidos. • Liberación neurohipofisiaria de hormona antidiurética, la cual disminuye la excreción hídrica aparece, entonces, otro signo clínico de la deshidratación, como es la oliguria o la anuria intentando de esta manera aumentar el volumen extracelular con el fin de corregir el déficit inicial. • Liberación de la renina por las células mioepiteliales del aparato yuxtaglomerular y la secreción subsiguiente de aldosterona por la corteza suprarrenal. Como consecuencia de ello, se disminuye la excreción hidrosalina con el fin de aumentar el volumen del compartimiento extracelular. Si el balance hidrosalino continúa siendo negativo, la disminución del volumen plasmático es la causa de la reducción del gasto cardiaco. de la caida de la presión arterial, de la aparición de un pulso rápido y filiforme. de la palidez y de la frialdad. Durante este estadio, los mecanismos homeostáticos antes mencionados son estimulados al máximo con el fin de llevar el volumen hídrico al rango de normalidad. Sobrehidratación Puede definirse como el estado corporal que resulta de la ganancia excesiva de líquidos o electrólitos, secundaria a un aumento en los ingresos o a una disminución en las pérdidas, lo que conlleva, según hemos visto, a un balance hídrico positivo. Causas 1. Ingestión compulsiva de agua 2. Ingreso aumentado: iatrugénico o accidental 3. Excreción renal disminuida: trabajo de parto, posoperatorio, etc. Clases Al igual que la deshidratación, puede clasificarse en tres tipos generales, a saber: • Sobrehidratacitin hipotónica. Estados en los cuales la ganancia de agua excede a la de sal ocasionada por una ingestión compulsiva de agua, una aplicación parenteral de soluciones hipotónicas, una hipersecreción de hormona antidiurética, una deficiencia de potasio y desnutrición. • Sobrehidratación hipertónica. Estados en los cuales la ganancia de sal excede a la de agua ocasionada por una ingestión de sal o aplicación parenteral de solución salina hipertónica. • Sobrehidratación isotónica. Estados en los cuales la ganancia de agua y sal ocurre en proporción balanceada secundada a una ingestión o aplicación de soluciones isotónicas. Intoxicación acuosa o ganancia hídrica La ingestión oral de agua, la inyección parenteral de la misma o la disminución en la excreción, representa una ganancia neta para el volumen acuoso total y más específicamente para el líquido intravascular a donde ella ingresa. Como consecuencia inmediata se presenta: • Un aumento del volumen plasmático, lo cual eleva la presión hidrostática capilar y ocurre, en consecuencia, salida del líquido al espacio intersticial, favoreciendo la presentación del edema. • Una disminución concomitante en la osmolalidad que aumenta aún mas la salida hídrica del espacio 36 vascular al intersticial y de ahí al intracelular; las células aumentan de volumen y concomitantemente disminuye su osmolalidad. El establecimiento del equilibrio osmótico determina, finalmente, una disminución en la osmolalidad corporal total y un aumento proporcional en el volumen de ambos compartimientos. La reducción de la osmolalidad inhibe los osmorreceptores hipotalámicos, lo cual determina una disminución en la liberación neurohipofisiaria de la antidiurética; en consecuencia, la reabsorción de agua disminuye y el exceso se exacta con la orina. Se trata, de esta manera, de reestablecer la osmolalidad plasmática. Por su parte, el aumento del volumen del compartimiento vascular es un estímulo que refuerza la disminución de la liberación neurohipofisiaria de la hormona antidiurética. La excreción de agua comienza aproximadamente a los 30 mm después de su ingreso, es máxima a los 60 mm y dura un lapso aproximado de tres horas. Intoxicación salina o ganancia sódica La ingestión oral de grandes cantidades de sal o la inyección parenteral de solución salina hipertónica (al 5%). determina, ademas del aumento del volumen plasmático, un aumento de su osmolalidad; esto último causa la salida hídrica del espacio intracelular, el cual disminuye su volumen, al vascular que aumenta aún más. Una vez establecido el equilibrio osmótico, se encontrará una hiperosmolalidad en ambos compartimientos y un volumen extracelular aumentado a expensas de la disminución del intracelular. La hipervolemia y el aumento concomitante de la presión arterial disminuyen al máximo la secreción de minina, por lo cual la excreción renal de sodio aumenta y con ella la excreción hídrica. La diuresis acuosa es reforzada por la disminución de la secreción de la hormona antidiurética, en respuesta al aumento del volumen. Es necesario anotar que los disturbios homeostaticos ocasionados por la sobrehjdratación sódica originan señales antagónicas con respecto a la secreción de hormona antidiurética. CLASES DE SOLUCIONES UTILIZADAS EN TRATAMIENTO DE HIDRATACIÓN: TRATAMIENTO DE LA DESHIDRATACIÓN. En casos de diarrea escasa con deposiciones semilíquidas y sin vomito, basta la dilución de la forma Láctea usual, pero es recomendable la suspensión de sopas, alimentos sólidos, y jugos las primeras 48 a 72 horas del tratamiento. Si la diarrea es demasiado liquida y no existe vómito se suprime alimentación oral de 8 a 12 horas y durante este tiempo se administra preparaciones electrolíticas. En presencia de diarrea profusa y vómito pertinaz se suprime la alimentación oral y se administra la preparación hidroeléctrica adecuada. La cantidad de suero que se administra es 100 a 150 ml / Kg. de peso. PREPARACIONES ELECTROLITICAS • PREPARACIÓN • Sal..................................................1 cucharada cafetera ( 2.5 g) • Azúcar............................................3 cucharadas soperas ( 45−50 g) • Zanahoria.......................................2 cucharaditas rayadas 37 • Agua...............................................1 Litro La mezcla se deberá hervir durante 10 minutos, luego se cuela y se completamente hasta el litro nuevamente con agua hervida para reparar la perdida por ebullición. La zanahoria tiene por objeto suministrar K+. • PREPARACIÓN • Cloruro de: Na ( NaCl)..........................2.5 g • Cloruro de: K+ ( KCl).............................1.5 g • Cloruro de : Ca ( CaCl2)........................0.25 g • Glucosa.................................................50.0 g • Agua......................................................1 Litro • PREPARACIÓN SUERO CASERO DISPONIBLE EN EL COMERCIO • Sodio....................................8.6 mEq • Potasio..................................8.9 mEq • Cloro.....................................17.6 mEq • Calcio....................................0.3 mEq Para lactantes de hasta 3 Kg. de peso 3 tabletas por litro de agua, para niños mayores 4 tabletas por litro agregando 3 cucharadas soperas de azúcar. • PREPARACIÓN Lytren, preparado comercial en polvo. ( medidas para un litro de agua. Suministra 280 calorías. • Sodio..................................25mEq • Potasio...............................25 mEq • Calcio.................................4 mEq • Magnesio...........................4 mEq • Cloruro ..............................30 mEq • Citrato................................15 mEq • Fosfato...............................5 mEq • Lactato...............................4 mEq • Sulfato................................4 mEq HIDRATACIÓN POR VIA PARENTERAL Los líquidos y electrolitos necesarios para la corrección de los déficit preexistentes se calculan mejor con base al peso corporal y al grado de deshidratación. En reemplazo de perdidas según el grado de deshidratación isotónica es: POR GRADO I GRADO II Kg. AGUA 40cc 80cc DE SODIO 3 mEq 6 mEq PESO POTASIO 2 mEq 4 mEq Deshidratación hipertónica 38 GRADO III 120cc 9 mEq 6 mEq En presencia de shock hipovolémico, la primera medida será la aplicación de 30cc de AGUA por kilogramo de peso con una composición electrolítica semejante a la del plasma sanguíneo ( 30cc de dextrosa 41.5 %; 1.5 % mEq de NaCl y 0.75 mEq de Bicarbonato de sodio por Kg. de peso ). BIBLIOGRAFIA • JARAMILLO L Hilda Norha, DIAZ H. Diana patricia, CALDERON V, Juan Camilo. LIQUIDOS Y ELECTROLITOS. Universidad de Antioquia, Facultad de Medicina, Departamento de Fisiología yBioquimica 39