ESTRUCTURA DE LA MEMBRANA
Anuncio

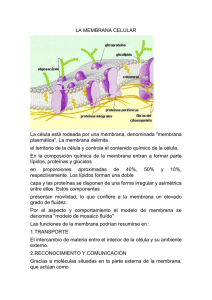
ESTRUCTURA DE LA MEMBRANA Una célula viva es un sistema de moléculas que se autorreproduce dentro de un recipiente. El recipiente es la membrana plasmática −una película lipídica tan delgada y transparente que no puede ser visualizada directamente al microscopio óptico. Su construcción es muy sencilla, basada en una lámina de moléculas lipídicas de aproximadamente 5 nm −es decir, de unos 50 átomos− de grosor. Sin embargo, sus propiedades son diferentes a las de cualquier otra lámina de un material que nos sea familiar del mundo que nos rodea. Es mucho más que una barrera que impide que el contenido celular se escape y se mezcle con el medio circundante (Figura 11− 1A). Los nutrientes han de cruzar la membrana hacia el interior de la célula para que la célula pueda sobrevivir y crecer, y los productos de desecho han de cruzarla hacia el exterior. Así pues, en la membrana hay canales y bombas altamente selectivas, formadas por moléculas proteicas, que permiten que determinadas sustancias sean importadas hacia el interior celular y que otras sustancias sean exportadas hacia el exterior. Además, otras moléculas proteicas actúan de s ensores que permiten a la célula responder a los cambios de su entorno. También son destacables las propiedades mecánicas de la membrana. Cuando la célula crece o cambia de forma, también lo hace la membrana plasmática: se alarga, incorporando más membrana sin perder su continuidad, y puede deformarse sin romperse (véase Figura 11-2). Si se agujerea, nunca se colapsa como un globo ni se rompe; al contrario, rápidamente se vuelve a soldar. Figura 11.1 Las membranas celulares como barreras Las membranas celulares entre dos compartimientos −entre el interior y el exterior de la célula (A) o entre dos compartimientos intracelulares (B). En cada caso la membrana impide que las moléculas de ambos compartimientos se mezclen 1 Figura 11.2 Algunas de las funciones de la membrana plasmática Las bacterias más sencillas tienen una sola membrana −la membrana plasmática. En cambio, las células eucariotas tienen, además, una profusión de membranas internas (endomembranas) que envuelven los compartimientos intracelulares. Estas membranas están construidas siguiendo los mismos principios que la membrana plasmática, y también actúan de barrera selectiva entre los espacios que contienen distintas colecciones de moléculas (Figura 11−1B). Así pues, las membranas del retículo endoplásmico, del complejo de Golgi, de las mitocondrias y de los otros orgánulos (Figura 11−3) mantienen las características diferenciales de composición y función entre estos orgánulos. Estas membranas internas actúan mucho más que como barrera: sutiles diferencias entre ellas, especialmente en cuanto a las moléculas proteicas que las forman, son las principales responsables de otorgar a cada orgánulo su carácter diferencial. 2 Figura 11.3 Las membranas forman los distintos compartimientos de las células eucariotas En la figura se muestran los distintos orgánulos rodeados de membrana de una típica célula animal. Obsérvese que el núcleo y las mitocondrias están rodeados por dos membranas. Todas las membranas celulares están formadas por lípidos y proteínas y tienen una estructura básica común (Figura 11−4). El componente lipídico está formado por muchos millones de moléculas de lípidos ordenados en dos láminas íntimamente superpuestas, formando una bicapa lipídica (véase Figura 11−4B y C). La bicapa lipídica proporciona la estructura básica y actúa de barrera permeable. Las moléculas proteicas intervienen en el resto de funciones de la membrana y otorgan a las distintas membranas sus características individuales. En este capítulo discutiremos en primer lugar los lípidos de la membrana y luego las proteínas. 3 Figura 11.4 Tres perspectivas de la membrana celular (A) Electromicrografía de una membrana plasmática de un eritrocito humano en sección transversal (B) y (C) Dibujos esquemáticos que muestran en dos y tres dimensiones la membrana celular 4 La bicapa lipídica La bicapa lipídica se ha establecido como la base universal de la estructura de la membrana celular. Sus propiedades son las responsables de las propiedades generales de las membranas celulares. Empezaremos esta sección considerando de qué forma la estructura de la bicapa es una consecuencia del comportamiento de las moléculas lipídicas en un medio acuoso. Los lípidos de las membranas forman bicapas en el agua Los lípidos de las membranas celulares combinan dos propiedades muy distintas en una misma molécula: tienen una cabeza hidrofílica ("que se siente atraída por el agua") y una o dos colas hidrocarbonadas hidrofóbicas ("que rehúyen el agua") (Figura 11−5). Los lípidos de membrana más abundantes son los fosfolípidos, en los cuales el grupo del extremo hidrofílico se encuentra unido al resto de la molécula por medio de un grupo fosfato. En la mayoría de membranas celulares el tipo más común de fosfolípido es la fosfatidilcolina, que tiene una pequeña molécula de colina unida a un fosfato como cabeza hidrofílica y dos largas cadenas hidrocarbonadas como colas hidrofóbicas (Figura 11−6). Figura 11.5 Dibujo esquemático de una típica molécula lipídica de la membrana 5 Figura 11.6 Molécula de fosfatidilcolina La fosfatidilcolina, representada ( A ) de forma esquemática (B) como fórmula química (C) como modelo espacial compacto (D) como símbolo Ese fosfolípido tiene cinco partes: la cabeza hidrofílica, la colina unida por el fosfato al glicerol; que está unido a las dos cadenas hidrocarbonadas que forman la cola hidrofóbicas. Las dos cadenas son sintetizadas como ácidos grasos – cadenas hidrocarbonadas con un grupo – COOH en un extremo- que están unidas al glicerol por sus grupos − COOH. Cuando hay un doble enlace entre dos carbonos se produce un doblegamiento de las cadenas hidrocarbonadas; la curvatura debida al doble enlace está exagerada en los dibujos. El término fosfatidil− que forma parte del nombre de los fosfolípidos se refiere a la parte fosfato–glicerol−ácido graso de la molécula. 6 Todas las moléculas con propiedades hidrofílicas e hidrofóbicas reciben el nombre de anfipáticas. Esta característica también la presentan otros tipos de lípidos de membrana −los esteroles (como el colesterol en las membranas celulares animales) y los glucolípidos, que tienen azúcares en su cabeza hidrofilica (Figura 11−7)− y juega un papel muy importante en el ensamblaje de los lípidos que forman la bicapa. Figura 11.7 Tres tipos distintos de moléculas lipídicas de membrana Todas son antipáticas, con una cabeza hidrofílica y una o dos colas hidrofóbicas. La cabeza (sombreada en rosa) es una serina−fosfato en la fosfatidilserina, un grupo −OH en el colesterol, y un azúcar (galactosa) en el galactocerebrósido Como hemos discutido en el Capítulo 2, las moléculas hidrofílicas se disuelven fácilmente en el agua puesto que disponen de átomos cargados o grupos polares (es decir, grupos con una 7 distribución desigual de cargas positivas y negativas) que pueden formar enlaces hidrostáticos o enlaces de hidrógeno con las moléculas de agua, las cuales también son polares (Figura 11−8). Por el contrario, las moléculas hidrofóbicas son insolubles en el agua puesto que todos, o casi todos, sus átomos son apolares o sin carga y, por tanto, no pueden formar enlaces con las moléculas de agua. En lugar de disolverse, fuerzan a las moléculas de agua adyacentes a reorganizarse adoptando una estructura parecida a una jaula alrededor de la molécula hidrofóbica (Figura 11−9). Esta estructura es mucho más ordenada que el agua que la envuelve, por lo que su formación necesita energía. Sin embargo, el coste energético es mínimo si las moléculas hidrofóbicas se agrupan de manera que quede afectado el número mínimo de moléculas de agua. Así pues, las moléculas puramente hidrofóbicas, como las grasas de las células adiposas animales y los aceites de las semillas de las plantas (Figura 11−10), coalescen en una única gran gota cuando se dispersan en el agua. Figura 11.8 Una molécula hidrofílica interactuando con moléculas de agua La acetona es una molécula polar, por los que puede formar interacciones favorables con las moléculas de agua, las cuales también son polares. Así pues la acetona se disuelve fácilmente en agua. δ- indica una carga parcial negativa y δ+ una carga parcial positiva. En la figura los átomos polares se han coloreados en rosa y azul y los grupos no polares están en gris. Figura 11.9 Una molécula hidrofóbica en el agua La molécula de 2−metil propano es completamente Hidrofóbica, por lo que no puede formar interacciones favorables con el agua y fuerza a las moléculas de agua adyacentes a reorganizarse en una estructura en forma de caja a su alrededor. 8 Figura 11.10 Comparación entre una molécula grasa (triacilglicerol) y una molécula de fosfolípido (fosfatidiletanolamina) Las zonas hidrofóbicas están sombreadas en gris, y las hidrofílicas en rosa. La molécula de grasa es totalmente hidrofóbica mientras que la molécula de fosfolípido es antipática. (En la figura, la tercera cola del triacilglicerol está situada hacia arriba de la molécula para poderla comparar con el fosfolípido, aunque normalmente se encuentra hacia abajo) Las moléculas antipáticas como los fosfolípidos están sujetas a dos fuerzas conflictivas: la cabeza hidrofílica es atraída por el agua, mientras que las colas hidrofóbicas rehuyen el agua y tienden a agregarse a otras moléculas hidrofóbicas. Este conflicto se resuelve maravillosamente con la formación de una bicapa lipídica −una disposición que satisface ambas partes y es lo más favorable desde el punto de vista energético. Las cabezas hidrofílicas quedan expuestas al agua mientras que todas las colas hidrofóbicas quedan alejadas del medio acuoso, unas junto a otras en el interior del sándwich (Figura 11−11). 9 Figura 11.11 Visión transversal de una bicapa de fosfolípidos. (A) Simulación por ordenador que muestra las moléculas de fosfolípido (Colas rojas y cabezas amarillas) y las moléculas de agua que las rodean (azul). (B) Dibujo esquemático de una bicapa de fosfolípidos en el agua. (Adaptado de Science 262:223-228(1993), cortesía de R. Venable y R. Pastor.) Las mismas fuerzas que conducen a las moléculas anfipáticas a formar una bicapa confieren a é sta bicapa su capacidad autoselladora. Cualquier rotura de la bicapa dará lugar a un extremo libre en el agua, y puesto que esto es energéticamente desfavorable, las moléculas de la bicapa se reordenarán espontáneamente, con lo cual la bicapa será reparada, restableciéndose de nuevo una capa continua. Si la fisura es muy grande, la capa puede romperse en vesículas aisladas. En estos casos, el principio predominante es que los extremos 10 libres sean rápidamente eliminados. La prohibición de que existan extremos libres tiene una consecuencia muy importante: sólo existe un sistema para que una lámina finita pueda evitar tener extremos libres, que consiste en cerrarse sobre sí misma y originar un espacio cerrado (Figura 11−12). Así pues, las moléculas antipáticas como los fosfolípidos se ensamblan necesariamente formando recipientes que se autosellan definiendo así compartimientos cerrados. Este comportamiento tan importante, fundamental para la creación de una célula viva, es en esencia sencillamente el resultado del hecho de que cada molécula es hidrofílica en un extremo e hidrofóbica en el otro. Figura 11.12 Las bicapas de fosfolípidos se doblan espontáneamente formando comportamientos cerrados. La estructura cerrada es estable puesto que evita la exposición de las colas hidrocarbonadas hidrófóbicas al agua, hecho energéticamente desfavorable. 11 La bicapa lipídica es un fluido bidimensional El ambiente acuoso dentro y fuera de la célula impide a los lípidos de la membrana escaparse de a bicapa, pero nada impide que estas moléculas se desplacen y cambien de posición las unas respecto a las otras dentro del plano de la bicapa. Por lo tanto, la membrana se comporta como un fluido bidimensional, lo cual es crucial para sus funciones. Esta propiedad es distinta de la de flexibilidad, que es la capacidad de la membrana para doblegarse. La flexibilidad de la membrana también es importante, y establece un límite menor de aproximadamente 25nm para el tamaño de la vesícula que las membranas celulares pueden formar. La fluidez de las bicapas lipídicas puede estudiarse utilizando bicapas lipídicas sintéticas, que pueden generarse fácilmente de manera artificial mediante la agregación espontánea de moléculas lipídicas anfipáticas en el agua. En estudios experimentales se suelen utilizar dos tipos de estas bicapas sintéticas. Al añadir fosfolípidos puros al agua se forman vesículas esféricas cerradas, llamadas liposomas; son de tamaño variable, desde 25nm hasta 1mm de diámetro (Figura 11−13). Alternativamente, se pueden formar bicapas de fosfolípidos planas a través de un agujero situado en una separación entre dos compartimientos acuosos (Figura 11−14). Figura 11.13 Liposomas Electrónmicrografía de vesículas de fosfolípidos (liposomas) que muestra la estructura de la bicapa de la membrana. Esquema de un pequeño liposomas esférico visto en sección transversal. 12 Figura 11.14 Representación de una sección transversal de una bicapa lipídica sintética Esta bicapa plana se forma a través de un pequeño agujero (aproximadamente de 1mm de diámetro) en una pared que separa dos compartimientos acuosos. Para formar la bicapa en el agujero, el agujero se sumerge en una solución acuosa y la solución de fosfolípidos (en disolvente no acuoso) se “pinta” a través del agujero con un pincel. Estas bicapas artificiales sencillas permiten medidas delicadas del desplazamiento de las moléculas lipídicas, y revelan que algunos desplazamientos son raros mientras que otros son rápidos y frecuentes. Así pues, en las bicapas lipídicas sintéticas, las moléculas de fosfolípidos raramente saltan de un lado de la monocapa (una mitad de la bicapa) al otro; sin proteínas que lo faciliten y en condiciones similares a las de la célula, se estima que este proceso, denominado "flip-flop", se produce menos de una vez al mes en cualquier molécula lipídica. Por otro lado, debido a movimientos térmicos, las moléculas lipídicas giran muy rápidamente sobre su eje longitudinal y constantemente intercambian su lugar con el de las moléculas vecinas dentro de cada monocapa (Figura 11−15). Este intercambio da lugar a una rápida difusión lateral; por ejemplo, una molécula lipídica en una bicapa artificial puede difundir una longitud igual a la de una gran célula bacteriana (~2µm) en aproximadamente un segundo. Si la temperatura disminuye, la caída de la energía térmica hace disminuir la velocidad del movimiento de los lípidos, con lo que la membrana es menos fluida. 13 Se han obtenido resultados parecidos con membranas celulares aisladas y con células enteras, lo cual indica que la bicapa lipídica de una membrana celular también se comporta como un fluido bidimensional en el que las moléculas constituyentes son libres de desplazarse lateralmente; como en las bicapas sintéticas, en las células las moléculas individuales de fosfolípido normalmente se hallan restringidas a su propia monocapa y no sufren espontáneamente el proceso de "flip-flop" (véase Figura 11−15). Figura 11−15 Movilidad de los fosfolípidos Tipos de movimientos posibles de las moléculas de fosfolípidos en una bicapa lipídica. La fluidez de una bicapa lipídica depende de su composición El grado de fluidez de una membrana celular −la facilidad con la que sus moléculas lipídicas se desplazan en el plano de la bicapa− es importante para su función y se ha de mantener dentro de unos ciertos límites. La fluidez de una bicapa lipídica a una temperatura determinada depende de su composición de fosfolípidos y, especialmente, de la naturaleza de las colas 14 hidrocarbonadas: cuanto más regular y más compacto sea el empaquetamiento de estas colas, más viscosa y menos fluida será la bicapa. Dos propiedades de las colas hidrocarbonadas afectan su empaquetamiento en la bicapa −su longitud y su insaturación (es decir, el número de dobles enlaces que contienen). Los extremos hidrocarbonados de las moléculas de fosfolípidos varían entre 14 y 24 átomos de carbono de longitud, siendo lo más habitual 18-20 átomos. Una longitud menor de la cadena reduce la tendencia de las colas hidrocarbonadas para interaccionar entre sí, de forma que aumenta la fluidez de la bicapa. Generalmente una de las dos colas hidrocarbonadas de cada molécula de fosfolípido tiene uno o más dobles enlaces entre átomos de carbono adyacentes (véase Figura 11−6). Por lo tanto, no tiene el número máximo de átomos de carbono que en principio podrían unirse a su esqueleto carbonado, por lo que se dice que está insaturada respecto a los hidrógenos. Generalmente la otra cola de ácido graso no tiene dobles enlaces, es decir, presenta el complemento completo de átomos de hidrógeno, con lo cual está saturada. Cada doble enlace de una cola insaturada genera un pequeño remolino en la cola hidrocarbonada (véase Figura 11−6) que dificulta el empaquetamiento de las colas. Por esta razón, las bicapas lipídicas que tienen grandes cantidades de colas hidrocarbonadas insaturadas son mucho más fluidas que las que tienen proporciones menores. Las bacterias y las levaduras, que han de adaptarse a temperaturas muy variables, ajustan constantemente tanto la longitud como la insaturación de las colas hidrocarbonadas de los fosfolípidos de su bicapa para mantener relativamente constante la fluidez de la membrana: por ejemplo, a temperaturas altas la célula fabrica lípidos de membrana con colas más largas y que contienen muy pocos dobles enlaces. Se utiliza un truco parecido en la fabricación de la margarina a partir de aceites vegetales. Las grasas producidas por las plantas son generalmente insaturadas y, por tanto, líquidas a temperatura ambiente, a diferencia de las grasas animales tales como la mantequilla o el sebo, que están generalmente saturadas y, por lo tanto, a esta misma temperatura son sólidas. La margarina se fabrica con aceites vegetales a los cuales se les han eliminado los dobles enlaces añadiéndoles hidrógeno, con lo que a temperatura ambiente son más sólidos y parecidos a la mantequilla. 15 La fluidez de la membrana es importante para la célula por muchas razones. Permite a las proteínas de membrana difundir rápidamente en el plano de la bicapa y que interaccionen unas con otras, lo cual es muy importante, por ejemplo, en los procesos de señalización celular (se discute en el Capítulo 15). Proporciona una manera sencilla de distribuir los lípidos y las proteínas, mediante difusión desde los lugares donde han sido insertados en la bicapa después de su síntesis, hasta otras regiones de la célula. Permite a las membranas fusionarse unas con otras y mezclar sus moléculas, y permite que las moléculas de la membrana se distribuyan de forma equitativa entre las dos células hijas durante la división celular. Es difícil imaginarse cómo podría una célula vivir, crecer y reproducirse si sus membranas no fueran fluidas. En las células animales, la fluidez de la membrana está modulada por la presencia del esterol colesterol, ausente en plantas, levaduras y bacterias. Estas cortas y rígidas moléculas se encuentran en grandes cantidades en la membrana plasmática, donde rellenan los espacios existentes entre las moléculas vecinas de fosfolípidos provocados por los remolinos de sus extremos hidrocarbonados insaturados (Figura11−16). De esta forma el colesterol endurece la bicapa y la hace menos fluida y menos permeable. 16 Figura 11−16 Esquemas superiores Estructura del colesterol representada mediante: (A) su fórmula (B) un esquema (C) un modelo compacto espacial. Esquema inferior: Papel del colesterol en las membranas celulares El colesterol en una bicapa lipídica. Dibujo esquemático de una molécula de colesterol interactuando con 2 moléculas de fosfolípido en una de las monocapas de la bicapa lipídica. 17 ACTUALIZACION 1 La membrana plasmática contiene microdominios lipídicos esfingolípidos, colesterol y algunas proteínas de membrana. enriquecidos en La mayoría de los diferentes tipos de moléculas lipídicas de las membranas celulares están distribuidas al azar mezcladas unas con otras en la monocapa en la que residen. Las fuerzas de atracción de van der Waals entre los ácidos grasos adyacentes no son tan selectivas como para mantener unidos grupos de moléculas de este tipo. Sin embargo, para algunas moléculas lipídicas, como los esfingolípidos que suelen presentar cadenas hidrocarbonadas saturadas largas, las fuerzas de atracción podrían ser lo suficientemente fuertes como para mantener unidas temporalmente las moléculas adyacentes formando pequeños microdominios. Estos microdominios lipídicos pueden considerarse una transición de fase temporal en la bicapa lipídica en la que los esfingolípidos se concentran. Parece que la membrana plasmática de las células animales contiene muchos pequeños microdominios lipídicos (de aproximadamente 70nm de diámetro), ricos tanto en esfingolípidos como en colesterol. Las cadenas hidrocarbonadas de los lípidos concentrados son más largas y rectas que las de la mayoría de los lípidos de membrana por lo que los microdominios son más gruesos que el resto de la bicapa (fig. 10.9) y pueden acomodar con mayor facilidad ciertas proteínas de membrana que tienden a acumularse en ellos (fig. 10.13). Así, parece que los microdominios lipídicos favorecen la organización de estas proteínas – concentrándolas para su transporte en pequeñas vesículas o permitiendo que puedan actuar unidas, como cuando transducen señales extracelulares en señales intracelulares. Casi siempre las moléculas lipídicas de una monocapa de la bicapa se desplazan independientemente de las de la otra monocapa. Sin embargo en los microdominios lipídicos las largas cadenas hidrocarbonadas de los esfingolípidos de una monocapa interaccionan con las de otra monocapa, de forma que en estos microdominios lipídicos las dos monocapas se comunican a través de sus colas lipídicas. Tomado de ALBERTS B.Biología molecular de la célula (4ª edición−2004) – Editorial Omega 18 Fig.10.9 Fig 10.13 19 ACTUALIZACION 2 Las gotas de lípido están rodeadas por una monocapa de fosfolípidos La mayoría de las células almacena un exceso de lípidos como gotas, a partir de las cuales se obtienen bloques constructores para la síntesis de la membrana o como fuente de alimento. Los adipocitos son células especializadas en el almacenamiento de lípidos. Tienen un alto contenido de gotas lipídicas de las cuales los ácidos grasos pueden ser liberados por demanda y exportados a otras células a través del torrente sanguíneo. Las gotas de lípidos almacenan lípidos neutros tales como triacilglicéridos y ésteres del colesterol, los cuales son sintetizados por enzimas a partir de ácidos grasos y colesterol en la membrana del retículo endoplásmico. Como estos lípidos no contienen grupos hidrofílicos, son moléculas hidrofóbicas, se agregan en gotas tridimensionales más que en bicapas. Las gotas de lípidos son organelos únicos porque están rodeados por una monocapa de fosfolípidos, la cual contiene una gran variedad de proteínas. Algunas de éstas son enzimas involucradas en el metabolismo de los lípidos, pero de la mayoría se desconoce su función. Las gotas de lípidos se forman rápidamente cuando las células son expuestas a una alta concentración de ácidos grasos. Se forman a partir de discretas regiones de la membrana del retículo endoplásmico donde están concentradas varias de las enzimas relacionadas con el metabolismo lipídico. En la figura se muestra un modelo de cómo las gotas lipídicas podrían formarse y adquirir la monocapa que las rodea. Tomado de ALBERTS B.Biología molecular de la célula (5ª edición−2004) – Editorial Omega 20 21 La bicapa lipídica es asimétrica Generalmente las membranas celulares son asimétricas, presentando un aspecto muy distinto en el interior de la célula o del orgánulo que en el exterior. Frecuentemente las dos mitades de una bicapa presentan diferencias importantes en cuanto a su composición de fosfolípidos y de glucolípidos (Figura 11−17). Además, las proteínas están embebidas en la bicapa en una orientación específica, muy importante para su función. Figura 11−17 La distribución asimétrica de los fosfolípidos y de los glucolípidos en la bicapa lipídica de una membrana plasmática muestran en distintosempieza colores cinco moléculas de (marcados roja), Enlas azul,nuevas los La Se asimetría lipídica entipos el de momento de fosfolípidos su síntesis. En en lasletra células, glucolípidos, con grupos de cabeza hexagonales que representan los azúcares. Todas las moléculas de moléculas de fosfolípido son sintetizadas por enzimas unidas a la membrana, que utilizan como glucolípidos se encuentran en la monocapa externa, mientras que el colesterol se distribuye por igual en ambas sustratos ácidos grasos disponibles en una de las dos mitades de la bicapa −esto es, en una monocapas. monocapa− y liberan el nuevo fosfolípido en la misma monocapa. Para permitir que la 22 membrana entera crezca, una proporción de las moléculas lipídicas se ha de trasladar a la monocapa opuesta. Esta transferencia está catalizada por unas enzimas llamadas flipasas (Figura 11−18). Se ha sugerido que las flipasas pueden transferir selectivamente moléculas específicas de fosfolípido, con lo cual en las dos mitades de la bicapa habría distintos tipos de flipasas. Figura 11−18 Papel de las flipasas en las síntesis de las bicapas lipídicas Todas las moléculas de fosfolípido de nueva síntesis se añaden a una de las caras de la bicapa, pero las flipasas transfieren algunas de ellas a la monocapa opuesta, con lo cual la bicapa se alarga La inserción en una sola cara y la presencia de flipasas selectivas no son los únicos sistemas de producir bicapas lipídicas asimétricas. En el caso de los glucolípidos, el tipo de moléculas lipídicas que presentan la distribución asimétrica más consistente y sorprendente, actúa un mecanismo distinto. Para explicar su distribución es necesario conocer con más detalle la ruta de formación de membrana en las células eucariotas. 23 La asimetría lipídica se genera dentro de la célula En las células eucariotas la síntesis de la membrana se produce en un compartimiento intracelular −el retículo endoplásmico, o ER (de "endoplasmic reticulum", discutido con más detalle en el Capítulo 14). La nueva membrana, una vez ensamblada, es exportada hasta las otras membranas de la célula mediante un ciclo de gemación y fusión: del retículo endoplásmico se desprenden pequeñas porciones de membrana, formando pequeñas vesículas, las cuales se incorporan mediante fusión a otras membranas. Durante este proceso de transporte vesicular se conserva la orientación de la bicapa respecto al citosol, por lo que todas las membranas celulares, tanto la membrana plasmática externa como las intracelulares que rodean los orgánulos, tienen caras "internas" y "externas" distintas: la interna, o citosólica, limita con el citosol, mientras que la externa, o no citosólica, está expuesta al exterior celular o al espacio interior de un orgánulo (Figura 11−19). Los glucolípidos están localizados principalmente en la membrana plasmática, y se encuentran únicamente en la mitad no citosólica de la bicapa. Por lo tanto, sus grupos de azúcar están expuestos al exterior celular (véase Figura 11−17), donde forman parte de la cubierta protectora de hidratos de carbono que rodea la mayoría de las células animales. Las moléculas de glucolípido adquieren sus grupos azúcar en el complejo de Golgi (se discute en el Capítulo 14). Las enzimas que añaden estos grupos se encuentran localizadas en el interior del complejo de Golgi, con lo cual las moléculas de azúcar se añaden a las moléculas lipídicas en la mitad no citosólica de la bicapa lipídica. Cuando se ha formado una molécula de glucolípido, permanece atrapada en esta monocapa, puesto que allí no hay flipasas que puedan transferirla a la monocapa citosólica. Así pues, cuando finalmente llega a la membrana plasmática, la molécula de glucolípido está situada de forma que su azúcar está colocado hacia el exterior de la célula (véase Figura 11− 19). 24 Figura 11−19 Aproximación y fusión de una vesícula de membrana Una vesícula de membrana aproximándose a un orgánulo rodeado de membrana y fusionándose con su membrana plasmática. Obsérvese cómo durante el proceso de aproximación y fusión se mantiene la orientación de la membrana, de forma que la superficie citosólica sigue siendo la superficie citosólica. Otras moléculas lipídicas presentan tipos distintos de distribución asimétrica, relacionados con otras funciones. Por ejemplo, los fosfolípidos del tipo inositol son componentes minoritarios de la membrana plasmática, pero juegan un papel especial en la transmisión de señales desde la s uperficie celular hasta los compartimientos intracelulares que responderán a la señal (se discute en el Capítulo 15). Actúan con posterioridad a que la señal haya sido transmitida a través de la membrana plasmática, por lo que están concentrados en la mitad citosólica de la bicapa lipídica (véase figura 11-17). 25 Las bicapas lipídicas son impermeables a los solutos y a los iones Hemos visto que una de las funciones más importantes de las membranas celulares es el control del paso de moléculas a través de la bicapa lipídica. En este aspecto el interior hidrofóbico de la bicapa lipídica juega un papel muy importante, puesto que constituye una barrera al paso de la mayoría de moléculas hidrofílicas. Estas moléculas rehúyen entrar en un ambiente graso, como lo hacen las moléculas hidrofóbicas a entrar en el agua. Esta función de barrera de las bicapas lipídicas se puede poner de manifiesto en bicapas sintéticas del tipo que se ilustra en la Figura 11−14. Con tiempo suficiente, prácticamente cualquier molécula acabará difundiendo a través de una bicapa lipídica. Sin embargo, la velocidad a la que se produce esta difusión varía enormemente, dependiendo en parte del tamaño de la molécula y, principalmente, de sus propiedades de solubilidad. En general, cuanto menor es la molécula y cuanto más soluble es en aceite (es decir, cuanto más hidrofóbica o no polar sea) más rápidamente difunde a través de una bicapa. Así pues: 1. Moléculas pequeñas no polares, tales como el oxígeno molecular (O2, de 32 daltons de peso molecular) y el dióxido de carbono (44 daltons), se disuelven fácilmente en las bicapas lipídicas y por lo tanto difunden con rapidez a través de ellas; de hecho, las células necesitan ser permeables a los gases para los procesos de respiración celular, los cuales se tratan en el Capítulo 13. 2. Moléculas polares no cargadas (moléculas con una distribución desigual de la carga eléctrica) también difunden rápidamente a través de una bicapa, si su tamaño es suficientemente reducido. Por ejemplo, el agua (18 daltons) y el metanol (46 daltons) atraviesan rápidamente una bicapa; el glicerol (92 daltons) lo hace con menor rapidez, y la glucosa (180 daltons) prácticamente no la atraviesa (Figura 11-20). 3. Por el contrario, las bicapas lipídicas son altamente impermeables a todos los iones y moléculas cargadas, por muy pequeñas que sean. Su carga y el elevado grado de 26 atracción hacia las moléculas de agua les impiden penetrar en la fase hidrocarbonada de la bicapa. Así, las bicapas artificiales son mil millones (109) de veces más permeables al agua que a los iones, incluso a los de reducido tamaño como el Na+ o el K+. Figura 11−20 Permeabilidad relativa de una bicapa lipídica artificial a diferentes tipos de moléculas Cuanto más pequeña sea la molécula y, lo que es más importante, cuanto menor sea el número de interacciones con el agua (es decir, cuanto menos polar sea), más rápidamente difundirá a través de una bicapa. Obsérvese que muchas de las moléculas que utilizan las células como nutrientes son demasiado grandes y polares para cruzar a través de una bicapa pura. 27 Por lo tanto, las membranas celulares permiten el paso, por simple difusión, del agua y de las moléculas no polares. Sin embargo, para que las células puedan captar nutrientes y eliminar los productos de deshecho, las membranas también han de permitir el paso de muchas otras moléculas, tales como iones, azúcares, aminoácidos, nucleótidos y muchos metabolitos celulares. Estas moléculas cruzan las bicapas lipídicas con gran lentitud por difusión simple, por lo que son necesarias proteínas de transporte especializadas para transportarlas de manera eficiente a través de las membranas celulares. Estas proteínas transportadoras de membrana son objeto de estudio en el Capítulo 12. Sin embargo, antes de entrar a estudiar este punto, vamos a considerar algunos principios generales sobre cómo están asociadas las proteínas con la bicapa lipídica en las membranas celulares Proteínas de membrana La bicapa lipídica es la estructura básica de todas las membranas biológicas y actúa de barrera de permeabilidad, pero la mayoría de las funciones específicas de la membrana las desempeñan las proteínas de membrana. En las células animales, las proteínas constituyen cerca del 50% de la masa total de la mayoría de membranas plasmáticas, mientras que la otra mitad de la masa son lípidos y una cantidad relativamente pequeña de carbohidratos. Sin embargo, las moléculas lipídicas son mucho más pequeñas que las moléculas de proteína, por lo que por cada molécula de proteína hay alrededor de 50 moléculas de lípidos (véase Figura 11−4). 28 Figura 11−21 Algunas funciones de las proteínas de la membrana plasmática Las proteínas de membrana realizan muchas otras funciones, además de transportar nutrientes, metabolitos, o iones a través de la bicapa lipídica. Algunas de ellas unen macromoléculas a la membrana, a uno u otro lado. Otras actúan como receptores que detectan señales químicas en el ambiente celular y las transmiten al interior de la célula; otras, como las enzimas, catalizan reacciones específicas (Figura 11-21; Tabla11-1). Cada tipo de membrana presenta un juego diferente de proteínas, lo cual refleja las funciones particulares de una membrana determinada. En esta parte del capítulo discutiremos la estructura de las proteínas de membrana e ilustraremos las distintas maneras en que se asocian con la bicapa lipídica. 29 Tabla 11−1 Algunos ejemplos de proteínas de membrana plasmática y sus funciones Clase funcional Ejemplo de proteínas Función específica Transportadores bomba de Na+ bombea en forma activa Na+ hacia el exterior y K+ hacia el interior de la célula Conectores integrinas unen los filamentos intracelulares de actina con las proteínas de la matriz extracelular Receptores receptor del factor de crecimiento derivado de las plaquetas (PDGF) une el PDGF extracelular y, como consecuencia, genera una señal intracelular que provoca que la célula crezca y se divida Enzimas adenilato ciclasa cataliza la producción de AMP cíclico intracelular como respuesta a señales intracelulares Las proteínas de membrana pueden estar asociadas a la bicapa lipídica de varias maneras Las proteínas se pueden asociar a la bicapa lipídica de una membrana celular de tres maneras principales (Figura 11-22). 1. Muchas proteínas de membrana atraviesan la bicapa lipídica de forma que parte de su masa se sitúa a cada lado de la membrana (Figura 11−22A). Estas proteínas transmembrana, al igual que sus vecinas lipídicas, tienen regiones hidrofílicas e hidrofóbicas. Las regiones hidrofóbicas se sitúan en el interior de la membrana en contacto con las colas hidrofóbicas de las moléculas lipídicas. Sus regiones hidrofílicas se hallan expuestas al medio acuoso de ambos lados de la membrana. 30 2. Otras proteínas de membrana se hallan localizadas completamente en el exterior de la bicapa, unidas a la bicapa únicamente por medio de una o más uniones covalentes con grupos de lípidos (11−22B). 3. Otras proteínas están unidas de manera indirecta a un lado u otro de la membrana sólo mediante interacciones con otras proteínas de membrana (Figura 11−22C). Todas las proteínas de membrana presentan una orientación característica: por ejemplo, una proteína transmembrana siempre tiene la misma región proteica en contacto con el citosol. La orientación es una consecuencia de la manera por la que se ha sintetizado la proteína, como se discute en el Capítulo 14. Figura 11.22 Distintas formas de asociación de las proteínas de membrana con la bicapa lipídica (A) Las proteínas transmembrana pueden atravesar la bicapa como hélices α sencillas, como hélices α múltiples, como láminas β cerradas (barril β). (B) Otras proteínas de membrana están unidas a la bicapa solamente mediante unión covalente a las moléculas de lípidos (líneas rojas en zig – zag). (C) Finalmente, muchas proteínas de membrana están unidas a la membrana mediante interacciones no covalentes relativamente débiles con otras proteínas de membrana. 31 ACTUALIZACION 3 Tomado de ALBERTS B.Biología molecular de la célula (4ª edición−2004) – Editorial Omega Varios sistemas de asociación de las proteínas con la bicapa lipídica Proteínas transmembrana que atraviesan la bicapa: (1) como una α-hélice única (de paso único). (2) en forma de múltiples α-hélices (de paso múltiple) Algunas de estas proteínas de paso único o de paso múltiple están unidas covalentemente a cadenas de ácidos grasos insertados en la monocapa citoplasmática (3) en forma de hebra β enrollada (un barrilβ). Otras proteínas están expuestas sólo a un lado de la membrana: (4) algunas de ellas están unidas a la superficie citosólica mediante una α hélice anfipática que se une a la monocapa citosólica a través de la superficie hidrofóbica de la hélice. (5) otras se encuentran unidas a la BL únicamente a través de su unión covalente a una cadena de lípido (a una cadena de ácido graso o a un grupo prenil) de la monocapa citosólica (6) a través de una unión mediante un oligosacárido, a un fosfatidilinositol de la monocapa no citosólica. Proteínas periféricas (7) y (8) unidas a través de interacciones no covalentes con otras proteínas de membrana 32 Las proteínas que están unidas directamente a la membrana -ya sean transmembrana o unidas a lípidos− solamente se pueden disociar de las membranas rompiendo la bicapa lipídica con detergentes, como se discute más adelante. Estas proteínas se conocen como proteínas integrales de membrana. Al resto de proteínas se las conoce como proteínas periféricas de membrana; éstas pueden ser liberadas de la membrana mediante procedimientos de extracción relativamente suaves que interfieren con las interacciones proteicas pero que mantienen intacta la bicapa lipídica. Una cadena polipeptídica habitualmente cruza la bicapa mediante una conformación de hélice α Las zonas de una proteína transmembrana que se localizan fuera de la bicapa lipídica están conectadas unas con otras mediante segmentos especializados de la cadena polipeptídica que atraviesan la membrana. Estos segmentos, que atraviesan el ambiente hidrofóbico del interior de la bicapa lipídica, están formados principalmente por aminoácidos cuyas cadenas laterales son hidrofóbicas. Debido a que estas cadenas laterales no pueden interaccionar con las moléculas de agua, prefieren el ambiente lipídico, en el que no hay agua. Sin embargo, al contrario que las cadenas laterales hidrofóbicas, los enlaces peptídicos que unen los aminoácidos sucesivos de una proteína normalmente son polares, lo cual determina que el esqueleto polipeptídico sea hidrofilico (Figura 11− 23). Debido a que en la bicapa no hay agua, todos los enlaces peptídicos de la zona de la cadena que atraviesa la bicapa tienden a formar enlaces de hidrógeno entre ellos. Este tipo de uniones se hace máximo si la cadena polipeptídica que cruza la bicapa forma una hélice α regular; se cree que la mayoría de los segmentos de las cadenas polipeptídicas que atraviesan la membrana se hallan en esta conformación. En este tipo de hélice α, los aminoácidos hidrofóbicos de las cadenas laterales están expuestos al exterior de la hélice, donde entran en contacto con las colas hidrofóbicas de los lípidos, mientras que las distintas partes de] esqueleto polipeptídico forman enlaces de hidrógeno entre sí en el interior de la hélice (Figura 11−24). 33 Figura 11.23 Enlaces peptídicos Los enlaces peptídicos (sombreados en gris) que unen loa aminoácidos adyacentes en una cadena polipeptídica son polares y pt lo tanto hidrofilitos δ- indica una carga parcial negativa y δ+ indica una carga parcial positiva. Figura 11.24 Un fragmento de una hélice que atraviesa una bicapa lipídica Las cadenas laterales hidrofóbicas de los aminoácidos que forman las hélices α entran en contacto con las colas hidrofóbicas hidrocarbonadas de las moléculas de fosfolípido, mientras que las zonas hidrofílicas del esqueleto polipeptídico forman enlaces de hidrógeno entre ellas, por el interior de la hélice. Se necesitan aproximadamente 20 aminoácidos para atravesar la membrana de esta forma. 34 La cadena polipeptídica de muchas proteínas transmembrana cruza la membrana una sola vez (véase Figura 11-22A). Muchas de estas proteínas son receptores de señales extracelulares; su extremo extracelular se une a la molécula señalizadora, mientras que su porción citoplasmática transmite la señal hacia el interior celular (véase Figura 11−21). Otras proteínas transmembrana forman poros acuosos que permiten el paso a través de la membrana de moléculas solubles en agua. Estos poros no los pueden formar las proteínas que tienen una sola hélice α transmembrana, uniformemente hidrofóbica. Son necesarias proteínas transmembrana mucho más complejas, en las que la que la cadena polipeptídica cruza la bicapa varias veces, como hélice α o como un “barril cerrado” (denominado barril β ) (véase Figura 11−22A). Muchas de estas proteínas tienen una o más regiones transmembrana formadas a partir de hélices α que contienen aminoácidos con cadenas laterales hidrofilicas y con cadenas laterales hidrofóbicas. Las cadenas laterales hidrofóbicas yacen en un lado de la hélice, expuestas a los lípidos de la membrana. Las cadenas laterales hidrofílicas están concentradas en el otro lado, donde forman parte de un poro hidrofílico creado mediante el empaquetamiento de distintas hélices que forman un tubo dentro del ambiente hidrofóbico de la bicapa lipídica (Figura 11−25). En el Capítulo 12 se discute cómo actúan estos poros en el transporte selectivo de pequeñas moléculas solubles en el agua, Figura 11.25 Formación de un poro hidrofílico transmembrana mediante varias hélices En este ejemplo, cinco hélices α transmembrana forman un canal relleno de agua a través de la bicapa lipídica. Las cadenas laterales de aminoácidos hidrófobicos (verde) en uno de los lados de cada hélice entran en contacto con las colas hidrocarbonadas hidrofóbicas, mientras que las cadena laterales hidrofílicas (rojo) en el lado opuesto de las hélices forman el poro relleno de agua. 35 Sin lugar a dudas, la hélice α es la forma más común mediante la cual una cadena polipeptídica cruza la bicapa lipídica, pero algunas proteínas transmembrana pueden cruzarla en estructura de lámina β (discutido en el capítulo 5), curvada formando un cilindro en forma de barril que se abre y cierra, llamado barril β. Como era de esperar, las cadenas laterales de los aminoácidos que están en contacto con el interior del barril, y por lo tanto forman un canal acuoso, son principalmente hidrofilicas, mientras que las cadenas laterales hidrofóbicas están en el exterior, en contacto con el núcleo hidrofóbico de la bicapa lipídica. El ejemplo más representativo de este tipo de proteínas transmembrana son las proteínas llamadas porinas, que forman grandes poros llenos de agua a través de la membrana externa de las mitocondrias y de algunas bacterias, permitiendo el paso de nutrientes y pequeños iones, pero que impiden la entrada de antibióticos y toxinas. A diferencia de las hélices α, los barriles β solamente pueden formar canales anchos, puesto que existe un límite en la forma en que la lámina β puede curvarse para formar el barril (Figura 11-26). Desde este punto de vista, una lámina β es menos versátil que un conjunto de hélices α. Figura 11.26 Estructura tridimensional de una porina de la membrana externa de una bacteria (Rhodoabacter capsulatus) determinada por cristalografía de rayos X La proteína forma una lámina β de 16 cadenas, que se curva sobre si misma formando un canal transmembrana lleno de agua. Aunque no se muestra en la figura, las porinas se asocian de tres en tres formando trímeros, con tres canales independientes (Adaptado de S.W. Cowan, Curr. Opin Struct. Biol.. 3:501-507, 1993) 36 Las proteínas de membrana se pueden solubilizar purificar mediante detergentes Para comprender totalmente una proteína es necesario conocer con todo detalle su estructura, lo cual no es fácil en el caso de las proteínas de membrana. La mayoría de procedimientos bioquímicos han sido diseñados para trabajar con moléculas disueltas en agua o en disolventes sencillos; sin embargo, las proteínas de membrana están diseñadas para trabajar en un ambiente que es parcialmente acuoso y parcialmente lipídico: sacarlas de este ambiente y purificarlas manteniendo su estructura, es un trabajo arduo. Para estudiar detalladamente una proteína determinada es necesario separarla del resto de proteínas. Para la mayoría de proteínas de membrana esta primera etapa del proceso de aislamiento implica la solubilización de la membrana con agentes que destruyen la bicapa lipídica y rompen las asociaciones hidrofóbicas. Para ello los más útiles son los detergentes, moléculas parecidas a lípidos, anfipáticas y pequeñas, con regiones hidrofilicas y regiones hidrofóbicas (véase Figura 11−27). Los detergentes se diferencian de los fosfolípidos de membrana en que disponen de una sola cola hidrofóbica y, por tanto, se comportan de un modo significativamente distinto. Debido a su cola hidrofóbica sencilla, las moléculas de detergente adoptan formas más parecidas a los conos que a los cilindros y en el agua tienden a agregarse en pequeños grupos llamados micelas, en lugar de formar bicapas más cilíndricas, como los fosfolípidos. Al mezclarlos en exceso con las membranas, los extremos hidrofóbicos de las moléculas de detergente se unen a las regiones hidrofóbicas de la zona externa de las proteínas transmembrana, y también a las colas hidrofóbicas de las moléculas de fosfolípido, separándolos de las proteínas. Puesto que el otro extremo de la molécula de detergente es hidrofílico, la unión tiende a disolver las proteínas de membrana en la solución en forma de complejos detergente-proteína (Figura 11−28). Al mismo tiempo, el detergente solubiliza los fosfolípidos. L o s complejos proteína−detergente pueden separarse unos de otros y de los complejos lípido−detergente mediante electroforesis en gel de poliacrilamida con SDS (véase Capítulo 5). 37 Figura 11−27 Estructura de dos detergentes utilizados habitualmente El dodecil sulfato sódico (SDS) es un detergente iónico fuerte (es decir, que tiene un grupo ionizado en su extremo hidrofílico), y el Tritón X- 100, es un detergente no iónico suave (es decir, tiene una estructura no ionizada pero polar en su extremo hidrofílico). La porción hidrofóbica de cada detergente se muestra en verde, y la porción hidrofílica en rojo. Obsérvese que la zona marcada entre corchetes del Tritón X-100 se repite unas ocho veces. Los detergentes iónicos fuertes como el SDS, no sólo desplazan las moléculas lipídicas de las proteínas sino que también producen un desplegamiento de estas proteínas. (Véase Panel 5-5, pp. 164-165). 38 Figura 11−28 Utilización de detergentes suaves como el Tritón X−100 para solubilizar proteínas de membrana El detergente rompe la bicapa lipídica e incorpora la proteína a la solución en forma de complejos proteína−detergente. Los fosfolípidos de la membrana también se solubilizan por acción del detergente. Como se ilustra en la figura, las moléculas de detergente tienen forma de cono y tienden a agregarse formando grupos llamados micelas 39 Se conoce la estructura completa de muy pocas proteínas de membrana Mucho de lo que sabemos acerca de la estructura de las proteínas de membrana lo hemos aprendido a través de medidas indirectas. El método directo estándar para determinar la estructura proteica se basa en la cristalografía de rayos X (se discute en el Capítulo 5), pero requiere que la molécula a estudiar adopte una disposición cristalina ordenada, y es muy difícil lograr que las proteínas transmembrana cristalicen. Sin embargo, hay dos excepciones notables, la bacteriorrodopsina y el centro de reacción fotosintético; ambas son proteínas de membrana bacterianas que desempeñan un papel primordial en la captación y utilización de la energía procedente de la luz solar. La estructura de estas dos proteínas ha revelado exactamente de qué forma las hélices α cruzan la bicapa lipídica, y también cómo pueden ensamblarse distintos tipos de moléculas proteicas formando complejos funcionales en una membrana. La estructura de la bacteriorrodopsina se muestra en la Figura 11−29. Esta pequeña proteína (de unos 250 aminoácidos) se encuentra en grandes cantidades en la membrana plasmática de la arqueobacteria Halobacterium halobium, en los pantanos salinos. La bacteriorrodopsina actúa como una proteína transportadora que bombea H+ hacia el exterior de la bacteria. Este bombeo necesita energía, y la bacteriorrodopsina capta directamente la energía de la luz solar. Cada molécula de bacteriorrodopsina contiene una molécula no proteica − llamada retinal − que absorbe la luz y que le da a la proteína (y a la bacteria) su característico color púrpura. Esta pequeña molécula hidrofóbica está unida covalentemente a una de las siete hélices α transmembrana de la bacteriorrodopsina, y está situada en el plano de la bicapa lipídica, completamente envuelta por estas siete hélices α (véase Figura 11−29). Cuando el retinal absorbe un fotón de luz, cambia de forma provocando una serie de pequeños cambios conformacionales en la proteína situada en la bicapa lipídica. Estos cambios dan lugar a la transferencia de un H+ desde el retinal hasta el exterior de la bacteria: el H+ se desplaza a través de la bicapa a lo largo de una vía de cadenas laterales de aminoácidos polares colocados estratégicamente (véase Figura 11−29). Entonces, el retinal se regenera captando un H+ del citosol y la proteína recupera su conformación original, con lo cual el ciclo puede reiniciarse. El resultado de todo este proceso es la transferencia de un H+ hacia el exterior de la bacteria, lo que disminuye 40 la concentración de H+ en el interior de la célula. En presencia de luz brillante, miles de moléculas de bacteriorrodopsina bombean H+ hacia el exterior celular, generando un gradiente de concentración de H+ a través de la membrana bacteriana. Este gradiente de H+ actúa como almacén de energía, como el agua en una presa: tal como el agua de una presa puede ser utilizada para generar energía cuando fluye cuesta abajo a través de una turbina, este gradiente de H+ puede ser utilizado para generar ATP cuando los H+ regresan hacia el interior de la bacteria a través de una segunda proteína de membrana, llamada ATP sintasa. Este mismo tipo de ATP sintasa es el que genera la mayor parte del ATP en las células de las plantas y de los animales, tal y como se discute en el Capítulo 13. Figura 11−29 Estructura tridimensional de la molécula de bacteriorrodopsina La cadena polipeptídica atraviesa la bicapa de forma de siete hélicesα. Se muestra la localización del retinal y el camino probables que siguen los protones durante el ciclo de bombeo activado por la luz; se cree que en el proceso de transferencia de H+ intervienen dos cadenas laterales de aminoácidos polares, los cuales se muestran en negro en la figura. Nuestros ojos también utilizan el retinal para detectar la luz, y en ellos el retinal también está unido a una proteína que tiene una estructura muy parecida a la de la bacteriorrodopsina. 41 La estructura del centro de reacción fotosintético bacteriano se muestra en la Figura 11−30. Se trata de un gran complejo proteico formado por cuatro moléculas. Tres de ellas son proteínas transmembrana; dos (M y L) tienen múltiples hélices α que atraviesan la bicapa lipídica, mientras que la tercera (H) tiene una sola hélice α. La cuarta proteína (el citocromo) está asociada con la superficie externa de la membrana, unida a otras proteínas transmembrana. En conjunto, el complejo proteico actúa como una máquina proteica, captando la energía de la luz absorbida por las moléculas de clorofila y produciendo electrones de alta energía necesarios para las reacciones fotosintéticas (véase Capítulo 13). Muchas proteínas de membrana se distribuyen en grandes complejos; la estructura del centro de reacción fotosintético es el mejor modelo del que disponemos para otros miles de proteínas de membrana cuyas estructuras desconocemos. Figura 11−30 Estructura tridimensional del centro de reacción fotosintético de la bacteria Rhodopseudomonas viridis La estructura se determinó mediante análisis de difracción de rayos X de cristales de este complejo proteico transmembrana. El complejo está formado por subunidades L, H, M y el citocromo. Las subunidades L y M forman el núcleo del centro de reacción y cada una de ellas tiene cinco hélices α que atraviesan la bicapa lipídica. Las hélices α se han dibujado en forma de cilindro. En negro se muestra la localización de varios grupos transportadores de electrones, unidos covalentemente a las subunidades proteicas, excepto el par especial de moléculas de clorofila que son excitadas por la luz, que se muestran como rectángulos verde oscuro en el centro del dibujo. Obsérvese cómo el citocromo está unido a la superficie externa de la membrana solamente a través de su unión a las subunidades transmembrana (Véase Figura 11−22C) 42 La membrana plasmática está reforzada por el córtex celular Una membrana celular por sí misma es extremadamente delgada y frágil. Se necesitarían aproximadamente 10.000 membranas celulares colocadas unas encima de otras para conseguir el grosor de esta hoja de papel. Por ello, la mayoría de las membranas celulares están reforzadas por un esqueleto proteico, unido a la membrana mediante proteínas transmembrana. En particular, la forma de la célula y las propiedades mecánicas de la membrana plasmática están determinadas por una red de proteínas fibrosas, llamada córtex celular, que se halla unida a la superficie citosólica de la membrana. El córtex celular de los glóbulos rojos sanguíneos humanos es una estructura relativamente sencilla y regular, con diferencia la mejor comprendida. Estas células son de pequeño tamaño y presentan una forma bicóncava característica (Figura 11−31). Figura 11−31 Electrónmicrografia de barrido de eritrocitos humanos Las células tienen forma bicóncava característica y carecen de núcleo y de otros orgánulos 43 El principal componente del córtex del eritrocito es la proteína espectrina, una varilla larga, delgada y flexible de aproximadamente 100nm de longitud. Forma una red que proporciona el soporte para la membrana plasmática y que mantiene la forma de la célula. La red de espectrina está conectada a la membrana mediante proteínas intracelulares de unión que unen la espectrina a proteínas transmembrana específicas (Figura 11−32). La importancia de esta red se pone de manifiesto en ratones y en humanos que presentan anomalías genéticas en la estructura de la espectrina. Estos individuos son anémicos: disponen de una menor cantidad de eritrocitos y las células son esféricas en vez de ser bicóncavas, y extraordinariamente frágiles. Figura 11-32 El córtex celular basado en la espectrina del eritrocito humano. A) Moléculas de espectrina (junto a un número reducido de moléculas de actina) forman una red que se une a la membrana plasmática mediante la unión de al menos dos tipos de proteínas (se muestran en azul y en amarillo) a dos especies de proteínas transmembrana (mostradas en marrón y en verde). La electrómicrografía de (B) muestra la red de espectrina de la cara citoplasmática del eritrocito. La red de espectrina se ha dibujado estirada para que se puedan observar los detalles de su estructura; en la célula normal, la trama mostrada debe ocupar únicamente una décima parte de esta área. (B, por cortesía de T. Byers y D. Branton, Proc. Natl. Acad Sci. USA 82:6153-6157,1985.) 44 En el córtex de la mayoría de nuestras células se encuentran proteínas semejantes a la espectrina y a sus proteínas de unión asociadas, pero este córtex es mucho más complejo que el de los eritrocitos. Mientras que los glóbulos rojos necesitan el córtex principalmente para que les proporcione sustento mecánico mientras son impulsados a través de los vasos sanguíneos, otras células también necesitan el córtex para poder cambiar de forma activamente y moverse, tal y como se discute en el Capítulo 16. La superficie celular está recubierta de carbohidratos Ya hemos visto cómo muchos de los lípidos de la capa externa de la membrana plasmática de las células eucariotas tienen azúcares unidos de manera covalente. Esto también es válido para la mayoría de proteínas de la membrana plasmática. La gran mayoría de estas proteínas tienen unidas cadenas cortas de azúcares, llamados oligosacáridos; estas proteínas se denominan glucoproteínas. Otras proteínas de membrana están unidas a una o más cadenas largas de polisacáridos; son los llamados proteoglucanos. Todos los hidratos de carbono de las glucoproteínas, de los proteoglucanos y de los glucolípidos se encuentran en una de las caras de la membrana, el lado no citosólico, donde forman una cubierta de azúcares llamada glucocáliz (Figura 11−33 A y B). A 45 B Figura 11−33 (A) Diagrama simplificado de la cubierta celular o glucocáliz La cubierta celular o glucocáliz está formada por las cadenas laterales de oligosacáridos de los glucolípidos y las glucoproteínas integrales de membrana y por cadenas de polisacáridos de proteoglucanos integrales de membrana. Las glicoproteínas y los proteoglicanos que han sido secretados por la célula y adsorbidos de nuevo sobre su superficie, también pueden contribuir a formar el glucocáliz. Se observa que todos los carbohidratos se hallan en la superficie extracelular (no citosólica) de la membrana plasmática. (B) Electrónmicrografía de la superficie de un linfocito contrastado con rojo de rutenio para mostrar la cubierta celular El glucocáliz ayuda a proteger la superficie celular de las lesiones mecánicas y químicas. Puesto que los oligosacáridos y los polisacáridos del glucocáliz absorben agua, confieren a la célula una superficie viscosa. Esto ayuda a las células móviles, como por ejemplo los glóbulos blancos, a que se deslicen a través de superficies estrechas, e impide que las células 46 sanguíneas se adhieran unas a otras o a las paredes de los vasos sanguíneos. Sin embargo, los carbohidratos de la superficie celular hacen mucho más que proteger y lubricar la célula. Juegan un papel muy importante en el reconocimiento célula-célula y en la adhesión celular. De la misma forma que muchas proteínas reconocen y se unen a un lugar determinado de otra proteína, algunas proteínas (llamadas lectinas) están especializadas en reconocer determinadas cadenas de oligosacárido y unirse a ellas. Las cadenas laterales de oligosacárido de las glucoproteínas y de los glucolípidos, aunque cortas (habitualmente menos de 15 residuos de azúcar), son extremadamente diversas. A diferencia de las cadenas polipeptídicas (proteínas), en las que los aminoácidos están unidos de forma lineal y mediante enlaces peptídicos idénticos (véase Figura 11−23), los azúcares pueden estar unidos de distintas formas y en secuencias muy variadas, a menudo formando cadenas ramificadas de oligosacáridos (véase Panel 2-3, pp. 56-57). Solamente con tres grupos de azúcar agrupados mediante distintas combinaciones de uniones covalentes se pueden formar cientos de trisacáridos distintos. En un organismo pluricelular, el glucocáliz puede considerarse como un tipo de vestido diferencial, como el uniforme de un policía, que es característico de una célula especializada en una función particular y es reconocido por otras células que han de interactuar con ella. Por ejemplo, determinados oligosacáridos del glucocáliz intervienen en el reconocimiento de un óvulo por el espermatozoide. También participan en procesos inflamatorios. Por ejemplo, en las primeras etapas de una infección bacteriana, los carbohidratos de la superficie de los glóbulos blancos llamados neutrófilos son reconocidos por una lectina de las células de los vasos sanguíneos donde se ha producido la infección. Este reconocimiento determina que los neutrófilos se adhieran a los vasos sanguíneos y migren desde la sangre hasta los tejidos infectados donde contribuirán en la eliminación de las bacterias (Figura 11−34). 47 Figura 11−34 El reconocimiento de carbohidratos de la superficie celular es la primera etapa de la migración de los neutrófilos desde la sangre hacia los lugares de infección Como respuesta a determinadas señales químicas enviadas desde los lugares de infección, las células que forman los vasos sanguíneos (llamadas células endoteliales) sintetizan proteínas transmembrana (llamadas lectinas). Estas proteínas reconocen residuos específicos de azúcares transportados por los glucolípidos y las glicoproteínas de la superficie de los neutrófilos circulantes de la sangre. Como consecuencia de este reconocimiento, los neutrófilos se fijan a la pared de los vasos sanguíneos. Esta asociación no es muy fuerte, pero conduce a otra interacción proteína−proteína mucho más fuerte (no mostrada en la figura) que ayuda al neutrófilo a migrar fuera de la sangre atravesando las células endoteliales hacia el tejido infectado. 48 Las células pueden restringir el desplazamiento de las proteínas de membrana La membrana es un fluido bidimensional, por lo que muchas de sus proteínas, al igual que sus lípidos, pueden moverse libremente dentro del plano de la bicapa lipídica. Esto se puede demostrar fácilmente fusionando una célula de ratón con una célula humana, formando una célula híbrida, y siguiendo la distribución de las proteínas humanas y de ratón de la membrana plasmática. Inicialmente, las proteínas humanas y de ratón se mantienen confinadas en sus propias mitades de la célula híbrida formada, pero al cabo de media hora aproximadamente los dos tipos de proteínas se han mezclado en toda la superficie celular (Figura 11−35). Figura 11−35 Experimento que demuestra que en células híbridas ratón−humana las proteínas de membrana se mezclan Inicialmente las proteínas de ratón y las humanas están confinadas a sus propias mitades de la membrana plasmática de la célula híbrida recién formada, pero se van mezclando en un corto período de tiempo. Para detectar las proteínas, dos anticuerpos que se unen respectivamente a las proteínas humanas y a las de ratón se han marcado con moléculas fluorescentes distintas y se han añadido a las células. Los dos anticuerpos Sinfluorescentes embargo, el de una membrana como un mar dedado lípidos el que lasesproteínas se esquema pueden distinguir en un microscopio de fluorescencia, que en la fluoresceína verde y la flotan libremente rodamina es roja. es demasiado sencillo. Las células disponen de diferentes sistemas para 49 confinar determinadas proteínas de membrana en áreas localizadas de la bicapa, dando lugar de este modo a regiones especializadas funcionalmente, o dominios de membrana, en la superficie de la célula o de un orgánulo. Algunos de estos sistemas de restringir el desplazamiento de las proteínas de membrana se resumen en la Figura 11-36. Figura 11−36 Cuatro sistemas mediante los cuales se puede restringir la movilidad lateral de determinadas proteínas de membrana plasmática Las proteínas por interacción con agregados macromoleculares de membrana pueden estar trabadas del interior (A) o del exterior (B) de la célula, o pueden interactuar con proteínas de la superficie de otra célula (C). Finalmente, las barreras de difusión (se muestran en forma de barras negras) pueden restringir las proteínas en un dominio de membrana particular (D) Las proteínas pueden unirse a estructuras fijas del exterior celular − por ejemplo, a moléculas de la matriz extracelular (se discute en el Capítulo 19). Las proteínas de membrana también pueden anclarse a estructuras relativamente inmóviles del interior de la célula, especialmente del córtex celular (véase Figura 11−32). Por último, las células pueden crear barreras que restrinjan el desplazamiento de determinados componentes de la membrana a un dominio de membrana. Por ejemplo, en las células epiteliales del intestino es importante que las proteínas transportadoras que intervienen en el transporte de nutrientes en el intestino se encuentren en la cara apical de la célula (la superficie que limita con el contenido intestinal) y que el resto de proteínas que intervienen en el transporte de solutos desde la célula epitelial hacia los tejidos y a la sangre se encuentren en las caras basal y lateral de la célula (Figura 11−37). 50 Esta distribución asimétrica de las proteínas de membrana se mantiene debido a la barrera formada por la línea a lo largo de la cual se unen las células epiteliales adyacentes mediante un tipo específico de uniones intercelulares llamadas uniones estrechas o estancas. En este lugar, proteínas de unión especializadas forman un cinturón continuo alrededor de la célula donde entra en contacto con las células vecinas y sellan el espacio entre las membranas celulares adyacentes. Las proteínas de membrana no pueden difundir a través de tales uniones. En el próximo capítulo, examinaremos las funciones particulares de las -moléculas proteicas que se encuentran en la superficie transportando moléculas hacia el interior y hacia el exterior de la célula. Figura 11−37 Esquema de una célula epitelial en el que se muestra como una proteína de membrana plasmática se halla confinada en un dominio particular de membrana La proteína A (en la zona apical de la membrana) y la proteína B (en la zona basolateral) pueden difundir lateralmente en sus dominios de membrana respectivos pero no pueden entrar en el otro dominio, en parte debido a una unión celular especial denominada unión estrecha o estanca) Tomado y modificado de ALBERTS B. – BRAY D. – JOHNSON A. – LEWIS J. – RAFF M. – ROBERTS K. – WATSON J.: Introducción a la Biología Celular 1ª edición, 1999 51