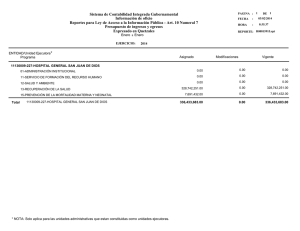
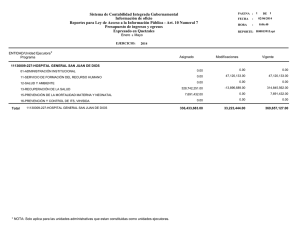
Convulsiones neonatales - Revista Pediatría Electrónica
Anuncio
 0
0
Anuncio