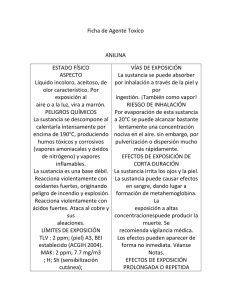
Sustancia Pura - Miguel Hadzich
Anuncio

Termodinámica para ingenieros PUCP
Cap. 6
Sustancia Pura
INTRODUCCIÓN
Estamos entrando al mundo virtual de la información, es una etapa de transición para nuestra
Termodinámica clásica, pues dentro de poco dejaremos nuestras antiguas Tablas de Vapor que
nos acompañaron año tras año para entrar en el mundo de los softwares y del internet. Basta buscar “Software de Termodinámica” con algún buscador de la web y nos daremos con la sorpresa
que te ofrecen estas herramientas de cálculo de manera gratuita y sencilla, pues lo consigues
bajándotela del internet en cuestión de minutos.
Lo que nunca podremos dejar es la aplicación de nuestros conocimientos en los problemas que
nos encontremos en nuestra vida diaria y en la industria, por lo que es importante saber las
propiedades de las sustancias dentro de las que nos desenvolvemos (agua, aire, refrigerantes,
etc) y conocer también las fases y estados en las que se encuentran en cualquier momento y
en cualquier situación, por ejemplo cuando modifiquemos alguna de sus propiedades, como la
temperatura o presión.
Este capítulo es la base para todo el curso pues debemos conocer el estado real que se encuentra
cualquier sustancia y en cualquier condición, si aquí fallamos, fallaremos en todos los cálculos
y los resultados nos parecerán sorprendentes e inverosímiles.
A trabajar a la antigua (Uso de Tablas de Vapor) y a la moderna (Uso de software). Suerte.
Al finalizar este capítulo ya
podremos conocer todas las
propiedades y estados de
las sustancias. Trabajaremos con Tablas y Software.
Al finalizar este capítulo ya
podremos conocer todas las
propiedades y estados de
las sustancias. Trabajaremos con Tablas y Software.
Sustancia Pura 6 - Pág. 1
Termodinámica para ingenieros PUCP
Sustancia Pura
Superficie P-v-T
SUSTANCIA PURA
Es aquella que tiene una composición química homogénea e invariable que puede existir en mas de una
fase. Por ejemplo: el agua, una mezcla de hielo y agua; son sustancias puras porque para cada fase tienen
la misma composición.
En cambio el agua de mar no es sustancia pura porque al producirse la evaporación, el vapor tendría una
composición química diferente a la de la fase líquida. Otro ejemplo de sustancia no pura es el aire porque
la composición del aire líquido difiere de la fase gaseosa.
6.1 SUPERFICIES TERMODINÁMICAS (Diagrama P- v - T)
Los estados de equilibrio de una fase de una sustancia pura vienen dados por una ecuación de estados:
f(P, T, v); la cual puede ser representada por una superficie de la siguiente forma:
Yo vivo dentro de este terreno,
no puedo volar ni excavar
dentro de el.
Zonas que se distinguen:
Nombre de los límites:
1. Zona de mezcla o vapor húmedo
2. Zona de fusión
3. Zona de sublimación
1.
2.
3.
4.
5.
6.
A presiones bajas y a temperaturas bajas, las sustancias
tienden a pasar de la fase sólida a la fase gaseosa, sin
antes haberse licuado. Este proceso se llama sublimación.
Sustancia Pura 6 - Pág. 2
Línea de líquido saturado
Línea de vapor saturado
Línea de fusión
Línea de solidificación
Línea de sublimación
Línea triple
Sustancia Pura 6 - Pág. 3
Termodinámica para ingenieros PUCP
Sustancia Pura
Cada sustancia tiene diferentes
valores de sus puntos triples y
puntos criticos
SUPERFICIE P - v
T para la mayoría de
las sustancias
Las que se contraen al
enfriarse
La mayoria de las sustancias
se comportan de esta forma.
12
MMM...!!
La región
que dice
FLUIDO es
una región
inestable
SUPERFICIE P - v T
para el H2O
Las que se expanden
al enfriarse
Cuál sería el
camino cuando
una botella
se enfria en el
freezer ?
Punto Crítico: (PC)
Por eso se rompen
las botellas de vidrio en el freezer
12
Sustancia Pura 6 - Pág. 4
Es el estado donde las fases
líquida y gaseosa se confunden.
Este punto varía dependiendo de
la sustancia tratada y se define
por: la presión crítica (Pc), la
temperatura crítica (Tc), etc.
En los procesos que se llevan a
cabo a esta Pc y Tc, no se puede
establecer un cambio de fase
líquido a vapor y no pasan por
un estado de equilibrio.
Punto Triple: (PT)
Es una propiedad característica
de las sustancias, en el cual
coexisten las tres fases, es decir
coexisten los estados sólido
líquido y gaseoso.
Sustancia Pura 6 - Pág. 5
Termodinámica para ingenieros PUCP
Sustancia Pura
6.2 Cambios de Fase y Estados Importantes
Supongamos un recipiente cilíndrico, con un pistón móvil sin fricción, que contiene agua.
Se le aplica calor hasta vaporizar completamente, la presión es constante (isobárico), y está en equilibrio en cada momento.
Se muestran los siguientes estados del proceso:
Propiedades de un vapor húmedo
6.3 Calidad de Vapor (x) ó Título
Para determinar el estado (1) ó (2) basta definir o
comparar dos propiedades. Por ejemplo: P,T.
m = mg + mf
Subíndice g (gas): propiedad de vapor saturado.
Subíndice f (fluido): propiedad de líquido saturado.
Para fijar un estado de una sustancia pura es
necesario conocer por lo menos dos propiedades intensivas o específicas independientes.
En la zona de mezcla, es decir donde están
en equilibrio, la fase líquida y gaseosa. La
presión y la temperatura dejan de ser variables independientes y se requiere de otra
propiedad para definir el estado (3).
Para esto se define una propiedad nueva,
llamada calidad e vapor o título de vapor (x)
El término Temperatura de Saturación
designa la temperatura a la cual se efectúa
la evaporación a una presión dada, y esta
presión se denomina Presión de Saturación.
Las condiciones de presión y temperatura
en que dos fases coexisten en equilibrio se
denominan las condiciones de saturación.
La temperatura de saturación depende de la
presión, a mayor presión mayor es la temperatura de saturación y viceversa.
Se usa el x porque se puede medir en un Calorímetro
de Estrangulamiento
Cómo harías tú para
medir la calidad ?
donde:
Ubique los puntos 1 ,2,3,4 y 5 en el T-v.
( 1 ) Líquido comprimido o sub enfriado:(LC o LSE)
Es aquel que tiene una temperatura menor que la de saturación a una presión dada.
( 2 ) Líquido Saturado: (LS)
Es cuando un estado es tal que empieza a cambiar de fase líquida a fase gaseosa, es decir se inicia la evaporación.
Es aquel que se encuentra a la temperatura de saturación correspondiente a su presión.
Todos estos estados constituyen la línea de líquido saturado.
( 3 ) Vapor Húmedo o mezcla líquido-vapor: (VH)
Es aquel que contiene líquido más vapor en equilibrio
( 4 ) Vapor Saturado:(VS)
Es cuando un estado es tal que el vapor comienza a cambiar de fase gaseosa a fase líquida (condensación).
Como por ejemplo la lluvia o la formación de escarcha. Estos estados forman la línea de vapor saturado.
( 5 ) Vapor Sobrecalentado: (VSC)
Es aquel que tiene una temperatura mayor que la de saturación pero a una presión dada
Sustancia Pura 6 - Pág. 6
Cómo mide el
Calorímetro ?
Sustancia Pura 6 - Pág. 7
Termodinámica para ingenieros PUCP
Sustancia Pura
Constante Críticas - Valores del Punto Crítico
La calidad solo sirve cuando trabajamos
dentro de la campana
Si un depósito
esta lleno
la mitad de
líquido y
mitad vapor,
entonces la
calidad será 50
%?
Todas las
formulas son similares, solo
cambian las propiedades.
Esta Tabla siempre tiene que ser DATO
Cuáles de las sustancias usarías para refrigerar ?
Los valores de vf y vg, se determinan experimentalmente y se encuentran en tablas de vapor o diagramas
para cada sustancia.
NOTA: En la zona de mezcla vf y vg son constantes para cada valor de P ó T. Lo que varían son las masas
de cada fase.
Sustancia Pura 6 - Pág. 8
En qué estado se encontraría el _____________ para las condiciones del salón ?
Sustancia Pura 6 - Pág. 9
Termodinámica para ingenieros PUCP
Sustancia Pura
Qué puede estar mal en estas historietaS ?
6.4 Uso de Tablas de Vapor
Como se ha visto para definir los estados termodinámicos de equilibrio, es necesario conocer dos o más
magnitudes de estado (presión, temperatura, volumen). Estas propiedades son diferentes para cada sustancia. Centros de investigación han obtenido experimentalmente la magnitud de ellas y las han tabulado.
Estudiaremos el caso del agua, por las siguientes razones:
1. El comportamiento es análogo en sustancias puras
2. Las tablas son similares en cuanto la forma de presentar los datos
3. La importancia del agua en los procesos térmicos
Diferentes tipos de Tablas:
1.
12
Tablas
de Van
Wylen
Tablas de Vapor Saturado: ( Tabla A.1.1 o Tabla A.1.2)
Dadas la presión o temperatura de saturación, se pueden encontrar las propiedades de líquido y
vapor saturado.
Ejemplo:
Calcular T(°C) para P = 0.130 MPa.
0
0
0
Las 2 tablas son las mismas,
sólo es cuestión de escoger
con cuál de ellas es más fácil
trabajar...
107.06 ºC
107.06 ºC
Esta forma de interpolar se utiliza también si nos piden otras propiedades como: u, s, h, v.
Como la incógnita era la temperatura hemos utilizado la Tabla A.1.2,
si la incógnita hubiese sido la Presión hubiésemos usado la tabla A.1.2.
Sustancia Pura 6 - Pág. 10
Sustancia Pura 6 - Pág. 11
Termodinámica para ingenieros PUCP
Sustancia Pura
PROBLEMAS-SUSTANCIA PURA
1.
2. Tablas de Vapor Sobrecalentado: (Tabla A.1.3)
Indicar el nombre del estado correspondiente, si la sustancia es agua.
Para cada presión o temperatura y para diferentes temperaturas o presiones, están tabuladas las otras
propiedades.
Esto debido a que basta tener definida la P y T para definir el estado de la sustancia. En algunas tablas
no se tiene u o h como datos, en este caso se usa la fórmula:
Ejemplo: Hallar el volumen específico (v), entalpía (h) y entropía (s) que corresponde a:
a) P=10bar
T= 172.96°C
b) T=0°C
s=-1.221kJ/kg-K
A dicha presión la temperatura de saturación
Ts = 89.95°C. Luego a T = 400°C nos encontramos
en la zona de VSC.
Debemos interpolar en las tablas de VSC.
P= 22.09MPa
d) T=290°C
u= 1297.1kJ/kg
e) x=40%
T= 420°C
P= 75kPa
Sustancia Pura 6 - Pág. 12
_________________
_________________
i)
P= 313kPa
v= 0.6822m3/kg
_________________
j)
h= 2500.6kJ/kg
T= -10°C
_________________
T= 1000°C
u= 4045.4kJ/kg
n) P= 2MPa
s= 6.4309kJ/kg-K
_________________
_________________
h= 2512.8kJ/kg-K
s= 8.2808kJ/kg-K
_________________
_________________
T= 647.3K
P= 40MPa
_________________
h= 2700kJ/kg
m) x=0%
p) P= 1.6MPa
El uso de las tablas son similares a la anterior.
h= 2700kJ/kg
u= 2721.6kJ/kg
o)
3. Tablas de Líquido sub-enfriado o comprimido : (Tabla A.1.4)
_________________
h) T= -20°C
Interpolando, encontramos:
_________________
s= 2kJ/kg-K
l)
2.
_________________
g) P= 1.2544MPa
k) P= 80kPa
Tablas A.1.3
_________________
c) T=374.14°C
f)
P = 0.7 bar, T = 400°C
_________________
_________________
_________________
Determinar el valor de la propiedad indicada:
a)
Mercurio
P= 2.8MPa
hfg= 287.54kJ/kg
v= _____________
b)
Freón 12T= 60°C
h= 225.488kJ/kg
c)
Freón 12T= -50°C
v= 350dm3/kg
d)
Freón 12T= -30°C
s= 0.7165kJ/kg-K
x= _____________
e)
Freón 12T= 30°C
h= 209.16kJ/kg
s= _____________
f)
Freón 12P= 2.0872MPa
sf= 0.3851kJ/kg-K
vf= _____________
g)
Freón 12T= 100°C
h= 180kJ/kg
v= _____________
h)
Amoniaco
T= 30°C
P= 150kPa
h= _____________
i)
Amoniaco
P= 246.51kPa
j)
Amoniaco
k)
s= _____________
s= _____________
v= 0.4168m3/kg
T= _____________
T= 30°C
v= 1.68cm3/g
s= _____________
Amoniaco
T= 40°C
v= 1.2107m3/kg
l)
Amoniaco
P= 1800kPa
s= 4.9715kJ/kg-K
T= _____________
m)
Amoniaco
P= 190.22kPa
v= 0.2168m3/kg
T= _____________
h= _____________
Sustancia Pura 6 - Pág. 13
Termodinámica para ingenieros PUCP
Sustancia Pura
3.
n)
Oxígeno P= 0.54339MPa
o)
Oxígeno T= 225°C
p)
Oxígeno P= 8MPa
h= 204.007kJ/kg
v= 9.351 dm3/kg
6.
T= _____________
Completar el cuadro de datos si la sustancia es agua:
P= _____________
T= _____________
q)H2O
T= 124°C
v= 0.7933m3/kg
P=_____________
r)H2O
T= 260°C
u= 1470.6kJ/kg
P=_____________
s)H2O
P= 7MPa
T= 300°C
s=_____________
Determinar el valor de la propiedad indicada y el nombre del estado correspondiente, si la sustancia
es agua:
a) T= 172.96°C
P=10bar
h=_____________ ESTADO: ________
b) P= 200kPa
h=2706.7kJ/kg
v=_____________ ESTADO: ________
c) T= 250°C
s=3.2802kJ/kg-K u=_____________ ESTADO: ________
d) P= 1.6MPa
v=0.14184m3/kg T=_____________ESTADO: ________
e) P=30.6bar
u=1009.89kJ/kg h=_____________ ESTADO: ________
f) T=162°C
________
g) P=0.5MPa
4.
s= 3.2823kJ/kg-K
h=2500kJ/kg
v=_____________ E S T A D O :
s=9.4224kJ/kg-K u=_____________ ESTADO: ________
h) T=124°C
v=0.7933m3/kg
P=_____________ESTADO: ________
I) T=300°C
P=15bar
v=_____________ ESTADO: ________
j) P=10Mpa
T=120°C
h=_____________ ESTADO: ________
7.
Para el Nitrógeno: Determine el título de 22kg de mezcla bifásica líquido-vapor a 100K en un tanque de 0.5m3,
sabiendo que: vf= 1.452 10-3m3/kg y vg=31.31 10-3m3/kg
8.
Determine el volumen en m3, ocupado por 2kg de H2O a 4MPa y 420°C.
Determine los estados en que se encuentra el sistema constituido por agua y ubíquelos en los diagramas
P-v y T-v para las condiciones siguientes:
a) P=500kPa
T= 200°C
ESTADO: ___________
b) P=5Mpa
T=264°C
ESTADO: ___________
c) P=0.9MPa
T=180°C
ESTADO: ___________
d) P=20MPa
T=100°C
ESTADO: ___________
e) P=1kPa
T=-10°C
ESTADO: ___________
5.
Determine el título de las mezclas bifásicas siguientes (líquido-vapor)
a) H2O
T=200°C
v=0.1m3/kg
x= ____________
b) R12
P=2bar
v=0.7m3/kg
x= ____________
Sustancia Pura 6 - Pág. 14
Sustancia Pura 6 - Pág. 15
Termodinámica para ingenieros PUCP
Sustancia Pura
9.
Un recipiente cerrado de 0.018m3, contiene 1.2kg de Freón 12 a 10bar. Determine T,u,v,h,s,x.
11. Una mezcla líquido-vapor de agua tiene una temperatura de 300°C y un título de 75%. La mezcla ocupa un volumen
de 0.05m3. Determine las masas de liquido y vapor de agua presentes en kg.
12. Vapor de agua sobrecalentado se encuentra a 460°C y 1.25MPa. Hallar: v, h y u.
10. Calcúlese el volumen en m3, ocupados por 2kg de una mezcla líquido-vapor de Freón 12 a –10°C cuyo título es de
80%.
Sustancia Pura 6 - Pág. 16
Sustancia Pura 6 - Pág. 17
Termodinámica para ingenieros PUCP
Sustancia Pura
13. Vapor de agua sobrecalentado se encuentra a 260°C y 4.2MPa. Hallar: v, h y u.
15. El tanque rígido mostrado contiene inicialmente 100kg de líquido y vapor de agua en equilibrio a 200 bar, el vapor
ocupa el 80% del volumen del tanque y el líquido el 20% restante. Se extraen a través de la válvula A, 40kg de
vapor y al mismo tiempo, por la válvula B, se introducen 80kg de líquido. Si durante el proceso se ha mantenido
constante la temperatura dentro del tanque, mediante una adecuada transferencia de calor, se pide determinar:
a) La calidad inicial en %
b) El volumen del tanque en m3.
c) La masa del líquido en el estado final, en kg.
14. En un recipiente rígido y hermético se tiene vapor de agua a 5 bar y 40% de calidad, dicho proceso realiza un
proceso hasta que en el recipiente sólo exista vapor saturado. Se puede afirmar que la temperatura de la sustancia
permaneció constante durante el proceso? Estará el proceso bien dibujado en el diagrama ? Explique.
Observando la curva P -v (o la T-v), veremos que
el proceso se realiza dentro de la campana
El volumen total permanece constante (rígido)
entonces V = mv
V1 = m1 v1 = V2 =m2 v2
mf1 vf1 + mg1 vg1 = mf2 vf2 + mg2 vg2
mf2 = 0 (sólo queda vapor saturado) por lo que
m2 = mg2, calculamos vg2 = V2/m2, pero m2 = m1 , y
m1 es Vi//v1 y vi se calcula de la fórmula con la
calidad x1., etc, etc
v1 = 0.001093 + 0.4 x 0.373993 = 0.1507 m3/kg
O de forma m{as simple:V1 = V2 (rígido), y como
la masa total también se mantiene m1 = ma,
entonces
v1 = v2 =vg2 = 0.1507 m3/kg
Por lo tanto en el diagrama dibujado el punto
2 deber{a ser igual a v1, entoces ESTARA MAL
DIBUJADO !!!, de 1 a 2 deber{a ser una vertical
hasta que choque con la curva de vapor saturado.
Sustancia Pura 6 - Pág. 18
Sustancia Pura 6 - Pág. 19
Termodinámica para ingenieros PUCP
Sustancia Pura
16. En la figura mostrada el pistón es sin fricción y el resorte es perfectamente elástico cuya constante es de 306.35
kN /m. El agua se encuentra inicialmente a 110°C y 14.32% de calidad. Se transfiere calor al agua hasta que la
temperatura sea de 300°C. Si la masa de agua contenida en el recipiente es de 0.5kg, se pide:
a) La presión del agua en el estado final, en kPa.
b) La temperatura del agua en °C, en el instante en que el pistón alcance los topes.
c) La temperatura del agua en °C en el instante en que exista sólo vapor saturado
dentro del recipiente.
d)Graficar los procesos en el diagrama P-v
17. Un sistema consiste en dos kg de agua. Se realiza un ciclo compuesto por los siguientes procesos:
1-2:
expansión con Pv=cte; donde el vapor saturado está desde 10bar hasta 100bar.
2-3:
proceso a P=cte hasta que v1=v3
3-1:
calentamiento a volumen constante.
Represente el ciclo en los diagramas P-v y T-v.
18. Un recipiente rígido contiene agua, habiendo 12kg de líquido y 2kg de vapor, en equilibrio a 2MPa. Hallar el
volumen del recipiente.
Sustancia Pura 6 - Pág. 20
Sustancia Pura 6 - Pág. 21
Termodinámica para ingenieros PUCP
Sustancia Pura
19. Un tanque de paredes rígidas contiene 300kg de vapor y líquido de agua en equilibrio, a 280°C. En estas condiciones,
el líquido ocupa el 70% del volumen del tanque. Cual es el volumen del tanque en m3?
21. Un recipiente rígido de 5m3 contiene vapor y líquido de agua en equilibrio a 100kPa y 70% de calidad. Se enfría
el contenido del recipiente hasta –10°C. Determine el volumen ocupado por el vapor a –10°C.
20. Se tiene agua en su punto triple, las masas se encuentran en las siguientes proporciones: 40% líquido, 58% sólido
y 2% vapor. Calcule el volumen específico de la mezcla.
22. Se tiene un cilindro rígido cuya base tiene 0.2m2 de superficie. El cilindro contiene inicialmente líquido y vapor
Sustancia Pura 6 - Pág. 22
Sustancia Pura 6 - Pág. 23
Termodinámica para ingenieros PUCP
Sustancia Pura
22. Se tiene un cilindro rígido cuya base tiene 0.2m2 de superficie. El cilindro contiene inicialmente líquido y vapor de
agua en equilibrio a 360°C. Mediante una válvula colocada en la parte inferior del cilindro, se extrae líquido. Si
durante el proceso la temperatura se mantiene constante y el nivel del líquido en el interior del tanque desciende
0.3m. Calcular la masa del líquido extraído en kg.
Sustancia Pura 6 - Pág. 24
23. 5kg de vapor saturado de agua a 400kPa son expandidos hasta una presión de 75kPa, de tal modo que su volumen
final es 1.2 veces su volumen inicial. Determine la masa de vapor que se ha condensado, en kg.
Sustancia Pura 6 - Pág. 25
Termodinámica para ingenieros PUCP
Sustancia Pura
24. En el dispositivo mostrado se tiene 15kg de agua ocupando inicialmente un volumen de 2.07m3 a una presión
de 100kPa. Se transfiere calor al agua hasta que esta alcanza una presión de 1MPa. Si la presión necesaria para
equilibrar el pistón es de 150kPa, se pide:
a) El volumen específico del agua cuando el pistón choca con el tope superior.
b) La presión de saturación en el instante en que el agua se encuentra como vapor saturado.
c) La temperatura final del agua.
d) Graficar los procesos en los diagramas P-v, P-T y v-T.
Sustancia Pura 6 - Pág. 26
25. Dentro de un cilindro cerrado por un pistón sin fricción de 0.2m2 de sección, se tienen 10kg de agua en estado
de líquido saturado a 0.15MPa. se transfiere calor al agua hasta que dentro del cilindro exista únicamente vapor
saturado. Para este proceso se pide:
a) Calcular la calidad, si es vapor húmedo y la temperatura si es VSC, en el instante en que el pistón toque
el tope superior.
b) Calcular la presión final del vapor en kPa.
c) Trazar los procesos en los diagramas P-v y T-v.
Sustancia Pura 6 - Pág. 27
Sustancia Pura
26. Considere el sistema cilindro-pistón sin fricción mostrado en la figura. El área de la sección transversal del pistón
es 0.2m2. Inicialmente el pistón descansa sobre el tope inferior del cilindro. Se sabe que la presión atmosférica es
de 100kPa y que el peso del pistón es de 20kN. Se transfiere energía al agua contenida en el cilindro, hasta que la
presión sea de 8MPa. Cuando el pistón toca el resorte el agua ocupa un volumen de 0.0747m3. Si el cilindro contiene
inicialmente 4kg de líquido saturado a 35°C, se pide:
a) La temperatura final del agua.
b) La altura que se eleva el pistón.
c) La ecuación del proceso durante el cual actúa el resorte, P = f(v).
d) Graficar el proceso o procesos en el diagrama P-v.
Constante del resorte: 4MN/m
Sustancia Pura 6 - Pág. 28