Problemas-Bioquímica-(2014-15)-T 2-1
PROBLEMAS de OXIDOREDUCCIÓN y RESPIRACIÓN CELULAR
1.- Elegir la respuesta correcta de las respuestas ofrecidas en la lista lateral.
No todas las respuestas han de ser utilizadas.
A) anabólicas
1)___
Los organismos que requieren oxígeno se llaman
________ aeróbicos obligados __________.
2)___
Una ganancia de electrones desde una sustancia es
conocida como una ____ reducción __.
3)___
La forma oxidada del NADH es ____ NAD+___.
4)___
El potencial de reducción en condiciones estandar
bioquímico esta simbolizado por
ε
___________________________ °'__.
5 )___ El orgánulo subcelular donde tiene lugar la
reducción del
B)Dos
C) reducción
D) catabólicas
E) mitocondria
F) aeróbicos obligados
G) espacio intermembrana
H) NAD+
I) NADPH
J) pirofosfatasa
K) oxidación
L)
ε°'
2.- Responder las cuestiones
1.-Definir qué es el potencial redox
R.- Potencial redox es la capacidad de un compuesto para ceder electrones a otro y se expresa en
voltios.
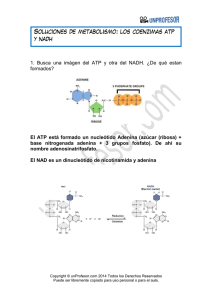
2.- Por qué son necesarias para el metabolismo las vitaminas niacina y riboflavina?
R: Estas vitaminas no son sintetizadas en humano, pero son componentes de las coenzimas requeridas
para las reacciones redox en el metabolismo. La niacina es un componente del NAD+, y la riboflavina es
un componente del FAD.
3.- Cúal es la relación entre el potencial de reducción y el ∆G de una reacción?
R: En una reacción redox, la diferencia de potencial eléctrico, ∆ε°, está relacionada con el ∆G° por la
siguiente ecuación. ∆G° = –n F∆ε° donde n es el número de moles de electrones transferidos por mol
reactivo en la ecuación balance y de F es número de Faraday (F = 96,485 J·V–1·mol–1).
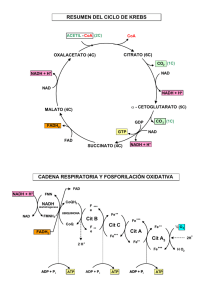
4.- Cúal es la razón por la que los transportadores electrónicos de la cadena respiratoria se ordenan del
modo en que lo hacen.
Los valores estándar para los diferentes pares redox se han calculado en condiciones estándar
considerando cero el potencial redox del par H+ / 1/2H2. Se ordenan en función de su potencial, los más
electronegativos son los más reductores.
5.- Cuáles son los aceptores terminales de electrones en la respiración de organismos aeróbicos?
R: El Oxígeno es el aceptor terminal de electrones en organismos aeróbicos. En organismos
anaeróbicos, otras sustancias, tales como sulfato o nitrato, son los aceptores terminales de electrones.
También existen organismos aerobios facultativos.
6.- ¿De qué manera el transporte de electrones a lo largo de la cadena respiratoria establece un gradiente
de protones?
R.- Mediante el bombeo de H+ que se produce en los complejos I, III y IV cuando los electrones pasan
a través de sus transportadores de e- (pares redox conjugados en cada complejo) en el paso de los e-
Problemas-Bioquímica-(2014-15)-T 2-2
desde el NADH hasta el O2.
7.- ¿Cuál es la razón por la que los agentes desacoplantes bloquean la síntesis de ATP?
R.- La síntesis de ATP en la fosforilación oxidativa está perfectamente acoplada al transporte de emitocondrial mediante el gradiente de H+. Los agentes desacoplantes disminuyen esta fuerza
protomotriz y por tanto bajan el rendimiento de la síntesis de ATP. Un ejemplo es el 2,4-dinitrofenol (DNP).
8.- ¿Qué es lo que provoca los cambios conformacionales en la ATP sintasa y lo que causa la síntesis de
ATP?
R.- El paso de H+ a través de complejo F0 de la ATP sintasa provoca el giro de la subunidad gamma,
que provoca a su vez el cambio de conformación (L, O, T) de las subunidades (alfa, beta) del complejo
F1 de la ATP sintasa y la síntesis de ATP por ésta, es decir la fosforilación del ADP hasta ATP.
3.- Ejercicios de cálculo: Elegir la respuesta adecuada.
1)
Dado que el potencial de reducción estandar del malato/oxaloacetato es –0.166 V y el
potencial de reducción estándar del NADH/NAD+ es –0.316 V. Cúal es el ∆ε°' para la
oxidación del malato por NAD+:
Malato + NAD+ → Oxaloacetato + NADH + H+
A) –4.81 V
B) + 4.81 V
C) +0.0523 V
D) +0.149 V
E) –0.150 V
Respuesta: E
2.- En la oxidación del NADH:
NADH + H+ + ½ O2 → NAD+ + H2O
a) Calcular ∆G°’
b) Calcular la eficiencia del proceso en términos de % de cambio de energía libre disponible si se forman
3 ATP
DATOS:
Eo’ para NAD/NADH+H+ = -0,32V
Eo’ para 1/2 O2 + 2H+/H2O = +0,82V
∆Eo = Eo OXIDANTE - Eo REDUCTOR = +0,82 – (-0,32) = 1,14 voltios
a)
∆G°’= -nF ∆Eo = -(2 · 96,5 · 1,14) = –220 kJ/mol;
∆G°’= –56,63 kcal/mol
b)
40%.
DATOS COMUNES:
R = 8,31451 J·K-1·mol-1
R = 1,987 cal·K-1·mol-1 ,
en Sistema Internacional de Unidades
1caloría = 4.18 J,
F=96,5 kJ/mol V