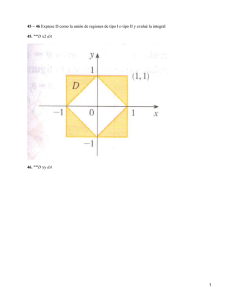
Conceptos fundamentales en Termodinámica
Anuncio

Conceptos fundamentales en Termodinámica Física II Grado en Ingeniería de Organización Industrial Primer Curso Joaquín Bernal Méndez Curso 2011-2012 Departamento de Física Aplicada III Universidad de Sevilla Índice Introducción Sistema y entorno Criterios macroscópico y microscópico Coordenadas termodinámicas Equilibrio Procesos termodinámicos 2/27 Introducción Termodinámica: rama de la Física que estudia los fenómenos inherentes a las transformaciones energéticas y sus efectos sobre el estado de la materia Origen: estudio de la producción de trabajo a partir de fuentes de calor 3/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico Coordenadas termodinámicas Equilibrio Procesos termodinámicos 4/27 Sistema y entorno Sistema: región del universo que aislamos para estudiarla Frontera Sistema Entorno masa y energía 5/27 Clasificación de los sistemas (I) Abierto: existe transferencia de materia y energía entre sistema y entorno Ejemplos: turbina; organismo vivo. Cerrado: sólo hay transferencia de energía Ejemplo: gas encerrado en recipiente con paredes móviles Aislado: no hay intercambio de materia ni energía Ejemplos: universo; sistema junto con su entorno 6/27 Clasificación de los sistemas (II) Homogéneos: propiedades físicas y químicas iguales en todo punto del sistema Ejemplos: gas, disolución diluida, sólido puro Heterogéneos: formado por subsistemas homogéneos (fases) de propiedades distintas Ejemplo: disolución saturada, agua y hielo En este bloque nos limitaremos al estudio de sistemas homogéneos 7/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico Coordenadas termodinámicas Equilibrio Procesos termodinámicos 8/27 Criterios macroscópico y microscópico Descripción del estado de un sistema: Mecánica: coordenadas espaciales y de velocidad Electromagnetismo: valores de los campos eléctricos y magnéticos en todos los puntos del espacio En Termodinámica se trata de describir el estado “interno” de un sistema 9/27 Criterio microscópico Método de la Termodinámica estadística Es preciso establecer una hipótesis sobre estructura de la materia Se describe el estado del sistema con muchas variables: Peso • Velocidad media No intuitivas No medibles Pistón Gas • Tiempo promedio entre colisiones • etc.. 10/27 Criterio macroscópico Método de la Termodinámica clásica No se parte de hipótesis sobre estructura de la materia Se describe el estado del sistema con unas pocas variables: Peso Sugeridas por los sentidos Medibles P, V, T Pistón Gas 11/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico Coordenadas termodinámicas Equilibrio Procesos termodinámicos 12/27 Coordenadas termodinámicas Magnitudes macroscópicas útiles para determinar el estado de un sistema Ejemplos: presión, volumen, masa, temperatura… También: propiedades del sistema Normalmente un subconjunto de estas coordenadas termodinámicas es suficiente para caracterizar el estado del sistema: Coordenadas de estado ó variables de estado 13/27 Coordenadas termodinámicas (I) P, T, V, , m P, T, P, T, V/2 V/2 m/2 m/2 Propiedades extensivas: su valor depende de las dimensiones del sistema Propiedades intensivas: su valor no depende de la masa ni del volumen del sistema 14/27 Coordenadas termodinámicas (II) Las propiedades extensivas pueden expresarse por unidad de masa: magnitudes específicas Ejemplo: volumen específico: v V m También pueden expresarse por unidad molar: magnitudes molares específicas Ejemplo: volumen molar: v0 V n Las magnitudes específicas son intensivas 15/27 Coordenadas termodinámicas (III) Tienen un significado macroscópico Carece de sentido aplicarlas a sistemas con un reducido número de moléculas o átomos ¡ Una molécula carece de T ó P ! Cuando se usan en forma diferencial: dP, dV… denotan cambios macroscópicos. Ejemplo: Un dV es un cambio de volumen pequeño respecto a V, pero suficientemente grande para contener un número muy elevado de moléculas 16/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico Coordenadas termodinámicas Equilibrio Procesos termodinámicos 17/27 Equilibrio Se dice que un sistema se encuentra en equilibrio termodinámico si no es capaz de experimentar un cambio espontáneo de estado sin un cambio de su entorno El equilibrio termodinámico implica: Equilibrio térmico Equilibrio mecánico Equilibrio de fases Equilibrio químico Las propiedades de un sistema solamente están definidas con claridad dentro del equilibrio 18/27 Equilibrio: ecuación de estado (I) Relación entre las coordenadas termodinámicas de un sistema en equilibrio Pueden obtenerse mediante experimentación ó estudio teórico (ajeno a la Termodinámica) Sistema PVT: f ( P,V , T ) 0 Peso Pistón Ejemplos: Gas ideal: PV nRT Gas de Van der Waals: Gas 2 a P n V nb nRT 2 V 19/27 Equilibrio: ecuación de estado (II) Ejemplo: sistema hidrostático puro, sistema simple compresible ó sistema PVT Peso Pistón Gas Coordenadas termodinámicas: P, V, T, ,… Ecuación de estado: f ( P,V , T ) 0 Dos coordenadas describen el estado del sistema Coordenadas de estado 20/27 Equilibrio: ecuación de estado (III) Ejemplo: hilo estirado Coordenadas termodinámicas: F, L, T, densidad lineal… Ecuación de estado: f ( F , L, T ) 0 Dos coordenadas describen el estado del sistema L F Coordenadas de estado 21/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico Coordenadas termodinámicas Equilibrio Procesos termodinámicos Funciones de estado Procesos cuasi-estáticos 22/27 Procesos termodinámicos Cuando cambia alguna propiedad del sistema, el estado del sistema cambia Proceso termodinámico Tipos especiales de procesos: Isotermo: la temperatura permanece constante Isóbaro: la presión permanece constante Isocoro: el volumen permanece constante 23/27 Funciones de estado Toda magnitud cuya variación en un proceso depende exclusivamente del estado inicial y el estado final: Y Y2 Y1 Matemáticamente: toda magnitud que puede expresarse como una función de las variables de estadoY Y ( P, T ) Ejemplos: energía interna, entalpía, volumen,… No son funciones de estado el calor y el trabajo Las propiedades de un sistema son, por definición, funciones de estado 24/27 Procesos cuasi-estáticos (I) Infinitamente lentos (irrealizables) El sistema se considera en equilibrio en cualquier punto del proceso La ecuación de estado se cumple en cualquier punto del proceso Tienen gran importancia teórica y práctica en Termodinámica 25/27 Procesos cuasi-estáticos (II) Un proceso cuasi-estático puede representarse en una gráfica (sucesión de puntos de equilibrio): P 2 P 2 1 1 V T 26/27 Resumen La termodinámica clásica estudia el estado macroscópico de los sistemas y cómo les afectan las transformaciones energéticas El estado del sistema viene determinado por el valor de sus propiedades ó coordenadas termodinámicas En un sistema en equilibrio existe una ecuación de estado: propiedades no son independientes Las propiedades necesarias y suficientes para determinar el estado del sistema: coordenadas de estado Cuando un sistema cambia de estado sufre un proceso termodinámico Las funciones de estado son aquellas magnitudes cuya variación en un proceso sólo depende del estado inicial y el estado final, pero no de la forma en que se realiza el proceso Las propiedades de un sistema son funciones de estado Un proceso cuasi-estático es aquel en el que el sistema se encuentra siempre en equilibrio (irrealizable en la práctica) 27/27