Leccion1.CERAMICAS.TiposMATERIALES
Anuncio
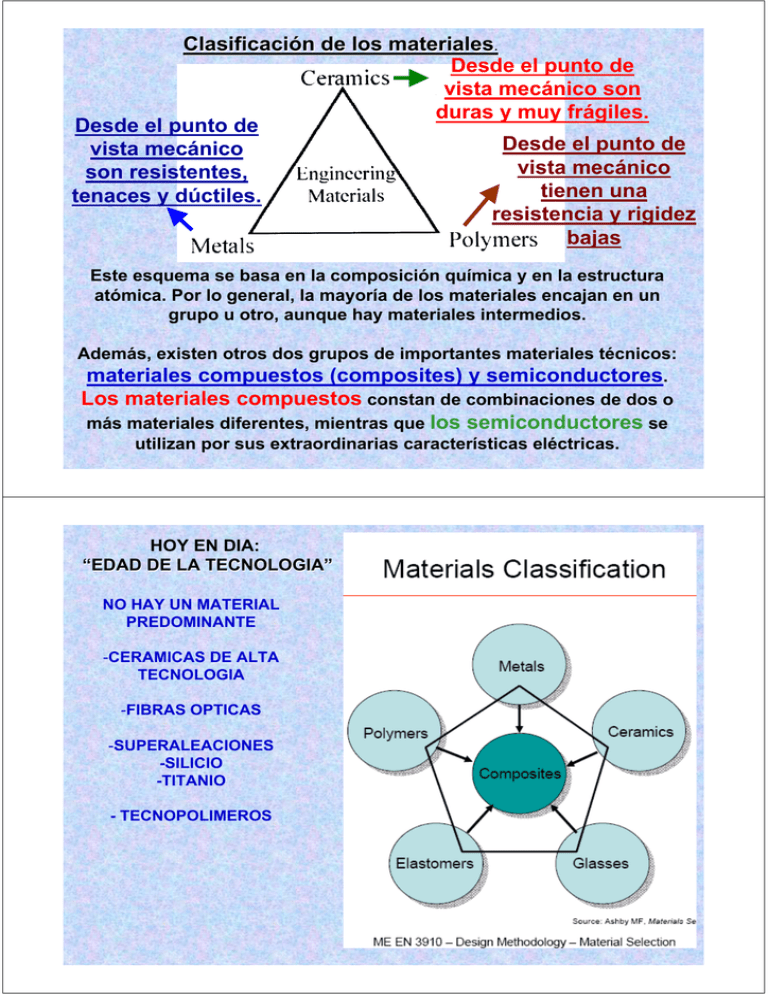
Clasificación de los materiales. Desde el punto de vista mecánico son duras y muy frágiles. Desde el punto de Desde el punto de vista mecánico vista mecánico son resistentes, tienen una tenaces y dúctiles. resistencia y rigidez bajas Este esquema se basa en la composición química y en la estructura atómica. Por lo general, la mayoría de los materiales encajan en un grupo u otro, aunque hay materiales intermedios. Además, existen otros dos grupos de importantes materiales técnicos: materiales compuestos (composites) y semiconductores. Los materiales compuestos constan de combinaciones de dos o más materiales diferentes, mientras que los semiconductores se utilizan por sus extraordinarias características eléctricas. HOY EN DIA: “EDAD DE LA TECNOLOGIA” NO HAY UN MATERIAL PREDOMINANTE -CERAMICAS DE ALTA TECNOLOGIA -FIBRAS OPTICAS -SUPERALEACIONES -SILICIO -TITANIO - TECNOPOLIMEROS COMPOSITES Clasificación de los materiales. MATERIALES ESTRUCTURALES SE UTILIZAN PARA LA REALIZACION DE ESTRUCTURAS, EDIFICACIONES, ETC. SU UTILIZACIÓN ES FUNCION DE LAS PROPIEDADES MECANICAS QUE PRESENTAN MATERIALES FUNCIONALES ENCUENTRAN APLICACIÓN EN FUNCIÓN DE OTRAS PROPIEDADES, FUNDAMENTALMENTE, FISICAS COMO: -CONDCUTIVIDAD TERMICA -CONDUCTIVIDAD ELECTRICA PROPIEDADES ÓPTICAS -PROPIEDADES MAGNETICAS - PROPIEDADES QUIMICAS ACEROS: PLASTICOS: VIDRIOS: 2000 TIPOS 5000 TIPOS 10000 TIPOS Las propiedades de los materiales dependen de su composición química, de su estructura, fundamentalmente del tipo de enlace entre los elementos que lo constituyen, de la ordenación espacial de los átomos o iones y de la microestructura (NATURALEZA, CANTIDAD Y DISTRIBUCION DE LAS FASES PRESENTES EN LA CERAMICA: FASE CRISTALINA, FASE VITREA Y POROSIDAD), es decir, el aspecto que presentan mediante observación microscópica. PROPIEDADES INTRINSECAS→DETERMINADAS POR AL ESTRUCTURA A ESCALA ATOMICA No son susceptibles de un cambio significativo por modificación de la microestructura Punto de fusión, Módulo elástico, coeficiente de expansión térmica, si el material es frágil, magnético, ferroelectrico o semiconductor, etc. PROPIEDADES QUE DEPENDEN SIGNIFICATIVAMENTE DE LA MICROESTRUCTURA (Propiedades críticas para aplicaciones ingenieriles) Resistencia mecánica, constante dieléctrica, conductividad eléctrica, PROPIEDADES INTRINSECAS→DETERMINADAS POR AL ESTRUCTURA A ESCALA ATOMICA No son susceptibles de un cambio significativo por modificación de la microestructura Punto de fusión, Módulo elástico, coeficiente de expansión térmica, si el material es frágil, magnético, ferroelectrico o semiconductor, etc. PROPIEDADES QUE DEPENDEN SIGNIFICATIVAMENTE DE LA MICROESTRUCTURA (Propiedades críticas para aplicaciones ingenieriles) Resistencia mecánica, constante dieléctrica, conductividad eléctrica, etc.) EN MUCHOS CASOS EL COMPORTAMIENTO DE UN DETERMINADO MATERIAL DEPENDE ADEMÁS DE SU HISTORIA Y, ENPARTICULAR, DE SU HISTORIA TÉRMICA ASÍ, POR EJEMPLO, UN ACERO AL CARBONO QUE SE FABRICA EN ESTADO LÍQUIDO, SI SE SOLIDIFICA MUY RÁPIDAMENTE Y SE DEJA ENFRIAR HASTA LA TEMPERATURA AMBIENTE MUY LENTAMENTE PRESENTA UNAS PROPIEDADES Y UNA ESTRUCTURA QUE SON MUY DIFERENTES QUE SI SE HUBIERA ENFRIADO DESDE, POR EJEMPLO, 1000 ºC A VELOCIDAD MUY RÁPIDA (SUMERGIÉNDOLO EN AGUA). COMO CONSECUENCIA DE ESTO, ADEMÁS DEL ESTUDIO DE LA ESTRUCTURA Y MICROESTRUCTURA DE LOS MATERIALES SE HA DE ESTUDIAR LAS DESVIACIONES QUE PUEDEN APARECER EN FUNCIÓN DE LOS DISTINTOS TIPOS DE CALENTAMIENTO O ENFRIAMIENTO. PARA CAMBIAR EL COMPORTAMIENTO Y EL RENDIMIENTO DE UN MATERIAL SE DEBE MODIFICAR SU ESTRUCTURA INTERNA. SI LAS CONDICIONES DE SERVICIO ALTERAN LA ESTRUCTURA DEL MATERIAL, EL INGENIERO O DISEÑADOR DEBE ANTICIPAR QUE CAMBIOS TENDRÁN LUGAR EN LAS PROPIEDADES Y COMPORTAMIENTO DEL MATERIAL LAS PROPIEDADES INFLUYEN SOBRE EL COMPORTAMIENTO DEL MATERIAL DURANTE SU FABRICACIÓN Y SU SERVICIO W: PF 3410 ºC, PE: 5930 ºC Sn PF 232 º , PE: 2602 ºC CERAMICOS ENLACE IONICO ENLACE COVALENTE Ionic Bonding NaCl Formation of ionic bond 1. Mutual ionization occurs by electron transfer 2. Ions are attracted by coulombic forces EA = − A / r ER = B / r n , n ~ 8 ~ 640 KJ/mole or 3.3eV/atom, Tm~ 801oC An ionic bond is non-directional (Ions can be attracted to one another in any direction) ionic crystals low ionization energy atoms (e.g. alkalis: Li, Na) combined with high electron affinity atoms (e.g. halogens: F, Cl) an alkali atoms transfer one or more electrons to a halogen atom ionic crystals low ionization energy atoms (e.g. alkalis: Li, Na) combined with high electron affinity atoms (e.g. halogens: F, Cl) an alkali atoms transfer one or more electrons to a halogen atom CH4 Covalent Bonding Formation of covalent bond 1. Cooperative sharing of valence electrons 2. Valence electronic can participate in bonding Strong: For Diamond (sp3) C ~ 713 KJ/mole or 7.4eV/atom, Tm~ 3550oC CN=4 (r/R=1, CN=12?) Weak: Polymers.. Bond angle: 109.5o A covalent bond is directional (Bonds form in the direction of greatest orbital overlap) covalent crystals two or more atoms share electrons to reach noble gas configuration for each atom often atoms with similar ionization energies ( diatomic molecules) covalent crystals •only few solids are covalently bound (diamond, Si, Ge, SiC) •covalent bond stronger than ionic •hardest materials •high melting points •insoluble •all covalent crystals have tetrahedral (diamond) structure Metallic Bonding Formation of metallic bond 1. Cooperative sharing of valence electrons 2. Delocalized valence electrons (free electrons) Strong: For W ~ 850 KJ/mole or 8.8eV/atom, Tm~ 3410oC Weak: Hg A covalent bond is directional Bonds form in any direction, pack closely (high CN) Secondary Bonding Formation of secondary bonds 1. Are formed between groups of atoms or ions 2. No electron transfer or sharing 3. Based upon the attraction of dipoles Dipole moment= charge x distance Van der Waals bonds: fluctuating dipole bonds, e.g., Ar (7.7KJ/mole, -189oC) Hydrogen bonds: permanent dipole bonds, e.g., H2O (51KJ/mole, 0oC) Why ρl > ρs? Summary: Bonding Directional Bonds Covalent Permanent dipole Non-Directional Bonds Metallic Ionic Fluctuating dipole Metallic M Examples: Metals: Metallic bonding Secondary Ceramics: Ionic/covalent Polymers: Covalent and secondary Semiconductors: Covalent or covalent/ionic Ionic C P S Covalent bonding in crystalline solids Electronegatividad (EN). Los enlaces de moléculas homodiatomicas como el H2 son covalentes puros. En una molécula heterodiatomica como el HF, el par de enlace esta más localizado sobre el fluor, produciendo una carga parcial positiva sobre el hidrogeno, y una negativa sobre el fluor. Un enlace de este tipo se llama polar, ya que presenta un momento dipolar eléctrico. La capacidad de cada átomo de atraer los electrones del enlace covalente determina la distribución de cargas y se llama electronegatividad. La electronegatividad se define “como la tendencia relativa de los distintos átomos a atraer hacia sí el par de electrones que comparte con otro en un enlace covalente”. Dicha tendencia debe estar relacionada con el potencial de ionización (energía que hay que comunicar a un átomo aislado neutro (gaseoso) en su configuración electrónica fundamental para arrancarle un electrón (el más débil) y convertirlo en un catión) X + 1ªE.I. → X+ + eX+ + 2ªE.I. → X2+ + e1 eV = 1,6.10-19 culombios . 1 voltio = 1,6.10-19 julios Electroafinidad o afinidad electrónica (Energía desprendida en un proceso en el que un determinado átomo neutro gaseoso en estado fundamental, capta un electrón para dar un ion mononegativo gaseoso en estado fundamental ) Un átomo con una afinidad electrónica muy negativa y un potencial de ionización elevado, atraerá electrones de otros átomos y además se resistirá a dejar ir sus electrones ante atracciones externas. Será muy electronegativo. El método sugerido por el profesor R.S. Mulliken promedia los valores del potencial de ionización y afinidad electrónica de un elemento: XM = 0.0085 (P.I. + A.E.) A medida que aumentan ambas magnitudes el átomo querrá tomar electrones y será bastante difícil que los pierda. Cuando la diferencia de electronegatividades es suficientemente alta, se produce una transferencia completa de electrones, dando lugar a la formación de especies iónicas. Ejemplo: Compuesto Diferencia de electronegatividad Tipo de enlace F2 HF 4.0 - 2.1 4.0 - 4.0 = 0 = 1.9 Covalente Covalente no polar polar LiF 4.0 - 1.0 = 3.0 Iónico Gráfica que relaciona el carácter iónico de un enlace con la diferencia de electronegatividad de los dos átomos enlazados, según una formula propuesta por Pauling. El carácter iónico aumenta con la diferencia entre las electronegatividades ELEMENTOS METALICOS (Mg, Al, Ti, Fe, Na, Zr) ELEMENTOS NO METALICOS (C, Si, S, N, B, O) MATERIALES METALICOS LOS MATERIALES METALICOS TIENEN GRAN NÚMERO DE ELECTRONES DESLOCALIZADOS, QUE NO PERTENECEN A NINGÚN ÁTOMO EN CONCRETO. LA MAYORÍA DE LAS PROPIEDADES DE LOS METALES SE ATRIBUYEN A ESTOS ELECTRONES. -CONDUCEN PERFECTAMENTE EL CALOR Y LA ELECTRICIDAD - ELEVADO PUNTO DE FUSIÓN -SON OPACOS A LA LUZ VISIBLE -LA SUPERFICIE METÁLICA PULIDA TIENE APARIENCIA LUSTROSA -DESDE EL PUNTO DE VISTA MECÁNICO LOS METALES SON DUROS RESISTENTES A LOS ESFUERZOS, TENACES (SE NECESITA GRAN CANTIDAD DE ENERGIA PARA QUE SE ROMPAN) Y DÚCTILES. LOS METALES SON DEFORMABLES, LO QUE CONTRIBUYE A SU UTILIZACIÓN EN APLICACIONES ESTRUCTURALES INCONVENIENTES: - MALAS PROPIEDADES MECÁNICAS A ALTAS TEMPERATURAS - ELEVADA DENSIDAD EN MUCHOS CASOS - TENDENCIA A REACCIONAR CON AGENTES QUÍMICOS AGRESIVOS, PRODUCIÉNDOSE FENÓMENOS DE CORROSIÓN QUE PUEDEN INUTILIZARLOS PARA EL SERVICIO AL QUE ESTÁN DESTINADOS. En la figura puede verse la resistencia a la rotura para varios materiales y su evolución en función de la temperatura. Puede observarse que los materiales cerámicos y los materiales compuestos de matriz cerámica (CMCs) son los únicos que se pueden utilizar a temperaturas superiores a los 1400 °C. Resistencia a la rotura para varios materiales y su evolución en función de la temperatura. MATERIALES CERAMICOS LOS COMPUESTOS QUÍMICOS CONSTITUIDOS, EN GENERAL, POR METALES Y NO METALES O METALOIDES (ÓXIDOS, NITRUROS, CARBUROS, BORUROS, SILICIUROS, ETC.) PERTENECEN AL GRUPO DE LAS CERÁMICAS, QUE INCLUYE MINERALES DE ARCILLA, CEMENTO Y VIDRIO. POR LO GENERAL SE TRATA DE MATERIALES QUE SON AISLANTES ELÉCTRICOS Y TÉRMICOS Y QUE A ELEVADA TEMPERATURA Y EN AMBIENTES AGRESIVOS SON MÁS RESISTENTES QUE LOS METALES Y LOS POLÍMEROS. DESDE EL PUNTO DE VISTA MECÁNICO, LAS CERÁMICAS TIENEN UN ELEVADO PUNTO DE FUSION, PRESENTAN UNA ELEVADA RESISTENCIA A LA COMPRESION, SON MUY DURAS, BUENAS PROPIEDADES MECÁNICAS A ALTAS TEMPERATURAS Y TIENEN EL INCONVENIENTE DE SER MUY FRÁGILES. SON RESISTENTES A MUCHOS MEDIOS AGRESIVOS QUÍMICAMENTE PROPIEDADES TIPICAS DE LAS CERAMICAS MATERIALES POLIMÉRICOS LOS POLÍMEROS COMPRENDEN MATERIALES QUE VAN DESDE LOS FAMILIARES PLÁSTICOS AL CAUCHO. SE TRATA DE COMPUESTOS ORGÁNICOS, BASADOS EN EL CARBONO, HIDROGENO Y OTROS ELEMENTOS NO METÁLICOS, CARACTERIZADOS POR LA GRAN LONGITUD DE LAS ESTRUCTURAS MOLECULARES. LOS POLÍMEROS POSEEN: -DENSIDADES BAJAS, LO QUE LOS HACE INTERESANTES EN INDUSTRIAS TALES COMO LA AUTOMOCIÓN Y AERONÁUTICA -EXTRAORDINARIA FLEXIBILIDAD (FACILMENTE DEFORMABLES) -RESISTENTES A MEDIOS AGRESIVOS - COEFICIENTE DE DILATACIÓN TÉRMICA ES GRANDE. DESDE EL PUNTO DE VISTA MECÁNICO LOS POLÍMEROS TIENEN UNA RESISTENCIA Y RIGIDEZ BAJAS. SE DETERIORAN A TEMPERATURAS RELATIVAMENTE BAJAS (A 200-300ºC SE INUTILIZAN). MATERIALES COMPUESTOS SE HAN DISEÑADO MATERIALES COMPUESTOS FORMADOS POR MÁS DE UN TIPO DE MATERIAL, GENERALMENTE UNO HACE DE FASE CONTINUA (MATRIZ) Y EL OTRO DE FASE DISCONTINUA (DISPERSA) . LA FIBRA DE VIDRIO, QUE ES VIDRIO EN FORMA FILAMENTOSA EMBEBIDO DENTRO DE UN MATERIAL POLIMÉRICO, ES UN EJEMPLO FAMILIAR. LOS MATERIALES COMPUESTOS ESTÁN DISEÑADOS PARA ALCANZAR LA MEJOR COMBINACIÓN DE LAS CARACTERÍSTICAS DE CADA COMPONENTE (COMBINAR LAS PROPIEDADES DE LOS DISTINTOS TIPOS DE MATERIALES). LOS MATERIALES PLÁSTICOS REFORZADOS CON FIBRA DE VIDRIO SON MECÁNICAMENTE RESISTENTES DEBIDO AL VIDRIO Y FLEXIBLES DEBIDO AL POLÍMERO. LA MAYORÍA DE LOS MATERIALES DESARROLLADOS ÚLTIMAMENTE SON MATERIALES COMPUESTOS. MATERIALES SEMICONDUCTORES LOS SEMICONDUCTORES TIENEN PROPIEDADES ELÉCTRICAS INTERMEDIAS ENTRE LOS CONDUCTORES Y LOS AISLANTES ELÉCTRICOS. LAS CARACTERÍSTICAS ELÉCTRICAS DE LOS SEMICONDUCTORES SON EXTREMADAMENTE SENSIBLES A LA PRESENCIA DE DIMINUTAS CONCENTRACIONES DE ÁTOMOS DE IMPUREZAS. ESTAS CONCENTRACIONES SE DEBEN CONTROLAR EN REGIONES ESPACIALES MUY PEQUEÑAS. LOS SEMICONDUCTORES POSIBILITAN LA FABRICACIÓN DE LOS CIRCUITOS INTEGRADOS QUE HAN REVOLUCIONADO, EN LAS ÚLTIMAS DÉCADAS, LA INDUSTRIA ELECTRÓNICA Y DE LOS ORDENADORES. PRESENTAN COMO PARTICULARIDAD QUE SU CONDUCTIVIDAD ELECTRICA ES MAYOR AL AUMENTAR LA TEMPERATURA MATERIALES COMPUESTOS Tipos de materiales compuestos en base al material que constituye la matriz: - Materiales compuestos de matriz polimérica (PMCs), - Materiales compuestos de matriz metálica (MMCs) - Materiales compuestos de matriz cerámica (CMCs). Tipos de materiales compuestos en base a la forma en que se refuerzan. TENDENCIA ACTUAL EN LA BUSQUEDA DE NUEVOS MATERIALES: 1.- MEJORA DE LAS PROPIEDADES MECANICAS 2.- MATERIALES DE BAJA DENSIDAD 3.- MATERIALES RESISTENTES A TEMPERATURAS ALTAS 4.- MATERIALES RESISTENTES A LA CORROSIÓN 5.- MATERIALES CON PROPIEDADES FÍSICAS (NO MECÁNICAS) MUY ESPECÍFICAS UN FACTOR IMPORTANTE ES EL ENERGÉTICO, REFIRIÉNDOSE SIEMPRE AL CONSUMO DE ENERGÍA EN LA FABRICACIÓN DEL MATERIAL. ADEMÁS, SE HA DE TENER EN CUENTA EN DICHA FABRICACIÓN EL FACTOR ECONÓMICO, EL MEDIOAMBIENTAL Y EL POSIBLE RECICLADO. ACERO ALTO EN CARBONO 1.- MODULO ELEVADO MIDE LA RESISTENCIA DEL MATERIAL A LA DEFORMACIÓN ELÁSTICA (DEFLEXIÓN, ) 2.- LIMITE ELASTICO (YIELD STRENGHT) ELEVADO, SINO SE DEFORMARA PLASTICAMENTE O PERMANENTEMENTE SI EL ESFUERZO ES GRANDE 3.- DUREZA ELEVADA 4.- TENAZ (TENACIDAD A LA FRACTURA ELEVADA), PARA QUE SE DEFORME ANTES DE LA FRACTURA EL VIDRIO CUMPLE LAS TRES PRIMERAS CONDICIONES, PERO NO LA CUARTA, YA QUE ES UN MATERIAL FRAGIL MANGO: MADERA, PMMA,… 1.- EL VALOR DEL MODULO NO TIENE TANTA IMPORTANCIA (SECCION GRANDE) 2.- PPMA SE PUEDE CONFORMAR CON FACILIDAD 3.- DENSIDAD BAJA 4.- RAZONES ESTETICAS: APARIENCIA, TACTO Y TEXTURA 5.- EL PMMA ES BARATO COMPONENTES DEL HORMIGON DOSIFICACION H.C. (m3 de HORMIGON) ARENA 790 Kg GRAVILLA 466 Kg GRAVA 662 Kg ARIDOS 1918 Kg CEMENTO 300 Kg (~12.6 %) AGUA 167 dm3 TOTAL 2385 Kg DOSIFICACION H.A.R. ARENA GRAVA 685 Kg 1094 Kg ARIDOS 1779 Kg CEMENTO (~20 %) 496 Kg AGUA 136 dm3 SUPERPLASTIFICANTE 16.6 Kg MICROSILICE 47.6 Kg TOTAL 2475.2 Kg HORMIGON PALACIO CONGRESOS - OVIEDO General Motors' new Vortec 4200 Inline six-cylinder engine features a robust air intake manifold made by Montaplast of North America, Inc. using DuPont Zytel® glass-reinforced nylon