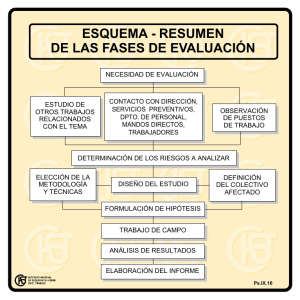
[] Departamento de Genética e Biología Evolutiva
Anuncio
![[] Departamento de Genética e Biología Evolutiva](http://s2.studylib.es/store/data/004986157_1-25143e63a2ae009397d0e6bf3fdbca3a-768x994.png)
ASESORAMIENTO GENÉTICO Y CÁLCULO DE RIESGOS Paulo A. Otto [[email protected]] Departamento de Genética e Biología Evolutiva Instituto de Biociências Universidade de São Paulo Caixa Postal 11461 05422-970 São Paulo SP Brasil PRIMER CURSO DE GENÉTICA MÉDICA 19-21 Octubre 2005 Laboratorio de Citogenética y Genética Humana Departamento de Genética FCEQyN / UNaM Este material fue vertido del portugués al castellano por las Doctoras Carola Cheroki y Carina Francisca Argüelles y se destinó para uso de los estudiantes del PRIMER CURSO DE GENÉTICA MÉDICA DE LA FCEQyN de la Universidad Nacional de Misiones, Posadas, República Argentina, 2005. EDITORIAL UNIVERSITARIA DE MISIONES San Luis 1870 Posadas - Misiones – Tel-Fax: (03752) 428601 Correos electrónicos: [email protected] [email protected] [email protected] [email protected] [email protected] Otto, Paulo Alberto Asesoramiento genético y cáculo de riesgo. - 1a ed. Posadas: EdUNaM - Editorial Universitaria de la Universidad Nacional de Misiones, 2008. 120 p. ; 28x22 cm. ISBN 978-950-579-114-9 1. Genética Médica. 2. CDD 616.042 Genética Humana. I. Título Fecha de catalogación: 10/10/2008 ISBN: 978-950-579-114-9 Impreso en Argentina ©Editorial Universitaria Universidad Nacional de Misiones Posadas, 2008 PAG. ENFERMEDADES CONDICIONADAS POR MECANISMO MONOGÉNICO: HERENCIA AUTOSÓMICA RECESIVA ENFERMEDADES CONDICIONADAS POR MECANISMO MONOGÉNICO: HERENCIA 6 AUTOSÓMICA DOMINANTE 14 ENFERMEDADES CONDICIONADAS POR MECANISMO MONOGÉNICO: HERENCIA LIGADA AL X 17 ENFERMEDADES PRODUCIDAS POR MECANISMO CROMOSÓMICO 23 ENFERMEDADES CONDICIONADAS POR MECANISMO MULTIFACTORIAL 25 ENFERMEDADES Y DEFECTOS ETIOLÓGICAMENTE HETEROGÉNEOS 28 DOENÇAS CONDICIONADAS POR MECANISMO MONOGÊNICO: HERANÇA AUTOSSÔMICA RECESSIVA 32 DOENÇAS CONDICIONADAS POR MECANISMO MONOGÊNICO: HERANÇA AUTOSSÔMICA DOMINANTE 39 DOENÇAS CONDICIONADAS POR MECANISMO MONOGÊNICO: MECANISMO LIGADO AO X 43 DOENÇAS PRODUZIDAS POR MECANISMO CROMOSSÔMICO 48 DOENÇAS CONDICIONADAS POR MECANISMO MULTIFATORIAL 51 DOENÇAS E DEFEITOS ETIOLOGICAMENTE HETEROGÊNEOS 53 RESUMEN DE CLASES (SLIDES) 56 CAPÍTULO “ACONSELHAMENTO GENÉTICO E CÁLCULO DE RISCOS” DEL LIBRO: TRATADO DE CLÍNICA MÉDICA (Lopes & Amato Neto) 91 REFERENCIAS BIBLIOGRÁFICAS 115 ENFERMEDADES CONDICIONADAS POR MECANISMO MONOGÉNICO: HERENCIA AUTOSÓMICA RECESIVA Un matrimonio normal tiene un hijo afectado con fenilcetonuria, enfermedad condicionada por mecanismo autosómico recesivo (la frecuencia del gen que condiciona la enfermedad es del orden del 1%). Explicar por qué el riesgo de recurrencia de la enfermedad para el próximo hijo es de 1/4. La enfermedad en el niño afectado puede haber surgido de tres maneras diferentes: a) los progenitores son homocigotas AA (probabilidad a priori p2 x p2 = p4) y ambos genes transmitidos al niño sufrieron mutación (probabilidad condicional µ x µ = µ2): la probabilidad conjunta asociada al evento es por lo tanto Pa = p4 x µ2; b) un progenitor es homocigota AA y el otro heterocigota Aa (probabilidad a priori 2 x p2 x 2pq = 4p3q), el gen transmitido por el homocigota sufre mutación y el heterocigota transmite el alelo a (probabilidad condicional µ/2): la probabilidad conjunta asociada al evento es por lo tanto Pb = 2p3q x µ; c) los progenitores son ambos heterocigotas Aa (probabilidad a priori 4p2q2) y cada uno transmitió al afectado un gen a (probabilidad condicional 1/4): la probabilidad conjunta asociada al evento es por lo tanto Pc = p2q2; la suma de esas tres probabilidades conjuntas es Pa+Pb+Pc = p4µ2 + 2p3qµ + p2q2 = p2(p2µ2 + 2pqµ + q2) = p2(pµ + q)2. Como los riesgos de repetición de la enfermedad en un próximo niño del matrimonio son µ2, µ/2 y 1/4 respectivamente en las hipótesis a, b y c, el riesgo de repetición considerando las tres hipótesis queda siendo R = (Pa x µ2 + Pb x µ/2 + Pc x 1/4)/(Pa + Pb + Pc); como Pa x µ2 + Pb x µ/2 + Pc x 1/4 = p4 x µ4 + p3q x µ2 + p2q2/4 = p2(p2µ4 + pqµ2 + q2/4) = p2(pµ2 + q/2)2, la expresión para el riesgo de recurrencia se simplifica inmediatamente como R = [(pµ2 + q/2)/(pµ + q)]2, expresión claramente de la orden de magnitud de [(q/2)/(q)]2 = 1/4. Dos hermanos se casaron con dos hermanas. Del primer matrimonio nace un niño afectado con fenilcetonuria y del segundo un niño afectado con galactosemia. Los dos matrimonios buscan un servicio de asesoramiento genético. ¿Qué riesgo darías para su futura prole? El riesgo de fenilcetonuria en la prole del primer matrimonio es 1/4, siendo que ya tuvieron un niño afectado; como del matrimonio formado por sus hermanos nació un niño con galactosemia (y por lo tanto el riesgo de ocurrencia de galactosemia en la prole del segundo matrimonio es también 1/4), marido y mujer del primer matrimonio poseen, cada uno, una probabilidad de 1/2 de ser heterocigota para el gen de la galactosemia y un riesgo de 1/4 x 1/4 = 1/16 de niño afectado, ya que con seguridad los progenitores de cada uno de los matrimonios de hermanos son Ff x FF y Gg x GG, donde f y g son los genes no alélicos que en homocigosis determinan cada una de las dos enfermedades. De la misma manera, un niño del segundo matrimonio posee un riesgo de 1/4 de presentar galactosemia y 1/16 de presentar fenilcetonuria. Para cada uno de los matrimonios, por lo tanto, la probabilidad de concebir un niño afectado es 1 - (1-P1)x(1-P2) = 1 - 1 + P1 + P2 - P1 x P2 = P1 + P2 - P1xP2 = 1/4 + 1/16 - 1/64 = 19/64 = 0.296875 o cerca de 30%. Existen por lo menos dos formas no alélicas de albinismo universal recesivo (tirosinasa-positivo y tirosinasa negativo, con frecuencias respectivas de 1/15.000 y 1/30.000 entre negroides norte-americanos. 6 ¿Cuál es la probabilidad de que un niño de un matrimonio de albinos no consanguíneos nazca igualmente afectado? ¿Y si el matrimonio fuera consanguíneo? Si un niño de ese matrimonio naciera albino, ¿cuál es el riesgo para el próximo niño? ¿Y si el niño naciera normal? La probabilidad de que un albino universal sea recesivo del tipo tirosinasa-positivo es P(tir+|alb) = P(alb,tir+) / [P(alb,tir+)+P(alb,tir-)] = (1/15000) / (1/15000+1/30000) = 2/3; P(tir|alb) = (1/30000) / (1/15000+1/30000) = 1 - P(tir+|alb) = 1 - 2/3 = 1/3. Para que el niño del matrimonio nazca albino, es necesario que el tipo de albinismo del hombre y de la mujer afectados sea el mismo, y la probabilidad asociada a esto es P = (2/3)2 + (1/3)2 = 4/9 + 1/9 = 5/9. Si el matrimonio fuera consanguíneo, entretanto, tratamos al albinismo del matrimonio como siendo del mismo tipo y el riesgo para cualquier niño es estimado en 1 o 100%. Si un niño del matrimonio nace afectado, es señal de que el tipo de albinismo de sus padres es el mismo, y el riesgo para cualquier niño siguiente se fija en 100%. Si el niño nace normal, es seguro que los progenitores son afectados por formas diferentes, no alélicas, de albinismo universal: el riesgo para cualquier hijo próximo se fija entonces en 0%. La probabilidad de que un gen cualquiera, presente en un individuo, este en una prima en primer grado es 1/8. Cerca de 1/l00 de todos los niños que nacen de matrimonios no consanguíneos están afectados con retardo mental. Alrededor de 1/4 de esos casos de retardo son condicionados por un mecanismo hereditario autosómico recesivo. Existen en la especie humana por lo menos l00 genes localizados en loci distintos que en homocigosis determinan retardo. Suponiendo que todos esos genes ocurran con frecuencias aproximadamente iguales, se pregunta: ¿Cuál es la probabilidad de que una persona cualquiera sea heterocigota para por lo menos uno de esos genes? ¿Cuál es la probabilidad de que el hijo de primos en primer grado nazca afectado con retardo mental? Como la frecuencia global de retardo mental autosómico recesivo es del orden de 1/100 x 1/4 = 1/400 y existen por lo menos 100 loci que independientemente determinan el defecto, la frecuencia de un tipo cualquiera dentro de esos 100 es del orden de 1/40000, de donde se obtiene que la frecuencia promedio de uno de esos genes que en homocigosis produce retardo es 1/200. La frecuencia poblacional de heterocigotas para ese gen es por lo tanto 2pq = 2 x 199/200 x 1/200 = 1.99/200 = 0.00995 ≈ 0.01 = 1/100 = 2q. La probabilidad de que una persona cualquiera no sea heterocigota para ese gen es, por lo tanto, 0.99005 ≈ 0.99; la probabilidad de no ser heterocigota para ninguno de 0.366; y la de ser los 100 posibles genes es por lo tanto (0.99)100 = heterocigota para por lo menos uno de esos 100 genes es dada por la cantidad complementar 1 - 0.366 = 0.634. Como un matrimonio de primos tiene en promedio 1/8 de los genes por origen común (su coeficiente de parentesco, r = 2F vale 1/8), eso significa que una estimativa grosera del riesgo de retardo autosómico recesivo para la prole de primos en primer grado es dada por 0.634 x 1/8 x 1/4 = 0.0198; sumando a esa cifra la de 0.0075 referente al retardo por otros mecanismos no influenciables por la consanguinidad, se llega a un riesgo global del orden de 0.027 o cerca de 3%. Empleando las frecuencias estimadas de las dos formas no alélicas de albinismo universal recesivo (tirosinasa-positivo y tirosinasa negativo), respectivamente 1/15.000 y 1/30.000 entre negroides norte-americanos, 7 ¿Cuál es la frecuencia de albinos entre hijos de individuos no emparentados? ¿Y entre hijos de primos en primer grado? ¿Cuál es el riesgo de que un niño nazca afectado con albinismo, siendo que su padre (normalmente pigmentado) tiene dos hermanos albinos y su madre (también normal) es hija de un hombre afectado por albinismo tirosinasa-negativo? ¿Cuál es la probabilidad de que un tío de un afectado por albinismo sea heterocigota para el gen que determina la enfermedad? Entre hijos de individuos no emparentados entre si, la frecuencia de albinismo es P(aa o bb|ncon) = q12 + q22. Por lo tanto las frecuencias de los genes que determinan las dos variantes son q1 = √(q12) y q2 = √(q22). Entre hijos de primos en primer grado las frecuencias de afectados por las dos formas serán respectivamente q12 + p1q1F = q12 + q1(1-q1)/16 y q22 + p2q2F = q22 + q2(1-q2)/16. Los valores numéricos de esas expresiones, para q12 = 1/15000 q22= 1/30000, obtenidos del código BASIC anexo, son p(1) = 0.00816 p(2) = 0.00577 no cons. pr.pr.gr. -------------------------------------alb.ty+ 0.00007 0.00057 alb.ty0.00003 0.00039 -------------------------------------total 0.00010 0.00096 REM program filename albinism.bas CLS : DEFDBL A-Z paa1 = 1 / 15000:pbb1 = 1 / 30000 p(1) = SQR(paa1): p(2) = SQR(pbb1) paa2 = paa1 + p(1) * (1 - p(1)) / 16:pbb2 = pbb1 + p(2) * (1 - p(2)) / 16 PRINT USING "p(1) = #.#####"; p(1):PRINT USING "p(2) = #.#####"; p(2) PRINT " nao-cons. pr.pr.gr." PRINT "--------------------------------------" PRINT "alb.ty+ "; : PRINT USING "#.##### "; paa1; paa2 PRINT "alb.ty"; : PRINT USING "#.##### "; pbb1; pbb2 PRINT "--------------------------------------" PRINT "total "; : PRINT USING "#.##### "; paa1 + pbb1; paa2 + pbb2 El riesgo de un niño, de nacer afectado con albinismo, cuyo padre (normalmente pigmentado) tiene dos hermanos albinos y cuya madre (también normal) es hija de un hombre afectado por albinismo tirosinasa-negativo, es calculado de la siguiente manera: si el padre tiene dos hermanos albinos la probabilidad de que él sea heterocigota para el gen de albinismo es P(het|nl) = (1/2)/(1/4 + 1/2) = 2/3. Como la madre es heterocigota cierta para el gen del albinismo tirosinasa-negativo, es necesario que el padre sea heterocigota (2/3) para el gen de esa forma (probabilidad 1/3); por lo tanto el riesgo de albinismo para un niño del matrimonio es R = 1/3 x 2/3 x 1 x 1/4 = 1/18 = 0.0556 o cerca de 5.5%. Un tío del afectado por albinismo, tiene una probabilidad del 50% de poseer el gen en heterocigosis que ciertamente está presente en su hermano o hermana, progenitor/a del afectado. Cerca de 1/100 de todos los niños que nacen de matrimonios no consanguíneos son afectadas con retardo mental. Cerca de 1/4 de esos casos de retardo son condicionados por mecanismo hereditario autosómico recesivo. Existen, en la especie humana, cerca de l00 genes (situados en loci distintos) que en homocigosis determinan retardo mental. Suponiendo que todos esos genes ocurran con frecuencias aproximadamente iguales, 8 ¿Cuál es el valor del riesgo de retardo matrimonios de primos en primer grado? mental para la prole de Como la frecuencia global de retardo mental autosómico recesivo es del orden de 1/100 x 1/4 = 1/400 y existen por lo menos 100 loci que independientemente determinan el defecto, la frecuencia de un tipo cualquiera, dentro de esos 100, es del orden de 1/40000 en la población general, de donde se obtiene que la frecuencia promedio de uno de esos genes que en homocigosis produce retardo es 1/200. Para cada uno de esos loci, la frecuencia de afectados en la prole de primos en primer grado es q2 + q(1-q)/16 = 1/40000 + (199/16)/40000 = 1/40000 + 12.4375/40000 = 13.4375/40000 = 0.000335938. Como son como mínimo 100 loci, el riesgo de retardo recesivo en la prole de primos es 0.0335938 o 3.36%. Sumándose a ello el riesgo referente al retardo por otros mecanismos, 0.75%, se llega a la cifra global de 0.0413 o cerca de 4%. ¿Qué riesgo (para fenilcetonuria) darías para la prole de un matrimonio de primos en primer grado si el mismo ya tuviera un niño afectado por esa enfermedad? ¿Y si el afectado fuese un tío común de los consultantes? ¿Si el matrimonio se separa y la prima contrae nuevas nupcias con otro primo, ¿Cuál es el valor de riesgo para su prole? ¿Y se ella se casase con una persona normal no emparentada? Si ya existe un niño afectado en la prole, el riesgo para cualquier hijo siguiente se fija en 1/4 o 25%. Si el afectado fuera un tío común de los consultantes, la probabilidad de cada uno de los progenitores de los dos primos de ser heterocigota es 2/3. El riesgo de la enfermedad en la prole del matrimonio es entonces estimado en R1 = (2/3 x 1/2 x 1/2) x (2/3 x 1/2 x 1/2) = (1/3)2 x 1/4 = 1/36 = 0.02778 o cerca de 3%. Si la prima se casa con otro primo el riesgo continúa siendo el mismo, ya que el tío referido es hermano de los progenitores del matrimonio. Si ella se casara con una persona no emparentada, ella continúa con la probabilidad de 1/3 de ser heterocigota, pero la probabilidad de heterocigosis para su compañero caerá a 2pq ≈ 2q = 2/100 = 1/50, que es la frecuencia poblacional de heterocigotas para el gen de la fenilcetonuria. Así, el riesgo para la prole de ese matrimonio queda igual a R2 = 1/3 x 1/50 x 1/4 = 1/600 = 0.0017 o cerca de 0.2%, de modo que R1/R2 = 600/36 = 16.6 (o sea, el riesgo de enfermedad de la prole, en el caso de casamiento con primo, es cerca de 16-17 veces mayor que para el caso de un casamiento con una persona no emparentada). ¿Qué es el coeficiente de endocruzamiento F? El coeficiente de endocruzamiento F es la probabilidad de homocigosis por origen común (autocigosis) para un locus cualquiera en la prole de un matrimonio consanguíneo. Calcular el valor del coeficiente de endocruzamiento F para los individuos señalados con punto de interrogación en los tres heredogramas de abajo: 9 Para la primera de las genealogías el valor de F es 1/4. El padre del matrimonio de hermanos (el abuelo del futuro niño) puede ser AA, Aa o aa con probabilidades p2, 2pq y q2. Si él fuera AA (que denominaremos ApAm apenas para distinguir el origen paterno (p) o materno (m) del alelo, la probabilidad de que el hijo del matrimonio de hermanos nazca AA por origen común es P(AA,oc|abuelo=ApAm) = P(ApAp)+P(AmAm) = (1/2)4 + (1/2)4 = 1/8; si el abuelo fuera Aa, la probabilidad del niño de nacer AA por origen común es P(AA,oc|abuelo=Aa) = P(AA) = (1/2)4 = 1/16. Probabilidades idénticas se obtienen partiendo de la abuela del futuro niño. Como las probabilidades del abuelo o de la abuela de ser AA y Aa son p2 y 2pq respectivamente, la probabilidad final del nieto de nacer AA por origen común es P(AA,oc) = 2 x P(abuelo=ApAm) x P(AA,oc|abuelo=ApAm) + 2 x P(abuelo=Aa) x P(AA,oc|abuelo=Aa) = 2 x p2x 1/8 + 2 x 2pq x 1/16 = p2/4 + pq/4 = p/4. Por simetría, se deduce que la probabilidad del niño de nacer homocigota aa por origen común es P(aa,oc) = q/4. Por lo tanto, la probabilidad del niño de nacer AA o aa por origen común, o sea, la probabilidad de homocigosis por origen común para el locus (A,a), que es la definición del coeficiente de endocruzamiento, es F = P(AA,oc) + P(aa,oc) = P(oc) = p/4 + q/4 = 1/4. Para la segunda genealogía el coeficiente de endocruzamiento para la prole señalada es F = 4 x (1/2)6 + 4 x (1/2)4 = 1/16 + 1/4 = 1/4 (1 + 1/4) = 5/16 = 0.3125. En este caso, cuando los ascendientes comunes del matrimonio de progenitores del niño son también endocruzados (con un coeficiente de endocruzamiento F), la fórmula del coeficiente de endocruzamiento puede ser colocada bajo la forma F' = 1/4 (1 + F). Para la tercer genealogía, en la cual los progenitores del futuro niño son al mismo tiempo primos en primer y en tercer grado, F' = 1/16 + 1/64 = 5/64 = 0.078125 = 1/16 + 0.015625 ≈ 1/16. ¿Cuál es el riesgo de enfermedad recesiva determinada por un gen de frecuencia poblacional q = 0.01 en esas proles? ¿Cuál es el parentesco de los dos matrimonios consanguíneos del heredograma de la derecha? Como la frecuencia de individuos aa en la prole de consanguíneos es dada por P(aa|cons) = q2 + pqF = 0.0001 + 0.0099F, se aplican los valores de F iguales respectivamente a 1/4, 5/16 y 5/64; obtenemos sucesivamente 10 0.0026, 0.0032 y 0.0009. En la última genealogía los matrimonios consanguíneos son primos en primer grado y primos en primer y tercer grado. ¿Qué riesgo darías para la prole de un matrimonio de primos en primer grado sin ningún caso de enfermedad en la familia? Aplicando el método simplificado por el cual las frecuencias globales de afectados por enfermedades recesivas son 1% y 7% respectivamente en la prole de no consanguíneos y consanguíneos: enfermad rec qq enfermedad qq enfermedad + RM nocons 1% 3% 4% ppg 7% 9% 13% -------------------------------------------------------dif 6% 6% 9% Para las proles con un F cualquiera, el riesgo puede ser calculado a través de la fórmula R = 1% + dif(drec) + 2% + [1% + dif(rm)] = 3% + (99F)% + [1% + (48F)%]. Considerando apenas los defectos físicos, la fórmula se reduce a R1 = 3% + (99F)%; incluyéndose también retardo mental, se obtiene R2 = 4% + (99F)% + (48F)% = 4% + (147)%. La tabla debajo muestra los valores de esos riesgos para varios valores de F: F df df+rm ----------------------------1/ 4 0.28 0.41 1/ 8 0.15 0.22 1/ 16 0.09 0.13 1/ 32 0.06 0.09 1/ 64 0.05 0.06 1/ 128 0.04 0.05 1/ 256 0.03 0.05 1/ 512 0.03 0.04 0 0.03 0.04 ---------------------------La frecuencia de determinada enfermedad autosómica recesiva (genotipo aa) es 1/40000 = 0.000025 entre niños nacidos de matrimonios no consanguíneos. Sabiendo que en esa población el 99% de los casamientos ocurren entre personas no emparentadas entre si y el restante entre primos en primer grado, se pregunta: a) ¿Cuáles son las frecuencias de individuos AA, Aa y aa entre hijos de matrimonios no consanguíneos? y entre los hijos de primos en primer grado? Las frecuencias de individuos AA, Aa y aa entre hijos de matrimonios no consanguíneos son respectivamente p2, 2pq y q2, donde p = P(A) es la frecuencia del gen A y q = P(a) = 1 - p la frecuencia de su alelo a. Como q2 = 1/40000 = 0.000025, surge que q = √(q2) = 1/200 = 0.005 y p = 1-q = 199/200 = 0.995. Para esos valores de p y q, las frecuencias de los genotipos AA, Aa y aa son respectivamente d1 = P1(AA) = 39601/40000 = 0.990025, h1 = P1(Aa) = 398/40000 = 0.00995 ≈ 0.01 = 2p y r1 = P1(aa) = 1/40000 = 0.000025. Las frecuencias de individuos AA, Aa y aa entre hijos de matrimonios de primos en primer grado son respectivamente p2 + pqF = pF + p2(1-F), 2pq-2pqF = 2pq(1-F) y q2 + pqF = qF + q2(1-F); para F = 11 1/16, que es el coeficiente de endocruzamiento para hijos primer grado, p = 199/200 y q = 1/200, las frecuencias de AA, Aa y aa son respectivamente d2 = P2(AA) = 39613.4/40000 h2 = P2(Aa) = 373.1/40000 = 0.00932812 y r2 = P2(aa) = 0.00033594. de primos en los genotipos = 0.99033594, 13.4/40000 = b) ¿Cuál es la frecuencia de la enfermedad al nacimiento, en el conjunto de todos los niños que nacen en la población? Basta ponderar r1 y r2 por las frecuencias poblacionales de casamientos no consanguíneos y entre primos en primer grado, que son respectivamente 0.99 y 0.01. Obtenemos entonces d3 = P3(aa) = 0.99 x 0.000025 + 0.01 x 0.00033594 = 0.00002475 + 0.0000033594 = 0.000028. c) ¿Es correcto afirmar que 0.000025 es la frecuencia de la enfermedad al nacimiento, en la población general? por qué? Si, porque 28x10-6 es un valor del mismo orden de magnitud que 25x10-6: d3/d1 = 28.11/25 = 1.12, con error absoluto de 3 x 10-6. d) ¿Cuántas veces es mas probable que nazca un afectado por esa enfermedad respectivamente en la prole de matrimonios de tío(a)sobrina(o), medios-hermanos, primos dobles en primer grado y primos simples en primer grado, en relación a la prole de personas no emparentadas entre si? La respuesta es obtenida aplicando los valores de F, p y q en la fórmula (que podemos llamar de riesgo relativo o RR): RR = (q2 + Fpq)/q2 = 1 + Fp/q. Para hijos de matrimonios de primos, F = 1/16 y RR = 1 + 199/16 = 13.4375. La prole de todos los otros casamientos mencionados posee un coeficiente de endocruzamiento F = 1/8, de modo que ahora RR = 1 + 199/8 = 25.875. e) Sabiendo que el número promedio de hijos por afectado es de 75%, del promedio de los individuos normales de la misma población, ¿cuál es la tasa de eliminación de afectados aa por generación? ¿cuál es la tasa de eliminación de genes a por generación? y ¿cuál es la tasa de mutación µ del gen a [µ = P(A->a)/generación]? El número promedio de hijos por afectado dividido por el número promedio de hijos por control no afectado constituye una estimativa buena del valor adaptativo de la enfermedad. Por lo tanto, W = 1-s = 3/4 y s = 1/4. De los q2 = 1/40000 individuos afectados que aparecen por generación, sq2 = 1/160000 son eliminados, de modo que esta es la tasa de eliminación de individuos aa por generación. La tasa de eliminación de los genes a por generación tiene un valor idéntico, ya que cada vez que está siendo eliminado 1 afectado homocigota de entre 160000 individuos, están siendo eliminados 2 genes a de entre 320000 genes. Por lo tanto sq2 = 2/320000 = 1/160000 representa también la tasa de eliminación de genes a por generación. Admitiéndose que la población se encuentra en estado de equilibrio, como debe estar, la cantidad de genes eliminados por generación debe ser repuesta casi exactamente con igual cantidad de genes recién-introducidos en la población, por generación. Por lo tanto, la tasa de mutación del gen a, entendida como la probabilidad, por generación, de un gen A transformarse en a [µ = P(A->a)/generación], es también dada por µ = sq2 = 2/320000 = 1/160000. 12 En una población A, el coeficiente promedio de endocruzamiento es cero, mientras que en otra población B el coeficiente promedio de endocruzamiento es F = 0.3. Una determinada enfermedad autosómica recesiva ocurre con frecuencia de 1/10000 en la población A. Conociéndose que en ambas poblaciones los números promedios de hijos de afectados y no afectados son respectivamente 1.40 y 1.75, se pregunta: a) ¿Cuál es el coeficiente de selección (s = 1-W) de la enfermedad? El coeficiente de selección de la enfermedad es obtenido de s = 1 - W = 1 - 1.40/1.75 = 1 - 0.8 = 0.2. b) ¿Cuál es la tasa de mutación del gen que determina la enfermedad? La tasa de mutación del gen, que para genes recesivos es dada por µ = s.x, donde x es la frecuencia de afectados, es obtenida inmediatamente de µ = 0.2 x 1/10000 = 2 x 10-6, utilizando la frecuencia conocida de afectados en la población A. c) ¿Cuál es la frecuencia de afectados en la población B? Como en la población B el coeficiente de selección es el mismo que en la población A y como se trata del mismo gen en ambas poblaciones, es obvio que la tasa de mutación es la misma. Deducimos por lo tanto que la frecuencia de afectados en la población 2 sólo puede ser 1/10000. d) ¿Cuál es la frecuencia del gen en la población A? La frecuencia del gen recesivo en la población A, que se encuentra en régimen de panmixia, es qA = √(1/10000) = 1/100 = 0.01. e) ¿Cuál es la frecuencia del gen en la población B? En la población B la frecuencia de afectados no es dada por qB2 = 1/10000, ya que esa población presenta un coeficiente promedio de endocruzamiento F = 0.3, y si, por qB2 + qB(1-qB)F = qB2 - qB2F + qBF = qB2(1-F) + qBF = 0.7 qB2 + 0.3 qB = 1/10000. Resolviéndose la ecuación cuadrática 7000 qB2 + 3000 qB - 1 = 0 y despreciando la raíz negativa, obtenemos qB = [√(9028000)-3000]/14000 = 0.000333074 ≈ 1/3002. f) Interprete el por qué de la diferencia, si esta existe. En la población B la frecuencia del gen recesivo es 30 veces menor que la observada en la población A. Esto ocurrió porque la endogamia favorece la aparición de homocigotas afectados, provocando al inicio una elevada eliminación de ellos; esto a su vez genera una disminución de la frecuencia génica, la eliminación de los afectados va atenuándose con el pasar de las generaciones hasta llegar exactamente a los mismos niveles preexistentes, desde que el equilibrio depende de las fuerzas antagónicas de mutación y de selección. La frecuencia génica, que era qA en panmixia, de a poco se reduce a qB con la vigencia de endogamia. g) ¿Qué se concluye sobre la eficacia de las leyes o costumbres que prohíben o limitan los casamientos consanguíneos, a nivel poblacional? Con o sin endogamia la frecuencia de cualquier enfermedad recesiva será la misma, de modo que las leyes que limitan los casamientos consanguíneos 13 no tienen sentido alguno en el ámbito poblacional. Obviamente a nivel familiar la historia es otra y existen argumentos (que veremos oportunamente) que desaconsejan uniones consanguíneas. ENFERMEDADES CONDICIONADAS POR MECANISMO MONOGÉNICO: HERENCIA AUTOSÓMICA DOMINANTE El valor de la tasa de penetrancia del gen R de retinoblastoma es K = 0.8; el valor adaptativo de los afectados fue estimado en alrededor de 0.6. Mientras que el genotipo de todos los afectados con tumor bilateral es Rr, apenas 20% de los casos unilaterales son producidos por el mismo gen. Un matrimonio normal tiene un hijo afectado por el tumor. Se pregunta: a) ¿Cuál es el valor adaptativo promedio W de los heterocigotas Rr? Si W' = 0.6 es el valor adaptativo de los afectados y la penetrancia del gen dominante que lo determina es K = 0.8, el valor adaptativo W de todos los heterocigotas Rr es W = W'.K + 1.(1-K) = 0.6 x 0.8 + 1 x 0.2 = 0.68. b) ¿Cuál sería el valor de W si todos los afectados murieran sin dejar descendencia? Si todos los afectados murieran sin dejar descendencia, el valor adaptativo de los afectados seria W' = 0 y el valor adaptativo promedio de los heterocigotas se reduciría a W = 1-K y s = 1-W tomaría el valor K. Se concluye por lo tanto que si el gen fuera letal todas las veces que penetrase, el coeficiente de selección de los heterocigotas tomaría exactamente el valor de la tasa de penetrancia K. c) ¿Cuál es la probabilidad (valor literal) de que una persona cualquiera, normal, sea heterocigota para el gen R, suponiéndose que exista información sobre la normalidad de todos los ascendientes directos del individuo hasta siete generaciones atrás? Esa información ¿ya es suficiente para rotular el caso de un niño afectado como aislado? La probabilidad de que una persona cualquiera sea heterocigota Rr normal es dada por P(het,nl) = 2µ(1-K)/K. Esa fórmula es deducida sumando los términos 2µ(1-K), 2µ(1-K)2, 2µ(1-K)3, 2µ(1-K)4, ... . Como 1-K = 0.2, la suma de 2µ(1-K)i, de i = 1 a 8 (hasta siete generaciones atrás) es 2µ x 0.2499968, que no difiere en el orden de magnitud de 2µ x 0.25, valor exacto dado por la fórmula 2µ(1-K)/K. Por lo tanto, la información sobre la normalidad de los ascendientes directos durante siete generaciones nos permite tratar el caso como aislado. Es posible obtener la fórmula P(het,nl) = 2µ(1-K)/K aplicando el siguiente razonamiento: como un individuo heterocigota normal sólo puede serlo por haber recibido el gen (con probabilidad 1/2) que no penetró (con probabilidad 1-K) de un progenitor también heterocigota (padre o madre), o por ser el resultado de una mutación nueva (que ocurre con probabilidad 2µ por haberse originado en el cromosoma paterno o en el materno), podemos escribir la ecuación de recurrencia Pt+1(het,nl) = 2.Pt(het,nl).1/2.(1-K) + 2µ(1-K). Haciendo Pt+1(het,nl) = Pt(het,nl) = P(het,nl), se obtiene inmediatamente la fórmula P(het,nl) = 2µ(1-K)/K. 14 d) ¿y si se trata de una persona adoptada, sin ninguna información sobre sus ascendientes directos? En esta situación, en la fórmula de recurrencia de arriba tendremos todavía que considerar la posibilidad de que el individuo heterocigota normal haya recibido el gen de un progenitor afectado, que se reprodujo con probabilidad W' (valor adaptativo de los afectados) y transmitió el gen no penetrante al hijo: Pt+1(het,nl) = 2.Pt(het,nl).1/2.(1-K) + 2.Pt(het,af).W'.1/2.(1-K) + 2µ(1-K). Retirando los subscritos (en la hipótesis de equilibrio) y haciendo P(het,nl)/P(het,af)=(1-K)/K, obtenemos sucesivamente P(het,nl) = 2.Pt(het,nl).1/2.(1-K) + 2.Pt(het,nl).W'.1/2.K + 2µ(1-K) , P(het,nl).K.(1-W') = 2µ(1-K) y, finalmente, P(het,nl) = 2µ(1-K)/Ks' = 2µ(1-K)/s, ya que W = 1-s = W'K + (1-K) = (1-s')K + 1-K y por lo tanto Ks' = s. e) ¿Cuál es el valor de esa probabilidad para un individuo cuyo hijo es afectado por la forma bilateral? ¿y si el niño hubiera tenido la forma unilateral? La probabilidad de que un caso aislado cualquiera sea heredado es 1-K. De hecho, siendo A y B los progenitores de un afectado aislado, surge que (método de Bayes): A y B homoc. A o B het. Prob. a priori 1-4µ(1-K)/K ≈ 1 4µ(1-K)/K Prob. cond. (hijo af.) 2µK K/2 Prob. conjuntas P1 = 2µK P2 = 2µ(1-K) ------------------------------------------------------------Prob. a posteriori P(A,B hom|f af) P(A,B het|f af) = P1/(P1+P2) = K = P2/(P1+P2) = 1-K Por lo tanto, la probabilidad de que el individuo A sea heterocigota es ahora P(het,nl) = (1-K)/2. Si el niño tuviera la forma unilateral del tumor, con probabilidad de 20% = 1/5 de ser producido por el mismo gen que provoca retinoblastoma bilateral, la probabilidad detallada arriba se reduce ahora a P(het,nl) = (1-K)/10. f) ¿y si existieran dos hijos afectados por la forma bilateral?, ¿y si uno tuviera la forma bilateral y el otro la forma unilateral?, ¿y si los dos tuvieran el tipo de tumor unilateral? En esa situación hay seguridad de que el gen fue heredado (o sea, está presente con seguridad en uno de los dos progenitores, A o B) y la probabilidad de A (de la misma manera que B) de ser heterocigota es ahora 1/2. g) Para el caso de un niño afectado, ¿Cuál es el riesgo para un nuevo niño que tenga el matrimonio, en el caso de tratarse de un tumor bilateral? ¿Y si el tumor fuera unilateral? En el caso de un tumor bilateral, el riesgo es dado por R = K(1-K)/2, expresión que da el valor de 0.08 o 8% para una tasa de penetrancia K = 0.8. En el caso de tratarse de retinoblastoma unilateral, el riesgo R se reduce a 1/5 de esa cantidad o sea cerca de 0.016 o 1.6%. h) ¿y si el afectado tuviera un hermano normal? ¿Y si existieran n hermanos normales? 15 Para resolver este problema, basta adicionar una probabilidad condicional mas (de ocurrencia de n hermanos normales sobre las hipótesis {A y B homoc.} y {A o B het.}: A y B homoc. A o B het. Prob. a priori 1-4µ(1-K)/K ≈ 1 4µ(1-K)/K Prob. cond. 1 (hijo af.) 2µK K/2 Prob. cond. 2 (n hij. nl.) 1n = 1 [1/2 + (1-K)/2]n = [(2-K)/2]n Prob. conjuntas P1 = 2µK P2 = 2µ(1-K).[(2-K)/2]n ------------------------------------------------------------Prob. a posteriori P(A,B hom|1 af,n nl) P(A,B het|1 af,n nl) = P1/(P1+P2) = P2/(P1+P2) = K / = (1-K).[(2-K)/2]n / {K+(1-K).[(2-K)/2]n} {K+(1-K).[(2-K)/2]n} Como era de esperar, la fórmula para P(A,B het) se reduce a (1-K) si n = 0. Para n = 1 la fórmula para R se reduce a R = K.(1-K).[(2-K)/2] /2{K+(1-K).[(2-K)/2]}. Para K = 0.8 el valor de R es entonces 0.052 . i) ¿Qué tipo de informaciones sobre riesgo podría darse en caso de que el valor de la tasa de penetrancia del gen de retinoblastoma no fuese conocido? Podría decirse que, a pesar que el valor de la tasa de penetrancia no es conocido, es posible calcular el riesgo máximo de repetición de la enfermedad. En el caso de tratarse de un afectado aislado sin hermanos ese riesgo máximo es de 12.5%, que corresponde a un valor intermedio (K = 0.5) de la tasa de penetrancia. Como generalmente los valores de la tasa de penetrancia son altos, ese valor constituye en la práctica generalmente una sobre-estimación del riesgo real. Un matrimonio normal tiene un niño afectado por retinoblastoma. El casamiento se disuelve y el padre contrae nuevas nupcias con una mujer también normal no emparentada. Se pregunta: a) ¿Cuál es la probabilidad de que el nuevo matrimonio tenga un niño que presente retinoblastoma, y en el caso del niño del casamiento anterior ¿cuál es la probabilidad presente la forma bilateral? El riesgo ahora es dado por R = K(1-K)/4 en reduciéndose por lo tanto a cerca de 0.04 o 4%. vez de R = K(1-K)/2, b) ¿Y si el tumor fuera unilateral? Si el tumor fuera unilateral la fórmula se reduce a R = 1/5 . K(1-K)/4 = K(1-4)/20 = 0.008 o 0.8%, cantidad despreciable inferior a 1%. c) ¿Y si del primer casamiento hubieran nacido dos niños afectados? En este caso el hombre tiene una probabilidad de 1/2 de ser heterocigota no penetrante del par original. El riesgo de un niño afectado en su prole se eleva entonces a R = 1/2 . 1/2 . K = 0.2 o 20%. 16 Un hombre es afectado por retinoblastoma. Se pregunta: a) ¿Cuál es el riesgo de ocurrencia de retinoblastoma en su prole, en el caso de tratarse de la forma bilateral del tumor? En caso de tratarse de la forma bilateral y el propósito no tiene todavía hijos, el riesgo de retinoblastoma en su prole es estimado como R = K/2 = 0.4 o 40%, ya que todos los casos de retinoblastoma bilateral son determinados por un gen autosómico dominante con tasa de penetrancia K = 0.8. b) ¿Y si el tumor hubiera sido unilateral? En caso de un tumor unilateral el riesgo se reduce a 1/5 del calculado arriba, ya que para que el niño del propósito nazca afectado es necesario que el hombre sea heterocigota, que transmita el gen, siendo que es heterocigota, y que el gen penetre, siendo que fue transmitido: R = 1/5 x 1/2 x K = K/10 = 0.08 o 8%. c) ¿Y si el hombre ya tuviera un niño normal? Si ya existe un niño normal, ello pudo haber ocurrido de dos maneras diferentes: a) el hombre es homocigota rr con probabilidad igual a 80% y transmitió a su hijo el gen r con probabilidad 1, dado que es homocigota rr: la probabilidad conjunta favoreciendo la ocurrencia de esa primera hipótesis toma por lo tanto el valor P1 = 0.8 x 1 = 0.8; b) el hombre es un heterocigota Rr con probabilidad igual a 20% y su hijo es normal porque heredó el gen r de su padre con probabilidad condicional 1/2 o porque heredó el gen R y este no penetró, evento con probabilidad condicional (1-K)/2: la probabilidad conjunta P2 favoreciendo esa segunda hipótesis toma el valor P2 = 0.2 x (2-K)/2 = 0.12. La probabilidad a posteriori (final) de que el hombre es heterocigota toma por lo tanto el valor P(het|hijo nl) = P2/(P1+P2) = 0.12/0.92 = 3/23 = 0.1304 o cerca de 13%. Acabamos de constatar de esta forma, que la ocurrencia de un niño normal en su prole disminuye la probabilidad a priori de heterocigosis de 20 a 13%. El riesgo de afección para un futuro hijo de ese hombre queda determinado entonces como R = 3/23 x 1/2 x 4/5 = 12/230 = 0.052 o cerca de 5%. d) ¿Y si ese primer niño también fuera afectado? En ese caso queda demostrado que el hombre es en verdad un heterocigota Rr. Se impone un nuevo asesoramiento y el riesgo para cualquier niño subsiguiente se fija en K/2 = 0.4 o 40%. ENFERMEDADES CONDICIONADAS POR MECANISMO MONOGÉNICO: HERENCIA LIGADA AL X En un heredograma, existen dos hermanos (un hombre y una mujer) afectados por una enfermedad que puede ser producida por mecanismo autosómico dominante o ligado al X dominante. La madre de los afectados es también portadora de la enfermedad. El hombre afectado tiene cinco niños: un niño normal y cuatro niñas afectadas. La mujer afectada tiene dos hijos: un niño afectado y una niña normal. Cual de los dos mecanismos explica con mayor probabilidad la ocurrencia de los afectados en esa familia? Por qué? La prole de la mujer afectada no indica con probabilidad mayor uno de los dos mecanismos, dado que ha ocurrido, pueden perfectamente suceder bajo ambas hipótesis. La descendencia del hombre afectado indica, con una 17 probabilidad mayor, que se trata de mecanismo ligado al X dominante. De hecho, respecto a la combinación de sexos en los afectados y normales puede ocurrir por pura probabilidad bajo la hipótesis autosómica dominante, con probabilidad (1/2).(1/2)4 = (1/2)5 = 1/32, en caso de la hipótesis de mecanismo ligado al X dominante todos los niños tienen que ser normales mientras que todas las niñas tienen que ser afectadas: la probabilidad asociada al evento condicional es por lo tanto 1.(1)4 = 15 = 1. Por lo tanto, dada la configuración del heredograma, es 32 veces mas probable que se trate de un defecto dominante ligado al X que de un defecto autosómico. Normalizándose las probabilidades conjuntas 1/32 y 1, obtenemos inmediatamente P(ad) = 1/33 ≈3% y P(xd) = 32/33 ≈ 97%. La distrofia muscular progresiva de tipo Duchenne es una enfermedad producida por un gen letal recesivo ligado al cromosoma X. Siendo µ la tasa de mutación de ese gen, a) ¿Cuál es la probabilidad de que una mujer cualquiera sea heterocigota para ese gen? Esa probabilidad es obtenida de la ecuación de recurrencia Pt+1(het) = Pt(het)/2 + 2µ. En equilibrio, Pt+1(het) = Pt(het) = P(het) y la ecuación arriba se reduce a P(het) = P(het)/2 + 2µ, de donde se obtiene que P(het) = 4µ b) ¿Cuál es la frecuencia, al nacimiento, distrofia muscular progresiva tipo Duchenne? de niños afectados con Esa probabilidad es obtenida, ahora, de la ecuación de recurrencia Pt+1(afe) = Pt(het)/2 + µ. En equilibrio, Pt+1(het) = Pt(het) = P(het) y Pt+1(afe) = Pt(afe) = P(afe) y la ecuación de arriba se reduce a P(afe) = P(het)/2 + µ, de donde se obtienen que P(afe) = P(het)/2 + µ = 2µ + µ = 3 µ. c) ¿Cuál es la probabilidad de que un heterocigota, para el gen de la DMD, lo sea por mutación nueva? Como P(het) = 4µ = P(het)/2 + 2µ = 2µ + 2µ, concluimos inmediatamente que del total de heterocigotas (4µ), la mitad (2µ) lo son por haber heredado el gen (de una madre que también era heterocigota) y la mitad por (2µ) por mutación nueva ocurrida en un o otro cromosoma X que recibió de sus progenitores. Por lo tanto, P(her|het) = P(het,her) / [P(het,her) + P(het,mut)] = P(het,her)/P(het) = 2µ/(2µ + 2µ) = 1/2 y P(mut|het) = 1 P(her|het) = 1/2. d) ¿Cuál es la probabilidad de que una hermana de esa mujer sea también heterocigota? Dado que la propósito inicial es heterocigota, la probabilidad de su madre lo sea es de 1/2, como lo observado arriba. La probabilidad de que la hermana de la mujer sea heterocigota es por lo tanto 1/2 x 1/2 = 1/4. e) ¿Y de su madre? 1/2, como fue visto en los ítems anteriores. f) ¿Cuál es la probabilidad de que un afectado aislado, lo sea por mutación nueva? 18 Como fue visto más arriba, P(afe) = P(het)/2 + µ = 2µ + µ = 3µ. Por lo tanto, del total de afectados (3µ), una proporción 2µ heredó el gen, mientras que en la proporción restante µ la enfermedad fue producida por una mutación nueva ocurrida en el cromosoma X recibido de la madre. Luego, P(her|afe) = 2µ/(2µ + µ) = 2µ/3µ = 2/3 y P(mut|afe) = µ/(2µ + µ) = µ/3µ = 1/3. En el caso de la hemofilia clásica (deficiencia del factor VIII) o de la distrofia muscular progresiva tipo Becker, el valor adaptativo de los afectados fue estimado en alrededor del 70%. Responda a las preguntas a) hasta f) para ese caso. a) ¿Cuál es la probabilidad de que una mujer cualquiera sea heterocigota para los genes que producen esas enfermedades? Esta probabilidad es obtenida de las ecuaciones de recurrencia Pt+1(het) = Pt(het)/2 + 2µ + Pt(afe).W y Pt+1(afe) = Pt(het)/2 + µ. En la primera, W es el valor adaptativo de los afectados (probabilidad de éxito reproductivo de los afectados, en relación al de controles normales), que ahora es diferente de cero (como ocurría en el caso de la distrofia de Duchenne). Para obtener la expresión P(het), que ahora será una función de la tasa de mutación y del coeficiente de selección, formamos un sistema de dos ecuaciones a dos incógnitas [P(het) y P(afe)] utilizando las formas sobre hipótesis de equilibrio, P(het)/2 = 2µ + P(afe).W y P(afe) = P(het)/2 + µ. De esas dos ecuaciones surge que P(het)/2 = 2µ + P(afe).W = P(afe) - µ y, finalmente, P(afe).(1-W) = P(afe).s = 3µ, donde obtenemos que P(afe) = 3µ/s. Substituyendo ese valor en la expresión P(afe) = P(het)/2 + µ obtenemos P(het)/2 = 3µ/s - µ = µ(3-s)/s y P(het) = 2µ(3-s)/s. Nótese que las fórmulas recién deducidas, P(het) = 2µ(3-s)/s y P(afe) = 3µ/s, se aplican hasta en el caso s = 1, cuando se reducen respectivamente a P(het) = 2µ(3-1)/1 = 4µ y a P(afe) = 3µ/1 = 3µ. La respuesta a la pregunta es por lo tanto P(het) = 2µ(3-s)/s, que se reduce a P(het) = 2µ(3-0.3)/0.3 = 18µ cuando W = 1-s = 0.7, como en los casos de la hemofilia A y de la distrofia muscular de Becker. b) ¿Cuál es la frecuencia, al nacimiento, de niños afectados por la distrofia muscular progresiva tipo Becker (DMB)? Esta probabilidad ya fue deducida en el ítem anterior, tomando el valor literal P(afe) = 3µ/s. En el caso de la DMB, W = 1-s = 0.7 y la fórmula se reduce a P(afe) = 3µ/s = 3µ/0.3 = 10µ. c) ¿Cuál es la probabilidad de que una heterocigota para el gen de la DMB, lo sea por mutación nueva? Como P(het) = 18µ = P(het)/2 + 2µ = 16µ + 2µ, concluimos inmediatamente que del total de heterocigotas (18µ), una proporción 16µ hereda el gen (de una madre que también era heterocigota) y una proporción 2µ posee el gen por haber ocurrido mutación nueva en uno u otro cromosoma X que recibió de sus progenitores. Por lo tanto, P(her|het) = 16µ/(16µ + 2µ) = 8/9 y P(mut|het) = 1 - P(her|het) = 1/9. En el caso genérico de coeficiente de selección cualquiera de esas expresiones se reducen respectivamente a P(her|het) = (3-2s)/(3-s) y P(mut|het) = s/(3-s). 19 Nótese que realmente esas expresiones se reducen a P(her|het) = (32s)/(3-s) = (3-0.6)/(3-0.3) = 2.4/2.7 = 8/9 y P(mut|het) = s/(3-s) = 0.3/(3-0.3) = 0.3/2.7 = 1/9 cuando W = 1-s = 0.7. Además de eso, las fórmulas son válidas para el caso extremo de genes letales (s=1), ya que para s=1 se reducen respectivamente a P(her|het) = (3-2s)/(3-s) = (32)/(3-1) = 1/2 y P(mut|het) = s/(3-s) = 1/(3-1) = 1/2. d) ¿Cuál es la probabilidad de que una hermana de esa mujer sea también heterocigota? Dado que la propósito inicial es heterocigota, la probabilidad de su madre lo sea es 8/9, como se vio arriba. La probabilidad de que la hermana de la mujer sea heterocigota es por lo tanto 8/9 x 1/2 = 4/9. e) ¿Y de su madre? 8/9, como fue visto en los ítems anteriores. f) ¿Cuál es la probabilidad de que un afectado aislado, lo sea por mutación nueva? Como ya fue visto arriba, P(afe) = P(het)/2 + µ = 9µ + µ = 10µ. Por lo tanto, del total de afectados (10µ), una proporción 9µ heredó el gen, mientras que en la proporción restante µ, la enfermedad fue producida por mutación nueva ocurrida en el cromosoma X recibido de la madre. Luego, P(her|afe) = 9µ/(9µ + µ) = 9µ/10µ = 9/10 y P(mut|afe) = µ/(9µ + µ) = µ/10µ = 1/10. En el caso genérico del coeficiente de selección cualquiera de esas expresiones se reducen respectivamente a P(her|afe) = (3-s)/3 y P(mut|afe) = s/3. Nótese que realmente esas expresiones se reducen a P(her|afe) = (3-s)/3 = (3-0.3)/3 = 2.7/3 = 9/10 y P(mut|afe) = s/3 = 0.3/3 = 1/10 cuando W = 1-s = 0.7. Además de eso, las fórmulas son válidas para el caso extremo de genes letales (s=1), ya que para s=1 se reducen respectivamente a P(her|afe) = (3-s)/3 = (3-1)/3 = 2/3 y P(mut|afe) = s/3 = 1/3. La penetrancia del gen del síndrome de Martin-Bell entre niños de mujeres normales portadoras de la premutación del gen fue estimada en 80% para individuos hemicigotas para el gen y en 35% para heterocigotas. Una mujer normal tiene un hermano y un hijo afectados con el síndrome. ¿Cuál es el riesgo de que un niño cualquiera que tenga sea nuevamente afectado? Como la madre es una heterocigota verdadera para la premutación (X'X) y el padre normal (XY), los genotipos posibles en la prole, cada uno ocurriendo con probabilidad de 0.25 o 1/4, son XY, X'Y, XX y X'X. Como las tasas de penetrancia son K(X'Y) = 0.80 y K(X'X) = 0.35 para hemicigotos y heterocigotas hijos de una mujer portadora de la premutación, el riesgo de afección en la prole de esa mujer es R = P(X'Y,afe) + P(X'X,afe) = P(X'Y).K(X'Y) + P(X'X).K(X'X) = 0.25 x 0.80 + 0.25 x 0.35 = 1.15/4 = 0.2875 o cerca del 29%. Para niños descendientes de mujeres afectadas o no pero portadoras de la mutación completa, los valores de la penetrancia suben para 100 y 50%, en niños y niñas respectivamente. ¿Cuál es el riesgo de un niño afectado en la prole de tales mujeres? 20 Como la madre (afectada o no) es heterocigota verdadera para la mutación completa (X"X) y el padre es normal (XY), los genotipos posibles en la prole, cada uno ocurriendo con probabilidad de 0.25 o 1/4, son XY, X"Y, XX y X"X. Como las tasas de penetrancia son K(X"Y) = 1 y K(X"X) = 0.5 para hemicigotas y heterocigotas hijos de una mujer portadora de la mutación completa, el riesgo de afección en la prole de esa mujer es R = P(X"Y,afe) + P(X"X,afe) = P(X"Y).K(X"Y) + P(X"X).K(X"X) = 0.25 x 1.00 + 0.25 x 0.50 = 0.375 o 37.5%. Sabiendo que el valor adaptativo de los afectados por hemofilia es del orden de w = 7/10, ¿Cuál es el riesgo de repetición de la enfermedad en una hermana con un afectado y un niño y una niña normales? Calcule ese riesgo bajo las hipótesis alternativas de presencia y ausencia de información sobre la normalidad de ascendientes y colaterales del afectado. Bajo la hipótesis de presencia de información sobre la normalidad de ascendientes y de colaterales del afectado, las probabilidades finales favoreciendo las hipótesis de madre homocigota normal y heterocigota, dado que existen 1 hijo afectado, 1 hijo normal y 1 hija normal, son obtenidas aplicando el método de Bayes, partiendo de una probabilidad a priori P(het) = 4µ favoreciendo la hipótesis de heterocigosis para la madre: madre homoc. madre heter. Prob. a priori 1-4µ ≈ 1 4µ Prob. cond. 1 (hijo af.) µ 1/2 Prob. cond. 2 (hijo nl.) 1 1/2 Prob. cond. 3 (hija nl.) 1 1 Prob. conjuntas P1 = µ P2 = µ ------------------------------------------------------------Prob. a posteriori P(madre hom|cond) P(madre het|cond) = P1/(P1+P2) = 1/2 = P2/(P1+P2) = 1/2 El riesgo para un próximo niño es evidentemente dado por R = P(madre het|cond).1/4 = 1/2 x 1/4 = 1/8 = 0.125 o 12.5%. Bajo la hipótesis de ausencia de información sobre la normalidad de ascendientes y colaterales del afectado, las probabilidades finales favoreciendo las hipótesis de madre homocigota normal y heterocigota, dado que existen 1 hijo afectado, 1 hijo normal y 1 hija normal, son obtenidas aplicando inmediatamente el método de Bayes exactamente como arriba, partiendo ahora de una probabilidad a priori P(het) = 18µ favoreciendo la hipótesis de heterocigosis para la madre: madre homoc. madre heter. Prob. a priori 1-18µ ≈ 1 18µ Prob. cond. 1 (hijo af.) µ 1/2 Prob. cond. 2 (hijo nl.) 1 1/2 Prob. cond. 3 (hija nl.) 1 1 Prob. conjuntas P1 = µ P2 = 9µ/2 ------------------------------------------------------------Prob. a posteriori P(madre hom|cond) P(madre het|cond) = P1/(P1+P2) = 2/11 = P2/(P1+P2) = 9/11 21 El riesgo para un próximo niño es evidentemente dado por R = P(madre het|cond).1/4 = 9/11 x 1/4 = 9/44 = 0.2045 o poco mas de 20%. Un individuo hemofílico se casa con su sobrina (hija de una hermana del afectado). Sabiendo que el valor adaptativo de la hemofilia es w = 0,7, responda las preguntas siguientes bajo las hipótesis alternativas de presencia y ausencia de información sobre la normalidad de ascendientes y colaterales del afectado: ¿Cuáles es la probabilidad de que la enfermedad en el afectado resulte de una mutación nueva? P(mut|afe) = 1/3 y P(mut|afe) = 1/10, respectivamente bajo las hipótesis de presencia o ausencia de informaciones sobre la normalidad de los ascendientes y colaterales del afectado. ¿Cuáles son las probabilidades de que heterocigota para el gen de la hemofilia? la madre del afectado sea P(het|niño afe) = 2/3 y P(het|niño afe) = 9/10, respectivamente bajo las hipótesis de presencia o ausencia de informaciones sobre la normalidad de los ascendientes y colaterales del afectado. Obviamente esas también son las probabilidades de que la enfermedad en el afectado resulte de un gen transmitido: por eso son exactamente complementarias a las cifras de la pregunta anterior. ¿Cuáles son las probabilidades(en las dos hipótesis del enunciado) de que la sobrina del afectado sea heterocigota para ese mismo gen? Esas probabilidades son dadas respectivamente por P(het|niño afe).1/2.1/2 = 2/3 x 1/4 = 1/6 y P(het|niño afe).1/2.1/2 = 9/10 x 1/4 = 9/40 = 0.225 o 22.5%. ¿Cuál es la probabilidad de que un nuevo hijo sea afectado por la enfermedad? ¿Cuál es el riesgo de que una nueva hija nazca afectada? ¿Cuál es el riesgo de que un hijo nazca afectado por hemofilia? Las probabilidades de niño afectado, niña afectada o hijo afectado son iguales, tomando el valor 1/6 x 1/2 = 1/12 = 0.083 y 9/40 x 1/2 = 9/80 = 0.1125 respectivamente en las dos situaciones del enunciado. Un matrimonio tiene tres niños y dos niñas. Dos de ellos (los más viejos) son normales y el más joven es afectado por distrofia muscular progresiva de Duchenne (DMD). Es realizado un dosaje de las enzimas séricas CK (creatino-quinasa) y PK (piruvato-quinasa) en la madre de los tres niños. Sabiendo que estas dos enzimas se encuentran elevadas en el 80% de las heterocigotas verdaderas para el gen de la DMD y en un 5% de las mujeres homocigotas normales, se pregunta: ¿Cuál es la probabilidad de que la madre sea heterocigota si sus enzimas estuvieran en niveles normales? Y si las enzimas estuvieran en niveles elevados? Bajo la hipótesis de niveles enzimáticos normales, las probabilidades finales favoreciendo las hipótesis de que la madre sea homocigota normal y heterocigota, dado que existen 1 hijo afectado, 2 hijos normales y 2 hijas normales, son obtenidas aplicando el método de Bayes, partiendo de 22 una probabilidad a priori P(het) heterocigosis para la madre: = 4µ favoreciendo la hipótesis de madre homoz. madre heter. Prob. a priori 1-4µ ≈ 1 4µ Prob. cond. 1 (hijo af.) µ 1/2 Prob. cond. 2 (2 hijo nls.) 12 = 1 (1/2)2 Prob. cond. 3 (2 hijas nls.) 12 = 1 12 = 1 Prob. cond. 4 (enz. nls.) 95/100 = 19/20 1/3 Prob. conjuntas P1 = 19µ/20 P2 = µ/6 ------------------------------------------------------------Prob. a posteriori P(madre hom|cond) P(madre het|cond) = P1/(P1+P2) = 0.851 = P2/(P1+P2) = 0.149 En la hipótesis de niveles enzimáticos elevados, las probabilidades finales favoreciendo las hipótesis de madre homocigota normal y heterocigota, dado que existen 1 hijo afectado, 2 hijos normales y 2 hijas normales, son obtenidas, como se mostró arriba, aplicando el método de Bayes, partiendo de una probabilidad a priori P(het) = 4µ favoreciendo la hipótesis de heterocigosis para la madre y ahora utilizando las probabilidades condicionales de enzimas elevadas en el suero: madre homoc. madre heter. Prob. a priori 1-4µ ≈ 1 4µ Prob. cond. 1 (hijo af.) µ 1/2 Prob. cond. 2 (2 hijo nls.) 12 = 1 (1/2)2 Prob. cond. 3 (2 hijas nls.) 12 = 1 12 = 1 Prob. cond. 4 (enz. ele.) 5/100 = 1/20 2/3 Prob. conjuntas P1 = µ/20 P2 = µ/3 ------------------------------------------------------------Prob. a posteriori P(madre hom|cond) P(madre het|cond) = P1/(P1+P2) = 0.130 = P2/(P1+P2) = 0.870 ¿Cuáles son las probabilidades de que un nuevo niño que el matrimonio tenga nazca afectado en las dos situaciones anteriores? En ambos casos el riesgo es dado evidentemente por R = P(madre het|cond).1/4, que se reduce respectivamente a 0.149/4 = 0.037 en el primero y a 0.870/4 = 0.217 en el segundo. ENFERMEDADES PRODUCIDAS POR MECANISMO CROMOSÓMICO Cerca de 15% (aproximadamente 1/7) de todos los embarazos terminan en abortos espontáneos. Tres parejas procuran un servicio de asesoramiento genético. El único embarazo del primer matrimonio terminó en aborto espontáneo en el primer trimestre. La segunda y la tercera pareja tuvieron dos embarazos cada una, que resultaron en un niño normal y en un aborto; y en dos abortos respectivamente. ¿Cuáles son las probabilidades asociadas a las tres historias reproductivas descriptas? ¿Está indicado el estudio citogenético de alguna de esas parejas? Por qué? Las probabilidades asociadas a las tres historias reproductivas son = 0.150, P(2) = respectivamente P(1) = C(1,1).(0.15)1.(0.85)0 1 1 C(1,2).(0.15) .(0.85) = 0.255 y P(3) = C(2,2).(0.15)2.(0.85)0 = 0.022, que obtenemos inmediatamente de la tabla de abajo (Otto y cols., 1998). 23 Apenas en el último matrimonio está indicado el estudio citogenético, ya que P(3) < 0.05. Probabilidad de ocurrencia de n abortos espontáneos en N embarazos, tomando como 0.15 la probabilidad de ocurrencia en la población de un aborto espontáneo. N n 1 2 3 4 5 6 7 8 1 0,150 2 0,255 0,022 3 0,325 0,057 0,005 4 0,368 0,098 0,011 0,001 5 0,392 0,138 0,024 0,002 0,000 6 0,400 0,176 0,041 0,005 0,000 7 0,396 0,210 0,062 0,011 0,001 0,000 0,000 8 0,385 0,238 0,084 0,018 0,003 0,000 0,000 0,000 9 0,368 0,259 0,107 0,028 0,005 0,001 0,000 0,000 9 0,000 0,000 La probabilidad de un embarazo cualquiera de terminar en aborto reconocible en la población general es alta, habiendo sido estimada en cerca de 1/7 o cerca de 15%. Por otro lado, el cariotipo 45,X es el más frecuentemente encontrado en abortos espontáneos. Cuando más temprana es la pérdida gestacional, mayor es la probabilidad de que el concepto eliminado presente esa constitución cromosómica. Eso permitió estimar que la frecuencia del cariotipo 45,X en el estadio de cigoto es del orden de 2% (o sea, aproximadamente 1/50 de todas las fecundaciones originan cigotos con el cariotipo encontrado en el síndrome). La frecuencia del síndrome de Turner al nacimiento fue estimada en cerca de 1 afectado entre cada 10000 niños de ambos sexos. La literatura, por otro lado, registra cerca de 60 casos de mujeres con síndrome de Turner que, probablemente por ser casos de mosaicismo 45,X/46,XX, consiguieron quedar embarazadas. Supongamos que una mujer con un mosaicismo 45,X/46,XX con 20% de células monosómicas y 80% de células normales se embarace. Se pregunta: ¿Cuál es la probabilidad de que un óvulo de esta mujer no contenga ningún cromosoma X (haga el cálculo suponiendo que los ovocitos X tienen la misma probabilidad de completar la división meiótica que los ovocitos con dos X)? ¿Cuál es el riesgo de que una niña que nazca de esa mujer sea portadora de cariotipo 45,X? Teniendo en vista todo esto, ¿indicarías la aplicación de técnicas de diagnóstico prenatal durante la gestación de esa mujer? Por qué? Las probabilidades de óvulos X y 0 son 0.8 + 0.2/2 = 0.9 y 0.2/2 = 0.1. Cigotos normales (XX o XY), monosómicos para el X (XO) y conteniendo apenas el cromosoma Y (Y0) ocurrirán, en el momento de la fecundación, con probabilidades respectivas 0.9, 0.05 y 0.05. Como las viabilidades de esos cigotos son respectivamente 0.85, (1/1000)/(1/50) = 50/1000 = 1/200 = 0.005 y 0, al nacimiento ocurrirán apenas niños cariotípicamente normales y portadoras del síndrome de Turner con probabilidades respectivas 0.9 x 0.85 /(0.9 x 0.85 + 0.05 x 0.005) = 0.765 / (0.765 + 0.00025) = 0.765/0.76525 = 0.99967 y 0.00025 / (0.765 + 0.00025) = 0.00033 o cerca de 3%, riesgo de un orden de magnitud despreciable. ¿Por qué se estudia de rutina el cariotipo de niños con sospecha de síndrome de Down, si su diagnóstico es de los menos problemáticos desde el punto de vista clínico? 24 Porque en casos de síndrome de Down producidos heredadas de uno de los progenitores el riesgo aumentado. por translocaciones de repetición está ¿Qué tipos de gametas puede, teóricamente, producir un portador de una translocación equilibrada 21/D? ¿Con qué probabilidades? ¿Por qué el riesgo de repetición del síndrome de Down es menor en la prole de hombres portadores de translocación que en la de mujeres en la misma condición? ¿Cuáles son esos riesgos? ¿Por qué los riesgos empíricos del ítem anterior son menores que el riesgo teórico? ¿Cuál es el valor de este? ¿Por qué? Gametas (21, D), (21/D), (21, 21/D), (D), (D, 21/D) y (21) con probabilidades iguales de 1/6 cada una. El riesgo de repetición en la prole de hombres portadores de la translocación equilibrada (cerca de 5%) es menor que el de mujeres en la misma condición (riesgo de 15 a 20%) porque los espermatozoides (70 a 80 x 106 por ml de eyaculación promedio total de 3 a 3.5 ml) son el elemento activo en la fecundación y probablemente los portadores de aneusomias poseen desventajas frente a los normales. Ambos riesgos descritos arriba son empíricos y difieren del teórico, estimado en 1/3, probablemente porque la viabilidad de cigotos, embriones y fetos con trisomía del 21 es menor que la de conceptos cariotípicamente normales. El riesgo teórico es 1/3 porque, de los seis tipos de cigotos resultantes de la combinación de las gametas producidas por portadores de la translocación en estado equilibrado con lo producido por su compañero (21, D), apenas tres son viables [(21,21,D,D), (21,21/D,D) y (21,21,21/D,D)] y uno de ellos (21,21,21/D,D) resulta en niño afectado con síndrome de Down. ¿Cuál es el riesgo de repetición de un caso de síndrome de Down cuya análisis cariotípico mostró la presencia de una translocación 15/21? Depende. Si la translocación fuera esporádica (presente apenas en el niño), el riesgo de repetición es cerca de 1%. Si el padre fuera portador de la translocación equilibrada, el riesgo de repetición es estimado en 5%; si la translocación estuviera presente en la madre, el riesgo se establece en 15%. ¿Por qué los riesgos de recurrencia de síndrome de Down son siempre mayores que los de ocurrencia en la prole de mujeres de la misma franja etaria? Porque entre las mujeres que ya tuvieron niños afectadas por síndrome de Down por trisomía simple, existen evidentemente más casos de mosaicismo y de portadoras de genotipos que favorecen la no disyunción, que entre las mujeres de la misma edad que no tuvieron niños con el defecto. Si admitimos que las frecuencias de mujeres portadoras de mosaicismo y de genes para no disyunción sean ambas del orden de 1/1000 y que la probabilidad de un niño afectado por este síndrome en la prole de esas mujeres sea de cerca de 1/10, surge que el riesgo en la población de que nazca un niño con síndrome de Down es de 0.001 x 0.1 + 0.001 x 0.1 + 0.98 x 1/500 = 0.0001 + 0.0001 + 0.00196. Dado, ahora, que ya nació un niño con síndrome de Down, la probabilidad de que la madre sea portadora de mosaicismo o de genes para no disyunción queda determinada como 0.0002/(0.0002+0.00196) = 0.0926. El riesgo de repetición del síndrome de Down en la prole de tales mujeres queda siendo, entonces, 0.0926 x 0.1 + 0.9074 x 1/500 = 0.011 o cerca del 1%. 25 Un matrimonio tiene un primer niño afectado por síndrome de Down con trisomía por translocación 21/21. Esta misma translocación está presente en estado equilibrado en el padre del niño. El médico del matrimonio aconsejó a la mujer someterse a una biopsia de vellosidades coriónicas en la eventualidad de un nuevo embarazo. ¿Qué piensas de esta orientación? Si la translocación es 21/21 y si estuviera en estado equilibrado en el padre del niño, es señal de que los espermatozoides que producirá tendrán el cromosoma 21 en dosis doble o no tendrán ningún cromosoma 21. Espermatozoides nulisómicos para el 21 originaran cigotos monosómicos inviables para el 21. Concluimos por lo tanto que toda vez que esta mujer se embarace el concepto será fatalmente trisómico para el cromosoma 21. Es claro que si fueras el médico dueño de un servicio de diagnóstico prenatal podrías decirle a la familia que es importante hacer el examen para verificar si todo esto es en verdad cierto. ENFERMEDADES CONDICIONADAS POR MECANISMO MULTIFACTORIAL ¿Qué entiendes por umbral de predisposición? Se admite que los sistemas poligénicos, cuando son íntegros, protegen adecuadamente el desarrollo embrionario contra factores ambientales nocivos; pero que, si varios genes deletéreos estuvieran presentes, tal protección puede debilitarse al punto de que los factores ambientales adversos, banales en condiciones normales, desencadenen defectos congénitos. En el mecanismo multifactorial existe, por lo tanto, un umbral de predisposición hereditaria, que, si fuera superado como consecuencia del acumulo de poligenes detrimentales, torna propenso al individuo a desarrollar determinada malformación congénita, en la dependencia de la existencia de factores ambientales nocivos. La estenosis hipertrófica de píloro y la luxación congénita de cadera? son dos enfermedades con umbrales bastante diferentes en los dos sexos. ¿Por qué el riesgo de ocurrencia de la enfermedad en la prole de un afectado perteneciente al sexo menos frecuentemente afectado por el defecto es mayor que en la situación inversa? ¿Por qué el riesgo es mayor cuando el defecto en el progenitor es mas grave? Como los umbrales son diferentes en los dos sexos, individuos pertenecientes al sexo menos frecuentemente afectado en la población están de alguna forma mas protegidos contra el defecto, de modo que necesitan, para ser afectados, recibir una carga de genes deletéreos mayor que los individuos pertenecientes al sexo mas comúnmente afectado. Eso explica el hecho de que el riesgo de repetición en la familia sea mayor cuando el propósito pertenece al sexo menos frecuentemente afectado en la población. De igual manera, cuanto más grave el defecto, más genes deletéreos recibió el afectado de sus progenitores; debido a eso, progenitores de casos más graves poseen riesgo mayor de repetición del defecto en su prole que el de progenitores de casos de defectos más leves. ¿Cómo se calcula el riesgo de recurrencia en enfermedades condicionadas por mecanismo multifactorial? ¿Qué nombre recibe ese riesgo y por qué? De que orden de magnitud es ese riesgo generalmente? El riesgo de recurrencia es calculado verificando la frecuencia de afectados entre todos los hermanos nacidos después de los propósitos de 26 las familias. Ese riesgo recibe el nombre de empírico porque es calculado directamente de datos muestrales, sin tener que echar mano a ningún modelo teórico. Generalmente el orden de magnitud de ese riesgo se sitúa entre 1-2 y 10%, con frecuencia modal del orden de 4-5%. ¿Cómo orientarías a un matrimonio que ya tuvo anencefalia? ¿Cuál es la causa de ese defecto? un niño portador de Las anomalías resultantes de defectos de cierre del tubo neural (anencefalia, meningomielocele y espina bífida) están relacionadas, ya que las familias que presentan casos de una de ellas son más propensas a presentar casos de la otra. La incidencia de la anencefalia es de 1-2 por 1.000 nacimientos y de la espina bífida, de 3 por 1.000. Los dos defectos ocurren con frecuencia dos veces mayor en niños del sexo femenino. El riesgo de recurrencia de una u otra anomalía para un nuevo niño hermano del afectado aislado es del orden de 4%. Cuando existen dos afectados en la hermandad, el riesgo sube a 10%. Se recomienda todavía que las mujeres que ya tuvieron un niño con ese defecto se sometan a una suplementación de ácido fólico, en la dosis de 4mg/día, durante por lo menos un mes antes de embarazarse nuevamente y que mantengan la medicación durante los tres primeros meses de la gestación. Con eso el riesgo de repetición se reduce a la mitad aproximadamente. ¿Y un matrimonio con un hijo con hidrocefalia? ¿Cuál es la causa de ese defecto? El riesgo de recurrencia de la hidrocefalia multifactorial para un nuevo niño hermano del propósito es de 5%. En contraste, la incidencia en la población general es de 3 por mil, sin contar los casos infecciosos y debidos a un tumor intracraneano. Es importante recordar, entretanto, que hay tipos de hidrocefalia que son producidos por genes autosómicos recesivos (hidrocefalia debida a la atresia del orificio de Luschka o de Magendie) y otro tipo determinado por un gen recesivo ligado al X (hidrocefalia por estenosis congénita del acueducto de Sylvius). En ambos casos, el riesgo de recurrencia se eleva a cifras del orden de 25%. ¿Y un matrimonio con un pariente afectado por retardo mental? ¿Cuáles son las causas de ese problema? Los orígenes del retardo mental (RM) son varios y, con frecuencia, difíciles de descubrir. Pueden ser genéticos (anomalías cromosómicas, monogenes dominantes, recesivos, ligados al cromosoma X, poligenes) o ambientales (prenatales, perinatales y postnatales). Casi todas las alteraciones estructurales de los cromosomas, sea por falta o por exceso de material genético, desequilibran el delicado sistema poligénico que condiciona la inteligencia. El RM es raro y, cuando existe, es leve en los síndromes de un X o tres X en mujeres, en la del doble Y en el hombre, en las translocaciones equilibradas y en algunos mosaicismos. En las otras anomalías trisomías, deleciones, duplicaciones, translocaciones no equilibradas - el RM ocurre en grado diverso. De entre las trisomías autosómicas, la de pronóstico menos sombrío para la rehabilitación es la del cromosoma 21 (síndrome de Down). Varían, de caso a caso, el grado del RM y las posibilidades de educación. Muchos síndromes hereditarios, mal formativos o no, incluyen el RM entre sus señales. Varios, como la fenilcetonuria y la galactosemia, derivan de defectos metabólicos autosómicos recesivos. Otras son autosómicas dominantes. La afección de RM mas frecuente después del síndrome de Down 27 es el síndrome del X frágil, debido a un gen dominante con penetrancia incompleta ligado al cromosoma X. Varias substancias tóxicas o medicamentosas, usadas en los tres primeros meses de gestación, pueden producir afecciones. Gestantes alcohólicas pueden tener niños con el síndrome fetal alcohólico en el que una reducción del CI (50 a 80) acompaña las señales físicas, como atraso de crecimiento, microcefalia discreta, compromiso de movimientos delicados, irritabilidad e hiperactividad, soplo cardíaco. Infecciones en la gestante por virus pueden perjudicar al niño. El síndrome de la rubéola fetal es el más importante. Produce defectos variados, especialmente microcefalia, oligofrenia, sordera, catarata, estenosis pulmonar. Toda mujer que nunca tuvo rubéola debe vacunarse antes de la primera gestación. Entre las causas perinatales, están la prematuridad, el parto distócico con hipoxia o anoxemia, la incompatibilidad materno-fetal Rh y la hiperbilirrubinemia, que puede lesionar centros encefálicos. Las causas postnatales son traumatismos con lesión del sistema nervioso central, envenenamientos, perturbaciones vasculares o degenerativas cerebrales, convulsiones. Es causa significativa de RM, en los países en desarrollo, la desnutrición, tanto de la gestante como del propio niño. La carencia emocional interfiere con la manifestación de la inteligencia explícita, produciendo desempeño retardado en niños intrínsecamente normales. Otras veces se atribuye un atraso de aprendizaje o RM, cuando deriva, de hecho, de dificultades de audición o de visión. Delante de un caso aislado de RM sin indicación alguna de su etiología, se aplican riesgos empíricos de recurrencia, que son del orden de 6% para parientes en primer grado (hijos, hermanos) de afectados y de 2.5% para parientes en segundo grado (sobrinos). Para parientes mas alejados el riesgo no difiere en orden de magnitud de aquel de la población general, que es del orden de 1%. ¿Por qué la tasa de concordancia en gemelos dicigóticos (5%) es ligeramente superior al riesgo de recurrencia de labio leporino para hermanos de afectados (4%)? La tasa de concordancia entre gemelos DZ es ligeramente superior al riesgo de recurrencia para hermanos porque el ambiente prenatal de los gemelos DZ es más homogéneo de aquel de dos hermanos nacidos en épocas diferentes. ENFERMEDADES Y DEFECTOS ETIÓLÓGICAMENTE HETEROGÉNEOS Existen cerca de 30 loci capaces de albergar genes autosómicos recesivos para sordera. Suponiendo que todos esos genes ocurran con frecuencias aproximadamente iguales y que la frecuencia de sordera autosómica recesiva sea del orden de 0.00075 al nacimiento en la población general, ¿cuántas veces es más probable que nazca un niño con ese tipo de sordera en la prole de primos en primer grado que en la de matrimonios no consanguíneos? La frecuencia al nacimiento de cada uno de los 30 tipos diferentes de sordera autosómica recesiva es 0.00075/30 = 0.000025. De ahí obtenemos que la frecuencia de cualquiera de esos genes es q = √(0.000025) = 0.005 = 1/200. Por lo tanto, en relación a cualquiera de esos tipos de sordera recesiva (y también en relación al total de casos de sordera recesiva) existirán (q2+pqF)/q2 = 1+pF/q = 1+199/16 = 13.4375 veces mas afectados en la prole de primos de que en la prole de personas no emparentadas entre si. 28 Cerca de 25% de los casos de una determinada enfermedad son producidos por mecanismo autosómico recesivo y los restantes por mecanismo autosómico dominante con penetrancia incompleta (K = 0.80). Sabiendo que en la población cerca del 1% de los casamientos ocurren entre primos en primer grado y el restante entre personas no emparentadas, se pregunta: ¿cuál es el riesgo de repetición de la enfermedad en la prole de un matrimonio no consanguíneo que ya tiene un niño afectado? ¿Y si el matrimonio fuera de primos en primer grado? ¿Y si nace un segundo niño también afectado? Si el matrimonio fuera no consanguíneo, el riesgo de repetición de la enfermedad es calculado según R = 25% x 1/4 + 75% x K(1-K)/2 = 1/16 + 3/4 x 2/25 = 1/16 + 3/50 = 98/800 = 0.1225 o 12.25%. Si el matrimonio fuera de primos en primer grado, las probabilidades a priori 0.25 y 0.75 favoreciendo las hipótesis de mecanismo recesivo y dominante se alteran, ya que la ocurrencia de consanguinidad parental aumenta la probabilidad de tratarse de la variante recesiva. De hecho, en esa eventualidad, para una frecuencia q = 0.01 como la obtenida, la probabilidad de ocurrencia de prole afectada está 7.1875 veces aumentada en relación a la situación de ausencia de consanguinidad. Por lo tanto, las probabilidades a priori favoreciendo las hipótesis recesiva y dominante no estarán mas entre si como 1/4 = 0.25 y 3/4 = 0.75, pero si como 7.1875 x 1/4 = 1.796875 para 1 x 3/4 = 0.75, de modo que ahora P(rec) y P(dom) valen 0.7055 y 0.2945. El riesgo de repetición de la enfermedad es entonces calculado según R = 0.7055 x 0.25 + 0.2945 x 0.08 = 0.1999 o cerca de 20%. Si nace un segundo niño afectado (probabilidad 1/4 = 0.25 en la hipótesis de mecanismo recesivo y probabilidad 2/5 = 0.40 en la hipótesis dominante) esas dos tasas de segregación van a interferir en las probabilidades a priori 0.25 y 0.75 favoreciendo las hipótesis AR y AD: las probabilidades favoreciendo esos dos mecanismos quedan entonces entre si así como 1/4 x 1/4 = 0.0625 y 3/4 x 2/5 = 0.30, de modo que P(rec) = 0.0625/0.3625 = 0.1724 y P(dom) = 0.30/0.3625 = 0.8276. El riesgo para un niño siguiente queda determinado por lo tanto como R = P(rec).R(rec) + P(dom).R(dom) = 0.1724 x 0.25 + 0.8276 x 0.4 = 0.3741. En la hipótesis de consanguinidad parental presente, las probabilidades 0.7055 y 0.2945 anteriormente determinadas quedan entre si como 0.7055 x 1/4 = 0.176375 y 0.2945 x 2/5 = 0.1178, de modo que ahora P'(rec) = 0.176375/0.294175 = 0.5996 y P'(dom) = 0.1178/0.294175 = 0.4004. El riesgo para un nuevo niño del matrimonio es R = P'(rec).R(rec) + P'(dom).R(dom) = 0.5596 x 0.25 + 0.4004 x 0.4 = 0.3001 o cerca de 30%. De un matrimonio normal nace un niño afectado con una enfermedad genéticamente heterogénea y letal. Se sabe que 1/10 de los casos de la enfermedad son producidas por mecanismo hereditario autosómico dominante de penetrancia igual a 4/5, 1/5 por mecanismo autosómico recesivo, 3/10 por mecanismo ligado al X recesivo y 2/5 constituyen fenocopias con riesgo despreciable de repetición. ¿Cuál es el riesgo de repetición de la enfermedad en un próximo niño que el matrimonio tenga? Suponiéndose que un nuevo hijo (un niño) nazca igualmente afectado, ¿Cuál es el riesgo para un tercer niño? ¿Y si el segundo hijo afectado fuera una niña? El riesgo para un segundo niño afectado es obtenido ponderando los riesgos apropiados a cada mecanismo (Rx) por las probabilidades a priori favoreciendo cada uno de los mecanismos (Px) y sumando esos productos: Px Rx Px.Rx ---------------------------------------------------AD 1/10 K(1-K)/2 = 0.08 0.0080 AR 1/5 1/4 = 0.25 0.0500 29 XR 3/10 2/3.1/4 = 0.17 0.0500 fenoc. 2/5 0 0.0000 ---------------------------------------------------ΣPx.Rx = 0.1080 Si nace un segundo niño afectado, la posibilidad de ser una fenocopia es alejada (quedando como posibles apenas los mecanismos AD, AR y XR, cuyas probabilidades a priori se tornan 1/6, 2/6 y 3/6) y los riesgos en las hipótesis de AD y XR se fijan en K/2 y 1/4 respectivamente. La propia ocurrencia del segundo afectado, en tanto, distorsiona las probabilidades favoreciendo los diversos mecanismos, ya que las tasas de segregación (0.40, 0.25 y 0.25) son diferentes. Teniendo esto en cuenta, las probabilidades favoreciendo las hipótesis de enfermedad AD, AR y AX quedan siendo respectivamente (1/6 x 2/5)/(1/6 x 2/5 + 2/6 x 1/4 + 3/6 x 1/4) = 24/99, (2/6 x 1/4)/(1/6 x 2/5 + 2/6 x 1/4 + 3/6 x 1/4) = 30/99 y (3/6 x 1/4)/(1/6 x 2/5 + 2/6 x 1/4 + 3/6 x 1/4) = 45/99. Como en el caso anterior, el riesgo final para un próximo niño es mostrado al pié de la tabla siguiente Px Rx Px.Rx ---------------------------------------------------AD 24/99 K/2 = 0.40 0.0970 AR 30/99 1/4 = 0.25 0.0758 XR 45/99 1/4 = 0.25 0.1136 ---------------------------------------------------ΣPx.Rx = 0.2864 Si nace un segundo niño afectado y este es una niña, las posibilidades de mecanismo recesivo ligado al X y de fenocopia son alejadas (quedando posibles apenas los mecanismos AD y AR, cuyas probabilidades a priori se tornan 1/3 y 2/3) y el riesgo en la hipótesis de AD se fija en K/2. La propia ocurrencia de la segunda afectada, en tanto, distorsiona las probabilidades favoreciendo los mecanismos AD y AR, ya que las tasas de segregación (0.40 e 0.25) son diferentes. Considerando esto, las probabilidades favoreciendo las hipótesis de enfermedad AD y AR quedan siendo respectivamente (1/3 x 2/5)/(1/3 x 2/5 + 2/3 x 1/4) = 24/54 y (2/3 x 1/4)/(1/3 x 2/5 + 2/3 x 1/4) = 30/54. Como en el caso anterior, el riesgo final para un próximo niño es mostrado al pié de la tabla siguiente Px Rx Px.Rx ---------------------------------------------------AD 24/54 K/2 = 0.40 0.1778 AR 30/54 1/4 = 0.25 0.1389 ---------------------------------------------------ΣPx.Rx = 0.3167 30 ACONSELHAMENTO GENÉTICO E CÁLCULO DE RISCOS Paulo A. Otto [[email protected]] Departamento de Genética e Biologia Evolutiva Instituto de Biociências Universidade de São Paulo Caixa Postal 11461 05422-970 São Paulo SP Brasil TEXTO ORIGINAL EM PORTUGUÊS PRIMER CURSO DE GENÉTICA MÉDICA 19-21 Octubre 2005 Laboratorio de Citogenética y Genética Humana DEPARTAMENTO DE GENÉTICA FCEQyN / UNaM 31 DOENÇAS CONDICIONADAS RECESSIVA POR MECANISMO MONOGÊNICO: HERANÇA AUTOSSÔMICA Um casal normal tem um filho afetado por fenilcetonúria, doença condicionada por mecanismo autossômico recessivo (a freqüência do gene que condiciona a doença é da ordem de 1%). Explicar por que o risco de recorrência da doença para um próximo filho é 1/4. A doença na criança afetada pode ter surgido de três maneiras diferentes: a) os genitores são homozigotos AA (probabilidade a priori p2 x p2 = p4) e ambos os genes transmitidos à criança sofreram mutação (probabilidade condicional µ x µ = µ2): a probabilidade conjunta associada ao evento é portanto Pa = p4 x µ2; b) um genitor é homozigoto AA e o outro heterozigoto Aa (probabilidade a priori 2 x p2 x 2pq = 4p3q), o gene transmitido pelo homozigoto sofre mutação e o heterozigoto transmite o alelo a (probabilidade condicional µ/2): a probabilidade conjunta associada ao evento é portanto Pb = 2p3q x µ; c) os genitores são ambos heterozigotos Aa (probabilidade a priori 4p2q2) e cada um transmitiu ao afetado um gene a (probabilidade condicional 1/4): a probabilidade conjunta associada ao evento é portanto Pc = p2q2; a soma dessas três probabilidades conjuntas é Pa+Pb+Pc = p4µ2 + 2p3qµ + p2q2 = = p2(p2µ2 + 2pqµ + q2) = p2(pµ + q)2. Como os riscos de repetição da doença numa próxima criança do casal são µ2, µ/2 e 1/4 respectivamente nas hipóteses a, b e c, o risco de repetição considerando-se as três hipóteses fica sendo R = (Pa x µ2 + Pb x µ/2 + Pc x 1/4)/(Pa + Pb + Pc); como Pa x µ2 + Pb x µ/2 + Pc x 1/4 = p4 x µ4 + p3q x µ2 + p2q2/4 = p2(p2µ 4 + pqµ2 + q2/4) = p2(pµ2 + q/2)2, a expressão para o risco de recorrência simplifica imediatamente para R = [(pµ2 + q/2)/(pµ + q)]2, expressão claramente da ordem de grandeza de [(q/2)/(q)]2 = 1/4. Dois irmãos casam-se com duas irmãs. Do primeiro casal nasce uma criança afetada por fenilcetonúria e do segundo uma criança afetada por galactosemia. Os dois casais procuram um serviço de aconselhamento genético. Que risco você daria para a futura prole deles? O risco de fenilcetonúria na prole do primeiro casal é 1/4, pois já tiveram uma criança afetada; como do casal formado por seus irmãos nasceu uma criança com galactosemia (e portanto o risco de ocorrência de galactosemia na prole do segundo casal é também 1/4), marido e mulher do primeiro casal possuem, cada um, uma chance de 1/2 de ser heterozigoto quanto ao gene da galactosemia e um risco de 1/4 x 1/4 = 1/16 de criança afetada, pois com certeza os progenitores de cada um dos casais de irmão são Ff x FF e Gg x GG, em que f e g são os genes não alelos que em homozigose determinam cada uma das duas doenças. De igual maneira, uma criança do segundo casal corre risco de 1/4 de apresentar galactosemia e 1/16 de apresentar fenilcetonúria. Para cada um dos casais, portanto, a chance de criança afetada é 1 - (1-P1)x(1-P2) = 1 - 1 + P1 + P2 - P1 x P2 = P1 + P2 - P1xP2 = 1/4 + 1/16 - 1/64 = 19/64 = 0.296875 ou cerca de 30%. Existem pelo menos duas formas não-alélicas de albinismo universal recessivo (tirosinase-positivo e tirosinase negativo, com freqüências 32 respectivas de 1/15.000 e 1/30.000 entre negróides norte-americanos). Qual a chance de uma criança de um casal de albinos não-consangüíneos nascer igualmente afetada? E se o casal for consangüíneo? Se uma criança desse casal nascer albina, qual o risco para uma outra criança? E se a criança nascer normal? A probabilidade de um albino universal recessivo ser do tipo tirosinasepositivo é P(tir+|alb) = P(alb,tir+) / [P(alb,tir+)+P(alb,tir-)] = (1/15000) / (1/15000+1/30000) = 2/3; P(tir-|alb) = (1/30000) / (1/15000+1/30000) = 1 - P(tir+|alb) = 1 - 2/3 = 1/3. Para nascer albina a criança do casal, é preciso que o tipo de albinismo do homem e da mulher afetados seja o mesmo, e a probabilidade associada a isso é P = (2/3)2 + (1/3)2 = 4/9 + 1/9 = 5/9. Se o casal for consangüíneo, no entanto, tratamos o albinismo do casal como sendo do mesmo tipo e o risco para qualquer criança é estimado em 1 ou 100%. Se uma criança do casal nascer afetada, é sinal de que o tipo de albinismo de seus pais é o mesmo, e o risco para qualquer criança subseqüente fixa-se em 100%. Se a criança nascer normal, é certo que os genitores são afetados por formas diferentes, não-alélicas, de albinismo universal: o risco para qualquer criança subseqüente fixa-se então em 0%. A chance de um gene qualquer presente num indivíduo estar em uma prima em primeiro grau é 1/8. Cerca de 1/l00 de todas as crianças que nascem de casais não consangüíneos são afetadas por retardo mental. Cerca de 1/4 desses casos de retardo são condicionados por mecanismo hereditário autossômico recessivo. Existem na espécie humana pelo menos l00 genes situados em locos distintos que em homozigose determinam retardo. Supondo que todos esses genes ocorram com freqüências aproximadamente iguais, pergunta-se: Qual a chance de uma pessoa qualquer ser heterozigota quanto a pelo menos um desses genes? Qual a chance de um filho de primos em primeiro grau nascer afetado por retardo mental? Como a freqüência global de retardo mental autossômico recessivo é da ordem de 1/100 x 1/4 = 1/400 e existem pelo menos 100 locos que independentemente determinam o defeito, a freqüência de um tipo qualquer dentre esses 100 é da ordem de 1/40000, de onde se tira que a freqüência média de um desses genes que em homozigose produz retardo é 1/200. A freqüência populacional de heterozigotos quanto a esse gene é portanto 2pq = 2 x 199/200 x 1/200 = 1.99/200 = 0.00995 ≈ 0.01 = 1/100 = 2q. A probabilidade de uma pessoa qualquer não ser heterozigota quanto a esse gene é, portanto, 0.99005 ≈ 0.99; a probabilidade de não ser heterozigota quanto a nenhum dos 100 possíveis genes é portanto (0.99)100 = 0.366; e a de ser heterozigoto quanto a pelo menos um desses 100 genes é dada pela quantidade complementar 1 - 0.366 = 0.634. Como um casal de primos tem em média 1/8 dos genes por origem comum (o seu coeficiente de parentesco, r = 2F vale 1/8), isso significa que uma estimativa grosseira do risco de retardo autossômico recessivo para a prole de primos em primeiro grau é dada por 0.634 x 1/8 x 1/4 = 0.0198; somando-se a essa cifra a de 0.0075 referente a retardo por outros mecanismos não influenciáveis pela consangüinidade, chega-se a um risco global da ordem de 0.027 ou cerca de 3%. Empregando as freqüências estimadas das duas formas não-alélicas de albinismo universal recessivo (tirosinase-positivo e tirosinase negativo), respectivamente 1/15.000 e 1/30.000 entre negróides norteamericanos, qual a freqüência de albinos entre filhos de indivíduos nãoaparentados? E entre filhos de primos em primeiro grau? Qual o risco de nascer afetada por albinismo uma criança cujo pai (normalmente 33 pigmentado) tem dois irmãos albinos e cuja mãe (também normal) é filha de um homem afetado por albinismo tirosinase-negativo? Qual a chance de um tio de um afetado por albinismo ser heterozigoto quanto ao gene que determina a doença? Entre filhos de indivíduos não-aparentados entre si, a freqüência de albinismo é P(aa ou bb|ñcon) = q12 + q22. Portanto as freqüências dos genes que determinam as duas variantes são q1 = √(q12) e q2 = √(q22). Entre filhos de primos em primeiro grau as freqüências de afetados pelas duas formas serão respectivamente q12 + p1q1F = q12 + q1(1-q1)/16 e q22 + p2q2F = q22 + q2(1-q2)/16. Os valores numéricos dessas expressões, para q12 = 1/15000 q22= 1/30000, obtidos do código BASIC anexo, são p(1) = 0.00816 p(2) = 0.00577 nao-cons. pr.pr.gr. -------------------------------------alb.ty+ 0.00007 0.00057 alb.ty0.00003 0.00039 -------------------------------------total 0.00010 0.00096 REM program filename albinism.bas CLS : DEFDBL A-Z paa1 = 1 / 15000:pbb1 = 1 / 30000 p(1) = SQR(paa1): p(2) = SQR(pbb1) paa2 = paa1 + p(1) * (1 - p(1)) / 16:pbb2 = pbb1 + p(2) * (1 - p(2)) / 16 PRINT USING "p(1) = #.#####"; p(1):PRINT USING "p(2) = #.#####"; p(2) PRINT " nao-cons. pr.pr.gr." PRINT "--------------------------------------" PRINT "alb.ty+ "; : PRINT USING "#.##### "; paa1; paa2 PRINT "alb.ty"; : PRINT USING "#.##### "; pbb1; pbb2 PRINT "--------------------------------------" PRINT "total "; : PRINT USING "#.##### "; paa1 + pbb1; paa2 + pbb2 Quanto ao risco de nascer afetada por albinismo uma criança cujo pai (normalmente pigmentado) tem dois irmãos albinos e cuja mãe (também normal) é filha de um homem afetado por albinismo tirosinase-negativo, ele é calculado da seguinte maneira: se o pai tem dois irmãos albinos a chance de ele ser heterozigoto quanto ao gene do albinismo é P(het|nl) = (1/2)/(1/4 + 1/2) = 2/3. Como a mãe é heterozigota certa quanto ao gene do albinismo tirosinase-positivo, é preciso que o pai seja heterozigoto (2/3) quanto ao gene dessa forma (probabilidade 1/3); portanto o risco de albinismo para uma criança do casal é R = 1/3 x 2/3 x 1 x 1/4 = 1/18 = 0.0556 ou cerca de 5.5%. Um tio de afetado por albinismo tem chance de 50% de possuir em heterozigose o gene que certamente está presente em seu irmão ou irmã, genitor do afetado. Cerca de 1/100 de todas as crianças que nascem de casais nãoconsangüíneos são afetadas por retardo mental. Cerca de 1/4 desses casos de retardo são condicionados por mecanismo hereditário autossômico recessivo. Existem cerca de l00 genes (situados em locos distintos) que em homozigose determinam retardo mental na espécie humana. Supondo que todos esses genes ocorram com freqüências aproximadamente iguais, qual é o valor do risco de retardo mental para a prole de casais de primos em primeiro grau? 34 Como a freqüência global de retardo mental autossômico recessivo é da ordem de 1/100 x 1/4 = 1/400 e existem pelo menos 100 locos que independentemente determinam o defeito, a freqüência de um tipo qualquer dentre esses 100 é da ordem de 1/40000 na população geral, de onde se tira que a freqüência média de um desses genes que em homozigose produz retardo é 1/200. Para cada um desses locos, a freqüência de afetados na prole de primos em primeiro grau é q2 + q(1-q)/16 = 1/40000 + (199/16)/40000 = 1/40000 + 12.4375/40000 = 13.4375/40000 = 0.000335938. Como são no mínimo 100 locos, o risco de retardo recessivo na prole de primos é 0.0335938 ou 3.36%. Somando-se a isso o risco referente a retardo por outros mecanismos, 0.75%, chega-se à cifra global de 0.0413 ou cerca de 4%. Que risco (para fenilcetonúria) você daria para a prole de um casal de primos em primeiro grau se o casal já tiver tido uma criança afetada por essa doença? E se o afetado fosse um tio comum dos consulentes? Se o casal se separar e a prima contrair novas núpcias com um outro primo, qual o valor desse risco para a sua prole? E se ela se casasse com pessoa normal não-aparentada? Se já existir uma criança afetada na prole, o risco para qualquer uma seguinte fixa-se em 1/4 ou 25%. Se o afetado for um tio comum dos consulentes, a chance de cada um dos genitores dos dois primos ser heterozigoto é 2/3. O risco da doença na prole do casal é então estimado em R1 = (2/3 x 1/2 x 1/2) x (2/3 x 1/2 x 1/2) = (1/3)2 x 1/4 = 1/36 = 0.02778 ou cerca de 3%. Se a prima se casar com outro primo o risco continua o mesmo, pois o tio referido é irmão dos genitores do casal. Se ela vier a se casar com pessoa não aparentada, ela continua com a chance de 1/3 de ser heterozigota, mas a chance de heterozigose para o seu parceiro cairá para 2pq ≈ 2q = 2/100 = 1/50, que é a freqüência populacional de heterozigotos para o gene da fenilcetonúria. Assim sendo, o risco para a prole desse casal fica igual a R2 = 1/3 x 1/50 x 1/4 = 1/600 = 0.0017 ou cerca de 0.2%, de modo que R1/R2 = 600/36 = 16.6 (ou seja, o risco de doença na prole no caso de casamento com primo é cerca de 16-17 vezes maior do que no caso de casamento com pessoa não aparentada). Que é coeficiente de endocruzamento F? Coeficiente de endocruzamento F é a probilidade de homozigose por origem comum (autozigose) quanto a um loco qualquer para a prole de um casal consangüíneo. Calcular o valor do coeficiente de endocruzamento F para os indivíduos assinalados por ponto de interrogação nos três heredogramas abaixo: 35 Para a primeira das genealogias o valor de F é 1/4. O pai do casal de irmãos (o avô da futura criança) pode ser AA, Aa ou aa com probabilidades p2, 2pq e q2. Se ele for AA (que denominaremos ApAm apenas para distinguir a origem paterna (p) ou materna (m) do alelo, a chance do filho do casal de irmãos nascer AA por origem comum é P(AA,oc|avô=ApAm) = P(ApAp)+P(AmAm) = (1/2)4 + (1/2)4 = 1/8; se o avô for Aa, a chance de a criança nascer AA por origem comum é P(AA,oc|avô=Aa) = P(AA) = (1/2)4 = 1/16. Probabilidades idênticas são obtidas partindo-se da avó da futura criança. Como as chances do avô ou da avó ser AA e Aa são p2 e 2pq respectivamente, a chance final do neto nascer AA por origem comum é P(AA,oc) = 2 x P(avô=ApAm) x P(AA,oc|avô=ApAm) + 2 x P(avô=Aa) x P(AA,oc|avô=Aa) = 2 x p2x 1/8 + 2 x 2pq x 1/16 = p2/4 + pq/4 = p/4. Por simetria, deduz-se que a probabilidade da criança nascer homozigota aa por origem comum é P(aa,oc) = q/4. Portanto, a probabilidade da criança nascer AA ou aa por origem comum, ou seja, a probabilidade de homozigose por origem comum quanto ao loco (A,a), que é a definição do coeficiente de endocruzamento, é F = P(AA,oc) + P(aa,oc) = P(oc) = p/4 + q/4 = 1/4. Para a segunda genealogia o coeficiente de endocruzamento para a prole assinalada é F = 4 x (1/2)6 + 4 x (1/2)4 = 1/16 + 1/4 = 1/4 (1 + 1/4) = 5/16 = 0.3125. Nesse caso, ou seja quando os ascendentes comuns do casal de genitores da criança são também endocruzados (com um coeficiente de endocruzamento F), a fórmula do coeficiente de endocruzamento pode ser colocada sob a forma F' = 1/4 (1 + F). Para a terceira genealogia, na qual os genitores da futura criança são ao mesmo tempo primos em primeiro e em terceiro grau, F' = 1/16 + 1/64 = 5/64 = 0.078125 = 1/16 + 0.015625 ≈ 1/16. Qual o risco de doença recessiva determinada por gene de freqüência populacional q = 0.01 nessas proles? Qual o parentesco dos dois casais consangüíneos do heredograma da direita? Como a freqüência de indivíduos aa na prole de consangüíneos é dada por P(aa|cons) = q2 + pqF = 0.0001 + 0.0099F, aplicando-se os valores de F iguais respectivamente a 1/4, 5/16 e 5/64, obtemos sucessivamente 0.0026, 0.0032 e 0.0009. Na última genealogia os casais consangüíneos são primos em primeiro grau e primos em primeiro e terceiro graus. 36 Que risco você daria para a prole de um casal de primos em primeiro grau sem nenhum caso de doença na família? Aplicando-se o método simplificado segundo o qual as freqüências globais de afetados por doenças recessivas são 1% e 7% respectivamente na prole de não-consangüíneos e consangüíneos: doenças rec qq doença qq doença + RM ñcons 1% 3% 4% ppg 7% 9% 13% -------------------------------------------------------dif 6% 6% 9% Para proles com F qualquer o risco pode ser calculado através da fórmula R = 1% + dif(drec) + 2% + [1% + dif(rm)] = 3% + (99F)% + [1% + (48F)%]. Considerando-se apenas defeitos físicos, a fórmula reduz-se a R1 = 3% + (99F)%; incluindo-se também retardo mental, fica sendo R2 = 4% + (99F)% + (48F)% = 4% + (147)%. A tabela abaixo mostra os valores desses riscos para vários valores de F: F df df+rm ----------------------------1/ 4 0.28 0.41 1/ 8 0.15 0.22 1/ 16 0.09 0.13 1/ 32 0.06 0.09 1/ 64 0.05 0.06 1/ 128 0.04 0.05 1/ 256 0.03 0.05 1/ 512 0.03 0.04 0 0.03 0.04 ---------------------------A freqüência de determinada doença autossômica recessiva (genótipo aa) é 1/40000 = 0.000025 entre crianças nascidas de casais não-consangüíneos. Sabendo-se que nessa população 99% dos casamentos ocorrem entre pessoas não aparentadas entre si e o restante entre primos em primeiro grau, pergunta-se: a) quais as freqüências de indivíduos AA, Aa e aa entre filhos de casais não-consangüíneos? e entre os filhos de primos em primeiro grau? As freqüências de indivíduos AA, Aa e aa entre filhos de casais nãoconsangüíneos são respectivamente p2, 2pq e q2, onde p = P(A) é a freqüência do gene A e q = P(a) = 1 - p a freqüência de seu alelo a. Como q2 = 1/40000 = 0.000025, vem que q = √(q2) = 1/200 = 0.005 e p = 1-q = 199/200 = 0.995. Para esses valores de p e q, as freqüências dos genótipos AA, Aa e aa são respectivamente d1 = P1(AA) = 39601/40000 = 0.990025, h1 = P1(Aa) = 398/40000 = 0.00995 ≈ 0.01 = 2p e r1 = P1(aa) = 1/40000 = 0.000025. As freqüências de indivíduos AA, Aa e aa entre filhos de casais de primos em primeiro grau são respectivamente p2 + pqF = pF + p2(1-F), 2pq-2pqF = 2pq(1-F) e q2 + pqF = qF + q2(1-F); para F = 1/16, que é o coeficiente de endocruzamento para filhos de primos em primeiro grau, p = 199/200 e q = 1/200, as freqüências dos genótipos AA, Aa e aa são respectivamente d2 = P2(AA) = 39613.4/40000 = 0.99033594, h2 = P2(Aa) = 373.1/40000 = 0.00932812 e r2 = P2(aa) = 13.4/40000 = 0.00033594. 37 b) qual a freqüência da doença ao nascimento, no conjunto de todas as crianças que nascem na população? Basta ponderarmos r1 e r2 pelas freqüências populacionais de casamentos não-consangüíneos e entre primos em primeiro grau, que são respectivamente 0.99 e 0.01. Obtemos então d3 = P3(aa) = 0.99 x 0.000025 + 0.01 x 0.00033594 = 0.00002475 + 0.0000033594 = 0.000028. c) é correto afirmar-se que 0.000025 nascimento, na população geral? por quê? é a freqüência da doença ao Sim, porque 28x10-6 é um valor de mesma ordem de grandeza que 25x10-6: d3/d1 = 28.11/25 = 1.12, com erro absoluto de 3 x 10-6. d) quantas vezes é mais provável nascer um afetado por essa doença respectivamente na prole de casais de tio(a)-sobrinha(o), meio-irmãos, primos duplos em primeiro grau e primos simples em primeiro grau, em relação à prole de pessoas não-aparentadas entre si? A resposta é obtida aplicando-se os valores de F, p e q na fórmula (que podemos chamar de risco relativo ou RR): RR = (q2 + Fpq)/q2 = 1 + Fp/q. Para filhos de casais de primos, F = 1/16 e RR = 1 + 199/16 = 13.4375. A prole de todos os outros casamentos mencionados possui um coeficiente de endocruzamento F = 1/8, de modo que agora RR = 1 + 199/8 = 25.875. e) sabendo-se que o número médio de filhos/afetado é 75% do de indivíduos normais da mesma população, qual a taxa de eliminação de afetados aa por geração? g) qual a taxa de eliminação de genes a por geração? h) qual a taxa de mutação µ do gene a [µ = P(A->a)/geração]? O número médio de filhos por afetado dividido pelo número médio de filhos por controle não-afetado constitui uma estimativa boa do valor adaptativo da doença. Portanto, W = 1-s = 3/4 e s = 1/4. Dos q2 = 1/40000 indivíduos afetados que aparecem por geração, sq2 = 1/160000 são eliminados, de modo que esta é a taxa de eliminação de indivíduos aa por geração. A taxa de eliminação de genes a por geração tem valor idêntico, pois cada vez que está sendo eliminado 1 afetado homozigoto dentre 160000 indivíduos estão sendo eliminados 2 genes a dentre 320000 genes. Portanto sq2 = 2/320000 = 1/160000 representa também a taxa de eliminação de genes a por geração. Admitindo-se que a população se encontra em estado de equilíbrio, como deve estar, a quantidade de genes eliminados por geração deve ser reposta mais ou menos exatamente por igual quantidade de genes recém-introduzidos na população por geração. Portanto, a taxa de mutação do gene a, entendida como a probabilidade, por geração, de um gene A se transformar em a [µ = P(A->a)/geração], é também dada por µ = sq2 = 2/320000 = 1/160000. Numa população A, o coeficiente médio de endocruzamento é zero, enquanto numa outra população B o coeficiente médio de endocruzamento é F = 0.3. Uma determinada doença autossômica recessiva ocorre com freqüência de 1/10000 na população A. Sabendo-se que em ambas as populações os números médios de filhos de afetados e não-afetados são respectivamente 1.40 e 1.75, pergunta-se: a) qual o coeficiente de seleção (s = 1-W) da doença? O coeficiente de seleção da doença é obtido de s = 1 - W = 1 - 1.40/1.75 = 1 - 0.8 = 0.2. 38 b) qual a taxa de mutação do gene que determina a doença? A taxa de mutação do gene, que para genes recessivos é dada por µ = s.x, onde x é a freqüência de afetados, é obtida imediatamente de µ = 0.2 x 1/10000 = 2 x 10-6, utilizando-se a freqüência conhecida de afetados, explicitada acima para a população A. c) qual a freqüência de afetados na população B? Como na população B o coeficiente de seleção é o mesmo da população A e como se trata do mesmo gene em ambas as populações, é óbvio que a taxa de mutação é a mesma. Deduzimos portanto que a freqüência de afetados na população 2 só pode ser 1/10000. d) qual a freqüência do gene na população A? A freqüência do gene recessivo na população A, que se encontra em regime de pan-mixia, é qA = √(1/10000) = 1/100 = 0.01. e) qual a freqüência do gene na população B? Na população B a freqüência de afetados não é dada por qB2 = 1/10000, uma vez que essa população apresenta coeficiente médio de endocruzamento F = 0.3, e sim por qB2 + qB(1-qB)F = qB2 - qB2F + qBF = qB2(1-F) + qBF = 0.7 qB2 + 0.3 qB = 1/10000. Resolvendo-se a equação quadrática 7000 qB2 + 3000 qB - 1 = 0 e desprezando-se a raiz negativa, obtemos qB = [√ (9028000)-3000]/14000 = 0.000333074 ≈ 1/3002. f) interprete o porquê da diferença, se houver. Na população B a freqüência do gene recessivo é 30 vezes menor que a observada na população A. Isso ocorreu porque a endogamia favorece o aparecimento de homozigotos afetados, de início provocando uma elevada eliminação deles; como isso por sua vez provoca uma diminuição da freqüência gênica, a eliminação dos afetados vai se atenuando com o passar das gerações até atingir exatamente os mesmos níveis préexistentes, uma vez que o equilíbrio depende das forças antagônicas de mutação e de seleção. A freqüência gênica, que era qA em pan-mixia, aos poucos reduz-se a qB na vigência de endogamia. g) o que você conclui sobre a eficácia de leis ou costumes que proíbam ou limitem os casamentos consangüíneos, ao nível populacional? Com ou sem endogamia a freqüência de qualquer doença recessiva será a mesma, de modo que leis que limitem os casamentos consangüíneos não fazem o menor sentido no âmbito populacional. Obviamente ao nível familiar a história é outra e existem argumentos (que veremos oportunamente) que desaconselham uniões consangüíneas. DOENÇAS CONDICIONADAS DOMINANTE POR MECANISMO MONOGÊNICO: HERANÇA AUTOSSÔMICA O valor da taxa de penetrância do gene R do retinoblastoma é K = 0.8; o valor adaptativo dos afetados foi estimado em cerca de 0.6. Enquanto o genótipo de todos os afetados com tumor bilateral é Rr, apenas 20% dos 39 casos unilaterais são produzidos pelo mesmo gene. Um casal normal tem um filho afetado pelo tumor. Pergunta-se: a) qual o valor adaptativo médio W dos heterozigotos Rr? Se W' = 0.6 é o valor adaptativo dos afetados e a penetrância do gene dominante que o determina é K = 0.8, o valor adaptativo W de todos os heterozigotos Rr é W = W'.K + 1.(1-K) = 0.6 x 0.8 + 1 x 0.2 = 0.68. b) Qual seria o valor de W se todos os afetados morressem sem deixar descendência? Se todos os afetados morressem sem deixar descendência, o valor adaptativo dos afetados seria W' = 0 e o valor adaptativo médio dos heterozigotos reduzir-se-ia a W = 1-K e s = 1-W tomaria o valor K. Conclui-se portanto que se o gene fosse letal toda vez que penetrasse, o coeficiente de seleção dos heterozigotos tomaria exatamente o valor da taxa de penetrância K. c) qual a chance (valor literal) de uma pessoa qualquer, normal, ser heterozigota quanto ao gene R, supondo-se que exista informação sobre a normalidade de todos os ascendentes diretos do indivíduo até 7 gerações atrás? essa informação já é suficiente para se rotular o caso de uma criança afetada como isolado? A probabilidade de uma pessoa qualquer ser heterozigota Rr normal é dada por P(het,nl) = 2µ(1-K)/K. Essa fórmula é deduzida somando-se os termos 2 µ(1-K), 2µ(1-K)2, 2µ(1-K)3, 2µ(1-K)4, ... . Como 1-K = 0.2, a soma de 2µ (1-K)i, de i = 1 a 8 (até sete gerações atrás) é 2µ x 0.2499968, que não difere em ordem de grandeza de 2µ x 0.25, valor exato dado pela fórmula 2 µ(1-K)/K. Portanto, a informação sobre a normalidade dos ascendentes diretos durante sete gerações permite-nos tratar o caso como isolado. É possível obter-se a fórmula P(het,nl) = 2µ(1-K)/K aplicando-se o raciocínio seguinte: como um indivíduo heterozigoto normal só pode sê-lo ou por haver recebido o gene (com probabilidade 1/2) que não penetrou (com probabilidade 1-K) de um progenitor também heterozigoto (pai ou mãe) ou por ser o resultado de uma mutação nova (que ocorre com probabilidade 2µ por poder ter se originado no cromossomo paterno ou no materno), podemos escrever a equação de recorrência Pt+1(het,nl) = 2.Pt(het,nl).1/2.(1-K) + 2µ(1-K). Fazendo-se Pt+1(het,nl) = Pt(het,nl) = P(het,nl), obtém-se imediatamente a fórmula P(het,nl) = 2µ(1-K)/K. d) e se se tratar de uma pessoa adotada, sem nenhuma informação sobre seus ascendentes diretos? Nessa situação, na fórmula de recorrência acima teremos ainda que considerar a possibilidade de o indivíduo heterozigoto normal haver recebido o gene de um progenitor afetado, que se reproduziu com probabilidade W' (valor adaptativo dos afetados) e transmitiu o gene nãopenetrante ao filho: Pt+1(het,nl) = 2.Pt(het,nl).1/2.(1-K) + 2.Pt(het,af).W'.1/2.(1-K) + 2µ(1-K). Retirando-se os subscritos (na hipótese de equilíbrio) e fazendo-se P(het,nl)/P(het,af)=(1-K)/K, obtemos sucessivamente P(het,nl) = 2.Pt(het,nl).1/2.(1-K) + 2.Pt(het,nl).W'.1/2.K + 2µ(1-K) , P(het,nl).K.(1-W') = 2µ(1-K) e, finalmente, P(het,nl) = 2µ(1K)/Ks' = 2µ(1-K)/s, pois W = 1-s = W'K + (1-K) = (1-s')K + 1-K e portanto Ks' = s. 40 e) qual o valor dessa chance para um indivíduo cujo filho é afetado pela forma bilateral? e se a criança tiver tido a forma unilateral? A chance de um caso isolado qualquer ser herdado é 1-K. De fato, sendo A e B os progenitores de um afetado isolado, vem que (método de Bayes): A e B homoz. A ou B het. Prob. a priori 1-4µ(1-K)/K ≈ 1 4µ(1-K)/K Prob. cond. (filho af.) 2µK K/2 Prob. conjuntas P1 = 2µK P2 = 2µ(1-K) ------------------------------------------------------------Prob. a posteriori P(A,B hom|f af) P(A,B het|f af) = P1/(P1+P2) = K = P2/(P1+P2) = 1-K Portanto, a chance do indivíduo A ser heterozigoto é agora P(het,nl) = (1-K)/2. Se a criança tiver a forma unilateral do tumor, com probabilidade de 20% = 1/5 de ser produzido pelo mesmo gene que produz o retinoblastoma bilateral, a chance acima reduz-se agora a P(het,nl) = (1K)/10. f) e se existirem dois filhos afetados pela forma bilateral? e se um tiver a forma bilateral e o outro a forma unilateral? e se os dois tiverem tumor unilateral? Nessa situação tem-se certeza de que o gene foi herdado (ou seja, está presente com certeza num dos dois progenitores, A ou B) e a probabilidade de A (da mesma maneira que B) ser heterozigoto é agora 1/2. g) no caso de apenas uma criança afetada, qual o risco para uma nova criança que o casal venha a ter, no caso de tratar-se de tumor bilateral? e se o tumor for unilateral? No caso de tumor bilateral, o risco é dado por R = K(1-K)/2, expressão que fornece o valor 0.08 ou 8% para uma taxa de penetrância K = 0.8. No caso de tratar-se de retinoblastoma unilateral, o risco R reduz-se a 1/5 dessa quantidade ou seja cerca de 0.016 ou 1.6%. h) e se o afetado tiver um irmão normal? e se existirem n irmãos normais? Para resolvermos esse problema, basta adicionarmos mais uma probabilidade condicional (de ocorrência de n irmãos normais sob as hipóteses {A e B homoz.} e {A ou B het.}: A e B homoz. A ou B het. Prob. a priori 1-4µ(1-K)/K ≈ 1 4µ(1-K)/K Prob. cond. 1 (filho af.) 2µK K/2 Prob. cond. 2 (n fil. nl.) 1n = 1 [1/2 + (1-K)/2]n = [(2-K)/2]n Prob. conjuntas P1 = 2µK P2 = 2µ(1-K).[(2-K)/2]n ------------------------------------------------------------Prob. a posteriori P(A,B hom|1 af,n nl) P(A,B het|1 af,n nl) = P1/(P1+P2) = P2/(P1+P2) = (1-K).[(2-K)/2]n / = K / {K+(1-K).[(2-K)/2]n} {K+(1-K).[(2-K)/2]n} 41 Como era de se esperar, a fórmula para P(A,B het) reduz-se a (1-K) se n = 0. Para n = 1 a fórmula para R reduz-se a R = K.(1-K).[(2-K)/2] /2{K+(1K).[(2-K)/2]}. Para K = 0.8 o valor de R é então 0.052 . i) que tipo de informação sobre risco você poderia dar caso o valor da taxa de penetrância do gene do retinoblastoma não fosse conhecido? Poderia ser dito que, apesar do valor da taxa de penetrância não ser conhecido, é possível calcular o risco máximo de repetição da doença. No caso de se tratar de afetado isolado sem irmãos esse risco máximo é de 12.5%, que corresponde a um valor intermediário (K = 0.5) da taxa de penetrância. Como geralmente os valores da taxa de penetrância são altos, esse valor constitui na prática geralmente uma superestimativa do risco real. Um casal normal tem uma criança afetada por retinoblastoma. O casamento se desfaz e o pai contrai novas núpcias com uma mulher também normal nãoaparentada. Pergunta-se: a) qual a chance de que uma criança que o casal venha a ter apresente retinoblastoma, no caso de a criança do casamento anterior apresentar a forma bilateral? O risco agora é dado por R = K(1-K)/4 em vez de R = K(1-K)/2, reduzindose portanto a cerca de 0.04 ou 4%. b) e se o tumor for unilateral? Se o tumor for unilateral a fórmula reduz-se a R = 1/5 . K(1-K)/4 = K(14)/20 = 0.008 ou 0.8%, quantidade desprezível inferior a 1%. c) e se do primeiro casamento tivessem nascido duas crianças afetadas? Nesse caso o homem tem uma chance de 1/2 de ser o heterozigoto não penetrante do par original. O risco de criança afetada em sua prole eleva-se então para R = 1/2 . 1/2 . K = 0.2 ou 20%. Um homem é afetado pelo retinoblastoma. Pergunta-se: a) qual o risco de ocorrência de retinoblastoma em sua prole, no caso de tratar-se da forma bilateral do tumor? No caso de tratar-se da forma bilateral e o propósito não tiver ainda filhos, o risco de retinoblastoma em sua prole é estimado em R = K/2 = 0.4 ou 40%, pois todos os casos de retinoblastoma bilateral são determinados por um gene autossômico dominante com taxa de penetrância K = 0.8. b) e se o tumor tiver sido unilateral? No caso de tumor unilateral o risco reduz-se a 1/5 do acima, pois que a criança do propósito nasça afetada é preciso que o homem heterozigoto, que transmita o gene, dado que é heterozigoto, e que o penetre, dado que foi transmitido: R = 1/5 x 1/2 x K = K/10 = 0.08 ou para seja gene 8%. c) e se o homem já tiver uma criança normal? 42 Se já existir uma criança normal, isso pode ter acontecido de duas maneiras diferentes: a) o homem é um homozigoto rr com probabilidade igual a 80% e transmitiu a seu filho o gene r com probabilidade 1, dado que é homozigoto rr: a probabilidade conjunta favorecendo a ocorrência dessa primeira hipótese toma portanto o valor P1 = 0.8 x 1 = 0.8; b) o homem é um heterozigoto Rr com probabilidade igual a 20% e seu filho é normal ou porque herdou o gene r de seu pai com probabilidade condicional 1/2 ou porque herdou o gene R e este não penetrou, evento com probabilidade condicional (1-K)/2: a probabilidade conjunta P2 favorecendo essa segunda hipótese toma portanto o valor P2 = 0.2 x (2K)/2 = 0.12. A probabilidade a posteriori (final) de que o homem é heterozigoto toma portanto o valor P(het|filho nl) = P2/(P1+P2) = 0.12/0.92 = 3/23 = 0.1304 ou cerca de 13%. Acabamos de constatar portanto que a ocorrência de uma criança normal na sua prole diminui a probabilidade a priori de heterozigose de 20 para 13%. O risco de afecção para uma futura criança que esse homem venha a ter fica sendo então R = 3/23 x 1/2 x 4/5 = 12/230 = 0.052 ou cerca de 5%. d) e se essa primeira criança também for afetada? Nesse caso fica demonstrado que o homem é na verdade um heterozigoto Rr. Novo aconselhamento se impõe e o risco para qualquer criança subseqüente fixa-se em K/2 = 0.4 ou 40%. DOENÇAS CONDICIONADAS POR MECANISMO MONOGÊNICO: MECANISMO LIGADO AO X Num heredograma, existem dois irmãos (um homem e uma mulher) afetados por uma doença que pode ser produzida por mecanismo autossômico dominante ou ligado ao X dominante. A mãe dos afetados é também portadora da doença. O homem afetado tem cinco crianças: um menino normal e quatro meninas afetadas. A mulher afetada tem duas crianças: um menino afetado e uma menina normal. Qual dos dois mecanismos explica com maior probabilidade a ocorrência dos afetados nessa família? Por quê? A prole da mulher afetada não indica com probabilidade maior um dos dois mecanismos, uma vez que o ocorrido pode acontecer perfeitamente sob ambas as hipóteses. Já a prole do homem afetado indica com probabilidade muito grande tratar-se de mecanismo ligado ao X dominante. De fato, enquanto a combinação de sexos nos afetados e normais poder ocorrer por pura chance na hipótese autossômica dominante, com probabilidade (1/2).(1/2)4 = (1/2)5 = 1/32, na hipótese de mecanismo ligado ao X dominante todos os meninos têm que ser normais enquanto todas as meninas têm que ser afetadas: a probabilidade associada ao evento condicional é portanto 1.(1)4 = 15 = 1. Portanto, dada a configuração do heredograma, é 32 vezes mais provável tratar-se de defeito dominante ligado ao X do que autossômico. Normalizando-se as probabilidades conjuntas 1/32 e 1, obtemos imediatamente P(ad) = 1/33 ≈3% e P(xd) = 32/33 ≈ 97%. A distrofia muscular progressiva tipo Duchenne é uma doença produzida por um gene letal recessivo ligado ao cromossomo X. Seja µ a taxa de mutação desse gene, a) qual a probabilidade de que uma mulher qualquer seja heterozigota quanto a esse gene? 43 Essa probabilidade é tirada da equação de recorrência Pt+1(het) = Pt(het)/2 + 2µ. Em equilíbrio, Pt+1(het) = Pt(het) = P(het) e a equação acima reduz-se a P(het) = P(het)/2 + 2µ, de onde se tira que P(het) = 4µ b) qual a freqüência, ao nascer, de meninos afetados pela distrofia muscular progressiva tipo Duchenne? Essa probabilidade é tirada, agora, da equação de recorrência Pt+1(afe) = Pt(het)/2 + µ. Em equilíbrio, Pt+1(het) = Pt(het) = P(het) e Pt+1(afe) = Pt(afe) = P(afe) e a equação acima reduz-se a P(afe) = P(het)/2 + µ, de onde se tira que P(afe) = P(het)/2 + µ = 2µ + µ = 3µ. c) qual a chance de uma heterozigota quanto ao gene da DMD sê-lo por mutação nova? Como P(het) = 4µ = P(het)/2 + 2µ = 2µ + 2µ, concluímos imediatamente que do total de heterozigotas (4µ), metade (2µ) o são por haverem herdado o gene (de uma mãe que também era heterozigota) e metade (2µ) por mutação nova ocorrido num ou noutro cromossomo X que recebeu de seus genitores. Portanto, P(her|het) = P(het,her) / [P(het,her) + P(het,mut)] = P(het,her)/P(het) = 2µ/(2µ + 2µ) = 1/2 e P(mut|het) = 1 - P(her|het) = 1/2. d) qual a chance de uma irmã dessa mulher ser também heterozigota? Dado que a propósita inicial é heterozigota, a chance de sua mãe sê-lo é 1/2, como visto acima. A chance de a irmã da mulher ser heterozigota é portanto 1/2 x 1/2 = 1/4. e) e de sua mãe? 1/2, como já visto nos itens anteriores. f) qual a chance de um afetado isolado sê-lo por mutação nova? Como já visto acima, P(afe) = P(het)/2 + µ = 2µ + µ = 3µ. Portanto, do total de afetados (3µ), uma proporção 2µ herdou o gene, enquanto que na proporção restante µ a doença foi produzida por mutação nova ocorrida no cromossomo X recebido da mãe. Logo, P(her|afe) = 2µ/(2µ + µ) = 2µ/3µ = 2/3 e P(mut|afe) = µ/(2µ + µ) = µ/3µ = 1/3. No caso da hemofilia clássica (deficiência do fator VIII) ou da distrofia muscular progressiva tipo Becker, o valor adaptativo dos afetados foi estimado em cerca de 70%. Responda às perguntas a) a f) para esse caso. a) qual a probabilidade de que uma mulher qualquer seja heterozigota quanto aos genes que produzem essas doenças? Essa probabilidade é tirada das equações de recorrência Pt+1(het) = Pt(het)/2 + 2µ + Pt(afe).W e Pt+1(afe) = Pt(het)/2 + µ. Na primeira, W é o valor adaptativo dos afetados (probabilidade de sucesso reprodutivo dos afetados, em relação ao de controles normais), que agora é diferente de zero (como acontecia no caso da distrofia de Duchenne). Para obtermos a expressão P(het), que agora será uma função da taxa de mutação e do coeficiente de seleção, formamos um sistema de duas equações a duas 44 incógnitas [P(het) e P(afe)] utilizando as formas sob hipótese de equilíbrio, P(het)/2 = 2µ + P(afe).W e P(afe) = P(het)/2 + µ. Dessas duas equações vem que P(het)/2 = 2µ + P(afe).W = P(afe) - µ e, finalmente, P(afe).(1-W) = P(afe).s = 3µ, donde tiramos que P(afe) = 3µ/s. Substituindo esse valor na expressão P(afe) = P(het)/2 + µ obtemos P(het)/2 = 3µ/s - µ = µ(3-s)/s e P(het) = 2µ(3-s)/s. Note-se que as fórmulas recém-deduzidas, P(het) = 2µ(3-s)/s e P(afe) = 3µ/s, aplicam-se mesmo no caso s = 1, quando se reduzem respectivamente a P(het) = 2µ(31)/1 = 4µ e a P(afe) = 3µ/1 = 3µ. A resposta ao quesito é portanto P(het) = 2µ(3-s)/s, que se reduz a P(het) = 2µ(3-0.3)/0.3 = 18µ quando W = 1-s = 0.7, como nos casos da hemofilia A e da distrofia muscular de Becker. b) qual a freqüência, ao nascer, de meninos afetados pela distrofia muscular progressiva tipo Becker (DMB)? Essa probabilidade já foi deduzida no item anterior, tomando valor literal P(afe) = 3µ/s. No caso da DMB, W = 1-s = 0.7 e a fórmula reduz-se a P(afe) = 3µ/s = 3µ/0.3 = 10µ. c) qual a chance de uma heterozigota quanto ao gene da DMB sê-lo por mutação nova? Como P(het) = 18µ = P(het)/2 + 2µ = 16µ + 2µ, concluímos imediatamente que do total de heterozigotas (18µ), uma proporção 16µ herda o gene (de uma mãe que também era heterozigota) e uma proporção 2µ possui o gene por haver ocorrido mutação nova num ou noutro cromossomo X que recebeu de seus genitores. Portanto, P(her|het) = 16µ/(16µ + 2µ) = 8/9 e P(mut|het) = 1 - P(her|het) = 1/9. No caso genérico de coeficiente de seleção qualquer essas expressões reduzem-se respectivamente a P(her|het) = (32s)/(3-s) e P(mut|het) = s/(3-s). Note-se que realmente essas expressões reduzem-se a P(her|het) = (3-2s)/(3-s) = (3-0.6)/(3-0.3) = 2.4/2.7 = 8/9 e P(mut|het) = s/(3-s) = 0.3/(3-0.3) = 0.3/2.7 = 1/9 quando W = 1-s = 0.7. Além disso, as fórmulas são válidas para o caso extremo de genes letais (s=1), pois para s=1 reduzem-se respectivamente a P(her|het) = (32s)/(3-s) = (3-2)/(3-1) = 1/2 e P(mut|het) = s/(3-s) = 1/(3-1) = 1/2. d) qual a chance de uma irmã dessa mulher ser também heterozigota? Dado que a propósita inicial é heterozigota, a chance de sua mãe sê-lo é 8/9, como visto acima. A chance de a irmã da mulher ser heterozigota é portanto 8/9 x 1/2 = 4/9. e) e de sua mãe? 8/9, como já visto nos itens anteriores. f) qual a chance de um afetado isolado sê-lo por mutação nova? Como já visto acima, P(afe) = P(het)/2 + µ = 9µ + µ = 10µ. Portanto, do total de afetados (10µ), uma proporção 9µ herdou o gene, enquanto que na proporção restante µ a doença foi produzida por mutação nova ocorrida no cromossomo X recebido da mãe. Logo, P(her|afe) = 9µ/(9µ + µ) = 9µ/10µ = 9/10 e P(mut|afe) = µ/(9µ + µ) = µ/10µ = 1/10. No caso genérico de coeficiente de seleção qualquer essas expressões reduzem-se 45 respectivamente a P(her|afe) = (3-s)/3 e P(mut|afe) = s/3. Note-se que realmente essas expressões reduzem-se a P(her|afe) = (3-s)/3 = (3-0.3)/3 = 2.7/3 = 9/10 e P(mut|afe) = s/3 = 0.3/3 = 1/10 quando W = 1-s = 0.7. Além disso, as fórmulas são válidas para o caso extremo de genes letais (s=1), pois para s=1 reduzem-se respectivamente a P(her|afe) = (3-s)/3 = (3-1)/3 = 2/3 e P(mut|afe) = s/3 = 1/3. A penetrância do gene da síndrome de Martin-Bell entre crianças de mulheres normais portadoras do gene foi estimada em 80% para indivíduos hemizigotos quanto ao gene e em 35% para heterozigotas. Uma mulher normal tem um irmão e um filho afetados pela síndrome. Qual o risco de que uma criança qualquer que venha a ter seja novamente afetada? Como a mãe é uma heterozigota certa quanto à pre-mutação (X'X) e o pai normal (XY), os genótipos possíveis na prole, cada um ocorrendo com probabilidade de 0.25 ou 1/4, são XY, X'Y, XX e X'X. Como as taxas de penetrância são K(X'Y) = 0.80 e K(X'X) = 0.35 para hemizigotos e heterozigotas filhos de mulher portadora da pré-mutação, o risco de afecção na prole dessa mulher é R = P(X'Y,afe) + P(X'X,afe) = P(X'Y).K(X'Y) + P(X'X).K(X'X) = 0.25 x 0.80 + 0.25 x 0.35 = 1.15/4 = 0.2875 ou cerca de 29%. Para crianças oriundas de mulheres afetadas, os valores da penetrância sobem para 100 e 50%, respectivamente para meninos e meninas. Qual o risco de criança afetada na prole de tais mulheres? Como a mãe (afetada) é uma heterozigota certa quanto à mutação (X"X) e o pai é normal (XY), os genótipos possíveis na prole, cada um ocorrendo com probabilidade de 0.25 ou 1/4, são XY, X"Y, XX e X"X. Como as taxas de penetrância são K(X"Y) = 1 e K(X"X) = 0.5 para hemizigotos e heterozigotas filhos de mulher portadora da mutação completa, o risco de afecção na prole dessa mulher é R = P(X"Y,afe) + P(X"X,afe) = P(X"Y).K(X"Y) + P(X"X).K(X"X) = 0.25 x 1.00 + 0.25 x 0.50 = 0.375 ou 37.5%. Sabendo-se que o valor adaptativo de afetados por hemofilia é da ordem de w = 7/10, qual o risco de repetição da doença numa irmandade com um afetado e um menino e uma menina normais? Calcule esse risco nas hipóteses alternativas de presença e ausência de informação sobre a normalidade de ascendentes e colaterais do afetado. Na hipótese de presença de informação sobre a normalidade de ascendentes e colaterais do afetado, as probabilidades finais favorecendo as hipóteses de mãe homozigota normal e heterozigota, dado que existem 1 filho afetado, 1 filho normal e 1 filha normal, são obtidas aplicando-se o método de Bayes, partindo-se de uma probabilidade a priori P(het) = 4µ favorecendo a hipótese de heterozigose para a mãe: Prob. Prob. Prob. Prob. Prob. a priori cond. 1 (filho af.) cond. 2 (filho nl.) cond. 3 (filha nl.) conjuntas mãe homoz. 1-4µ ≈ 1 µ 1 1 P1 = µ mãe heter. 4µ 1/2 1/2 1 P2 = µ 46 ------------------------------------------------------------Prob. a posteriori P(mãe hom|cond) P(mãe het|cond) = P1/(P1+P2) = 1/2 = P2/(P1+P2) = 1/2 O risco para uma próxima criança é evidentemente dado por R = P(mãe het|cond).1/4 = 1/2 x 1/4 = 1/8 = 0.125 ou 12.5%. Na hipótese de ausência de informação sobre a normalidade de ascendentes e colaterais do afetado, as probabilidades finais favorecendo as hipóteses de mãe homozigota normal e heterozigota, dado que existem 1 filho afetado, 1 filho normal e 1 filha normal, são obtidas aplicando-se o método de Bayes exatamente como imediatamente acima, partindo-se no entanto agora de uma probabilidade a priori P(het) = 18µ favorecendo a hipótese de heterozigose para a mãe: mãe homoz. mãe heter. Prob. a priori 1-18µ ≈ 1 18µ Prob. cond. 1 (filho af.) µ 1/2 Prob. cond. 2 (filho nl.) 1 1/2 Prob. cond. 3 (filha nl.) 1 1 Prob. conjuntas P1 = µ P2 = 9µ/2 ------------------------------------------------------------Prob. a posteriori P(mãe hom|cond) P(mãe het|cond) = P1/(P1+P2) = 2/11 = P2/(P1+P2) = 9/11 O risco para uma próxima criança é evidentemente dado por R = P(mãe het|cond).1/4 = 9/11 x 1/4 = 9/44 = 0.2045 ou pouco mais de 20%. Um indivíduo hemofílico casa-se com sua sobrinha (filha de uma irmã do afetado). Sabendo-se que o valor adaptativo da hemofilia é w = 0,7, responda às perguntas seguintes nas hipóteses alternativas de presença e ausência de informação sobre a normalidade de ascendentes e colaterais do afetado: Quais as chances de que a doença no afetado resulte de uma mutação nova? P(mut|afe) = 1/3 e P(mut|afe) = 1/10, respectivamente nas hipóteses de presença ou ausência de informações sobre a normalidade dos ascendentes e colaterais do afetado. Quais as chances de que a mãe do afetado seja heterozigota quanto ao gene da hemofilia? P(het|cça afe) = 2/3 e P(het|cça afe) = 9/10, respectivamente nas hipóteses de presença ou ausência de informações sobre a normalidade dos ascendentes e colaterais do afetado. Obviamente essas também são as chances de que a doença no afetado resulte de gene transmitido: por isso são exatamente complementares às cifras do quesito anterior. Quais as probabilidades (nas duas hipóteses do enunciado) de sobrinha do afetado seja heterozigota quanto a esse mesmo gene? que a 47 Essas probabilidades são dadas respectivamente por P(het|cça afe).1/2.1/2 = 2/3 x 1/4 = 1/6 e P(het|cça afe).1/2.1/2 = 9/10 x 1/4 = 9/40 = 0.225 ou 22.5%. Qual é a probabilidade de que um menino que venham a ter seja afetado pela doença? Qual é o risco de que uma menina que venham a ter nasça afetada? Qual é o risco de que uma criança que venham a ter nasça afetada por hemofilia? As chances de menino afetado, menina afetada ou criança afetada são iguais, tomando o valor 1/6 x 1/2 = 1/12 = 0.083 e 9/40 x 1/2 = 9/80 = 0.1125 respectivamente nas duas situações do enunciado. Um casal tem três meninos e duas meninas. Dois deles (os mais velhos) são normais e o mais jovem é afetado por distrofia muscular progressiva de Duchenne (DMD). É realizada uma dosagem das enzimas séricas CK (creatinoquinase) e PK (piruvato-quinase) na mãe dos três meninos. Sabendo-se que estas duas enzimas encontram-se elevadas em 80% das heterozigotas certas quanto ao gene da DMD e em 5% de mulheres homozigotas normais, perguntase: Qual é a probabilidade de que a mãe seja heterozigota se suas enzimas tiverem níveis normais? E se as enzimas tiverem níveis elevados? Na hipótese de níveis enzimáticos normais, as probabilidades finais favorecendo as hipóteses de mãe homozigota normal e heterozigota, dado que existem 1 filho afetado, 2 filhos normais e 2 filhas normais, são obtidas aplicando-se o método de Bayes, partindo-se de uma probabilidade a priori P(het) = 4µ favorecendo a hipótese de heterozigose para a mãe: mãe homoz. mãe heter. Prob. a priori 1-4µ ≈ 1 4µ Prob. cond. 1 (filho af.) µ 1/2 Prob. cond. 2 (2 filho nls.) 12 = 1 (1/2)2 Prob. cond. 3 (2 filha nls.) 12 = 1 12 = 1 Prob. cond. 4 (enz. nls.) 95/100 = 19/20 1/3 Prob. conjuntas P1 = 19µ/20 P2 = µ/6 ------------------------------------------------------------Prob. a posteriori P(mãe hom|cond) P(mãe het|cond) = P1/(P1+P2) = 0.851 = P2/(P1+P2) = 0.149 Na hipótese de níveis enzimáticos elevados, as probabilidades finais favorecendo as hipóteses de mãe homozigota normal e heterozigota, dado que existem 1 filho afetado, 2 filhos normais e 2 filhas normais, são obtidas, como acima, aplicando-se o método de Bayes, partindo-se de uma probabilidade a priori P(het) = 4µ favorecendo a hipótese de heterozigose para a mãe e agora utilizando as probabilidades condicionais de enzimas elevadas no soro: mãe homoz. mãe heter. Prob. a priori 1-4µ ≈ 1 4µ Prob. cond. 1 (filho af.) µ 1/2 Prob. cond. 2 (2 filho nls.) 12 = 1 (1/2)2 Prob. cond. 3 (2 filha nls.) 12 = 1 12 = 1 Prob. cond. 4 (enz. ele.) 5/100 = 1/20 2/3 Prob. conjuntas P1 = µ/20 P2 = µ/3 ------------------------------------------------------------Prob. a posteriori P(mãe hom|cond) P(mãe het|cond) 48 = P1/(P1+P2) = 0.130 = P2/(P1+P2) = 0.870 Quais as chances de que uma nova criança que o casal venha a ter nasça afetada nas duas situações anteriores? Em ambos os casos o risco é dado evidentemente por R = P(mãe het|cond).1/4, que se reduz respectivamente a 0.149/4 = 0.037 no primeiro e a 0.870/4 = 0.217 no segundo. DOENÇAS PRODUZIDAS POR MECANISMO CROMOSSÔMICO Cerca de 15% (aproximadamente 1/7) de todas as gravidezes terminam em abortamentos espontâneos. Três casais procuram um serviço de aconselhamento genético. A única gravidez do primeiro casal terminou em abortamento espontâneo de primeiro trimestre. O segundo e o terceiro casais tiveram duas gravidezes cada, que resultaram respectivamente em uma criança normal e um abortamento; em dois abortamentos. Quais as probabilidades associadas às três histórias reprodutivas acima? Está indicado o estudo citogenético de algum desses casais? Por quê? As probabilidades associadas às três histórias reprodutivas são respectivamente P(1) = C(1,1).(0.15)1.(0.85)0 = 0.150, P(2) = C(1,2).(0.15)1.(0.85)1 = 0.255 e P(3) = C(2,2).(0.15)2.(0.85)0 = 0.022, que tiramos imediatamente da tabela abaixo (Otto e cols., 1998). Apenas no último casal está indicado o estudo citogenético, pois P(3) < 0.05. Probabilidade de ocorrência de n abortamentos espontâneos em N gestações, tomando como 0,15 a probabilidade de ocorrência na população de um abortamento espontâneo. N n 1 2 3 4 5 6 7 8 1 0,150 2 0,255 0,022 3 0,325 0,057 0,005 4 0,368 0,098 0,011 0,001 5 0,392 0,138 0,024 0,002 0,000 6 0,400 0,176 0,041 0,005 0,000 0,000 7 0,396 0,210 0,062 0,011 0,001 0,000 0,000 8 0,385 0,238 0,084 0,018 0,003 0,000 0,000 0,000 9 0,368 0,259 0,107 0,028 0,005 0,001 0,000 0,000 9 0,000 A chance de uma gestação qualquer terminar em aborto reconhecível na população geral é alta, tendo sido estimada em cerca de 1/7 ou cerca de 15%. Por outro lado, o cariótipo 45,X é o mais freqüentemente encontrado em abortos espontâneos. Quanto mais precoce é a perda gestacional, maior a chance de o concepto eliminado apresentar essa constituição cromossômica . Isso permitiu estimar-se que a freqüência do cariótipo 45,X no estágio de zigoto é da ordem de 2% (ou seja, aproximadamente 1/50 de todas as fecundações originam zigotos com o cariótipo encontrado na síndrome). A freqüência da síndrome de Turner ao nascimento foi estimada em cerca de 1 afetado entre cada 10000 crianças de ambos os sexos. A literatura, por outro lado, registra cerca de 60 casos de mulheres com síndrome de Turner que, provavelmente por serem casos de mosaicismo 45,X/46,XX, conseguiram engravidar. Suponhamos que uma mulher com um mosaicismo 45,X/46,XX com 20% de células monossômicas e 80% de células normais engravide. Pergunta-se : Qual a chance de que um óvulo desta mulher não contenha nenhum cromossomo X (faça o cálculo supondo que 49 ovócitos X têm a mesma chance de completar a divisão meiótica que ovócitos com dois X)? Qual o risco de que uma criança que venha a nascer dessa mulher seja portadora de cariótipo 45,X? Tendo em vista tudo isso, você indicaria a aplicação de técnica de diagnóstico pré-natal durante a gestação dessa mulher? Por quê? As chances de óvulos X e 0 são 0.8 + 0.2/2 = 0.9 e 0.2/2 = 0.1. Zigotos normais (XX ou XY), monossômicos quanto ao X (XO) e contendo apenas o cromossomo Y (Y0) ocorrerão, à época da fecundação, com probabilidades respectivas 0.9, 0.05 e 0.05. Como as viabilidades desses zigotos são respectivamente 0.85, (1/1000)/(1/50) = 50/1000 = 1/200 = 0.005 e 0, ao nascimento ocorrerão apenas crianças cariotípicamente normais e portadoras da síndrome de Turner com probabilidades respectivas 0.9 x 0.85 /(0.9 x 0.85 + 0.05 x 0.005) = 0.765 / (0.765 + 0.00025) = 0.765/0.76525 = 0.99967 e 0.00025 / (0.765 + 0.00025) = 0.00033 ou cerca de 3%, risco de ordem de grandeza desprezível. Por que se estuda de rotina o cariótipo de crianças suspeitas de síndrome de Down, se o seu diagnóstico é dos menos problemáticos sob o ponto de vista clínico? Porque em casos de síndrome de Down produzidas por translocações herdadas de um dos genitores o risco de repetição está aumentado. Que tipos de gametas um portador de uma translocação equilibrada 21/D teoricamente pode produzir? Com que probabilidades? Por que o risco de repetição de síndrome de Down é menor na prole de homens portadores de translocação do que na de mulheres na mesma condição? Quais são esses riscos? Por que os riscos empíricos do item anterior são menores do que o risco teórico? Qual o valor deste? Por quê? Gametas (21, D), (21/D), (21, 21/D), (D), (D, 21/D) e (21) com probabilidades iguais a 1/6 cada. O risco de repetição na prole de homens portadores da translocação equilibrada (cerca de 5%) é menor do que o de mulheres na mesma condição (risco de 15 a 20%) porque os espermatozóides (70 a 80 x 106 por ml de ejaculação média total de 3 a 3.5 ml) são o elemento ativo na fecundação e provavelmente os portadores de aneussomias possuem desvantagem frente aos normais. Ambos os riscos acima são empíricos e diferem do teórico, estimado em 1/3, provavelmente porque a viabilidade de zigotos, embriões e fetos com trissomia do 21 é menor do que a de conceptos cariotipicamente normais. O risco teórico é 1/3 porque, dos seis tipos de zigotos resultantes da combinação dos gametas produzidos por portadores da translocação em estado equilibrado com o produzido por seu parceiro (21, D), apenas três são viáveis [(21,21,D,D), (21,21/D,D) e (21,21,21/D,D)] e um dêles (21,21,21/D,D) resulta em criança afetada pela síndrome de Down. Qual o risco de repetição de um caso de síndrome de Down cuja análise cariotípica mostrou a presença de uma translocação 15/21? Depende. Se a translocação for esporádica (presente apenas na criança), o risco de repetição é cerca de 1%. Se o pai for portador da translocação equilibrada, o risco de repetição é estimado em 5%; se a translocação estiver presente na mãe, o risco fica sendo 15%. Por que os riscos de recorrência de síndrome de Down são sempre maiores que os de ocorrência na prole de mulheres de mesma faixa etária? 50 Porque entre as mulheres que já tiveram crianças afetadas por síndrome de Down por trissomia simples existem evidentemente mais casos de mosaicismo e de portadoras de genótipos que favorecem a não-disjunção que entre as mulheres de mesma idade que não tiveram crianças com o defeito. Se admitirmos que as freqüências de mulheres portadoras de mosaicismo e de genes para não disjunção sejam ambas da ordem de 1/1000 e que a chance de criança afetada por mongolismo na prole dessas mulheres seja cerca de 1/10, vem que o risco na população de nascer uma criança com síndrome de Down é 0.001 x 0.1 + 0.001 x 0.1 + 0.98 x 1/500 = 0.0001 + 0.0001 + 0.00196. Dado, agora, que já nasceu uma criança com síndrome de Down, a probabilidade de que a mãe seja portadora de mosaicismo ou de genes para não-disjunção fica sendo 0.0002/(0.0002+0.00196) = 0.0926. O risco de repetição de síndrome de Down na prole de tais mulheres fica sendo, então, 0.0926 x 0.1 + 0.9074 x 1/500 = 0.011 ou cerca de 1%. Um casal tem uma primeira criança afetada por síndrome de Down por trissomia com translocação 21/21. Esta mesma translocação está presente em estado equilibrado no pai da criança. O médico do casal aconselhou a mulher a se submeter a uma biópsia de vilosidade coriônica na eventualidade de uma nova gravidez. O que você acha dessa orientação? Se a translocação é 21/21 e se estiver em estado equilibrado no pai da criança, é sinal de que os espermatozóides que este produzir ou possuirão o cromossomo em dose dupla ou não terão nenhum cromossomo 21. Espermatozóides nulissômicos quanto ao 21 originarão zigotos monossômicos inviáveis quanto ao 21. Concluímos portanto que toda vez que a mulher engravidar o concepto será fatalmente trissômico quanto ao cromossomo 21. É claro que se você for o médico da família e for dono de um serviço de diagnóstico pré-natal você poderá dizer à família que é importante fazer o exame para verificar se isso tudo é verdade mesmo. Que você entende por limiar de predisposição? Admite-se que os sistemas poligênicos, quando íntegros, protegem adequadamente o desenvolvimento embrionário contra fatores ambientais nocivos; mas que, se vários genes deletérios estiverem presentes, tal proteção pode enfraquecer-se a ponto de fatores ambientais adversos, banais em condições normais, desencadearem defeito congênito. No mecanismo multifatorial existe, portanto, um limiar de predisposição hereditária, que, se for ultrapassado, em conseqüência do acúmulo de poligenes detrimentais, torna o indivíduo propenso a desenvolver determinada malformação congênita, na dependência da existência de fatores ambientais nocivos. A estenose hipertrófica do piloro e a luxação congênita do quadril são duas doenças com limiares bastante diferentes nos dois sexos. Por que o risco de ocorrência da doença na prole de um afetado pertencente ao sexo menos freqüentemente atingido pelo defeito é maior que na situação inversa? Por que o risco é maior quando o defeito no progenitor é mais grave? Como os limiares são diferentes nos dois sexos, indivíduos pertencentes ao sexo menos freqüentemente afetado na população estão de alguma forma mais protegidos contra o defeito, de modo que precisam, para serem afetados, receber uma carga de genes deletérios maior que indivíduos pertencentes ao sexo mais comumente afetados. Isso explica o fato de o 51 risco de repetição na família ser maior quando o propósito pertence ao sexo menos freqüentemente afetado na população. De igual maneira, quanto mais grave o defeito, mais genes deletérios recebeu o afetado de seus progenitores; devido a isso, progenitores de casos mais graves possuem risco maior de repetição do defeito em sua prole que o de progenitores de casos mais leves do defeito. Como se calcula o risco de recorrência em doenças condicionadas por mecanismo multifatorial? Que nome recebe esse risco e por quê? De que ordem de grandeza esse risco é geralmente? O risco de recorrência é calculado verificando-se a freqüência de afetados entre todos os irmãos nascidos após os propósitos das famílias. Esse risco recebe o nome de empírico porque é estimado diretamente a partir de dados amostrais, sem ter que lançar mão de nenhum modelo teórico. Geralmente a ordem de grandeza desse risco situa-se entre 1-2 e 10%, com freqüência modal da ordem de 4-5%. Como você orientaria um casal que já anencefalia? Qual a causa desse defeito? teve uma criança portadora de As anomalias resultantes de defeitos de fechamento do tubo neural (anencefalia, meningomielocele e espinha bífida) estão relacionadas, pois as famílias que apresentam casos de uma delas são mais propensas a apresentar casos da outra. A incidência da anencefalia é de 1-2 por 1.000 nascimentos e a da espinha bífida, de 3 por 1.000. Os dois defeitos ocorrem com freqüência duas vezes maior em crianças do sexo feminino. O risco de recorrência de uma ou outra anomalia para nova criança da irmandade de afetado isolado é da ordem de 4%. Quando existem dois afetados na irmandade, o risco sobe para 10%. Recomenda-se às mulheres que já tiveram uma criança com esse defeito que se submetam a uma suplementação de ácido fólico, na dose de 4mg/dia, durante pelo menos um mês antes da gravidez e que a medicação seja mantida durante os três primeiros meses da gestação. Com isso o risco de repetição reduz-se à metade aproximadamente. E um casal com um filho com hidrocefalia? Qual a causa desse defeito? O risco de recorrência da hidrocefalia multifatorial para nova criança da irmandade do propósito é de 5%. Em contraste, a incidência na população geral é de 3 por mil, sem contar os casos infecciosos e devidos a tumor intracraniano. É importante lembrar, entretanto, que há tipos de hidrocefalia que são produzidos por genes autossômicos recessivos (hidrocefalia devida à atresia do orifício de Luschka ou de Magendie) e outro tipo determinado por gene recessivo ligado ao X (hidrocefalia por estenose congênita do aqueduto de Sylvius). Em ambos os casos, o risco de recorrência se eleva para cifras da ordem de 25%. E um casal com um parente afetado por retardo mental? Quais as causas desse problema? As origens do retardo mental (RM) são várias e, com freqüência, difíceis de descobrir. Podem ser genéticas (anormalias cromossômicas, monogenes dominantes, recessivos, ligados ao cromossomo X, poligenes) ou ambientais (pré-natais, perinatais e pós-natais). Quase todas as alterações estruturais dos cromossomos, seja por falta ou por excesso de material genético, desequilibram o delicado sistema poligênico que condiciona a 52 inteligência. O RM é raro e, quando existe, é leve nas síndromes de um X ou três X em mulheres, na do duplo Y no homem, nas translocações equilibradas e em alguns mosaicismos. Nas outras anomalias - trissomias, deleções, duplicações, translocações não equilibradas - o RM ocorre em grau diverso. Dentre as trissomias autossômicas, a de prognóstico menos sombrio quanto à reabilitação é a do cromossomo 21 (síndrome de Down). Variam, de caso a caso, o grau do RM e as possibilidades de educação. Muitas síndromes hereditárias, mal formativas ou não, incluem o RM entre seus sinais. Várias, como a fenilcetonúria e a galactosemia, decorrem de defeitos metabólicos autossômicos recessivos. Outras são autossômicas dominantes. A afecção de RM mais freqüente depois da síndrome de Down é a síndrome do X frágil, devida a gene recessivo ligado ao cromossomo X. Várias substâncias tóxicas ou medicamentosas, usadas nos três primeiros meses de gestação, podem produzir afecções. Gestantes alcoólatras podem ter crianças com a síndrome fetal alcoólica em que um rebaixamento do QI (50 a 80) acompanha sinais físicos, como atraso de crescimento, microcefalia discreta, comprometimento de movimentos delicados, irritabilidade e hiperatividade, sopro cardíaco. Infecções da gestante por vírus podem prejudicar a criança. A síndrome da rubéola fetal é a mais importante. Produz defeitos variados, especialmente microcefalia, oligofrenia, surdez, catarata, estenose pulmonar. Toda mulher que nunca teve rubéola deve vacinar-se antes da primeira gestação. Entre as causas perinatais, estão a prematuridade, o parto distócico com hipoxia ou anoxemia intercorrente, a incompatibildiade materno-fetal Rh e a hiperbilirrubinemia, que pode lesar centros encefálicos. As causas pósnatais são traumatismos com lesão do sistema nervoso central, envenenamentos, perturbações vasculares ou degenerativas cerebrais, convulsões. É causa significante do RM, nos países em desenvolvimento, a desnutrição, tanto da gestante como da própria criança. A deprivação emocional interfere com a manifestação da inteligência explícita, produzindo desempenho de retardado em crianças intrinsecamente normais. Outras vezes atribui-se um atraso de aprendizagem ao RM, quando ele decorre, de fato, de dificuldades de audição ou visão. Diante de um caso isolado de RM sem indicação alguma de sua etiologia, aplicam-se riscos empíricos de recorrência, que são da ordem de 6% para parentes em primeiro grau (filhos, irmãos) de afetados e de 2.5% para parentes em segundo grau (sobrinhos). Para parentes mais afastados o risco não difere em ordem de grandeza do da população geral, que é da ordem de 1%. Por que a taxa de concordância em gêmeos dizigóticos (5%) é ligeiramente superior ao risco de recorrência do lábio leporino para irmãos de afetados (4%)? A taxa de concordância entre gêmeos DZ é ligeiramente superior ao risco de recorrência para irmãos porque o ambiente pré-natal dos gêmeos DZ é mais homogêneo do que o de dois irmãos nascidos em épocas diferentes. DOENÇAS E DEFEITOS ETIOLOGICAMENTE HETEROGÊNEOS Existem cerca de 30 locos capazes de abrigar genes autossômicos recessivos para surdez. Supondo que todos esses genes ocorram com freqüências aproximadamente iguais e que a freqüência de surdez autossômica recessiva seja da ordem de 0.00075 ao nascimento na população geral, quantas vezes é mais provável nascer uma criança com esse tipo de surdez na prole de primos em primeiro grau do que na de casais nãoconsangüíneos? 53 A freqüência ao nascimento de cada um dos 30 tipos diferentes de surdez autossômica recessiva é 0.00075/30 = 0.000025. Daí tiramos que a freqüência de qualquer um desses genes é q = √(0.000025) = 0.005 = 1/200. Portanto, em relação a qualquer um desses tipos de surdez recessiva (e também em relação ao total de casos de surdez recessiva) existirão (q2+pqF)/q2 = 1+pF/q = 1+199/16 = 13.4375 vezes mais afetados na prole de primos do que na prole de pessoas não aparentadas entre si. Cerca de 25% dos casos de uma determinada doença são produzidos por mecanismo autossômico recessivo e os restantes por mecanismo autossômico dominante com penetrância incompleta (K = 0.80). Sabendo-se que na população cerca de 1% dos casamentos ocorrem entre primos em primeiro grau e o restante entre pessoas não-aparentadas, pergunta-se: qual o risco de repetição da doença na prole de um casal não-consangüíneo que já tem uma criança afetada? E se o casal for de primos em primeiro grau? E se nascer uma segunda criança também afetada? Se o casal for não-consangüíneo, o risco de repetição da doença é calculado segundo R = 25% x 1/4 + 75% x K(1-K)/2 = 1/16 + 3/4 x 2/25 = 1/16 + 3/50 = 98/800 = 0.1225 ou 12.25%. Se o casal for de primos em primeiro grau, as probabilidades a priori 0.25 e 0.75 favorecendo as hipóteses de mecanismo recessivo e dominante se alteram, pois a ocorrência de consangüinidade parental aumenta a probabilidade de tratarse da variante recessiva. De fato, nessa eventualidade, para uma freqüência q = 0.01 como fornecida, a probabilidade de ocorrência de prole afetada está 7.1875 vezes aumentada em relação à situação de ausência de consangüinidade. Portanto, as probabilidades a priori favorecendo as hipóteses recessiva e dominante não estarão mais entre si como 1/4 = 0.25 e 3/4 = 0.75, mas sim como 7.1875 x 1/4 = 1.796875 para 1 x 3/4 = 0.75, de modo que agora P(rec) e P(dom) valem 0.7055 e 0.2945. O risco de repetição da doença é então calculado segundo R = 0.7055 x 0.25 + 0.2945 x 0.08 = 0.1999 ou cerca de 20%. Se nascer uma segunda criança afetada (probabilidade 1/4 = 0.25 na hipótese de mecanismo recessivo e probabilidade 2/5 = 0.40 na hipótese dominante) essas duas taxas de segregação vão interferir nas probabilidades a priori 0.25 e 0.75 favorecendo as hipóteses AR e AD: as probabilidades favorecendo esses dois mecanismos ficam então entre si assim como 1/4 x 1/4 = 0.0625 e 3/4 x 2/5 = 0.30, de modo que P(rec) = 0.0625/0.3625 = 0.1724 e P(dom) = 0.30/0.3625 = 0.8276. O risco para uma criança seguinte fica sendo portanto R = P(rec).R(rec) + P(dom).R(dom) = 0.1724 x 0.25 + 0.8276 x 0.4 = 0.3741. Na hipótese de consangüinidade parental presente, as probabilidades 0.7055 e 0.2945 anteriormente determinadas ficam entre si como 0.7055 x 1/4 = 0.176375 e 0.2945 x 2/5 = 0.1178, de modo que agora P'(rec) = 0.176375/0.294175 = 0.5996 e P'(dom) = 0.1178/0.294175 = 0.4004. O risco para nova criança do casal é R = P'(rec).R(rec) + P'(dom).R(dom) = 0.5596 x 0.25 + 0.4004 x 0.4 = 0.3001 ou cerca de 30%. De um casal normal nasce um menino afetado por doença geneticamente heterogênea e letal. Sabe-se que 1/10 dos casos da doença são produzidas por mecanismo hereditário autossômico dominante de penetrância igual a 4/5, 1/5 por mecanismo autossômico recessivo, 3/10 por mecanismo ligado ao X recessivo e 2/5 constituem fenocópias com risco desprezível de repetição. Qual o risco de repetição da doença numa próxima criança que o casal venha a ter? Supondo-se que uma nova criança (um menino) nasça igualmente afetado, qual o risco para uma terceira criança? E se a segunda criança afetada for uma menina? 54 O risco para uma segunda criança afetada é obtido ponderando-se os riscos apropriados a cada mecanismo (Rx) pelas probabilidades a priori favorecendo cada um dos mecanismos (Px) e somando-se esses produtos: Px Rx Px.Rx ---------------------------------------------------AD 1/10 K(1-K)/2 = 0.08 0.0080 AR 1/5 1/4 = 0.25 0.0500 XR 3/10 2/3.1/4 = 0.17 0.0500 fenoc. 2/5 0 0.0000 ---------------------------------------------------ΣPx.Rx = 0.1080 Se nascer um segundo menino afetado, a possibilidade de fenocópia é afastada (ficando possíveis apenas os mecanismos AD, AR e XR, cujas probabibilidades a priori tornam-se 1/6, 2/6 e 3/6) e os riscos nas hipóteses de AD, AR e XR fixam-se em K/2, 1/4 e 1/4 respectivamente. A própria ocorrência do segundo afetado, no entanto, distorce as probabilidades favorecendo os diversos mecanismos, pois as taxas de segregação (0.40, 0.25 e 0.25) são diferentes. Levando-se isso em conta, as probabilidades favorecendo as hipóteses de doença AD, AR e AX ficam sendo respectivamente (1/6 x 2/5)/(1/6 x 2/5 + 2/6 x 1/4 + 3/6 x 1/4) = 24/99, (2/6 x 1/4)/(1/6 x 2/5 + 2/6 x 1/4 + 3/6 x 1/4) = 30/99 e (3/6 x 1/4)/(1/6 x 2/5 + 2/6 x 1/4 + 3/6 x 1/4) = 45/99. Como no caso anterior, o risco final para uma próxima criança é mostrado ao pé da tabela seguinte Px Rx Px.Rx ---------------------------------------------------AD 24/99 K/2 = 0.40 0.0970 AR 30/99 1/4 = 0.25 0.0758 XR 45/99 1/4 = 0.25 0.1136 ---------------------------------------------------ΣPx.Rx = 0.2864 Se nascer uma segunda criança afetada e esta for uma menina, as possibilidades de mecanismo recessivo ligado ao X e de fenocópia são afastadas (ficando possíveis apenas os mecanismos AD e AR, cujas probabibilidades a priori tornam-se 1/3 e 2/3) e o risco na hipótese de AD fixa-se em K/2. A própria ocorrência da segunda afetada, no entanto, distorce as probabilidades favorecendo os mecanismos AD e AR, pois as probabilidades de ocorrência do segundo afetado [K(1-K)/2 = 8/100 = 2/25 e 1/4] são diferentes nas hipóteses dominante e recessiva. Levando-se isso em conta, as probabilidades favorecendo as hipóteses de doença AD e AR ficam sendo respectivamente (1/3 x 2/5)/(1/3 x 2/5 + 2/3 x 1/4) = 24/54 e (2/3 x 1/4)/(1/3 x 2/5 + 2/3 x 1/4) = 30/54. Como no caso anterior, o risco final para uma próxima criança é mostrado ao pé da tabela seguinte Px Rx Px.Rx ---------------------------------------------------AD 24/54 K/2 = 0.40 0.1778 AR 30/54 1/4 = 0.25 0.1389 55 ---------------------------------------------------ΣPx.Rx = 0.3167 56 ASESORAMIENTO GENÉTICO Y CÁLCULO DE RIESGOS Paulo A. Otto [[email protected]] Departamento de Genética e Biologia Evolutiva Instituto de Biociências Universidade de São Paulo Caixa Postal 11461 05422-970 São Paulo SP Brasil PRIMER CURSO DE GENÉTICA MÉDICA 19-21 Octubre 2005 Laboratorio de Citogenética y Genética Humana DEPARTAMENTO DE GENÉTICA FCEQyN / UNaM RESUMEN DE LAS CLASES (SLIDES) Todo el texto y todas las ilustraciones Paulo A. Otto 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 ASESORAMIENTO GENÉTICO y CÁLCULO DE RIESGOS Paulo A. Otto [[email protected]] Departamento de Genética y Biología Evolutiva Instituto de Biociencias Universidad de Sao Paulo Casilla Postal 11461 05422-970 Sao Paulo SP Brasil Capítulo “Aconselhamento genético e cálculo de riscos”. En Lopes AC, Amato Neto V (ed.), del libro Tratado de Clínica Médica, Editora Roca, São Paulo, 2006, Volume I, pp. 311-322.). Este material fue reproducido y traducido del portugués al castellano por las Doctoras Carola Cheroki y Carina Francisca Argüelles (Curso de Genética, Facultad de Ciencias Exactas Químicas y Naturales, Universidad Nacional de Misiones, Posadas, Republica Argentina) bajo autorización expresa de la Editora Roca (São Paulo, Brasil), detentora de los derechos autorales de la obra Tratado de Clínica Médica. 92 Introducción: qué entendemos aquí por Asesoramiento Genético A pesar de que el nombre sugiere de inmediato algún tipo de intervención psicológica, el asesoramiento genético tiene por finalidad primaria el cálculo de los riesgos de repetición de una enfermedad con cualquier tipo de determinismo genético en la progenie de un matrimonio, generalmente perteneciente a la familia o al núcleo familiar más restricto donde que nació el afectado. Son todavía actividades ligadas de manera directa al asesoramiento genético la transmisión adecuada de esa información, en un lenguaje adaptado al medio socio-económico-cultural de los consultantes, de modo que ello pueda ser entendido (de la misma manera como se explica como debe ser tomado un antibiótico para combatir un estado infeccioso), y el apoyo psicológico que debe ser dado a la familia en el sentido de ayudarla a adoptar una actitud racional al respecto (de la misma manera como se explica a un consultante detalles sobre la naturaleza y el pronóstico de una enfermedad, incurable o no, diagnosticada en él o en un hijo menor). En estas dos últimas actividades el médico debe tener entrenamiento adecuado, sea un especialista o un generalista. Es frecuente listar, como etapas todavía pertinentes al asesoramiento genético, además de las mencionadas arriba, el diagnóstico de la afección o la comprobación de la misma, mediante la aplicación de exámenes complementarios y de laboratorio cuando son indicados, y la orientación terapéutica, si existe. Con los progresos fantásticos de la medicina que ya fueron implantados en los países del primer mundo, la realidad es que los diversos especialistas (pediatra, neurólogo, dermatólogo, etc.) ya van teniendo entrenamiento clínico adecuado en el reconocimiento, diagnóstico y orientación de las enfermedades genéticas, que ya constituyen en esos lugares, en su conjunto, la principal causa de morbilidad y mortalidad en los primeros y en los últimos años de vida. Todavía mas, con el desarrollo vertiginoso de las técnicas de biología molecular aplicables al diagnóstico de esas enfermedades, el interés por ellas aumentó de manera desproporcionada en los últimos diez a veinte años, inclusive en países francamente subdesarrollados. En los países en desarrollo como los nuestros, esa situación ya existe pero apenas en los grandes centros de los estados mas desarrollados económica e industrialmente. Inclusive así, debido a los problemas crónicos del subdesarrollo, muchos servicios de asesoramiento genético se ven, aunque localizados en esos envidiables bolsones de progreso, obligados todavía a efectuar esas etapas de diagnóstico y orientación. En el presente capítulo encaramos esto como expediente de emergencia, abocándonos de manera especial al cálculo de riesgos. Indicaciones de asesoramiento genético Con poquísimas excepciones, todos los consultantes derivados a los servicios de asesoramiento genético lo hacen con la finalidad de obtener informaciones sobre la existencia de riesgos genéticos aumentados para su descendencia. En la mayoría de los casos, ellos son matrimonios normales que tuvieron uno o mas niños afectadas cuyos problemas se encuadran en una de las siguientes categorías: retardo mental atribuible claramente a causas ambientales; defecto físico aislado o no, con o sin retardo mental; síndrome, defecto o enfermedad condicionada por mecanismo monogénico (autosómico o ligado al X, recesivo o dominante), mecanismo multifactorial o alteración cromosómica. Con cierta frecuencia son atendidos también matrimonios consanguíneos, generalmente sin hijos y sin casos de enfermedades genéticas en sus familias, los cuales desean informarse al respecto de la existencia de eventuales riesgos de 93 enfermedad genética, a consecuencia de la consanguinidad, en su futura prole. También buscan los servicios de asesoramiento genético con la finalidad de informarse sobre la existencia de riesgos genéticos aumentados para a su progenie las personas relativamente añosas y los individuos expuestos accidental, terapéutica o profesionalmente a radiaciones o a drogas y fármacos con capacidad mutagénica. Finalmente son atendidas personas adultas afectadas o normales, y por lo tanto parientes próximos de individuos portadores de defectos supuestamente genéticos o hereditarios, y que son derivados a los servicios con la misma finalidad. El papel del clínico general, del especialista no genetista, del médico especializado en genética clínica y del genetista humano no médico En situaciones simples, como por ejemplo el asesoramiento genético de matrimonios que tuvieron un niño afectado con síndrome de Down por trisomía simple o un niño afectado por enfermedad autosómica recesiva como el albinismo óculo-cutáneo o la fenilcetonuria, tanto el clínico general como el especialista clínico no genetista pueden realizar perfectamente el asesoramiento genético del matrimonio. Esto es extremamente deseable, desde que como médico de la familia el tendrá naturalmente mayor facilidad no sólo en la orientación general sino también en la prestación de auxilio psicológico para ayudar al matrimonio a tomar alguna actitud racional frente a la situación. Cuando su sentido común le indique que no está preparado para ello, o simplemente cuando se sienta inseguro frente a las complejidades de la situación, el médico derivará el caso a un servicio de asesoramiento genético o a un especialista en genética clínica, con la misma naturalidad con que deriva sus pacientes para la opinión o consulta con un especialista en Oncología, Hematología etc. Los especialistas en genética clínica son médicos que tuvieron entrenamiento específico en el reconocimiento (diagnóstico) y en la orientación (asesoramiento genético) de enfermedades con componente genético importante. Inicialmente ese objetivo era conseguido exclusivamente a costas de cursos de pos-grado con énfasis en las áreas de genética humana y genética médica, como los ofrecidos en Brasil por las Universidades de San Pablo, Federal de Paraná y Federal de Río Grande del Sur. Más recientemente, los conocimentos necesarios son adquiridos también a través de pasantías de especialización y residencia médica, como es el caso de los cursos ofrecidos por la Facultad de Medicina de Ribeirão Preto de la USP y por la Facultad de Ciencias Médicas de la Universidad Estadual de Campinas. Todavía más recientemente, la Sociedad Brasileña de Genética Clínica viene otorgando títulos de especialista a los profesionales del área médica aprobados en concursos realizados periódicamente con esa finalidad específica. Con la mejora de las condiciones médico-sanitarias que se observan en los países subdesarrollados, por un lado, y en desarrollo, por otro lado, inclusive los especialistas no genetistas vienen enfrentándose cada vez más con casos de enfermedades genéticas. En un futuro relativamente próximo el especialista clínico no genetista deberá recibir entrenamiento adecuado para lidiar con las enfermedades genéticas de su área, quedando capacitado para acompañar, por lo menos gran parte de los casos que suceden dentro de su clínica, lo que ya ocurre hace algún tiempo con especialistas en Neurología, Pediatría y Ortopedia (apenas para citar algunas especialidades) formados en buenas facultades de los grandes centros brasileños. Generalmente las especialidades médicas se concentran en grupos o subgrupos de enfermedades cuyos denominadores comunes son los aparatos y 94 sistemas (como en el caso de la otorrinolaringología, oftalmología, dermatología, etc.) o la edad o el sexo de los afectados (pediatría, ginecología, etc.) o inclusive, en circunstancias especiales como el embarazo y la infertilidad (obstetricia y clínica de reproducción e infertilidad). Muy rara vez las especialidades son agrupadas por el modo de acción o transmisión del patógeno: clásicamente, eso ocurría con las enfermedades tropicales o exóticas, generalmente de naturaleza parasitaria, y con las enfermedades infecciosas; el agrupamiento aquí se justificaba por el hecho de que esas enfermedades poseen prevalencia poblacional elevada y son fácilmente reconocibles, ya que presentan una serie de señales y síntomas típicos en común. La especialidad de Genética Clínica, que al principio trata de un grupo heterogéneo de enfermedades que pertenecen a varias especialidades clínicas clásicas, aglutina en si el estudio de condiciones cuyo único punto de contacto es su causa ("enfermedades de origen genético") o el modo de transmisión ("enfermedades hereditarias"), cuando esto ocurre. El factor complicado de ello es la frecuencia, generalmente insólitamente baja, con que ocurren esas enfermedades o defectos. Eso hace que hasta el especialista en Genética Clínica esté obligado constantemente a involucrarse con problemas interminables y cada vez mas complicados de diagnóstico diferencial. En los últimos tiempos esos problemas vienen minimizándose debido a la masa crítica ya relativamente numerosa de especialistas, a la proliferación en ritmo frenético de exámenes especializados de laboratorio que facilitan enormemente el diagnóstico diferencial de muchas enfermedades con mecanismos de transmisión diferentes; y a la existencia de bancos de datos actualizados sobre esas enfermedades, de acceso fácil a través de la red electrónica. El mejor de estos bancos de datos (OMIM = Mendelian Inheritance in Man) es el organizado por el Prof. Víctor McKusick, de la Universidad Johns Hopkins en los Estados Unidos, con acceso a través de la dirección electrónica (en la red World Wide Web o www de la Internet) http://www.ncbi.nlm.nih.gov/Omim/searchomim.html. Además de permitir la búsqueda de prácticamente todas las condiciones patológicas hereditarias conocidas, ese banco de datos ofrece listas de patologías con varias señales y síntomas en común, introducidos en el sistema por los usuarios, lo que facilita tremendamente el trabajo de diagnóstico diferencial no solamente para los genetistas sino también para especialistas o clínicos generalistas no genetistas. No tiene fundamento lógico la idea de que el asesoramiento genético no pueda ser realizado por no médicos, desde que la actividad en si no involucra diagnóstico por medios invasivos ni intervención terapéutica. Tanto es así, que en los Estados Unidos ya existe hasta la figura del especialista en asesoramiento genético, reconocida plenamente por la clase médica, de la misma manera que hace mucho años allá y más recientemente entre nosotros ya existe la especialidad de psicología clínica, ejercida por profesionales no médicos del área de psicología. Lo más importante de todo es que el asesor genetista tenga un buen entrenamiento en genética humana y esté actualizado sobre los aspectos generales de la patología en pauta, para ser capaz de orientar con seguridad a los afectados y sus familias. Este asunto viene siendo debatido de manera emocional desde hace bastante tiempo, con consecuencias injustas para el personal no médico ligado a la especialidad. De hecho, además de haber sido creado por esos profesionales, por muchos años el asesoramiento genético no fue sólo ejercido sino que también desarrollado por el personal ligado al área básica de investigación y apenas recientemente la actividad de la genética médica y clínica fue reconocida como importante por la propia clase médica, adquiriendo status de especialidad médica y trayendo como consecuencia situaciones de conflictos de intereses. El autor de este capítulo, que trabaja en servicios de asesoramiento genético desde los 95 años de internado médico del final del curso de medicina (1968), jamás vivenció personalmente algún problema realmente serio relacionado a eso. En el Departamento de Biología/Genética del Instituto de Biociencias de la USP, él trabaja desde 1972 en un servicio de asesoramiento genético donde médicos y biólogos conviven en perfecta armonía. Ese servicio nunca dejó de contar, en su equipo de atención al paciente, con médicos altamente entrenados en genética médica, la mayoría de los cuales con pos-graduación y doctorado en la especialidad, y con biólogos, muchos de los cuales llegaron a adquirir habilidad envidiable en lidiar con ciertas patologías, al punto de ser reconocidos por especialistas médicos, como es el caso de las distrofias musculares, el retardo mental y la sordera no sindrómica, áreas en las cuales el servicio es considerado centro de excelencia. Obviamente se sabe de abusos ocurridos esporádicamente aquí y allí, como por ejemplo casos raros de genetistas no médicos que tratan problemas eminentemente clínicos o de médicos que practican la especialidad sin ningún conocimiento técnico en el asunto, simplemente porque se juzgan con derecho de hacerlo por ser médicos. Pero esos casos raros poco a poco van siendo cohibidos por la censura inter-pares y por el control de las sociedades y órganos de clase, tanto de médicos como de biólogos y de otros profesionales no médicos del área de salud. Cuándo, genético cómo y dónde derivar posibles casos de asesoramiento En los casos en que se desconfía de la participación de factores genéticos, o en cualquier caso para cuya orientación no se sienta preparado o seguro, el médico deberá derivar a la familia a un servicio de asesoramiento genético o al especialista en genética clínica, como ya mencionáramos superficialmente más arriba. Como se acostumbra hacer en la derivación correcta de pacientes a especialistas para su opinión o para algún examen especializado, es deseable que la familia reciba de su médico, antes de la consulta con el genetista, un relatorio sobre el caso, incluyendo la sospecha clínica y un resumen de los exámenes y procedimientos ya realizados. A pesar de que la situación ha mejorado bastante en los últimos años, los servicios de genética médica y asesoramiento genético (principalmente los de naturaleza más pública) todavía acostumbran recibir con cierta frecuencia derivaciones resumidas conteniendo, como mucho, apenas la indicación "síndrome genético para descubrir". Muchos servicios de asesoramiento genético, tanto en el Brasil como en el extranjero, continúan ligados a Departamentos Universitarios, generalmente de Facultades de Biología, Biociencias, Biomédicas o afines, que funcionan independientemente de Facultades de Medicina o de Hospitales Universitarios. Muchos servicios de genética clínica o médica que funcionan ligados a las Facultades de Medicina y Hospitales Universitarios fueron fundados por especialistas en Genética Humana y Médica no médicos o por médicos que tuvieron su entrenamiento en la especialidad apenas a través de cursos de pos-graduación en instituciones no médicas. Todo ello se explica por el hecho de que prácticamente toda la investigación básica en el área se originó en esas últimas instituciones, orientadas por investigaciones profesionales. En los últimos tiempos la situación viene profesionalizándose cada vez más (tanto en el exterior como en el Brasil), de manera que prácticamente todos los servicios no ligados directamente a Facultades de Medicina o a hospitales poseen en sus equipos a médicos con entrenamiento en genética clínica, los cuales interactúan con los demás profesionales del servicio, especialistas en citogenética no médicos, biología molecular o cálculo de 96 riesgos, por ejemplo. En los Estados Unidos, los servicios frecuentemente se encuentran en las Universidades, donde los departamentos médicos se encargan directamente de los casos de rutina sin interés en investigación básica y de los casos con utilidad en la experimentación clínica y terapéutica, mientras que los ligados a los departamentos de investigación básica en genética reciben prioritariamente los casos con interés académico y científico. La Sociedad Brasileña de Genética Clínica disponibiliza en su site (http://www.sbgc.org.br/) listas de servicios de asesoramiento genético y de especialistas en genética médica y clínica. Enumeramos abajo algunos de esos servicios localizados en el Estado de San Pablo en Brasil y citados por Brunoni (1997). En la mayoría de esos servicios las consultas son marcadas por teléfono y los consultantes, o profesionales que los estuvieran derivando, deben esa ocasión dar informaciones resumidas sobre el caso, incluyendo el diagnóstico sospechado y los exámenes solicitados (eso es importante porque ya existe un cierto grado de especialización dentro de cada servicio). Ellos son: Centro de Estudos do Genoma Humano, reuniendo los servicios de asesoramiento genético del Laboratorio de Genética Humana, Unidad de Asesoramiento Genético y Laboratorio de Genética Molecular Humana (Departamento de Biología/Genética del Instituto de Biociencias de la Universidad de San Pablo en San Pablo SP); Unidad de Genética Clínica, Instituto da Criança, Hospital de Clínicas da Facultad de Medicina, Universidad de San Pablo (San Pablo SP); Centro de Genética Médica da Escola Paulista de Medicina, Universidad Federal de San Pablo (San Pablo SP); Departamento de Genética, Hospital de Lesões Lábio-Palatais, Faculdade de Odontologia, Universedad de San Pablo (Bauru SP); Departamento de Genética, Faculdade de Ciências Médicas, Universidad Estadual de Campinas (Campinas SP); Servicio de Asesoramiento Genético, Departamento de Genética, Instituto de Biociências/Faculdade de Medicina, Universidad Estadual Paulista (Botucatu SP); Setor de Genética Clínica, Hospital de las Clínicas de Ribeirão Preto, Universidad de San Pablo (Ribeirão Preto SP). Riesgos de recurrencia en situaciones simples Entendemos aquí como simples las siguientes situaciones: a) Casos de ocurrencia aislada (o sea sin repetición en la familia) de enfermedades diagnosticadas correctamente y sabidamente determinadas por cualquiera de los mecanismos siguientes: monogénico (recesivo o dominante, autosómico o ligado al cromosoma X), multifactorial y cromosómico. Los consultantes que se encuadran en ésta y en la categoría listada abajo corresponden a matrimonios normales que tuvieron niños afectados; individuos afectados; y parientes próximos de afectados. b) Casos de ocurrencia familiar (o sea con repetición en la familia) de enfermedades diagnosticadas correctamente y sabidamente determinadas por cualquiera de los mecanismos mencionados en el ítem anterior; o enfermedades no diagnosticadas o desconocidas pero que no dejan dudas, a través de su patrón de segregación en el heredograma de la familia, sobre su mecanismo de transmisión. c) Casos de matrimonios consanguíneos, generalmente primos simples en primer grado, sin hijos afectados y generalmente sin parientes próximos afectados, que buscan orientación sobre la existencia de riesgos genéticos para su prole, en relación apenas a la consanguinidad existente. d) Casos de personas relativamente añosas, que desean informarse sobre la existencia de riesgos genéticos dependientes de la edad para su descendencia. No trataremos aquí de otras situaciones igualmente simples, pero que son relativamente raras, como la exposición accidental o profesional a agentes mutagénicos o teratógenos químicos y físicos. Esas y otras situaciones son tratadas con algún detalle en obras estandarizadas y 97 libros-texto sobre genética clínica y médica o sobre asesoramiento genético como los enumerados en la sesión de referencias bibliográficas. Riesgos para hermanos de casos aislados de enfermedades, síndromes o defectos condicionados por mecanismo monogénico, multifactorial o cromosómico A pesar de constituir la condición de comprensión menos intuitiva y más complicada, es la que con mayor frecuencia ocurre en la práctica del asesoramiento genético. Por eso comenzaremos por ella, mostrando, de manera lo mas intuitiva e informal posible, cómo son estimados los riesgos de recurrencia en la descendencia de matrimonios normales que tuvieron aisladamente un niño afectado. Mecanismo monogénico Las enfermedades monogénicas son determinadas por genes que ocurren con frecuencias generalmente muy bajas en la población, una vez que, tratándose de enfermedades, promueven de manera directa o indirecta una disminución del desempeño reproductivo de los afectados y el consecuente bloqueo o disminución de la transmisión del gen patológico (generalmente referido como mutante, para contrastarlo con o alelo normal). Denominando s a esa disminución relativa (que en genética recibe el nombre de coeficiente de selección), la frecuencia de la enfermedad al nacimiento, en cada generación, acaba fijándose en una tasa muy baja que resulta del equilibrio entre las fuerzas opuestas de la introducción de alelos recién mutados por generación y de la eliminación de los mismos por selección negativa de los afectados. Cuando se trata de una mutación autosómica dominante que impide que su portador se reproduzca, la frecuencia de la enfermedad al nacimiento se fija en un valor igual a dos veces la tasa de mutación del gen (2u), o sea, solamente nace afectado un niño que recibió el gen recién mutado en el espermatozoide (con probabilidad u) o en el óvulo (con la misma probabilidad u) que lo originó. En casos en que la enfermedad apenas disminuye el desempeño reproductivo de su portador, lo que resultará en que él tenga, en promedio, un número menor de hijos que un individuo cualquiera sin la mutación, la frecuencia de la enfermedad en la población se fijará en un valor determinado por el equilibrio entre la cantidad de mutaciones introducidas por generación en la población (cantidad que es dada exactamente por la tasa de mutación del gen, que posee un orden de magnitud irrisoria, entre 10-4 y 10-8) y al total de genes eliminados por generación: si el desempeño reproductivo de los afectados es w = 1-s en relación a los no afectados, la probabilidad de eliminación del afectado es 1-w = s. Ahora, con rarísimas excepciones, los afectados por enfermedades autosómicas dominantes son heterocigotas. De hecho, los homocigotas solo podrían surgir si ocurriera una mutación en ambas gametas que los originasen a partir de progenitores en el afectado, o de la unión de una gameta con el gen patológico producido por un afectado mas una gameta mutada producida por el compañero normal, o todavía de gametas con el gen deletéreo producidos por un matrimonio de afectados; y la probabilidad de ocurrencia al azar de cada una de esas situaciones es absolutamente despreciable. Cada vez que uno de esos 98 afectados heterocigotas es eliminado por selección (en la tasa de 1 afectado por N individuos de la población) está ocurriendo eliminación de un gen deletéreo A, en la tasa de 1 gen en relación a los 2N genes de la población; de todo eso resulta que, si la frecuencia de afectados heterocigotas al nacimiento es x = NAa/N y si la intensidad relativa de selección de ellos es s, la tasa de eliminación de genes A por generación es sx/2. En equilibrio (como sucede con las poblaciones relativamente antiguas), u = sx/2, de modo que la frecuencia de afectados al nacimiento en una población cualquiera es x = 2u/s, que se reduce a x = 2u cuando s = 1 (indicando que el gen es letal y que ningún afectado consigue reproducirse). Lo importante de todo eso es que el orden de magnitud de la incidencia de las enfermedades autosómicas dominantes y de los genes que las determinan es una cantidad insólitamente baja, prácticamente del orden de la tasa de mutación del gen. Todo esto explica el hecho de que, en la mayoría de los casos, los afectados por enfermedades autosómicas dominantes son casos aislados en sus familias, siendo el resultado de una mutación ocurrida en una de las gametas que los originaron. Generalmente no existe riesgo aumentado de repetición de la enfermedad en la familia cuando esa situación se configura y la enfermedad tiene penetrancia completa (significando que todos los heterocigotas Aa son afectados); cuando la penetrancia es incompleta, el riesgo de repetición de la enfermedad en un futuro hermano de un afectado aislado es R = K(1-K)/2, donde K es el valor de la tasa de penetrancia del gen. No es muy complicado deducir esta última fórmula, ya que el gen presente en el afectado y responsable de la enfermedad fue transmitido por uno de los progenitores heterocigota no penetrante o se originó de una mutación ocurrida en una de las gametas que lo originaron. Como un heterocigota normal solo puede serlo por haber recibido un gen (con probabilidad 1/2) no penetrante (con probabilidad 1-K) de cualquiera de sus progenitores también heterocigotas normales o de haber recibido una mutación recién ocurrida en la gameta paterna o en la materna que lo originó (probabilidad 2u), también no penetrante (probabilidad 1-K). Por lo tanto, P(het,nl) = 2 x P(het,nl)/2 x (1-K) + 2u(1-K), donde se obtiene que P(het) = 2u(1-K)/K . Si existe un afectado en la prole del matrimonio, eso puede haber sucedido de dos maneras : (1) el padre o la madre son heterocigotas no penetrantes, y transmitieron el gen al hijo y el gen penetró; (2) el padre o la madre son heterocigotas pero ocurrió una mutación en una de las gametas que originaron al hijo y finalmente el alelo mutado penetró. Las probabilidades conjuntas asociadas a los eventos (1) y (2) son respectivamente 2 x 2u(1-K)/K x 1/2 x K = 2u(1-K) y [1 - 2u(1-K)/K]2 x 2u x K ~ 2uK. La probabilidad favoreciendo la hipótesis de que uno de los progenitores es heterocigota no penetrante, dado que tiene un hijo afectado, queda determinada entonces como P(het|hijo afectado) = 2u(1-K)/[2u(1-K) + 2uK] = (1-K). Por lo tanto, el riesgo de que un nuevo niño del matrimonio nazca igualmente afectado se reduce realmente a R = K(1-K)/2, donde (1-K) es a probabilidad de heterocigosis para uno de los progenitores, 1/2 es la probabilidad de transmisión del alelo patológico y K es la probabilidad de que éste penetre, una vez transmitido. Ese riesgo como máximo es de 12,5%, valor que corresponde a una tasa de penetrancia K = 0,5; como esa tasa es, en realidad generalmente alta, del orden de 80% a 90% o mas, el riesgo de repetición tiende a ser bajo, 8% a 5%, o menos. Cuando el afectado tiene hermanos normales, esos riesgos son evidentemente menores, como se constata de la inspección de la Figura 1 y da Tabla 1 abajo, que muestran riesgos aplicables en la situación en que el afectado aislado, es parte de una hermandad con n (variando de 0 a 6) hermanos normales. 99 Figura 1 - Riesgos de recurrencia (R) de una enfermedad autosómica dominante con penetrancia incompleta en función de la tasa de penetrancia (K) y del número n (0,...,6) de hermanos normales del afectado. Tabla 1 - Riesgos de recurrencia (R) de una enfermedad autosómica dominante con penetrancia incompleta en función de la tasa de penetrancia (K) y del número n (0,...,6) de hermanos normales del afectado. -----+----------------------------------------------| n K |----------------------------------------------| 0 1 2 3 4 5 6 -----+----------------------------------------------0,00 0,000 0,000 0,000 0,000 0,000 0,000 0,000 0,10 0,045 0,045 0,045 0,044 0,044 0,044 0,043 0,20 0,080 0,078 0,076 0,074 0,072 0,070 0,068 0,30 0,105 0,100 0,094 0,088 0,082 0,076 0,070 0,40 0,120 0,109 0,098 0,087 0,076 0,066 0,056 0,50 0,125 0,107 0,090 0,074 0,060 0,048 0,038 0,60 0,120 0,095 0,074 0,056 0,041 0,030 0,022 0,70 0,105 0,076 0,054 0,037 0,025 0,017 0,011 0,80 0,080 0,052 0,033 0,020 0,013 0,008 0,005 0,90 0,045 0,026 0,015 0,008 0,005 0,003 0,001 1,00 0,000 0,000 0,000 0,000 0,000 0,000 0,000 ----------------------------------------------------- La situación es semejante en el caso de las enfermedades dominantes ligadas al cromosoma X. Comúnmente el cuadro clínico de los individuos de sexo masculino afectados (hemicigotas para el gen) es mucho mas grave o hasta letal, en contraste con las mujeres heterocigotas para el gen, que generalmente presentan un cuadro clínico menos severo, cuando son comparadas con las manifestaciones en hombres hemicigotas. Cuando el caso 100 es aislado en una familia, normalmente se trata de un afectado masculino, es casi seguro que la ocurrencia se debió a una mutación recién ocurrida en una gameta parental. En el caso de enfermedades recesivas ligadas al cromosoma X, la frecuencia del gen en la población es también mantenida en tasas muy bajas, próximas al valor de su tasa de mutación. De hecho, para que su frecuencia aumente sistemáticamente en la población seria necesario que ese gen fuese transmitido de generación en generación apenas a través de mujeres heterocigotas normales, pero la probabilidad de que eso ocurra es pequeña, porque cada vez que una mujer heterocigota tiene un niño, existe una probabilidad igual a 1/4 de que ese niño sea hemicigota para el gen deletéreo, que sufrirá selección intensa. Como la eliminación del gen se da exclusivamente a través de individuos afectados de sexo masculino y 1/3 de los cromosomas X de la población están en individuos de sexo masculino (en una población en que hembras XX y machos XY ocurren en proporciones prácticamente iguales), es fácil constatar que la eliminación de individuos afectados, sx, corresponde a la eliminación de 1/3 de los genes deletéreos contenidos en la población total; es intuitivo por lo tanto que en ese caso u = sx/3 y x, la frecuencia de afectados al nacimiento en la población general, se reduce a 3u/s, expresión que se iguala a 3u cuando s = 1 (en una enfermedad letal ligada al X, como es el caso de la distrofia muscular de Duchenne). Todavía en el caso letal, como la frecuencia de la enfermedad al nacimiento es 3u y u es la probabilidad de ocurrencia de la mutación en el cromosoma X que un niño recibe de su madre, se concluye que 1/3 de los casos de la enfermedad son el resultado de una mutación nueva; en los 2/3 restantes el gen mutante es heredado de madres heterocigotas clínicamente normales. En el caso general en que s es diferente de 1, la frecuencia de la enfermedad al nacimiento se fija en 3u/s, con una fracción resultando de una mutación nueva: la probabilidad de que un caso aislado cualquiera sea el resultado de mutación nueva se reduce por lo tanto a u/(3u/s) = s/3; la cantidad complementaria (3-s)/3 indica la probabilidad del caso ser heredado. Por ejemplo, en el caso de la distrofia muscular de Becker o en el caso de la hemofilia por deficiencia del factor VIII, el coeficiente de selección de los afectados fue estimado en aproximadamente 30%. Las probabilidades de que un caso aparentemente aislado de esas enfermedades sea el resultado de una mutación nueva, o de haber sido heredada son respectivamente 10% y 90%. Estas cifras, mientras tanto, se aplican formalmente apenas en la situación en la que no existe información alguna sobre los ascendientes directos del afectado. Cuando existen esas informaciones, sabiendo que en el fueron encontrados afectados entre sus ascendientes directos, el gen, en la hipótesis de haber sido transmitido al afectado, lo fue exclusivamente a través de mujeres heterocigotas. En ese caso se aplican las cifras correspondientes a genes letales, 1/3 y 2/3. Tomando como ejemplo nuevamente la distrofia muscular progresiva de Duchenne, cuando nace de un matrimonio un niño afectado, caso único en la familia, el riesgo de repetición en un próximo niño del matrimonio es 2/3 x 1/4 = 1/6 o cerca del 17%. Si ya existieran en la hermandad del afectado n niños normales, la probabilidad favoreciendo la hipótesis de mutación nueva aumenta y el riesgo de repetición disminuye. De hecho, si la frecuencia de afectados en la población, en el caso de la distrofia de Duchenne, es 3u y 2/3 de esos casos son heredados (con probabilidad 1/2 de madres heterocigotas), la probabilidad de que una mujer cualquiera de la población sea heterocigota es 2/3 x 3u x 2 = 4u. La ocurrencia de un afectado y n niños normales en la prole de una mujer cualquiera puede suceder bajo las hipótesis de que ella sea heterocigota o no. Para que el evento ocurra en la primera hipótesis, es necesario que la mujer sea antes que nada heterocigota (probabilidad 4u) y transmita el alelo recesivo al afectado (con probabilidad 1/2) y el alelo normal a sus n 101 niños normales con probabilidad (1/2)n. En la hipótesis alternativa es necesario que ella no sea heterocigota (probabilidad 1-4u), que ocurra una mutación en el gen que ella transmite al hijo que será afectado (probabilidad u) y que transmita el alelo normal a los n niños en el pedigree (con probabilidad 1n = 1, bajo la hipótesis de que ella es homocigota normal). Las probabilidades a favor de que la mujer sea heterocigota o no, dado que tiene un hijo afectado y n niños normales, están entre si así como los productos 4u.(1/2)n+1 = 2u(1/2)n y (1-4u).u.1 = u-4u2 ~ u. La probabilidad de que ella sea heterocigota se reduce entonces a P(het) = 2.(1/2)n/[2.(1/2)n + 1]. Esa expresión toma el valor 2/3 cuando n = 0 y ya cae para P(het)= 1/2 cuando n = 1. En la Tabla 2 de abajo son mostrados otros valores, juntamente con los riesgos de repetición en la hermandad del afectado, obtenidos de R = P(het).1/4. Tabla 2 - Probabilidades de heterocigosis [P(het)] para la madre de un afectado aislado por una enfermedad recesiva ligada al cromosoma X y riesgo de repetición de la enfermedad (R) en un próximo hermano del afectado, en función del número n de hermanos normales que el ya tiene. -----------------------n P(het) R -----------------------0 0,667 0,167 1 0,500 0,125 2 0,333 0,083 3 0,200 0,050 4 0,111 0,028 5 0,059 0,015 6 0,030 0,008 7 0,015 0,004 8 0,008 0,002 -----------------------También en el caso de enfermedades producidas por mecanismo autosómico recesivo, ellas ocurren en la población con frecuencia muy baja, ya que en equilibrio u = s.x, donde x, como en los casos anteriores, es la incidencia de la enfermedad al nacimiento. Como cada vez que un individuo aa es eliminado (en relación a los N individuos de la población) dos genes a son retirados del total de 2N genes de la población, la cantidad s.x es tanto la tasa de eliminación de individuos aa como de genes a. Una población donde los casamientos ocurren al azar equivale a una población donde los individuos resultan de la combinación al azar entre las gametas producidas por individuos de sexos opuestos. Así, si la frecuencia del gen autosómico A fuera p y la de su alelo a fuera q, estas serán exactamente las frecuencias con que ocurrirán espermatozoides y óvulos con el gen A o a producidos en la población. De eso resulta que las probabilidades de que se formen individuos AA, Aa y aa son respectivamente p2, 2pq y q2. Si se trata de un loci del X, los individuos de sexo masculino ocurrirán exactamente en las frecuencias gaméticas p y q, mientras que los genotipos femeninos AA, Aa y aa ocurrirán en las proporciones p2, 2pq y q2, tal cual como si se tratase de un autosoma. Volvamos ahora a las expresiones que describen el equilibrio entre las fuerzas opuestas de mutación y selección, y que son dadas respectivamente para los casos autosómico dominante, ligado al X recesivo y autosómico recesivo por u = sx/2, u = sx/3 y u = sx. En el primer caso x es igual a 2pq; en el segundo, a q; y en el tercero, a q2. Por lo tanto, esas tres fórmulas pueden ser re-escritas como spq ~ sp, 102 sq/3 y sq2. Evidentemente todas esas cantidades son del orden de magnitud de la tasa de mutación, lo que hace que tanto p como q/3 también sean cantidades insólitamente bajas: por eso la probabilidad de que un caso cualquiera de enfermedad dominante o recesiva ligada al X sea resultado de una mutación nueva es siempre muy alta. Ya en el caso autosómico recesivo los afectados que son eliminados ocurren a una tasa q2, que también generalmente es una cantidad insólitamente baja; pero la frecuencia del gen q es relativamente alta (del orden de 1% para una tasa de afectados del orden de 1/10000 = 1% x 1%), de modo que para esa frecuencia de afectados (1/10000) se espera que existan cerca de 2pq = 2q(1-q) ~ 2q = 2% de heterocigotas normales por lo tanto portadores del gen patológico en la población. Cuando en la descendencia de un matrimonio cualquiera surge un afectado por una enfermedad recesiva es mucho mas probable, por lo tanto, que los genes en homocigosis del afectado hayan sido transmitidos por heterocigotas de que hayan (uno o ambos) sido originados a través de una mutación nueva. Eso explica el riesgo de repetición del 25% que se aplica siempre que ocurre un caso de enfermedad recesiva en la prole de un matrimonio normal. Mecanismo multifactorial En el llamado mecanismo multifactorial el rasgo fenotípico es determinado por la acción conjunta e integrada de factores genéticos y ambientales. Los factores genéticos no se encuentran mas representados por un par de alelos con relación de dominancia o codominancia, y si por un sistema poligénico, o sea por un conjunto de genes situados en loci generalmente independientes uno del otro sobre el punto de vista físico (en cromosomas diferentes o en puntos muy alejados del mismo cromosoma) pero no desde el punto de vista funcional o fisiológico, ya que todos ellos intervienen en la determinación de la característica, que por causa de ello va a exhibir una variación continua o prácticamente continua. Sobre el punto de vista didáctico y para facilitar la comprensión de los modelos, se acostumbra tratar los efectos de los genes de cada locus como iguales o aproximadamente iguales, pero es cierto que todo sistema poligénico va a presentar genes con efecto mas fuerte ("genes principales"): la segregación de esos genes en algunas familias puede indicar superficialmente un patrón de herencia autosómico dominante. La determinación de las características dependientes de ese patrón es tan compleja que no se sabe hasta hoy cuantos loci intervienen en la determinación de rasgos fáciles de ser identificados, como es el caso del peso y de la altura de las personas. Las complicaciones ligadas a las características patológicas se multiplican, una vez que ellas ocurren con baja frecuencia en la población y los factores no genéticos ligados a su determinación no son obvios como es el caso de las características normales (por ejemplo el peso, donde la intervención, en la condición de factor ambiental, de la cantidad y calidad de la comida, es clara). Debido a todo esto, desde épocas relativamente distantes se usan los riesgos calculados empíricamente. Por ejemplo, para conocer el riesgo de repetición de los casos de labio leporino en hermandades con un afectado aislado se verificó simplemente, del total de hermanos nacidos después del caso índice, cuántos eran portadores de un defecto igual o similar. Procediéndose de esa manera en relación a varias condiciones multifactoriales se consiguió determinar con precisión el riesgo de recurrencia, que ya se sabia era bajo o por lo menos no muy alto para muchas condiciones. Esos riesgos son comúnmente listados en libros-texto, de los cuales seleccionamos los que constan en la Tabla 3 abajo. Excepcionalmente esos riesgos son superiores a 5%, la mayoría concentrándose en la franja de 2 a 4%; las condiciones listadas con riesgos mayores que esos generalmente son heterogéneas, incluyendo una 103 proporción de casos de determinación monogénica superiores a las cifras mencionadas anteriormente. con riesgos bien Tabla 3 - Incidencia al nacimiento y riesgos de recurrencia para parientes en primer grado de afectados (hijos, hermanos) de algunos defectos condicionados por mecanismo multifactorial (Otto y cols., 1998) Defecto o enfermedad Luxación congénita de cadera Estenosis hipertrófica de píloro Labio leporino con o sin paladar hendido Paladar hendido Epilepsia Pié torcido Anencefalia Espina bífida Retardo mental inespecífico Estenosis aórtica Comunicación interauricular Coartación de aorta Comunicación interventricular Enf. de Hirschsprung (megacolon cong.) Incidencia (%) 0,07 0,3 0,1 0,04 0,5 0,1 0,2 0,3 1,0 0,05 0,1 0,06 0,1 0,02 Riesgo recurrencia (%) 5 4 4 2 10 5 5 5 6 2 3 2 1 4 de Enfermedades producidas por defectos cromosómicos En el caso de las enfermedades, síndromes y defectos producidos por aberraciones cromosómicas, en la mayoría de las situaciones los afectados son esporádicos (casos aislados debidos a defectos cromosómicos no presentes en los progenitores), no existiendo aumento de riesgo significativo en la hermandad del afectado. Cuando el defecto numérico (por ejemplo, una trisomía autosómica simple, como la del cromosoma 21 que ocurre en el síndrome de Down) está presente apenas en el niño afectado el riesgo de afección en un próximo concepto del matrimonio es del orden de 1% si los progenitores (generalmente las madres) son jóvenes, tomando valores ligeramente mayores con el aumento de la edad, como muestra a Tabla 4 abajo, aplicable a casos esporádicos de síndrome de Down causados por trisomía simple y otros defectos del cromosoma 21. Tabla 4 - Riesgos de ocurrencia y de recurrencia del síndrome de Down en la prole de un matrimonio en función de la edad materna (Tabla simplificada de varias fuentes) Edad materna al Riesgo de ocurrencia Riesgo de nacer el niño del afectado recurrencia ------------------------------------------------------menos de 35 años 0,1% 1% 35 - 39 años 0,5% 1,5% 40 - 44 años 1,5% 2,5% 45 - 49 años 3,5% 4,5% ------------------------------------------------------La tabla muestra los riesgos de ocurrencia y de recurrencia en función de la edad materna, notándose que el riesgo de recurrencia es siempre cerca de 1% mayor que el de ocurrencia en la prole de mujeres pertenecientes al mismo grupo etario. Ese descubrimiento aparentemente paradójico tiene una explicación simple: cuando consideramos un grupo de progenitores que ya tuvieron un niño con síndrome de Down, es de esperar que entre ellos haya una proporción mayor de personas con algún tipo de 104 mosaicismo minoritario comprometiendo la línea germinativa o con genes que predispongan a la no disyunción del cromosoma 21, que en el grupo de personas de la misma edad que todavía no tuvieron ningún hijo afectado. De ahí el aumento del riesgo de 1% cuando son comparadas las dos tasas. El caso anterior constituye el ejemplo más importante de riesgos genéticos dependientes de la edad. Un fundamento del asunto puede ser encontrado en el interesante artículo de Frota-Pessoa (1978), cuya lectura recomendamos. En el caso de otras trisomías autosómicas como las responsables por los síndromes de Edwards y de Patau, los riesgos de repetición son de un orden de magnitud mucho mas modesto que los observados en el caso del síndrome de Down, eso porque las probabilidades de eliminación del concepto son muy altas, hecho que explica la gran discrepancia entre la incidencia del síndrome de Down (1/500 a 1/1000 entre recién nacidos de ambos sexos) y las de las otras dos condiciones, de un orden de magnitud por lo menos diez veces menor. Riesgos bajos de repetición constituyen generalmente la regla para casos de defectos numéricos (aneuploidías) pero en casos en que el niño es portador de un defecto cromosómico estructural esa alteración puede estar presente en uno de los dos progenitores en estado equilibrado (o sea, sin determinar efectos fenotípicos deletéreos) en un cierto porcentaje de casos, generalmente pequeño. Por ejemplo, en el síndrome de Down menos del 5% de los casos se deben a translocaciones involucrando un cromosoma 21 y un acrocéntrico cualquiera (cromosomas 13, 14 y 15 del grupo D y cromosomas 21 y 22 del grupo G). Cerca del 10 a 20% de esos casos la translocación está presente en estado equilibrado en uno de los progenitores: si la translocación es entre el 21 y el 22 o cualquier cromosoma del grupo D, los riesgos empíricos de repetición del síndrome de Down en la hermandad de un afectado varían de cerca de 5% (cuando el progenitor masculino es el portador de la translocación) a 15% (cuando la translocación equilibrada está en la madre del niño). Si se trata de la rarísima translocación 21/21, presente en estado equilibrado en uno de los progenitores, el riesgo de recurrencia es de 100%, cualquiera que sea el progenitor portador de la translocación equilibrada. En los 80 a 90% de los casos restantes en que la translocación está presente apenas en el niño afectado, se aplican los riesgos correspondientes a la situación de trisomía simple. Lo mismo ocurre cuando el niño es portador de mosaicismo cromosómico. Riesgos para la descendencia de casos aislados de enfermedades, síndromes o defectos condicionados por mecanismo monogénico, multifactorial o cromosómico Esos riesgos, al contrario de lo que sucede con los anteriormente vistos, son de determinación trivial. Enfermedades autosómicas dominantes En el caso de las enfermedades autosómicas dominantes con penetrancia completa, como es el caso de la acondroplasia, suponiéndose (como sucede generalmente) que el afectado aislado se case con una persona normal no emparentada (detalle que admitiremos también en el tratamiento de los otros tipos de enfermedades), el riesgo se fija en 50%, ya que basta que el hijo reciba el alelo patológico de su progenitor afectado para también desarrollar la enfermedad. Cuando la penetrancia es incompleta, como es el caso del retinoblastoma bilateral (valor de K del orden del 80%), el riesgo de ocurrencia del niño afectado en la prole de un afectado es K/2, ya que para que eso suceda es necesario que el gen 105 sea transmitido a la prole (con probabilidad 1/2) y penetre (con probabilidad K). Para el caso del retinoblastoma bilateral ese riesgo es K/2 = 0.80/2 = 0.40 o 40%. Enfermedades dominantes ligadas al X En el caso de las enfermedades dominantes ligadas al cromosoma X, la situación es semejante a la del ítem de enfermedades con penetrancia completa, en la situación de mujeres afectadas, que tendrán en promedio la mitad de los hijos o hijas afectados. En el caso de hombres afectados, el riesgo global para la prole también se fija en 50%, con la diferencia de que todas las hijas serán afectadas, lo que no sucederá con ninguno de los hijos, que recibirán del padre no el X pero si el cromosoma Y. En la mayoría de las enfermedades producidas por ese tipo de patrón, el cuadro clínico de los afectados de sexo masculino es exageradamente más grave que el presentado por las mujeres heterocigotas, donde las manifestaciones son típicamente minimizadas por el efecto de la lyonización. Son raras las enfermedades en que el individuo afectado de sexo masculino consigue reproducirse; muchas de esas condiciones llegan hasta a ser letales (en el sentido original del concepto, que era reservado para describir apenas aquellas condiciones que conducían a la inviabilidad del embrión o feto). El caso de la penetrancia incompleta es en general más complicado, ya que comúnmente los valores de la penetrancia son diferentes entre los hombres y mujeres que reciben el gen. Por ejemplo, en el caso del síndrome del cromosoma X frágil, una importante causa de retardo mental en niños de ambos sexos, una heterocigota normal y, por lo tanto, portadora de la premutación puede transmitir el gen a un hijo o una hija. En el conjunto de todos los niños que recibieron el gen de tales mujeres, el 80% presentará retardo, lo mismo sucede con el 35% de las niñas que se encuentren en la misma categoría. Llamándose de Km = 0.80 y de Kf = 0.35 los valores de la penetrancia en individuos de sexo masculino y femenino respectivamente, el riesgo de la ocurrencia del síndrome en la descendencia de tales mujeres es R = 1/4 x Km + 1/4 x Kf = 0.2875 o cerca del 29%, y el riesgo para los hijos de hombres normales, por lo tanto portadores de la premutación, es nulo. Para los portadores de la mutación completa, los afectados de sexo masculino no se reproducen debido al hecho de presentar retardo mental generalmente grave, pero cerca del 50% de las heterocigotas con la mutación completa no presentan retardo, por efecto de la lyonización, y una proporción considerable de las afectadas presentan retardo mental mucho mas leve que el presentado en promedio por los afectados de sexo masculino, de modo que una fracción de las heterocigotas portadoras de la mutación completa logra reproducirse. Cuando el X conteniendo la mutación completa de esas mujeres es transmitido a un niño, éste será con seguridad afectado; sin embargo cuando es una hija la que lo recibe, apenas cerca de la mitad será afectada. Eso hace que el riesgo de la prole afectada de esas mujeres sea 1 x 1/4 + 1/2 x 1/4 = 3/8 = 0.375 o cerca del 38%; es como si ahora Km = 1 y Kf = 0.50 en vez de los valores Km = 0.80 y de Kf = 0.35 admitidos por las tasas de penetrancia en el caso de progenitoras portadoras de la premutación. Enfermedades producidas por mecanismo autosómico recesivo En el caso de las enfermedades producidas por mecanismo autosómico recesivo, el riesgo de ocurrencia de la enfermedad en la prole de un afectado cualquiera es despreciable, generalmente del orden del 1% o menos, siempre que el afectado no se case con un primo en primer grado o cualquier otro tipo de pariente próximo (situación que discutiremos en el ítem sobre riesgos para la prole de matrimonios consanguíneos). De hecho, 106 como el afectado es homocigota aa, una niño de éste recibe con seguridad el gen a. Pero como para ser afectado ese niño precisa recibir también un gen a de su otro progenitor, es necesario que éste sea heterocigota (probabilidad 2pq ~ 2q = 2% para un gen de frecuencia poblacional q = 0.01 o 1%) y que transmita el gen a al niño, configurándose por lo tanto un riesgo del orden de magnitud del 1% o menor (para frecuencias génicas menores que 1%). Enfermedades producidas por mecanismo recesivo ligado al X En el caso de las enfermedades recesivas ligadas al X como la hemofilia por deficiencia del factor VIII de la coagulación o la distrofia muscular progresiva tipo Becker, el riesgo de afección en la prole de un afectado es cero, ya que el afectado pasará fatalmente el X para todas las hijas (que, siendo por lo tanto heterocigotas, serán normales, a pesar de que llevan para su futura prole un riesgo de 1/4 o 25%) y el Y para todos los hijos, que recibirán el X de sus madres, mujeres normales con probabilidad despreciable de ser heterocigotas. Enfermedades producidas por mecanismo multifactorial Como los riesgos de una enfermedad multifactorial dependen obviamente de la cantidad de genes deletéreos no funcionales en el sistema poligénico ligado a una determinada característica, los riesgos de un pariente cualquiera del afectado dependen primariamente de la cantidad de genes compartidos entre él y el individuo afectado. Por eso los riesgos de repetición de defectos multifactoriales son del mismo orden de magnitud para hijos y para hermanos de casos aislados, porque esos pares de individuos poseen cerca del 50% de sus genes en común. Enfermedades debidas a aberraciones cromosómicas Típicamente las enfermedades producidas por defectos cromosómicos producen retardo mental grave (como es el caso de los defectos numéricos y estructurales no equilibrados de los autosomas) o esterilidad (como es la regla de las enfermedades producidas por aberraciones de los cromosomas sexuales). Por eso rara vez hay que considerar la situación de riesgo para la prole de los afectados. En los pocos casos en que eso sucedió, se verificó que el defecto autosómico se transmite como un patrón autosómico dominante. Por ejemplo, verificándose la descendencia de mujeres con síndrome de Down que se embarazaron, se constató que cerca de la mitad es normal y la otra mitad afectada con el síndrome de Down, por trisomía. En el caso de las aberraciones ligadas a los cromosomas sexuales X y Y, particularmente en los casos raros en que los afectados procrearon, se verificó una frecuencia aumentada de defectos cromosómicos variados en la prole, incluyendo frecuentemente casos de mosaicismo; muy probablemente por efecto de genes causantes de la no disyunción cromosómica segregando en esas familias. Riesgos para la descendencia de hermanos normales de casos aislados de enfermedades, síndromes o defectos condicionados por mecanismo monogénico, multifactorial o cromosómico 107 En el caso del asesoramiento de personas normales parientes próximas de afectados aislados, consideraremos apenas la situación en que el consultante es hermano o hermana del paciente. Mecanismo autosómico dominante Si la enfermedad es producida por un mecanismo autosómico dominante de penetrancia completa, el riesgo para la prole de hermana(o) normal de un afectado es totalmente despreciable, del orden de magnitud de la tasa de mutación y por lo tanto realmente próximo a cero. Si la enfermedad en el caso aislado es producida por gen autosómico dominante de penetrancia incompleta (tasa K), como la probabilidad de heterocigosis para los progenitores del afectado es 1-K, la normalidad del hermano puede ser explicada de dos maneras: a) uno de los progenitores es heterocigota no penetrante, el hermano del afectado recibió de él el gen A y este no penetró, con probabilidad conjunta (1-K) x 1/2 x (1-K) = (1-K)2/2, o recibió el alelo normal, con probabilidad conjunta (1-K) x 1/2 x 1 = (1K)/2; b) ninguno de los progenitores es heterocigota, el afectado por lo tanto se originó por mutación nueva: por eso el hermano es normal; la probabilidad conjunta relativa a ese evento es K x 1 x 1 = K. Por lo tanto, las probabilidades de que el hermano normal del afectado sea heterocigota o no, están entre si así como (1-K)2/2 está para (1-K)/2 + K = (1+K)/2, de modo que la probabilidad de que el hermano normal del afectado sea heterocigota es P(het) = (1-K)2/[(1-K)2 + (1+K)] = (1K)2/(2-K+K2) y el riesgo de un afectado en la prole de este último es R = K(1-K)2/[2(2-K+K2)]. Como puede ser visto en la Tabla 5 abajo y en el gráfico correspondiente (Figura 2), esos riesgos son bajos, del orden máximo de 0,04 o 4% para valores de K entre 0,25 y 0,45. Como los valores que toma K en la práctica son generalmente altos, del orden de 80% o mas, se puede afirmar que para la mayoría de las enfermedades ese riesgo es inferior a 1%, como muestran el gráfico y a tabla de abajo. Figura 2 - Variación de los riesgos de recurrencia de una enfermedad autosómica dominante en la descendencia de un hermano normal de un afectado aislado, en función de la tasa de penetrancia K. 108 Tabla 5 - Riesgos de recurrencia (R) de una enfermedad autosómica dominante con penetrancia incompleta (tasa K) en la prole de un hermano normal de un afectado aislado. Estos riesgos corresponden a los mostrados en el gráfico de la Figura 2. K R ------------0,00 0,000 0,10 0,021 0,20 0,035 0,30 0,041 0,40 0,039 0,50 0,036 0,60 0,027 0,70 0,018 0,80 0,009 0,90 0,002 1,00 0,000 ------------Mecanismo dominante ligado al X Para las enfermedades con penetrancia completa en hombres y mujeres afectadas, ese riesgo es del orden de magnitud igual a cero, como en el caso autosómico. Cuando la penetrancia es incompleta, como en el caso del retardo mental ligado al sitio frágil del cromosoma X, se requieren cálculos mas complicados que en el caso autosómico correspondiente. Esos cálculos, entre tanto, redundan en riesgos relativamente bajos para la prole de hermanas normales. De rutina ya existen técnicas, tanto citogenéticas como moleculares, que permiten detectar con seguridad los parientes heterocigotas próximos de los afectados portadores de la 109 mutación incompleta, la situación en esos casos es resuelta mediante la aplicación de análisis de laboratorios. Mecanismo recesivo ligado al X En el caso de las enfermedades recesivas ligadas al cromosoma X, el riesgo para la prole de hermanos normales (de sexo masculino) del afectado es evidentemente despreciable, sea tanto si el afectado haya recibido el gen de una progenitora heterocigota o haya sido el resultado de una mutación nueva. La situación es diferente, no obstante, cuando la consultante es una hermana normal del afectado. Tratándose de un caso aislado, la probabilidad de que la madre del afectado sea heterocigota es 2/3. La probabilidad de heterocigosis de la hermana del afectado se reduce a la mitad de esa cifra, de modo que el riesgo para la descendencia de esta última es 1/3 x 1/4 = 1/12, o sea, cerca del 8%. Mecanismo autosómico recesivo En el caso de las enfermedades autosómicas recesivas, finalmente, la ocurrencia de un afectado en la prole de un hombre y una mujer normales, indica que los dos son heterocigotas. Siendo así, cualquier hermano normal del afectado tiene una probabilidad de 2/3 = (1/2)/(1/2+1/4) de ser heterocigota desde que, si fuera normal, él no podría ser aa como el hermano afectado, y las probabilidades favoreciendo las hipótesis de heterocigosis y homocigosis normal están entre sí así como 2 está para 1 en la prole de matrimonios de heterocigotas. Para que un niño de ese hermano nazca afectado es necesario que no solo él como también su cónyuge sean heterocigotas y transmitan cada uno el gen a para el hijo: el riesgo final de un niño afectado de ese matrimonio queda determinado como R = 2/3 x 2% x 1/4 = 0.33% si fijamos la frecuencia de heterocigotas en la población en aproximadamente 2%, que tiene lugar cuando la frecuencia del gen es del orden del 1%. Para otros valores de q el riesgo es calculado segundo R = q/3. Mecanismo multifactorial De la misma manera que los hijos y hermanos de afectados comparten entre sí 50% de todos sus genes y eso justifica el hecho de que los riesgos de recurrencia para hijos y hermanos de afectados sean del mismo orden de magnitud, un sobrino del afectado, hijo de progenitores normales, que posee un 25% de los genes del afectado en común, tendrá un riesgo menor que la mitad del riesgo atribuible a los parientes en primer grado de afectados, dado que los progenitores son normales. Enfermedades producidas por defectos cromosómicos El riesgo de un defecto cromosómico en la prole de hermanos normales de afectados es generalmente de un orden de magnitud despreciable. Tomándose como ejemplo nuevamente el síndrome de Down, dado un caso cualquiera, la probabilidad de deberse a una translocación es del orden del 5% o 1/20. Como máximo en el 20% o 1/5 de esos casos la translocación estará presente en estado equilibrado en uno de los progenitores; siendo que la probabilidad de que un hijo normal de un portador de la translocación equilibrada, la herede es del orden del 50% o 1/2. El hijo de un portador de translocación equilibrada será afectado 110 con una probabilidad no superior a 15% o cerca de 1/6. El riesgo para la prole afectada del hermano o hermana normal del afectado es obtenido, por lo tanto, multiplicándose todas esas cifras. Se obtiene entonces R = 1/20 x 1/5 x 1/2 x 1/6 = 1/600, valor éste de un orden de magnitud despreciable. Como, por otro lado, a través de un estudio de rutina de los cromosomas se puede determinar si la translocación está presente o no en ese pariente del afectado, muchos indican el examen para evitar la determinación probabilística del riesgo a través de la ponderación detallada arriba. Riesgos de recurrencia para la prole de parientes familiares afectados por mecanismo monogénico o multifactorial de casos Como en los dos últimos ítems, que trataban el asesoramiento de afectados y de parientes normales de afectados, la determinación de los riesgos de recurrencia es también trivial. En el caso de un afectado por una enfermedad autosómica dominante casado con una persona normal y ya con un hijo también afectado el riesgo para un nuevo niño es fijado en R = K/2, donde K es el valor de la penetrancia del gen, incluyéndose aquí hasta casos de penetrancia completa (K = 100%), cuando el riesgo queda definido en 0,5 o 50%. El caso correspondiente al X es semejante y ya fue discutido en relación a la prole de mujeres portadoras de la premutación o de la mutación completa del síndrome del cromosoma X frágil: con o sin niños afectados, el riesgo para la descendencia de mujeres heterocigotas portadoras de la premutación es de 29%; cuando las mujeres son heterocigotas portadoras de la mutación completa, afectadas o no, ese riesgo se eleva a 38%. En casos de penetrancia completa, el riesgo para la prole de hombres o mujeres afectados, con niños afectadas o no, es del orden de 50%, como ya fue explicado anteriormente. En el caso recesivo, tanto autosómico como ligado al X, la ocurrencia de niños afectadas en la prole de afectados es imposible o excepcional, y consideraremos aquí como familiares: a) en el caso autosómico, mas de un afectado en la hermandad; b) en el caso ligado al X, mas de un hijo afectado o un hijo y por lo menos un colateral masculino, por el lado materno, ambos afectados. En ambos casos el riesgo de recurrencia en la hermandad es del orden de 1/4 o 25%. El riesgo para la prole de hermanas normales de esos afectados es 1/8 o 12,5% en el caso recesivo ligado al X y despreciable (del orden de 0,33%) en el caso autosómico. En el caso dominante con penetrancia incompleta, el riesgo para la prole de hermanos normales de afectados familiares es R = K(1-K)/[2(2K)]. De hecho, un hermano cualquiera del afectado familiar, situación en que uno de los progenitores es verdaderamente portador del gen mutante, es normal, porque recibió el alelo normal (probabilidad 1/2) o porque recibió el alelo mutante y este no penetró [probabilidad conjunta (1K)/2], donde se concluye que la probabilidad de que él sea heterocigota no penetrante es (1-K)/[1+(1-K)] = (1-K)/(2-K). Multiplicándose esta expresión por K/2 se obtiene el riesgo literal obtenido mas arriba. Los valores de R son generalmente bajos, como muestran el gráfico de la Figura 3 y la Tabla 6 de abajo. Figura 3 - Riesgos de recurrencia (R) de enfermedad autosómica dominante de penetrancia incompleta en la prole de hermanos normales de casos familiares del defecto, en función de la tasa de penetrancia K. 111 Tabla 6 - Riesgos de recurrencia (R) de una enfermedad autosómica dominante de penetrancia incompleta en la prole de hermanos normales de casos familiares del defecto, en función de la tasa de penetrancia K. Los riesgos corresponden a los mostrados en el gráfico da Figura 3. K R ------------0.00 0.000 0.10 0.024 0.20 0.044 0.30 0.062 0.40 0.075 0.50 0.083 0.60 0.086 0.70 0.081 0.80 0.067 0.90 0.041 1.00 0.000 ------------Riesgos de recurrencia en situaciones complejas Como ejemplo principal de las situaciones complejas en genética abordaremos el asesoramiento genético de las enfermedades heterogéneas, ejemplificándolas con el retardo mental inespecífico y la sordera no sindrómica. Ambas situaciones pueden ser condicionadas por todos los mecanismos monogénicos conocidos; además de ello, una parte considerable 112 de los casos de estos dos defectos, principalmente en los países subdesarrollados y en desarrollo, son debidos a factores ambientales (por ejemplo, asistencia deficiente al embarazo, al parto y al recién nacido, malnutrición, infecciones maternas durante el embarazo etc.). Eventualmente el defecto segrega en algunas familias con un patrón típico de herencia, el cual permite la inclusión del caso en uno de los mecanismos monogénicos posibles. En ese caso, no hay problema sobre el asesoramiento genético. La situación se complica cuando el afectado es un caso aislado o el patrón de herencia no es claro. La primera solución es usar los riesgos empíricos, cuyo uso ilustraremos con casos de retardo mental grave. En el caso de ese defecto y en la imposibilidad de la aplicación de análisis de laboratorio (para verificar, por ejemplo, la posibilidad de que se trate de un caso de síndrome del cromosoma X frágil), todavía hoy son usados clásicamente los riesgos empíricos obtenidos en un amplio estudio realizado por Reed y Reed (1965). Los riesgos de retardo para la prole de matrimonios con 0, 1 y 2 progenitores afectados son respectivamente 1%, 11% y 40%. Obviamente el primer valor corresponde a la incidencia de retardo al nacimiento, en la población general. Los riesgos para los mismos tipos de matrimonios, aunque con un niño afectado, se elevan a 6%, 20% y 42%. Esos riesgos son aplicables en países desarrollados, en especial en los Estados Unidos, donde la investigación fue realizada en la década del 60. En países subdesarrollados y en desarrollo, esos riesgos deben sufrir alteraciones debido a la prevalencia mas elevada, en ellos, de casos atribuibles a factores ambientales. Alternativamente, existen métodos que permiten la estimativa teórica de los riesgos, basados en las frecuencias relativas de las diversas causas del defecto (Pi) y en los riesgos asociados a cada una de ellas (Ri), siendo el riesgo final ponderado dado por R = ΣPiRi. Ejemplificaremos la aplicación del método al caso de la sordera no sindrómica (Braga y cols., 2000). La frecuencia de casos ambientales del defecto fue estimada, para el Brasil y otros países en desarrollo, en 84%. Los 16% restantes son casos hereditarios, de los cuales 78% son autosómicos recesivos, 19% autosómicos dominantes y 3% recesivos ligados al cromosoma X. Como los riesgos de recurrencia del defecto en hermanos de casos aislados son respectivamente, para esos tres mecanismos monogénicos, 1/4 = 25%, K(1-K)/2 = 8% para un valor promedio de penetrancia K = 80% y 1/6 = 16,7%, el riesgo final toma el valor R = 16% x 78% x 25% + 16% x 19% x 8% + 16% x 3% x 16,7% + 84% x 0% = 0,034 o cerca de 3%. Otras situaciones son resueltas aplicando un raciocinio semejante, pero redundan en fórmulas más complejas cuyos detalles omitiremos aquí y que pueden ser consultados en el trabajo supra citado de Braga y cols. (2000). La Tabla 7, tomada de ese mismo trabajo, muestra los riesgos de sordera para diversas situaciones de asesoramiento genético, para países en desarrollo y para países industrializados (en éstos la frecuencia de casos ambientales del defecto es como máximo de 50%; en los cálculos usados para generar los riesgos de la tabla fue usada una tasa del 38%, estimada a partir de levantamientos recientes). La Tabla 7 muestra también los riesgos correspondientes a la situación en que los factores ambientales pueden ser excluidos con alta probabilidad. Tabla 7 - Riesgos de recurrencia de sordera no sindrómica en la prole de matrimonios cuya situación es especificada en la columna de la izquierda -----------------------------------------------------------------------situación fact. amb. no excluidos fact. amb. Brasil países desarr. excluidos -----------------------------------------------------------------------matrimonio normal, no 3% 13 - 14% 21 - 23% 113 cons., 1 hijo. af. -----------------------------------------------------------------------matrimonio normal de 17% 23 - 24% 25% primos, 1 hijo. af. -----------------------------------------------------------------------matrimonio no cons., 1% 5% 9% 1 conj. afect. -----------------------------------------------------------------------matrimonio de primos, 9% 12% 13% 1 conj. afect. -----------------------------------------------------------------------matrimonio no cons., 1 40% conj. af., 1 hijo. af. -----------------------------------------------------------------------matrimonio de primos, 1 48% conj. af., 1 hijo. af. -----------------------------------------------------------------------matrimonio no cons., 2 3 - 10% 10 - 14% 18% conj. afect. -----------------------------------------------------------------------matrimonio de primos, 6 - 20% 22 - 29% 36% 2 conj. afect. ------------------------------------------------------------------------ Asesoramiento genético de matrimonios de primos en primer grado El asunto ha sido objeto de exhaustivas investigaciones desarrolladas durante los últimos 60 años pero todavía permanece controvertido, en el sentido de que no existe consenso sobre el orden de magnitud de los riesgos para la prole de esos y de otros matrimonios consanguíneos. Analizando los cuestionarios desarrollados por 309 asesores genéticos y genetistas médicos en los Estados Unidos, Bennett y cols. (1999) verificaron que los riesgos de defectos físicos y retardo mental comunicados a consultantes primos en primer grado variaban de 0,5 a 20% y que no existía consenso sobre los tipos de defectos y enfermedades que eran incluidos dentro de ellos. Una de las formas usadas para la determinación de esos riesgos se basa en la comparación de las frecuencias de niños nacidos con defectos en la descendencia de matrimonios de primos y de matrimonios no consanguíneos. La Tabla 8 reúne, en las columnas A y B, los resultados de cuatro de esos estudios, realizados en los países indicados en la columna de la izquierda (para detalles, v. Otto y cols., 1998). Las diferencias entre las frecuencias en los dos grupos, mostradas en la columna (A-B), varían de un estudio a otro, como era de esperarse. A pesar de que todos esos estudios han sido realizados por excelentes grupos de investigadores, los criterios de inclusión de los defectos variaron de un estudio a otro; además, los observadores fueron diferentes en los cuatro estudios. Los promedios aritméticos de los valores de A, B y A-B son mostrados en la última línea de cada columna. Tabla 8 - Frecuencias, en porcentajes, de niños nacidos con defectos en la prole de primos en primer grado (A) y en la prole de matrimonios no consanguíneos (B). Estados Unidos A 16,2 B 9,8 A-B 6,4 114 Francia Japón Suecia Total 12,8 11,7 16,0 14,2 3,5 8,5 4,0 6,4 9,3 3,2 12,0 7,8 En la prole de matrimonios consanguíneos la probabilidad de que se forme un individuo homocigota AA o aa es mayor que las cantidades esperadas P'(AA) = p2 y P'(aa) = q2 en la prole de no consanguíneos, y la probabilidad de formarse un heterocigota es menor que P'(Aa) = 2pq; en realidad, ellas se reducen en ese caso a P"(AA) = p2+Fpq = pF+p2(1-F), P"(Aa) = 2pq-2pqF = 0+2pq(1-F) y P"(aa) = q2+Fpq = qF+q2(1-F), donde F es la probabilidad de homocigosis por origen común (en el caso de hijos de primos F toma el valor 1/16) o sea la probabilidad de que un hijo de primos reciba en dosis doble, a través de sus dos progenitores, un mismo alelo presente en dosis única en uno de los ascendientes comunes del matrimonio de primos (el abuelo y la abuela que ellos comparten debido al hecho de ser hijos de dos hermanos). Por lo tanto, la diferencia (A-B) mostrada en la tabla arriba representa el valor de la suma de los Fpq de todos los genes recesivos deletéreos, admitiéndose que ocurran casos de defectos no genéticos, con frecuencia semejante en los dos grupos de niños. Agregándose 0,5% a 1% (frecuencia global de las enfermedades recesivas al nacimiento en la población general) al valor total de la última columna, se llega a una estimativa de riesgo para la descendencia de primos en primer grado del orden de 8% a 9%. Existen en la literatura varios métodos teóricos para determinar el riesgo de una enfermedad en la prole de primos. Uno de esos métodos (Otto y cols., 2007) se basa en las frecuencias con que ocurren los genes determinantes de las enfermedades recesivas y ya había sido delineado en líneas generales en Frota-Pessoa y cols. (1975), Otto y Frota-Pessoa (1979) y Otto (1989). Mediante la consulta de obras generales recopiladas, artículos especializados y bancos de datos de enfermedades genéticas (referencias en Vieira Hijo, 1992), fueron levantados los datos de 125 afecciones razonablemente bien estudiadas poblaciones caucasoides y con poca variación geográfica de frecuencia, incluyendo retardo mental (mas de 100 loci) y sordera congénita (35 loci), permaneciendo un total de 258 loci. Esos datos permitieron levantar la distribución de las frecuencias de genes recesivos causantes de enfermedades, la cual fue ajustada a familias de funciones genéricas, lo que posibilitó obtener la función densidad del punto promedio de cada clase de frecuencia génica fi tal como Sfi = 1 y comparar las frecuencias globales de afectados con el coeficiente de endocruzamiento F = 1/16, R(F) = NΣ{fi[qiF + qi2(1-F)]}, y de afectados hijos de no consanguíneos con F = 0, R(0) = NΣ[fiqi2]. Los valores numéricos obtenidos fueron R(F) = 0,065 = 6,5% y R(0) = 0,005 = 0,5%; como esas cifras se refieren apenas a las enfermedades producidas por un mecanismo recesivo y al menos cerca del 4% de los recién nacidos presentan defectos físicos o retardo mental, debemos agregar a R(F) el riesgo referente a otras enfermedades, o defectos no influenciables por la consanguinidad (enfermedades y defectos genéticos con otros mecanismos fuera del autosómico recesivo o debido a factores ambientales, no genéticos), que es del orden de 0,04 - 0,005 = 0,035. Llegamos así a los riesgos globales de enfermedad en la prole de primos y de no consanguíneos del orden de R(F) = 0,065 + 0,035 = 0,10 = 10% y R(0) = 0,04 = 4%, respectivamente. El banco de dados on-line OMIM (agosto de 2003) cita cerca de 3.000 condiciones autosómicas recesivas, mas de la mitad de ellas no confirmadas. De igual forma, si reducimos drásticamente a 500 el número de enfermedades realmente recesivas de ese total, ninguna de ellas incluida en nuestra lista, y todavía admitimos que todas ellas 115 ocurrieron con frecuencias insólitamente bajas, del orden de 1/1.000.000 en la población general, se espera un total de mas 500 x 1/1.000.000 = 1/2.000 = 0,0005 de afectados por enfermedades recesivas en la prole de no consanguíneos y un total de 500 x 63,4/1.000.000 = 0,03 en la prole de primos en primer grado. En ese caso, el riesgo de afección en la prole de matrimonios primos en primer grado se tornaría R(F) = 13%, mientras que R(0) permanecería con el valor determinado anteriormente (4%). De cualquier manera, es cierto que ese riesgo no debe ser menor que el 10% y que la reproducción de esos matrimonios no debe ser recomendada. Esos riesgos no difieren de los obtenidos aplicándose un método aproximado propuesto por Frota-Pessoa y cols. (1975), el cual permite también determinarlos para la prole de un matrimonio con grado genérico de consanguinidad. Admitiéndose que los genes recesivos que en homocigosis determinan defectos físicos, ocurran todos con frecuencias del orden de q = 1-p = 1% y que la frecuencia global de las enfermedades recesivas al nacer sea también de ese orden de magnitud, el riesgo R0 de enfermedades recesivas en la prole de un matrimonio consanguíneo queda determinado como el riesgo relativo RR = (q2+pqF)/q2 = 1 + pF/q = 1 + 99F expresado en porcentaje, donde F es el coeficiente de endocruzamiento de la descendencia del matrimonio. Sobre el retardo mental puro, el riesgo de ocurrencia en la prole de no consanguíneos es del orden del 1%, elevándose a 4% en la prole de primos en primer grado: la diferencia de 3% corresponde a un coeficiente de endocruzamiento F = 1/16; para F = 1/8 y 1/4 la diferencia debe elevarse a 6% y 12%; para F = 1/32, 1/64 y 1/128 esa diferencia disminuye a 1,5%, 0,75% y 0,375%. Por lo tanto, para un F genérico cualquiera el aumento del riesgo en relación al de matrimonios no emparentados corresponde, en porcentaje, a 48F. El riesgo de retardo mental puro en la prole de un matrimonio consanguíneo cualquiera es por lo tanto, en porcentaje, 1 + 48F. Admitiéndose también que la frecuencia global de enfermedades recesivas (excluyéndose retardo mental) es del orden del 1% al nacimiento en la población general, se tiene que el riesgo de prole afectada en un matrimonio no consanguíneo es R1 = 3%, si consideramos apenas defectos físicos con o sin retardo mental y del orden de R2 = 4% si consideramos también el retardo mental puro. En la prole de consanguíneos esos dos riesgos (considerándose o no el retardo mental puro) toman valores porcentuales R1 = (1 + 99F) + 2 = 3 + 99F y R2 = (1 + 99F) + 2 + (1 + 48F) = 4 + 147F. La Tabla 9 muestra algunos de los valores que R1 y R2 toman, en función de F. Nótese que para valores de F menores que 1/16 los aumentos de riesgo son pequeños, siendo de un orden de magnitud despreciable para valores de F = 1/64 (que corresponden a la prole de primos en tercer grado) o menos. Tabla 9 - Riesgos de enfermedad en la prole de matrimonios consanguíneos, en porcentajes, en función del coeficiente de endocruzamento F, admitiéndose que la frecuencia de todos los genes recesivos patogénicos es constante y igual a 0,01 (tabla modificada de Otto y cols., 1998). Casamientos padre-hija, madre-hijo, hermanos. F Riesgo % de afección recesiva R0 = 1+99F Riesgo % total sin retardo mental puro R1 = 3+99F Riesgo % total incluyéndose retardo mental R2 = 4+147F 1/4 25,8% 27,8% 40,8% 116 medios-hermanos, primos dobles en 1er grado, tío-sobrina, tía-sobrino. 1/8 13,4% 15,4% 22,4% primos en 1er grado, tío-media sobrina, tía-medio sobrino. 1/16 7,2% 9,2% 13,2% primos en 2do grado, medios-primos en 1er grado. 1/32 4,1% 6,1% 8,6% primos en 3er grado. 1/64 2,5% 4,5% 6,3% to grado. 1/128 1,8% 3,8% 5,2% to grado. 1/256 1,4% 3,4% 4,6% ... ... ... ... 0 1,0% 3,0% 4,0% primos en 4 primos en 5 ... no consanguíneos. En una sesión de asesoramiento eso es explicado al matrimonio de consultantes consanguíneos en un lenguaje adaptado a su medio sociocultural, sin necesidad de entrar en detalles técnicos. Se explica también que el aumento del riesgo es dado por la existencia de más de 1000 enfermedades autosómicas recesivas conocidas y que eso imposibilita, al menos por el momento, la aplicación de estudios moleculares para verificar, por ejemplo, si los cónyuges son portadores heterocigotas de un mismo gen patológico. En el caso de optar por un embarazo, estarán indicados apenas los estudios y exámenes aplicables en cualquier embarazo. Por ejemplo, se explica que ya es parte de la rutina obstétrica que se acompañe la gestación a través de la ecografía prenatal y que al momento del examen se buscará la presencia de malformaciones y defectos físicos aislados. A pesar de que muchos defectos genéticos dejan de ser detectados en ese examen de rutina, el resultado de examen normal traerá la tranquilidad psicológica al matrimonio. Referencias bibliográficas Bennett RL, Hudgins L, Smith CO, Motulsky AG (1999). Inconsistencies in genetic counseling and screening for consanguineous couples and their offspring: the need for practice guidelines. Genet. Med. 6: 286-292. Braga MCC, Otto PA, Frota-Pessoa O (2000). Calculation of recurrence risks for heterogeneous genetic disorders. Amer. J. Med. Genet. 95: 36-42. Brunoni D (1997). Estado e desenvolvimento dos serviços de genética médica no Brasil. Braz. J. Genet. (Suppl.) 20: 11-23. Frota-Pessoa O (1978). Riscos genéticos dependentes da idade. Rev. Bras. Pesq. Méd. Biol. 11: 77-80. Frota-Pessoa O, Otto PA, Otto PG (1975). Genética clínica. Livraria Francisco Alves Editora, Rio de Janeiro. Fuhrmann W, Vogel F (1978). Aconselhamento genético. Editora Pedagógica Universitária, São Paulo. 117 Murphy EA, Chase GA (1975). Principles of genetic ccounseling. Year Book Medical Publishers, Chicago. Otto PA (1989). Estimativas de riscos de doença genética na prole de primos em primeiro grau. Ci. Cult. 41: 471-474. Otto PA, Frota-Pessoa O (1979). Estimativas de riesgos genéticos. An. Acad. Ci. Ex. Fis. Nat. Buenos Aires 31: 271-289. Otto PA, Frota-Pessoa O, Vieira-Filho J (2007). Genetic risks of consanguineous marriages. In Mayo O, Leach C (ed.), Fifty years of human genetics: A Festschrift and liber amicorum to celebrate the life and work of George Robert Fraser, Wakefield Press, Adelaide, pp. 436-442. Otto PG, Otto PA, Frota-Pessoa O (1998). Genética humana e clínica. Editora Roca, São Paulo. Reed RW, Reed SC (1965). Mental retardation: a family study. Saunders, Philadelphia. Stevenson AC, Davison BCC (1976). Genetic counselling. Lippincott, Philadelphia. Vieira Fo J (1992). Riscos de doença genética na prole de consangüíneos. Tese de doutoramento, DB IB USP, São Paulo. 118 119