Modelos del átomo
Anuncio

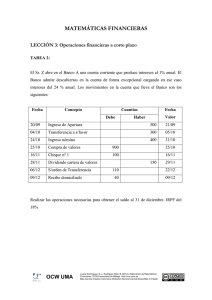
Física Nuclear Descubrimiento del Núcleo Componentes del núcleo: protones y neutrones Propiedades de la fuerza nuclear fuerte Debe ser de atracción y suficientemente grande para vencer la repulsión culombiana entre protones Es independiente de la carga. Es la misma entre protón y protón, entre protón y neutrón y entre neutrón y neutrón. En un núcleo con muchos nucleones (nucleón=protón o neutrón) cada nucleón interacciona solo con los vecinos inmediatos. Por lo tanto, la fuerza necesaria para remover un nucleón es aproximadamente la misma si el núcleo tiene 5 o 6 nucleones o si tiene 100. A distancias de 1 fermio (10-15 m) la fuerza es de atracción y alrededor de 10 veces la fuerza eléctrica entre dos protones. La fuerza decae rápidamente a cero a distancias de unos pocos fermios (es de corto alcance). La fuerza es repulsiva a distancias de alrededor de 0.4 fm o menor lo cual evita que el núcleo colapse. Terminología nuclear, masa y radio nuclear A Z X Número másico A = número de protones y neutrones (nucleones) Número atómico Z = número de protones Número de neutrones N = A - Z Masa del protón mp = 1.673 x 10-27 kg Masa del Neutrón mn = 1.675 x 10-27 kg 1 uma =1.661 x 10-27 kg Radio nuclear: R = R0 A , R0 ≈1.2 fm 13 Organizando los núcleos Energía de enlace E La masa del núcleo es menor que la masa de la suma de los componentes. ∆m = ( Zm p + Nmn ) − M > 0, M = masa nuclear E = ( ∆m ) c 2 Energía que hay que añadir al núcleo para separarlo en sus constituyentes. Otra forma de calcular ∆m : m p = mH − me M = ma − Zme , ma = masa atómica tenemos ∆m = ( ZmH + Nmn ) − ma Energía de enlace del deuterón Hidrógeno tiene un isótopo llamado deuterio, cuyo núcleo (llamado deuterón) consiste de un protón y un neutrón. La masa del deuterón es 2.013553 uma. Calcula su energía de enlace. m p = 1.007276 uma, mn = 1.008665 uma m p + mn = 2.05941 uma M = 2.013553 uma ∆m = ( Zm p + Nmn ) − M = 2.05941 uma − 2.013553 uma ∆m = 0.002388 uma E = ( ∆m ) c 2 ⎛ 1.661× 10 kg ⎞ ⎛ 8 m⎞ E = ⎜ 0.002388 uma × ⎟ ⎜ 3 ×10 ⎟ 1 uma s⎠ ⎝ ⎠⎝ 1 eV 6 −13 = × 2.23 10 E = 3.57 ×10 J × eV −19 1.6 × 10 J E = 2.23 MeV −27 Hay que añadir 2.23 MeV al deuterón para separarlo en sus componentes. 2 Energía de enlace por nucleón Radioactividad Decaimiento Radioactivo No hay forma de saber cual núcleo en una fuente radioactiva será uno de los pocos núcleos que van a decaer. Todos tienen igual probabilidad de decaer. Sin embargo, para una muestra que contiene N núcleos radioactivos, la razón a la cual los núcleos decaen es proporcional a N. dN = −λ N , λ = constante de decaimiento dt N dN t ∫N0 N = −∫0 λ dt ⎛ N ⎞ ln ⎜ ⎟ = −λ t ⎝ N0 ⎠ N = N 0 e − λt A veces nos interesa más la razón R (= dN/dt) a la cual decaen los núcleos que el número de núcleos N. R se conoce como la actividad (número de decaimientos por segundo = 1 Becquerel). dN − λt = N0λe R= dt R = R0 e − λt Media Vida ~ tiempo necesario para que el número de núcleos de una sustancia radioactiva se reduzca a la mitad Cuando t = T1/2 (media vida), tenemos N = N0/2: N0 − λT1 2 = N0e 2 − ln ( 2 ) = −λT1 2 T1 2 = ln ( 2 ) λ Calculando λ: Podemos determinar la constante de desintegración en un experimento donde se mida la actividad del elemento en función del tiempo. Sabemos que − λt R = R0 e Tomando logaritmo natural en ambos lados de la ecuación, tenemos ln R = ln R0 − λt Si decimos que ln R = y, ln R0 = b, -λ = m, vemos que la ecuación anterior es una linea recta cuya pendiente es igual a la constante de desintegración λ. Calcula la constante de desintegración de 128I usando la data que se obtuvo en un experimento de decaimiento radioactivo. Tiempo (min) R (cuentas/s) 392.2 36 161.4 68 65.5 100 26.8 132 10.9 164 4.56 196 1.86 218 1.00 6 ln(R) (R en cuentas/s) 4 4 2 0 0 50 100 150 Tiempo (min) Usar los puntos (0, 6.2) y (218, 1.0) para calcular la pendiente. 200 Decay of a sample of 128 I R (counts/sec) 1000 100 10 1 0 50 100 150 Time (min) 200 250 Radioactividad: decaimiento alfa A Z X→ Y + He + γ + E A− 4 Z −2 4 2 Radioactividad: decaimiento beta Una partícula beta es un electrón (carga –e) o un positrón (carga +e). A Z A Z X→ X→ Y + e +ν Y + e +ν A Z +1 A Z −1 n → p + e +ν − p → n + e +ν + 0 −1 0 +1 Ejemplos: C → N + e +ν 14 6 12 7 14 7 0 −1 N → C + e +ν 12 6 0 +1 Carbono 14 es un isótopo radioactivo que se usa para calcular la edad de materiales orgánicos. El isótopo se produce en reacciones nucleares activadas por las partículas de alta energía que continuamente nos llegan del espacio (los llamados rayos cósmicos). Su abundancia relativa a carbono 12 es 1.3 x 10-12. Todos los organismos vivos tienen esta razón de C14 a C12 ya que intercambian bióxido de carbono con el ambiente. Ejemplo: Cuando un organismo muere, deja de absorber C14 de la atmósfera, por lo tanto, la razón de C14 a C12 disminuye debido al decaimiento de C14. Podemos usar este hecho para calcular la edad de un objeto usando el decaimiento de C14.