“CONVERTIDORES CATALÍTICOS Y SUS APLICACIONES”
Anuncio

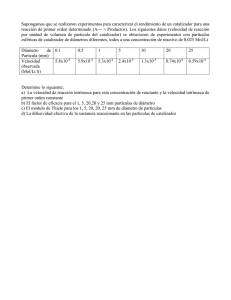
UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUIMICAS REGION POZA RICA -TUXPAN “CONVERTIDORES CATALÍTICOS Y SUS APLICACIONES” TESINA PARA PRESENTAR EL EXAMEN DE LA EXPERIENCIA EDUCATIVA DE EXPERIENCIA RECEPCIONAL DEL PROGRAMA EDUCATIVO DE INGENIERÍA QUÍMICA PRESENTA: EDUARDO MARTÍNEZ JIMENEZ DIRECTOR DE TESIS: DR. ISRAEL HERNÁNDEZ ROMERO ASESOR: M.C. RAUL ENRIQUE CONTRERAS BERMUDEZ POZA RICA DE HIDALGO VER. ABRIL 2014 AGRADECIMIENTOS A Dios Gracias a Dios y a la vida por permitir este momento tan importante en mi vida y por las buenas cosas que me han dado. A MIS PADRES: A mis padres Rosa Elia y Clemente porque este triunfo en mi vida no solo fue mío, si no de ellos también ya que solo fui el reflejo de algo que ellos formaron e inculcaron. A MI MADRE: A mi madre Rosa Elia por el apoyo que me brindaste y la confianza que me tuviste para poder terminar esta carrera y creer en mí. A MI PADRE: A mi padre Clemente por ser un ejemplo e inspiración, gracias por tu confianza y la oportunidad de terminar una carrera que es el mejor regalo que me has dado en la vida. A MIS HERMANOS: A mis hermanos Nora Alicia y Oscar Jamiel porque siempre han estado conmigo en los momentos difíciles de mi preparación. A MIS AMIGOS: A mis amigos Alberto Gutiérrez, Jaziel Alberto, Francisco Jesús, Rubí Esmeralda, Alondra Olmedo, Victor Hugo, Patricia, Brayan Felipe, Mauricio Daniel, Camilo Miranda, Veralsi Dodanim, Carlos Silíceo y Juan Antonio por los buenos momentos que pasamos juntos y que jamás se olvidaran la ayuda que nos brindamos. EDUARDO MARTINEZ JIMENEZ A MI DIRECTOR Y ASESOR DE TESIS: A mi director el Doc. Israel y mi Asesor Ing. Raúl Enrique por el apoyo que me brindaron para poder terminar lo último de mi carrera que fue mi tesis, les doy las gracias. INDICE INDICE INTRODUCCIÓN I CAPITULO I ANTECEDENTES 1.1 Catálisis 3 1.1.1 Catálisis homogénea 7 1.1.2 Catálisis heterogénea 9 1.1.2.1Catalizadore heterogéneos 11 1.1.2.2 Metales 11 1.1.2.3 Óxidos metálicos semiconductores 12 1.1.2.4 Sales metálicas 14 CAPITULO II CONVERTIDORES CATALITICOS 16 2.1 Convertidor catalítico 17 2.1.1 Clasificación 18 2.1.1.1 De mezcla pobre para óxidos de nitrógeno 18 2.1.1.2 De dos vías (oxidación) 19 2.1.1.3 De tres vías (oxidación-reducción) 19 2.2 Diseño del convertidor catalítico 21 2.2.1 Catalizadores empleados 24 2.2.3 Catalizador de reducción 25 2.2.3.1 Catalizador de oxidación 26 2.2.3.2 Reacciones químicas en el convertidor catalítico 26 INDICE CAPITULO III APLICACIONES 3.1 Automóviles 28 3.1.1 Emisiones por el tubo de escape 28 3.1.2 Contaminantes emitidos por las fuentes vehiculares 29 3.1.3 Convertidores catalíticos en automóviles 29 CONCLUSIONES 34 BIBLIOGRAFÍA 35 INTRODUCCIÓN INTRODUCCIÓN La contaminación proveniente de los motores de combustión interna es una de las que más contribuye perjudicialmente en la calidad del aire. Siendo de particular importancia en aquellas ciudades con alta concentración de vehículos en áreas pequeñas. La concentración de contaminantes se incrementa debido a las reacciones fotoquímicas, ya que en presencia de la luz solar se produce la interacción de los productos de gases de escape con el oxígeno. Los cielos despejados conducen a la formación de capas de inversión desde la tarde a las primeras horas de la mañana. Es por esto que durante esas horas la contaminación tiene lugar en la capa superficial de la atmósfera, alcanzando concentraciones críticas, contribuyendo a problemas globales de polución del aire, como smog, lluvia ácida, agotamiento de la capa de ozono y calentamiento global, ya que tienen el potencial de cambiar la atmósfera superior. Los vehículos automotores de combustión interna produce, en general, tres tipos de emisiones de gases contaminantes: a) emisiones evaporativas y b) emisiones por el tubo de escape, así como c) emisiones de partículas por el desgaste tanto de los frenos como de las llantas. El convertidor catalítico ha sido considerado como un dispositivo eficiente para el tratamiento de los gases de combustión, ya que reduce las emisiones contaminantes de monóxido de carbono (CO) en dióxido de carbono (CO 2), hidrocarburos no quemados (HC) en vapor de agua (H 2O) y dióxido de carbono (CO2); así como óxidos de nitrógenos (NOx) en nitrógeno (N2), dichos gases pueden ser transformados de compuestos tóxicos a otros menos dañinos a la salud. i INTRODUCCIÓN Una de las aplicaciones que ha tenido mayor relevancia es para reducir las emisiones de gases contaminantes a la atmósfera, desde hace poco tiempo, se incorpora el convertidor catalítico al tubo de escape de los automóviles. Se trata de un ejemplo de catálisis heterogénea, donde un sólido que recubre los canales de un panel-soporte de cerámica o acero inoxidable cataliza una reacción entre gases. De no utilizarse el convertidor catalítico, la emisión de agentes tóxicos a la atmósfera sería mayor que si se empleara gasolina con plomo. El objetivo de este trabajo es dar a conocer los tipos de convertidores existentes así como el uso de cada de ellos. A continuación se da una breve explicación de los puntos a tratar en el trabajo: En el capítulo I Marco teórico se verán los temas relacionados con la catálisis, así como los tipos de catalizadores y sus usos, principalmente en convertidores catalíticos. En el capítulo II Tipos de convertidores se describirán cada uno de ellos, indicando el tipo de material y catalizador empleado, así como los tipos de venenos y su forma de regenerarse. En el capítulo III Aplicaciones se darán a conocer cada una de las aplicaciones que tienen estos tipos de convertidores. En las Conclusiones de dará a conocer si se logro alcanzar el objetivo mediante la metodología empleada durante el desarrollo de este trabajo. Finalmente se da la Bibliografía consultada. ii CAPITULO I ANTECEDENTES CAPÍTULO I ANTECEDENTES 1.1 Catálisis El término catálisis agrupa el conjunto de procedimientos y conocimientos que permiten que la velocidad con la que transcurre una reacción se incremente insitu. Bajo tal condición la catálisis es una rama de la cinética química. La cinética química se ocupa del estudio dinámico de las reacciones químicas tomando en cuenta el mecanismo en el nivel molecular de tales transformaciones. El concepto de velocidad de reacción traduce la rapidez con la que en un sistema se produce una transformación química. La reacción química global se lleva a cabo a través de etapas las cuales en su conjunto constituyen el mecanismo de reacción. La velocidad se define en términos de parámetros que pueden ser medidos durante la transformación; así, se puede definir como la variación de la concentración de uno de los reactivos que desaparece, o de uno de los productos que aparece, en el sistema respecto al tiempo. La catálisis es un proceso catalítico superficial, las reacciones ocurren repentinamente por una secuencia de pasos elementales que incluyen adsorción, difusión superficial, rearreglos químicos (rompimiento de enlace, formación de enlace, rearreglo molecular) de los intermediarios reaccionantes adsorbidos y de la deserción de los productos. La catálisis se encarga del estudio del fenómeno que se presenta en un sistema reaccionante al introducir una sustancia denominada catalizador, que da lugar a un camino alterno al proceso de transformación química, tal alternativa lleva consigo a una modificación en la velocidad de reacciónes, es decir, se observa un 3 CAPITULO I ANTECEDENTES cambio en la variación de la concentración de uno de los reactivos que desaparece, o uno de los productos que aparece en el sistema con respecto del tiempo. De esta forma se puede definir a un catalizador como una sustancia que incrementa la velocidad de reacción sin ser apreciablemente consumida en el proceso, un catalizador puede sufrir cambios específicos en su estructura y composición como parte del mecanismo de su participación en la reacción. La palabra catálisis proviene de dos palabras griegas: el prefijo “cata” que significa hacia abajo y el verbo “lisien” que significa partir o romper, pero los fenómenos catalíticos son conocidos por la humanidad desde hace mucho tiempo. La definición de catálisis implica la posición en el equilibrio logrado con la presencia de un catalizador, es la misma a la que se llegaría si la reacción no fuera catalizada, el catalizador únicamente aumentaría la velocidad de la transformación, pero no modifica las variables termodinámicas, por lo que el valor de la constante de equilibrio es independiente de cualquier fenómeno catalítico. La especial característica de las reacciones catalíticas es que en los centros activos (moléculas reactantes), son reproducidas en una secuencia de pasos “elementales” a través de los cuales los reactantes son convertidos en productos; esto significa que los mismos centros activos, los cuales son fijados sobre el catalizador, permanentemente gobiernan los eventos de las transformaciones de los reactantes. W. Ostwald fue el primero en señalar que la presencia de un catalizador en el sistema de reacción se limita a modificar la velocidad de la transformación. El catalizador no se considera ni reactivo ni producto en la reacción. Otras definiciones de catalizador son: 4 CAPITULO I ANTECEDENTES Un catalizador es una sustancia que sin estar permanentemente involucrada en la reacción, incrementa la velocidad con la que una transformación química se aproxima al equilibrio. Un catalizador es una sustancia que químicamente altera un mecanismo de reacción así como la velocidad total de la misma, regenerándose en el último paso de la reacción. Una reacción puede llevarse a cabo en una, dos o tres etapas denominadas elementales, durante las cuales participan las moléculas de los reactivos. En general, existirá una etapa más lenta que las otras y será esta la que determine la velocidad global de la transformación. Catalizar una reacción implica reemplazar este paso por varias etapas más rápidas que se llevan a cabo solo en presencia del catalizador. Esto significa que la intervención del catalizador abre un nuevo camino a la reacción, compuesto de reacciones elementales con energía de activación menor. Se puede analizar el efecto del catalizador utilizando la teoría de colisiones (aunque no es la única forma): La teoría de las colisiones explica que la velocidad de una reacción química es en función del número de choques que se efectúan entre las moléculas de reactivos con determinada energía. Las principales características que distinguen a un catalizador son: a) Un catalizador no puede actuar en reacciones termodinámicamente imposibles (ΔG0). De la misma forma que la termodinámica establece que no puede existir la máquina de movimiento perpetuo, también delimita el campo de acción de los catalizadores. 5 CAPITULO I ANTECEDENTES b) Para una reacción en equilibrio A+B k1 k2 C El catalizador no modifica el valor de la constante en equilibrio Ke = k1/k2. Como consecuencia de lo anterior, un aumento de la velocidad en una reacción (k 1) es acompañado por un aumento similar en la constante de velocidad de reacción inversa (k2). En un sentido práctico esto quiere decir que el catalizador de una reacción lo es igualmente para la reacción inversa. c) El catalizador puede tener uno o dos efectos sobre un sistema, un efecto acelerador o un efecto orientador. En el segundo caso, la función catalítica se observa en la variación de selectividad de un proceso cuando varias direcciones son termodinámicamente posibles. Así por ejemplo, el alcohol etílico puede descomponerse según las reacciones siguientes: C2H4 + H2O I C2H4O + H2 II C2H5OH La utilización de óxido de zinc como catalizador conduce casi exclusivamente a la reacción II. Si se emplea cobre como catalizador, la reacción II se produce en mayor extensión. El hecho de que el catalizador abra una nueva ruta de reacción se puede traducir en que la reacción llegue a otro lugar diferente del que se desea. Esto se corrige estudiando muchos catalizadores de los cuales se escoge el que nos ofrezca el mejor producto deseado. d) El catalizador tiene una vida limitada, sin embargo, en lapsos cortos, se puede decir que permanece ser inalterado; esta característica es de suma importancia 6 CAPITULO I ANTECEDENTES para estudios cinéticos. Existen algunas sustancias que tienden a frenar las reacciones a través de un efecto llamado “inhibición”, sin embargo, estas especies cinéticamente activas no son especies catalíticas, no se trata de un efecto catalítico en si, ya que no se ponen en juego el mismo tipo de factores energéticos. Esto significa que no existe una catálisis negativa. Los sistemas catalíticos pueden ser divididos en tres grandes categorías distintas: catálisis homogénea, donde los reactantes y el catalizador están presentes en la misma fase, catálisis heterogénea, donde el catalizador y los reactantes están presentes en fases diferentes y catálisis enzimática. Las enzimas son catalizadores los cuales son producidos en células vivientes y controlan una gran variedad de reacciones bioquímicas. 1.1.1 Catálisis homogénea En sentido más amplio del término, la catálisis homogénea tiene lugar cuando los reactivos y el catalizador se encuentran en la misma fase, sea líquida o gaseosa. En la catálisis homogénea se tiene un acceso más fácil al mecanismo de reacción y por consecuencia se puede dominar mejor el proceso catalítico correspondiente. Las reacciones homogéneas se pueden presentar en los siguientes casos: Tabla 1. Casos de catálisis homogénea CATALIZADOR REACTANTE EJEMPLO Líquido Líquido Hidrólisis de ésteres por ácidos Gas Gas Oxidación de SO2 por NO2 Sólido Sólido Descomposición del clorato de potasio por MnO2 Fuente: Sandoval Reyes Guillermo, maestría en tecnología del petróleo y petroquímica, año 2002. 7 CAPITULO I ANTECEDENTES Otra ventaja no menos despreciable de este tipo de catálisis es la ausencia de efectos de envenenamiento tan frecuentes en el caso de la catálisis heterogénea y que obliga a tratamientos costosos de eliminación de impurezas. La catálisis homogénea ha tenido gran relevancia en algunos de los procesos, dentro de los más importantes en su aplicación industrial son: 1) Proceso oxo o reppe de carbonilación de olefinas: ácido acético. 2) Polimerización de olefinas: polietileno. 3) Adición de olefinas: polibutadieno. 4) Oxidación de olefinas: óxido de propileno. 5) Oxidación de alcanos y arenos: ácido tereftálico, adípico. 6) Polimerización – condensación: fibra de poliéster. Estas reacciones catalíticas presentan la particularidad de proceder a bajas temperaturas con selectividades elevadas, esto se logra mediante la selección adecuada del metal de transición, de los ligandos, del disolvente y de las condiciones de reacción. Esto es reflejo nuevamente del conocimiento mecanistico que caracteriza a la catálisis homogénea y que permite optimizar el proceso conociendo los ciclos catalíticos completos. Uno de los inconvenientes de la catálisis homogénea es la dificultad de separar el catalizador del medio reaccionante, lo que presenta un mayor costo que el de los procesos heterogéneos convencionales. Con base en esta inconveniencia se han intentado diseñar “catalizadores homogéneos soportados”, en los cuales se desea inmovilizar el complejo metálico activo sobre un soporte como sílice, alúmina o carbón. Sin embargo en muchos casos de esto no es posible, ya que la entidad catalítica 8 CAPITULO I ANTECEDENTES activa no es el complejo inicialmente introducido a la reacción, sino una especie derivada de él. La catálisis homogénea en solución (fase líquida) ha sido objeto de numerosos estudios y dentro de la catálisis ácido- base tiene un lugar muy importante. La catálisis ácido - base fue de los primeros fenómenos catalíticos observados por investigadores como Oztwald, Arrhenius, Bronsted, Euler, etc. La constatación de que un ácido aceleraba u orientaba ciertas reacciones químicas fue el inicio para una serie de investigaciones realizadas a fines del siglo pasado e inicio de este, que se tradujeron en una serie de numerosas aplicaciones industriales como la esterificación, la saponificación, la hidrólisis, la halogenación, la condensación, etc. 1.1.2 Catálisis heterogénea En catálisis heterogénea el fenómeno catalítico esta relacionado con las propiedades químicas de la superficie del sólido que se ha elegido como catalizador, siendo por supuesto estas propiedades superficiales un reflejo de la química del sólido. El catalizador es insoluble en los sistemas químicos en los cuales ocurre la transformación, constituyendo una fase distinta, muy a menudo sólida. Existen entonces dos fases y una superficie de contacto, la reacción se lleva a cabo en esta interfase. En la reacción heterogénea catalizada, al menos uno de los reactivos (gas o líquido), debe estar adsorbido en la superficie del catalizador. Estos sistemas de reacción son preferidos por las conversiones industriales a gran escala; conversiones las cuales son operadas usualmente como sistemas de reacción abiertos es decir, como sistemas con cambio continúo de materia y energía con el ambiente. 9 CAPITULO I ANTECEDENTES El número de combinaciones de fase que ocurren normalmente en la catálisis heterogénea las cuales se encuentran en la tabla 2 que son las siguientes: Tabla 2. Casos de catálisis heterogénea CATALIZADOR REACTANTE Liquido Gas EJEMPLO Polimerización de alquenos catalizada por ac. fosfórico Sólido Liquido Disproporcionación de cíclohexeno por Pd Sólido Gas Síntesis de NH3 sintetizada por Fe Sólido Liquido + Gas Hidrogenación del benceno por Ni Líquido Sólido Hidrogenación del carbón con complejos metálicos Fuente: Sandoval Reyes Guillermo, maestría en tecnología del petróleo y petroquímica, año 2002. Para explicar el fenómeno catalítico heterogéneo se han sugerido varias teorías. La teoría geometría explica el acto catalítico como una correspondencia geométrica entre los átomos activos en la superficie del catalizador y los átomos de la molécula o parte de ella a ser modificada en el momento de la reacción. La principal contribución a esta teoría fue la de los multipletes de Balandin que asumía que para hidrogenar benceno se requería de un arreglo hexagonal de siete átomos en la cara 111 de los metales. La teoría electrónica se basa en el hecho de que la quimisorción involucra desorción o desplazamiento de nubes de electrones. Esto puede ser analizado en función de la teoría de bandas o de la teoría de orbitales moleculares. En el primer caso, Volkenstein postuló que la reacción está controlada por la disponibilidad de electrones u hoyos en el catalizador y que la actividad depende de la facilidad o dificultad de remover o ceder un electrón de o hacia la red. 10 CAPITULO I ANTECEDENTES 1.1.2.1 Catalizadores heterogéneos En general, puede afirmarse que la selección adecuada de la especie activa de un catalizador constituye el fundamento de un diseño correcto del mismo. Tanto la actividad, como la selectividad y en parte la vida del catalizador, dependerán en forma directa de la fase activa utilizada. (Ver tabla 3). Por este motivo, los catalizadores suelen clasificarse según las características de las fases activas que lo componen. Se distinguen dos grandes grupos: El primero lo forman los elementos y compuestos que presentan propiedades de conductores electrónicos El segundo están agrupados los sólidos carentes de electrones libres, los cuales se clasifican a continuación: 1.1.2.2 Metales Puede considerarse que todos los catalizadores actúan según un esquema de reversibilidad, es decir, que aquellos que sean activos en reacciones de hidrogenación, también lo serán en procesos de deshidrogenación. Este es el caso de los catalizadores metálicos que encuentran su mayor aplicación en reacciones de adición o eliminación de hidrógeno. La acción de estos catalizadores se funda en la presencia de átomos coordinados de forma incompleta que contienen orbitales d disponibles. 11 CAPITULO I ANTECEDENTES Tabla 3. Clasificación de catalizadores heterogéneos. FASE ACTIVA Metales PROCESOS Hidrogenación EJEMPLOS Ni, Pd, Pt, Ag Deshidrogenación Combustión total Metanación Oxidación Óxidos metálicos Oxidación Cr2O3, V2O5, Mo O3 semiconductores Deshidrogenación Deshidrociclación Hidrodealquilación Desproporción de olefinas Polimerización Sales metálicas Hidrodesulfuración SCo, SNi, CuCl2 Oxicloración Óxidos metálicos Isomerización Al2O3, SiO2, MgO, aisladores SiO2-Al2O3 Deshidratación (ácidos y bases) Desintegración catalítica Isomerización Alquilación Hidratación Disfuncionales Reformación Pt/Al2O3 Fuente: Jesús Blanco, Ricardo Linarte, catálisis: fundamentos y aplicaciones industriales, Ed. Trillas. 1.1.2.3 Óxidos metálicos semiconductores Los catalizadores preparados a base de óxidos metálicos se pueden dividir en dos grandes grupos. El primero lo componen los óxidos estequiométricos y en el segundo los óxidos que, por la acción del calor, ganan o pierden oxigeno de su superficie. 12 CAPITULO I ANTECEDENTES Entre los óxidos metálicos semiconductores, los que pierden oxígeno se denominan semiconductores tipos n. En el caso del ZnO el fenómeno puede representarse: Zn+2 + ½ O2-2 Zn+2 +½ O2 + 2e Zn + ½ O2 La semiconductividad del ZnO es debida a los electrones adquiridos por los átomos del metal. En el caso de óxidos que ganan oxígeno o semiconductores tipo P: 3Ni2 + ½ O2 2Ni3 + ½ O2-2 El catión es el que cede electrones teniendo lugar la conductividad mediante huecos positivos; se considera que el movimiento de huecos positivos en una dirección es equivalente a la emigración de electrones en la dirección opuesta. En general, los óxidos tipos n son menos activos pero mas selectivos que los tipos p. Estos últimos se emplean frecuentemente en procesos de oxidación total. El estado del oxígeno en la superficie del catalizador y la energía de su enlace con el catión son determinantes de la velocidad de la reacción en la mayoría de las oxidaciones que se llevan acabo con oxígeno molecular. Dentro de ciertos límites, cuanto más débil sea el enlace metal-oxigeno mayor será la actividad catalítica del oxido en reacciones de oxidación. 1.1.2.4 Sales metálicas Las sales metálicas más interesantes desde el punto de vista catalítico son los sulfuros y cloruros. Los primeros se utilizan en procesos de eliminación de azufre, mientras que los segundos son los catalizadores de los procesos de oxicloración. 13 CAPITULO I ANTECEDENTES Los sulfuros metálicos que interesan desde el punto de vista aplicado son los que permanecen estables en atmósferas reductoras donde el azufre puede estar presente en pequeñas cantidades. Los más interesantes son los sulfuros de Co, Ni, Mo y W puesto que los de Mn y Fe, también estables, tienen una actividad muy baja, posiblemente debido a la configuración d 5 del metal ya señalada en el caso de los óxidos. Los haluros metálicos que han sido utilizados en la halogenación de hidrocarburos son los de Cu, Fe, V, Mo y Ti. El cloruro de hierro y especialmente el cloruro de cobre son catalizadores clásicos en reacciones de oxicloración. La utilidad de otras sales como catalizadores heterogéneos es muy limitada, probablemente a causa de su falta de estabilidad en las condiciones de la reacción. En los procesos de oxidación, la actividad catalítica de las sales que contienen oxigeno suelen ser mucho menor que la de los óxidos correspondientes. 1.1.3 Aplicaciones de los catalizadores Los catalizadores son sustancias que varían la velocidad de una reacción química sin consumirse en la misma. Una vez se ha producido la reacción química, el catalizador se recupera inalterado. Por tanto, el catalizador no perturba los procesos que suponen situaciones de equilibrio químico. Únicamente hace variar la velocidad a la que el equilibrio se alcanza. En muchos procesos químicos interesa aumentar la velocidad de reacción, lo cual se consigue, entre otras formas, empleando un catalizador adecuado. 14 CAPITULO I ANTECEDENTES En diferentes reacciones químicas juega un papel determinante el catalizador empleado. Por ejemplo, muchos procesos industriales como la síntesis del amoniaco, del ácido nítrico, del ácido sulfúrico y de diferentes compuestos orgánicos, no serían rentables debido a la lentitud con la que se producen las reacciones correspondientes en ausencia de un catalizador específico. Una de las aplicaciones más populares de los catalizadores supone su utilización en los tubos de escape de los automóviles. La mezcla gaseosa que expulsan estos vehículos contiene, además de N2(g), CO2(g) y HO(g), otras sustancias contaminantes, entre las que se encuentran: algo de combustible sin quemar, CO(g) y óxidos de nitrógeno (que designaremos como NO 2). Los catalizadores empleados (metales nobles y caros como Pt, Pd y Rh) consiguen la combustión rápida de los hidrocarburos todavía no quemados y aceleran la conversión del monóxido de carbono en dióxido de carbono y de los óxidos de nitrógeno en nitrógeno. Un problema de estos catalizadores es que pueden envenenarse o inactivarse. El plomo es un veneno muy intenso para los catalizadores de los tubos de escape. Por ello, los vehículos actuales van equipados con motores que utilizan gasolina sin plomo. Una ventaja adicional de este combustible supone la reducción de la contaminación atmosférica debido a la presencia de este metal en la misma. Gases tóxicos a la entrada de un tubo de escape y gases que salen debido a la presencia de un catalizador. 15 CAPITULO II CATALÍTICOS CONVERTIDORES CAPITULO II CONVERTIDORES CATALÍTICOS El consumo mundial de combustible usado en automotores prácticamente se ha triplicado desde 1960, debido al rápido crecimiento del parque automotor. Es de vital importancia encontrar formas para reducir estas contaminaciones. Entre las soluciones estudiadas a escala mundial, el convertidor catalítico ha demostrado el mejor resultado en términos de funcionalidad, costo y confiabilidad a largo plazo para reducir el nivel de contaminantes contenidos en los gases de escape de automotores. El catalizador es un elemento que acelera una reacción química. En el presente caso, el catalizador es la mezcla de metales preciosos como lo son platino(Pt), paladio(Pd), rodio(Rh). Muy a menudo el término catalizador, se utiliza también para referirse al soporte con los metales preciosos, y a veces incluso al producto acabado (convertidor catalítico). A fin de reducir las emisiones, los motores de los automóviles modernos controlan la cantidad de combustible que queman. El catalizador trata los gases de escape transformándolos en otros de escaso poder contaminante. Los catalizadores usados en la industria automovilística se les denomina en función del número de vías que poseen (número de gases a tratar), y en función de estos son los metales preciosos con los que están fabricados y alojados en su interior para poder hacer una reacción química y purificar los gases de escape. En los automóviles se utiliza el catalizador de tres vías (tres gases), en la primer vía se produce la oxidación del monóxido de carbono para transformarse en anhídrido carbónico, en la segunda vía los hidrocarburos son transformados en anhídrido 16 CAPITULO II CATALÍTICOS CONVERTIDORES carbónico y vapor de agua, en la tercera vía se reducen los óxidos de nitrógeno que se transforman en nitrógeno para mezclarse con el aire. 2.1 Convertidor catalítico El convertidor catalítico (Figura 1), ha demostrado el mejor resultado en términos de funcionalidad, costo y confiabilidad a largo plazo para reducir el nivel de contaminantes contenidos en los gases de escape de automotores. Un catalizador es un material que acelera una reacción química pero sin entrar en la reacción ni ser consumido en ella, muchos materiales pueden actuar como catalizadores dependiendo de la reacción química involucrada. La mayoría de los convertidores catalíticos que se producen actualmente para los vehículos son del tipo de metales nobles, es decir, los que utilizan platino y paladio. Figura 1. Convertidor catalítico Fuente: http://www.geocities.com El término convertidor catalítico designa genéricamente a un reactor metálico instalado en el sistema de escape que depura los gases que salen por el tubo de escape, transformando gran parte de las emisiones nocivas en otras menos contaminantes antes de dejarlas libres en la atmósfera. Este reactor de acero 17 CAPITULO II CATALÍTICOS CONVERTIDORES inoxidable contiene en su interior al catalizador, el cual está constituido por una colmena cerámica impregnada con sustancias activas. 2.1.1 Clasificación Los catalizadores usados en la industria automovilística se denominan en función del número de vías que poseen (número de gases a tratar), y en función de estos son los metales preciosos con los que están fabricados y alojados en su interior para poder hacer una reacción química y purificar los gases de escape. Existen tres tipos de convertidores catalíticos: 1. De mezcla pobre para óxidos de nitrógeno 2. De dos vías o llamados también de oxidación 3. De tres vías o llamados también de oxidación-reducción 2.1.1.1 De mezcla pobre para óxidos de nitrógeno Todos los motores sean de diesel o de gasolina, operan de manera más eficiente con mezclas pobres, produciendo menos emisiones de CO, HC y en el caso de los diesel de partículas, pero a costa de un incremento en las emisiones de NO x. Los convertidores de mezcla pobre para NO x los cuales con materiales completamente distintos como catalizador son capaces de provocar la reacción de reducción en presencia de agentes oxidantes. La eficiencia de estos dispositivos es muy baja, cerca del 50 % que es muy inferior a la del convertidor de tres vías, los cuales trabajan con mezclas muy pobres, además no requieren tratamiento para HC y CO por las bajas emisiones de estos que normalmente producen. La restricción para el uso de estos convertidores sería que el diesel empleado no tenga más de 0.05 % en peso de azufre, ya que de lo contrario se degrada el catalizador. 18 CAPITULO II CATALÍTICOS CONVERTIDORES 2.1.1.2 De dos vías (oxidación) Sirven para acelerar la reacción entre el oxígeno y los hidrocarburos, y entre el oxígeno y el monóxido de carbono (reacciones de oxidación), de manera que los residuos de estos dos contaminantes en los gases de escape cuando pasan por el catalizador, reaccionan con el oxígeno y se transforman en bióxido de carbono y agua, logrando una disminución drástica en la concentración de estas sustancias en emisiones. Para su adecuado funcionamiento, este tipo de convertidores requiere que los gases se encuentren a una temperatura mínima, por lo cual en frío no proporciona buenos resultados, es necesario que la proporción aire-combustible con la que opera el motor sea pobre de manera que exista un excedente de oxígeno en los gases de escape para que pueda reaccionar con los contaminantes. Así mismo requiere que la gasolina empleada no contenga aditivos con plomo, ya que los residuos con plomo en las emisiones forman depósitos en la superficie del catalizador impidiendo el contacto posterior con los gases de escape. Esta situación con el plomo es tan grave que un solo tanque de gasolina con plomo utilizado reduce casi al 50 % la eficiencia del catalizador, también el azufre y el fósforo en la gasolina inhiben la función del catalizador en forma temporal. 2.1.1.3 De tres vías (oxidación-reducción) Este es básicamente un catalizador de dos vías al que se le ha agregado otro metal que funciona también como catalizador, pero que exclusivamente sirve para acelerar la reacción de descomposición del óxido nitroso a nitrógeno molecular y oxígeno (reacción de reducción). Este tipo de catalizador reduce a niveles insignificantes la concentración de los tres contaminantes principales en los vehículos a gasolina. 19 CAPITULO II CATALÍTICOS CONVERTIDORES Para lograr la descomposición de los óxidos nitrosos, siendo ésta una reacción de reducción, se requiere que no existan agentes oxidantes como el oxígeno en los gases de escape, por lo cual el vehículo debe operar con mezclas ricas o estequiométricas. Sin embargo para lograr las reacciones de oxidación mediante las cuales se transforman los HC y el CO se requiere la presencia de oxígeno y por consiguiente mezclas pobres. Esto parece algo contradictorio, pero existe un estrecho margen de proporciones aire-combustible en las cuales la cantidad de oxígeno en los gases de escape es tal, que permite que se lleven a cabo ambas reacciones, de oxidación y de reducción de forma simultánea con un grado razonable de eficiencia. El uso de convertidores catalíticos de tres vías requiere que el automóvil tenga un sistema electrónico de inyección, ya que únicamente de esta manera se puede mantener constante la proporción aire-combustible, en el rango adecuado que permita el funcionamiento del catalizador. El convertidor denominado de tres vías es el utilizado en todos los automóviles de manufactura posterior a 1994 en México y esencialmente en todos los países donde es obligatorio el uso de convertidores. El catalizador promueve de manera simultánea la oxidación de los hidrocarburos remanentes de la combustión, la oxidación del monóxido de carbono y la reducción del monóxido de nitrógeno a nitrógeno, como se observa en la reacción 1. CO + NO CO2 + ½ N2 (1) La mayoría de los automóviles modernos están equipados con convertidores catalíticos de tres vías (Figura 2). Las tres vías se refieren a las tres emisiones reguladas que ayudan a reducir moléculas de NO x, monóxido de carbono (CO) y 20 CAPITULO II CATALÍTICOS CONVERTIDORES COV (hidrocarburos sin quemar). El convertidor utiliza dos tipos diferentes de catalizadores, uno de reducción y otro de oxidación. Figura 2. Convertidor catalítico de tres vías. A (catalizador de reducción), B (Catalizador de oxidación) y C (alveolar). Fuente: http://www.red-de-autoridades.org/capacitacion/Capitulo3/3_4_4_1.htm 1.2 Diseño del convertidor catalítico Hay dos tipos principales de estructuras que se utilizan en los convertidores catalíticos: alveolar (Figura 3a) y de cuentas cerámicas (Figura 3b). En la actualidad la mayoría de los automóviles utiliza una estructura alveolar. a) b) Figura 3. a) Estructura del catalizador alveolar, b) Estructura de cuentas cerámicas. Fuente: http://es.techemet.com/What_Is.cfm/ 21 CAPITULO II CATALÍTICOS CONVERTIDORES En cada convertidor se requiere solo una pequeña cantidad de material catalítico, el método consiste en depositar el material en un substrato de soporte para exponer lo más posible de su superficie. El catalizador actúa por área no por volumen. El substrato se hace con óxido de aluminio, bien sea en forma de bolitas o de una superficie monolítica parecida a un panal. El catalizador está constituido por una colmena cerámica impregnada con una capa de óxidos metálicos sobre la cual se distribuyen uniformemente los metales preciosos. Estos constituyen la capa catalíticamente activa. La colmena está formada por millares de minúsculos canales (celdas) por donde pasan los gases de escape. Las paredes de estos canales generan una superficie de contacto equivalente a tres canchas de fútbol. La formulación incluye una serie de sustancias activas como óxidos de aluminio, metales nobles catalíticamente activos: platino, rodio, paladio, y promotores o retardadores específicos, que aumentan o retardan la acción catalítica de los anteriores sobre determinadas reacciones. Los monolitos cerámicos sensitivos (Figura 4), se recubren desde hace tiempo con entramados metálicos especiales. Figura 4. Monolito cerámico Fuente: http://www.geocities.com/mecanicoweb/cl4.htm 22 CAPITULO II CATALÍTICOS CONVERTIDORES Este tipo de tela metálica no es sensible a las temperaturas extremas de los gases de escape en el rango de alta velocidad. El rango de temperaturas a las que actúa este tipo de monolito es desde 250 a 900 ºC. Para limitar la expansión longitudinal de los monolitos y mejorar la mezcla de gases de escape, se utiliza el encapsulado multicapa (Figura 5). Figura 5. Encapsulado Multicapa Fuente: http://www.geocities.com/mecanicoweb/cl4.htm Otro método para proteger al monolito es encapsularlo en una especie de estera insuflada (Figura 6). De este modo se consigue un aislamiento más continuo a lo largo de los diversos monolitos que conforman el convertidor catalítico. Metal precioso Revestimiento intermedio Soporte cerámico Figura 6. Encapsulado Insuflado Fuente: http://www.geocities.com/mecanicoweb/cl4.htm 23 CAPITULO II CATALÍTICOS CONVERTIDORES 2.2.1 Catalizadores empleados Los metales preciosos usados son platino, paladio y rodio. Impregnados sobre un soporte poroso, todo aquello que ingresa al convertidor sale por el otro extremo, átomo por átomo. Nada desaparece, nada permanece en el convertidor, todo lo que el convertidor hace es transformar una sustancia en otra, y lo hace mediante la ionización de los diferentes gases que pasan a través del mismo. Los vehículos modernos están equipados con convertidores catalíticos de tres vías haciendo referencia a los tres contaminantes que debe reducir (CO, HC y NO x). El convertidor utiliza dos tipos de catalizadores, uno de reducción y otro de oxidación (Figura 7). Ambos consisten de una estructura cerámica cubierta con metal normalmente platino, rodio y paladio. La idea es crear una estructura que exponga al máximo la superficie del catalizador contra el flujo de gases de escape, minimizando también la cantidad de catalizador requerido ya que es muy costoso. Figura 7. Catalizador de óxido – reducción Fuente: http://www.oni.escuelas.edu.ar/2001/santa-fe-sur/motor/converti.htm 24 CAPITULO II CATALÍTICOS CONVERTIDORES 1.2.3 Catalizador de reducción El catalizador de reducción es la primera etapa del convertidor catalítico, utiliza platino y rodio para disminuir las emisiones de NOx. Cuando una molécula de monóxido o dióxido de nitrógeno (NO o NO 2) entra en contacto con el catalizador, éste atrapa el átomo de nitrógeno de la molécula y lo retiene liberando el oxígeno en forma de O2, como se muestra en las reacciones 2 y 3. Posteriormente el átomo de nitrógeno se une con otro átomo de nitrógeno adherido al catalizador y se libera. Es decir, descompone los óxidos de nitrógeno en oxígeno y nitrógeno que son los componentes del aire y por lo tanto no son contaminantes. 2.2.3.1 2 NO N2 + O2 (2) 2 NO2 N2 + 2 O2 (3) Catalizador de oxidación El catalizador de oxidación es la segunda etapa del convertidor catalítico, reduce los hidrocarburos y el monóxido de carbono no quemados, oxidándolos sobre un catalizador de platino y paladio. Este catalizador colabora con la reacción del monóxido de carbono y los hidrocarburos con el oxígeno restante en el gas del escape, como se muestra en la reacción 4. 2 CO + O2 2 CO2 (4) 25 CAPITULO II CATALÍTICOS CONVERTIDORES 2.2.3.2 Reacciones químicas en el convertidor catalítico Estas son altamente exotérmicas, como se observa en las siguientes reacciones. Un esquema simple de las mismas se muestra en la figura 8: 2 CO + O2 2 CO2 (5) 2 CO + 2 NO N2 + 2 CO2 (6) 2 H2 + 2 NO N2 + 2 H2O (7) CmHn + O2 CO2 + H2O (8) CmHn + NO N2 + H2O + CO2 (9) Estas reacciones tienen lugar en los catalizadores de oxidación, mediante ellas se obtienen grandes reducciones de HC y CO. Si el catalizador es de tres vías también se eliminan los óxidos de nitrógeno. N2 H 2O CO2 NO2 soporte cerámico revestido con óxido cerámico Figura 8. Reacciones químicas en el convertidor catalítico Fuente: http://www.energiaadebate.com.mx/Articulos/Agosto%202004/gerardo_bazan.htm 26 CAPITULO IIII APLICACIONES CAPÍTULO III APLICACIONES 3.1 Automóviles Los vehículos automotores propulsados por motores de combustión interna producen, en general, tres tipos de emisiones de gases contaminantes: a) Emisiones evaporativas b) Emisiones por el tubo de escape, así como c) Emisiones de partículas por el desgaste tanto de los frenos como de las llantas 3.1.1. Emisiones por el tubo de escape Las emisiones por el tubo de escape son producto de la quema del combustible (sea éste gasolina, diesel u otros como gas licuado o biocombustibles) y comprenden a una serie de contaminantes tales como: el monóxido y bióxido de car- bono, los hidrocarburos, los óxidos de nitrógeno y las partículas. Además, ciertos contaminantes presentes en el combustible como el azufre y, hasta hace algunos años, el plomo se liberan al ambiente a través del proceso de combustión. Las emisiones por el tubo de escape dependen de las características del vehículo, su tecnología y su sistema de control de emisiones; los vehículos más pesados o más potentes tienden a generar mayores emisiones por kilómetro recorrido y las normas que regulan la construcción de vehículos determinan tanto su tecnología así como la presencia o ausencia de equipos de control de emisiones, como los convertidores catalíticos. El estado de mantenimiento del vehículo y los factores operativos, la velocidad de circulación, la frecuencia e intensidad de las aceleraciones y las características del combustible (como su contenido de azufre) juegan un papel determinante en las emisiones por el escape. 28 CAPITULO IIII APLICACIONES 3.1.2 Contaminantes emitidos por las fuentes vehiculares Si en un motor la combustión fuera perfecta, el oxígeno en el aire convertiría todo el hidrógeno del combustible en agua y todo el carbono en dióxido de carbono. En la realidad, el proceso de combustión no es perfecto y, en consecuencia, los motores de los automóviles emiten varios tipos de contaminantes. En la tabla 4 se muestran algunos de los contaminantes que son emitidos por las fuentes vehiculares. Tabla 4. Algunos contaminantes emitidos por los automóviles Tipo de emisión Contaminantes emitidos Hidrocarburos, monóxido de carbono, Por el tubo de escape óxidos de nitrógeno partículas, bióxido de carbono, bióxido de azufre, plomo (sólo en el caso de gasolinas con plomo), amoniaco y metano. Evaporativas Hidrocarburos 3.1.3 Convertidores catalíticos en automóviles La utilización de convertidores catalíticos para el control de emisión de contaminantes en los escapes de los automóviles es una de las más nuevas aplicaciones de los catalizadores. En la actualidad, la mayoría de los coches vienen equipados con un dispositivo catalítico que ha permitido disminuir a niveles bastantes bajos la concentración de los contaminantes más usuales producidos durante la combustión de la gasolina. Los contaminantes usuales provenientes de los escapes de los automóviles son el monóxido de carbono (CO), los óxidos de nitrógeno (NOx) y los hidrocarburos (HC). La composición de los gases de escape depende de la relación aire/combustible = A/C que sea alimentada a la máquina. 29 CAPITULO IIII APLICACIONES En condiciones ricas en combustible la composición de un gas de escape de automóvil podría ser por ejemplo CO 3%, H2 1%, HC 1%, O2 1%, CO2 y H2O 10%, compuestos de plomo, azufre y halógenos. Cuando la relación aire/combustible pasa de condiciones ricas en combustible a condiciones ricas en oxigeno (aire). A medida que aumenta la cantidad de oxígeno, los productos que no sufrieron una combustión completa disminuyen y la concentración de (NO) pasa por un máximo después del valor estequiométrico p = 14.5. La eliminación completa de productos no quemados, HC y CO, y de NO es imposible. Básicamente se requieren dos catalizadores diferentes para la purificación de los gases de emisión: Uno para el control de (CO) y (HC), es decir, un catalizador de oxidación trabajando en condiciones de exceso de oxígeno. Otro para la remoción de (NOx) que será un catalizador de reducción trabajando en atmósfera rica en combustible. Dos catalizadores diferentes son utilizados en serie: para la oxidación los catalizadores son metales de transición como Pt (platino) y Pd paladio), para la reducción Rh (rodio) y Ru (Rutenio). La cantidad de estos metales en el catalizador varía de 0.03 a 0.16 onzas/automóvil. Este tipo de convertidor dio lugar a diferentes problemas por lo que se diseñó un convertidor catalítico único (tres funciones catalíticas en un solo catalizador). Las tres reacciones que se llevan a cabo son: 30 CAPITULO IIII APLICACIONES NO reducción N2 CO oxidación CO2 + H2O HC oxidación CO2 + H2O La única restricción para el uso de este catalizador es que trabaja en una región de la relación aire/combustible muy estrecha y cercana a la relación estequiométrica A/C = 14.5. Se trata de un catalizador compuesto, los más populares son: Pt - Rh. Pt - Pd - Rh. La restricción de operación hace necesaria la presencia de un sensor de O 2 que permite ajustar continuamente la mezcla aire/gasolina y mantener el valor muy cercano al estequiométrico. Existen varias formas físicas del convertidor catalítico que se encuentra localizado en el escape del automóvil. Sin embargo las más usuales incluyen pellets (pequeñas bolitas) y monolitos de cerámica que sirven como soporte de las partículas metálicas que funcionan como catalizador. El convertidor catalítico es considerado, a la fecha, como el dispositivo más eficiente para reducir las emisiones contaminantes de los gases de combustión generados por los vehículos con motor a gasolina: monóxido de carbono (CO), hidrocarburos no quemados (HC) y óxidos de nitrógeno (NOx). Hoy día se les considera como uno de los grandes triunfos de la ingeniería del siglo pasado. Dada la importancia del uso del convertidor y por ende su masificación se realizan estudios que buscan encontrar alternativas más económicas y/o más eficientes para su producción. Una de esas alternativas la constituye las tecnologías emergentes 31 CAPITULO IIII APLICACIONES basadas en los llamados sólidos mesoporosos. Estos son esponjas sólidas de materiales cerámicos que al haber ido simplificando y abaratando su construcción han pasado la etapa de ser utilizados como simples filtros físicos para usos de alta temperatura (coladas de aluminio y otros metales), para comenzar a asomarse como soportes catalíticos para los llamados filtros catalíticos ambientales utilizados para la remoción de contaminantes tanto en efluentes gaseosos como líquidos. De un punto de vista teórico, el convertidor catalítico es un pequeño reactor químico empacado con un catalizador sólido. Sin embargo, su estudio es complicado por la gran variabilidad en los volúmenes de flujo, alta variabilidad en las temperaturas de entrada e inclusive en las composiciones de la alimentación. Además, como es bien conocido, una vez alcanzada la temperatura de ignición de una mezcla de hidrocarburo-aire, la reacción es tan rápida que no es posible efectuar mediciones directas. En el caso de los convertidores catalíticos automotores los factores mencionados arriba hacen aún más compleja la determinación de los parámetros cinéticos que afectan el proceso. Por lo que la mayor parte de las regulaciones sobre contaminación ambiental vehicular se basan en mediciones integrables, es decir, la medición de emanaciones totales para ciclos de manejo simulados. Los convertidores catalíticos que se utilizan son generalmente del tipo panal de abeja, o sea, un monolito con orificios longitudinales en los cuales se impregnan los ingredientes catalíticos. Actualmente en la ciudad de México y dadas las condiciones geográficas de la misma no se puede pensar en un catalizador que pueda resolver por completo el problema de la contaminación ambiental. Sin embargo, es posible desarrollar un catalizador que permita abatir la concentración de uno de los contaminantes más críticos, como es el NOx. 32 CAPITULO IIII APLICACIONES El rendimiento exacto en cuanto a las emisiones de cualquier tipo de catalizador depende del tamaño del catalizador y la temperatura a la que se encuentre este dispositivo. Se requiere una temperatura mínima de 180°C para activar la conversión. El mejor rendimiento del catalizador ocurre a temperaturas sobre 250 a 300°C cuando la conversión del monóxido de carbono supera el 90%. En la figura 9 se muestra un comparativo de las emisiones con convertidor y sin convertidor; en la que podemos observar que con convertidor catalítico se reduce las emisiones de los monóxidos de carbono (CO), hidrocarburos no quemados (HC) y óxidos de nitrógeno (NOx). Figura 9. Comparativo de emisiones con convertidor y sin convertidor Fuente: http://www.oni.escuelas.edu.ar/olimpi99/autos-y-polucion/cataliza.htm 33 CONCLUSIONES CONCLUSIONES Se logro dar a conocer lo que es la catálisis, así como su clasificación en homogénea y heterogénea. Además de los tipos de catalizadores existentes indicando sus aplicaciones, dentro de las cuales se encuentra en los convertidores catalíticos empleados en los motores automotrices. Se dio lo que es un convertidor catalítico, el cual puede ser de dos vías o de tres. Además de indicar qué función tiene cada uno de ellos, así como los diferentes catalizadores empleados para realizar la oxidación o reducción de los productos obtenidos de la combustión de hidrocarburos. El conocer las alternativas que se tienen para reducir la emisión de gases contaminantes a la atmósfera por este tipo de dispositivo es de gran importancia, conocer cómo funcionan ayuda a identificar su funcionalidad y además cuando requiere tener un mantenimiento. La disposición y almacenamiento final es realizada por parte del municipio y una compañía encarga del tratamiento de aceite requemado de carro. Se proponer continuar con estudios en los convertidores catalíticos para encontrar mejores catalizadores que ayuden a disminuir la contaminación originada por las fuentes contaminantes que utilizan hidrocarburos como combustibles. Además de probar con otras fuentes contaminantes. 34 BIBLIOGRAFIA BIBLIOGRAFIA 1. Aguayo, Pérez Javier. preparación y caracterización de catalizadores. 2. Aguilar, Ríos Gabriel. Fundamentos de catálisis heterogénea. Series científicas IMP, 1988. 3. E.D. Gamas, L. Díaz e I. Schifter. metodos de evaluacion de convertidores cataliticos. Gerencia de Transformación de Energéticos, SPA, Instituto Mexicano del Petróleo. 4. E.D. Gamas (1), G.A. Fuentes (2) e I. Schifter (1). Estudios de la influencia del azufre sobre la actividad de convertidores de tres vias. (1) Gerencia de Transformación de Energéticos, SPA, Instituto Mexicano del Petróleo. 5. Fuentes S., Díaz G. catalizadores. ¿la piedra filosofal del siglo xx?. Impresora Progreso. México, 1995. 6. gasolina y diesel de bajo azufre. La clave para disminuir las emisiones vehiculares versión final en español, 21 de mayo de 2003. El Colegio Nacional, México, 1966. 7. G. Quadri y L. Sánchez. la zona metropolitana y la contaminación atmosférica. Limusa-Noriega Editores, México, 1992. 8. L. García Colín y J.R. Varela Ham (compiladores). contaminación atmosférica. 9. Los vehículos automotores como fuente de http://www2.inecc.gob.mx/publicaciones/libros/618/vehiculos.pdf emisión. 10. Nerea Burgos, María Paulis y Mario Montes. dispositivos catalíticos sobre monolitos metálicos. Grupo de Ingeniería Química, Departamento de Química Aplicada, Facultad de Química de San Sebastián. Universidad del País Vasco, Paseo M. Lardizábal, 3; 20018. 11. N. Burgos. Eliminación de compuestos orgánicos volátiles (cov’s) con monolitos metálicos. Tesis Doctoral, UPV-EHU, 2001. 12. Oh, S.H. y Cavendish, J.C. (1985) “Mathematical modeling of catalytic converted lighoff. Part II: Model 35 BIBLIOGRAFIA 13. Programa integral contra la contaminación atmosférica en la zona metropolitana de la ciudad de méxico. Departamento del Distrito Federal, octubre de 1990. 14. Satterfield, Charles. Heterogeneous catalysis in industrial practice. Editorial Mc Graw-Hill. México, 1991. 15. Secretaria de Medio Ambiente, Recursos Naturales y Pesca. Norma oficial mexicana NOM-041-ECOL-1999. 16. S. P. Beaton, G. Bishop y D. Stedrnan. Emission characteristics of mexico city vehicles. Journal of Air Waste Management Assoc., Vol. 42,1992. 17. T. Fleish. New clean diesel fuel and engine technology. Colaboración presentada en la 1996 World Conference on Refinery Processing & Reformulated Fuels, Texas, EUA. 36