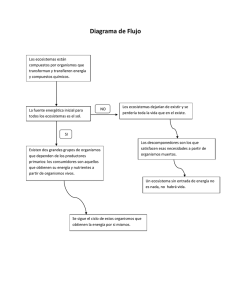
Invasiones de Plantas en Ecosistemas Forestales: Bosques y
Anuncio

Invasiones de plantas en ecosistemas Capítulo 18 Invasiones de Plantas en Ecosistemas Forestales: Bosques y Praderas Invadidas Aníbal Pauchard, Rafael García, Barbara Langdon, Martín Nuñez INTRODUCCIÓN Las invasiones biológicas, entendidas como el movimiento de una especie más allá de su rango biogeográfico, mediado por el ser humano, son uno de los componentes fundamentales del cambio global (Salas et al. 2000, Blackburn et al. 2011). Las invasiones biológicas incluyen el movimiento de organismos y su posterior crecimiento poblacional desde hongos y bacterias, hasta animales y plantas. Sus efectos pueden ir desde cambios en la biodiversidad hasta modificaciones de los procesos ecosistémicos, con los consecuentes impactos sociales y económicos (Mack et al. 2000). La evidencia indica que algunos ecosistemas son más invadidos que otros y que no todas las especies introducidas tienen la capacidad de volverse invasoras (Blackburn et al. 2011), por ello resulta fundamental entender las interacciones entre especies invasoras y ecosistemas invadidos para detectar y reducir los impactos de éstas sobre la biodiversidad. En particular, las invasiones de plantas pueden alterar tanto la composición, estructura y función de los ecosistemas (Vilá et al. 2011). Aun cuando la mayoría de las invasiones de plantas ocurren en ambientes perturbados, recientes investigaciones demuestran que las plantas invasoras pueden afectar sitios relativamente prístinos, incluyendo ecosistemas de alta montaña y bosques nativos (Pauchard et al. 2009, Martin et al. 2008). Los ecosistemas forestales a nivel mundial están cambiando drásticamente en el último siglo, reduciendo su cobertura y siendo afectados por la fragmentación del hábitat, mientras algunas especies se extinguen o disminuyen su abundancia, otras se están volviendo dominantes en múltiples continentes (Butchart et al. 2010, Wardle et al. 2011, Laurance et al. 2012). Históricamente se consideró a los bosques como ecosistemas relativamente resistentes a las invasiones de plantas en comparación a otros ecosistemas más abiertos y más expuestos a la actividad humana, pero creciente evidencia demuestra que los bosques también son altamente invadidos (Martin et al. 2008). Especies arbóreas de géneros como Acacia, Pinus y Eucalyptus no sólo son abundantes en plantaciones forestales, sino también en bosques donde se han naturalizado (Richardson y Rejmanek 2011). También, especies arbustivas y herbáceas están cambiando los sotobosques de los ecosistemas forestales, incorporando incluso funciones ecosistémicas que estaban ausentes en los ecosistemas naturales (Vitousek y Walker 1989). Por ejemplo, la llegada de arbustos de fabáceas cambia el ciclo de nitrógeno en sitios donde el nitrógeno es un factor limitante (García et al. 2012). Evidentemente, las invasiones de plantas en ecosistemas forestales pueden ser consideradas un síntoma más de la degradación de los bosques naturales causada por la explotación no sustentable, el cambio de uso de suelo y la fragmentación. Esto es lo que se conoce como el concepto de “especies pasajeras” en ecología de invasiones (MacDougall y Turkington 2005, Wardle et al. 2011). Sin embargo, nuevos estudios indican que muchas especies son “especies conductoras” de los cambios en ecosistemas forestales, pudiendo ir más allá de los cambios causados directamente por la acción antrópica y generando un espiral de cambios ecosistémicos sin precedentes. Las invasiones en ecosistemas forestales pueden ocurrir fundamentalmente de dos formas. La primera, es la llegada de especies de plantas introducidas a ecosistemas dominados por especies arbóreas nativas. La segunda, es la llegada de especies arbóreas introducidas a ecosistemas dominados por arbustos o herbáceas. En ambos casos, el resultado es un ecosistema forestal con una nueva composición florística, con especies que han evolucionado en diferentes regiones biogeográficas. La interacción entre la especie introducida y el ecosistema invadido será fundamental para determinar el resultado de una invasión y sus potenciales impactos. Por ello, resulta crucial entender los patrones de invasión, los procesos detrás de estos patrones, para luego evaluar los impactos de las invasiones tanto en la biodiversidad como en otras funciones ecosistémicas. 673 Invasiones de plantas en ecosistemas Los bosques templados de Sudamérica presentan numerosas particularidades, en especial su alto nivel de endemismos (Rodriguez-Cabal et al. 2008). Otra particularidad es la ausencia de especies que cumplen roles comunes en otros ecosistemas, como por ejemplo especies arbóreas que regeneren rápido luego de una perturbación, lo cual genera nichos vacíos en estos. Al igual que las islas oceánicas, los boques templados están también aislados de otros bosques lo que genera baja cantidad de especies, un alto número de endemismos y la falta de especies que cumplen un rol que es común en otras regiones. Por ejemplo, no hay pináceas nativas, dado que están no han podido colonizar el hemisferio sur debido a limitantes ecofisiológicas (Brodribb y Feild 2008). La ausencia de especies arbóreas con alta capacidad de dispersión y regeneración, hace a estos bosques vulnerables a la invasión de las pináceas. Las pináceas son a su vez altamente plantadas por su importancia forestal y muy buenas colonizadoras. Otro ejemplo donde se podría ver el efecto del nicho básico es en las especies arbustivas que se asocian con bacterias fijadoras de nitrógeno, las cuales no son dominantes en el bosque templado. Esto facilita la invasión de especies como la retama (Cytisus scoparius), el ulex (Ulex europaeus) y otras especies fijadoras de nitrógeno como las acacias arbóreas. A su vez, la invasión de estas especies que en su asociación con bacterias que fijan nitrógeno atmosférico genera un cambio en el suelo que aumenta el impacto de estas especies en el ecosistema. Esto se debe a que el suelo modificado puede ser también más fácil de colonizar por otras especies de plantas introducidas las cuales tienden a desarrollarse favorablemente cuando hay mayor disponibilidad de nutrientes (Davis y Pelsor 2001). Este capítulo tiene por objetivo revisar la evidencia sobre invasiones de plantas en ecosistemas forestales, incluyendo tanto las invasiones en bosques naturales como la formación de nuevos bosques con especies invasoras. Se busca responder las siguientes preguntas: 1) ¿Qué limita las invasiones de plantas en bosques o en otras palabras, tienen los bosques una invasibilidad muy distinta a la de otros ecosistemas?, 2) ¿Cómo ocurren los procesos de invasión de plantas en bosques naturales y las invasiones de especies arbóreas en otros ecosistemas?, 3)¿Cuáles son los impactos de estas invasiones en la biodiversidad y los servicios ecosistémicos, y por último, 4)¿Cómo es posible reducir las invasiones de plantas y sus impactos en ecosistemas forestales? La revisión se plantea desde una perspectiva global pero con un énfasis en los ecosistemas del sur de Sudamérica. Finalmente, mediante dos recuadros se discuten ejemplos de los impactos en los bosques de las especies animales invasoras, en especial del castor, ciervo y jabalí. Limitantes de la invasión de plantas en bosques Existe la tendencia general a pensar que comunidades más avanzadas en la sucesión, como los bosques, son más resistentes a la invasión de plantas (Rejmánek 1989, 2004, Von Holle et al. 2003). Hoy en día, nuevas investigaciones ponen en duda tal planteamiento (Rejmánek 2004, Martin et al. 2008). Por un lado, la mayor parte de las investigaciones de invasiones involucran especies pioneras o etapas tempranas de la sucesión, las que por sus atributos, como rápido crecimiento, alta intolerancia a la sombra, reproducción temprana, entre otros; son capaces de establecerse e invadir en ambientes abiertos y/o perturbados (Lodge 1993, Rejmanek y Richardson 1996, Reichard y Hamilton 1997, Martin et al. 2008). Además, un alto porcentaje de las especies introducidas ya sea con fines ornamentales o productivos, corresponden a especies de rápida propagación, bajos requisitos de mantenimiento, de rápido crecimiento y sin enfermedades evidentes (Flint 1983, Weber 2003, Martin et al. 2008). Por otro lado, la mayor parte de los estudios sobre invasiones se han realizado en ecosistemas de praderas o comunidades similares y sólo un pequeño porcentaje se han realizado en ecosistemas de bosque o matorrales (Levine et al. 2004), por lo que existe poca evidencia de invasión en ambientes de bosque. Esto da la falsa impresión de que los bosques son más resistentes a la invasión que otros ambientes, como praderas o sistemas perturbados. Sin embargo, Rejmánek (2004) plantea que cuando se introduce la especie “adecuada”, cualquier ecosistema es susceptible, sin importar lo resistente que pareciera ser. Martin et al. (2008) dejan muy clara la importancia de incorporar especies tolerantes a la sombra en los estudios de invasión de bosques. A través de una recopilación de literatura publicada a nivel global ellos demuestran que el atributo común a todas las especies que invaden ecosistemas de bosque es la tolerancia a la sombra. Se encontraron 139 especies invasoras catalogadas como tolerantes a la sombra y determinaron que ninguna de ellas requiere de la presencia de disturbios para invadir el sotobosque de bosques densos. La forma de vida parece ser un factor importante en la capacidad de una especie para invadir bajo el dosel de un bosque: herbáceas y arbustos (35 % y 28 %) parecen ser las más comunes y árboles o plantas trepadoras representan un 21 % y 17 %, respectivamente. 674 Invasiones de plantas en ecosistemas El estudio de la interacción entre los atributos de las plantas invasoras y la dinámica de bosques parece ser una buena opción para esclarecer los mecanismos que determinan los procesos de invasión (Lamarque et al. 2011). Se sabe que la disponibilidad de luz en bosques con un dosel cerrado es muy baja. En este tipo de ambientes, es la tolerancia a la sombra la que guía el proceso de sucesión. La baja presencia de especies de árboles introducidos tolerantes a la sombra hace pensar que sólo aquellos bosques perturbados, con mayores niveles de luz disponible son invadidos por árboles. En estos bosques, pequeños disturbios generan claros de menor tamaño, los que son ocupados por la expansión de las copas de los individuos dominantes en el dosel superior. Los eventos que generan aperturas mayores son muy escasos, por lo que generalmente se forma un banco de plántulas introducidas en el sotobosque esperando la oportunidad para poder dominar (Canham 1985). El sotobosque, por otro lado, parece ser más susceptible a la invasión de plantas que el dosel superior, ya que la mayor parte no se encuentra saturado en términos de diversidad o biomasa (Gilbert y Lechowicz 2005). Esto es común en sitios como el noreste de Estados Unidos, donde la historia de uso agrícola ha provocado la reducción o extinción local de las especies herbáceas y arbustivas del sotobosque (Flynn y Vellend 2005). Esto también estaría apoyado por la mayor riqueza de herbáceas y arbustos tolerantes a la sombra. Dinámica de invasiones en ecosistemas forestales Las invasiones en ecosistemas forestales pueden ocurrir debido a la llegada de especies invasoras a bosques naturales o la formación de bosques de especies invasoras en lugares previamente cubiertos con vegetación no boscosa. En el primer caso, las invasiones a un bosque natural pueden ser clasificadas de manera general en: a. Invasión de especies herbáceas, b. Invasión de especies arbustivas, y c. Invasión de especies arbóreas dominantes o co-dominantes (figura 18.1). En todas estas situaciones, el dosel dominante de especies nativas se mantiene o es gradualmente remplazado por las especies invasoras (Essl et al. 2011). En el segundo caso, la llegada de especies arbóreas en ecosistemas abiertos puede generar un ecosistema forestal novedoso para el área mediante tres procesos: a. Invasión de especies arbóreas en praderas y matorrales, b. Invasión de especies arbóreas en ecosistemas con presencia de especies arbóreas con una baja cobertura (e.g sabana), o c. Invasión de especies arbóreas en ecosistemas forestales afectados por una perturbación catastrófica natural o antrópica (figura 18.2). La creación de estos ecosistemas forestales novedosos es considerada de alto impacto ya que cambia la función ecosistémica y altera las condiciones ambientales del área (Langdon et al. 2010, Rascher et al. 2011). Figura 18.1. Invasión de plantas en bosques naturales. a) Invasión de especies herbáceas bajo dosel, b) Invasión de especies arbustivas bajo dosel, c) Invasión de especies arbóreas capaces de ocupar el dosel superior del bosque. 675 Invasiones de plantas en ecosistemas Figura 18.2. Invasión de árboles en ambientes abiertos. a) Invasión de árboles en ambientes naturalmente abiertos (e.g. zona alpina, estepa), b) Invasión de especies arbóreas en bosques abiertos o sabanas, c) Invasión de especies arbóreas después de perturbaciones que eliminan la cobertura de árboles nativos (e.g incendios, talas rasas). Invasiones en bosques La invasión en bosque requiere de al menos superar dos barreras para la invasión. Primero, es la barrera de la dispersión, la que puede estar dada por la falta de vectores de dispersión y las barreras propias del bosque a esa dispersión, por ejemplo un denso sotobosque (Cadenaso y Pickett 2001). Segundo, las condiciones de luz al interior de un bosque pueden ser complejas para la mayoría de las especies invasoras que se consideran especies intolerantes a la sombra (Pauchard y Alaback 2004). Además, puede existir una tercera barrera respecto a la disponibilidad de sustrato, el cual se encuentra generalmente cubierto por una gruesa hojarasca (Martin et al. 2008). Sin embargo, todas estas barreras pueden ser sobrepasadas debido a la acción de agentes naturales o del hombre y sus actividades. Por ejemplo, la ganadería, la creación de redes de caminos, la maquinaría forestal puede facilitar la ruptura de estas barreras naturales, ya sea por la llegada de propágulos como también por el aumento de la perturbación y la consecuente liberación de recursos (Pauchard y Alaback 2004). La invasión de especies herbáceas (figura 18.1a) ocurre fundamentalmente como un proceso gradual ayudado por la dispersión de semillas mediante vectores como el viento o herbívoros y requiere que las especies invasoras sean capaces de tolerar las condiciones de sombra del bosque. Alternativamente, puede ocurrir en los claros de los bosques. Este tipo de invasión es fuertemente facilitada por la construcción de caminos que permiten la formación de poblaciones fuentes en ambientes abiertos que luego logran dispersarse al interior del bosque (Pauchard y Alaback 2004). Por ejemplo en los bosques adyacentes a praderas del sur de Chile, especies como Taraxacum officinale, Hypochaeris radicata y Poa pratensis pueden sobrevivir en el sotobosque de bosques de Nothofagus (Pauchard y Alaback 2004). Incluso en bosques densos siempreverdes del sur de Chile, la especie Prunella vulgaris es capaz de adaptarse a condiciones de baja luminosidad al interior del bosque (Godoy et al. 2011). Las especies arbustivas invasoras generalmente son capaces de dispersarse a grandes distancias mediante mutualismos con especies de aves o mamíferos granívoros por lo que una vez establecidas en las cercanías de un bosque son capaces de ingresar fácilmente. También, en algunos casos sus semillas o frutos son dispersados por los cursos de agua, invadiendo en una primera etapa los ecosistemas ribereños. Este es el caso de Rubus ulmifolius (zarzamora), una especie con gran capacidad de mantenerse bajo dosel y con una alta dispersión por aves. La zarzamora no sólo es capaz de invadir, sino también de permanecer bajo dosel pudiendo limitar la sucesión del bosque (Quiroz et al. 2009b). Las Fabáceas arbustivas invasoras, donde 676 Invasiones de plantas en ecosistemas destacan las especies Teline monspessulana, Cytisus scoparius y C. striatus, si bien toleran menos la sombra de los bosques, en Chile central pueden invadir desde los bordes al interior de fragmentos de bosques abiertos de Nothofagus (García et al. 2010). Estas especies ven favorecido su establecimiento con la ocurrencia de incendios forestales lo que les permite invadir aquellos bosques que mantienen una estructura más cerrada después de la apertura del dosel y la eliminación de la capa de hojarasca (Pauchard et al. 2008, García et al. 2010). Recientemente, la introducción de nuevas especies ornamentales y cultivares para biocombustibles aumenta el riesgo de invasión bajo dosel (Richardson y Blanchard 2011). Por ejemplo, las bambúceas introducidas en Norteamérica pueden rápidamente expandirse en los bosques del noroeste del Pacífico debido a la falta de competidores y la eventual existencia de un nicho vacío (Richard Mack, com. pers.). La invasión de especies arbóreas capaces de ocupar el dosel superior del bosque son las que pueden causar mayores impactos en los ecosistemas boscosos, ya que su establecimiento tendrá un efecto directo en todas las especies presentes en el bosque. Aún cuando los bosques degradados son más permeables a la invasión, actualmente algunos bosques en buen estado de conservación están siendo invadidos. Este es el caso de Pseudotsuga menziesii (pino oregón) en Argentina, donde se encuentra invadiendo bosques de Nothofagus dombeyi y Austrocedrus chilensis a considerables distancias desde la plantación (Simberloff et al. 2002, Sarasola et al. 2006). En Chile, la misma especie ha sido registrada como invasora en el Parque Nacional Conguillío (Teillier et al. 2003), la Reserva Nacional Coyhaique (Langdon et al. 2011), en la Reserva Nacional Malalcahuello, donde también se encuentra invadiendo bosques naturales de Nothofagus spp. (Peña y Pauchard 2001, Peña et al. 2007) y en varios sectores de las regiones de la Araucanía y de los Ríos (Pauchard et al. 2008). Pseudotsuga menziesii es exitoso incluso en ambientes sombríos bajo dosel, lo que le permite invadir bosques maduros e incluso renovales de Nothofagus (Peña et al. 2007). Otro ejemplo es el de Pinus radiata, la especie con mayor superficie de plantaciones en Chile que también ha sido registrada invadiendo en áreas abiertas (Becerra et al. 2006), pero la situación más relevante ocurre en el Bosque Costero Maulino, donde ha sido registrado invadiendo bosques de ruíl (Nothofagus alessandrii). Si bien se encuentra invadiendo el bosque, el establecimiento sólo ocurre en el interior de aquellos fragmentos de bosque cuyo dosel presenta evidente degradación o en los bordes de estos (Bustamante et al. 2003, Bustamante y Simonetti 2005). Los fragmentos de bosque maulino de menor tamaño presentan una mayor invasión donde predominan los individuos jóvenes, sin embargo, es posible encontrar pinos adultos con producción de semillas (Gómez et al. 2011). También en Chile central, el aromo (Acacia dealbata) y el aromo australiano (Acacia melanoxylon) invaden fragmentos de bosques nativos, estableciéndose primero en las orillas de los fragmentos pudiendo luego ocupar claros en el bosque, lo que se ve fuertemente facilitado, al igual que en las Fabaceaes arbustivas, por los incendios forestales (Fuentes-Ramirez et al. 2011). Acacia dealbata es capaz de superar rápidamente en supervivencia y crecimiento a las especies del bosque nativo (Cryptocarya alba y N. obliqua) pudiendo llegar a dominar el dosel del bosque (Fuentes-Ramirez et al. 2011). Bosques de especies invasoras Las especies invasoras pueden formar ecosistemas forestales novedosos, no existentes con anterioridad en un determinado sitio generando impactos impredecibles. Este proceso puede ocurrir en ambientes que naturalmente no contaban con un bosque o en aquellos bosques naturales que luego de una fuerte perturbación son remplazados por bosques dominados por especies no-nativas. En la mayoría de los casos estos procesos son irreversibles ya que generan dinámicas sucesionales completamente inciertas. Por ejemplo en el hemisferio sur, en áreas donde no existen especies arbóreas nativas capaces de tolerar condiciones de sequía o de frío y por lo tanto se desarrollan ecosistemas arbustivos y herbáceos, la llegada de especies de Pinaceae del hemisferio norte que han evolucionado en estas condiciones permite rápidamente la invasión del sitio (Simberloff et al. 2010, Pauchard et al. 2010). La llegada de especies invasoras a sitios no boscosos puede ocurrir por dispersión desde una fuente de propágulo cercana como una plantación forestal ubicada adyacente a ecosistemas naturales. Pinus contorta, por ejemplo, ha logrado disponerse desde plantaciones y establecerse en la Estepa Patagónica de la región de Aysén. En este ecosistema abierto se pueden encontrar individuos a 3 km desde la plantación y con densidades que alcanzan los 13.000 individuos por hectárea en los 60 m más cercanos a la plantación, esto es más de 10 veces superior a la densidad de la plantación original (Langdon et al. 2010). En este sitio, un ecosistema nativo, las especies residentes se encuentran interactuando con P. contorta, lo que estaría facilitando o al 677 Invasiones de plantas en ecosistemas menos, favoreciendo su establecimiento bajo las condiciones ambientales extremas de la estepa (Langdon 2011). Como consecuencia de esto, el ecosistema abierto se está transformando en un bosque de coníferas que pronto cerrará el dosel. Este mismo comportamiento ha sido registrado en otras partes del mundo con clima similar como Nueva Zelanda (Ledgard 2001). En el sur de Sudamérica, especies como A. dealbata, Alnus glutinosa, Salix spp y Populus spp han formado bosques de galería en zonas ribereñas o bien pequeños bosquetes en bancos de ríos, con serias implicancias en características hidrológicas de los ríos invadidos (Quiroz et al. 2009b). En algunos casos los ecosistemas invadidos tienen especies arbóreas pero en una muy baja densidad, encontrándose estos árboles nativos en el límite de sus condiciones ecofisiológicas. Este es el caso de los ecosistemas abiertos de Araucaria araucana invadidos por Pinus contorta en la Reserva Nacional Malalcahuello. Araucaria tiene una muy baja tasa de reclutamiento y compite con una abundante invasión de pino contorta proveniente de una pequeña superficie de ensayos forestales establecidos en la década de 1970 (Peña et al. 2008). La relativa ventaja que tiene el pino sobre araucaria ha permitido el establecimiento de un bosque cerrado de la especie invasora que ha ido desplazando a las especies nativas y por lo tanto reduciendo la diversidad vegetal (Urrutia 2012). Por último, perturbaciones catastróficas como el fuego, talas rasas o temporales pueden dar paso en ecosistemas forestales a ecosistemas abiertos muy expuestos a la invasión de especies arbóreas. Estas especies pueden encontrarse en el banco de semilla del área perturbada o pueden ser dispersadas durante los primeros años post-perturbación. Este es el caso de A. dealbata y A. melanoxylon que rápidamente colonizan (o recolonizan) áreas afectadas por incendios de alta intensidad en la zona centro-sur de Chile formando ecosistemas totalmente nuevos (i.e. novel ecosystems, Hobbs et al. 2006) con presencia de especies no nativas en todos los niveles de organización y con baja representación de especies nativas (Fuentes-Ramírez et al. 2010). Impactos de las invasiones en los ecosistemas forestales Las especies invasoras pueden amenazar a los ecosistemas invadidos en formas extremadamente diversas; los principales mecanismos son la depredación, parasitismo, herbívora, vector de patógenos, modificación del hábitat, hibridación y competencia (Simberloff 2000). La modificación del hábitat en el caso de las plantas invasoras puede darse de variadas formas y dependerán de la forma de vida y los hábitos de la planta. Algunos ejemplos frecuentes son alteraciones sobre el régimen del fuego (Mandle et al. 2011), efectos sobre el ciclo del nitrógeno (Liao et al. 2008) y modificaciones químicas del ambiente a través de sustancias alelopáticas (Inderjit et al. 2008). El impacto de una especie invasora puede ser medido a cinco niveles: i) efecto sobre individuos (incluyendo tasas demográficas como el crecimiento y la mortalidad); ii) efectos genéticos (incluyendo hibridación); iii) efectos en la dinámica poblacional (abundancia, crecimiento poblacional, etc); iv) efectos comunitarios (riqueza de especies, diversidad, estructura trófica) y v) efecto sobre procesos ecosistémicos (disponibilidad de nutrientes, producción primaria, etc). El estudio de los impactos de las especies invasoras se ha centrado a un nivel poblacional, mientras que los impactos a un nivel genético y cambios en las funciones de los ecosistemas están muy poco representados (Parker et al. 1999). Los impactos de las invasiones han crecido de forma exponencial, así mismo las investigaciones de especies invasoras han florecido también (Pauchard y Shea 2006). Sin embargo, los estudios se han concentrado en patrones espaciales y los procesos relacionados con la invasión, siendo menos los trabajos que estudian los impactos de estas invasiones (Quiroz et al. 2009a, Pauchard et al. 2011). Además estos impactos generalmente son asumidos y/o cuantificados de manera subjetiva (Parker et al. 1999, Colauti y Richardson 2009). En relación a sus impactos, una de las pocas generalizaciones aceptadas es que los mayores impactos ocurren cuando las especies introducidas realizan una función totalmente novedosa en la comunidad nativa (Ruesink et al. 1995), como cuando mamíferos depredadores invaden una isla oceánica que no tenía predadores nativos (Elton 1958) ó plantas que se asocian con bacterias fijadoras de nitrógeno atmosférico invaden una región con suelos pobres en este elemento y sin plantas locales capaces de fijarlo (Liao et al. 2008). Impactos en la biodiversidad del bosque Las especies introducidas invasoras producen números impactos en las comunidades nativas (Mack et al. 2000). Por ejemplo, se ha registrado que generan reducción en la biodiversidad y cambios en las interacciones entre especies (Traveset y Richardson 2006). Actualmente, en los bosques templados de la 678 Invasiones de plantas en ecosistemas región se han observado numerosos impactos de las especies introducidas. Entre ellos, hay cambios en la composición florística (Anderson et al. 2006, Relva et al. 2010), alteración de las interacciones entre especies nativas (Aizen et al. 2008), y facilitación de la invasión de otras especies introducidas (Molina-Montenegro et al. 2008, Nuñez et al. 2008a). A pesar de esto, dada la gran cantidad de especies invasoras en los bosques, aún se requiere más estudios, especialmente que consideren una escala temporal mayor para evaluar los efectos de las invasiones. Hay numerosas plantas con alto impacto en los bosques. Por ejemplo, los pinos generan con su invasión zonas donde estos son mono-dominantes, y pocas especies puede crecer debajo de su dosel (Nuñez et al. 2008b). Los pinos también están asociados a especies de hongos micorrícicos que tampoco son nativos a los bosques de Sudamérica. Por lo tanto, no solo producen cambios en las comunidades vegetales sino también en las especies de hongos mutualísticos asociados a las especies de plantas nativas, los cuales no pueden crecer en los pinos (Nuñez et al. 2009). A su vez, especies como Citysus spp., Ulex spp. y Acacia spp. también generan zonas donde pocas otras especies pueden crecer (Fuentes-Ramírez et al. 2010). Estas especies fijadoras de nitrógeno también cambian el suelo de un modo drástico, por lo que generan que a las especies nativas que estaban antes de la invasión se les haga difícil re-colonizar la zona, dados los cambios producidos en el suelo. Otro impacto más sutil es el de la facilitación de polinización que se ha registrando donde una especie introducida con flores muy atractivas para los polinizadores (Lupinus arboreus), facilita la polinización de otra especie introducida con flores no tan atractivas (Carduus pycnocephalus). Esto produce un aumento en la tasa reproductiva de la especies menos atractivas y facilitaría su invasión (Molina-Montenegro et al. 2008). En algunos ecosistemas invadidos, se puede producir lo que en la literatura se ha denominado invasional meltdown (sensu Simberloff 2006), donde un número creciente de especies invasoras van modificando el ecosistema hasta un punto de no retorno. Ese proceso está ocurriendo fuertemente en la zona de Chile central donde especies de árboles invasores han creado bosques “novedosos” donde el sotobosque está dominado por especies exóticas arbustivas que son favorecidas por estas nuevas condiciones. Por ejemplo, en la cordillera de la Costa del centro-sur de Chile en bosques de Acacia dealbata y Acacia melanoxylon, las especies nativas se reducen drásticamente por la alta competencia y cuando se produce una apertura del dosel sólo las especies invasoras como Teline monspessula y Ulex europaeus logran ocupar el sitio. Estos ensambles de especies se automantienen por las frecuentes perturbaciones antrópicas incluyendo un aumento en el régimen del fuego (Pauchard et al. 2008). El impacto sobre la biodiversidad, por lo tanto, resulta irreversible, especialmente en paisajes con altos niveles de antropización. Varias especies de animales también producen impactos importantes en la biodiversidad de los bosques del sur de Sudamérica. En los recuadros 18.1 y 18.2, se describe el impacto de los ciervos, el jabalí y el castor, especies que pueden causar la disminución de las plantas nativas y su remplazo por especies introducidas. Otras especies que han sido estudiadas y que han mostrado un alto impacto en las comunidades nativas son los polinizadores. Por ejemplo, Aizen et al. (2008). mostraron que la presencia de polinizadores introducidos en el bosque cambia las simetrías de las interacciones entre las plantas y sus polinizadores, con pocas especies de polinizadores siendo muy abundantes (las invasoras) y desplazando a las especies menos abundantes (nativas). Esto genera cambios no solo en las plantas y sus especies asociadas sino también, en las trayectorias evolutivas de éstas. A su vez, existe evidencia de que la presencia de abejorros introducidos (e.g., Bombus ruderatus) ha limitado a los nativos, lo cual también puede producir cambios ecológicos y evolutivos dado los diferentes comportamientos y abundancias de los polinizadores nativos e introducidos (Morales 2007). Impactos en servicios ecosistémicos: el caso del agua La invasión de ecosistemas por especies arbóreas invasoras de rápido crecimiento puede aumentar la evapotranspiración y disminuir el caudal de los cursos de aguas en las cuencas hidrográficas invadidas (Pejchar y Mooney 2009, Görgens y van Wilgen 2004). Los árboles invasores, sobre todo especies que alcanzan grandes alturas y con una alta tasa de crecimiento como pinos, eucaliptos y acacias, tienen tasas de evapotranspiración mayor que las especies nativas, especialmente cuando los ecosistemas originales son arbustivos o de praderas (Görgens y van Wilgen 2004, Le Maitre et al. 2011). Si bien la evapotranspiración depende de la edad, biomasa y área foliar de cada árbol, también existen marcadas diferencias entre especies y también entre sitios o condiciones ambientales (Görgens y van Wilgen 2004). Las reducciones de caudales y escorrentía pueden variar, pero en lugares de Sudáfrica donde este fenómeno ha sido ampliamente estudiado se estiman pérdidas de escorrentía de entre 100 a 300 mm/año. Incluso, se considera que la reducción del agua disponible puede 679 Invasiones de plantas en ecosistemas también afectar a las napas freáticas que requieren varios años para alcanzar niveles previos a la plantación o invasión de especies exóticas. Estos efectos en napas freáticas pueden ser muy relevantes en zonas de sequías intensas y cuando las especies invasoras tienen una raíz pivotante profunda (e.g. Prosopis en Sudáfrica). El impacto negativo de las especies invasoras sobre los caudales de agua en Sudáfrica ha sido tan alto, que el gobierno de ese país ha impulsado exitosamente un programa de control de especies arbóreas invasoras denominado Working for Water. El programa consiste en la remoción mecánica de especies invasoras mediante la contratación de trabajadores locales, lo que aumenta el beneficio social al proveer de una fuente laboral a la población, además de mejorar la provisión de aguas para las comunidades locales (Turpie et al. 2008). En los bosques del sur de Sudamérica, se ha estudiado el efecto de las plantaciones en la producción de agua, comparando cuencas plantadas con cuencas con bosque nativo (e.g. Little et al. 2009, capítulo 15). En estos estudios se ha demostrado que las plantaciones de especies exóticas reducen el caudal de los ríos. Sin embargo, no existen antecedentes directos del efecto de los procesos de invasión en los procesos hidrológicos. Este efecto puede resultar muy relevante en la zona central de Chile donde las invasiones de árboles y arbustos ha aumentado fuertemente en las últimas décadas (Figueroa et al. 2004, Pauchard et al. 2010) y donde los escenarios de cambio climático predicen una mayor escasez de agua. El principal problema metodológico es poder separar el efecto de las invasiones arbóreas de otros factores antrópicos como plantaciones forestales, redes de caminos o degradación del bosque. Por lo tanto, se recomienda utilizar marcos conceptuales sólidos que permitan ir integrando variables observacionales y experimentales para generar modelos predictivos basados en los mecanismos que determinan el impacto de las especies invasoras en la reducción de los caudales (Görgens y van Wilgen 2004). La invasión de zonas ribereñas también puede afectar la dinámica de los cursos de agua y el caudal. Los efectos en el caudal se producen por la alta evapotranspiración de especies establecidas cerca del curso de agua. Por otro lado, los efectos en el caudal son de carácter estructural y ocurren cuando las especies invasoras tienen características muy diferentes a las especies nativas y ocupan nichos ecológicos usualmente libres en el ecosistema invadido (e.g. Tamarix en el sudoeste de EEUU, Sher et al. 2002). En el sur de Sudamérica las especies de Salix introducidas, que invaden cursos de agua, son capaces de sobrevivir hasta el borde del curso pudiendo reducir su ancho y por lo tanto aumentando la velocidad del caudal con consecuencias importantes para la fauna de macroinvertebrados (Claudio Valdovinos, com. pers.). Otras especies como Acacia dealbata tienen la capacidad de establecerse en zonas habitualmente no aptas para las especies arbóreas nativas en depósitos de arena y gravas de ríos de la zona centro-sur de Chile. Aun cuando, las variables geofísicas del caudal tienden a reducir el efecto de estos árboles en el curso de agua principal, en zonas más alejadas del cauce principal estos bosques de especies invasoras pueden permanecer y por lo tanto, modificar el curso del río (Andrea Andreoli com.pers.). Impactos en ciclos ecosistémicos Régimen del Fuego. Uno de los mecanismos mediante el cual las invasiones biológicas pueden afectar a los ecosistemas nativos es cambiando propiedades del combustible acumulado en su interior, las cuales pueden a su vez afectar el comportamiento del fuego y en última instancia modificar características del régimen del fuego como la frecuencia, intensidad, severidad, extensión y estacionalidad de los incendios forestales. Para evaluar correctamente el efecto del combustible acumulado por plantas en el régimen del fuego, se deben considerar detalladamente las propiedades intrínsecas (e.g. contenido de humedad, compuestos volátiles) y extrínsecas (e.g. carga, continuidad) de los combustibles. Las propiedades del combustible pueden cambiar directamente por la adición de plantas invasoras o cambiar indirectamente por la alteración en la cantidad y composición de plantas nativas, causadas por el efecto competitivo de los invasores (D’Antonio et al. 1998). Esta dinámica puede describirse a través de un modelo conceptual en distintas fases, el ciclo invasión de plantas-régimen del fuego (Brooks et al. 2004) que considera un amplio rango de posibles interrelaciones entre las plantas invasoras, combustible y régimen del fuego. Para entender completamente el ciclo invasión de plantas-régimen del fuego, primero se debe considerar la historia evolutiva de los potenciales invasores y del hábitat que pueden invadir, además de sus características del combustible (Brooks et al. 2004). La habilidad de un invasor para crear eventualmente un ciclo de invasión de plantas-régimen del fuego autosuficiente, depende de su capacidad para persistir bajo el nuevo régimen creado. El fuego puede reducir el vigor de las plantas residentes y su habilidad para resistir la invasión, o alterar condiciones ambientales que favorecen a los invasores, pudiendo acortar la fase entre el establecimiento y expansión de 680 Invasiones de plantas en ecosistemas la invasión. La expansión de la especie invasora no sólo afecta a la biota nativa, sino que puede crear nuevas condiciones de combustible que pueden alterar el comportamiento del fuego (Brooks et al. 2004). La fase final de éste ciclo considera la perpetuación del cambio en las características del combustible y el comportamiento del fuego durante subsecuentes intervalos de retorno del fuego. En éste punto, el régimen del fuego ha sido modificado. El nuevo régimen persiste en la medida que refuerce positivamente la abundancia o el efecto de las especies invasoras. Esta interacción positiva podría incluir la eliminación de las plantas nativas residentes. Figura 18.3. El Ciclo invasión de plantas-régimen del fuego. (Adaptado de Brooks et al. 2004). Dentro de las plantas leñosas las familias Pinaceae y Fabaceae se destacan por crear esta interacción entre invasión e incendios forestales (Mandle et al. 2011). En diversos ecosistemas a nivel mundial se ha sugerido que las especies de retamos (Fabaceae, “brooms and gorse species”) tienen la capacidad de generar una retroalimentación positiva con los incendios forestales (Alexander y D’Antonio 2003, Mandle et al. 2011). En la zona centro-sur de Chile algunos miembros familia Fabaceae como Ulex europaeus, Cytisus spp. y Teline monspessulana están ampliamente distribuidos (Fuentes et al. 2012). Teline monspessulana regenera abundantemente desde el banco de semillas después de la ocurrencia de un incendio forestal (García et al. 2007, Pauchard et al. 2008) además, presenta un rápido crecimiento en altura en los meses siguientes (García et al. 2007). Las semillas de esta especie tienen la habilidad de soportar las elevadas temperaturas registradas al interior del banco de semillas durante la acción del fuego. De hecho, la germinación de las semillas aumenta con el aumento de las temperaturas, alcanzando su máxima germinación cuando son precalentadas entre 80 y 120 ºC (García et al. 2010). La elevada carga y la alta inflamabilidad del combustible acumulado en poblaciones de T. monspessulana jugarían un rol importante en la modificación del régimen del fuego en las zonas invadidas. El rápido crecimiento de esta especie genera una acumulación de combustible cercana a las 80 ton ha-1 en poblaciones menores de 10 años, con directa influencia en la severidad de los incendios forestales. Además, el combustible presenta una importante acumulación de material fino y de alta inflamabilidad que facilitaría la ignición del combustible y posterior propagación del fuego. Sin embargo, el inicio de un fuego que pueda gatillar un incendio forestal, aun dependerá de factores externos, especialmente la acción humana. De esta manera la invasión de T. monspessulana estaría acentuando los efectos negativos de los incendios en el ecosistema y no la cantidad de estos. Las pináceas pueden generar un ciclo similar de interacción positiva 681 Invasiones de plantas en ecosistemas con el fuego al aumentar la carga de combustible y su inflamabilidad, lo que ha sido observado en Sudáfrica (Holmes et al. 2000), Argentina (Zalba et al. 2008) y Chile (Gonzalez et al. 2011). Ciclo del Nitrógeno. Las invasiones de plantas pueden alterar varios componentes del ciclo ecosistémico del nitrógeno. Las variaciones generadas por las plantas invasoras pueden tener como consecuencias un aumento o disminuciones en las concentraciones de este elemento en el suelo. Así en sitios invadidos, aumentos en la producción primaria neta (PPN) (e.g. Wilsey y Polley 2006), aumentos en la tasa de descomposición de la hojarasca (e.g. Allison y Vitousek 2004) y mayores concentraciones de nitrato y amonio en comparación con los dominados por especies nativas (e.g. Ehrenfeld et al. 2001), tendrían efectos positivos sobre el ciclo del nitrógeno, pudiendo generarse una interacción positiva que facilitaría la mantención de la especie invasora. Por otro lado, otros estudios muestran que las invasiones de plantas pueden hacer disminuir la fijación del N. Johnson y Wedin (1997) reportan que el N almacenado en el suelo decrece con la invasión de pastos en bosques tropicales secos. Windham y Ehrenfeld (2003) encontraron que la hojarasca de la invasora Phragmites australis se descompone más lentamente que la nativa Spartina patens, disminuyendo la velocidad de incorporación de este elemento al sistema. El meta-análisis realizado por Liao et al. (2008) muestra que la invasión de plantas aumenta la PPN en un 83 % en ecosistemas invadidos, comparado con ecosistemas nativos (figura 18.4). La tasa de descomposición de la hojarasca aumenta por la invasión de plantas en un 17 %. Esta mayor tasa de descomposición en ecosistemas invadidos sugiere que la invasión puede acelerar el proceso ecológico del ciclo de nutrientes. Las tasas de la red de mineralización de N y nitrificación en el suelo fue 52 % y 53 %, respectivamente, más alta en ecosistemas invadidos que en los nativos. Junto con una hojarasca rica en N y rápida descomposición, las altas tasas de mineralización de N y nitrificación podrían dar lugar a aumentos en las concentraciones de NH4+ y NO3- en el suelo, que aumentarían el N disponible (Svejcar y Sheley 2001). Este patrón se refleja en el correspondiente aumento en la concentración de NH4+ y NO3- en el suelo en ecosistemas invadidos (figura 18.4). Figura 18.4. Interacción positiva potencial entre invasión de plantas y el ciclo del nitrógeno en ecosistemas invadidos. ↑ respuesta positiva a la invasión; ? respuesta no clara a la invasión; PPN producción primaria neta (modificado de Liao et al. 2008). 682 Invasiones de plantas en ecosistemas El incremento en el N acumulado en el sistema debido a la invasión de plantas es explicado por tres importantes procesos. Primero, el incremento en la biomasa de raíces de las plantas invasoras presumiblemente como resultado de una expansión del sistema radicular (Liao et al. 2008). Este sistema radicular más grande permite acceder a incorporar N de zonas del suelo que no pueden ser exploradas por las plantas nativas (Luo et al. 2006). Segundo, el aumento en la PPN en ecosistemas invadidos aumenta la entrada de C en el suelo, proveyendo más carbohidratos para los microorganismos del suelo capaces de fijar nitrógeno (Knops et al. 2002). Tercero, el aumento de la biomasa microbiana del suelo podría estimular la acumulación neta de N en ecosistemas invadidos. El aumento de la cantidad de N en el ecosistema sugiere que las plantas invasoras pueden modificar rápidamente la dinámica de largo plazo del N. En la zona centro-sur de Chile dos especies de fabáceas leñosas están causando cambios en el ciclo del N, por un lado suelos invadidos por Acacia dealbata presentan mayor concentración de amonio que bosques nativos adyacentes y Teline monspessulana presenta mayores concentraciones de nitrato que las encontradas en praderas circundantes (García et al. 2012). Todos estos cambios sugieren que la invasión de plantas alteran profundamente funciones y procesos de los ecosistemas (Liao et al. 2008). Las implicancias que estas modificaciones puedan tener en la comunidad nativa son aun materia de discusión. Sin embargo, es claro suponer que no todas las especies responderán de la misma forma y que en el caso de ecosistemas altamente degradados estos incrementos en la cantidad de N disponible en el suelo podrían facilitar futuras tareas de restauración. Desafíos de manejo Los programas de control de especies invasoras consideran cuatro etapas principalmente: prevención, detección temprana, erradicación y control (Lockwood et al. 2007). La primera etapa, de prevención es considerada la más eficiente en términos de costos. Esta tiene por objetivo evitar la introducción de una nueva especie al territorio, ya sea accidental o intencional. Las evaluaciones de riesgo cumplen un rol fundamental en la prevención, ya que permiten evaluar el potencial invasor de cada especie previa introducción voluntaria. En el caso de las introducciones accidentales, se pueden desarrollar listados que incluyan aquellas especies con mayor riesgo de introducción y potencial invasor, generados a partir de la evaluación de riesgos. Los análisis de riesgo, en ambos casos, deben ser actualizados cada vez que existan nuevos antecedentes que permitan predecir con mayor precisión el riesgo de invasión. Si estos esfuerzos no son suficientes y una especie es introducida al territorio o área de interés (los límites político-administrativos no definen si una especie es introducida) un sistema de detección temprana deberá establecer los protocolos a seguir una vez se detecta especies introducidas fuera del marco regulatorio. Si el análisis de riesgo indica que el potencial invasor de esta especie es alto, las acciones deben tender a la erradicación de la población, es decir, su eliminación por completo (Moore 2005). En el caso de especies ya introducidas a un área de interés para la conservación, deben realizarse análisis de riesgo que permitan priorizar las acciones de control. Aquellas especies que no presenten evidencias de invasión deben ser monitoreadas constantemente, ya que se ha demostrado que en algunos casos pueden pasar largos periodos de tiempo entre la introducción y la invasión de una especie (Crooks 2005, Moore 2005). En el caso de especies ya introducidas y con evidencias claras de invasión, los esfuerzos deben concentrarse en erradicar sus poblaciones o, en el caso de que esto ya no sea posible, contener su presencia a un rango geográfico determinado. Muchas veces, dada la extensión de la invasión, se deben establecer métodos de priorización (Fuentes et al. 2010) para el control, los que ponderan el potencial invasor de una especie combinado con alguna medida de la abundancia de la misma. La interacción entre especie invasora y el ecosistema invadido permite evaluar la invasividad de la especie y la invasibilidad del sitio (figura 18.5). En especies arbóreas, existen algunos atributos que determinan el comportamiento de la especie (e.g. semillación, tolerancia a la sombra, síndrome de dispersión). Como se ha discutido en este capítulo, la mayoría de las especies adecuadas para la forestación industrial poseen algunos de estos atributos. Sin embargo, es posible seleccionar aquellas especies o variedades que permitan reducir la invasividad, incluso considerando herramientas de modificación genética como la esterilidad. Por otro lado, los atributos del sitio invadido se pueden manejar para reducir las oportunidades de invasión. Una silvicultura sustentable debiera considerar la interacción entre ambas variables: invasividad e invasibilidad. 683 Invasiones de plantas en ecosistemas Figura 18.5. Aspectos relevantes del proceso de invasión, incluyendo aquellos factores intrínsecos de la especie invasora que determinan su invasividad y aquellos del ecosistema invadido que determinan su invasibilidad. Para evaluar las medidas de control de invasiones en ecosistemas forestales es necesario tener un marco conceptual que permita considerar los impactos negativos y positivos de la invasión en los distintos componentes ecosistémicos, económicos y sociales. Además, resulta fundamental establecer cual es el objetivo de las medidas de control que pueden ir desde la reducción de la abundancia de una especie, limitación de su dispersión entre otras áreas hasta la erradicación de la especie de una región o paisaje. Un problema aún más complejo se produce cuando se busca controlar una especie invasora, pero no se cuenta con una estrategia adecuada de restauración ecológica. La eliminación de una especie invasora en ningún caso asegura la restauración del ecosistema de referencia o “deseado”. Es más, en algunos casos la eliminación de una especie invasora puede abrir la puerta a la llegada y dominancia de un conjunto de especies invasoras que pueden tener un impacto mayor. Por otro lado, existe creciente debate sobre los posibles servicios ecosistémicos que algunas de estas especies invasoras pueden brindar. Por lo tanto, se requieren aproximaciones integrales adaptadas a las realidades locales tanto ecológicas como sociales. Conclusiones Los bosques son sistemas altamente invadibles, a pesar de su apariencia de alta resistencia. Muchas especies han logrado invadirlos y se predice que muchas más lo hagan en el futuro, especialmente si se producen más introducciones de especies y se aumentan la dispersión de especies y las perturbaciones antrópicas en los paisajes forestales. Estas invasiones pueden ser de especies herbáceas y arbustivas que pueden ocupar el sotobosque y los bordes de bosques naturales, como también de especies arbóreas que remplazan bosques nativos o ecosistemas naturales abiertos. En ambos casos, la magnitud de los impactos sobre la biodiversidad, los servicios ecosistémicos (e.g. provisión de agua), el régimen de incendios y los ciclos de nutrientes, son inciertas, pero la evidencia indica que estos cambios amenazan no solo la sustentabilidad de los bosques, sino también de las comunidades locales que dependen de ellos. 684 Invasiones de plantas en ecosistemas Las especies arbóreas utilizadas en silvicultura industrial pueden ser altamente invasivas. Por ejemplo las Pináceas invaden tanto bosques como ecosistemas no boscosos en los cuales producen cambios radicales dado el cambio en las formas de vidas dominantes y los cambios ecosistémicos asociados. Resulta fundamental para evitar un aumento en las invasiones de ecosistemas forestales desincentivar el cultivo de especies invasoras, para lo cual la legislación y el compromiso del sector público y privado es fundamental. Los bosques están cambiando rápidamente en su composición y función debido a factores antrópicos. Se crean nuevos ecosistemas boscosos y se pierden o transforman radicalmente los ecosistemas boscosos nativos causando impactos impredecibles en ecosistemas de praderas. Es un desafío para el futuro entender la magnitud y direccionalidad de estos cambios, así como las complejas interacciones ecosistémicas que se dan después de los procesos de invasión. Científicos y administradores debemos entender que los bosques ya no son como los describieron los primeros naturalistas y debemos estar preparados para manejar estos ecosistemas cambiantes en una era de globalización y homogenización biológica. AGRADECIMIENTOS Financiado por ICM P05-002, PFB-023 y Fondecyt 1100792. Se agradece el interés y la importante información entregada por los autores de los recuadros de este capítulo. Ana Cóbar y Pablo Bravo por su colaboración en el armado de este capítulo. Se agradece a todas las personas ligadas al Laboratorio de Invasiones Biológicas (LIB) http://www.lib.udec.cl que con su constante trabajo han colaborado en el desarrollo de la investigación que este capítulo recoge. Recuadro 18.1 El castor, un ingeniero de ecosistemas invasor en los bosques subantárticos Christopher B. Anderson, Guillermo Martínez Pastur El castor (Castor canadensis) fue introducido en la isla Grande de Tierra del Fuego en 1946 para promover el establecimiento de especies peleteras de interés comercial, al igual que el visón (Neovison vison) y la rata almizclera (Ondatra zibethica). Estas especies constituyen la mayor perturbación actual de los biomas boscosos australes, y en especial el castor que afecta hasta un 30-40 % de los bosques ribereños desde el centro al sur-oeste del archipiélago (figura 1, Anderson et al. 2009). El castor es un herbívoro generalista que además de plantas herbáceas corta árboles para alimento (hojas y floema) y para construir sus represas. Dentro de las especies de Nothofagus, prefiere al N. pumilio, y evita Drimys winteri y Maytenus magellanica, lo que explica en parte sus patrones de colonización (Wallem et al. 2007). El mayor impacto del castor se asocia a las represas que inundan grandes extensiones de bosque, modificando las condiciones físicas y químicas del hábitat, provocando una mayor diversidad y productividad de especies herbáceas y disminución de especies leñosas. Este impacto facilita la invasión de plantas de ecosistemas adyacentes (e.g., pastizales, turberas, bosques de N. antartica) incluyendo numerosas plantas introducidas. En contraste, en Norte América el castor genera mayor heterogenidad de hábitats y causa la conservación de ciertas especies asociadas a ambientes alterados por el castor (Wright et al. 2002). Figura 1: Los Impactos del castor sobre los ecosistemas dulceacuícolas y ribereños son las alteraciones más grandes al bosque subantártico de Tierra del Fuego durante el Holoceno (Foto: A.E.J. Valenzuela). 685 Invasiones de plantas en ecosistemas Asimismo, el ensamble de vegetación leñosa en Norte América incluye especies no comestibles (e.g., coníferas), adaptadas a sitios inundados (e.g., sauces) o con defensas para evitar la herbivoría (álamos), características que aumentan la resiliencia de este ecosistema al impacto del castor. En comparación, esta diversidad de especies leñosas no está presente en los bosques subantárticos. Los Nothofagus carecen de estrategias ante el impacto del castor, siendo el N. antarctica el menos sensible. Como consecuencia del impacto, la sucesión post-perturbación genera pastizales (meadows) persistentes en el tiempo evitando la recuperación del bosque original (Wallem et al. 2010). En la actualidad, Chile y Argentina promueven un plan de erradicación del castor para restaurar los bosques subantárticos. Sin embargo, la restauración pasiva no es una opción viable, dado las características de la regeneración natural. La restauración ribereña tiene que considerar impactos diferenciales entre inundación y herbivoría. El bosque afectado pero sin inundación se recupera rápidamente bajo una dinámica natural, sin embargo, los sectores inundados deben retroceder a etapas previas de sucesión. Por ejemplo, además de remover el dique del castor, la opción es trasplantar plántulas de N. antárctica que son capaces de sobrevivir en condiciones de meadows. Las plántulas de N. pumilio y N. betuloides podrían establecerse en las partes más secas de los meadows (vegas o praderas húmedas), como el dique o la cola de la laguna. Con el tiempo, el bosque de N. antartica podría facilitar la recolonización de las especies del bosque original. No obstante este posible éxito en la restauración de especies arbóreas, difícilmente se lograría nuevamente una condición de bosque prístino, ya que las especies introducidas se mantienen en el sistema (e.g. Cerastium fontanum, Veronica serpyllifolia, Taraxacum officinale, Rumex acetosella, Trifolium pratense o Bellis perennis). Sin embargo, sí existe la posibilidad de recuperar las funciones ecosistémicas y los servicios ambientales. En conclusión, las similitudes y las diferencias entre el bosque subantártico con los bosques de Norte América nos entregan herramientas claras para definir metas realistas para no sólo el control del castor sino también para la restauración de los bosques subantárticos. Recuadro 18.2 El ciervo y el jabalí en los bosques de Chile y Argentina María Noelia Barrios-Gracia, Martin A. Nuñez Numerosas especies animales se han introducido en los bosques de Sudamérica para la caza deportiva. Entre estas se destacan el ciervo colorado (Cervus elaphus) y el jabalí (Sus scrofa), ambas nativas de Eurasia. Dadas las características de estas especies y su impacto en los bosques templados, son consideradas las más invasivas en Chile y Argentina (Jacksic et al. 2002). El ciervo colorado fue introducido independiente en Chile en 1928 y Argentina en 1904, pero sus poblaciones se expandieron, cruzando el limite en ambos sentidos (Jacksic et al. 2002, Novillo y Ojeda 2008). El ramoneo del ciervo afecta negativamente los bosques nativos (Jacksic 1998, Veblen et al. 1989, 1992), facilitando la invasión de otras especies vegetales (Nuñez et al. 2008, Relva et al. 2010). Estudios en Chile y Argentina han demostrado que el ramoneo selectivo del ciervo altera la composición vegetal de los bosques, disminuyendo la regeneración y el crecimiento de especies nativas como el ciprés (Austrocedrus chilensis) y el maqui (Aristotelia chilensis) (Veblen et al. 1989, 1992, Jacksic et al. 1998, Relva et al. 2010). Así mismo se ha observado que el ramoneo afecta preferentemente a especies vegetales nativas, promoviendo así el establecimiento y crecimiento de especies vegetales introducidas como el pino contorta (Pinus contorta), ponderosa (Pinus ponderosa) y el Oregón (Pseudotsuga menziesii) (Nuñez et al. 2008, Relva et al. 2010). Por otra parte se ha sugerido que el ciervo colorado compite por recursos alimenticios con los ungulados nativos, el huemul (Hippocamelus bisulcus) y el pudu (Pudu pudu) (Povilitis 1981, Dolman y Wäber 2008), ambos en peligro de extinción y poco abundantes. 686 Invasiones de plantas en ecosistemas El jabalí fue introducido en La Pampa, Argentina en 1904 desde donde, luego de escaparse, se expandió hasta cruzar a Chile (Daciuk 1978, Jacksic et al. 2002). A diferencias del ciervo, en los bosques templados no hay ninguna especie nativa con un rol y hábito similar al del jabalí, con lo que su impacto es completamente nuevo para el ambiente. El jabalí escarba extensas áreas de vegetación para alimentarse de raíces, insectos y hongos. Este comportamiento afecta la vegetación nativa y en especial especies con bulbos y rizomas como Gunnera tinctoria (Jacksic et al. 2002, Skewes et al. 2007, Cuevas et al. 2010). También se ha reportado que la depredación de semillas de araucaria (Araucaria araucana) podría comprometer la regeneración de esta especie endémica (Sanguinetti y Kitzberger 2010). Por otra parte, análisis de contenido estomacal en Chile ha demostrado una gran ocurrencia de larvas de coleópteros y aves, así como de hongos (Skewes et al. 2007). Si bien no hay datos específicos para la zona, se sabe que el hábito alimenticio destructivo del jabalí altera la estructura del suelo, afectando así el hábitat de especies animales y procesos ecosistémicos como el ciclo de nutrientes y la descomposición de materia orgánica (Singer et al. 1984). Por último, el disturbio ocasionado por el hábito alimenticio del jabalí facilita la invasión de otras especies introducidas promoviendo el establecimiento y crecimiento de las mismas (Barrios-García y Simberloff in press). El impacto que el ciervo colorado y el jabalí ejercen directamente sobre la flora y fauna nativa de los bosques templados es pronunciado y amenaza la persistencia de los mismos. Poco se sabe del impacto indirecto en los bosques templados y a pesar de estar identificadas como las especies mas invasoras de la región lamentablemente no existen políticas de manejo o control que reduzcan su efecto. Recuadro 18.3 Rol de los privados (Certificación forestal) El rol de los privados en las invasiones biológicas puede analizarse desde dos puntos de vista. En un comienzo, fue la actividad forestal la responsable de la introducción de una serie de especies para evaluar su potencial productivo. En su gran mayoría, estas pertenecen a los géneros Pinus y Eucalyptus (Richardson et al. 1998, Haysom y Murphy 2003). Varias especies de Eucalyptus han sido reportadas como invasoras (Haysom y Murphy 2003, Rejmánek et al. 2005, Becerra 2006), pero la familia Pinaceae sigue presentando la mayor tasa de invasión. Esta familia posee 28 especies registradas como invasoras a nivel mundial (Richardson y Rejmánek 2004) y de estas, 22 corresponden al género Pinus (Richardson y Rejmánek 2011). Dentro de las coníferas introducidas en Chile, figuran algunas de las especies con mayor potencial invasor registradas hasta la fecha en distintas regiones, principalmente del hemisferio sur (Simberloff et al. 2010). Este es el caso de Pseudotsuga menziesii, Pinus contorta, Pinus radiata, Pinus pinaster y Pinus ponderosa (Richardson y Higgins 1998, Ledgard 2009). Por otro lado, actividades del manejo forestal tales como transporte, la construcción de caminos y faenas como la cosecha (Moore 2005), fomentan el avance de especies invasoras, sean estas las cultivadas u otras, como es el caso de Acacia dealbata, A. melanoxylon, Teline monspessulana, Ulex europaeus, entre otras. La presencia de caminos también ha sido reportada como un vector importante de avance de las invasiones de plantas (Lewellyn et al. 2010, Kuhman et al. 2010), ya sea a través de los disturbios generados por su mantención, creando hábitat, o la incorporación de materiales contaminados con semillas que finalmente logran establecerse a lo largo de estos (Mortensen et al. 2009, Gordon et al. 2005, Christen y Matlack 2009). En la actualidad, el proceso de certificación forestal, ha provocado, que las empresas que deseen acogerse a ella, deban preocuparse principalmente del potencial invasor de las especies cultivadas. La certificación Forestal corresponde a un proceso mediante el cual una organización externa, acredita que una empresa del rubro forestal cumple con un estándar nacional. Estos estándares, a través de principios y criterios consideran aspectos económicos, sociales y de medio ambiente (FSC-Chile 2012, CERTFOR 2007). Como parte de esta 687 Invasiones de plantas en ecosistemas certificación la empresa debe asegurar, mediante la entrega de evidencias, que se realizan evaluaciones de riesgo de invasión previa introducción de cualquier especie al territorio nacional, que existe un plan para controlar la invasión de las especies cultivadas y también para aquellas especies registradas en el patrimonio que presenten un gran potencial invasor. De esta manera, las empresas deben implementar planes de control para las principales especies invasoras presentes en su patrimonio, pero también implementar planes de monitoreo de aquellas especies para las cuales no existe información suficiente. BIBLIOGRAFÍA Aizen MA, CL Morales, JM Morales. 2008. Invasive Mutualists Erode Native Pollination Webs. Plos Biology 6: e31. Alexander J, C D’Antonio. 2003. Seed bank dynamics of French broom in coastal California grasslands: Effects of stand age and prescribed burning on control and restoration. Restoration Ecology 11: 185-197. Allison SD, PM Vitousek. 2004. Rapid nutrient cycling in leaf litter from invasive plants in Hawaii. Oecologia 141: 612–619. Anderson CB, CR Griffith, AD Rosemond, R Rozzi, O Dollenz. 2006. The effects of invasive North American beavers on riparian plant communities in Cape Horn, Chile - Do exotic beavers engineer differently in sub-Antarctic ecosystems? Biological Conservation 128: 467-474. Anderson CB, G Martínez Pastur, MV Lencinas, PK Wallem, MC Moorman, AD Rosemond. 2009. Do introduced North American beavers engineer differently in southern South America? – An overview with implications for restoration. Mammal Review 39: 33-52. Barrios-Garcia M.N. and D. Simberloff .2013. Linking the pattern to the mechanism: how an exotic mammal promotes plant invasions?. Austral Ecology 38(8): 884-890. Becerra P. 2006. Invasión de árboles alóctonos en una cuenca pre-andina de Chile central. Gayana Botánica 63(2): 161-174. Brodribb TJ, TS Feild. 2008. Evolutionary significance of a flat-leaved Pinus in Vietnamese rainforest. New Phytologist 178: 201-209. Brooks ML, CM D’antonio, DM Richardson, JB Grace, JE Keeley. 2004. Effects of invasive plants on fire regimes. BioScience 54: 677-688. Bustamante RO, IA Serey, STA Pickett. 2003. Forest fragmentation, Plant regeneration and invasion processes across edges in Central Chile. In Bradshaw GA, PA Marquet eds. How Landscapes Change. Human Disturbance and Ecosystem Fragmentation in the Americas. New York, USA. Springer-Verlag. p. 145-160. Bustamante RO, JA Simonetti. 2005. Is Pinus radiata invading the native vegetation in central Chile? Demographic responses in a fragmented forest. Biological Invasions 7: 243-249. CERTFOR-PEFC. 2007. Manual del auditor. Estándar CERTFOR de manejo forestal sustentable de plantaciones. Santiago, Chile. Cadenasso ML, STA Pickett. 2001. Effect of edge structure on the flux of species into forest interiors. Conservation Biology 15: 91-97. Christen DC, GR Matlack. 2009. The habitat and conduit functions of roads in the spread of three invasive plant species. Biological Invasions 11(2): 453-465 Colautti RI, DM Richardson. 2009. Subjectivity and flexibility in invasion terminology: too much of a good thing? Biological Invasions 11: 1225-1229. Crooks JA. 2005. Lag times and exotic species: The ecology and management of biological invasions in slow-motion. Ecoscience 12: 316-329. Cuevas MF, A Novillo, C Campos, MA Dacar, RA Ojeda. 2010. Food habits and impact of rooting behavior of the invasive wild boar, Sus scrofa, in a protected area of the Monte Desert, Argentina. Journal of Arid Environments 74: 1582-1585. D’Antonio CM, RF Hughes, M Mack, D Hitchcock, P Vitousek. 1998. Response of native species to the removal of non-native grasses in a Hawaiian woodland. Journal of Vegetation Science 9: 699–712. Daciuk J. 1978. Notas faunísticas y bioecológicas de Península Valdés y Patagonia: IV. Estado actual de las especies de mamíferos introducidos en la subregión Araucana (Rep. Argentina) y grado de coacción ejercido en algunos ecosistemas subcordilleranos. Anales de Parques Nacionales 14: 105–130. Davis MA, M Pelsor. 2001. Experimental support for a resource-based mechanistic model of invasibility. Ecology Letters 4: 421-428. Dolman PM, K Wäber. 2008. Ecosystem and competition impacts of introduced deer. Wildlife Research 35: 202–214. Elton CS. 1958. The ecology of invasions by animals and plants. London, United Kingdom. Methuen and Company. 181 p. Ehrenfeld JG, P Kourtev, WZ Huang. 2001. Changes in soil functions following invasions of exotic understory plants in deciduous forests. Ecological Applications 11: 1287–1300. Essl F, N Milasowszky, T Dirnbock. 2011. Plant invasions in temperate forests: Resistance or ephemeral phenomenon? Basic and Applied Ecology 12: 1-9. Figueroa JA, SA Castro, PA Marquet, FM Jaksic. 2004. Exotic plant invasions to the mediterranean region of Chile: causes, history and impacts. Revista Chilena de Historia Natural 77:465-483. Forest Stewardship Council (FSC) Chile. 2012. Estándar para la certificación FSC de plantaciones forestales de operación de pequeña y gran escala. Santiago, Chile. FSC. 688 Invasiones de plantas en ecosistemas Fuentes N, A Pauchard, P Sánchez, J Esquivel, A Marticorena. 2012. A new comprehensive database of alien plant species in Chile based on herbarium records. Biological Invasions. DOI 10.1007/s10530-012-0334-6. Fuentes-Ramírez A, A Pauchard, LA Cavieres, RA García. 2011. Survival and growth of Acacia dealbata vs. native trees across an invasion front in south-central Chile. Forest Ecology and Management 261: 1003-1009. Fuentes-Ramírez A, A Pauchard, A Marticorena, P Sánchez. 2010. Relationship between the invasion of Acacia dealbata Link (Fabaceae: Mimosoideae) and plant species richness in South-Central Chile. Gayana Botanica 67: 188-197. Gilbert B, MJ Lechowicz MJ. 2005. Invasibility and abiotic gradients: The positive correlation between native and exotic plant diversity. Ecology 86: 1848-1855. García RA, A Fuentes-Ramírez, A Pauchard. 2012. Effects of two nitrogen-fixing invasive species on soil chemical properties in south-central Chile. Gayana Botánica 69 (1): 106-109. García RA, A Pauchard, E Peña. 2007. Invasión de Teline monspessulana (L.) K. Koch después de un incendio forestal: Banco de semillas, regeneración y crecimiento. Gayana Botanica 64: 200-209. García RA, A Pauchard, LA Cavieres, E Peña, MF Rodriguez. 2010. El fuego favorece la invasión de Teline monspessulana (Fabaceae) al aumentar su germinación. Revista Chilena de Historia Natural 83: 443-452. Godoy O, A Saldana, N Fuentes, F Valladares, E Gianoli. 2011. Forests are not immune to plant invasions: phenotypic plasticity and local adaptation allow Prunella vulgaris to colonize a temperate evergreen rainforest. Biological Invasions 13: 1615-1625. Gómez P, RO Bustamante, J San Martín, S Hahn. 2011. Estructura poblacional de Pinus radiata D. Don en fragmentos de bosque maulino en Chile central. Gayana Botánica 68: 93-97. González ME, A Lara, R Urrutia, J Bosnich. 2011. Climatic change and its potential impact on forest fire occurrence in southcentral Chile (33 degrees-42 degrees S). Bosque 32: 215-219. Gordon DR, CH Greenberg, SH Crownover, OL Slapcinsky. 2005. Effects of unpaved road soils on persistence of three nonnative grass species. Natural Areas Journal 25: 257–262. Gorgens A, B van Wilgen. 2004. Invasive alien plants and water resources in South Africa: current understanding, predictive ability and research challenges. South African Journal of Science 100: 27-33. Haysom KA, ST Murphy. 2003. The status of invasiveness of forest tree species outside their natural habitat: a global review and discussion paper. Forest Health and Biosecurity Working Papers. FAO, Forestry Department. Hobbs RJ, S Arico, J Aronson, JS Baron, P Bridgewater, VA Cramer,PR Epstein, JJ Ewel, CA Klink, AE Lugo, D Norton, D Ojima, DM Richardson, EW Sanderson, F Valladares, M Vilá, R Zamora, M Zobel. 2006. Novel ecosystems: theoretical and management aspects of the new ecological world order. Global Ecology and Biogeography 15: 1-7. Holmes PM, DM Richardson, BW Van Wilgen, C Gelderblom. 2000. Recovery of South African fynbos vegetation following alien woody plant clearing and fire: implications for restoration. Austral Ecology 25: 631–639. Inderjit, J Weiner. 2001. Plant allelochemical interference or soil chemical ecology? Perspectives in Plant Ecology, Evolution and Systematics 4: 4-12. Jaksic FM. 1998. Vertebrate invaders and their ecological impacts in Chile. Biodiversity and Conservation 7: 1427-1445. Jaksic FM, JA Iriarte, JE Jiménez, DR Martínez. 2002. Invaders Without Frontiers: Cross-border Invasions of Exotic Mammals. Biological Invasions 4: 157-173. Johnson NC, DA Wedin. 1997. Soil carbon, nutrients, and mycorrhizae during conversion of dry tropical forest to grassland. Ecological Applications 7: 171–182. Knops JMH, KL Bradley, DA Wedin. 2002. Mechanisms of plant species impacts on ecosystem nitrogen cycling. Ecology Letters 5: 454–466. Kuhman TR, SM Pearson, M Turner. 2010. Effects of land-use history and the contemporary landscape on non-native plant invasion at local and regional scales in the forest-dominated southern Appalachians. Landscape Ecology 25(9): 1433-1445. Lamarque LJ, S Delzon, CJ Lortie. 2011. Tree invasions: a comparative test of the dominant hypotheses and functional traits. Biological Invasions 13: 1969-1989. Langdon B, A Pauchard, M Aguayo. 2010. Pinus contorta invasion in the Chilean Patagonia: local patterns in a global context. Biological Invasions 12: 3961-3971. Langdon B. 2011. Invasión de Pinus controta en la Patagonia: patrones y mecanismos tras el proceso. Tesis de Doctorado en Ciencias Forestales. Concepción, Chile. Facultad de Ciencias Forestales, Universidad de Concepción. 89 p. Ledgard N. 2001. The spread of lodgepole pine (Pinus contorta Dougl.) in New Zealand. Forest Ecology and Management 141: 43-57. Ledgard N. 2009. Wilding Control: Guidelines for the control of Wilding Conifers. Christchurch, New Zealand.. Forest Research Institute. 53 p. Le Maitre DC, M Gaertner, E Marchante, EJ Ens, PM Holmes, A Pauchard, PJ O’Farrell, AM Rogers, R Blanchard, J Blignaut, DM Richardson. 2011. Impacts of invasive Australian acacias: implications for management and restoration. Diversity and Distributions 17: 1015-1029. Levine JM, PB Adler, SG Yelenik. 2004. A meta-analysis of biotic resistance to exotic plant invasions. Ecology Letters 7: 975-989. Liao CZ, RH Peng, YQ Luo, XH Zhou, XW Wu, CM Fang, JK Chen, B Li. 2008. Altered ecosystem carbon and nitrogen cycles by plant invasion: a meta-analysis. New Phytologist 177: 706-714. Little C, A Lara, J McPhee, R Urrutia. 2009. Revealing the impact of forest exotic plantations on water yield in large scale watersheds in South-Central Chile. Journal of Hydrology 374: 162-170. Lewellyn F, V Jarošyk, P Pyšek, DM Richardson, M Rouget. 2010. Protected Area Boundaries as Filters of plant Invasions. Conservation Biology 25(2): 400-405. Lockwood JL, MF Hoopes, MP Marchetti. 2007. Invasion Ecology. Massachusetts, USA. Blackwell Publishing. 304 p. 689 Invasiones de plantas en ecosistemas Luo YQ, DF Hui, DQ Zhang. 2006. Elevated CO2 stimulates net accumulations of carbon and nitrogen in land ecosystems: a meta-analysis. Ecology 87: 53–63. MacDougall AS, R Turkington. 2005. Are invasive species the drivers or passengers of change in degraded ecosystems? Ecology 86: 42-55. Mack RN, D Simberloff, WM Lonsdale, H Evans, M Clout, FA Bazzaz. 2000. Biotic invasions: Causes, epidemiology, global consequences, and control. Ecological Applications 10: 689-710. Mandle L, JL Bufford, IB Schmidt, CC Daehler. 2011. Woody exotic plant invasions and fire: reciprocal impacts and consequences for native ecosystems. Biological Invasions 13: 1815-1827. Molina-Montenegro MA, EI Badano,LA Cavieres. 2008. Positive interactions among plant species for pollinator service: assessing the ‘magnet species’ concept with invasive species. Oikos 117: 1833-1839. Moore BA. 2005. Alien Invasive Species: Impacts on Forests and Forestry: A Review. Forest Health and Biosecurity Working Papers. Rome, Italy. FAO, Forestry Department. 36 p. Morales CL. 2007. Introducción de abejorros (Bombus) no nativos: causas, consecuencias ecológicas y perspectivas. Ecologia Austral 17: 51-65. Mortensen DA, ESJ Rauschert, AN Nord, BP Jones. 2009. Forest Roads Facilitate the Spread of Invasive Plants. Invasive Plant Science and Management 2: 191–199. Novillo A, RA Ojeda. 2008. The exotic mammals of Argentina. Biological Invasions 10: 1333-1344. Nuñez MA, TR Horton, D Simberloff. 2009. Lack of belowground mutualisms hinders Pinaceae invasions. Ecology 90: 2352-2359. Nuñez MA, MA Relva, D Simberloff. 2008a. Enemy release or invasional meltdown? Deer preference for exotic and native trees on Isla Victoria, Argentina. Austral Ecology 33: 317-323. Nuñez MA, D Simberloff, MA Relva. 2008b. Seed predation as a barrier to alien conifer invasions. Biological invasions 10: 1389-1398. Parker IM, D Simberloff, WM Lonsdale, K Goodell, M Wonham, PM Kareiva, MH Williamson, B Von Holle, PB Moyle, JE Byers, L Goldwasser. 1999. Impact: toward a framework for understanding the ecological effects of invaders. Biological Invasions 1: 3-19. Pauchard A, PB Alaback. 2004. Influence of elevation, land use, and landscape context on patterns of alien plant invasions along roadsides in protected areas of south-central Chile. Conservation Biology 18: 238-248. Pauchard A, K Shea. 2006. Integrating the study of non-native plant invasions across spatial scales. Biological Invasions 8: 399-413. Pauchard A, B Langdon, E Peña. 2008. Potencial invasivo de Pseudotsuga menziesii (Mirb.) Franco en bosques nativos del Centro-Sur de Chile: patrones y recomendaciones. In Mujica R, H Grosse, B Müller-Using eds. Bosques Seminaturales: una opción para la rehabilitación de bosques nativos degradados. Santiago, Chile. Impresores y Editores Austral S.A. p. 89-96. Pauchard A, RA García, E Peña, C González, LA Cavieres, R Bustamante. 2008. Positive feedbacks between plant invasions and fire regimes: Teline monspessulana (L.) K.Koch (Fabaceae) in central Chile. Biological Invasions 10: 547-553. Pauchard A, C Kueffer, H Dietz, CC Daehler, J Alexander, PJ Edwards, JR Arevalo, LA Cavieres, A Guisan, S Haider, G Jakobs, K McDougall, CI Millar, BJ Naylor, CG Parks, LJ Rew, T Seipel. 2009. Ain’t no mountain high enough: plant invasions reaching new elevations. Frontiers in Ecology and the Environment 7: 479-486. Pauchard A, RA García, B Langdon, N Fuentes. 2011. The Invasion of Non-Native Plants in Chile and their Impacts on Biodiversity: History, Current Status, and Challenges for Management. In Figueroa E ed. Biodiversity Conservation in the Americas: Lessons and Policy Recommendations. Santiago, Chile. Editorial FEN-Universidad de Chile. p 133-165. Pejchar L, H Mooney. 2009. Invasive species, ecosystem services and human well-being. Trends in Ecology & Evolution 24: 497-504. Peña E, M Hidalgo, B Langdon, A Pauchard. 2008. Patterns of spread of Pinus contorta Dougl. ex Loud. invasion in a Natural Reserve in southern South America. Forest Ecology and Management 256: 1049-1054. Peña E, A Pauchard. 2001. Coníferas introducidas en unidades del SNASPE: un riesgo para la biodiversidad. Bosque Nativo 30: 3-7. Peña E, B Langdon, 2007. Árboles exóticos naturalizados en el bosque nativo chileno. Bosque Nativo 40: 3-7. Povilitis A. 1981. The huemul: an endangered species in Chile. Oryx 12: 215–219. Quiroz C, A Pauchard, LA Cavieres, CB Anderson. 2009. Análisis cuantitativo de la investigación en invasiones biológicas en Chile: tendencias y desafíos. Revista Chilena de Historia Natural 82: 497-505. Quiroz C, A Pauchard, A Marticorena, LA Cavieres. 2009 Manual de Plantas Invasoras del Centro-Sur de Chile. Concepción, Chile. Laboratorio de Invasiones Biológicas. 45 p. Reichard SH, CW Hamilton. 1997. Predicting invasions of woody plants introduced into North America. Conservation Biology 11: 193-203. Rejmanek M, DM Richardson. 1996. What attributes make some plant species more invasive? Ecology 77: 1655-1661. Rascher KG, A Grosse-Stoltenberg, C. Maguas, JAA Meira-Neto, C Werner. 2011. Acacia longifolia invasion impacts vegetation structure and regeneration dynamics in open dunes and pine forests. Biological Invasions 13: 1099-1113. Relva MA, MA Nuñez, D Simberloff. 2010. Introduced deer affect native plant communities and facilitate non-native tree species in a temperate forests in Patagonia, Argentina. Biological invasions 12: 303-311. Richardson D, R Blanchard. 2011. Learning from our mistakes: minimizing problems with invasive biofuel plants. Current Opinion in Environmental Sustainability 3: 36-42. Richardson D, S Higgins. 1998. Pines as invaders in the southern hemisphere. In Richardson DM ed. Ecology and biogeography of Pinus. Cambridge, United Kingdom. Cambridge University Press. p. 450-473. Richardson DM, M Rejmánek. 2004. Conifers as invasive aliens: a global survey and predictive framework. Diversity and Distributions 10: 321-331. 690 Invasiones de plantas en ecosistemas Richardson DM, M Rejmánek. 2011. Trees and shrubs as invasive alien species-a global review. Diversity and Distributions 17: 788- 809. Rodriguez-Cabal MA, MA Nuñez, AS Martínez. 2008. Quantity versus quality: endemism and protected areas in the temperate forest of South America. Austral Ecology 33: 730-736. Ruesink JL, IM Parker, MJ Groom, PM Kareiva. 1995. Reducing the risks of nonindigenous species introductions: guilty until proven innocent. Bioscience 45: 465–477. Sala OE, FS Chapin, JJ Armesto, E Berlow, J Bloomfield, R Dirzo, E Huber-Sanwald, LF Huenneke, RB Jackson, A Kinzig, R Leemans, DM Lodge, HA Mooney, M Oesterheld, NL Poff, MT Sykes, BH Walker, M Walker, DH Wall. 2000. Biodiversity - Global biodiversity scenarios for the year 2100. Science 287: 1770-1774. Sanguinetti J, T Kitzberger. 2010. Factors controlling seed predation by rodents and non-native Sus scrofa in Araucaria araucana forests: potential effects on seedling establishment. Biological Invasions 12: 689-706. Sarasola M, V Rusch, T Schlichter, C Ghersa. 2006. Invasión de coníferas forestales en áreas de estepa y bosques de ciprés de la cordillera en la región Andino Patagónica. Austral Ecology 16: 143-156. Sher AA, DL Marshall, JP Taylor. 2002. Establishment patterns of native Populus and Salix in the presence of invasive nonnative Tamarix. Ecological Applications 12: 760-772. Simberloff D. 2006. Invasional meltdown 6 years later: important phenomenon, unfortunate metaphor, or both? Ecology Letters 9: 912-919. Simberloff D. 2000. Nonindigenous species: a global threat to biodiversity and stability. In Raven P, T Williams eds. Nature and Human Society: the Quest for a Sustainable World. Washington, D.C., USA. National Academy Press. p. 325–334. Simberloff D, Nuñez MA, NJ Ledgard, A Pauchard, DM Richardson, M Sarasola, BW Van Wilgen, SM Zalba, RD Zenni, R Bustamante, E Peña, SR Ziller. 2010. Spread and impact of introduced conifers in South America: Lessons from other southern hemisphere regions. Austral Ecology 35: 489-504. Simberloff D, MA Relva, M Nuñez. 2002. Gringos en el bosque: introduced tree invasión in a native Nothofagus/Austrocedrus forest. Biological Invasions 4: 35-53. Singer FJ, WT Swank, EEC Clebsch. 1984. Effects of wild pig rooting in a deciduous forest. Journal of Wildlife Management 48: 464-473. Skewes O, R Rodriguez, FM Jaksic. 2007. Trophic ecology of the wild boar (Sus scrofa) in Chile. Revista Chilena de Historia Natural 80: 295-307. Svejcar T, R Sheley. 2001. Nitrogen dynamics in perennial and annual dominated arid rangeland. Journal of Arid Environments 47: 33–46. Teillier S, R Rodríguez, MT Serra. 2003. Lista preliminar de plantas leñosas, alóctonas, asilvestradas en Chile Continental. Chloris Chilensis 6(2). Traveset A, DM Richardson. 2006. Biological invasions as disruptors of plant reproductive mutualisms. Trends in Ecology & Evolution 21: 208-216. Turpie J, C Marais, J Blignaut. 2008. The working for water programme: Evolution of a payments for ecosystem services mechanism that addresses both poverty and ecosystem service delivery in South Africa. Ecological Economics 65: 788-798. Urrutia J. 2011. Impactos de la invasión de Pinus contorta sobre la riqueza y abundancia de plantas nativas en la Reserva Nacional Malalcahuello, Región de La Araucanía, Chile. Tesis de Magister en Botánica. Concepción, Chile. Facultad de Ciencias Naturales y Oceanográficas, Universidad de Concepción. 55 p. Veblen TT, M Mermoz, C Martin, T Kitzberger. 1992. Ecological impacts of introduced animals in Nahuel Huapi National Park, Argentina. Conservation Biology 6: 71-83. Veblen TT, M Mermoz, C Martin, E Ramilo. 1989. Effects of exotic deer on forest regeneration and composition in Northern Patagonia. Journal of Applied Ecology 26: 711-724 Vilá M, JL Espinar, M Hejda, PE Hulme, V Jarosik, JL Maron, J Pergl, U Schaffner, Y Sun, P Pysek. 2011. Ecological impacts of invasive alien plants: a meta-analysis of their effects on species, communities and ecosystems. Ecology Letters 14: 702-708. Vitousek PM, LR Walker. 1989. Biological invasion by Myrica faya in Hawai’i: plant demography, nitrogen fixation, and ecosystem effects. Ecological Monographs 59: 247–265. Von Holle B, HR Delcourt, D Simberloff. 2003. The importance of biological inertia in plant community resistance to invasion. Journal of Vegetation Science 14: 425-432. Wallem PK, Jones CG, Marquet PA, FM Jaksic. 2007. Identificación de los mecanismo subyacentes a la invasión de Castor canadensis (Kuhl 1820, Rodentia) en el archipiélago de Tierra del Fuego, Chile. Revista Chilena de Historia Natural 80: 309-325. Wallem PK, CB Anderson, G Martínez Pastur, MV Lencinas. 2010. Community re-assembly by an exotic herbivore, Castor canadensis, in subantarctic forests, Chile and Argentina. Biological Invasions 12: 325-335. Wardle DA, RD Bardgett, RM Callaway, WH Van der Putten. 2011. Terrestrial Ecosystem Responses to Species Gains and Losses. Science 332: 1273-1277. Wilsey BJ, HW Polley. 2006. Aboveground productivity and root-shoot allocation differ between native and introduced grass species. Oecologia 150: 300–309. Windham L, JG Ehrenfeld. 2003. Net impact of a plant invasion on nitrogen-cycling processes within a brackish tidal marsh. Ecological Applications 13: 883–896. Wright JP, CG Jones, AS Flecker. 2002. An ecosystem engineer, the beaver, increases species richness at the landscape scale. Oecologia 132: 96-101. Zalba SM, YA Cuevas R Boó .2008. Aleppo pine invasión after a wildfire in an Argentinian grassland nature reserve. Journal of Environmental Management 88: 539–46. 691