Espectros de emisión y absorción. Los espectros de emisión y
Anuncio
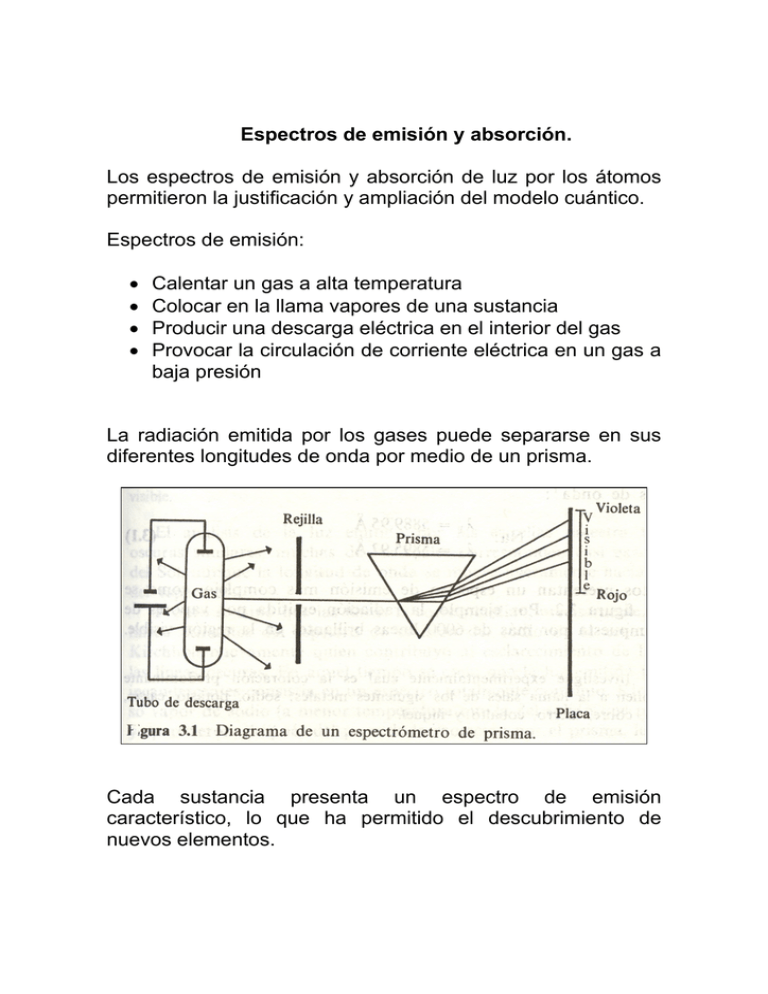
Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: • • • • Calentar un gas a alta temperatura Colocar en la llama vapores de una sustancia Producir una descarga eléctrica en el interior del gas Provocar la circulación de corriente eléctrica en un gas a baja presión La radiación emitida por los gases puede separarse en sus diferentes longitudes de onda por medio de un prisma. Cada sustancia presenta un espectro de emisión característico, lo que ha permitido el descubrimiento de nuevos elementos. Espectro de absorción Wollaston en 1802 encontró siete líneas obscuras espaciadas irregularmente. Doce años después Fraunhofer encontró varios cientos de líneas oscuras. Espectro de emisión del sodio Espectro de absorción del sodio La fórmula de Balmer En 1885, Johann Jacob Balmer encontró una relación numérica entre las líneas espectroscópicas. Estas coincidían con los resultados experimentales reportados por Anders Jonas Ångstrom. ⎛ n2 ⎞ λ = b⎜⎜ 2 2 ⎟⎟ ⎝n −2 ⎠ Donde b=3645.6Å, para n= 3, 4, 5 y 6. Problema: Las líneas de emisión medidas por Ångstrom fueron: Nombre de Hα la línea λ (Å) 6562.10 Color Rojo Hβ Hγ Hδ 4860.74 Verde 4340.1 Azul 4102.2 Violeta Determina las previstas por la relación de Balmer así como el porcentaje de error (⏐λ-λexp⏐/λexp)100 En 1890, Johannes Robert Rydberg encontró dos generalizaciones fundamentales en los espectros de otros elementos. Empleó números de onda: ν = 1 λ 4⎛ 1 1 ⎞ − 2⎟ 2 b⎝2 n ⎠ ⎛1 1⎞ ν = RH ⎜ 2 − 2 ⎟ ⎝2 n ⎠ ν= ⎜ RH=109677.581cm-1 Finalmente la ecuación correcta es: ⎛1 1⎞ ν = RH ⎜⎜ 2 − 2 ⎟⎟ ⎝ n2 n1 ⎠ n1>n2 esta ecuación surge de aplicar la ecuación de Balmer Con esta ecuación se reproducen las líneas de emisión del Hidrógeno. De modelos a modelos, el modelo del átomo. Con el descubrimiento del núcleo atómico realizado por Rutherford, se empezó a utilizar éste como base de un modelo clásico del átomo. Se consideraba la fuerza de atracción entre el núcleo y electrón (para el átomo más sencillo) como la de Coulomb. La representación era de un electrón atraído hacia una masa mucho mayor que él. A este modelo se le denominó como planetario. Dado que el núcleo se encuentra en reposo y el electrón se encuentra girando alrededor de él, la energía total sería: 1 Ec = mv2 2 V =κ qq ' r Ze2 V = −κ r 1 2 Ze2 E = Ec + V = mv − κ 2 r Considerar que la fuerza eléctrica es igual a Fe=m a V κZe2 E= =− 2 2r La frecuencia, f, con la que gira el electrón dependerá del radio de la orbita, r: 1 ⎛ κZe 2 ⎞ ⎜⎜ ⎟ f = 3 ⎟ 2π ⎝ mr ⎠ 1/ 2 Determinar las frecuencias y la energía para un átomo de hidrógeno si r=1Å y r=2Å. Determinar la velocidad del electrón. Consideración clásica: Como resultado de la emisión de radiación ultravioleta, la energía del electrón se reduciría, lo que haría girar al electrón más cerca del núcleo y a mayor velocidad. El átomo irradiaría continuamente. Al acercarse más al núcleo, su energía decrecería más y la radiación sería de mayor frecuencia. De acuerdo con los resultados obtenidos, la trayectoria del orbital sería una espiral y disiparía cada vez más energía radiante de forma continua. El modelo atómico de BOHR En 1913, Niels Bohr desarrolló un modelo atómico abandonando las consideraciones de la electrodinámica clásica y tomando en cuenta la cuantización de la energía en la interacción radiación-materia. La propuesta de Bohr fue ponerle restricciones al modelo planetario: 1. No se aplica el resultado clásico de que una carga acelerada emite radiación continuamente. 2. El proceso de absorción y emisión de un átomo sólo puede realizarse discontinuamente. 3. la cantidad de energía radiada en una emisión fundamental debe ser igual a nhν 4. Cuando el átomo no absorba o emita radiación significa que se encuentra en estado estacionario con una energía constante. 5. La energía radiante tiene una sola frecuencia, la cual es la mitad de la frecuencia a la que orbita el electrón en un estado final (suponiendo que el electrón se acerca al núcleo desde el infinito) 6. el núcleo es infinitamente más grande que el electrón. − 2π 2κ 2 Z 2 e 4 m E= n2h2 n= 1, 2, 3,… Determinar la energía considerando n= 1, 2, 3 para el átomo de hidrógeno A partir de estos resultados, Bohr propone órbitas estacionarias, donde el valor de r para la primera órbita es conocido como a0 o radio de Bohr. o h2 −11 a0 = 2 2 = 5.292x10 m = 52.92pm= 0.5292A 4π κe m Así pues la expresión para la energía total puede expresarse como: ⎛ 4π 2κe 2 m ⎞⎛ κZ 2 e 2 ⎟⎟⎜⎜ E n = −⎜⎜ 2 2 h ⎠⎝ 2n ⎝ En = − Determinar la energía considerando n= 1, 2, 3 ⎞ ⎟⎟ ⎠ κZ 2 e 2 ⎛ 1 ⎞ ⎜ ⎟ 2a 0 ⎝ n 2 ⎠ para el átomo de hidrógeno Para obtener la energía radiada cuando el átomo pasa de un estado estacionario a otro propuso la siguiente relación: 2πκ 2mZ 2e4 ⎛ 1 1 ⎞ ⎜⎜ 2 − 2 ⎟⎟ En = En 2 − En1 = − 2 h ⎝ n1 n2 ⎠ Er= -∆E Considerando que la radiación es monocromática, tenemos: 2πκ 2mZ 2e4 ⎛ 1 1 ⎞ ⎜⎜ 2 − 2 ⎟⎟ ν =− 3 ch ⎝ n2 n1 ⎠ Esta es igual a la propuesta por Rydberg para las líneas espectrales del hidrógeno. ⎛1 1⎞ ν = − R∞ Z ⎜⎜ 2 − 2 ⎟⎟ ⎝ n2 n1 ⎠ 2 Donde R∞ es la constante de Rydberg. Para determinar las transiciones entre las líneas espectrales: En = E1 + hνnc La teoría de Bohr justificaba la presencia de un menor número de líneas. En su estado más estable, el átomo puede absorber energía para excitarse. El estado inicial es n=1 y el final tendría una n de 2 en adelante. Al estado atómico con menor energía se le denomina estado basal o fundamental. A cualquier otro se le denomina estado excitado. Los postulados de Bohr 1. Los átomos monoelectrónicos (H, He+, Li2+, Be3+,…) están constituidos por un núcleo, de carga Ze, con una masa M que es A veces mayor a la del electrón, el cual gira alrededor del núcleo en una órbita circular de radio r. MH= 1836.1me 2. La cantidad de movimiento angular, L, del átomo está cuantizada. De los infinitos movimientos orbitales existentes de acuerdo al primer postulado, sólo son posibles aquello para los cuales el momento angular sea múltiplo entero de h =h 2π Es decir L=n h 3. las órbitas determinadas por el segundo postulado son estacionarias, es decir, el átomo no radía cuando se encuentra en una de ellas. Sólo cuando el átomo cambia de un estado (1) con mayor energía a otro (2) con menor energía, se emite radiación monocromática cuya frecuencia viene dada por En1 − En2 ν= h ⎡ 1 1 ⎤ ν = RH ⎢ 2 − 2 ⎥ n1 ⎦ ⎣ n2 Las orbitas elípticas de Sommerfield Las órbitas elípticas tienen energía negativa. Pero es necesario considerar la distancia al núcleo, r, y al ángulo, φ n 1 2 3 k 1 2 1 3 2 1 nr 0 0 1 0 1 2 b/a=k/n 1 1 ½ 1 2/3 1/3 Penetrabilidad: Una orbita elíptica es más penetrante conforme más cerca del núcleo puede pasar el electrón. A mayor excentricidad de la elipse, menor valor de k, orbitas más penetrantes. Localizabilidad: Una orbita elíptica está más localizada conforme menos varía la distancia al núcleo cuando el electrón gira. Las orbitas menos excéntricas (k=n) son las más localizadas. Si se considera el caso tridimensional, aparece un tercer número cuántico. El número cuántico magnético, m.



