Tratamiento paliativo del dolor óseo metastásico
Anuncio

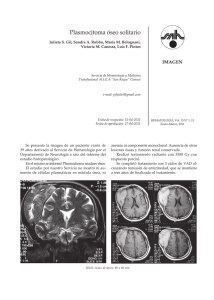
Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. formación continuada Tratamiento paliativo del dolor óseo metastásico F. PONS, D. FUSTER, S. VIDAL-SICART Servicio de Medicina Nuclear. Hospital Clínic. Barcelona. TRATAMIENTO DEL DOLOR ÓSEO METASTÁSICO PALLIATIVE TREATMENT OF METASTASIC BONE PAIN INTRODUCCIÓN Las metástasis óseas son una complicación frecuente en los pacientes oncológicos. Las neoplasias que con mayor frecuencia se asocian a este tipo de metástasis son el cáncer de próstata, mama y pulmón, aunque también hay que destacar el cáncer de tiroides, cáncer de riñón, los tumores gastrointestinales y el linfoma. El dolor óseo es el síntoma predominante en la mayoría de los pacientes con metástasis óseas, lo que empeora su calidad de vida y tiene efectos negativos tanto físicos como psicológicos. Además, este tipo de dolor es el que requiere, con más frecuencia, tratamiento en los pacientes oncológicos, cuyos síntomas van progresando gradualmente. Aunque el dolor suele estar ocasionado por infiltración tumoral y expansión del periostio, no se conoce con exactitud la etiología exacta del dolor ocasionado por las metástasis óseas. Se sabe que intervienen diferentes mecanismos y que en las metástasis de pequeño tamaño influiría especialmente la estimulación de los nociceptores por citoquinas, mientras que en las lesiones de mayor tamaño sería por afectación directa y compresión de estructuras como el periostio, nervios, vasos y estructuras articulares1. Recibido: 04-10-02. Aceptado: 13-12-02. Correspondencia: F. PONS Servicio de Medicina Nuclear Hospital Clínic Villarroel, 170 08036 Barcelona E-mail: [email protected] 77 El dolor óseo secundario a crecimiento tumoral metastásico es el dolor más difícil de tratar en los pacientes oncológicos2. El objetivo del tratamiento es la paliación del dolor, con el fin de mejorar en lo posible la calidad de vida para el paciente. Cuando las metástasis son de localización única, la radioterapia local externa tiene un importante efecto paliativo en más del 70 % de los pacientes y es habitualmente el tratamiento de elección. Sin embargo, la mayoría de los pacientes con metástasis óseas presentan lesiones en múltiples localizaciones. En estos casos, la radioterapia externa de amplio campo es un tratamiento eficaz cuando el dolor es difuso, pero su utilización se ve limitada por su elevada toxicidad3. El tratamiento habitualmente es multidisciplinario e incluye, de forma aislada, combinada o secuencial, la utilización de fármacos analgésicos, quimioterapia, hormonoterapia y radioterapia externa. A medida que la enfermedad progresa, la eficacia de estos tratamientos se va reduciendo y muchos pacientes van a precisar dosis crecientes de analgésicos opiáceos, que presentan diversos efectos secundarios. Un método alternativo para el tratamiento paliativo del dolor óseo metastásico consiste en la administración sistémica de radiofármacos que se concentran en las metástasis óseas4, produciendo así una irradiación más selectiva de las lesiones con una reducción en los efectos secundarios. Punto clave 1 El tratamiento del dolor óseo metastásico es multidisciplinario e incluye diferentes opciones terapéuticas, utilizadas de forma aislada, combinada o secuencial. RADIOFÁRMACOS El uso de radionúclidos para el tratamiento de las metástasis óseas no es nuevo y ya se aplicó a mediados del siglo pasado. El fósforo radioactivo fue el primero Rev. Esp. Med. Nuclear, 2003;22(6):429-38 429 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico Tabla 1 CARACTERÍSTICAS FÍSICAS DE LOS PRINCIPALES RADIOFÁRMACOS PARA EL TRATAMIENTO DEL DOLOR ÓSEO METASTÁSICO Período de semidesintegración (días) Energía  máxima (MeV) P 14,3 1,71 – Sr 50,5 1,49 – Radionúclido 32 89 Energía ␥ (keV) Sm 001,93 0,81 103 Re 03,7 1,07 137 14 0 Ninguna, emite electrones de conversión 159 153 186 Sn 117m en utilizarse para la terapia de las metástasis osteoblásticas5,6. La aparición, en el primer número que se editó de la revista Journal of Nuclear Medicine, de un artículo sobre la utilización del 32P en el tratamiento paliativo del dolor óseo, pone de relieve las expectativas de la Medicina Nuclear en este tema7. En los últimos años, el tratamiento sistémico con radionúclidos ha vuelto a resurgir como una opción terapéutica de utilidad en la paliación del dolor óseo metastásico, puesto que ofrece una acción terapéutica sin los efectos secundarios de los opiáceos. Los principales radiofármacos utilizados han sido el cloruro de Estroncio-89 (89Sr), el Samario-153 EDTMP (153Sm), el Renio-186 HEDP (186Re) y el Estaño117m (117mSn). En España, el 89Sr fue comercializado hace más de una década (MetastronR) para el tratamiento del dolor ocasionado por metástasis óseas de cáncer de próstata. Más recientemente se comercializó el 153Sm (QuadrametR), que está registrado para el tratamiento del dolor óseo en pacientes con metástasis osteoblásticas por cualquier tipo de neoplasia. Los demás radiofármacos no están comercializados. En la tabla 1 se resumen las características físicas de estos radionúclidos. Estroncio-89 El 89Sr es un emisor beta puro con una energía máxima de 1,49 MeV, una energía media de 0,58 MeV y un rango medio de penetración en tejidos blandos de 2,4 mm. Su período de semidesintegración es de 50,5 días. Químicamente es similar al calcio y, después de ser administrado por vía sistémica, sigue el mismo comportamiento farmacocinético y se incorpora en la matriz mineral del hueso en una proporción similar al grado de actividad osteoblástica8. La captación y retención de 89Sr en las metástasis óseas osteoblásticas es de 10 a 15 veces superior a la del hueso normal. 430 Aproximadamente, de un 60 % a un 70 % queda retenido en el compartimento óseo y el resto se elimina a través de la orina. La excreción es máxima en los dos primeros días después de su administración. La vida media biológica del 89Sr en el hueso normal es aproximadamente de 14 días, mientras que en las metástasis es mucho más larga y superior a los 50 días9. Diversos estudios han valorado la eficacia del tratamiento con 89Sr, siendo el radionúclido con el que se tiene más experiencia clínica10-16. Samario-153 El 153Sm es emisor de radiación beta y gamma. Las energías máximas medias de las diferentes partículas beta son 0.808 MeV (18 %), 0,705 MeV (50 %) y 0,635 MeV (32 %), con un rango medio de penetración en tejidos blandos de 0,6 mm. La radiación gamma tiene una energía de 0,103 MeV (30 %). El período de semidesintegración del 153Sm es de 46,3 horas. La emisión de radiación gamma permite la obtención de imágenes gammagráficas y, por lo tanto, la visualización de la distribución de la dosis terapéutica (fig. 1). El compuesto de 153Sm-EDTMP es un análogo del pirofosfato y se localiza en el tejido óseo con una afinidad y distribución similar a los compuestos utilizados para la gammagrafía ósea. Como ocurre con otros fosfatos, se concentra principalmente en áreas con aumento de la actividad osteoblástica. Los estudios farmacocinéticos17,18 han mostrado que, después de su inyección endovenosa, el 153Sm es aclarado del plasma con un patrón biexponencial. La primera fase se atribuye a la rápida captación en hueso y la segunda al aclaramiento sanguíneo y su excreción urinaria. Aproximadamente, de un 25 % a un 45 % de la dosis inyectada se elimina por orina y entre un 55 % y 75 % queda retenido en el esqueleto. Cuanto mayor es el número y la extensión de las lesiones osteoblásticas, Rev. Esp. Med. Nuclear, 2003;22(6):429-38 78 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico A B FIG. 1.—Gammagrafía ósea con 99mTc-HMDP (A) y gammagrafía realizada después de la administración de una dosis terapéutica de 153Sm (B). La distribución de ambos radiotrazadores es prácticamente idéntica. mayor es la retención. La relación entre la captación en las metástasis y la médula ósea normal es del orden de 5/19. La posibilidad de utilizar el 153Sm como agente terapéutico se describió en 198719 pero, en la actualidad, la experiencia en la aplicación clínica no es tan amplia como con el 89Sr20-26. Renio-186 El 186Re es emisor de radiación beta y gamma. La energía máxima de la partícula beta es de 1,065 MeV (71 %), con una energía media de 0,349 MeV. El rango medio de penetración en tejidos blandos es de 1,1 mm. La radiación gamma tiene una energía de 0,137 MeV (9 %). El período de semidesintegración del 186Re es de 3,7 días. Sus propiedades químicas son parecidas al 99mTc y habitualmente se utiliza unido al HEDP. Después de su inyección endovenosa, se distribuye de forma similar a los compuestos utilizados para la gammagrafía ósea tales como el MDP. Es aclarado rápidamente de la sangre, sobre todo por excreción renal, eliminándose aproximadamente un 70 % en los tres primeros días después de su administración9. Se han descrito índices muy elevados de captación en las lesiones en relación con la médula ósea, llegando a valores de 34/1. Las neoplasias en las que se cuenta con 79 mayor experiencia sobre la eficacia del 186Re son el cáncer de próstata y mama27-30. Estaño-117m El 117mSn se desintegra por transición isomérica, emitiendo fotones gamma de 0,159 MeV (86 %), lo que permite obtener imágenes gammagráficas de su distribución. Alternativamente a esta emisión tiene lugar el proceso de la conversión interna, cuyo resultado es la emisión de electrones con una energía similar a la del fotón gamma, que son los que producirán la acción terapéutica. Estos electrones tienen un rango que se sitúa entre los 0,2 y 0,3 mm, por lo que la toxicidad hematológica por irradiación de la médula ósea debería ser muy inferior a cuando se utiliza un emisor beta. Su período de semidesintegración es de 14 días. La experiencia clínica con este radiofármaco es, en la actualidad, todavía muy limitada31,32. Punto clave 2 En España están registrados en la actualidad dos radiofármacos para su uso asistencial: el 89Sr (MetastronR) y el 153Sm (QuadrametR). Rev. Esp. Med. Nuclear, 2003;22(6):429-38 431 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico ADMINISTRACIÓN DEL TRATAMIENTO Criterios para la administración del tratamiento Se recomienda seguir los siguientes criterios para la selección de pacientes33: 1. Presentar dolor ocasionado por metástasis óseas y que las localizaciones dolorosas coincidan con imágenes hipercaptantes en la gammagrafía ósea. 2. Presencia de dolor a pesar del tratamiento regular con analgésicos. 3. Hematología: Hb > 100 g/l Leucocitos > 3 × 109/l Plaquetas > 100 × 109/l 4. Función renal: Urea < 12 mmol/l Creatinina < 200 mmol/l La adecuada selección de pacientes es esencial para conseguir el éxito terapéutico. Aunque los pacientes con enfermedad metastásica muy extensa pueden presentar una disminución significativa del dolor óseo, generalmente la respuesta es mejor en pacientes con una afectación metastásica ósea moderada y no tan extensa33. Precauciones Hay diversas situaciones clínicas en las que el tratamiento con radiofármacos no está contraindicado, pero en las que se debe realizar con precaución. El tratamiento puede ser combinado con radioterapia externa local, pero la aplicación de radioterapia hemicorporal en los tres meses después de la terapia con radiofármacos es una contraindicación relativa, ya que incrementará la mielosupresión. La coagulación intravascular diseminada puede ser un factor de riesgo de trombocitopenia severa. En teoría, el tratamiento reciente con bifosfonatos podría reducir la captación de 89Sr o 153Sm en las metástasis óseas y disminuir la efectividad del tratamiento. Por ello, se recomienda suprimir los bifosfonatos por lo menos 48 horas antes. No se considera apropiado realizar el tratamiento en aquellos pacientes que tengan una esperanza de vida inferior a 4 meses34. Contraindicaciones No se debe administrar el tratamiento en casos de insuficiencia renal severa o cuando la fórmula hematológica no cumpla los criterios de inclusión. No se recomienda esta terapia cuando hay una fractura patológica o una compresión medular, ya que en estos casos se precisa un efecto terapéutico más rápido y estos pacientes suelen ser candidatos a radioterapia externa o a una intervención quirúrgica. Punto clave 4 El tratamiento no está indicado cuando hay una fractura patológica o existe compresión medular. En estos casos es preferible el uso de tratamientos con acción más rápida como la radioterapia externa o la cirugía. Administración de la dosis Los dos radiofármacos registrados en este momento para su utilización asistencial son el 89Sr y el 153 Sm y se administran por vía endovenosa. El paciente no precisa ningún tipo de preparación específica previa. El tratamiento se realiza ambulatoriamente y el paciente puede seguir con su actividad habitual. La dosis de 89Sr es de 148 MBq (4 mCi), mientras que la dosis de 153Sm es de 37MBq/kg. El 153Sm tiene una rápida eliminación urinaria y se debe recoger la orina del paciente durante las seis primeras horas después de su administración. Transcurrido este tiempo, el paciente puede regresar a su domicilio. En el caso del 89Sr, puede abandonar el servicio de Medicina Nuclear justo después de recibir el tratamiento, no precisando la recogida de orina. Hay que tomar medidas de precaución especiales cuando el paciente presente incontinencia urinaria, explicando con detalle las normas higiénicas a seguir para evitar una posible contaminación. Punto clave 5 El 89Sr y el 153Sm se administran por vía endovenosa y de forma ambulatoria. El paciente no precisa ninguna preparación especial previa. Punto clave 3 Para poder realizar el tratamiento del dolor con radionúclidos, previamente debe demostrarse captación de radiotrazador en las lesiones óseas dolorosas mediante gammagrafía ósea con 99mTc-difosfonatos. 432 Efectos secundarios Las complicaciones y los efectos secundarios son poco frecuentes. Entre 4 y 6 semanas post-tratamiento puede aparecer toxicidad hematológica, que suele Rev. Esp. Med. Nuclear, 2003;22(6):429-38 80 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico criterios que sugirió la Societat Catalana de Medicina Nuclear36: Tabla 2 ESCALA DE KARNOFSKY % Capacidad Funcional 100 El paciente no se queja y está sin evidencia de enfermedad 90 Tiene signos/síntomas de enfermedad leves, pero es capaz de realizar sus actividades normales 80 Presenta algunos signos/síntomas de enfermedad y requiere algo de esfuerzo para realizar actividades normales 70 Es capaz de cuidar de si mismo, pero no es capaz de hacer sus actividades normales o trabajo activo 60 Es capaz de cuidar de si mismo, pero requiere ayuda ocasional 50 Requiere cuidados médicos y mucha ayuda para el cuidado de si mismo 40 Está incapacitado y requiere ayuda y cuidados especiales 30 Está severamente incapacitado y está indicada la hospitalización. No hay riesgo de muerte inminente 20 Está muy enfermo y precisa hospitalización y respiración asistida 10 Está moribundo con evolución del proceso rápidamente fatal 0 Muerte limitarse a leucopenia y trombopenia que habitualmente se recuperan espontáneamente. Esta mielosupresión no es clínicamente importante si se cumplen los criterios de inclusión para recibir el tratamiento y raramente requiere una transfusión sanguínea. En aproximadamente un 10-20 % de los casos aparece una exacerbación del dolor en los 2 a 4 días después de recibir el tratamiento (fenómeno de la llamarada). Este incremento del dolor es transitorio y, Punto clave 6 El principal efecto secundario es la toxicidad hematológica, con aparición de leucopenia y trombopenia que habitualmente se recuperan espontáneamente. 1. Capacidad funcional, utilizando la escala de Karnofsky (tabla 2). 2. Grado de dolor, que se define como Severidad × Frecuencia. Severidad: se recomienda utilizar una escala analógica de dolor, en la que el paciente señala, en una recta de diez cm de longitud, en que punto situaría su nivel de dolor, siendo el 0 la ausencia de dolor y los 10 cm el máximo dolor. Así la severidad puede ser: 1. Leve (entre 0-4 cm de la escala analógica) 2. Moderada (de 4,1 a 7,5 cm) 3. Severa (superior a 7,5 cm) Frecuencia: puede tener tres grados 1. Ocasional 2. Intermitente 3. Constante Por lo tanto, la puntuación final del grado de dolor podrá oscilar entre 1 y 9 puntos. 3. Grado de analgesia, que se puede valorar mediante la escala validada del Grupo de Urología de la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC, protocolo 30921) y que consta de 5 grados: Grado 0: El paciente no requiere ningún tipo de analgesia Grado 1: Analgésicos no opiáceos de forma ocasional Grado 2: Analgésicos no opiáceos de forma regular Grado 3: Analgésicos opiáceos de forma ocasional Grado 4: Analgésicos opiáceos de forma regular además, suele ser predictor de que se producirá una buena respuesta al tratamiento35. En las tablas 3 y 4 se resumen la valoración del grado de dolor y analgesia. Los criterios de respuesta son: VALORACIÓN DE LA RESPUESTA 1. BUENA RESPUESTA si se produce a + [b o c], teniendo en cuenta que: No existe unanimidad en los criterios que hay que seguir para valorar la respuesta al tratamiento y cada centro aplica los que considera más oportunos. A continuación se describen de forma detallada los 81 a) Aumento del índice de Karnofsky. b) Disminución del grado de dolor igual o superior a 4 puntos. Rev. Esp. Med. Nuclear, 2003;22(6):429-38 433 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico c) Disminución del grado de analgesia, de forma que la dosis total diaria de analgésicos se reduzca al menos un 25 % en relación a la dosis pretratamiento. 2. RESPUESTA PARCIAL si se produce a + [b o c], teniendo en cuenta que: a) Aumento del índice de Karnofsky. b) Disminución del grado de dolor en 2-3 puntos. c) Sin cambios en el grado de analgesia o cambios de la dosis de analgésicos inferiores a los del apartado 1c. 3. NO RESPUESTA si ocurre que: a) No hay variación o empeora el índice de Karnofsky. b) El grado de dolor o el grado de analgesia no disminuyen o empeoran. EFICACIA La eficacia del tratamiento para la paliación del dolor, bien sea porque se consigue una respuesta completa o parcial, es variable y oscila entre un 60 % y un 90 % de los pacientes, según las series estudiadas13,16,26,37. En un 30 % de los casos que responden, el dolor desaparece. El porcentaje de pacientes que responden al tratamiento es similar para el 153Sm, 186Re y 89Sr33. Este efecto terapéutico permite reducir la dosis de analgésicos y mejora la calidad de vida del paciente. La disminución del dolor empieza en algunos casos durante los primeros días después de la administración de la dosis pero, en ocasiones, el efecto terapéutico no se inicia hasta la segunda o tercera semana. Dependiendo del radiofármaco utilizado, la duración del efecto terapéutico puede ser variable, pero la media de tiempo es de varios meses. En general, y por sus características físicas, el 153Sm suele tener un efecto terapéutico más rápido, mientras que la duración del efecto suele ser más prolongada con el 89Sr. Estas diferencias van a influir en la selección del Tabla 3 VALORACIÓN DEL GRADO DE DOLOR Severidad 1. Leve 2. Moderado 3. Severo Frecuencia 1. Ocasional 2. Intermitente 3. Constante Puntuación final = Severidad × Frecuencia. Tabla 4 VALORACIÓN DEL GRADO DE ANALGESIA Puntuación Ingesta de analgésicos 0 No analgesia 1 Analgésicos no opiáceos de forma ocasional 2 Analgésicos no opiáceos de forma regular 3 Analgésicos opiáceos de forma ocasional 4 Analgésicos opiáceos de forma regular radiofármaco óptimo para cada caso individual, que dependerá del tipo de neoplasia, la severidad de los síntomas, la capacidad funcional y la esperanza de vida en el momento en que se realice el tratamiento. En ocasiones, la situación clínica de los pacientes no es la más adecuada para conseguir el mayor efecto terapéutico. En general, la respuesta es peor y hay una mayor toxicidad hematológica en pacientes en fases muy avanzadas de la enfermedad. Aquellos pacientes en fases iniciales de enfermedad ósea metastásica, con dolor moderado y con un estado funcional poco afectado, van a ser los que con mayor probabilidad respondan al tratamiento, con mejor respuesta y mayor duración del efecto terapéutico38. En una encuesta realizada a cien especialistas en oncología médica, éstos contestaron que preferían administrar opiáceos en vez de radiofármacos y que consideraban que estos últimos estaban más indicados en los casos de enfermedad muy avanzada y diseminada39. En Punto clave 8 La duración del efecto analgésico es variable y depende de la situación clínica del paciente y del radiofármaco utilizado. La duración media es de varios meses. consecuencia, esta opción paliativa se utiliza en muchos casos en condiciones clínicas que no son las óptimas. Punto clave 7 La disminución del dolor empieza a los pocos días o a las 2 o 3 semanas después de la administración de la dosis, dependiendo del radiofármaco utilizado. 434 Rev. Esp. Med. Nuclear, 2003;22(6):429-38 82 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico RETRATAMIENTO Aunque las referencias bibliográficas relativas al retratamiento son escasas, ésta es una alternativa segura y eficaz siempre que se cumplan nuevamente los criterios de inclusión y se haya recuperado la función hematológica. En el caso del 89Sr se recomienda esperar 3 meses después de la última inyección y para el 153Sm un período de 2 meses. Las administraciones repetidas no están indicadas en aquellos pacientes que no han presentado respuesta a una dosis anterior. En nuestra experiencia, en pacientes con cáncer de próstata que presentaron una respuesta buena o parcial después de una primera dosis con 89Sr, la eficacia del tratamiento tras la segunda dosis fue similar a la obtenida después de la primera dosis. No hubo diferencias significativas en el tipo de respuesta, pero la duración del efecto terapéutico fue menor después de la primera dosis, lo que atribuimos a un empeoramiento Punto clave 9 Puede repetirse el tratamiento, siempre que la primera dosis haya obtenido una respuesta satisfactoria en el control del dolor y se haya recuperado la función hematológica. del Karnofsky, puesto que la enfermedad estaba más avanzada40. Sin embargo, algunos autores han descrito mejores resultados después de administrar una segunda dosis41. COSTES La terapéutica con los citados radiofármacos pretende paliar el dolor, mejorar la calidad de vida del paciente y reducir la dependencia de analgésicos de tipo opiáceo, sin que ello suponga un incremento de los costes del tratamiento. Aunque en ocasiones se ha argumentado que su coste es elevado, diferentes trabajos han demostrado que se trata de una alternativa terapéutica coste-efectiva42,43. Esta disminución en los Punto clave 10 Diferentes estudios han demostrado que el tratamiento del dolor óseo metastásico con radiofármacos se trata de una alternativa coste-efectiva. 83 costes de tratamiento se debe a una disminución tanto de los costes directos (analgésicos, terapéutica hormonal, radioterapia externa) como indirectos (visitas en consultas externas, hospitalización, exploraciones complementarias). APLICACIONES FUTURAS Se ha sugerido que, además de paliar el dolor, esta terapia metabólica podría disminuir los niveles sanguíneos de los marcadores tumorales y enlentecer la progresión de la enfermedad metastásica38. Se han obtenido resultados prometedores utilizando estos radiofármacos combinados con radioterapia o quimioterapia, con lo que se consigue un mayor efecto terapéutico. También se ha sugerido que la quimioterapia utilizada conjuntamente con la terapia con radionúclidos podría ofrecer, además de paliación del dolor, una mejoría en la supervivencia de los pacientes44. Otras posibilidades futuras incluyen la aplicación del tratamiento con radiofármacos en fases precoces de la enfermedad en pacientes con alto riesgo de desarrollar metástasis óseas para prevenir su aparición45. De todas formas, se precisan más estudios que confirmen que esta terapia puede dar lugar a una mayor supervivencia. Aunque el tratamiento paliativo del dolor óseo metastásico con radiofármacos se inició hace ya más de medio siglo, su utilización en la práctica asistencial no ha sido la que cabría esperar, teniendo en cuenta los beneficios que reporta y los mínimos efectos secundarios que ocasiona. Una encuesta realizada recientemente entre los centros de Medicina Nuclear de España, a la que respondieron 19 servicios, recogió la experiencia en 720 pacientes tratados. Un 79 % de los pacientes presentaron una respuesta buena o parcial al tratamiento y aparecieron efectos secundarios sólo en un 2 % de los casos. Parece evidente que el tratamiento del dolor óseo metastásico con radiofármacos está infrautilizado46. Los especialistas en Medicina Nuclear debemos dar a conocer las ventajas de esta terapia y aplicarla a aquellos pacientes que más puedan beneficiarse de ella. Es posible que en un futuro próximo se desarrollen estrategias que mejoren su efectividad, quizás combinándola con otras modalidades analgésicas. Lo más importante es que, en cualquier caso, se pueda mejorar la calidad de vida del paciente oncológico. Rev. Esp. Med. Nuclear, 2003;22(6):429-38 435 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico BIBLIOGRAFÍA 1. Nielsen OS, Munro AJ, Tannock IF. Bone metastases: Pathophysiology and management policy. J Clin Oncol 1991;9:509-24. 2. Campa JA, Payne R. The management of intractable bone pain: A clinician’s perspective. Semin Nucl Med 1992;22:3-10. 3. Janjan NA. Radiation for bone metastases. Conventional techniques and the role of systemic radiopharmaceuticals. Cancer 1997;80:1628-45. 4. McEwan AJB. Unsealed source therapy of painful bone metastases: An update. Semin Nucl Med 1997;27:165-82. 5. Friedell HL, Storaasly JP. The use of radioactive phosphorus in the treatment of carcinoma of the breast with widespread metastases to the bone. Am J Roentgenol Rad Ther 1950;64:559-75. 6. Silberstein EB, Elgazzar AH, Kapilivsky A. Phosphorus-32 radiopharmaceuticals for the treatment of painful osseous metastasis. Sem Nucl Med 1992;22:17-27. 7. Silberstein EB. The treatment of painful osseous metastases with phosphorus-32 labeled phosphates. Semin Oncol 1993 (suppl 2);20:10-21. 8. Blake GM, Zivanovic MA, McEwan AJ, Ackery DM. Sr-89 therapy: Strontium kinetics in disseminated carcinoma of the prostate. Eur J Nucl Med 1986;12:447-54. 9. Serafini AN. Current status of bone pain palliation with systemic radioisotopes. In: Freeman LM, ed. Nuclear Medicine Annual 2002. Philadelphia: Lippincott Williams & Wilkins, 2002;2 53-74. 10. Buchali K, Correns HJ, Shuerer M, Schnorr D, Lips H, Sydow K. Results of a double blind study of 89-Strontium therapy of skeletal metastases of prostatic carcinoma. Eur J Nucl Med 1988;14:349-51. 11. Silberstein EB, Williams C. Strontium-89 therapy for the pain of osseous metastases. J Nucl Med 1989;26:345-8. 12. Laing AH, Ackery DM, Bayley RJ, Buchanan RB, Lewington VJ, McEwan AJB, et al. Strontium-89 chloride for pain palliation in prostatic skeletal malignancy. Br J Radiol 1991;64:816-22. 13. Robinson RG, Preston DF, Schiefelbein M, Baxter KG. Strontium-89 therapy for the palliation of pain due to osseous metastases. JAMA 1995;274:420-4. 14. Lewington VJ, McEwan AJ, Ackery DM, Bayly RJ, Keeling DH, Macleod PM, et al. A prospective randomized double blind crossover study to examine the efficacy of strontium-89 in pain palliation in patients with advanced prostate cancer metastatic to bone. Eur J Cancer 1991;27:954-8. 15. Haesner M, Buchali K, Pink V, Lips H. The efficacy of therapy using 89Sr-strontium chloride in 200 patients with bone metastases of a prostatic cancer. Nuklearmedizin 1992;31:48-52. 16. Pons F, Herranz R, García A, Vidal-Sicart S, Conill C, Grau JJ, et al. Strontium-89 for palliation of pain from bone metastases in patients with prostate and breast cancer. Eur J Nucl Med 1997; 24:1210-4. 17. Singh A, Holmes RA, Farhangi M, Volkert WA, Williams A, Stringham LM, et al. Human pharmacokinetics of samarium-153 EDTMP in metastatic cancer. J Nucl Med 1989;30: 1814-8. 18. Eary JF, Collins C, Stabin M, Vernon C, Petersdorf S, Baker M, et al. Samarium 153-Sm-EDTMP biodistribution and dosimetry estimation. J Nucl Med 1993;343:1031-6. 19. Goeckeler WF, Edwards B, Volkert WA, Holmes RA, Simon J, Wilson D. Skeletal localization of samarium-153 chelates: Potential therapeutic bone agents. J Nucl Med 1987;28: 495-504. 20. Collins C, Eary JF, Donaldson G, Vernon C, Bush EN, Petersdorf S, et al. Samarium-153-EDTMP in bone metastases of hormone 436 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. refractory prostate carcinoma: A phase I/II trial. J Nucl Med 1993;34:1839-44. Turner JH, Claringbold PG. A phase II study of treatment of painful multifocal skeletal metastases with single and repeated dose samarium-153 ethylenediaminetetramethylene phosphonate. Eur J Cancer 1991;27:1084-6. Serafini AN. Systemic metabolic radiotherapy with samarium-153-EDTMP for the treatment of painful bone metastases. Q J Nucl Med 2001;45:91-9. Serafini AN. Samarium Sm-153 lexidronam for the palliation of bone pain associated with metastases. Cancer 2000;88 (12 Suppl):2934-9. Serafini AN, Houston SJ, Resche I, Quick DP, Grund FM, Ell PJ, et al. Palliation of pain associated with metastatic bone cancer using samarium-153 lexidronam: A double-blind placebo-controlled clinical trial. J Clin Oncol 1998;16:1574-81. Tian JH, Zhang JM, Hou QT, Oyang QH, Wang JM, Luan ZS, et al. Multicentre trial on the efficacy and toxicity of single-dose samarium-153 ethylene diamine tetramethylene phosphonate as a palliative treatment for painful skeletal metastases in China. Eur J Nucl Med 1999;26:2-7. Resche I, Chatal JF, Pecking A, Ell P, Duchesne G, Rubens R, et al. A dose-controlled study of 153Sm-ethylenediaminetetramethylenephosphonate (EDTMP) in the treatment of patients with painful bone metastases. Eur J Cancer 1997;33: 1583-91. Maxon HR 3rd, Schroder LE, Thomas SR, Hertzberg VS, Deutsch EA, Scher HI, et al. Rhenium-186(Sn)HEDP for treatment of painful osseous metastases: Initial clinical experience in 20 patients with hormone-resistant prostate cancer. Radiology 1990;176:155-9. Maxon HR 3rd, Schroder LE, Hertzberg VS, Thomas SR, Englaro EE, Samaratunga R, et al. Rhenium-186(Sn)HEDP for treatment of painful osseous metastasis: Results of a double blind crossover comparison with placebo. J Nucl Med 1991;32: 1877-81. Han SH, Zonnenberg BA, De Klerk JMH, Quirijnen JM, Van Het Schip AD, Van Dijk A, et al. 186-Re-etidronate in breast cancer patients with metastatic bone pain. J Nucl Med 1999; 40:639-42. Han SH, De Klerk JM, Zonnenberg BA, Tan S, Van Rijk PP. 186-Re-etidronate. Efficacy of palliative radionuclide therapy for painful bone metastases. Q J Nucl Med 2001;45:84-90. Srivastava SC, Atkins HL, Krishnamurthy GT, Zanzi I, Silberstein EB, Meinkin G, et al. Treatment of metastatic bone pain with tin-117m stannic diethylenetriaminepentaacetic acid: a phase I/II clinical study. Clin Cancer Res 1998;4:61-8. Swailem FM, Krishnamurthy GT, Srivastava SC, Aguirre ML, Ellerson DL, Wals TK, et al. In-vivo tissue uptake and retention of Sn-117m (4 +) DTPA in a human subject with metastatic bone pain and in normal mice. Nucl Med Biol 1998;25: 279-87. Lewington VJ. A practical guide to targeted therapy for bone pain palliation. Nucl Med Commun 2002;23:833-6. Silberstein EB, Taylor AT. EANM Procedure guidelines for treatment of refractory metastatic bone pain. Eur J Nucl Med 2003;30:BP7-BP11. Serafini A. Therapy of metastatic bone pain. J Nucl Med 2001; 42:895-906. Societat Catalana de Medicina Nuclear. Tractament del dolor ossi metastàsic amb estronci-89. Barcelona: SCMN; 1999. Piffanelli A, Dafermou A, Giganti M, Colamussi P, Pizzocaro C, Bestagno M. Radionuclide therapy for painful bone metastases. An Italian multicentre observational study. Writing Committee of an Ad Hoc study group. Q J Nucl Med 2001;45: 100-7. Sciuto R, Tofani A, Festa A, Giannarelli D, Pasqualoni R, Maini CL. Short- and long-term effects of 186Re-1, 1-hydroxyethylidene Rev. Esp. Med. Nuclear, 2003;22(6):429-38 84 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico 39. 40. 41. 42. 85 diphosphonate in the treatment of painful bone metastases. J Nucl Med 2000;41:647-54. Papatheofanis FJ. Variation in oncologic opinion regarding management of metastatic bone pain with systemic radionuclide therapy. J Nucl Med 1999;40:1420-3. Fuster D, Herranz R, Alcover J, Mateos JJ, Vidal-Sicart S, Pons F. Tratamiento del dolor óseo metastásico con dosis repetidas de estroncio-89 en pacientes con neoplasia de próstata. Rev Esp Med Nucl 2000;19:270-4. Kasalicky J, Krajská V. The effect of repeated strontium-89 chloride therapy on bone pain palliation in patients with skeletal cancer metastases. Eur J Nucl Med 1998;24:1362-7. McEwan AJB, Amyotte GA, McGowan DG, MacGillivray JA, Porter AT. A retrospective analysis of the cost effectiveness of treatment with Metastron (89Sr-chloride) in patients with prostate cancer metastatic to bone. Nucl Med Commun 1994;15: 499-504. 43. Malmberg I, Persson U, Ask A, Tennvall J, Abrahamsson PA. Painful bone metastases in hormone-refractory prostate cancer: Economic costs of Strontium-89 and/or external radiotherapy. Urology 1997;50:747-53. 44. Tu SM, Millikan RE, Mengistu B, Delpassand ES, Amato RJ, Pagliaro LC, et al. Bone-targeted therapy for advanced androgen-independent carcinoma of the prostate: a randomised phase II trial. Lancet 2001;357:336-41. 45. McCready VR, O’Sullivan JM. Future directions for unsealed source radionuclide therapy for bone metastases. Eur J Nucl Med 2002;29:1271-5. 46. Pons F, Fuster D. Under-utilization of radionuclide therapy in metastatic bone pain palliation. Nucl Med Commun 2002;23: 301-2. Rev. Esp. Med. Nuclear, 2003;22(6):429-38 437 Documento descargado de http://www.elsevier.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Pons F, et al. Tratamiento paliativo del dolor óseo metastásico APÉNDICE TRATAMIENTO DEL DOLOR ÓSEO METASTÁSICO EXPERIENCIA ESPAÑOLA Francesca Pons. Servicio de Medicina Nuclear, Hospital Clínic, Barcelona Una encuesta a la que respondieron un total de 19 centros de Medicina Nuclear de toda España, analizó la experiencia en el tratamiento del dolor óseo metastásico con Radiofármacos. El estudio pone de manifiesto importantes diferencias en cuanto al número de pacientes tratados en cada centro, diferencias en la forma de valorar los resultados del tratamiento, así como las dificultades derivadas de que, en muchos casos, la situación clínica de los pacientes no es la más adecuada para conseguir la máxima eficacia terapéutica. Los resultados obtenidos permiten concluir que la Medicina Nuclear cuenta una modalidad de tratamiento con una alta eficacia clínica y escasos efectos secundarios, aunque notablemente desconocida. El objetivo de la encuesta se centró en analizar la experiencia del tratamiento paliativo del dolor óseo metastásico con radiofármacos en España, por lo que fue enviada a todos los centros que tenían experiencia en esta modalidad terapéutica. Contestaron al cuestionario un total de 19 servicios de Medicina Nuclear, que se detallan en la tabla 1. No se planteó el objetivo de realizar un estudio comparativo de los dos radiofármacos registrados en la actualidad, Cloruro de 89Sr (Metastron) y 153Sm-EDTMP (Quadramet), puesto que las indicaciones clínicas no son las mismas y, además, su período de comercialización difiere considerablemente (casi una década de diferencia entre ambos). Los primeros tratamientos fueron realizados a principios de la década de los 90, utilizando 89Sr en pacientes con cáncer de próstata. En la actualidad, de los 19 centros participantes, 9 tienen experiencia en la utilización de 89Sr, 2 con 153Sm y 8 con ambos radiofármacos. El número total de pacientes tratados asciende a 720: 558 con cáncer de próstata, 136 con carcinoma de mama y los 26 restantes con otros tipos de neoplasias. Con relación al número de casos por centro, 3 servicios han tratado menos de 10 pacientes, 3 entre 10-25 pacientes, 7 entre 25-50, 5 entre 50-75 y sólo un servicio tiene una experiencia superior a los 100 pacientes. La valoración de la respuesta al tratamiento y el seguimiento de los pacientes la realizan de forma conjunta el especialista de Medicina Nuclear y el clínico que remite al paciente en la mitad de los casos, aunque en 1 centro lo lleva a cabo el especialista en Medicina Nuclear y en 9 centros el clínico de forma aislada. Existe una gran discrepancia en los parámetros que se utilizan para valorar la respuesta al tratamiento. Aunque la mayoría de los servicios de Medicina Nuclear tienen en consideración variaciones en el grado de dolor, la capacidad funcional y las modificaciones en la ingesta de analgésicos, las escalas de valoración no son siempre las mismas y, en algunos centros, sólo tienen en cuenta uno o dos de estos parámetros. Los resultados obtenidos, según la valoración que hace cada centro, muestran que en el 35 % de los casos (n = 252) la respuesta al tratamiento fue buena, en 35 % (n = 254) parcial, en 19 % (n = 136) no hubo respuesta y en el 11 % restante (n = 78) se desconoce. Estos casos en los que no se conoce la respuesta al tratamiento corresponden a pacientes tratados en centros en los que la valoración la realiza el clínico sin contar con el médico nuclear, o casos en los que no ha transcurrido el tiempo suficiente después de la administración de la dosis. Si se excluyen de la valoración éstos últimos, se obtiene que un 79 % (n = 506) de los pacientes respondieron al tratamiento (con respuesta buena o parcial) y el 21 % restante (n = 136) no respondió. Presentaron efectos secundarios 14 de los 720 pacientes tratados, lo que representa un 2 %. Éstos fueron 8 casos con aplasia medular severa, 4 con trombopenia, 1 sangrado digestivo y una fractura en una lesión metastásica todavía en estudio. Hay que destacar que 16 de los 19 centros opinan que la situación clínica de los pacientes que han sido tratados no es adecuada para conseguir la máxima eficacia terapéutica, ya que éstos son remitidos en fases demasiado avanzadas de la enfermedad. Además, todos los centros excepto uno consideran que la terapéutica del dolor óseo metastásico está infrautilizada, ya que el número de pacientes debería ser superior, pero hay poco interés o desconocimiento por parte de los clínicos. De los resultados de este estudio se puede concluir que la Medicina Nuclear dispone de una modalidad de tratamiento con una alta eficacia terapéutica (79 % de los pacientes presentaron respuesta al tratamiento) y mínimos efectos secundarios (2 % de los casos). Sin embargo, existe desconocimiento por parte de los clínicos de su eficacia, la cual disminuye en las fases demasiado avanzadas de la enfermedad metastásica, momento en el cual nos son remitidos un elevado porcentaje de los pacientes. Tabla 1 CENTROS DE MEDICINA NUCLEAR QUE PARTICIPARON EN EL ESTUDIO Ciutat Sanitària i Universitària de Bellvitge Ciutat Sanitària i Universitària Vall d’Hebron Complejo Hospitalario Materno-Insular Complejo Hospitalario Nuestra Señora de Alarcos Fundación Jiménez Díaz Hospital Clínic Hospital Clínico Universitario Lozano Blesa Hospital de la Santa Creu i Sant Pau Hospital La Paz Hospital Ramón y Cajal 438 Barcelona Barcelona Las Palmas Ciudad Real Madrid Barcelona Zaragoza Barcelona Madrid Madrid Hospital San Jaime, Torrevieja Hospital Santiago Apóstol Hospital Universitario Central de Asturias Hospital Universitario de Canarias, La Laguna Hospital Universitario Dr. Peset Hospital Universitario Marqués de Valdecilla Hospital Universitario Puerta del Mar Hospital Universitario Virgen de las Nieves Hospital Virgen de la Arrixaca, El Palmar Rev. Esp. Med. Nuclear, 2003;22(6):429-38 Alicante Vitoria Oviedo Tenerife Valencia Santander Cádiz Granada Murcia 86