EL MOL
Anuncio
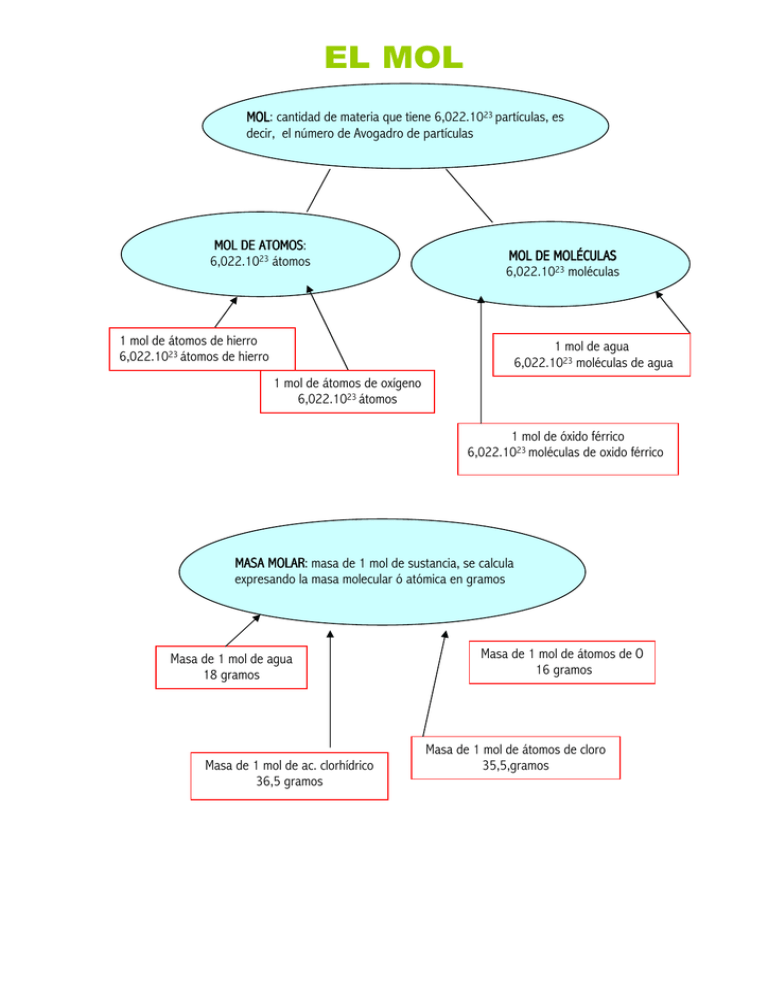
EL MOL MOL: MOL cantidad de materia que tiene 6,022.1023 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: ATOMOS 6,022.1023 átomos MOL DE MOLÉCULAS 6,022.1023 moléculas 1 mol de átomos de hierro 6,022.1023 átomos de hierro 1 mol de agua 6,022.1023 moléculas de agua moléculas de agua 1 mol de átomos de oxígeno 6,022.1023 átomos 1 mol de óxido férrico 6,022.1023 moléculas de oxido férrico MASA MOLAR: MOLAR masa de 1 mol de sustancia, se calcula expresando la masa molecular ó atómica en gramos Masa de 1 mol de agua 18 gramos Masa de 1 mol de ac. clorhídrico 36,5 gramos Masa de 1 mol de átomos de O 16 gramos Masa de 1 mol de átomos de cloro 35,5,gramos Calcular el número de moles= moles gramos totales gramos de 1 mol CONCENTRACIÓN MOLAR de una disolución es la relación entre el número de moles de soluto y el volumen de la disolución expresado en litros n º moles c= V (l ) Un mol de cualquier gas a 0 o C y 1 atm de presión (condiciones normales) ocupa 22,4 litros. EJERCICIOS DE MOLES 1. ¿Cuántos moles son 110 g de ácido clorhídrico? Sol: 3,02 moles 2. ¿Cuántos moles son 140 g de nitrógeno? Sol: 5 moles 3. ¿Cuántos moles son 1,6 g de metano? Sol: 0,1 moles 4. Calcula la masa que hay en 1,5 moles de anhídrido carbónico. Sol: 66 g 5. Calcula la masa que hay en 2 moles de H2SO3. Sol: 164 g. 6. Calcula la masa que hay en 0,2 moles de cloruro sódico. Sol: 11,7 g 7. ¿Que número de moléculas contienen dos litros de agua? Sol: 6,69.1025 moléculas 8. Calcula la masa en gramos de 0,15 moles de anhídrido carbónico. Sol: 6,6 g 9. Calcula la masa en gramos de 6,022 . 1023 moléculas de anhídrido sulfuroso. Sol: 64 g 10. La masa molecular del metano es 16 u. ¿Cual es su masa molar? ¿Qué número de moléculas habrá en 2 moles de metano? Sol: 16 g. 1,20 . 1024 11. ¿Cuántos moles de moléculas de agua hay en un vaso que contiene 180 g de agua? Sol: 10 moles de agua 12. Disponemos de 0,2 moles de hidrógeno, 0,2 moles de anhídrido carbónico y 0,2 moles de agua ¿Que masa es mayor? Sol: La respuesta es la b. 13. Halla la masa de un mol óxido cálcico. Sol: 56 g. 14. Si en un recipiente hay 142 g de gas cloro, ¿Cuántos moles de gas hay? Sol: 2 moles 15. En un mol de moléculas de óxido de azufre (IV) ¿Cuantos moles de átomos de azufre hay? ¿ Y cuantos moles de átomos de oxígeno?Sol: 1 mol y 2 moles 16. Si un recipiente lleno de gas nitrógeno tiene una masa de 56 g. ¿Cuántos moles contiene? Sol: 2 moles 17. ¿Cuantas moléculas hay en un mol de dióxido de carbono? ¿Cuál es la masa de un mol de dióxido de carbono expresada en gramos? Sol: 6,02 . 1023 moléculas y 44 g 18. La reacción entre el hidrógeno y el oxígeno forma agua, escribe la reacción, ajústala y razona; si en el proceso se han formado 20 moles de agua ¿Cuantos moles de hidrógeno y de oxígeno habrán reaccionado? Sol: 20 de hidrógeno y 10 de oxígeno. 19. La masa de una mina de lápiz es 0,1035 g. Tras escribir en una página, su masa se reduce a 0,1026 g. ¿Cuanto grafito y cuantos átomos de carbono quedan en el papel? Sol: Han quedado 4,517. 1019 átomos. 20. El nitrógeno reacciona con el hidrógeno para dar amoniaco. Ajusta la reacción y determina: a. El número de moles de nitrógeno, hidrógeno y amoniaco que intervienen en la reacción b. El número de moléculas de estas misma sustancias Sol: 1 mol de nitrógeno, 3 de hidrógeno y 2 de amoniaco. 6,022 . 1023 moléculas de nitrógeno, 1,81 . 1024 de hidrógeno y 1,20 . 1024 21. Si un trozo de hierro contiene 4,6 moles de hierro ¿Cuántos gramos son? ¿Cuántos átomos hay en ellos? 22. ¿Cuántos moles de carbono hay en 20 gramos de carbono? 23. Un trozo de oro contiene 7.1032 átomos ¿Cuántos moles de átomos son? ¿Cuántos átomos? 24. Se tienen 2 moles de cada una de las siguientes sustancias: amoniaco, óxido sódico, óxido férrico e anhídrido perclórico. a. ¿Cuántos gramos y cuántas moléculas habrá de cada sustancia? b. Halla cuantos átomos de oxígeno habrá en cada muestra 23. Un mol de cierto compuesto contiene 112 gramos. ¿Cual es la masa de una molécula en unidades de masa? ¿Cuantas moléculas hacen falta para completar 200 gramos? 24. Se puede considerar el átomo de aluminio como una esfera de 0,14 nm de radio.¿Qué longitud tendría 1 mol de átomo de aluminio puestos en fila uno tras otro? 25. Se ha preparado una disolución de cloruro potásico disolviendo 5 g en agua destilada y completando hasta obtener 500 ml de disolución. Halla su concentración molar 26. Se dispone en el laboratorio de ácido nítrico de concentración 5mol/l ¿Cuantos gramos de ácido están contenidos en 250 ml de disolución? 27. Ha ardido completamente en la atmósfera de aire 1 mol de metano. Ajusta la ecuación y calcula: a) Las moléculas de oxígeno, dióxido de carbono y agua que intervienen en la reacción b) Los átomo de carbono, hidrógeno y oxígeno que han reaccionado. 27. Razona si las siguientes afirmaciones son ciertas o falsas a. La masa molecular del óxido cálcico es 66,1 uma. b. Una molécula de cloruro sódico tiene de masa 58,44 c. La masa de un átomo de berilio es 1,49.10-23 d. En 18 g de agua hay el mismo número de moléculas que en 100,86 g de cloruro de cinc. 28. Ordena de mayor a menor las masas de las siguientes muestras: a. 4 moles de ácido bromhídrico b. 3,1 moles de anhídrido hipocloroso c. 20.1023 átomos de sulfuro ferroso d. 3 dm3 de aire de densidad 2,7 g/l 29. La masa molecular del óxido estánnico es........ por tanto 300 g de este compuesto son .......moles. A partir de esta cantidad de óxido se pueden obtener ......... moles de átomos de oxígeno, y ........ moles de átomos de estaño. 30. Dados c. d. e. f. 5 moles de anhídrido hipobromoso halla: los gramos de este compuesto los moles de bromo que se pueden obtener los moles de oxigeno que se pueden obtener los átomos de bromo y los átomos de oxígeno.




