Determinación del Peso Molecular por Crioscopía
Anuncio

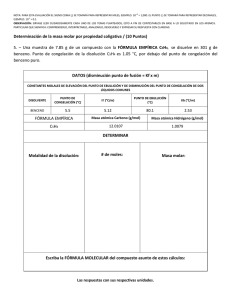
LABORATORIO DE FISICOQUÍMICA QMC‐313 Determinación del Peso Molecular por Crioscopía Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 08/04/2014 PROCEDIMIENTO OPERATIVO ESTÁNDAR Determinación del Peso Molecular por Crioscopía Fisqmc-0030 Emisión: Codificación y Revisión Ed. 0001 Página 2 de 7 Determinación de Peso Molecular Por Crioscopía Tabla de contenido 1. FUNDAMENTO ......................................................................................................................... 3 2. INSTRUMENTOS Y MATERIAL .................................................................................................. 5 3. REACTIVOS ............................................................................................................................... 5 4. PROCEDIMIENTO ..................................................................................................................... 5 5. CÁLCULOS ................................................................................................................................ 7 PROCEDIMIENTO OPERATIVO ESTÁNDAR Determinación del Peso Molecular por Crioscopía Fisqmc-0030 Emisión: Codificación y Revisión Ed. 0001 Página 3 de 7 1. FUNDAMENTO El descenso crioscópico es una propiedad coligativa, es decir, que depende únicamente de la actividad (valor muy próximo de la concentración molal) de soluto en la solución, sin importar su naturaleza química o sus interacciones físicas. Esta propiedad corresponde a la diferencia entre el punto de congelación del solvente puro y el punto de congelación del solvente en presencia de un soluto. Esta propiedad es proporcional a la actividad del soluto en solución. En esta práctica a través de medidas de temperatura en un sistema benceno y benzenoacido benzoico, se determinará el peso molecular, el peso molecular aparente, así como el grado de dimerización del ácido benzoico en benceno. La expresión matemática de este efecto es: ∆ (1) donde ∆T es la disminución del punto de congelación del disolvente puro, k es la constante del punto de congelación y m es la concentración molal de las partículas de soluto (esto es, la concentración expresada en moles de partículas de soluto por 1000 g de disolvente)1. La constante del punto de congelación, k, es diferente para cada disolvente, pero no depende del soluto. Por medidas del descenso crioscópico, podemos calcular la masa molecular de un soluto siempre que trabajemos con disoluciones muy diluidas. ∆ ∙ ∙ ∙ (2) m1 = masa de soluto en gramos m2 = masa de disolvente en gramos En este experimento, todas las muestras problema consistirán de sustancias de moléculas sin disociar. Cuando estas sustancias entran en solución, cada molécula actúa como una partícula separada, por lo que la "concentración molal de partículas de soluto" es igual a la "concentración molal de soluto". 1 PROCEDIMIENTO OPERATIVO ESTÁNDAR Determinación del Peso Molecular por Crioscopía Fisqmc-0030 Emisión: Codificación y Revisión Ed. 0001 Página 4 de 7 M1 = peso molecular del soluto ∆ ó Conocida la Kf, es posible establecer el peso molecular M1 del compuesto desconocido, tomando datos de sólo su masa, la masa del solvente y el descenso del punto de congelación según: ∙ ∆ (3) ∙ En la Tabla 1 se dan los valores de k de algunas sustancias. Tabla 1. Constantes molales de disminución del punto de congelación. Sustancia K / °C kg/mol) Punto de Fusión / °C Benceno 5,12 5,5 Difenilamina 8,60 70 Ácido Benzoico 4,47 122 Ácido Acético 3,90 16,6 Naftaleno 6,90 80,2 Ácido Fórmico 2,77 8,4 Etanol 1,99 -114 Nitrobenceno 7,00 5,7 Agua 1,86 0,0 Así el valor 8,0 °C kg/mol para el difenilo indica que 1 mol de cualquier sustancia no disociable, disuelta en 1 kg de este disolvente, disminuirá en 8,0°C el punto de congelación. Los pesos moleculares obtenidos con este método pueden no ser muy exactos, pero esto no les resta utilidad. Por regla general se conoce ya la fórmula empírica del compuesto, por ejemplo, C6H14O en base al análisis elemental, y la medición de la disminución del punto de congelación, aun no siendo muy precisa, permite seleccionar entre C6H14O, C12H28O2, C18H42O3, etc. Los pesos moleculares de estas fórmulas son 102, 204, 306, etc. y la determinación no necesita ser muy exacta para poder escoger el valor real. PROCEDIMIENTO OPERATIVO ESTÁNDAR Determinación del Peso Molecular por Crioscopía Fisqmc-0030 Emisión: Codificación y Revisión Ed. 0001 Página 5 de 7 2. INSTRUMENTOS Y MATERIAL 2.1. 1 vaso de precipitados de 600 mL 2.2. 6 tubos de ensayo de 20 X 150 mm con tapón de rosca 2.3. 1 termómetro (-10 a 100 °C) 2.4. Gradilla para tubos 2.5. Balanza analítica 2.6. Papel Higiénico Blanco 3. REACTIVOS 3.1. Benceno 3.2. Ácido Benzoico 3.3. Ácido Acético 3.4. Acetona 3.5. Diclorometano 3.6. Hielo 3.7. Sal 3.8. Agua Destilada. 4. PROCEDIMIENTO Determinación de Punto de Fusión del Solvente Puro (benceno y ácido acético) 4.1. Poner unos 12 mL de benceno p.a. en un tubo de ensayo. 4.2. Introducir un termómetro y sumergir el tubo en un vaso con hielo, agitando el líquido cuidadosamente con el termómetro y realizando lecturas de temperatura cada 15 s hasta la estabilización de la temperatura. Los cristales de benceno PROCEDIMIENTO OPERATIVO ESTÁNDAR Determinación del Peso Molecular por Crioscopía Fisqmc-0030 Emisión: Codificación y Revisión Ed. 0001 Página 6 de 7 deberán comenzar a formarse aproximadamente a 5.5°C, y la temperatura permanecerá constante durante unos minutos si la agitación es suficiente. 4.3. Regístrese esta temperatura leyéndola tan exactamente como sea posible. 4.4. Se repite esta operación 3 o más veces hasta tener la seguridad de tener perfectamente fijada la temperatura de fusión o temperatura de congelación del disolvente. Determinación de la Constante Crioscópica (Kf) 4.5. A continuación se saca el tubo del baño se espera que vuelva a fundirse la fracción sólida y se le añade 1 mL de un soluto conocido como diclorometano (ácido acético), se tapa y se sumerge en el baño de hielo teniendo precaución de disolver perfectamente el soluto en el disolvente, no puede quedar ningún soluto adherido a las paredes del tubo, pues falsearíamos los resultados. Se repite la operación efectuada para la determinación del punto de congelación del disolvente puro y con la misma precisión que en el caso anterior. 4.6. Se determina el valor de la constante crioscópica (Kf) 4.7. A diferencia del caso anterior, la temperatura de la disolución no permanece constante durante la cristalización, ya que la concentración de la disolución aumenta al congelarse el disolvente, por lo que es necesario hacer varias determinaciones del punto de fusión de la disolución y procurar que haya la mínima cantidad de cristales al tomar la lectura. 4.8. Se repite esta operación 3 o más veces hasta tener la seguridad de tener perfectamente fijada la temperatura de fusión o temperatura de congelación de la solución de soluto y solvente. Determinación de Peso Molecular de Solutos Conocidos 4.9. En un segundo tubo, poner unos 12 mL (pesados con exactitud) de benceno p.a. El peso del líquido debe determinarse pesando el tubo antes y después de introducir los 12 mL de benceno. PROCEDIMIENTO OPERATIVO ESTÁNDAR Determinación del Peso Molecular por Crioscopía Fisqmc-0030 Emisión: Codificación y Revisión Ed. 0001 Página 7 de 7 4.10. Pesar con exactitud 1 g de ácido benzoico y disuélvase completamente en el benceno. 4.11. Determínese el punto de congelación de esta solución en la misma forma que para el benceno puro. En esta parte es en extremo importante leer la temperatura cuando sólo ha cristalizado una pequeña cantidad (5% o menos), pues dicha temperatura disminuye rápidamente si solidifica más disolvente. 4.12. Determínese el peso molecular del ácido benzoico empleando el valor de la constante crioscópica determinada en 4.6 y con el valor teórico de la Tabla 1, tal como se explica en la sección "cálculos", y compárese con el valor aceptado, para verificar el procedimiento utilizado. Determinación de Peso Molecular de Muestra X 4.13. Obténgase la muestra problema y repítase el procedimiento de determinación del punto de congelación, volviendo a pesar las cantidades apropiadas de benceno y de soluto. No es necesario volver a determinar el punto de congelación del solvente puro. Calcúlese el peso molecular de la muestra problema, así como la incertidumbre experimental del valor obtenido. 5. CÁLCULOS 5.1. Empleando la ecuación 2, determinar el valor de las constantes crioscópicas del soluto conocido. Comparar con el valor teórico o bibliográfico. 5.2. Empleando la ecuación 3, determinar el peso molecular de los solutos conocidos y del soluto desconocido. Comparar con los datos teóricos y determinar la magnitud de los errores y sus respectivas fuentes de error.