DETERMINACIÓN DE LA PRESENCIA DE Trichomonas foetus Y
Anuncio

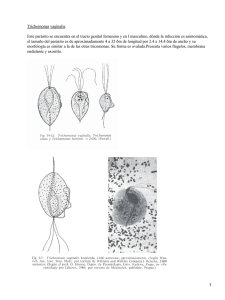
DETERMINACIÓN DE LA PRESENCIA DE Trichomonas foetus Y DE FLORA BACTERIANA ACOMPAÑANTE A PARTIR DE LAVADOS UTERINOS EN BOVINOS CON PROBLEMAS REPRODUCTIVOS EN UN HATO LECHERO DE LA SABANA DE BOGOTÁ LADY CAROLINA GONZALEZ CARMONA MILENA JINETH SANCHEZ LADINO PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS MICROBIOLOGÍA AGRÍCOLA Y VETERINARIA BOGOTÁ D.C. COLOMBIA 2009 DETERMINACIÓN DE LA PRESENCIA DE Trichomonas foetus Y DE FLORA BACTERIANA ACOMPAÑANTE A PARTIR DE LAVADOS UTERINOS EN BOVINOS CON PROBLEMAS REPRODUCTIVOS EN UN HATO LECHERO DE LA SABANA DE BOGOTÁ LADY CAROLINA GONZALEZ CARMONA MILENA JINETH SANCHEZ LADINO TRABAJO DE GRADO Presentado como requisito parcial Para optar por el titulo de Microbióloga Agrícola y Veterinaria PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA AGRÍCOLA Y VETERINARIA BOGOTÁ D.C. NOVIEMBRE 2009 NOTA DE ADVERTENCIA Artículo 23 de la Resolución N° 13 de Julio de 1946 “La universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por qué no se publique nada contrario al dogma y a la moral católica y porque las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”. DETERMINACIÓN DE LA PRESENCIA DE Trichomonas foetus Y DE FLORA BACTERIANA ACOMPAÑANTE A PARTIR DE LAVADOS UTERINOS EN BOVINOS CON PROBLEMAS REPRODUCTIVOS EN UN HATO LECHERO DE LA SABANA DE BOGOTÁ LADY CAROLINA GONZALEZ CARMONA MILENA JINETH SANCHEZ LADINO ‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐ RUBIELA CASTAÑEDA MED. VETERINARIA MSc. DIRECTORA ‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐ ADRIANA PULIDO BACTERIOLOGA MSc. JURADO DETERMINACIÓN DE LA PRESENCIA DE Trichomonas foetus Y DE FLORA BACTERIANA ACOMPAÑANTE A PARTIR DE LAVADOS UTERINOS EN BOVINOS CON PROBLEMAS REPRODUCTIVOS EN UN HATO LECHERO DE LA SABANA DE BOGOTÁ LADY CAROLINA GONZALEZ CARMONA MILENA JINETH SANCHEZ LADINO APROBADO ‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐ ‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐ INGRID SCHULER GARCIA MSc JANETH ARIAS PALACIOS MSc DECANA ACADÉMICA DIRECTORA DE CARRERA TABLA DE CONTENIDO Resumen……………………………………………………………………………………………………………………………………1 1. Introducción…………………………………………………………………………………………………………………..1 2. Formulación del problema y justificación ………………………………………………………………………1 2.1 Formulación del problema……………………………………………………………………………………….1 2.2 Justificación del problema ………………………………………………………………………………………2 3. Marco teórico…………………………………………………………………………………………………………………2 3.1 Abortos por Trichomonas foetus ……………………………………………………………………………..2 3.1.1 Taxonomía ………………………………………………………………………………………………….2 3.1.2 Características generales……………………………………………………………………………..2 3.1.3 Epidemiología……………………………………………………………………………………………..3 3.1.4 Patogénesis……………………………………………………………………….………………………..3 3.1.5 Signos y síntomas………………………………………………………………………..………………4 3.1.6 Diagnóstico………………………………………………………………………………………………….5 3.1.7 Tratamiento, Prevención y Control………………………………………………………………6 3.2 Flora bacteriana acompañante……………………………………………………………………..…………6 3.2.1 Bacterias Gram positivas…………………………………………………………………………….7 3.2.2 Bacterias Gram negativas………………………………………………………………….………..9 4. Objetivos……………………………………………………………………………………………………………………..10 4.1 Objetivo general…………………………………………………………………………………………………….10 4.2 Objetivos específicos………………………………………………………………………………………..……10 5. Materiales y métodos…………………………………………………………………………………………………..10 5.1 Diseño de investigación…………………………………………………………………………………………10 5.2 Población de estudio………………………………………………………………………………………..……10 5.3 Toma de muestras…………………………………………………………………………………………………11 5.4 Transporte de las muestras……………………………………………………………………………………11 5.5 Procesamiento de las muestras………………………………………………………………………..……11 5.5.1 Evaluación macroscópica……………………………………………………………………….11 5.5.2 Cultivo de Trichomonas ……………………..…………………………………………..…….11 5.5.3 Evaluación citológica…………………………………………………………………………………11 5.5.4 Evaluación de Trichomonas foetus por medio de campo oscuro y tinción ...11 5.5.5 Flora Bacteriana Acompañante………………………………………………………………….12 5.5.5.1 Pruebas de susceptibilidad……………………………………………………………….12 6. Resultados y discusión de resultados……………………………………………………………………..…….12 6.1 lavados uterinos…………………………………………………………………………………………………….12 6.2 Evaluación citológica……………………………………………………………………………………………..12 6.3 Cultivo y evaluación microscópica de Trichomonas foetus……………………………………..13 6.4 Flora bacteriana acompañante………………………………………………………………………………16 7. Conclusiones………………………………………………………………………………………………………….…….17 8. Recomendaciones………………………………………………………………………………………………………..18 9. Bibliografía…………………………………………………………………………………………………………………..19 10. Anexos……………………………..………………………………………………………………………………………….23 10.1 Anexo #1: tabla de observaciones microscópicas………………………………………..……23 10.2 Anexo #2: resultados de flora bacteriana y Trichomonas foetus……………………….23 10.3 10.4 Anexo #3: tabla de pruebas bioquímicas y pruebas para flora acompañante……23 Anexo #4: Medio base para Trichomonas foetus……………………………………………24 TABLA DE FIGURAS 1. Figura 1: Morfología de T. foetus……………………………………………………………………………………3 2. Figura 2: Observación macroscópica de los lavados uterinos………………………………………12 3. Figura 3: Morfología de T. foetus en fresco con lugol y coloración de Wright…..……………14 TABLA DE GRÁFICAS 1. 2. 3. 4. Gráfica 1: Evaluación microscópica de los lavados uterinos por tinción de Gram………….13 Gráfica 2: Evaluación microscópica de los lavados uterinos por tinción de Wright ……….13 Gráfica 3: Porcentaje de la presencia de T. foetus…………………………………………………………14 Gráfica 4: Microorganismos aislados a partir de los lavados uterinos ……………………..……16 RESUMEN En Colombia, son escasos los estudios epidemiológicos sobre el estado de la Tricomoniasis bovina en las zonas de producción lechera. La determinación de su presencia como agente infeccioso del tracto reproductivo es de vital importancia para establecer programas de control y prevención debido a la dificultad para su erradicación en los hatos. En este trabajo se evaluaron 10 muestras de lavados uterinos de vacas con historial de problemas reproductivos de un hato lechero de la sabana de Bogotá mediante la técnica de microscopía de campo oscuro y de cultivo para determinar la presencia de Trichomonas foetus y para evaluar presencia de flora bacteriana acompañante. Los resultados obtenidos evidenciaron la presencia de Trichomonas foetus en 6 de las 10 muestras. En dos muestras negativas para el protozoo se aislaron Streptococcus beta y gamma hemolíticos además de Lactobacillus sp. y Actinomyces pyogenes y Klebsiella sp,respectivamente, determinadas por cultivo y bioquímicas. Las tres muestras restantes fueron negativas para Trichomonas foetus y flora bacteriana acompañante. 1. INTRODUCCIÓN La tricomoniasis bovina, es una enfermedad de amplia distribución mundial y de gran trascendencia en los países con alta producción ganadera; su importancia radica en las elevadas pérdidas económicas debidas a los problemas reproductivos que ocasiona y a la difícil erradicación de los hatos (manual OIE 2004). Aunque son escasos los estudios epidemiológicos sobre el estado de esta enfermedad en Colombia, no se desconoce del todo su presencia, especialmente en las zonas de alta producción de ganado como se determino al evaluar 8 áreas productoras de leche del país en 1982 y encontrar una presencia de 18,4% de Trichomonas foetus (Griffiths et al, 1982) o en el alto Putumayo en 1999 donde se presentaba una prevalencia de 48.3% de T. foetus (González y Patiño 1999) a pesar de esto, no se tiene conocimiento sobre su presencia en zonas de producción lechera con clima frío (ICA. 2007) Teniendo en cuenta que la tricomoniasis está reportada en la lista B por la clasificación de la OIE, y que es una enfermedad venérea de carácter enzoótico, el conocimiento epidemiológico de su presencia en las zonas productoras del país se hace de vital importancia para evaluar el estado sanitario de los hatos y participar de los programas de prevención, debido a que no existe un tratamiento efectivo para la cura en los animales afectados por este parásito (manual OIE 2004) Mediante esta evaluación se busca determinar la presencia de Trichomonas foetus y de flora bacteriana acompañante en vacas con problemas reproductivos de un hato lechero de la Sabana de Bogotá, a través del procesamiento en laboratorio de lavados uterinos. 2. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 2.1 Formulación del problema La importancia clínica de la tricomoniasis, radica en que ésta es una enfermedad de distribución mundial que causa pérdidas económicas importantes por los problemas reproductivos que ocasiona y representa un factor limitante en las lecherías por su impacto en la disminución de la producción de los hatos (Gädicke y Monti 2008); además de no existir ningún tratamiento totalmente efectivo que permita contrarrestar las pérdidas (Schwebke y Burgess, 2004), esta enfermedad venérea ocasiona infertilidad temporal y repeticiones del estro en los animales infectados además de abortos (Kasimanickam, Et al 2005). La tricomoniasis bovina representa un problema sanitario para las áreas de producción pecuaria debido a la poca información que se tiene sobre su prevalencia en el 1 país y sobre programas de prevención y control, además de las altas pérdidas económicas representadas en abortos, baja producción de leche y los problemas reproductivos en los hatos. 2.2 Justificación En Colombia la situación de la tricomoniasis bovina es incierta y la mayoría de los estudios realizados hacen referencia a la prevalencia de otras enfermedades reproductivas como Brucelosis, leptospirosis, campylobacteriosis, diarrea viral bovina (DVB) y rinotraqueítis infecciosa bovina (IBR), aun cuando ésta es una enfermedad que figura en la lista B de la OIE. La ganadería intensiva manejada en las zonas de producción lechera de la sabana de Bogotá, utiliza principalmente la inseminación artificial como método reproductivo, lo cual se cree que ha disminuido sustancialmente la prevalencia de las enfermedades venéreas como la tricomoniasis, sin embargo, Trichomonas foetus puede sobrevivir en el semen congelado, lo que hace que este método no sea del todo útil para evitar su trasmisión. Por esta razón se propone como una aproximación inicial al problema, establecer la presencia de la tricomoniasis bovina en un hato lechero de la Sabana de Bogotá, para determinar el estado sanitario de los animales frente a este agente patógeno. 3. MARCO TEÓRICO El aborto se define como la pérdida del producto de la concepción a partir del periodo fetal (42 días) y hasta antes de los 260 días de gestación (Rivera y Zuñiga 2004). El aborto bovino es un factor limitante en el desarrollo de la industria ganadera en todos los países, por el impacto negativo que conlleva a la disminución en el número de animales con potencial para reemplazo y la reducción en la producción de leche, además del incremento de los costos por tratamientos, inseminación artificial y descarte de animales (Gädicke y Monti 2008); los abortos pueden presentarse de forma esporádica o en brotes, y su origen puede ser no infeccioso o infeccioso, siendo este último, el resultado de la infección de la hembra que llega al feto por vías como la circulatoria; los agentes causales de aborto en bovinos más comunes son IBR, DVB, Brucella abortus, Campylobacter foetus, Leptospira interrogans serovar Harjo y Pomona, Listeria monocytogenes, Clamidia psittaci, Corynebacterium pyogenes (Actinomyces pyogenes), Mycoplasma agalactiae, Trichomonas foetus, Neospora caninum, Aspergillus sp, Mucor sp y Rhizopus sp (Villa 2003). 3.1. Abortos por Trichomonas foetus 3.1.1 Taxonomía Trichomonas foetus o Tritrichomonas foetus, es el agente causal de la tricomoniasis o aborto tricomoniásico (Quiroz 1994), esta es una enfermedad venérea de carácter enzoótico que invade el tracto reproductivo del Ganado (BonDurant 2007). Este protozoo fue observado por primera vez por Künstler en 1888 y Mazzanti en 1900, sin embargo el nombre de Trichomonas foetus fue dado por Riedmüller en 1928, y en 1933 fue transferido al género Tritrichomonas por Wenrich y Emmerson (Tachezy et al. 2002) Trichomonas foetus está incluido en la familia Trichomonadidae, subfamilia Tritrichomonadinae, genero Trichomonas, especie foetus (Cordero del Campillo et al. 2007). 3.1.2 Características generales Trichomonas es un protozoo flagelado de aspecto piriforme que mide entre 8‐18 x 4‐9 µm, posee cuatro flagelos, tres de ellos salen de la parte anterior y miden entre 11 a 17 µm de largo y el cuarto se dirige a la parte posterior y es de 16 µm además está asociado con la membrana ondulante como se observa en la figura 1 (Borchert. 1981). En condiciones normales y a temperatura de 37°C es muy móvil (Quiroz 1994); las Trichomonas son microorganismos capaces de adaptarse a 2 vivir en condiciones de anaerobiosis o microaerofilia (Campero y Cobo 2006). Su forma de alimentación se realiza por fagocitosis o pinocitosis, y su fuente de energía se obtiene por catabolismo anaeróbico de los carbohidratos (Belding 1942); la reproducción de Trichomonas foetus es asexual, realizándose por fisión binaria longitudinal (Consort et al. 2002). Figura 1: Caracteristicas morfológicas de Tritrichomonas foetus, 930 x (af: flagelo anterior, ax: axostilo, bl: blefaroplasto, c: cuerpo basal, n: nucleo, pf: flagelos posteriores, um: membrana ondulante. Tomado de Lun y Gajadhar 1999 3.1.3 Epidemiología Trichomonas es transmitido durante la copula o monta de un macho infectado a una hembra susceptible; los toros constituyen el reservorio principal de la enfermedad ya que tienden a ser portadores a largo plazo (Yule et al. 1989). Sin embargo, puede difundirse a través de la inseminación artificial, por la capacidad del protozoo de permanecer viable en el semen congelado que fue contaminado con liquido prepucial durante la colecta (Bowman 1999; Campero y Cobo 2006); en las regiones donde la enfermedad es endémica, la transmisión mecánica por instrumentos contaminados, semen o exámenes ginecológicos puede ocurrir ( Rae y Crews 2006). La prevalencia de T. foetus en países como Estados Unidos es de 30.4 %, en Argentina de 28%, en Australia de 65.6% y en España de 37% (Mendoza et al. 2008); en Colombia los datos sobre la prevalencia establecidos por Griffiths et al en 1982 que evaluaban ocho regiones de producción lechera a lo largo del país, determinaba que el 18.4% de los hatos estaban infectados con T. foetus Algunos de los factores que influyen en la epidemiología son el número de intercambios sexuales por individuo, la presencia de animales de mayor edad (Dargatz et al. 1985) los portadores asintomáticos y la persistencia de la infección, pues no hay inmunidad entre periodos pos infección, además la presencia de al menos 1 toro positivo para Trichomonas foetus aumenta el riesgo cuatro veces más de presentar tricomoniasis en el hato (Mardones et al. 2008). 3.1.4 Patogénesis El ciclo biológico del parasito es directo y no posee huéspedes intermediarios (Ottea et al. 1995); su huésped definitivo es el bovino (Bos taurus y Bos indicus) en el cual suele localizarse en el tracto genital colonizando de forma ascendente la vagina, el cuello, los pliegues del cérvix, el útero, el liquido amniótico y las trompas uterinas en las hembras, mientras que en los machos se localiza en la superficie epitelial del pene, donde se estabiliza como una infección crónica asintomática (Parker et al. 1999). Este parásito no tiene carácter invasivo, se localiza en la superficie de la mucosa, en las secreciones y en la luz glandular de los órganos sexuales masculinos y femeninos (Borchert 1981). Entre los mecanismos de patogenicidad, la adhesión de T. foetus a la célula epitelial del tracto genital de la hembra bovina es fundamental para el establecimiento de la infección que se inicia 3 mediante el flagelo posterior; la adhesina Tf 190 ubicada en la superficie del patógeno favorece la adhesión y citotoxicidad hacia la célula hospedadora; el poder invasivo y la selectividad de T. foetus hacia las células huésped están determinados por glicoconjugados de la superficie del parásito y la matriz extracelular con las lectinas del protozoo, conocido todo el complejo como adhesinas (Kucknoor et al. 2005). Trichomonas también cuenta con endoenzimas, exoenzimas y cisteína proteinasa extracelular que favorece la invasión por su capacidad para desintegrar epitelios, enzimas celulares y fibronectinas; la cisteina proteinasa degrada isotipos de IgG, especialmente IgG2 y un componente del complemento (C3), ambos presentes en las secreciones del tracto reproductivo y son importantes dentro de los mecanismos de defensa del bovino frente a organismos patógenos extracelulares, esta acción lítica del protozoo es un mecanismo de evasión hacia el sistema inmune(Cobo y Campero 2002). La actividad citotóxica de Trichomonas foetus es un fenómeno dependiente de contacto celular, el cual incluye glicosidasas, que son liberadas en el espacio extracelular y proteasas tanto extracelulares como intracelulares, que están directamente relacionadas con la degradación de la matriz extracelular; la citoadherencia no es un prerrequisito para la citotoxicidad pero juega un papel importante sobre los efectos patogénicos en las células epiteliales vaginales, causando su destrucción y muerte por apoptosis (Da Rocha et al. 2005), lo que beneficia al parásito, debido a que se limita la respuesta inflamatoria del huésped porque las células apoptóticas son eliminadas antes de lisarse y de liberar su contenido que es el inductor de la respuesta inflamatoria, y al huésped, porque al no desatarse la respuesta se mantiene íntegra la barrera epitelial de la vagina (Singh et al. 2004). Durante el estro, aumenta la queratinización de las células del epitelio de la vagina, favoreciendo la adherencia del parásito en el estado inicial de colonización, por lo tanto se evidencia una influencia de estrógenos que eleva los niveles de glicoproteínas en el epitelio celular favoreciendo la instauración del patógeno e incluso afectando los mecanismos de defensa del huésped (Soto et al. 2005); la colonización del epitelio vaginal también es pH dependiente, dándose la máxima adhesión del patógeno a las células cuando se alcanza un pH de 6‐7.5 (Corbeil et al. 1989). 3.1.5 Signos y Síntomas Debido a que las hembras contraen la infección al aparearse, sufren de una vaginitis catarral, causada por la multiplicación activa del parásito que dura entre 40 y 80 días luego de la infección (Quiroz 1994) la vaginitis desaparece cuando los microorganismos se alojan en el útero (25 días post infección) donde llegan a causar endometritis, la tricomoniasis bovina se caracteriza por infertilidad transitoria de las hembras, siendo susceptibles todos los animales sexualmente maduros. Las principales manifestaciones son abortos, repeticiones de celo, disminución del porcentaje de preñez y presencia de piómetras (por maceración fetal)(Rossanigo 1998). Los abortos suelen presentarse antes del quinto mes de gestación (entre el segundo y el cuarto mes); si se presentan antes de los 90 días raramente se observan piómetra y repetición de estro (Rebhun 1999); los fetos poseen los parásitos en el contenido abomasal, la placenta se muestra engrosada, con un exudado blanquecino y con signos de hemorragias y necrosis (Doxey 1983). 4 3.1.6 Diagnóstico La remisión de las muestras junto a la historia y datos del hato son fundamentales para el diagnóstico, aunque a veces esto último no se tiene y solo se cuenta con el producto final: la hembra vacía o la muerte del embrión o feto. Entre los aspectos que se deben tener en cuenta están el número de animales afectados, edad, sexo, condición corporal, cambios de alimentación, problemas reproductivos, examen genital y signos en otros órganos (Jorge et al, 2007). El diagnóstico presuntivo de tricomoniasis se basa en la historia clínica, síntomas de aborto prematuro o ciclos de celo irregulares. La confirmación depende de la demostración de los microorganismos en el líquido placentario, el contenido estomacal de los fetos abortados, los lavados uterinos, el flujo piometral o el moco vaginal (Manual OIE. 2004). En los rebaños contaminados, las muestras de elección para el diagnóstico son los lavados prepuciales o vaginale; evitando la contaminación fecal, para no confundir con protozoos intestinales (Manual OIE. 2004). En las hembras, un muestreo de 10‐ 20 % de los animales del hato permitirá registrar datos de valor para el diagnóstico de la enfermedad venérea, siempre y cuando los muestreos se realicen en épocas poco distantes del retiro del servicio del toro (no más de 4 meses). Uno de los procedimientos para la evaluación del moco vaginal es la obtención de lavados uterinos; inicialmente se debe realizar una limpieza de la vulva eliminando heces sin usar jabón o productos antisépticos, solo agua, para luego introducir un catéter de 50cm de largo y 10 mm de grosor por la vagina hasta el cuello uterino con ayuda de un estilete; con una jeringa adherida al catéter, adicionar solución salina y con ella misma succionar el líquido a medida que se va retirando el catéter o hasta obtener aproximadamente 5 cm de muestra en la jeringa, el cual debe ser llevado a un frasco previamente rotulado y con solución de lactato de Ringer para su transporte al laboratorio ( Rodriguez y Cob, 1999). El muestreo de los machos se debe realizar antes y después del servicio, dos muestreos cada vez con intervalo de tiempo de 15 días (Jacobo et al. 2007) mediante la toma de muestra prepucial considerando que el número de muestreos a realizar en los toros tiene mucho que ver con los antecedentes sanitarios y reproductivos de todos los machos (Catena 1999). El transporte de las muestras debe ser realizado en medio Winters o solución salina tamponada con suero fetal bovino al 5% y leche descremada con o sin antibióticos o en el sistema InPouch TV o lactato de ringer (Catena 1999) la temperatura óptima de transporte es a temperatura ambiente, pero si se deben conservar a temperaturas bajas, deben ser incubadas a 37ºC al llegar al laboratorio (Manual OIE. 2004) Cuando los microorganismos son demasiado escasos para una detección directa es necesario el cultivo en medios como método gold Standard utilizando medio CPLM (cisteína/peptona/infusión de hígado y maltosa), medio BGPS (extracto de carne/glucosa/peptona y suero), medio de Clausen (Neopeptna‐Lemco‐extracto de hígado y glucosa), medio Diamond para Trichomonas, medio Oxoid para Trichomonas y los sistemas de cultivo comerciales (Grahn et al. 2005); el medio base para Trichomonas foetus es un medio líquido muy rico en aminoácidos, sales minerales y glucosa. (Agredo 1961) En los medios de cultivo, las muestras deben incubarse a 36 ± 1ºC, con una concentración de CO2 de 5 a 7 %, y a una humedad de 80 a 85% por un período de 5 días (Gelbart et al. 1990); la evaluación 5 directa de las muestras de lavados se hace en el microscopio de campo oscuro para identificar movilidad de las Trichomonas, con el fin de dar un resultado positivo (Levi et al. 1997). El examen directo, que consiste en realizar un frotis de los sedimentos obtenidos al centrifugar, puede ser coloreado con varias técnicas entre las que se encuentran coloraciones húmedas (azul de lactofenol), coloración de Gram, coloración de Wright, coloración de Zielh neelsen y coloración giemsa (Salcedo 2004). Los ensayos moleculares basados en la amplificación por PCR, son herramientas post cultivo que se usan para la correcta detección del parásito. Este ensayo usa variantes de tamaño en los ITS1 (espaciadores internos de transcripción) contenidos entre las subunidades 18S y 5.8S del rRNA lo que permite hallar los polimorfismos entre los genomas e identifica el agente causal de la infección por Trichomonas, diferenciándola de posibles contaminaciones con Trichomonas intestinales o fecales no patógenas (Tetratrichomonas spp), que en pruebas de cultivo llevan a falsos positivos (Lun et al.2005) 3.1.7 Tratamiento, Prevención y Control No existe un tratamiento eficiente para la tricomoniasis (Stoltenow y Dyer 2007); sin embargo, el manejo de Trichomonas en un hato puede considerarse de dos maneras: prevención y control: la prevención con el fin de mantener la enfermedad fuera del hato y el control para tratar de minimizar el impacto de la enfermedad en el rebaño. Entre las medidas preventivas está el introducir solo animales certificados libres de la enfermedad y la abolición en lo posible de pastoreos comunales (Thomas y Harmon 1994). Como medidas de control, hay dos principios definidos para la tricomoniasis que son: 1. Mantener a las hembras susceptibles apartadas de los toros infectados y 2. Mantener a los toros susceptibles alejados de las vacas infectadas (Bartlett 1947). El objetivo de la vacunación contra T. foetus en vacas es evitar la endometritis y placentitis, las cuales ocasionan infertilidad y pérdida de la preñez, activando la respuesta inmune antes de que sea causado el daño al feto (Da Rocha et al. 2005). Las vacunas de células completas que se producen cultivando T. foetus en medio modificado de Diamond y congelando el cultivo a –20ºC durante 60 minutos, han mostrado ofrecer protección moderada y se encuentran disponibles comercialmente como bacterina monovalente o vacuna polivalente que también contiene Campylobacter y Leptospira spp (Vacuna CL) (Catena 1999). 3.2. Flora bacteriana acompañante Durante los periodos de gestación y parto, el cuello uterino y el útero no se encuentran totalmente estériles debido a la presencia de microorganismos saprófitos; estos pueden alterar el útero llegando a producir inflamaciones e infecciones que hacen necesario su adecuado diagnóstico en un período de tiempo corto para prevenir problemas reproductivos (Fernández et al 2006). La flora acompañante del tracto genital se puede clasificar principalmente en tres grupos: bacterias Gram positivas, bacterias Gram negativas y bacilos esporulados (Méndez 2008). Las bacterias Gram positivas representantes de la flora genital, agrupan los géneros Staphylococcus spp, Streptococcus spp, Lactobacillus spp, Enterococcus spp, Corynebacterium spp, Mycoplasma spp y Arcanobacterium spp (Méndez 2008). Por otro lado el grupo de bacterias Gram negativas está conformado por los géneros Pseudomonas spp, Shigella spp, E. coli, Klebsiella spp y Proteus spp (Méndez 2008). 6 El grupo de los bacilos esporulados está constituido por los géneros Bacillus spp y Clostridium spp, las esporas que forman este grupo de bacterias, poseen una elevada resistencia a los diversos cambios de su entorno, como la desecación debido a que está constituida por dipicolinato de calcio (Moat y Foster 1988). En Argentina se ha encontrado Clostridium spp, a partir de aislado de lavados uterinos en vacas, con técnicas de cultivo para microorganismos anaerobios, pero en investigaciones realizadas en Estados Unidos no se ha podido reportar este bacilo debido a su estricta naturaleza anaeróbica (Palmer 2008). Los problemas reproductivos que se asocian con esta bacteria son la metritis tóxica, gangrenosa e incluso puede llegar a generar la muerte del animal, por lo que se hace necesario su diagnóstico a tiempo (Palmer 2007). 3.2.1 Bacterias Gram positivas • Streptococcus spp: este grupo de bacterias esféricas que se agrupan en pares o cadenas, anaerobios facultativos, no formadores de esporas, catalasa negativos e inmóviles, pertenecen a la familia Streptococcaceae. El parámetro más importante para su clasificación es el patrón de hemólisis en agar sangre, además de su composición antigénica, sus características de crecimiento, sus reacciones bioquímicas y su análisis genético, debido a que existen más de 30 especies en este género (Rodríguez 2002). Los componentes celulares más importantes para su interacción con el huésped y su medio, son la cápsula, que impide la fagocitosis por leucocitos y macrófagos, y la proteína F que es uno de los principales factores de virulencia que le atribuyen adherencia y colonización al huésped (Rodríguez 2002). Los productos extracelulares más estudiados en este grupo de bacterias son las hemolisinas que se clasifican como O y S, la O tiene un efecto lítico sobre las células, además de ser tóxica para algunas células, mientras que la S lisa los leucocitos, plaquetas y organelos celulares. La exotoxina pirogénica (SPE) es otro de los productos extracelulares importantes en este grupo de bacterias, debido a que actúa como un súper antígeno, estimulando de modo intensivo e inespecífico el sistema inmune (Rodríguez 2002). Streptococcus spp, se encuentra relacionada a problemas reproductivos en bovinos, entre los más destacados están el aborto, cervicitis y metritis; las enfermedades reproductivas postparto causadas por esta bacteria comprometen la eficiencia reproductiva, debido a la persistencia de una inflamación moderada de las paredes musculares del útero o el retraso de la involución uterina; las pérdidas a nivel reproductivo son debido al aumento en los días abiertos, incremento de los servicios por concepción o a una falla reproductiva (Rodríguez, 2000; Fernández et al 2006; Palmer 2007 y Palmer 2008). La identificación de esta bacteria en el laboratorio, inicia con su caracterización morfológica macroscópica y microscópica a partir de un cultivo puro, luego se procede con las pruebas bioquímicas como catalasa, oxidasa, urea y fermentación de lactosa, trealosa, sorbitol, entre otras, además de la prueba de CAMP y pruebas de hemólisis del Agar sangre (Rodríguez 2002), donde se encuentran clasificados en β‐hemolíticos (hemolisis completa de los glóbulos rojos viéndose iun halo translucido), α hemolíticos (abren los poros de los glóbulos rojos liberando la hemoglobina, exponiendo el grupo hemo al oxigeno y transformándose en biliverdina dando su color verde característico) y la γ hemolíticos (no se observa daño ni lisis de los glóbulos rojos) (Méndez, 2008). • Actinomyces pyogenes (Corynebacterium spp): Son bacilos pleomorfos, que no producen endosporas y no son acido‐alcohol resistentes, son bacterias inmóviles, catalasa negativa, que se agrupan conformando empalizadas o letras chinas. Este género reúne bacterias que son aeróbicas 7 estrictas o anaeróbicas facultativas (Vadillo, et al 2002). Considerado un habitante normal de mucosas nasal, conjuntiva, vaginal y prepucial en los rumiantes (Araínga, et al 2003). En los estudios realizados en un hato lechero del valle de Cieneguilla (Lima‐Perú) no se encontró la bacteria en fetos abortados o placenta, pero se ha reportado que llega al útero vía hematógena produciendo placentitis supurativa y causando la muerte del feto por la falta de oxígeno y por inanición debido a la obstrucción de la placenta; los abortos pueden presentarse en cualquier estadio de gestación, pero son esporádicos (Araínga, et al 2003). La identificación de este grupo de bacterias se puede realizar mediante el cultivo en agar nutritivo o en medio de cultivo con sangre a 37°C, pero no en medios selectivos para enterobacterias. El primer sistema de identificación es la fenotípica, mediante la realización de un API como la reducción de nitratos, hidrólisis de urea y esculina, la producción de ácidos a partir de glucosa, maltosa y sacarosa, además de la catalasa y la oxidasa; otro método rápido y efectivo es la evaluación de la actividad enzimática y la utilización de hidratos de carbono. También se ha implementado el uso de un análisis quimiotaxonómico como lo es el análisis de ácidos grasos procedentes del metabolismo de la glucosa, perfiles de ácidos grasos celulares, ácidos micólicos y lípidos polares o la identificación genotípica por medio de secuenciación de genes del RNA (Vadillo, et al 2002). Estudios realizados en Iraq, establecieron la importancia del adecuado diagnóstico de este microorganismo, debido a que es capaz de establecerse hasta 21 días post parto, generando una severa endometritis, lo que usualmente termina con infertilidad; además se reportó que hasta el 69% de las vacas que presentan infecciones uterinas albergan a esta bacteria en cultivos puros (Azawi, 2008). En Cuba se encontró que es una de las bacterias con un alto porcentaje de aislamiento (83.5%) en vacas que presentaban exudados, endometritis y lesiones inflamatorias siendo el mayor agente causal de problemas reproductivos (Fernández et al 2006). • Lactobacillus spp: Esta bacteria de la familia Lactobacillacae, posee una morfología variable encontrando desde cocobacilos hasta bacilos largos, delgados y ocasionalmente curvos, esto depende del tiempo, composición y tensión de oxígeno en el medio de cultivo. Lactobacillus spp, no genera esporas y son catalasa negativa, su metabolismo se caracteriza por ser fermentativo y la producción de ácido láctico (Vadillo, et al 2002). Uno de los parámetros de clasificación de estas bacterias es su metabolismo categorizando dos grupos, los homofermentativos son los que al fermentar las hexosas tiene como producto el ácido láctico y los heterofermentativos además de producir el ácido láctico, producen CO2 y etanol o ácido acético (Vadillo, et al 2002). Los Lactobacillus spp, son microflora bacteriana normal en la cavidad oral, intestinal y vaginal, y algunas especies crecen generando un beneficio para su hospedero, debido a que la producción de ácido láctico reduce el pH , contribuyendo a la disminución o crecimiento retrasado de otro tipo de flora posiblemente patógena para el hospedero (Vadillo, et al 2002, Fernández et al 2006). Estas bacterias crecen en medios nutritivos y en agar sangre, Su identificación al igual que para otras bacterias se debe realizar por medio de caracterización macroscópica y microscópica, además de bioquímicas de diversos azúcares para evaluar su capacidad fermentativa (Vadillo, et al 2002). 8 En Cuba, Estados Unidos y Colombia, se confirmó la presencia del Lactobacillus spp como una bacteria de la microflora bacteriana cervical y uterina en vacas, generando beneficios a su huésped, debido a la producción del acido láctico con el cual puede inhibir la flora patógena, por lo cual no se ha encontrado relacionado a procesos patológicos en bovinos (Fernández et al 2006). 3.2.2 Bacterias Gram negativas • Klebsiella spp: son bacilos cortos, no esporulados, capsulados e inmóviles, clasificados dentro de la familia Enterobacteriaceae. Los factores de virulencia que caracterizan a este grupo de bacterias son la cápsula de polisacáridos (antígeno K) que le confiere al microorganismo propiedades antifagocíticas, la endotoxina O y la ciliar que es esencial para la interacción y adaptación al medio de su huésped (Stanchi et al 2007, Vadillo, et al 2002). Esta bacteria se identifica mediante observación macroscópica y microscópica, confirmando el diagnóstico con pruebas bioquímicas como la fermentación de lactosa (+), la movilidad de la bacteria (‐), la producción de ureasa (‐) y la prueba indol (‐) para llegar a una clasificación de especies (Stanchi et al 2007). En un estudio realizado en Montería, Colombia se identificó a Klebsiella spp como una bacteria que hace parte de la flora normal en vacas vírgenes, ya que no se encontró relacionada a la monta natural o a la inseminación artificial, ni a patología del tracto genital de bovinos (González et al 2007). En Cuba se estudiaron 104 vacas que presentaban secreciones cervicales 15 días antes del parto, donde se quería determinar la microbiota bacteriana presente allí, encontrando Klebsiella aerogenes en un porcentaje bajo (6.3%) (Fernández et al 2006). En una investigación realizada por Méndez 2008 en la Pontificia Universidad Javeriana de Bogotá se determinó y confirmó, que el porcentaje de prevalencia para Klebsiella spp en el útero es bajo (9.52%), y se concluyó que no es un patógeno asociado con problemas reproductivos, simplemente es un acompañante bacteriano normal en el útero de vacas donadoras de embriones. • Pseudomonas spp: este grupo de bacterias pertenece a la familia Pseudomonadaceae, siendo bacilos aeróbicos, no fermentadores, catalasa positivos, móviles y en su gran mayoría oxidasa positiva. Casi todas sus especies pueden degradar la glucosa por vía oxidativa, además produce pigmentos como la pioverdina, piorrubina y piomelanina siendo este uno de los aspectos más característicos de este grupo. Aunque algunas de estas especies pueden crecer a 4°C, se ha encontrado que su temperatura óptima de crecimiento es de 30 a 37°C (Goméz et al 1998). Los factores de virulencia más importantes en este grupo de bacterias son las fimbrias para adherencia, la cápsula de polisacáridos y la producción de enzimas como las proteasas que contribuyen a la destrucción tisular (Soberón 2005). Pseudomonas spp es una bacteria que se transmite por medio de la monta natural o de la inseminación artificial o por la contaminación del ambiente donde se encuentra el animal, causando infecciones como metritis séptica y que en muchos casos se asocia a la retención de las membranas fetales (Palmer 2007,González et al 2007, Méndez 2008). La identificación y clasificación de este microorganismo, se realiza por la producción de pigmentos y a su olor característico; las observaciones macroscópicas pueden variar, siendo colonias puntiformes, rugosas, mucosas y hasta metálicas, por lo que se hace necesario realizar pruebas 9 bioquímicas (fermentación de azucares como lactosa, glucosa, trealosa, manitol, sorbitol y otras como lactosa) para la confirmación de su clasificación; algunas de las cepas de Pseudomonas spp, poseen resistencia a antibióticos en especial a los betalactámicos (Goméz et al 1998). • E. coli: esta bacteria hace parte de la familia Enterobacteriaceae; son bacilos no esporulados, móviles con flagelos perítricos, aerobio o anaerobio facultativo, además fermenta la glucosa u otros carbohidratos, catalasa positivos, oxidasa negativos y reductores de nitratos (Rodríguez, 2004). E. coli se clasifica según su poder patógeno en enteropatogénica produciendo lesión histopatológica por la adherencia célular y por la producción de toxinas que pueden llegar a generar diarrea, por otro lado está la enteroinvasiva que también genera problemas intestinales pero más complicados, debido a que invade las células epiteliales del intestino generando una disentería leve y la enterohemorrágica o verotoxigénica, presenta un desorden multisistémico caracterizado por presentar insuficiencia renal aguda y anemia hemolítica (Rodríguez, 2004). La identificación de esta bacteria se debe hacer a nivel macroscópico y microscópico, teniendo como base un aislamiento adecuado de la presunta cepa, además se debe corroborar con las pruebas bioquímicas de rutina para la identificación de la bacteria. La identificación por medio de pruebas moleculares es muy utilizada en la actualidad por la alta sensibilidad, en general en la identificación de cualquier microorganismo, además tienen una sensibilidad alta para diagnóstico veterinario (Rodríguez 2004). Esta bacteria es un contaminante no muy frecuente del tracto genital en vacas, encontrándose unos días después del parto y comprendiendo hasta el 36% de bacterias aisladas encontrando una relación directa con los aislamientos a partir de las muestras de prepucio. En Argentina se reportó que el porcentaje de aislamiento de esta bacteria es del 29% en vacas que presentan síntomas como la metritis y donde las descargas uterinas manifestaron un olor fétido (Palmer 2007). • • • 4. OBJETIVOS 4.1. Objetivo general Determinar la presencia de Trichomonas foetus y de flora bacteriana uterina en bovinos con problemas reproductivos de un hato lechero de la sabana de Bogotá a partir de lavados uterinos. 4.2. Objetivos específicos Obtener lavados uterinos de vacas de un hato lechero con historia de problemas reproductivos asociados a Trichomonas foetus Evaluar el porcentaje de presentación de Trichomonas foetus en muestras de lavados uterinos recolectadas en campo. Determinar la presencia de flora bacteriana acompañante 5. MATERIALES Y METODOS 5.1. Diseño de la investigación Diseño descriptivo de corte transversal prospectivo 5.2. Población de Estudio y muestra El área de estudio fue un hato lechero en la Sabana de Bogotá ubicado en el municipio de Sibaté, con una población de 322 vacas. Los parámetros de inclusión fueron 3: muestrear vacas vacías; que no hayan recibido tratamiento antimicrobiano 15 días antes del muestreo y que presentaran 10 historia de problemas reproductivos. Con base en los criterios de inclusión, se muestreo el 3% de los animales representados en diez muestras de lavados uterinos. 5.3. Toma de muestras Se realizaron diez lavados uterinos, los cuales fueron obtenidos mediante la infusión de 40 a 50mL de solución salina fisiológica dentro del cuerpo uterino con ayuda de una jeringa unida a una sonda o catéter; el útero fue masajeado y retraído para recoger el líquido, mediante aspiración con la jeringa, y se transfirió a un tubo cónico de 50mL, rotulado con número del animal y el nombre de la finca (Kasimanickam et al, 2005). 5.4. Transporte de las muestras Las muestras fueron transportadas al laboratorio para su procesamiento en un periodo no superior a 6 horas a temperatura ambiente para garantizar la viabilidad de la flora bacteriana acompañante y de Trichomonas foetus. 5.5 Procesamiento de las muestras 5.5.1. Evaluación macroscópica Se realizó la caracterización macroscópica de los lavados uterinos, determinando apariencia, color y contenido de sedimento. 5.5.2 Cultivo de Trichomonas foetus Los tubos cónicos de 50mL que contenían las muestras de los lavados, se llevaron a centrifugar por 10 minutos a 1000rpm para concentrar los protozoos y evitar la lisis celular; luego de centrifugar se pasaron 2ml del sedimento de cada muestra a tubos cónicos de 15ml con 10ml de medio Trichomonas (anexo # 4)el cual fue llevado a incubación por 8 días a 37°C y posteriormente fueron evaluados por microscopia de campo oscuro (Kasimanickam et al, 2005) 5.5.3 Evaluación citológica Se tomaron 100µl del sedimento para la realización de extendidos que fueron coloreados con tinción de Gram y Wright con el fin de observar morfologías bacterianas y protozoarias, además de determinar respuesta inflamatoria y presencia de células de descamación epitelial. 5.5.4 Evaluación de Trichomonas foetus, por medio del campo oscuro y tinción El diagnóstico de Trichomonas foetus se realizó por la detección directa al microscopio de campo oscuro bajo el objetivo 10 X y 40X con el fin de identificar las Trichomonas; estas observaciones fueron realizadas el día del muestreo y a los días 8 y 15 después de sembrar en el medio Trichomonas (levi et al; 1997). Las láminas positivas para el protozoo, se dejaron secar para realizar coloraciones con el fin de identificar la morfología del parásito. A las 6 muestras positivas para T. foetus se les realizo dos tinciones, la primera consistió en la fijación de una gota de sedimento con una gota de lugol, los cuales se dejaron secar al ambiente para luego realizar la coloración de Wright como técnica modificada de la usada por Lun y Dajadhar (1999) y la segunda se realizó adicionando una gota de muestra y una de lugol para observar al microscopio. 11 5.5.5 Flora Bacteriana Acompañante 100µl del sedimento de cada lavado uterino anteriormente obtenido, fueron sembrado en agar sangre por agotamiento e incubados por 24h a 37°C. Post incubación, se determinó el tipo de crecimiento bacteriano evaluando sus características macroscópicas y microscópicas por coloración de Gram; además se realizó la identificación de género y especie por medio de pruebas bioquímicas (anexo # 3) 5.5.5.1 Pruebas de susceptibilidad: La técnica de kirby Bauer fue realizada con el fin de establecer patrones de sensibilidad y resistencia a antibióticos que permitieran confirmar la clasificación de las cepas bacterianas aisladas. 6. RESULTADOS Y DISCUSIÓN 6.1 Evaluación macroscópica Los lavados uterinos obtenidos presentaban diversas apariencias macroscópicas, que se describen a continuación: 4 muestras totalmente translúcidas y sin sedimento, una muestra con aspecto turbio y con sedimento, y 5 muestras con secreción sanguinolenta (figura 2A), una de las cuales presentaba un contenido mucopurulento como se observa en la figura 2B. A B Figura 2: A muestra de lavado uterino con secreción sanguinolenta y B muestra de lavado uterino con secreción mucopurulento 6.2 Evaluación citológica La evaluación microscópica por las coloraciones de Gram y de Wright es de gran utilidad para la identificación de una respuesta inflamatoria, de células epiteliales de descamación uterina y de flora bacteriana acompañante en las muestras de los lavados uterinos, además de evaluar citológicamente cada una de ellas. En la coloración de Gram se encontró en 8 muestras (80%) ausencia total de bacterias, mientras que en las dos muestras restantes (20%) se encontraron bacilos Gram positivos y cocos Gram positivos como se observa en la grafica 1 (anexo 1) En los lavados translucidos y sin sedimentos, no se encontró evidencia de células de descamación uterina ni de respuesta inflamatoria y los lavados con secreciones sanguinolentas presentaron células intermedias de descamación uterina. 12 (BG‐ bacilos Gram negativos) (BG+ bacilos Gram positivos) (CG‐ coco Gram negativos) (CG+ cocos Gram positivos) Gráfica 1: Evaluación microscópica de los sedimentos de lavados uterinos del hato lechero con tinción de Gram (n=10) En la coloración de Wright se evidenció una respuesta inflamatoria mediada por polimorfonucleares (PMN) en un 20% (n=2) de las muestras analizadas, mientras que la presencia de células epiteliales intermedias de descamación uterina correspondió al 40% (n=4), en el 40% restante no se evidenció ningún tipo de células de tejido epitelial uterino o de respuesta inflamatoria como se observa en la grafica 2 (anexo 1). (CEDU células de descamación uterina) (RI respuesta inflamatoria mediada por PMN) (A. PMN‐MN ausencia) Gráfica 2: Evaluación citológica de los sedimentos de lavados uterinos del hato lechero con la tinción Wright (n=10) Las células epiteliales de descamación uterina en este estudio se presentaron de forma leve, lo cual puede ocurre de manera normal en los lavados uterinos en algunas fases del ciclo reproductivo de las hembras como lo es el metaestro, donde el animal ovula normalmente presentando un bajo efecto de estrógenos y altos niveles de progesterona producida en el cuerpo lúteo lo que lleva a un aumento en la descamación celular; pero a su vez si se observa en gran proporción en el campo del microscopio, se deben evaluar otros parámetros como una posible vulvitis, la cual es una reacción post parto relacionada con infecciones venéreas (Rimbaud, 2005); la respuesta inflamatoria es uno de los parámetros de mayor importancia al evaluar el estado inmunológico del animal frente a una enfermedad uterina, en este estudio la respuesta inflamatoria mediada por polimorfonucleares se presento de forma leva a moderada, lo cual se relacionó con lo encontrado en los aislamientos microbianos de los lavados uterinos donde se determino la presencia de patógenos uterinos como Streptococcus α y β hemolíticos y Actinomyces pyogenes. 13 6.3 Cultivo y evaluación microscópica de Trichomonas foetus A partir de las técnicas de cultivo y de microscopia de campo oscuro, se logró determinar la presencia de Trichomonas foetus en 6 de las 10 muestras de lavados uterinos analizadas, lo que indica que un 60% de las muestras fueron positivas como se observa en la grafica 3. Grafica 3. Porcentaje de presencia de Trichomonas foetus (n=10) Para la determinación de la morfología, La primera coloración realizada, no permitió la visualización del protozoo, mientras que la segunda si permitió la observación, pero no mostró una definición más detallada de las estructuras morfológicas como se observa en la figura 1, por lo cual se hace necesario determinar una técnica de tinción para Trichomonas más sensible. (B) (A) (C) Figura 3:.Morfología de Trichomonas foetus observada por la metodología de impresión en fresco con lugol (A), por coloración de Wright (B‐C). La evaluación realizada el día de la obtención de las muestras de lavados uterinos, fue negativa para Trichomonas foetus, pero la evaluación de los lavados post cultivo realizada a los 8 y al los 15 días por microscopia de campo oscuro mostro una positividad de 4 y 2 muestras más respectivamente; por lo tanto, esto indica que el campo oscuro no es tan sensible como lo puede llegar a ser el cultivo, porque existe la posibilidad que la concentración del protozoo era mínima y fuera indetectable en un inicio, pero que con ayuda del medio de cultivo que favorece la reproducción de Trichomonas foetus dará positiva dentro de los 8 o 15 días post incubación. 14 El porcentaje obtenido de las 10 muestras de lavados uterinos evaluadas para Trichomonas foetus, aunque es significativamente mayor, concuerda parcialmente con las evaluaciones de secreciones vaginales y uterinos, realizadas por Corpoica en 1999 para la detección de los agentes etiológicos infectocontagiosos de la problemática de aborto e infertilidad en el ganado lechero de Nariño y Alto Putumayo, en el que se detectó una prevalencia para T. foetus del 16.7% en 115 hatos de Nariño y de 48.3% en el alto putumayo constituyéndose en el segundo microorganismo involucrado en problemas reproductivos (González y Patiño 1999). Debido a que los reportes que se obtienen sobre prevalencia de T. foetus están determinados por la evaluación de raspados prepuciales y no de lavados uterinos, los datos encontrados sobre la presencia de este microorganismo en Colombia y en otros países ganaderos del mundo, se basan en el estudio de los machos. En 1982, Griffiths y colaboradores, evaluaron en Colombia, ocho áreas productoras de leche dentro de las regiones andina, Caribe y Orinoquia, con lo cual establecieron que el 18.4% de los toros en los hatos estaban infectados con Trichomonas foetus; estos datos disminuyeron 2 años después al realizar la evaluación de los toros de 103 fincas de ocho áreas lecheras de Colombia, determinando un 13,7% de aislamiento de T. foetus (Griffiths 1984). Luego de esto, Un estudio piloto realizado en varias fincas del meta en 1991, demostró que los principales agentes causales de abortos en bovinos son Brucella abortus, Chlamydia psittaci, cinco serovariedades de Leptospira interrogans y el virus de la rinotraqueitis infecciosa bovina que son los microorganismos más buscados en las hembras, dejando la evaluación de Trichomonas foetus, Campylobacter foetus spp y Haemophilus somnus para el macho exclusivamente (Parker et al. 1999). Además de estos datos que tienen más de 10 años de realizados, no hay evidencia actual reportada por el ICA sobre la situación de la tricomoniasis bovina en Colombia durante la última década (Ica, 2007). La prevalencia de Trichomonas foetus en países como Estados Unidos es de 30.4%, en Argentina de 28%, en Australia de 65.6% y en España de 37% (Mendoza et al, 2008). Estudios realizados en España, determinaron que la prevalencia de T. foetus en machos fue del 3,6%, estos toros correspondían al 68.6% de la población de machos existentes en 350 rebaños que manejaban sistemas extensivos y con monta directa alternada con inseminación artificial, así se asumió que aproximadamente 42,5% de las hembras existentes en los hatos, estarían expuestas a un toro infectado con Trichomonas foetus (Martín et al. 1998). En Estados Unidos, se reporta que la prevalencia de T. foetus en estados del oriente está entre 4‐7%, pero en estudios efectuados en Alabama donde se evaluaron 374 toros, solo un animal fue positivo dando un 0,27% de prevalencia confirmado por técnicas moleculares como PCR (Rodning et al. 2007); en florida, se ha reportado prevalencia del 6% del protozoo en toros individuales y de 30, 4% en el rebaño por el uso de monta directa de los animales como sistema de reproducción (Rae et al. 2004); en Argentina, en estudios realizados en machos se demostró una prevalencia de 2,7% de T. foetus, en 542 toros muestreados de 44 rebaños (Rossanigo 1998). Con el fin de evaluar la autolimitación de la enfermedad, otros estudios realizados en Argentina en los que evaluaron lavados uterinos de hembras vacías y preñadas, se demostró la presencia de T. foetus en un 3,9% y 3,1% respectivamente, representando bajos niveles de prevalencia luego de 90 días de descanso sexual (Mancebo et al. 1995). Estos datos reportados sobre portadores asintomáticos y la persistencia de la infección en los hatos, además de la posibilidad de contactos sexuales espontáneos por posibles pastoreos compartidos, aumentan la exposición de las hembras a esta enfermedad, debido a que la 15 presencia de al menos un toro positivo para Trichomonas foetus aumenta cuatro veces el riesgo de presentar tricomoniasis en el hato. (Mardones et al. 2008) 6.4 Flora bacteriana acompañante La presencia de flora bacteriana acompañante se observo en el 20% de los animales muestreados, encontrando una amplia diversidad de microorganismos entre los que se aislaron bacilos Gram negativos (Klebsiella sp), bacilos Gram positivos (Lactobacillus sp y Actinomyces pyogenes) y cocos Gram positivos (Streptococcus α y β hemolíticos) como se puede apreciar en la gráfica 3 (anexo2), observándose una relación directa entre las muestras positivas para flora acompañante y la respuesta inflamatoria, ya que una reacción inflamatoria se puede dar como respuesta frente a estos agentes infecciosos. Gráfica 4: Microorganismos aislados a partir de los lavados uterinos La muestra 6 incubada en agar sangre, presentó dos tipos de bacterias Klebsiella sp y Actinomyces pyogenes, las cuales fueron identificadas por medio de aislamiento y bioquímicas; a la cepa de A. pyogenes, se le realizo un antibiograma para determinar la sensibilidad del agente a antimicrobianos en donde presentó resistencia para estreptomicina y astreonam, mientras que fue sensible para gentamicina (28mm), ampicilina (26mm), norfloxacilina (24mm) y amoxicilina con acido clavulánico (40mm). Klebsiella sp es una bacteria que se encuentran como flora habitual y por su naturaleza no causa alteraciones o problemas reproductivos (Farinati, et al 2005). Mientras que Actinomyces pyogenes ha sido muy estudiado debido a sus implicaciones en abortos en ganado lechero; esta bacteria es comúnmente encontrada en mucosas prepuciales, vaginales y en útero, pero no es usual aislarla en fetos y placenta (Araínga, et al 2003), esto se ha comprobado en estudios realizados en Colombia, como el que se hizo en Bogotá en el año 2000 por la universidad de La Salle donde se encontró a este agente patógeno como el principal causante de problemas reproductivos asociados a metritis en hatos lecheros de la Sabana de Bogotá (Gutiérrez y Fonseca, 2000) y el realizado en el año 2008 por la Pontificia Universidad Javeriana donde se relacionó con la endometritis bovina evaluados vacas donantes de embriones de fincas lecheras de la Sabana de Bogotá (Méndez 2008). En Iraq, también se encontró esta bacteria asociada con E. coli como causantes de infecciones uterinas postparto en bovinos, reportando hasta en un 64% de presencia de estas bacterias (Azawi, 2008). Una investigación hecha en Santa Clara, Cuba, demostró que A. pyogenes es un agente altamente patógeno que causa severas inflamaciones del útero y que también se encuentra en el esperma de los toros, siendo este el medio de transmisión a las hembras y causando severas inflamaciones en el útero, sin importar que sea por monta natural o inseminación artificial (Silverira y Machado, 2005). A. pyogenes, genera placentitis supurativa y además 16 afecta el porcentaje de fertilidad del animal; en el caso especifico de este estudio, en la muestra 6, la presencia de esta bacteria se puede relacionar con la baja tasa de fertilidad manifestada en sucesivas repetición de celo (Roppel y Campero, 1998); aunque esta bacteria se encontró solo en una de las muestras, se debe tener precaución con la manipulación de elementos como las mangas de palpación y demás implementos que entren en contacto directo con el conducto vaginal, para evitar que se propague en el hato y cause serios problemas reproductivos en toda la población que se encuentra allí expuesta. En la muestra 10 se aislaron 3 tipos de colonias, Streptococcus (β hemolíticos y α hemolíticos) y Lactobacillus sp, identificadas mediante aislamiento en agar sangre y bioquímicas (anexo 3). Lactobacillus sp, se considera habitante normal del útero, por lo cual no se considera como agente causal de problemas reproductivos en bovinos, mientras que Streptococcus sp es un agente infeccioso que se puede transmitir fácilmente por el material espermático, como lo reveló el estudio realizado en Santa Clara, Cuba (Silveira y Machado, 2005). Estas bacterias son causantes de infecciones uterinas, y problemas inflamatorios como la endometritis y metritis, llegando a ser en ocasiones supurativos por la asociación con otras bacterias o simplemente por la gran población de estas (Fernández et al 2006). Estos microorganismos se presentaron en el ejemplar con ID 1103, del cual se conocía su estado de parto reciente (20 días antes de la toma de los lavados uterinos) y poseía un lavado con evidencia de secreción mucopurulenta posiblemente asociada a estas bacterias, sin embargo esto no se puede asegurar completamente, porque la historia de este animal se encontraba incompleta con respecto a los periodos reproductivos y posibles anomalías presentadas en el tracto urogenital. Los hallazgos de este estudio concuerdan con investigaciones hechas en Argentina en las que se encontró Streptococcus sp en vacas lecheras con problemas de metritis, siendo este el agente causal de dicha patología en animales post parto (Palmer, 2007), en Colombia, se encontró Streptococcus α‐hemolítico en problemas de endometritis bovina, asociado a E. coli y A. pyogenes, lo cual implicaría un estudio detallado de cada una de las bacterias para encontrar el verdadero agente causal de dicha patología (Méndez 2008). Cuba, es uno de los líderes mundiales en investigación de problemas reproductivos en bovinos, allí se encontró que esta bacteria puede llegar a ser microbiota bacteriana de secreciones cérvico‐uterinas de vacas clínicamente sanas, siendo mayor su incidencia en infecciones puerperales (infecciones luego de 15 días del parto) (Fernández et al 2006). Con la presencia de estas bacterias patógenas en bovinos, se deben implementar medidas de seguridad estrictas, debido a que la población expuesta puede ser vulnerable y la distribución de cada uno de estos agentes, puede llegar a ser de gran relevancia, causando problemas reproductivos e implicando pérdidas económicas 7. CONCLUSIONES La evaluación de los lavados uterinos evidenció que una positividad del 60% para T. foetus en las muestras analizadas que representa un hallazgo significativo debido a que el hato se consideraba negativo para este agente infeccioso. En el 20% de los lavados uterinos, se evidencio la presencia de bacterias acompañantes de las cuales A. pyogenes y Streptococcus β y α hemolíticos fueron las más importantes por encontrarse asociados a problemas reproductivos como la metritis y baja fertilidad; lo cual refleja que Trichomonas foetus no es el único agente infeccioso en bovinos con problemas reproductivos en el hato y que se debe realizar un estudio más amplio para evidencia la presencia de estas bacterias patógenas. 17 8. RECOMENDACIONES La falta de información clínica de los animales muestreados, limito la correlación e interpretación de los resultados obtenidos con sus antecedentes clínicos, puesto que la finca no posee datos detallados sobre programas y fechas de vacunación, tratamientos antimicrobianos manejados, confirmaciones de preñez de los animales y problemas reproductivos padecidos; por tanto se recomienda que el hato lechero de la sabana de Bogotá, implemente un sistema adecuado de historial clínico, para garantizar el adecuado manejo y control de cada uno de los animales que allí se encuentren, donde incluya vacunas con sus fechas, problemas reproductivos, tratamientos realizados, inseminación con fecha, partos y demás consideraciones necesarias para garantizar la calidad de cada animal. Debido a que en el hato lechero muestreado se maneja la inseminación artificial como técnica de reproducción, se hace necesario la evaluación de las muestras de semen, porque el protozoo puede permanecer viable en el semen congelado que fue contaminado con liquido prepucial durante la colecta. Además, la alta prevalencia de Trichomonas foetus encontrada en 10 muestras evaluadas, sugiere la implementación de programas de prevención y control con el fin de disminuir o eliminar la diseminación de esta enfermedad dentro del hato. 18 • • • • • • • • • • • • • • • • • • • • • • • 9. BIBLIOGRAFÍA AGREDO. C. Importancia del medio de cultivo y el diagnóstico de Trichomonas. Tesis pregrado bacteriología. 1961. Pontificia universidad javeriana. Editorial Iris. Págs. 27‐28. ARAÍNGA, M; SANDOVAL, N, ZACARÍAS, E y RIVERA H. Actinomyces pyogenes causante de abortos en bovinos. Revista veterinaria del Perú; 2003.Págs. 3 AZAWI, O. Review: Postpartum uterine infection in cattle. Revista: Animal Reproduction science. Musul, Iraq; 2008. Págs. 22. BARTLETT, D. Trichomonas foetus and bovine reproduction. Am J Vet Res; 1947, 8: 343‐352. BELDING. D. text book of clinical parasitology. Págs. 72‐75. 1942 BONDURANT, R.H. Selected diseases and conditions associated with bovine conceptus loss in the first trimester. Theriogenology; 2007,68: 461–473 BORCHERT. A. Parasitología Veterinaria. 1981. Editorial Acribia Zaragoza. Págs.596‐598 BOWMAN. D. Georgis´ Parasitology for Veterinarians. 1999. Seventh edition. Págs.82‐83 CAMPERO, C y COBO. E. Tritrichomonas foetus: patogénesis de la mortalidad embrionaria/fetal, caracterización de antígenos vacúnales y respuesta inmune inducida. Revista de Medicina Veterinaria, Bs As Argentina; 2006, vol. 87: 47‐56. CATENA, M. Tritrichomoniasis y Campylobacteriosis genital bovina. Área de Enfermedades Infecciosas. Fac. de Cs. Vet‐ UNCPBA. 1999. COBO, E y CAMPERO, C. Nuevos aspectos inmunológicos y vacúnales de la tricomoniasis bovina. Revista de Medicina Veterinaria; 2002, vol. 83: 203‐208. CONSORT. K, MEYER. R LOPES. L, BENCHIMOL. M. Nucleus behavior during the closed mitosis of Tritrichomonas foetus. Biology of the Cell 94; 2002. pag 289–301 CORBEIL. L, HODGSON. J, JONES. D, CORBEIL. R, WIDDERS. P, STEPHENS. L. Adherence of Tritrichomonas foetus to Bovine Vaginal Epithelial Cells. Infection and immunity; 1989, p. 2158‐ 2165 CORDERO DEL CAMPILLO. M, ROJO VÁSQUEZ. F, MARTÍNEZ FERNÁNDEZ. A. Parasitología general. 2007. McGraw‐Hill. Págs. 363‐365 DA ROCHA. B, DE MELO‐BRAGA. M, SILVA. F. Intra‐strain clonal phenotypic variation of Tritrichomonas foetus is related to the cytotoxicity exerted by the parasite to cultured cells Parasitol Res, 2005, vol 95: 106–112 DARGATZ. D, MORTIMER. R, CHENEY. J. Bovine trichomoniasis. Compend. Contin. Educ. Pract. Vet., 1985, vol 7: SI79‐SI84 DOXEY. D. Patología Clínica y Procedimientos de Diagnóstico en Veterinaria. El manual moderno, S.A. de C.V. México, D.F. 1983. Pág: 130. 137. FARINATI, A; MORMANDI, J y TILLI, M. Infecciones en ginecología y obstetricia: del diagnostico al tratamiento. Argentina. 2005. Págs. 396 FERNÁNDEZ, A; SILVEIRA, E y LÓPEZ, O. Las infecciones uterinas en las hembras bovinas. Revista electronic de veterinaria; 2006. Santa Clara, Cuba. Págs. 39. GÄDICKE. P, MONTI. G. Epidemiological and analytical aspects of bovine abortion syndrome. Arch Med Vet; 2008. Vol 40, 223‐234 GELBART. S, THOMASON. J, OSYPOWSKI. P, KELLETT. A, JAMES. J, BROEKHUIZEN. F. Growth of Trichomonas vaginalis in Commercial Culture Media. JOURNAL OF CLINICAL MICROBIOLOGY, May 1990, Vol. 28, No. 5, p. 962‐964 GOMÉZ, C; MATIA, C; CURIEL, G y DÍAS, P. Infecciones por Pseudomonas spp. Unidad de enfermedades infecciosas. Hospital Universitario Virgen del Rocío. Sevilla, España. 1998. Págs 5 GONZÁLEZ. H, PATIÑO. R. Principales agentes infectocontagiosos del aborto e infertilidad en el ganado lechero de Nariño y alto Putumayo. Corporación Colombiana de Investigación 19 • • • • • • • • • • • • • • • • • • • Agropecuaria Regional No. 5. Programa Nacional de Transferencia de Tecnología PRONATTA. Ministerio de Agricultura y Desarrollo Rural. 1999. GONZÁLEZ, M; RÍOS, M y MATTAR, S. Prevalencia de bacterias asociadas a la infertilidad infecciosa en bovinos de Montería, Colombia. 2007. Págns 8. GRAHN R.A, BONDURANT R.H., VAN HOOSEAR K.A., WALKER R.L., LYONS L.A. An improved molecular assay for Tritrichomonas foetus. Veterinary Parasitology; 2005. vol 127: 33–41. GRIFFTHS. IM GALLEGO. M, VILLAMIL.L.. Factores de infertilidad y pérdidas económicas en ganado de leche en Colombia. ICA sugerencias de investigación, División de ciencias veterinarias. 1982. Analac. GRIFFITHS. I, GALLEGO. M. DE LEON. L. Levels of some reproductive diseases in the dairy cattle of Colombia. Trop Anim Health Prod. 1984 Nov;16(4):219‐23. GUTIÉRREZ, D y FONSECA, C. Efectividad del producto homeopático metrix‐H en el tratamiento de la endometritis bovina. Facultad de medicina veterinaria, Universidad de la Salle. 2000. Pags 75. ICA. 2007. Instituto Colombiano Agropecuario. Boletines Epidemiológicos anuales. http://www.ica.gov.co/getattachment/499b52b5‐c483‐4024‐adc5‐a51dbd85a99b/2007.aspx. consultada: 26‐10‐2009 JACOBO, R.A.; STORANI, C.A.; CIPOLINI, M.F.; MARTÍNEZ, D.E.; MARTÍNEZ, E.I.; CARDOZO, R.O. Resultados preliminares del diagnóstico de campylobacteriosis y trichomonosis en búfalos del nordeste argentino. Rev. vet. 2007, vol 18: No 2, 130–132. JORGE. M, CATENA. M, FRESNEDA. K, CHIAPPARRONE. M. GUÍA DE TRABAJOS PRÁCTICOS ÁREA ENFERMEDADES INFECCIOSAS FCV‐UNCPBA. 2007. KASIMANICKAM. R, DUFFIELD. T, FOSTER. R, GARTLEY. C, LESLIE. K, WALTON. J, JOHNSON. H. A comparison of the cytobrush and uterine lavage techniques to evaluate endometrial cytology in clinically normal postpartum dairy cows Can Vet J. 2005 March; 46(3): 255–259 KUCKNOOR . A, MUNDODI. V, ALDERETE. J. Heterogonous expression in Tritrichomonas foetus of functional Trichomonas vaginalis AP65 adhesin. BMC Mol Biol. 2005; 6: 5v LEVI. M, TORRES. J, PIN. C. KLEIN. R. Comparison of the InPouch TV Culture System and Diamond’s Modified Medium for Detection of Trichomonas vaginalis. JOURNAL OF CLINICAL MICROBIOLOGY, Dec. 1997, p. 3308–3310 Vol. 35, No. 12 LUN. Z. R, CHEN. X.G, ZHU. X. Q, LI. X. R, XIE. M. Q. Are Tritrichomonas foetus and Tritrichomonas suis synonyms?. TRENDS in Parasitology; 2005, Vol.21 No.3 LUN. Z, DAJADHAR. A. A simple and rapid method for staining Tritrichomonas foetus and Trichomonas vaginalis. J Vet Diagn Invest, 1999, vol 11:471–474 MANCEBO. O, RUSSO. A, CARABAJAL. L, MONZON. C. Persistence of Tritrichomonas foetus in naturally infected cows and heifers in Argentina Veterinary Parasitology 59 (1995) 7‐11 Manual de la OIE sobre animales terrestres 2004. Capítulo 2.3.6. — Tricomoniasis. MARDONES. F, PEREZ. A, MARTINEZ. A, CARPENTER. T. Risk factors associated with Tritrichomonas foetus infection in beef herds in the Province of Buenos Aires, Argentina. Veterinary Parasitology 153 (2008) 231–237 MARTÍN. S, GONÁLEZ. R, PEREIRA. J, ORTEGA. M. Prevalence of Tritrichomonas foetus infection in beef bulls in northwestern Spain. Vet Parasitol. Feb 1998. 28;75(2‐3):265‐8. MÉNDEZ, D. Trabajo de grado: determinación de la microflora bacteriana uterina en vacas donantes de embriones. Pontificia Universidad Javeriana, Bogotá‐ Colombia. 2008. MENDOZA. J, PEDRAZA. S, GARCÍA. F, ROJO. S, RUIZ. J, ORTEGA. L, OSORO. K, COLLANTES. E. Prevalencia de las infecciones por tritrichomonas foetus y campylobacter foetus en la raza asturiana de la montaña. Ponencias VII congreso internacional ANEMBE. 2008. 20 • • • • • • • • • • • • • • • • • • • • • • MOAT, A y FOSTER, J. Microbial Physiology. Second edition. United State of America. Editorial Jhon Wiley and Sons. 1988. Chapter 1. Pags 1‐50 OTTEA. M, RAVENBORGB. T, HIITTNERB. K. A pilot study of elevated abortion and stillbirth ratios in cattle in the foothills of the Eastern plains of Colombia. Preventive Veterinary Medicine 22 (1995) 103‐ 113 PARKER, S., CAMPBELL, J., RIBBLE, C., GAJADHAR, A., Comparison of two sampling tools for diagnosis of Tritrichomonas foetus in bulls and clinical interpretation of culture results. Vet. Med.Assoc; 1999. Vol 215, 231–235 PALMER, C. Metritis postparto en vacas lecheras. Huerta Grande, provincia de Córdoba, Argentina. 2007. Págs 6. PALMER, C. Endometritis en vacas lecheras. Huerta Grande, provincia de Córdoba, Argentina. 2008. Págs 7. QUIROZ. H. Parasitología y enfermedades parasitarias de animales domésticos. Noriega editores. 1994. Pag. 96‐102 RAE, D.O., CREWS, J.E., Tritrichomonas foetus. Vet. Clin. North Am. Food Anim. Pract. 2006. Vol 22, 595–611. RAE. O, CREWS. J, GREINER. C. DONOVAN. G. Epidemiology of Tritrichomonas foetus in beef bull populations in Florida. Theriogenology; 2004. vol 61 605–618 REBHUN.W. Enfermedades del Ganado vacuno lechero. Edi. Acribia. 1999. Pags. 440‐441. RIMBAUD, E. Fisiopatología de la reproducción. Escuela de medicina veterinaria y zootécnica, Universidad de ciencias comerciales. España. 2005. Págs.. 90. RIVERA. H, ZUÑIGA. A. ETIOLOGÍA DEL ABORTO BOVINO. Facultad de Medicina Veterinaria. Universidad Nacional Mayor de San Marcos, Lima‐Perú. 2004. www.produccion‐animal.com.ar RODNING. S, WOLFE. D, CARSON. R, WRIGHT. J, STOCKDALE. H, PACOLI. M, BUSBY. H, ROWE. S. Prevalence of Tritrichomonas foetus in several subpopulations of Alabama beef bulls. Theriogenology. 2007. vol 69(2):212‐7. RODRÍGUEZ, G. Géneros Streptococcus y Enterococcus. 2002.Pags 18 RODRÍGUEZ, G. Principales características y diagnóstico de los grupos patógenos de Escherichia coli. México. 2004. Págs 12. RODRIGUEZ. R Y COB. L. Técnicas diagnosticas en parasitología veterinaria. Ediciones de la universidad de Yucatan. Segunda edición. 1999. Págs. 98‐101 ROPPEL, M y CAMPERO, C. Acción de Actinomyces pyogenes en el tracto reproductivo bovino. Revista Therios; 1998. págs. 8. ROSSANIGO. C. Las enfermedades venéreas en los rodeos de cría; prevalencia, diagnóstico y control Oeste Ganadero, 1998. vol 1(2):22‐24. www.produccion‐animal.com.ar SALCEDO. P. Coloraciones útiles para facilitar la identificación de Trichomonas vaginalis en los laboratorios clínicos. Trabajo de pregrado. Maestría microbiología con énfasis en parasitología. Universidad de los Andes. 2004. SCHWEBKE. J, BURGESS. D. Trichomoniasis. Clinical microbiology reviews, Oct. 2004, p. 794–803 Vol. 17, No. 4 SILVEIRA, E y MACHADO, R. Flora bacteriana del semen de toros antes y después de la congelación. Santa Clara, Cuba. 2005. Págs. 8. SINGH. B, LUCAS. J, HAYES. G, KUMAR. I, BEACH. D, FRAJBLAT. M, GILBERT. R, SOMMER. U, COSTELLO. C. Tritrichomonas foetus Induces Apoptotic Cell Death in Bovine Vaginal Epithelial Cells. Infection and Immunity, July 2004, p. 4151‐4158, Vol. 72, No. 7 SOBERÓN, G. Pseudomonas aeruginosa. Instituto de biotecnología. Universidad Nacional Autónoma de México. 2005. Págs 24. 21 • • • • • • • • SOTO. P, ECHEVARRIA. H,MONTEAVARO. C, CATENA. C. Experimental induced intravaginal Tritrichomonas foetus infection in a mouse model. Brazilian journal of veterinary research 25; 2005., pp 225‐230. STANCHI. N; MARTINO. P; GENTILINI. E; REINOSO. E; ECHEVERRIA. M; LEARDINI. N y copes. J. Microbiología veterinaria. Editorial INTER‐MEDICA. Buenos Aires, Argentina, 2007. Págs. 572. STOLTENOW. C, DYER. N. Bovine Trichomoniasis a venereal disease of cattle. 2007, V‐1342. TACHEZY. J, HAMPL.V, EDINOVA. M, VANˇA´Cˇ. S, VRLI´K. M, VAN RANST. M, FLEGR. J, KULDA. J. Cattle Pathogen Tritrichomonas foetus (Riedmu¨ ller, 1928) and Pig Commensal Tritrichomonas suis (Gruby & Delafond, 1843) Belong to the Same Species q 2002 by the Society of Protozoologists J. Eukaryot. Microbiol., 2002, vol 49(2), pp. 154–163 THOMAS. M, HARMON. W. Bovine Trichomoniasis: General Information, Diagnosis and Control. California Agriculture Technology Institute. San joaquin experimental range. CATI publication#940301; 1994. VADILLO, S; PÍRIS; S y MATEOS, E. Manual de microbiología veterinaria. Editorial McGraw Hill interamericana. Madrid, España. 2002. Págs. 853. VILLA. C. ABORTOS EN BOVINOS. Rev. Hereford, Bs. As., 2003. Vol 67(630):72‐76. www.produccion‐animal.com.ar YULE, A., SKIRROW, S.Z., BONDURANT, R.H., Bovine trichomoniasis. Parasitol. 1989. pag 373–377. 22 10. TABLAS DE ANEXOS • 10.1 Anexo #1: tabla de observaciones microscópicas con tinción de Gram y Wright de los sedimentos de las 10 muestras de lavados uterinos del hato lechero MUESTRAS 1 (R‐11) GRAM Negativo para bacterias 2 (19) 3 (20) Negativo para bacterias Negativo para bacterias 4 (69) Negativo para bacterias 5 (58) 6 (132) 7 (514) 8 (550) Negativo para bacterias Negativo para bacterias Negativo para bacterias Negativo para bacterias 9 (876) 10 (1103) Cocos Gram positivos ocasionales Bacilos Gram positivos de gran tamaño (+) WRIGHT Negativo para células de descamación uterina respuesta inflamatoria Células de descamación uterina Negativo para células de descamación uterina respuesta inflamatoria Negativo para células de descamación uterina respuesta inflamatoria Ocasional presencia de descamación uterina Moderada respuesta inflamatoria Células de descamación uterina Negativo para células de descamación uterina respuesta inflamatoria Descamación de células epiteliales Respuesta inflamatoria por polimorfonucleares bacilos intracelulares. y y y y y • 10.2 Anexo #2: tabla de resultados obtenidos de la flora bacteriana y Trichomonas foetus, en los lavados uterinos. NÚMERO DE MUESTRA 1 (R‐11) 2 (19) 3 (20) 4 (69) 5 (58) 6 (132) 7 (514) 8 (550) 9 (876) 10 (1103) PRESENCIA/AUSENCIA DE Trichomonas foetus (día de reporte) ‐ ‐ + (15) + (8) + (8) ‐ + (8) ‐ + (15) + (8) PRESENCIA/AUSENCIA DE LA FLORA BACTERIANA ‐ ‐ ‐ ‐ ‐ Klebsiella spp y Actinomyces pyogenes ‐ ‐ ‐ Lactobacillus spp, Streptococcus β hemolítico y Streptococcus α hemolítico • 10.3 Anexo #3: tabla de bioquímicas y pruebas realizadas a las cepas bacterianas aisladas en los lavados uterinos. NÚMERO DE MUESTRA 6 (132) BACTERIA CARACTERISTICAS MACROSCÓPICAS CARACTERISTICAS MICROSCÓPICAS Klebsiella spp Colonias grandes, planas, blancas, cremosas y muciodes (agar sangre). Colonias rosadas , grandes y cremosas, medio color amarillo (fermentador de lactosa) (agar McConkey) Bacilos Gram negativos BIOQUIMICAS Y/O PRUEBAS Gelatina: + Urea: + Citrato: + TSI: alk/ac Nitrato: + SIM: movilidad: ‐ H2S: ‐ 23 Actinomyces pyogenes Colonias regulares, medianas de color gris. Bacilos Gram positivos, en disposición de empalizada y letras chinas 10 (1103) Lactobacillus spp Colonias grandes, blancas grisáceas Bacilos Gram positivos Streptococcus (β hemolíticos) Streptococcus (α hemolíticos) Colonias puntiformes tras 8 dias de incubación con β‐ hemolisis Colonias puntiformes tras 8 dias de incubación con α‐ hemolisis Cocos Gram positivos Indol: ‐ Antibiograma: sensible (cefatoxima sódica, gentamicina, amoxicilina con ácido clavulánico, ampicilina y norfloxacina) y resistente (estreptomicina, metrodinidazol y astreonam) Gelatina: + Urea: ‐ Citrato: ‐ TSI: no fermentador Nitrato: ‐ Sucrosa: + Manitol: ‐ Lactosa: ‐ Trealosa: ‐ Glucosa: ‐ SIM: movilidad: ‐ H2S: ‐ Indol: ‐ Urea: + Sucrosa: + Manitol: + Lactosa: + Trealosa: + Glucosa: + Cocos Gram positivos • 10.4 Anexo #4: Medio base para Trichomonas foetus Hígado hidrolizado……………………………………25g/L D(+)glucosa………………………………………………..5g/L NaCl…………………………………………………………6.5g/L Agar Agar………………………………………………..0.5g/L Suero equino.……………………………………….80mL/L Antibiótico…………………………………………..375mg/L pH 6,4 ± 0,2 24