PDF - Revista Clínica Española
Anuncio

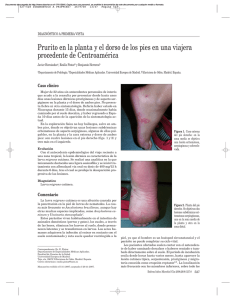
Documento descargado de http://www.revclinesp.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. MEDICINA EN IMÁGENES Prurito y erupción cutánea serpiginosa tras estancia en el Pirineo J. L. Santiago Sánchez-Mateosa, S. Aboín Gonzáleza, R. López-Vélezb, C. Moreno García del Realc y A. Harto Castañoa Servicio de Dermatología. bServicio de Medicina Tropical y cServicio de Anatomía Patológica. Hospital Ramón y Cajal. Madrid. Universidad de Alcalá de Henares. Madrid. España. a Caso clínico Mujer de 31 años que consulta en urgencias por una erupción cutánea pruriginosa que afecta a extremidades inferiores, sin otra sintomatología acompañante, de una semana de evolución. Comentaba que el cuadro se había iniciado con una placa pruriginosa en la región glútea izquierda durante un viaje al Pirineo catalán, tras haber realizado baños en estanques y senderismo. No había realizado viajes al extranjero en los meses previos. Negaba antecedente de traumatismo local, ingesta de productos no controlados o contacto con animales o plantas. Todos sus compañeros de viaje se encontraban asintomáticos. Había sido diagnosticada de picaduras de insecto y tratada con antihistamínicos orales y una crema de ketoprofeno durante cinco días, con mal control del prurito, empeoramiento del cuadro cutáneo y aparición de nuevas lesiones. A la exploración presentaba una erupción formada por pápulas eritematosas, alguna de ellas serpiginosa, en el área púbica y ambas extremidades inferiores, con una placa eritematosa y exudativa en el glúteo izquierdo (fig. 1). No mostraba alteraciones significativas en el hemograma ni en la bioquímica. Se realizó una biopsia cutánea de una lesión serpiginosa reciente (figs. 2 y 3). A la espera del resultado, se añadió a los antihistamínicos una pauta descendente de corticoides orales combinada con corticoides tópicos. Siete días después, sólo refería alivio del prurito, con nuevas lesiones y cambios en el trazado serpiginoso de la lesión biopsiada. El examen histológico fue inespecífico y mostraba pústulas subcórneas con un infiltrado inflamatorio agudo perivascular a nivel de la dermis superficial (fig. 4). Fig. 1. Placa eritematosa bien delimitada con superficie exudativa en área de aplicación tópica de ketoprofeno. Múltiples lesiones papulares eritematosas distribuidas en la cara posterior de la pierna derecha. Fig. 3. Lesión similar en cara anterior del muslo. Se tomó una biopsia del extremo caudal (se aprecia la cicatriz). Fig. 2. Lesiones cutáneas de trayecto serpiginoso en área inguinal. Fig. 4. Imagen histológica (H-E, x200) que muestra una pústula subcórnea constituida por polimorfos nucleares neutrófilos y un infiltrado inflamatorio agudo a nivel de la dermis papilar. 00 Rev Clin Esp. 2008;208(8):411-3 411 Documento descargado de http://www.revclinesp.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. SANTIAGO SÁNCHEZ-MATEOS JL ET AL. PRURITO Y ERUPCIÓN CUTÁNEA SERPIGINOSA TRAS ESTANCIA EN EL PIRINEO Diagnóstico Infestación por larva migratoria cutánea. Discusión La larva migratoria cutánea (LMC) es una parasitosis causada por la penetración cutánea y migración epidérmica de formas filariformes de larvas de nematodos. El agente etiológico más frecuente es Ancylostoma braziliense1-7. Otras especies implicadas son Ancylostoma caninum, Uncinaria stenocephala y Bunostomun phlebotomum2,3. La forma adulta de estos parásitos se halla en el intestino de mamíferos carnívoros domésticos (perros, gatos) y salvajes (zorros, lobos) que eliminan los huevos a través de sus heces y contaminan los suelos. Los huevos permanecen viables en terrenos húmedos y arenosos (playas, charcas o jardines), donde ocurre el paso a la forma infectante larvaria. Los humanos adquieren la infección al contactar la piel con suelos contaminados, con un periodo de incubación que varía desde horas hasta varios meses después de la exposición. La infección se restringe a la piel, ya que el hombre sólo es un huésped circunstancial y el parásito no puede completar en él su ciclo vital1-7. La LMC constituye un motivo de consulta frecuente en viajeros que regresan de países con clima tropical o subtropical como las zonas costeras del sureste de Estados Unidos, América Central y del Sur, África, India y sudeste asiático1-3. Aunque la mayoría de los casos publicados se deben a infecciones importadas desde áreas tropicales, existen casos raros de adquisición en países europeos4, 5, entre ellos España6,7. Estos últimos podrían explicarse por la contaminación del suelo mediante las heces infectadas de mamíferos autóctonos. Ancylostoma caninum y Uncinaria stenocephala han sido documentados en muestras fecales de animales salvajes como el lobo8 y el zorro9 peninsulares, confirmándose la parasitación por Ancylostomatidae spp. de gatos10 y perros11 de hogares españoles. La clínica consiste en lesiones pruriginosas, migratorias y con una morfología serpiginosa característica, que puede acompañarse de eosinofilia periférica. Generalmente se trata de una lesión única, pero se pueden encontrar múltiples lesiones cuando aumenta el área expuesta y/o el tiempo de exposición (al tumbarse o sentarse)12. Nuestra paciente reconocía haber estado echada sobre la tierra cercana a un riachuelo del Pirineo, después de bañarse en él, lo que favoreció la infección por varias larvas. El signo clínico principal y diagnóstico es el carácter migratorio de las lesiones. Cuando aparecen vesículas o ampollas sobre este trayecto puede plantear el diagnóstico diferencial con el herpes zóster13. Puede afectar a cualquier área cutánea expuesta, si bien las localizaciones más frecuentes son los pies, nalgas y muslos. Aunque el diagnóstico clínico es sencillo, debe tenerse en cuenta que otras parasitosis causadas por Ancylostoma duodenale, Necator americanus, Strongyloides ster412 coralis, Strongyloides spp. animales (Strongyloides procyonis, Strongyloides miopoton), Gnathostoma spp., Dirofilaria repens y algunas formas de miasis se manifiestan con lesiones cutáneas migratorias similares a la LMC3. La complicación más frecuente es la sobreinfección bacteriana (impétigo, foliculitis o celulitis) que favorece las excoriaciones por rascado1-7, habiéndose descrito otras menos comunes como urticaria y síndrome de Löeffler (infiltrados pulmonares y eosinofilia periférica)14,15. La LMC es una infección autolimitada debido a que el parásito es incapaz de completar su ciclo vital en el hombre, por lo que cura espontáneamente en semanas o meses. Sin embargo, se aconseja iniciar un tratamiento ante su sospecha clínica para aliviar el prurito, acortar la duración del proceso y evitar la posibilidad de aparición de complicaciones. Se han utilizado diversos tratamientos locales y sistémicos16,17. La crioterapia se ha desechado por ser un procedimiento doloroso y de baja efectividad (la lesión no suele coincidir con el emplazamiento real de la larva). La aplicación de tiabendazol tópico al 10% también se encuentra en desuso. Actualmente, existe preferencia por los antihelmínticos sistémicos como tiabendazol o albendazol, sobre todo en caso de lesiones múltiples. Ambos permiten el cese del avance del trayecto serpiginoso y un alivio significativo del prurito a las 48 horas de iniciado el tratamiento. Aunque el tiabendazol (50 mg/día durante 2-5 días) es el fármaco del que tenemos más experiencia, el hecho de que albendazol (400-800 mg/día durante 2-7 días) presente mejor tolerancia digestiva ha convertido a este último en la opción más adecuada16. Nosotros nos decantamos por una pauta oral de albendazol 400mg/día durante 7 días, polaramine 2 mg cada 8 horas y corticoides tópicos; la clínica mejora a partir del tercer día. La ivermectina (200 microgramos/kg en dosis única) se reserva para los casos en que el tratamiento oral con los anteriores fármacos no da resultado17, aunque antes de hablar de fracaso terapéutico habría que descartar recaídas por tratamientos antihelmínticos incompletos o de escasa duración. Presentamos un caso autóctono de LMC con infección por múltiples larvas y prurito intenso, diagnosticado y tratado con éxito a partir de la identificación de lesiones cutáneas características. Nuestro caso ilustra que la ausencia de un viaje reciente al trópico no descarta la posibilidad de LMC, pudiendo aparecer en nuestro medio de modo infrecuente y bajo circunstancias concretas que favorecen la infección. BIBLIOGRAFÍA 1. Rubio S, Ruiz L, Gascón J, Corachán M. Larva migrans cutánea en viajeros. Med Clin (Barc). 1992;98(6):224-6. 2. Puente Puente S, Bru Gorraiz F, Azuara Solís M, Colomo Gómez C, González Lahoz JM. Larva migrans cutánea: 34 casos importados. Rev Clin Esp. 2004;204(12):636-9. 3. Davies HD, Sakuls P, Keystone JS. Creeping eruption. A review of clinical presentation and management of 60 cases presenting to a tropical disease unit. Arch Dermatol. 1993;129:588-91. 4. Roest MA, Ratnavel R. Cutaneous larva migrans contracted in England: a reminder. Clin Exp Dermatol. 2001;26(5):248-9. Rev Clin Esp. 2008;208(8):411-3 00 Documento descargado de http://www.revclinesp.es el 17/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. SANTIAGO SÁNCHEZ-MATEOS JL ET AL. PRURITO Y ERUPCIÓN CUTÁNEA SERPIGINOSA TRAS ESTANCIA EN EL PIRINEO 5. Zimmerman R, Combemale P, Piens MA, Dupin M, Le Coz C. Cutaneous larva migrans, autochthonous in France. A propos of a case. Ann Dermatol Venereol. 1995;122(10):711-4. 6. Fernández Fernández M, Santos-Juanes Jiménez J, Concha Torre JA, Medina Villanueva A, Sánchez del Río J. Placa cutánea pruriginosa. An Pediatr (Barc). 2003;59:297-8. 7. Colomina J, Buesa J, Jordá E, Belda S, Borrás R. Lesión cutánea serpenteante en región plantar. Enferm Infecc Microbiol. 1994;12:103-4. 8. Segovia JM, Guerrero R, Torres J, Miquel J, Feliu C. Ecological analices of the intestinal helminto communities of the wolf, Canis lupus, in Spain. Folia Parasitol (Praha). 2003;50(3):231-6. 9. Gortázar C, Villafuerte R, Lucientes J, Fernández-de-Luco D. Habitat related differences in helminth parasites of red foxes in the Ebro valley. Vet Parasitol. 1998;80(1):75-81. 10. Calvete C, Lucientes J, Castillo JA, Estrada R, Gracia MJ, Peribáñez MA, et al. Gastrointestinal helminth parasites in stray cats from the mid-Ebro valley, Spain. Vet Parasitol. 1998;75(2-3):235-40. 11. Martínez-Carrasco C, Berriatua E, Garijo M, Martínez J, Alonso FD, de Ybáñez RR. Epidemiological study of non-systemic parasitism in dogs in sout- 00 heast Mediterranean Spain assessed by coprological and post-mortem examination. Zoonoses Public Health. 2007;54(5):195-203. 12. Sugathan P. Massive infestation of cutanea larva migrans. Dermatol Online. 2002;8(2):21. 13. Malvy D, Ezzedine K, Pistone T, Receveur MC, Longy-Boursier M. Extensive cutaneous larva migrans with folliculitis mimicking multimetameric herpes zoster presentation in an adult traveller returning from Thailand. J Travel Med. 2006;13(4):244-7. 14. Schaub NA, Perruchoud AP, Buechner SA. Cutaneous larva migrans associated with Loffler’s syndrome. Dermatology. 2002;205:207-9. 15. Del Giudice P, Desalvador F, Bernard E, Caumes E, Vandebos F, Marty P, et al. Loeffler’s syndrome and cutaneous larva migrans. A rare case association. Br J Dermatol. 2002;147:386-8. 16. Albanese G, Ventura C, Galbiati G. Treatment of cutaneous larva migrans (creeping eruption): a comparison between albendazole and traditional therapy. Intern J Dermatol. 2001;40:67-71. 17. Del Giudice P, Chosidow O, Caumes E. Ivermectin in dermatology. J Drugs Dermatol. 2003;2(1):13-21. Rev Clin Esp. 2008;208(8):411-3 413