Esporulación
Anuncio

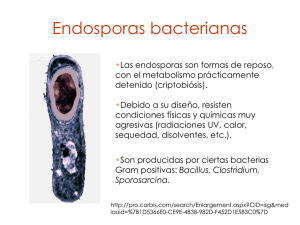
Esporulación http://diverge.hunter.cuny.edu/ ~weigang/Lecture-syllabus.html Esporulación Algunas especies de bacterias Gram positivas (principalmente de los géneros Bacillus, Clostridium, Sporosarcina y Thermoactinomyces), disponen de una serie de estrategias adaptativas cuando se ven sometidas a privación de nutrientes en su medio ambiente. •Alcanzar un ambiente más propicio: síntesis de flagelos, quiomitaxis, inducción de enzimas intracelulares y extracelulares, producción de antibióticos. •Esporulación (estado criptobiótico). Partes de la endospora •Protoplasto o núcleo, con la membrana citoplásmica de la espora (membrana esporal interna). •Pared de la espora (Germen de la pared de la futura célula vegetativa). •Corteza o córtex, rodeado externamente de la membrana esporal externa. •Cubiertas. •Exosporio (no universal, las esporas de algunas especies carecen de él). Nota: revisar notas de Microbiología General Propiedades biológicas de las endosporas •Hipometabolia. La más baja tasa metabólica. •Dormancia. Gran inercia a los sustratos exógenos, la espora sólo perderá la dormancia cuando se haya activado para la germinación. •Resistencia al calor. Es un subproducto de los cambios que llevan a la deshidratación como medio de lograr la hipometabolia y la dormancia. •Deshidratación. Refrigencia al microscopio óptico. •Resistencia a los rayos UV. •Resistencia a los agentes químicos. Esporulación Fase I. Formación del filamento. Fase II. Formación del septo acéntrico. Fase III. Formación de la forespora. Fase IV. Formación de la corteza. Fase V. Síntesis de las cubiertas. Fase VI. Maduración de la preespora a endospora. Fase VII. Liberación de la espora. Nature Reviews Microbiology 1, 117-126 (November 2003) Genes de la esporulación •Participan más de 113 genes en el proceso de esporulación. Bacillus subtilis esporula cuando se expresan los genes spo. •Los genes se clasifican de acuerdo a la fase de esporulación (O, I, II, etc.) y se diferencian por una letra. -Mutantes de spo0A fallan en el inicio de la esporulación y no procede la fase I. -Mutantes de spoIIA completan la fase II (septación) pero fallan para proceder a la fase III (formación de la doble membrana) http://www.invitrogen.com/site/us/en/ home/References/Molecular-ProbesThe-Handbook/Technical-Notes-andProduct-Highlights/Fluorescent-Probesfor-Use-with-GFP.html Genes de la esporulación y factores que regulan su expresión •Factores sigma. Factor de inicio de la transcripción en procariontes que permite la unión específica de la ARN polimerasa al promotor de un gen. σH σE σF σG σK Sistema de dos componentes El estímulo es detectado por un sensor a nivel de membrana (o a nivel citoplasmático), el cual transduce el estímulo hacia una proteína citoplásmica produciendo un cambio (–P) que inicia una cascada de señales, que provoca la interacción con secuencias determinadas de ADN, generando así la respuesta adaptativa correspondiente a la señal ambiental. Inicio de la esporulación Estímulos: •Carencia de nutrientes •Alta densidad celular Nature Reviews Microbiology 1, 117-126 (November 2003) Proteínas involucradas FtsZ. Polimeriza y forman una anillo en el centro de la célula durante la división celular. Durante el estado II de la esporulación las células forman dos anillos en los polos para la formación del septo asimétrico. Spo0J. Reconoce el origen de la replicación OriC en el cromosoma de la célula vegetativa y en la esporulación se une a los polos de la célula. RacA. Remodeling and Anchorinin of Chromosome A. Participan en la formación del filamento durante la esporulación. DivIVA. Proteína de anclaje en los polos de la bacteria, une directa o indirectamente a Spo0J y a RacA. Se ha propuesto que une a MinCD durante la división celular. SpoIIIE. ADN translocasa de pendiente de ATP. Transloca la copia del ADN en la forespora después de la formación del septo. Segregación del cromosoma (fase I y II) DivIVA. (OriC MinCD) Spo0J. RacA. SpoIIIE. Nature Reviews Microbiology 1, 117-126 (November 2003) σF activa la presencia de SpoIIE necesaria para la trasferencia de ADN durante la fase II. Factor σF SpoIIAB es una proteína inestable y funciona como anti-σF. spoIIAB está localizado en la parte distal de OriC. Durante el periodo inmediato a la formación del septo solo bajas concentraciones de SpoIIAB pasan a la preespora lo que permite la expresión de spoIIE. Nature Reviews Microbiology 1, 117-126 (November 2003) Fases II y III. Envoltura de la preespora SpoIID, SpoIIM SpoIIP (también probablemente SpoIIQ) son necesarias en las fases 2 y 3. SpoIID, SpoIIM y SpoIIP (σE) conducen la regresión del segundo tabique polar, así como para la envoltura. SpoIIIE es implicado en el paso final de fusión de la membrana. SpoIIB probablemente regulen este proceso. Nature Reviews Microbiology 1, 117-126 (November 2003) Factores σG y σK La síntesis σG es regulada por σF, el producto del gen spoIIIG es inactivado por el anti-σ SpoIIAB (u otro anti-σ) y activado por σE. Esta asociado con la activación de proteínas de formación de la forespora. La síntesis de SpoIVFB es estimulada por σG y tiene actividad de proteasa y junto con otras SpoIV activan de pro-σK a σK, que estimula la transcripción de genes importantes para la síntesis de la corteza y las cubiertas, así como para la maduración y liberación de la espora. σE Nature Reviews Microbiology 3, 969-978 (December 2005) The sporulation cascade in Bacillus subtilis and selected clostridia. Partes de la endospora Pared Corteza Protoplasto o núcleo Cubiertas Protoplasto (núcleo de la endospora) DPA DPC Sus componentes están inmovilizados en una matriz de quelatos de ácido dipicolínico (DPA) con iones Ca2+ (dipicolinato de calcio, DPC), que llega a representar el 15% del peso. Protoplasto (núcleo de la endospora) •Citoplasma muy deshidratado (10 - 30%) •Contiene el cromosoma, pocos ribosomas, ARNt, ARN polimerasa, mono y di nucleótidos pero no tri nucleótidos (no ATP). •Carece de componentes inestables: ~No ARNm ~No enzimas biosintéticas ~No aminoácidos ni bases nitrogenadas ~No cofactores reducidos (NADH, CoA, etc.) Espora de Bacillus cereus http://www.shef.ac.uk/mbb/staff/moir-a Protoplasto (núcleo de la endospora) •Gran cantidad de pequeñas proteínas especiales, las pequeñas, ácidas, solubles (SASP) que mantienen le pH más bajo que en la célula vegetativa. ~Durante la germinación se usarán como fuente de amino ácidos. ~Acomplejan el ADN: protegen de las radiaciones UV. •Fuente de energía: 3-fosfoglicerato→PEP Membrana interna de la espora. Rodea al protoplasto, membrana citoplásmica que carece de fluidez (estructura policristalina). http://sitemaker.umich.edu/hanna_lab/home. A Bacillus anthracis endospore (False colored transmission electron micrograph, 92,000X, as shown on the cover of the Jan. 1, 2004 issue of the Journal of Bacteriology) Pared de la endospora •A base de un Peptidoglucano similar al de la célula vegetativa. •Estructura muy delgada. •Constituye lo que será la pared de la futura célula vegetativa. •Origen: se sintetiza a partir de la preespora Pared Corteza o córtex Córtex • Al microscopio electrónico: gruesa, transparente a electrones, láminas concéntricas, formado de un Peptidoglucano especial: ~ 30% del NAM con tetrapéptidos, pero con bajo grado de entrecruzamiento ~ 15% del NAM tiene solo L-ala ~ 55% lactama del ácido murámico Corteza o córtex • Origen: a partir de la célula madre. • Tiene un bajo grado de entrecruzamiento: ~ Estructura más laxa, floja y flexible que el PG normal es capaz de expandirse o contraerse. ~ Rápida autolísis durante la germinación. • La lactama del murámico presenta gran resistencia a la lisozima. Cubiertas Aspecto muy voluminoso, distinto según especies. Partes densas a los electrones. Formada de una o más proteínas de tipo queratina, ricas en cisteína y amino ácidos hidrófobos. Bacterial endospores. Panel A shows endospores from B. subtilis one of which is still retained within the rod shaped 'mother cell'. In B. subtilis, spores are approximately 1.2 µm in length and are ellipsoidal. Released spores have a clear protective shell known as the spore coat and is comprised of as many as 25 different protomeric components assembled into discrete layers. Panel B shows a typical SDS-PAGE (12.5%) fractionation of solubilised spore coat proteins revealing predominant species. Ricca and Cutting Journal of Nanobiotechnology 2003 1:6 doi:10.1186/1477-3155-1-6 Estructura insoluble e impermeable que impide la entrada de numerosos agentes químicos agresivos, incluyendo tóxicos. Exosporio • Estructura membranosa transparente, a modo de saco delgado y flojo a base de proteínas, polisacáridos complejos y lípidos • Muy resistente a enzimas proteolíticas Esporulación • Estímulo desencadenante de la esporulación: estado de inanición (carencia de nutrientes) • Dura 7-8 horas en Bacillus subtilis o en B. megaterium. • Las fases se nombran con un número romano (I, II,....VII). Se suele indicar los límites de tiempo en los que transcurre la fase (ej: t2-t3 significa que la fase transcurre entre la 2ª y la 3ª hora) Fase I (t0-t1) •Los dos cromosomas se condensan formando un filamento. •Se inician dos tabiques, cada uno cerca de un polo (espículas de PC hacia el interior). •Se degradan proteínas viejas y los aminoácios se emplean en fabricar proteínas específicas de la esporulación. •Se sintetizan y liberan al medio: antibióticos y exoenzimas (proteasas, amilasas, ribonucleasas, etc.). Fase II (t1-t2) •Se termina el septo acéntrico en uno de los polos (el otro septo no se completa, aborta). •Cada nucleoide queda en un: ~Compartimiento pequeño, la prespora. ~Compartimiento grande la célula madre. •Sigue síntesis de antibióticos y exoenzimas (proteasas, amilasas, ribonucleasas, etc.). Fase III (t2-t3) •Formación del protoplasto de la espora debido a: ~Degradación selectiva del PG del septo ~La membrana citoplásmica de la célula madre va avanzando hacia el polo, envolviendo a la prespora •Resultado: prespora posee dos membranas, con polaridad opuesta. •La síntesis de proteínas sigue en la célula madre, pero se detiene en la prespora Fase IV (t3-t4) •Formación de la corteza: deposición de PG de la célula madre entre las dos membranas de la prespora. Deposición del PG de la pared, procedente de la prespora •La espora puede verse ya refráctil en fresco •Comienza síntesis de DPA y acumulación de Ca2+ •Comienza la síntesis del exosporio Fase V (t4-t5.5) •Deposición de materiales de las cubiertas por fuera de la membrana externa de la espora. •Continúa la acumulación de DPA, que secuestra iones Ca2+ para formar el DPC en el protoplasto. Fase VI (t5.5-t7) •Maduración de prespora a endospora. •Maduración de la corteza (PG especial, más laxo, con pocos entrecruzamientos). •Maduración de las cubiertas. •Citoplasma se hace más homogéneo y denso a los electrones. •Resistencia al calor y al cloroformo. •Resistencia a las radiaciones UV. •Resistencia a la lisozima. Fase VII (t7-t8) •Autolísis de la célula madre y liberación de la espora. •El exosporio pierde agua y se pega a las cubiertas. Ciclo de vida en Bacillus subtilis Nature Reviews Microbiology 3, 214-224 (March 2005)