Cinética Química 1603 Prof. Norma Angélica Macías Ruvalcaba 1
Anuncio

Cinética Química 1603 Prof. Norma Angélica Macías Ruvalcaba Unidad 6
1. Para una reacción con una energía de activación de 10 kJ/mol determinar cuántos grados
deberá incrementarse la temperatura para duplicar la velocidad de la reacción del valor que
tiene a 300 K. Respuesta: 63.4 K
2. Considera las siguientes reacciones paralelas:
A → B
A → C
La energía de activación para la reacción de A → B es de 45.3 kJ mol-1 y para la reacción
A→C es de 69.8 kJ mol-1. Si a 320 K las constantes de velocidad k1 y k2 son iguales. ¿a qué
temperatura se encontrará que k1/k2 = 2. Respuesta: 298 K
3. Si una reacción de primer orden tiene una energía de activación de 104600 J/mol y un
factor pre-exponencial A de 5×1013 s-1. Determina a qué temperatura la reacción tendrá un
tiempo de vida media de: a) 1 min y b) 30 días. Respuesta: a) 76º C y b) -3oC
4. Se observa que una muestra de leche que se conserva a 25 oC se pone agria 40 veces más
rápido que cuando se mantiene a 4oC. Estima la energía de activación para este proceso.
Respuesta: 120.7 kJ/mol
Unidad 8
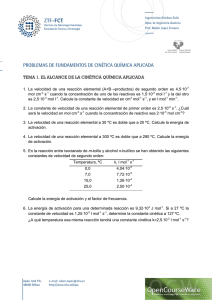
5. En un estudio de la hidrólisis alcalina del acetato de metilo se encontró que la constante
de velocidad variaba con la temperatura como sigue:
T/K
k /dm3mol-1s-1
293
0.135
298
0.186
303
0.259
308
0.358
Calcula la entalpía ΔH°≠ y entropía ΔS°≠ de activación para esta reacción. Respuesta: 46.6
kJmol-1; -102.7 J K-1mol-1
6. El factor pre-exponencial y la energía de activación para la reacción unimolecular:
CH3NC(g) → CH3CN(g) son 4.0×1013 s-1 y 272 kJ mol-1 respectivamente. Determina los
valores de ΔH°≠, ΔS°≠ y ΔG°≠ a 300 K. Respuesta: ΔS°≠ = 7.12 Jmol-1K-1 ; ΔH°≠= 270 kJ
mol-1 ; ΔG°≠= 268 kJ mol-1
7. El factor pre-exponencial y la energía de activación para la hidrólisis de cloruro de tbutilo son 2.1×1016 s-1 y 102 kJ mol-1 respectivamente. Determina los valores de ΔH°≠ y
ΔS°≠ a 286 K. Respuesta: ΔH°≠ = 9.96×104 Jmol-1 ; ΔS°≠ = 68 Jmol-1 K-1
1
Cinética Química 1603 Prof. Norma Angélica Macías Ruvalcaba 8. Dos reacciones del mismo orden tienen energías de activación idénticas y sus entropías
de activación difieren por 50 J mol-1 K-1. Calcula la relación de sus constantes de velocidad
a cualquier tempratura. Respuesta: 409
Unidad 9
9. La constante de velocidad para la reacción:
[CoBr(NH3)5]2+ + OH- → [Co(NH3)5OH]2+ + Brk = 1.52 M-1 s-1 a T = 25 °C. Este valor se obtuvo en un experimento en que las
concentraciones de los reactivos fueron: [{CoBr(NH3)5}Br2] = 5 × 10-4 M, [NaOH] = 7.95
× 10-4 M. A = 0.51 mol-1/2dm3/2 . Asume fuerzas iónicas bajas.
a) Estima la constante de velocidad a fuerza iónica cero ___________________
b) Calcula las constantes de
concentraciones de reactivos.
Exp 2
velocidad
[CoBr(NH3)5]Br2
(M)
NaOH
(M)
NaCl
(M)
6.00 × 10-4
0.691 × 10-3
-4
-3
correspondientes
a
I
las
siguientes
k
0.030
Exp 3
6.00 ×10
0.696 × 10
0.005
Respuesta: a) k= 1.9 M-1s-1, b) 0.8147 M-1s-1 (exp 2) y 1.273 M-1s-1 (exp 3)
10. En presencia de SO42-, la velocidad de hidrólisis ácida de acetilcolina podría
interpretarse de dos maneras: a) como un mecanismo en el cual una reacción termolecular
tiene lugar en el paso lento de la reacción (reacción 1) y b) como una catálisis por HSO4¯,
en la cual el paso lento es la reacción bimolecular entre acetilcolina y el HSO4¯ (reacción
2).
Reacción 1
(CH3)3N+CH2CH2OCOCH3 + H3O+ + SO42¯ → complejo activado
Reacción 2
(CH3)3N+CH2CH2OCOCH3 + HSO4¯ → complejo activado
Para cada uno de estos mecanismos predice cual sería el efecto de la fuerza iónica e indica
si un estudio de la fuerza iónica sobre la velocidad de la reacción podría apoyar la presencia
de uno u otro mecanismo.
2
Cinética Química 1603 Prof. Norma Angélica Macías Ruvalcaba 11. Cuando la especie subatómica muonio (Mu) se descubrió por primera vez en 1957, no
se sabía si tenía carga eléctrica. La respuesta se obtuvo al efectuar un estudio cinético
acerca del efecto de la fuerza iónica sobre la reacción Mu + Cu2+ en solución acuosa. Los
resultados obtenidos para las constantes de velocidad son los siguientes:
I=0
k = 6.50×109 dm3 mol-1 s-1
I = 0.9 M
k = 6.35×109 dm3 mol-1 s-1
Utiliza esta información para encontrar si la carga del muonio es +1, 0 ó -1. Tip.
Determina que valor tendría k para fuerza iónica de 0.9 M para los diferentes valores de
cargas y en base a tus resultados concluye acerca de la carga eléctrica del muonio.
12. La decoloración de bromofenol azul en solución alcalina es una reacción de segundo
orden entre los iones hidróxido y la forma quinoide del colorante:
Forma quinoide(azul) + ¯OH → forma carbinol2- (incolora)
Los siguientes resultados muestran la variación de la constante de velocidad de segundo
orden con la presión a 25 oC.
P / kPa
101.3
2.76×104 5.51×104 8.27×104 11.02×104
4
-1
3 -1
10 k / mol dm s
9.3
11.13
13.1
15.3
17.9
Determina el volumen de activación Δ≠V°. ¿Es el signo consistente con el tipo de reacción?
Respuesta: 14.5 cm3/mol
13. Para cada una de las siguientes reacciones predice de manera cualitativa cual sería el
efecto sobre la velocidad de la reacción cuando se incrementa: a) la constante dieléctrica, b)
la fuerza iónica y c) la presión. Para cada una de estas reacciones predice también el signo
de: d) el volumen de activación y e) la entropía de activación. Utiliza los espacios en la
tabla para contestar
Reacción
a) ↑ε
b) ↑ I
c) ↑ P
d) ΔV≠o
e) ΔS≠o
Co(NH3)3Br2+ + Hg2+ à
Co(NH3)5Cl2++ HO¯ à
S2O32- + SO32-
à
Para cada una de las reacciones esquematiza el comportamiento para las siguientes
relaciones (representa las dos reacciones en la misma gráfica).
log kno-ideal vs. I1/2 y log kideal vs. 1/ε
Asume que kno-ideal y kideal son iguales para las dos reacciones
3