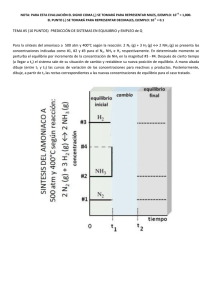
EQUILIBRIOS DE FORMACION DE COMPLEJOS
Anuncio

(48,/,%5,26'()250$&,21'(&203/(-26 ,QWURGXFFLyQ 7HRUtDGH:HUQHU (VWUXFWXUDGHORVFRPSOHMRV )DFWRUHVTXHLQIOX\HQHQODHVWDELOLGDGGHORVFRPSOHMRV (IHFWR4XHODWR 7DPDxRGHODQLOOR (IHFWRVHVWpULFRV &RPSOHMRVLQWHUQRV4XHODWRV&RPSOH[RQDV 5HDFFLRQHVSRUIRUPDFLyQGHFRPSOHMRV(VWDELOLGDGGHORVFRPSOHMRV $VSHFWRV FXDQWLWDWLYRV GH OD UHODFLyQ SUHFLSLWDFLyQGLVROXFLyQ GH SUHFLSLWDGRVSRUIRUPDFLyQGHFRPSOHMRV )RUPXODFLRQ\1RPHQFODWXUDGHORVFRPSOHMRV 1 ,1752'8&&,21 Los cationes pueden ejercer intensas acciones atractivas sobre los grupos negativos o sobre los extremos negativos de moléculas neutras polares, dando lugar a la formación de combinaciones de orden superior MLn que se denominan complejos. Al ión metálico se le denomina ión central del complejo y los grupos L, denominados ligandos, se unen al ión central mediante un enlace covalente coordiando (coordiando dativo). En el enlace covalente coordinado que se forma en el complejo, el ión metálico es el aceptor de pares de electrones, en tanto que el ligando actúa donando los pares de electrones para establecer el enlace 0DFHSWRU/GRQDGRU0/ FRPSOHMR Por tanto, la formación de complejos se puede explicar por al teoría ácido-base de Lewis. Así, el ión central es un aceptor de pares de electrones o ácido de Lewis y cada ligando un dador de pares de electrones o base de Lewis. Muchas sustancias biológicas importantes son compuestos de coordinación. La hemoglobina y la clorofila son ejemplos. La hemoglobina es una proteína que transporta oxígeno en la sangre. Contiene iones Fe2+ enlazados a grandes anillos porfirina. 7(25,$'(:(51(5 Los metales de transición tienen una tendencia particular a formar iones complejos, que a su vez se combinan con otros iones o iones complejos para formar compuestos de coordinación. Un compuesto de coordinación es una especie neutra que contiene uno o más iones complejos. El azul de Prusia, descubierto accidentalmente a comienzos del siglo dieciocho, fue quizás el primer compuesto de coordinación conocido. Sin embargo, pasó casi un siglo antes de poder apreciar la singularidad de estos compuestos. En 1798, B.M. Tassaert, obtuvo cristales amarillos de un compuesto de fórmula CoCl3.6NH3 a partir de una mezcla de CoCl3 y NH3(ac). Lo que pareció inusual fue que los dos compuestos, CoCl3 y NH3, son estables, capaces de existir independientemente y aún así se combinan entre ellos para formar otro compuesto estable. Estros compuestos son los denominados compuestos de coordinación. 2 En 1851, se descubrió otro compuesto de coordinación de CoCl3 y NH3, de fórmula CoCl3.5NH3 que formaba cristales morados (Figura 1). Dos compuestos de coordinación. El compuesto de la izquierda es derecha es [&R&O ( 1+ 3 )5 ]&O2 . [&R( 1+ 3 ) 6 ]&O3 . El compuesto de la El misterio de los compuestos de coordinación aumentaba a medida que se estudiaban y descubrían más. Por ejemplo, al tratar el primer compuesto con AgNO3(ac), formaba tres moles de AgCl(s), como era de esperar, pero el compuesto segundo formaba sólo dos moles de AgCl(s). La química de coordinación inorgánica fue un campo de investigación punta en la última mitad del siglo XIX y todas las piezas encajaron con el trabajo del químico sueco Alfred Werner (químico suizo que recibió el Premio Nobel de Química en 1913 por su Teoría de los compuestos de la coordinación) quién preparó y caracterizó muchos de ellos. En 1893, a la edad de 26 años, Werner propuso la Teoría que hoy se conoce como teoría de la coordinación de Werner. Esta teoría explicaba las reacciones de los dos compuestos anteriores con AgNO3(ac) considerando que en disolución acuosa estos dos compuestos se ionizan de la siguiente manera: 2 (a) [&R( 1+ 3 ) 6 ]&O3 ( V ) →[&R( 1+ 3 ) 6 ] ( DF ) + 3&O − ( DF ) 3+ 2 →[&R&O ( 1+ 3 ) 5 ] (DF) + 2&O − (DF ) (b) [&R( 1+ 3 ) 5 ]&O 2 ( V ) 2+ Así el compuesto (a) produce tres moles de Cl- por mol del compuesto necesario para precipitar tres moles de AgCl(s) mientras que el compuesto (b) produce solamente dos moles de Cl-. Para proponer este esquema de ionización, Werner se basó en amplios estudios sobre la conductividad eléctrica de los compuestos de coordinación. El compuesto (a) es mejor conductor que el compuesto (b), ya que produce cuatro iones por fórmula unidad comparados con tres iones que produce el compuesto (b). El compuesto CoCl3.4NH3 es todavía peor conductor y le corresponde la fórmula 3 [CoCl2.(NH3)4]Cl. El compuesto CoCl3.3NH3 es un electrolito y le corresponde la fórmula [CoCl3.(NH3)3]. Werner postuló que cada metal tiene dos clases de valencia: primaria y secundaria. La valencia primaria o ionizable corresponde al número de oxidación, es adireccional y sólo puede satisfacerse por iones negativos o por moléculas neutras. La valencia secundaria corresponde al número de coordinación, y están dirigidas en el espacio según una disposición geométrica que minimiza las fuerzas de repulsión de las nubes de electrones. Así, el Ag(NH3)2+ para indicar que grupos son los que se encuentran unidos al átomo central por valencias secundarias, se encierra el átomo junto con los grupos coordinados dentro de un corchete cuando escribamos su fórmula. El conjunto encerrado en el corchete se conoce como primera esfera de coordinación o esfera interna. El complejo mantiene su identidad cuando está disuelto aunque a veces se disocia parcialmente en los componentes de su esfera. [3HN:Ag:NH3]+ Como átomo central (aceptor de electrones) actúan todos los cationes, aunque no con el mismo grado. Los mejores aceptores son los que combinan la capacidad para atraer electrones con la disponibilidad para alojarlos en sus capas electrónicas. El tamaño pequeño y la carga catiónica elevada favorecen la atracción electrónica, los electrones son atraídos fuertemente por el núcleo positivo del catión, así como los orbitales externos vacíos o vacantes, que proveen espacio para alojar a los electrones. Por esto, los elementos que con mayor facilidad forman complejos son los iones de los metales de transición. Por el contrario los alcalino y alcalinotérreos, son poco aceptores debido a su gran diámetro, pequeña carga y a no poseer orbitales “G” incompletos, forman pocos complejos. Los ligandos son las especies que actúan como donadores de pares electrónicos y pueden ser moléculas o aniones que contengan en su estructura al menos un par de electrones no compartidos. Algunas moléculas que actúan como donadores: H2O, NH3, CO2, NO2. Aniones que actúan como ligandos: CN-, OH-, X-. Los ligandos pueden donar 1, 2, 3, etc pares de electrones y de acuerdo con el número de ellos se clasifican en monodentados y polidentados: bidentados, tridentados, tetradentados, etc. Un ligando polidentato está unido al átomo central por dos o más puntos de unión, a través de dos o más átomos donadores. Por ejemplo: DMG-Ni 4 OH O H3C N N CH3 H3C N N CH3 O HO Ni En ocasiones se originan complejos polinucleares (contienen más de un átomo central) en los que existen ligandos que unen entre si los átomos centrales constituyendo lo que se denomina ligandos puente, así: [OH(NH3)4-Cr-CO3-Cr-(NH3)4OH]2+ presenta dos átomos centrales de Cr y un ligando CO3 que actúa de puente entre los dos átomos de Cr. Finalmente, cabe decir que los compuestos resultantes pueden ser aniónicos, como el tetracloroplatinato [PtCl4]2-, catiónicos como ([Cu(NH3)4]2+ llamados iónes complejos, o neutros como el tricarbonilniquel (0) [Ni(CO)4] llamándose entonces complejos o compuestos de coordinación. (6758&785$'(/26&203/(-26 Se denomina número de coordinación de un átomo central al número de pares de electrones que acepta de los ligandos situados en la primera esfera de coordinación. Este número de coordinación coincide con la valencia secunadaria de Werner y en el caso de ligandos mondentados con el número de los mismos unidos al átomo central. La direccionalidad de las valencias secundarias que determinará la estructura del complejo viene impuesta por el hecho de que las uniones de los ligandos con el átomo central sean uniones covalentes coordinadas. En efecto, el par de electrones del átomo dador tendrá que situarse en el orbital molecular resultante de la superposición del orbital de procedencia con el orbital atómico vacante correspondiente del átomo central. (O Q~PHUR GH FRRUGLQDFLyQ QR VyOR GHSHQGH GH ORV RUELWDOHV YDFDQWHV GHO iWRPRFHQWUDOVLQRTXHWDPELpQHVIXQFLyQGHOWDPDxRGHORVOLJDQGRVGHPRGRTXH XQ iWRPR FHQWUDO GHILQLGR SXHGH DFWXDU FRQ PiV GH XQ Q~PHUR GH FRRUGLQDFLyQ. 5 Como ya hemos comentado, ORV PHWDOHV GH WUDQVLFLyQ VRQ HOHPHQWRV HVSHFLDOPHQWH DSWRVSDUDFRQVWLWXLUVHHQiWRPRVFHQWUDGRVSRUGLVSRQHUGHRUELWDOHVYDFtRVGHEDMD HQHUJtD TXH SXHGHQ DFHSWDU FRQ IDFLOLGDG SDUHV GH HOHFWURQHV 2WUR IDFWRU TXH IDYRUHFH OD IRUPDFLyQ GH FRPSOHMRV GH ORV HOHPHQWRV GH WUDQVLFLyQ HV OD HVSHFLDO GLVWULEXFLyQGHODVHQHUJtDVUHODWLYDVGHORVRUELWDOHVGHYDOHQFLDGHHVWRVHOHPHQWRV ORTXHSRVLELOLWDXQDIiFLOKLEULGDFLyQ. En la siguiente tabla se muestran las geometrías idealizadas para los índices de coordinación más comunes. 6 Indice Geometría Coordinación 2 L M L Hibridación Ejemplos LINEAL [Ag(NH3)2+] sp [Cu(CN)2]- TETRAEDRICA [Zn(CN)4]2- sp3 [Cd(NH3)4]2+ PLANO [Ni(CN)4]2- CUADRADA [Cu(OH2)4]2+ dsp2 o sp2d [PtCl2(NH3)2] L 4 M L L L L 4 L M L L L 5 L BIPIRAMIDE M L L TRIGONAL 3 dsp [Fe(CO)5]3+ [CuCl5]3- L L 5 L L M L 6 PIRAMIDAL CUADRADA 2 L 2 d sp [Ni(CN)5]3[MnCl5]3- OCTAEDRICA [Fe(CN)6]4- d2sp3 o sp3d2 [Fe(OH2)6]2+ 7 Para índices de coordinación 5 son comunes las estructuras bipiramidal trigonal y piramidal cuadrada. Las energías asociadas a estas estructuras son muy próximas. Las geometrías tetraédrica y plano cuadrada son comunes para complejos con índice de coordinación 4. Las geometrías tabuladas son geometrías ideales. /DV HVWUXFWXUDV UHDOHV HVWiQ D YHFHV GLVWRUVLRQDGDV, especialmente si los ligandos no son todos los mismos. Las distorsiones VH GHEHQ D FRPSHQVDFLRQHV GH ORV GHVLJXDOHV FDPSRV HOpFWULFRVJHQHUDGRVSRUORVGLIHUHQWHVOLJDQGRV. )$&725(648(,1)/8<(1(1/$(67$%,/,'$''(/26&203/(-26 La causa que más afecta a la estabilidad de un complejo es la fortaleza de la unión ligando-metal. La fortaleza de esta unión nos dará una medida de su estabilidad. Ya hemos dicho que un complejo será tanto más estable cuanto mayor sea la carga del catión, menor sea su tamaño y tenga más orbitales vacíos. Sin embargo, hay otra serie de causas que también influyen en la estabilidad de un complejo como son el efecto quelato, el tamaño del anillo, el efecto estérico. ()(&7248(/$72 Cuantos más uniones presente un mismo ligando con el catión central, más difícil será romperlas, y, por tanto, más estable será el complejo. La estabilidad de un complejo aumenta en general, si se sustituyen n ligandos monodentados por un ligando n-dentado. El incremento en la estabilidad de los complejos con ligandos polidentados proviene principalmente de un efecto entrópico. Se puede entender con base en consideraciones termodinámicas las dos tendencias que rigen las reacciones químicas: la disminución de la entalpía (liberación de calor) y el aumento de entropía (mayor desorden). En las reacciones 1 y 2 se forman cuatro enlaces y la variación de entalpía (∆H) es aproximadamente igual para ambas reacciones. Sin embargo, la segunda reacción implica la unión de tres especies químicas, mientras que en la primera intervienen cinco. Con cinco especies se tienen más grados de libertad (más desorden) que con tres. Por tanto la reacción inversa de la primera está más favorecida que la inversa de la segunda. Es decir, desde un punto de vista entrópico, la segunda reacción 8 tal como está escrita está más favorecida; la variación de entropía favorece la segunda reacción frente a la primera. Cu2+ + 4NH3 [Cu(NH3)2+] Cu2+ + 2en [Cu(en)22+] 1:4 (1) 1:2 (2) Como hemos visto, la estabilidad del complejo aumenta por el efecto quelato de forma que el dietilendiamnacobre(II) es más estable que el tetraamincobre(II). 2+ NH3 Cu 2+ + 4NH3 NH3 Cu NH3 NH3 Cu 2+ + 2 H2N-CH2-CH2-NH2 H2C H2N H2C H2N Cu NH2 CH2 NH2 CH2 2+ 7$0$f2'(/$1,//2 Al formase un complejo con un ligando polidentado se forma un ciclo; la estabilidad del complejo será máxima cuando el número de eslabones es 5, siendo PHQRV HVWDEOHV ORV formados por 6 y 4 eslabones ya TXH SUHVHQWDQ PD\RU UHSXOVLyQ HQWUHODVQXEHVGHHOHFWURQHV. El resto de los anillos presenta gran inestabilidad. ()(&726(67(5,&26 Si los ligandos son de gran volumen, es posible que los impedimentos estéricos eviten que entre el número apropiado de ligandos. Estos cambios se dan por ejemplo en el caso de la 1,10-fenantrolina, ligando que forma con el hierro (II) un complejo muy 9 estable de estequiometria 3:1. Sin embargo, un derivado suyo, la 2,9-dimetil-1,10fenantrolina ya no forma complejo con hierro (II). 2+ N N Fe 2+ + N N Fe 3 N N N N 2+ H3C N N Fe 2+ + Fe 3 N H3C N N N N N Por otra parte, este impedimento estérico se utiliza para hacer la reacción más selectiva. Así por ejemplo, el calcicromo forma complejos con Ca2+ pero no con Ba2+, Sr2+ ni Mg2+. Esto es debido a que el tamaño del hueco que deja el calcicromo en su interior determina el catión que puede entrar. El ión calcio tiene un tamaño más pequeño que el hueco mientras que los iónes estroncio, bario y magnesio son muy grandes. 10 SO3H SO3H SO3H SO3H N N N N SO3H OH HO HO3S OH N N N N SO3H SO3H Ca 2+ SO3H OH HO 2+ OH Ca HO3S N N N N SO3H SO3H 5($&&,21(6325)250$&,Ï1'(&203/(-26(67$%,/,'$''(/26 &203/(-26 En medio acuoso los cationes de los metales de transición se encuantran solvatados formando auténticos acuocomplejos tales como [Ni(H2O)6]2+, [Cu(H2O)4]2+, [Zn(H2O)4]2+, etc, y las reaccones por formación de complejos en medio acuoso pueden considerarse reducidas la mayoría de las veces a un simple desplazamiento de los ligandos acuo por otros ligandos para los que el átomo central presenta mayor afinidad. Este proceso de sustitución tiene lugar por etapas, de modo que, en cualquier momento debemos considerar la coexistencia de las especies límites y de todas las intermedias, siendo la proporción relativa de éstas función de la concentración del agente complejante (ligando que ha de sustituir al agua). Por ejemplo, el zinc(II) en medio acuso forma el complejo tetraacuazinc(II) [Zn(H2O)4]2+. Si se añade amoniaco, las reacciones que tienen lugar son: [Zn(H2O)4]2+ + NH3 [Zn(H2O)3(NH3)]2+ + H2O [Zn(H2O)3(NH3)]2+ + NH3 [Zn(H2O)2(NH3)2]2+ + H2O [Zn(H2O)2(NH3)2]2+ + NH3 [Zn(H2O)(NH3)3]2+ + H2O [Zn(H2O)(NH3)3]2+ + NH3 [Zn(NH3)4]2+ + H2O Normalmente, el átomo central se simboliza con M y con L al nuevo ligando. El átomo central tiene un índice de coordinación n y tanto el ligando como el átomo central los suponemos sin carga. Las reacciones de formación sucesivas de complejos serían: 11 M + L ML ML + L ML2 ML2 + L ML3 ... ... ... MLn-2 + L MLn-1 MLn-1 + L MLn A cada proceso parcial le corresponde una corresponde una constante de equilibrio de formación de complejo sucesiva: .1 = [ 0/] [ 0 ][ /] .2 = [ 0/2 ] [ 0/][ /] . = [ 0/ ] [ 0/ −1 ][ /] El proceso global de formación del complejo de máxima coordinación en el ligando L sería: M + nL MLn La correspondiente constante de formación global de formación o de estabilidad de dicho complejo viene dada por la expresión: . = [ 0/ ] [ 0 ][ /] La inversa de la constante de formación de un complejo o de la constante de estabilidad es la constante de inestabilidad o constante de destrucción. Esta constante valora la estabilidad de los complejos de forma que un complejo es tanto más estable cuanto menor sea su constante de inestabilidad. . 1 [ 0 ][ /] = = . [ 0/ ] $HIHFWRVSUiFWLFRVHQPXFKDVRFDVLRQHVHQODVTXHVHWUDEDMDHQSUHVHQFLDGH H[FHVRGHOLJDQGRSXHGHRSHUDUVHFRQHVWDVFRQVWDQWHVJOREDOHV\DTXHODSUHVHQFLD GH HVSHFLHV LQWHUPHGLDV HV LUUHYHODQWH IUHQWH D OD GHO FRPSOHMR GH Pi[LPD FRRUGLQDFLyQ. 12 $63(&726 &8$17,7$7,926 '( /$ 5(/$&,21 35(&,3,7$&,Ï1 ',62/8&,21'(35(&,3,7$'26325)250$&,Ï1'(&203/(-26 )RUPDFLyQGHXQLyQFRPSOHMRGLVROXFLyQGH$J&OVHQ1+ a) Una disolución saturada de cloruro de plata en contacto con exceso de AgCl(s). b) Cuando se añade NH3(aq), se disuelve el exceso de AgCl(s) por formación del ión complejo [Ag(NH3)2]+. Como se muestra en la figura anterior, cuando se añade NH3(aq) de concentración moderada a una disolución saturada de cloruro de plata en contacto con AgCl(s) sin disolver, el sólido se disuelve. La clave de este proceso de disolución es que los iones Ag+ del AgCl se combinan con moléculas de NH3 para formar iones [Ag(NH3)2]+, que junto con los iones Cl- permanecen en disolución como el compuesto soluble Ag(NH3)2Cl. $J&O ( V ) + 2 1+ 3 ( DF ) → [$J (1+ 3 )2 ] ( DF ) + &O − (DF ) + Existen dos equilibrios simultáneos: $J&O (V ) $J + ( DF ) + 2 1+ 3 ( DF ) $J + ( DF ) + &O − (DF ) [$J (1+ 3 )2 ]+ (DF) El equilibrio de la segunda reacción está muy desplazado hacia la derecha, ya que [Ag(NH3)2]+, es un ión complejo estable. La concentración en el equilibrio de Ag+ (ac) en el segundo equilibrio se mantiene tan baja que el producto iónico [Ag+][Cl]- no alcanza el valor de Kps y el AgCl permanece en disolución. 13 Si disponemos de un precipitado en equilibrio con una disolución saturada de la misma sustancia se cumple el equilibrio: AxMy xAy- + yMxDicho equilibro viene regido por el producto de solubilidad: Ks = [Ay-]x [Mx-]y De forma que la concentración del catión en la disolución es tanto menor cuanto más pequeño sea el producto de solubilidad [0 + ]= . [ $ −] Si a esta disolución le añadimos un agente acomplejante L que puede formar con el catión un complejo [MLn], el catión en disolución formará en lo posible el complejo y el precipitado se disolverá si hay suficiente cantidad de ligando para mantener la concentración del catión por debajo de lo que dicta el producto de solubilidad, dándose la reacción por formación de complejo: M + nL MLn Si el precipitado disuelto ha de coexistir en equilibrio con el complejo es preciso que la concentración del catión satisfaga exactamente las condiciones de los dos equilibrios simultáneamente. En el caso de que la concentración del catión que pueda estar en equilibrio con el complejo sea inferior a la requerida por el valor del producto de solubilidad el precipitado se disolverá. &203/(-26,17(512648(/$726&203/(;21$6 Se conoce como complejos internos a los complejos en que el ión metálico se une a moléculas orgánicas por dos o más puntos de las mismas, originando estructuras cíclicas. Muchos compuestos orgánicos que se comportan como ligandos bidentados forman complejos internos con cationes metálicos. Los complejos internos formados con ligandos bidentados presentan en su estructura, con mucha frecuencia, anillos de cinco o seis eslabones en los que intervienen el átomo central y poseen una elevada estabilidad. Estos compuestos reciben la denominación genérica de quelatos (vocablo que procede del griego y significa pinza 14 de cangrejo) y son generalmente insolubles en agua pero solubles en disolventes orgánicos. La presencia en la molécula de anillos no saturados de cinco o seis eslabones confiere a muchos quelatos colores intensos. Este conjunto de propiedades hacen muy interesante el uso de agentes quelatos en Química Analítica. Así, la dimetilgiloxima es un reactivo específico para el Ni a pH 8 que origina un precipitado rojo intenso de dimetilglioximato de niquel(II). La presencia del átomo de niquel en los cuatro anillos pentagonales confiere una elevada estabilidad al complejo. H3C C N C N H3C O HO Ni OH O N C CH3 CH3CH3 HO N C C N OH N C Dioxina CH3 Dimetilglioximato de niquel(II) Los quelatos encuentran aplicación en otras ramas de la química, pero constituyen un área de mucha utilidad dentro de la Química Analítica. En 1946 SCHWARTZENBACH propone la utilización de unas sustancias (complexonas) que con muchos cationes metálicos (incluidos alcalinoterreos) originaban complejos internos (en general solubles) y muy estables. Estas se denominaron complexona I, complexona II y complexona III. La complexona I es el ácido nitrilotriacético, que se simbloliza por H3X (N(CH2COOH)3) CH2COOH N CH2COOH CH2COOH La complexona II es el ácido etilendiaminotetraacético, que se simboliza como H4Y y al que de manera general se le conoce como EDTA HOOCH2C CH2COOH N HOOCH2C C H2 C H2 N CH2COOH 15 La complexona III es la sal disódica del ácido etilendiaminotetraacético, a la que se simboliza como Na2H2Y, y que, siendo la más apliamente utilizada (por ser soluble en agua), también se conoce como EDTA. HOOCH2C CH2COOH N C H2 NaOOCH2C O C H2 O H2C NaOOC C H2 N CH2COONa O Ca N C C H2 H2 N O CH2 C COONa H2 En todos los casos en que el EDTA reacciona con un catión lo hace en una relación molar 1:1. Se utiliza mucho como agente valorante de cationes metálicos. A las valoraciones con complexonas se les denomina complexometrías. Como indicadores del punto de equivalencia en las complexometrías se utilizan compuestos orgánicos que forman con el catión a valorar complejos intensamente coloreados menos estables que los complejos EDTA-metal, de modo que el desplazamiento del ligando indicador por el EDTA venga claramente señalado por un cambio de color. M-Ind (COLOR A) + EDTA M-EDTA + Ind (COLOR B) También se utiliza el EDTA como agente enmascarante de iones metálicos. 16 120(1&/$785$'(/26&203/(-26 En las fórmulas de los compuestos de coordinación van primero los cationes, y después los aniones, aunque en los nombres primero se nombra el anión, como se hace en los compuestos iónicos sencillos: cloruro de sodio, NaCl. Los aniones que actúan como ligandos se nombran utilizando la terminación o. Normalmente, las terminaciones XUR cambian a R, las terminaciones LWR y DWR no cambian. Las moléculas neutras que actúan como ligandos generalmente no modifican su nombre. Por ejemplo, el nombre etilendiamina se utiliza tanto para la molécula libre como para el ligando. Acuo, amin, carbonilo, y nitrosilo son las principales exceciones. El número de ligandos de un determinado tipo, se indica con un prefijo. Los prefijos habituales son PRQR=1, GL=2, WUL=3, WHWUD=4, SHQWD=5 y KH[D=6. El prefijo PRQR se suele omitir. Si el nombre del ligando es un nombre compuesto que a su vez contiene un préfijo numérico como etilendiamina, se encierra el nombre con un paréntesis precedido por ELV=2, WULV=3, WHWUDNLV=4, y así sucesivamente. Así, dicloro significa dos iones Cl- como ligandos, pentaacuo significa cinco moléculas de H2O. Para indicar la presencia de dos ligandos etilendiamina (en), escribimos ELV (etilendiamina). Para nombrar un complejo, se nombran primero los ligandos por orden alfabético, seguidos por el nombre del metal central. El estado de oxidación del metal central se indica con números romanos. Si el complejo es un anión, el metal lleva la terminación “ato”. Los prefijos (di, tri, bis, tris,...) no se tienen en cuenta al establecer el orden alfabético. Así, el nombre de [CrCl2(H2O)4]+ es el ión tetraacuodiclorocromo (III); de [CoCl2(en)2]+ es el ión diclorobis(etilendiamina)cobalto(III) y de [Cr(OH)4]- es el ion tetrahidroxocromato (III). Para los aniones complejos de algunos metales, se utiliza el nombre en latín dado en la siguiente tabla. Así el de [CuCl4]2- es el ión tetraclorocuprato (II). Al escribir la fórmula de un complejo, se escribe primero el símbolo químico del metal central, seguido de las fórmulas de los aniones y después las moléculas neutras. Si hay dos o más aniones o moléculas neutras diferentes como ligandos, se escriben en orden alfabético de acuerdo con el primer símbolo químico de sus fórmulas. Así, en la fórmula del ion tetraammincloronitrocobalto (III), el Cl- precede al NO 2− , y ambos se colocan antes de las moléculas neutras de NH3: de [CoCl(NO2)(NH3)4]+. 17 1RPEUHVGHDOJXQRVPHWDOHVHQORVDQLRQHVFRPSOHMRV → Ferrato Cobre → Cuprato Estaño → Estannato Plata → Hierro Argentato Plomo → Plumbato Oro → Aurato Nombres comunes o vulgares: ferrocianuro para el de [Fe(CN)6]4- y ferricianuro para el de [Fe(CN)6]3-. Estos nombre vulgares indican el estado de oxidación de los iones metálicos centrales mediante las designaciones o e i (o para el ión ferroso, Fe2+, en el [Fe(CN)6]4- e i para el ión férrico, Fe3+, en el [Fe(CN)6]3-. Sin embargo estos nombres vulgares no indican que los iones metálicos tienen un número de coordinación 6. Los nombres sistemáticos, hexacianoferrato(II) y hexacianoferrato(III), dan más información. 18 02/(&8/$ 120%5( 120%5(&202/,*$1'2 MOLECULAS NEUTRAS NH3 Amoníaco Ammin H2O Agua Acua CO Monóxido de carbono Carbonil PH3 Fosfina Fosfin NO Oxido nítrico Nitrosil CH3NH2 Metilamina Metilamina C5H5N Piridina Piridina ANIONES F- Fluoruro Fluoro Cl- Cloruro Cloro Br- Bromuro Bromo - I Ioduro Yodo O2- Anión óxido Oxo OH- Hidróxido Hidroxo -CN Cianuro Ciano CN- Isocianuro Isociano SO42- Sulfato Sulfato S2O32- Tiosulfato Tiosulfato NO2- Nitrito Nitrito-N o Nitro ONO- Nitrito Nitrito-O -SCN Sulfocianuro, Tiocianato-S Tiocianato -NCS Sulfocianuro Tiocianato-N Tiocianato 19